Физиология растений, 2021, T. 68, № 3, стр. 326-336
Ростовые и биосинтетические характеристики суспензионных культур клеток Phlojodicarpus sibiricus
М. Т. Ханды a, b, *, Д. В. Кочкин c, d, С. В. Томилова c, d, А. Г. Клюшин d, Б. А. Галишев e, А. М. Носов c, d
a Федеральное государственное автономное образовательное учреждение высшего образования
“Северо-Восточный федеральный университет им. М.К. Аммосова”
Якутск, Россия
b Федеральное государственное бюджетное учреждение науки
“Федеральный научный центр биоразнообразия наземной биоты Восточной Азии”
Дальневосточного отделения Российской академии наук
Владивосток, Россия
c Федеральное государственное автономное образовательное учреждение высшего образования
“Московский государственный университет им. М.В. Ломоносова”
Москва, Россия
d Федеральное государственное бюджетное учреждение науки “Институт физиологии растений
им. К.А. Тимирязева” Российской академии наук
Москва, Россия
e Федеральное государственное автономное образовательное учреждение высшего образования
“Уральский федеральный университет имени первого Президента России Б.Н. Ельцина”
Екатеринбург, Россия
* E-mail: handy_89@mail.ru
Поступила в редакцию 08.05.2020
После доработки 23.07.2020
Принята к публикации 23.07.2020
Аннотация
Изучены особенности роста и качественного состава вторичных метаболитов в двух линиях суспензионной культуры клеток вздутоплодника сибирского Phlojodicarpus sibiricus (Steph. ex Spreng.) К.-Pol. – исчезающего вида, эндемика Восточной Сибири. Лучшими ростовыми характеристиками обладала суспензионная культура клеток листового происхождения: индексы роста по различным критериям (сухая и сырая биомасса клеток, концентрация клеток) I = 10–14; удельная скорость роста μ = 0.3–0.4 сут–1; максимальное накопление сухой биомассы М = 9.6 г/л, экономический коэффициент Y = 0.29. Культура клеток гипокотильного происхождения имела более низкие показатели роста: I = 3.6–4.9, μ = 0.12–0.18 сут–1, М = 6.6 г/л, Y = 0.16. Отличия в росте исследованных культур коррелируют со степенью агрегированности клеток: суспензионная культура клеток листового происхождения состоит преимущественно из агрегатов мелкого размера (от 10 до 30 клеток), тогда как культура гипокотильного происхождения представлена крупными агрегатами (не менее 50 клеток в агрегате). Проведено аппаратурное выращивание мелкоагрегированной суспензионной культуры клеток Ph. sibiricus листового происхождения в двух типах лабораторных биореакторов – барботажном и с механическим перемешиванием. Установлено, что при выращивании в барботажном биореакторе наблюдается улучшение основных ростовых характеристик (индекс роста по сухой биомассе I – 12.7; продуктивность по сухой биомассе P = 0.78 г/л · сут, μ = 0.18 сут–1, М = 15.8 г/л, Y = 0.49). При использовании биореактора с механическим перемешиванием зафиксировано снижение всех ростовых показателей, что очевидно связано с повреждающим действием на клетки перемешивающих устройств. Проведено фитохимическое исследование состава вторичных метаболитов в исследуемых культурах клеток в сопоставлении с корнями интактного растения Ph. sibiricus. Установлены значительные различия состава фенольных соединений в клетках in vitro и в корнях растения. В культурах клеток Ph. sibiricus преобладали полярные (гидрофильные) соединения, относящиеся к фенольным производным – гликозиды кумаринов и бензофуранов. В корнях главными компонентами были более гидрофобные метаболиты – эфиры пиранокумарина келлактона. Полученные результаты подтверждают разрабатываемую в наших работах концепцию о различиях вторичного метаболизма в клетках растений in vitro и in vivo.
ВВЕДЕНИЕ
Исследование вторичного метаболизма в настоящее время является одной из наиболее актуальных задач современной физиологии и биохимии растений. Принципиально новые подходы для изучения этого процесса открывает использование культур клеток высших растений. Помимо возможности исследования различных факторов, влияющих на образование вторичных метаболитов (регуляторы роста, элиситоры, стрессовые воздействия и др.), использование клеток in vitro позволяет изучать процесс формирования соединений специализированного обмена в дедифференцированных пролиферирующих клетках, лишенных организменных систем контроля. Сопоставление специфики вторичного метаболизма в интактных растениях (где он распределен, как правило, по разным органам растений и протекает в специализированных клетках) и в клетках in vitro позволяет не только определять механизмы и системы регулирования этого процесса, но и выяснять функции вторичных метаболитов в жизнедеятельности растения [1].
Прикладным аспектом исследования вторичного метаболизма в клетках высших растений in vitro является биотехнологическое использование культур клеток в качестве возобновляемого высококачественного сырья для получения биологически активных соединений растительного происхождения, в частности для создания новых и безопасных лекарственных средств и их использования в терапии различных заболеваний [1]. Перспективным направлением в этой области является изучение редких и эндемичных видов растений, используемых в народной медицине и природные ресурсы которых недоступны или ограничены. Несомненный интерес с этой точки зрения представляет флора Сибири, где особо выделяются природные популяции лекарственных растений Якутии. В этом регионе многие ценные виды растений имеют ограниченный ареал и их запасы быстро сокращаются. К числу таких растений относится вздутоплодник сибирский Phlojodicarpus sibiricus (Steph. ex Spreng.) К.-Pol. (семейство Зонтичные, Umbelliferae), который занесен в Красные книги Якутии, Амурской области и Забайкальского края [2–4].
Корни вздутоплодника сибирского используют для профилактики и лечения сердечно-сосудистых заболеваний, некоторых неврологических расстройств, нарушений функций желудка и легких. Основные лечебные эффекты Ph. sibiricus обеспечиваются наличием в нем фенольных соединений, а именно кумаринов (пирано- и гидроксикумаринов). Известно, что некоторые кумарины обладают спазмолитическим, антикоагулянтным, гиполипидемическим, седативным, нейропротективным, противоопухолевым, бактериостатическим свойствами, проявляют антиоксидантную активность [5].
Для Ph. sibiricus наиболее специфичными вторичными метаболитами являются пренилированные кумарины, которые в основном представлены пиранокумаринами (келлактон, виснадин, дигидросамидин, суксдорфин, птериксин и другие) и в меньшей степени фуранокумаринами (пеуценидин). В составе корневищ и корней Ph. sibiricus обнаружены также и “простые” кумарины (различные производные гидроксикумарина – умбеллиферон, скополетин) [5–9].
Вздутоплодник сибирский, являясь фармакопейным растением, использовался как сырье для получения спазмолитического препарата “Фловерин” (смесь дигидросамидина и виснадина), и комплексного препарата, обладающего сердечно-сосудистым действием, “Сафинора”. В настоящее время производство данных препаратов приостановлено из-за сокращения природного сырья [10].
В связи с растущим интересом к Ph. sibiricus как основы создания фармпрепаратов и биологически активных добавок, а также невозможностью использования его природных популяций, изучение специфики вторичного метаболизма в клетках in vitro этого вида имеет не только фундаментальное, но и прикладное значение.
Таким образом, цель настоящей работы – исследование ростовых и биосинтетических (образование вторичных метаболитов) характеристик суспензионных культур клеток Ph. sibiricus при выращивании в колбах и в разных типах биореакторов.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объектов исследования использованы суспензионные культуры клеток вздутоплодника сибирского, которые были получены из каллусных культур листового и гипокотильного происхождения в 2019 году [11].
Для выращивания использовали среду Мурасиге и Скуга (MS), приготовленную по прописи [12] с добавлением инозитола (0.1 г/л), 3% сахарозы и регуляторов роста – 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) (1.0 мг/л) и 6-бензиламинопурина (БАП) (0.5 мг/л) (“Merck”, Германия).
Культивирование проводили в колбах объемом 250 мл (35 – 40 мл суспензии в колбе) на ротационном шейкере (100 об/мин) в темноте при 25 ± 1°С. Цикл выращивания составлял 21 сут. Для пересева использовали соотношение инокулюм : свежая среда, равное 1 : 4 (для суспензионной культуры клеток гипокотильного происхождения) и 1 : 10 (для суспензионной культуры клеток листового происхождения).
Для аппаратурного выращивания применяли биореакторы с различным типом перемешивающего устройства:
1) Микробиологический биореактор с механической мешалкой, общим объемом 7.5 л (“New Brunswick”, MF-107, США). Перемешивающее устройство – типа “морской винт” (оригинальная конструкция лаборатории биологии культивируемых клеток ИФР РАН, материал – фторпласт, диаметр 60 мм, 4 лопасти, 100 об/мин).
2) Барботажный соплоконусный биореактор, общим объемом 21 л (собственная разработка лаборатории биологии культивируемых клеток ИФР РАН). Перемешивающее устройство – барботер с одним отверстием диаметром 6 мм.
В обоих аппаратах использовали одинаковый тип трубчатого аэратора с микроотверстиями для мелкодисперсной подачи воздуха в питательную среду. Скорость подачи воздуха для аэрации – от 0.17 до 0.25 л на 1 л питательной среды в минуту (скорость постепенно повышали из-за уменьшения объема суспензии после отбора проб, в случае барботажного биореактора – это сумма воздуха на барботаж и аэрацию вместе взятые).
Для инокуляции в биореакторы использовали двухнедельную культуру, выращенную в колбах. Исходная плотность сухой биомассы составляла около 1 г/л. Культивирование проводили при температуре 26 ± 0.1°С в темноте.
Жизнеспособность культур определяли с помощью окрашивания клеток прижизненным красителем феносафранином (0.1% раствор) (“Merck”, Германия) путем подсчета живых (неокрашенных) и мертвых (окрашенных) культивируемых единиц под микроскопом. Для вычисления концентрации клеток применяли подсчет клеток в гемоцитометре Фукса-Розенталя после инкубации суспензии в 20% растворе хромовой кислоты при 60°C в течение 25–30 мин. Для определения сырой и сухой биомассы в 1 л среды фиксированный объем суспензии (не менее 10 мл в двух биологических повторностях) фильтровали под вакуумом через бумажный фильтр с помощью воронки Бюхнера [13]. Биомассу высушивали в сушильном шкафу при 50°C в течение 24 ч.
Микрофотографии клеток сделаны с помощью цифровой камеры ToupCam SCMOS 0.3 Мпикс (Китай).
На основании полученных результатов рассчитывали параметры роста суспензионных культур клеток, такие как индекс роста (I), удельная скорость роста (μ), время удвоения биомассы (τ), максимальное накопление сухой биомассы (Mmах), экономический коэффициент (Y), продуктивность по биомассе (P).
Для расчетов использовали следующие формулы [12]:
I = Xmax/ Xo, где Xmaxи Хo – максимальное и начальное значения критерия роста соответственно (сухая биомасса, сырая биомасса, концентрация клеток).
µ (сут–1) = ln X2 – ln X1)/(t2 – t1), где X2 и X1 – значения критерия роста (концентрация клеток, содержание сырой/сухой биомассы в литре среды) в момент времени t2 и t1 соответственно (рассчитывается для экспоненциальной фазы роста).
τ (сут) = ln 2/µ.
Y = (Хmax – Хo)/So, где Хmax и Хo – максимальная и начальная концентрации сухой биомассы (г/л), соответственно; So – начальная концентрация субстрата (сахарозы) в среде (г/л среды).
P (г/л · сут) = (Хi – Хo)/(ti – to), где Хo и Хi – количество сухой биомассы в начале культивирования и в момент времени ti, соответственно.
Для качественного анализа вторичных метаболитов в биомассе суспензионных культур клеток Ph. sibiricus использовали ультраэффективную жидкостную хроматографию с масс-спектрометрическим детектированием при ионизации электрораспылением (УЭЖХ ЭР МС). В качестве образца сравнения использовали корни интактных растений Ph. sibiricus (сбор 2017 года, Олекминский район, Якутия), предоставленные Ю.А. Аргыловым.
Общую экстракцию проводили из измельченного воздушно-сухого растительного материала (40–100 мг) 70% (по объему) водным этиловым спиртом 3 раза в течение 30 мин под действием ультразвука (УЗВ-12, “Сапфир”, Россия), после чего центрифугировали при 10000 об/мин в течение 10 мин (МЦФ “ПЭ-6926”, Россия) и отбирали супернатант в грушевидную колбу. Объединенные спиртовые экстракты упаривали под вакуумом при температуре 45°С. Полученный экстракт суспендировали в 5% (по объему) растворе уксусной кислоты в дистиллированной воде и наносили на патрон для твердофазной экстракции Supelclean ENVI-18 (“Supelco”, США). Патрон последовательно промывали 5% (по объему) раствором уксусной кислоты в дистиллированной воде и 70% этанолом. Полученный раствор упаривали под вакуумом при 45°С. Перед анализом экстракты растворяли в 1 мл смеси ацетонитрил-вода (1 : 1, по объему). Объем инжекции составлял 1–2 мкл.
УЭЖХ ЭР МС анализ проводили на хроматографе Waters Acquity UPLC (“Waters”, США), оснащенном гибридным квадрупольным времяпролетным масс-спектрометром XEVO QTOF (“Waters”, США). Анализ осуществляли в режиме детектирования положительных и отрицательных ионов (диапазон m/z 100–2000). Параметры источника ионизации: температура источника ионизации – 120°С, температура десольвации – 250°С, напряжение на капилляре – 3.0 кВ, напряжение на конусе ввода пробы – 30 В, скорость подачи азота (десольвационный газ) 600 л/ч.
Условия хроматографического разделения: колонка ACQUITY UPLC BEH Phenyl (50 × 2.1 мм, 1.7 мкм; “Waters”, Ирландия), температура колонки – 40°С, скорость потока подвижной фазы – 0.4 мл/мин. Компоненты подвижной фазы: 0.1% (по объему) раствор муравьиной кислоты в воде (растворитель А) и 0.1% (по объему) раствор муравьиной кислоты в ацетонитриле (растворитель Б). В работе использовали два разных режима градиентного элюирования. При этом в ходе анализа состав подвижной фазы менялся следующим образом (растворитель Б, % по объему): градиентный режим “А”: 0–1 мин – 15%, 1–5 мин – 15→30%, 5–15 мин – 30 → 38%, 15–15.,5 мин – 38 → 45%, 15.5–23 мин – 45%, 23–23.5 мин – 45 → 95%; градиентный режим “Б”: 0–15 мин – 5 → 30%, 15–17 мин – 30 → 95%, 17–20 мин – 95%. Обработку полученных результатов производили с помощью программы MassLynx (“Waters”, США).
Определение ростовых и физиологических характеристик (содержание сырой и сухой биомассы, жизнеспособность и концентрацию клеток) проводили в двух биологических повторностях. На графиках представлены средние значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
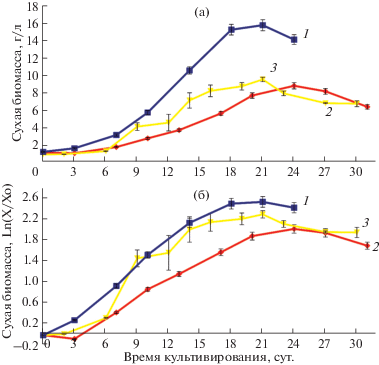
Для оценки ростовых и физиологических характеристик суспензионных культур клеток Ph. sibiricus при выращивании в колбах использовали жизнеспособность, концентрацию клеток, накопление сырой и сухой биомассы. Полученные результаты представлены на рис. 1 и табл. 1 и 2. При анализе кривых роста было отмечено наличие лаг-фазы в течение 2 суток для суспензионной культуры клеток Ph. sibiricus листового происхождения и отсутствие лаг-фазы для суспензионной культуры клеток гипокотильного происхождения. Жизнеспособность клеток в течение цикла выращивания находилась на уровне 70–80% и снижалась до 50–60% после 19–21 сут. Из представленных результатов по производным параметрам роста следует, что суспензионную культуру клеток листового происхождения можно отнести к хорошо растущим культурам Индексы роста по всем критериям (сухая и сырая биомасса клеток, концентрация клеток) превышает 10, удельная скорость роста μ находится в пределах 0.3–0.4 сут–1; максимальное накопление сухой биомассы М около 10 г/л. Экономический коэффициент Y при выращивании этой культуры равен 0.29, из чего следует, что почти 30% сахарозы питательной среды расходуется на построение биомассы клеток. В то же время суспензионная культура клеток гипокотильного происхождения при аналогичных условиях культивирования имела существенно худшие показатели роста. В среднем ростовые параметры этой культуры были в 2–3 раза ниже, чем культуры листового происхождения (I = 3.6–4.9, μ = = 0.12–0.18 сут–1, М = 6.6 г/л, Y = 0.16).
Рис. 1.
Кривые роста суспензионных культур клеток Ph. sibiricus листового (а) и гипокотильного (б) происхождения: 1 – концентрация клеток ((*105)/2), кл/мл; 2 – сырая биомасса (/10), г/л; 3 – сухая биомасса, г/л; 4 – жизнеспособность клеток.

Таблица 1.
Ростовые характеристики суспензионной культуры клеток Ph. sibiricus листового происхождения
| Показатель роста | Производные параметры роста | |||||
|---|---|---|---|---|---|---|
| I | μ, сут–1 | τ, сут | Mmax, г/л | Y | P, г/(л · сут) | |
| Концентрация клеток | 12.4 | 0.30 | 2.35 | 9.6 | 0.29 | 0.46 |
| Сырая биомасса | 14.2 | 0.40 | 1.73 | |||
| Сухая биомасса | 10.0 | 0.38 | 1.82 | |||
Таблица 2.
Ростовые характеристики суспензионной культуры клеток Ph. sibiricus гипокотильного происхождения
| Показатель роста | Производные параметры роста | |||||
|---|---|---|---|---|---|---|
| I | μ, сут–1 | τ, сут | Mmax, г/л | Y | P, г/(л · сут) | |
| Концентрация клеток | 4.08 | 0.18 | 3.78 | 6.6 | 0.16 | 0.27 |
| Сырая биомасса | 4.93 | 0.17 | 4.16 | |||
| Сухая биомасса | 3.60 | 0.12 | 5.62 | |||
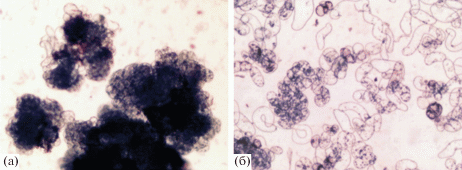
Для ростовых процессов исследуемых культур клеток провели оценку их степени агрегированности. Суспензионная культура клеток из каллусов листового происхождения имела преимущественно более мелкие агрегаты, которые включали от 10 до 30 меристемоподобных клеток, и большое количество одиночных меристемоподобных, паренхимоподобных, удлиненных и аномальных клеток. Для суспензионной культуры из каллусов гипокотильного происхождения показано наличие большого количества крупных плотных агрегатов, состоящих, как минимум, из 30–50 клеток меристемоподобного и паренхимоподобного типа. Микрофотографии суспензий представлены на рис. 2.
Рис. 2.
Микрофотографии суспензионных культур клеток Ph. sibiricus, полученных из каллуса гипокотильного происхождения (а) и каллуса листового происхождения (б) (увеличение – 360x).
Для аппаратурного выращивания использовали хорошо растущую мелкоагрегированную суспензионную культуру клеток листового происхождения. Были применены два типа биореакторов – с механическим перемешиванием общим объемом 7.5 л) и барботажный общим объемом 21 л. Ростовые характеристики при культивировании в разных типах биореакторов представлены на рис. 2 и в табл. 3 и 4.
Таблица 3.
Ростовые характеристики суспензионной культуры клеток Ph. sibiricus листового происхождения при выращивании в барботажном биореакторе
| Показатель роста | Производные параметры роста | |||||
|---|---|---|---|---|---|---|
| I | μ, сут–1 | τ, сут | Mmax, г/л | Y | P, г/(л · сут) | |
| Сырая биомасса | 14.7 | 0.20 | 3.51 | 15.8 | 0.49 | 0.78 |
| Сухая биомасса | 12.7 | 0.18 | 4.10 | |||
Таблица 4.
Ростовые характеристики суспензионной культуры клеток Ph. sibiricus листового происхождения при выращивании в биореакторе с механическим перемешиванием
| Показатель роста | Производные параметры роста | |||||
|---|---|---|---|---|---|---|
| I | μ, сут–1 | τ, сут | Mmax, г/л | Y | P, г/(л · сут) | |
| Сырая биомасса | 6.9 | 0.13 | 5.5 | 8.9 | 0.26 | 0.33 |
| Сухая биомасса | 7.6 | 0.13 | 5.2 | |||
Из представленных результатов следует, что аппаратурное выращивание клеток в барботажном биореакторе приводит к стабильному росту культуры с длительностью лаг-фазы около 3 суток и улучшению ее основных ростовых показателей (индекс роста по сухой биомассе I = 12.7; максимальное накопление сухой биомассы M = 15.8 г/л продуктивность по сухой биомассе P = 0.78 г/(л · сут), экономический коэффициент Y = 0.49). Напротив, при использовании биореактора с механическим перемешиванием отмечено ухудшение ростовых параметров (индекс роста по сухой биомассе – 7.6; удельная скорость роста по сухой биомассе – 0.13 сут–1; максимальное накопление сухой биомассы – 8.9 г/л.). Наблюдаемое снижение ростовых характеристик обусловлено повреждающим действием на клетки механических перемешивающих устройств этого типа биореактора. Качественный фитохимический анализ вторичных метаболитов в исследуемых линиях суспензионных культур клеток и корнях вздутоплодника сибирского был проведен методом УЭЖХ ЭР МС. Хроматографический анализ суспензионных культур клеток Ph. sibiricus был разделен на две стадии. Первая стадия включала поиск и идентификацию в спиртовых экстрактах из биомассы суспензионных культур ацилированных производных келлактона – основных биологически активных веществ вздутоплодника сибирского (для сравнения использовали спиртовой экстракт из корней Ph. sibiricus). На второй стадии фитохимического исследования была выполнена предварительная идентификация обнаруженных вторичных метаболитов других структурных типов.
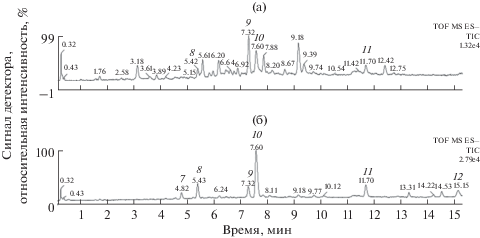
На первой стадии УЭЖХ ЭР МС анализ экстрактов из корней и биомассы двух суспензионных культур клеток Ph. sibiricus был выполнен в градиентном режиме “А”. Этот режим разделения позволяет проводить анализ соединений достаточно широкого диапазона полярности [14]. Результаты представлены на рис. 3.
Рис. 3.
Кривые роста по накоплению сухой биомассы суспензионной культуры Ph. sibiricus листового происхождения в нормальной (а) и в полулогарифмической (б) системах координат при выращивании различных типах систем: 1 – барботажный биореактор; 2 – биореактор с механическим перемешиванием, 3 – колбы.
Выявлено, что профили вторичных метаболитов в культурах клеток и корнях интактных растений вздутоплодника сибирского имели значительные отличия. В суспензионных культурах клеток Ph. sibiricus в основном преобладали более полярные соединения (элюируются с хроматографической колонки в пределах 1–8 мин). В корнях вздутоплодника сибирского основными компонентами являлись более гидрофобные соединения (элюируются с колонки в пределах 11–20 мин). Сравнение результатов масс-спектрометрии обнаруженных соединений в экстрактах из корней Ph. sibiricus с данными литературы [5] позволяет заключить, что все они представляют собой эфиры ангулярного пиранокумарина келлактона с различными органическими кислотами. Два основных метаболита корней Ph. sibiricus (соединения 2 и 3, элюируются с колонки на 13.1 и 13.5 мин соответственно) идентифицированы как виснадин и дигидросамидин. В образцах биомассы суспензионных культур клеток Ph. sibiricus эти соединения обнаружить не удалось.
Для детальной идентификации полярных метаболитов (в градиентном режиме “А” элюируются с хроматографической колонки в пределах 1–8 мин), обнаруженных в суспензионных культурах клеток Ph. sibiricus, провели УЭЖХ ЭР МС анализ соответствующих экстрактов с использованием программы элюирования “Б”. Запись хроматограмм проводили в режиме детектирования отрицательных ионов [15]. Хроматограммы (полный ионный ток) экстрактов из биомассы двух суспензионных культур клеток Ph. sibiricus, записанные при детектировании отрицательных ионов, представлены на рис. 4.
Рис. 4.
УЭЖХ ЭР МС хроматограммы (режим полного ионного тока, регистрация положительных ионов; программа градиентного элюирования “А”) спиртовых экстрактов из корней (а) и биомассы суспензионных культур клеток Ph. sibiricus гипокотильного (б) и листового (в) происхождения: 1 – pteryxin; 2 – visnadin; 3 – dihydrosamidin; 4 – khellactone 3-isovaleroyl/2-methylbutyroyl-4-isobuturoyl ester; 5 – khellactone 3-isovaleroyl/2-methylbutyroyl-4-senecioyl/angeloyl ester; 6 – khellactone 3,4-diisovaleroyl/2-methylbutyroyl ester/khellactone isovaleroyl-2-methylbutyroyl ester.

Показано, что основными (судя по интенсивности сигналов соответствующих хроматографических пиков) во всех образцах были шесть соединений, которые элюировались с колонки в пределах 4.8–15.2 мин. В порядке увеличения гидрофобности эти соединения обозначены номерами 7–12 (рис. 5). Состав полярных вторичных метаболитов в биомассе суспензионных культур клеток Ph. sibiricus характеризовался значительным сходством.
Рис. 5.
УЭЖХ ЭР МС хроматограммы (режим полного ионного тока, регистрация отрицательных ионов; программа градиентного элюирования “Б”) спиртовых экстрактов из биомассы суспензионных культур клеток Ph. sibiricus листового (а) и гипокотильного (б) происхождения: 7–12 – хроматографические пики идентифицированных вторичных метаболитов (табл. 4).
Предварительную структурную идентификацию обнаруженных соединений проводили путем сравнения их масс-спектрометрического и относительного хроматографического поведения с данными литературы [5, 16–18]. Результаты идентификации компонентов № 7–12 представлены в таблице 5. Все идентифицированные компоненты являются фенольными производными разных структурных типов. Компоненты 7, 11 и 12 относятся к группе кумаринов: компонент 7 – гексозид (скорее всего – глюкозид) ангулярного пиранокумарина келлактона [5]; компоненты 11 и 12 – производные простого пренилированного кумарина остхенола или 7-деметилсуберозина (изомерные кумарины, которые трудно различить на основании только данных масс-спектрометрии) [19]. Компоненты 8 и 10, вероятнее всего, относятся к группе гликозидов бензофуранов [16]. Компонент 9 – идентифицирован как гликозилированное производное изомера матаирезинола – лигнана дибензилбутиролактонного типа [18]. Из идентифицированных соединений для интактных растений вздутоплодника сибирского характерным считается только гликозид келлактона (компонент 7) [5]. Однако судя по интенсивности сигнала соответствующего хроматографического пика, соединение 7 является “минорным” (в количественном отношении) фенольным вторичным метаболитом в культивируемых in vitro клетках Ph. sibiricus. Стоит отметить, что в настоящей работе идентификация соединений основана почти исключительно на результатах масс-спектрометрии. Поэтому для более точного структурного описания обнаруженных веществ требуются дальнейшие исследования.
Таблица 5.
Результаты УЭЖХ ЭР МС анализа (регистрация отрицательных ионов; градиентный режим “Б”) экстракта из биомассы суспензионной культуры клеток Ph. sibiricus гипокотильного происхождения
| Номер пика* | tR, мин** | Масс-спектры, m/z*** | Результаты идентификации | |
|---|---|---|---|---|
| [M–H]– | Другие ионы | |||
| 7 | 4.8 | 423.11 | 847.25 [2M – H]– 491.10 [M–H+ HCOONa]– 486.10 [M–H + HCOONH4]– |
Khellactone-Hex |
| 8 | 5.4 | 397.10 | 795.22 [2M–H]– 465.09 [M–H + HCOONa]– 460.12 [M–H + HCOONH4]– |
Изомер 6-Carboxyethyl-7-methoxy-5-hydroxybenzofuran 5-Hex |
| 9 | 7.3 | 605.17 | 673.16 [M–H + HCOONa]– 561.19 [M–H–CO2]– 357.12 [M–H–Hex–Mal]– 339.12 [M–H–Hex–Mal–18]– |
Изомер matairesinol-Hex-Mal |
| 10 | 7.6 | 483.10 | 967.21 [2M–H]– 469.12 [M–H–14]– 439.09 [M–H–CO2]– |
Изомер 6-Carboxyethyl-7-methoxy-5-hydroxybenzofuran 5-Hex-Mal |
| 11 | 11.8 | – | 955.26 [2M–H]– 433.15 [M–H–CO2]– 229.07 [M–H–Hex–Mal]– 545.12 [M–H + HCOONa]– 540.13 [M–H + HCOONH4]– |
7-demethylsuberosin/Osthenol-Hex-Mal |
| 12 | 15.1 | 229.07 | – | 7-demethylsuberosin/Osthenol |
Примечание: * – нумерация пиков соответствует таковой на рис. 5; ** – время удерживания на хроматографической колонке, мин (градиентный режим “Б”); *** – данные масс-спектров (указаны значения m/z для обнаруженных ионов); Hex – остаток гексозы; Mal – остаток малоновой кислоты.
ОБСУЖДЕНИЕ
Исследование факторов, определяющих ростовые и биосинтетические свойства культур клеток высших растений, имеет как фундаментальное, так и прикладное значение. Традиционно считается, что эпигенетические свойства экспланта (использование различных органов растения для инициации культур клеток) играют менее существенную роль для этих характеристик, чем генетические особенности (вид растения) или условия культивирования. Полученные в настоящей работе результаты не в полной степени согласуются с этой точкой зрения. Анализ ростовых характеристик двух суспензионных культур клеток Ph. sibiricus, которые были получены из каллусов, инициированных из разных эксплантов (лист или гипокотиль стерильных растений), показал существенные отличия. Ростовые параметры суспензионной культуры клеток, полученной из каллусов листового происхождения, были в два – три раза выше, чем у культуры, инициированной из каллусов гипокотильного происхождения. Любопытно, что используемые для получения суспензионных культур каллусные линии Ph. sibiricus обладали противоположными свойствами – худший рост был характерен для каллусной культуры клеток листового происхождения [11].
Сопоставление основных физиологических характеристик исследуемых суспензионных культур клеток Ph. sibiricus позволяет предположить, что наблюдаемые изменения их ростовых параметров обусловлены различиями в степени их агрегированности: культура клеток листового происхождения состояла из мелких клеточных агрегатов, гипокотильного – из крупных. Поскольку обе суспензионные культуры клеток Ph. sibiricus были получены одновременно и в идентичных условиях, можно предположить, что наблюдаемые различия в их степени агрегированности обусловлены характеристиками (в том числе, эпигенетическими) исходных каллусных культур клеток.
Характеристика линий, полученных из разных органов одного растения, является важным критерием при отборе перспективных штаммов для биотехнологического использования культур клеток. Выращивание суспензионной культуры клеток Ph. sibiricus листового происхождения в барботажном биореакторе показало улучшение ростовых показателей, по сравнению с культивированием в колбах. Напротив, при выращивании клеток в биореакторе с механическим перемешиванием отмечено снижение ростовых показателей. Подобные результаты были получены при работе с культурами клеток других видов (диоскореи Dioscorea deltoidea Wall., женьшеня Panax japonicus var repens, стефании Stephania glabra Roxb [20, 21]). При этом улучшение ростовых характеристик в барботажном биореакторе предположительно связано с большей интенсивностью аэрации клеток, а ухудшение роста при использовании биореактора с механическим перемешиванием – с повреждающим действием на клетки перемешивающих устройств. Таким образом, при аппаратурном культивировании суспензионной культуры клеток Ph. sibiricus предпочтительной системой ожидаемо оказался барботажный биореактор.
В ходе исследования фитохимического состава в суспензионных культурах клеток вздутоплодника сибирского были отмечены значительные различия в составе фенольных соединений в клетках in vitro и в корнях интактного растения. В суспензионных культурах клеток Ph. sibiricus в основном преобладали полярные (гидрофильные) соединения, тогда как в корнях главными компонентами были более гидрофобные метаболиты. Основные метаболиты корней Ph. sibiricus, такие как виснадин и дигидросамидин, в биомассе суспензионных культур клеток обнаружены не были.
Все идентифицированные полярные компоненты суспензионных культур клеток вздутоплодника сибирского относились к фенольным производным. При этом большинство обнаруженных соединений в клетках in vitro (за исключением гликозида келлактона [22]) не характерны для интактных растений Ph. sibiricus.
Некоторые из обнаруженных соединений – эфир гексозида пренилированного кумарина остхенола/7-деметилсуберозина, малонильные производные гликозидов кумаринов – могут быть отнесены к весьма редким фенольным производным растений. Другие из обнаруженных соединений – гликозиды бензофуранов – достаточно широко распространены среди разных таксонов [16, 22–26], однако сообщений об их присутствии у видов Phlojodicarpus spp. в доступной литературе обнаружить не удалось.
Любопытно, что характерные для интактного растения пренилированные кумарины (виснадин, дигидросамидин и другие эфиры келлактона) были идентифицированы в исходных каллусных культурах Ph. sibiricus [11], но в длительно выращиваемых суспензионных культурах клеток они не были обнаружены.
Изложенные результаты вполне согласуются с известными в литературе данными об изменении (по сравнению с интактными растениями) вторичного метаболизма в культивируемых in vitro клетках растений. Подобные тенденции были отмечены при образовании стероидных гликозидов в культурах клеток диоскореи дельтовидной (Dioscorea deltoidea Wall.) и якорцев стелющихся (Tribulus terrestris L.). В обеих культурах происходило накопление только способствующих пролиферации клеток фуростаноловых гликозидов, тогда как для интактных растений более характерны спиростаноловые формы стероидных гликозидов [1, 27].
Работы по выращиванию суспензионных культур клеток Ph. sibiricus и исследованию их ростовых характеристик выполнены при финансовой поддержке гранта Российского научного фонда (проект № 18-74-00097).
Работы по анализу фитохимических характеристик культур клеток Ph. sibiricus выполнены при финансовой поддержке государственного задания Минобрнауки России (FSRG-2020-0019).
Работы по аппаратурному выращиванию суспензионных культур клеток Ph. sibiricus и идентификации обнаруженных вторичных метаболитов выполнены при финансовой поддержке Мегагранта Правительства Российской Федерации (Соглашение № 075-15-2019-1882).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Nosov A.M., Popova E.V., Kochkin D.V. Isoprenoid Production via Plant Cell Cultures: Biosynthesis, Accumulation and Scaling-Up to Bioreactors // Production of Biomass and Bioactive Compounds Using Bioreactor Technology / Eds. Paek K.Y., Murthy H., Zhong J.J. Dordrecht: Springer, 2014. P. 563. https://doi.org/10.1007/978-94-017-9223-3_23
Красная книга Республики Саха (Якутия). Т. 1: Редкие и находящиеся под угрозой исчезновения виды растений и грибов / Отв. ред. Данилова Н.С. Москва: Реарт, 2017. 409 с.
Сенчик А.В., Маликова Е.И. Красная книга Амурской области: Редкие и находящиеся под угрозой исчезновения виды животных, растений и грибов [2-е изд.]; http://www.amurohota.ru/files/RedBookAmur2019.pdf
Красная книга Забайкальского края: Растения / Научный редактор Попова О.А. Новосибирск: Дом мира, 2017. 384 с.
Olennikov D.N., Fedorov I.A., Kashchenko N.I., Chirikova N.K., Vennos C. Khellactone Derivatives and Other Phenolics of Phlojodicarpus sibiricus (Apiaceae): HPLC-DAD-ESI-QQQ-MS/MS and HPLC-UV Profile, and Antiobesity Potential of Dihydrosamidin // Molecules. 2019. V. 24. P. 2286. https://doi.org/10.3390/molecules24122286
Antonova O.K., Shemeryankin B.V. Coumarins of the roots of Phlojodicarpus sibiricus // Chemistry of Natural Compounds. 1981. V. 17. P. 588. https://doi.org/10.1007/BF00574388
Nikonov G.K., Vandyshev V.V. Visnadin – A new component of the plant genus Phlojodicarpus // Chemistry of Natural Compounds. 1969. V. 5. P. 101. https://doi.org/10.1007/BF00633290
Babilev F.V., Nikonov G.K. Coumarins of the roots of Phlojodicarpus villosus Turcz. // Chemistry of Natural Compounds. 1965. V. 1. P. 278. https://doi.org/10.1007/BF00563704
Gantimur D., Semenov A.A. Coumarins from Phlojodicarpus sibiricus // Chemistry of Natural Compounds. 1981. V. 17. P. 41. https://doi.org/10.1007/BF00566431
Васильева О.Д. Вздутоплодник сибирский Phlojodicarpus sibiricus (Steph. ex Spreng.) K.-Pol. в Якутии (Биология, интродукция, охрана): Автореф. дисc. … канд. биол. наук. Новосибирск: ИБПК СО РАН, 2005. 15 с.
Ханды М.Т., Кочкин Д.В., Томилова С.В., Галишев Б.А., Клюшин А.Г., Носов А.М. Получение и фитохимический скрининг каллусных и суспензионных культур клеток вздутоплодника сибирского Phlojodicarpus sibiricus (Steph. ex Spreng.) К.-Pol. / Биотехнология. 2020.
Murashige T., Skoog F. A revised medium for rapid growth and bio-assays with tobacco tissue cultures // Physiologia Plantarum. 1962. V. 15. P. 473.
Носов А.М. Методы оценки и характеристики роста культур клеток высших растений // Молекулярно-генетические и биохимические методы в современной биологии растений / Под ред. Вл.В. Кузнецова, В.В. Кузнецова, Г.А. Романова. Москва: Бином. Лаборатория знаний, 2012. С. 386.
Kochkin D.V., Galishev B.A., Glagoleva E.S., Titova M.V., Nosov A.M. Rare triterpene glycoside of ginseng (ginsenoside malonyl-Rg1) detected in plant cell suspension culture of Panax japonicus var. repens // Russ. J. Plant Physiol. 2017. V. 64. P. 649. https://doi.org/10.1134/S102144371705003X
Liigand P., Kaupmees K., Haav K., Liigand J., Leito I., Girod M., Antoine R., Kruve A. Think Negative: Finding the Best Electrospray Ionization/MS Mode for Your Analyte // Analytical Chemistry. 2017. V. 89. P. 5665. https://doi.org/10.1021/acs.analchem.7b00096
Wei S.-P., Luan J.-Y., Lu L.-N., Wu W.-J., Ji Z.-Q. A new benzofuran glucoside from Ficus tikoua Bur. // Int. J. Mol. Sci. 2011. V. 12. P. 4946. https://doi.org/10.3390/ijms12084946
Xu M. J., Wu B., Ding T., Chu J. H., Li C. Y., Zhang J., Wu T., Wu J., Liu S. J., Liu S. L., Ju W. Z., Li P. Simultaneous characterization of prenylated flavonoids and isoflavonoids in Psoralea corylifolia L. by liquid chromatography with diode-array detection and quadrupole time-of-flight mass spectrometry // Rapid Commun. Mass Spectrom. 2012. V. 26. P. 2343. https://doi.org/10.1002/rcm.6361
Liu X.-T., Wang X.-G., Yang Y., Xu R., Meng F.-H., Yu N.-J., Zhao Y.-M. Qualitative and Quantitative Analysis of Lignan Constituents in Caulis Trachelospermi by HPLC-QTOF-MS and HPLC-UV // Molecules. 2015. V. 20. P. 8107. https://doi.org/10.3390/molecules20058107
Sasaki H., Taguchi H., Endo T., Yosioka I. The Constituents of Glehnia littoralis Fr. Schmidt et Miq. Structure of a New Coumarin Glycoside, Osthenol-7-O-β-gentiobioside // Chem. and Pharm. Bull. 1980. V. 28. P. 1847.
Titova M.V., Shumilo N.A., Kulichenko I.E., Ivanov I.M., Sukhanova E.S., Nosov A.M. Features of respiration and formation of steroidal glycosides in Dioscorea deltoidea cell suspension culture grown in flasks and bioreactors // Russ. J. Plant Physiol. 2015. V. 62. P. 557. https://doi.org/10.1134/S1021443715040160
Titova M.V., Reshetnyak O.V., Osipova E.A., Shumilo N.A., Oreshnikov A.V., Osip’yants A.I., Nosov A.M. Submerged cultivation of Stephania glabra (Roxb.) Miers cells in different systems: Specific features of growth and accumulation of alkaloid stepharine // Appl. Biochem. Microbiol. 2012. V. 48. P. 645. https://doi.org/10.1134/S0003683812070046
Murray R.D.H. The Naturally Occurring Coumarins. In Fortschritte der Chemie organischer Naturstoffe // Progress in the Chemistry of Organic Natural Products / Eds. Murray R.D.H., Herz W., Falk H., Kirby G.W., Moore R.E. Vienna: Springer, 2002. P. 1. https://doi.org/10.1007/978-3-7091-6172-2_1
Sarker S.D., Nahar L. Progress in the Chemistry of Naturally Occurring Coumarins. // Progress in the Chemistry of Organic Natural Products 106 / Eds. Kinghorn A.D., Falk H., Gibbons S., Kobayashi J.I. Cham: Springer International Publishing, 2017. P. 241. https://doi.org/10.1007/978-3-319-59542-9_3
He R., Zhang Y., Wu L., Nie H., Huang Y., Liu B., Deng S., Yang R., Huang S., Nong Z., Li J., Chen H. Benzofuran glycosides and coumarins from the bark of Streblus indicus (Bur.) Corner. / Phytochemistry. 2017. V. 138. P. 170. https://doi.org/10.1016/j.phytochem.2017.01.011
Matsuo Y., Yamaguchi E., Hakamata R., Ootomo K., Takatori K., Fukaya H., Mimaki Y. Benzofuran and coumarin derivatives from the root of Angelica dahurica and their PPAR-γ ligand-binding activity / Phytochemistry. 2020. V. 173. e112301. https://doi.org/10.1016/j.phytochem.2020.112301
Mi J., Peng, Y., Zhang H., Wang X., Huo Y., Wang Z., Liu Y., Gao Y., Zhang H. A new benzofuran derivative glycoside and a new coumarin glycoside from roots of Heracleum dissectum Ledeb. / Medicinal Chemistry Research. 2018. V. 27. P. 470. https://doi.org/10.1007/s00044-017-2073-9
Ханды М.Т., Кочкин Д.В., Томилова С.В., Галишев Б.А., Суханова Е.С., Клюшин А.Г., Иванов И.М., Носов А.М. Получение и характеристика каллусных и суспензионных культур клеток якорцев стелющихся Tribulus terrestris L. – продуцента стероидных гликозидов // Биотехнология. 2016. Т. 32. С. 21.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


