Физиология растений, 2021, T. 68, № 3, стр. 297-307
Способность лактон- и кетонсодержащих брассиностероидов индуцировать прайминг у растений рапса к солевому стрессу
Л. В. Коломейчук a, *, Е. Д. Данилова a, В. А. Хрипач b, В. Н. Жабинский b, Вл. В. Кузнецов a, c, М. В. Ефимова a
a Национальный исследовательский Томский государственный университет
Томск, Россия
b Институт биоорганической химии Национальной академии наук Беларуси
Минск, Беларусь
c Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: kolomeychuklv@mail.ru
Поступила в редакцию 22.06.2020
После доработки 29.06.2020
Принята к публикации 29.06.2020
Аннотация
Исследовали способность брассиностероидов (БС) разной химической структуры (на примере 24‑эпибрассинолида (ЭБЛ) и 24-эпикастастерона (ЭКС)) индуцировать у растений рапса (Brassica napus L.) состояние прайминга, повышающего устойчивость к “отсроченному” солевому стрессу (150 мМ NaCl). После 2-недельного роста проростков рапса на гидропонной установке на среде Хогланда-Снайдера (ХС) их переносили на ту же среду с добавлением ЭБЛ или ЭКС (10 нМ) на 4 ч. Далее растения находились на среде ХС без добавления БС 20 ч. В дальнейшем их выращивали на питательной среде ХС в отсутствие или в присутствии 150 мМ NaCl в течение 6 суток. Засоление тормозило ростовые процессы (длину стебля, число листьев, площадь ассимилирующей поверхности, сырую массу растений (на 30–35%)), понижало уровни хлорофиллов a и b и каротиноидов (на 38–44%), оводненность тканей (на 3.54%), осмотический потенциал клеток (в 1.7 раза) и повышало перекисное окисление липидов (ПОЛ) (на 62%) в листьях. Одновременно солевой стресс стимулировал в 6 раз уровень пролина в листьях, в 11 раз в стеблях и корнях, в 2.3 раза активность супероксиддисмутазы (СОД) и на 26% пероксидазы. При засолении во всех частях растений возрастала концентрация (At%) Na и Cl, но снижалась концентрация ионов K, Ca, Mg, S, P, Al и Fe. Обработка растений БС (10 нМ, 4 ч) стимулировала ростовые процессы в оптимальных условиях, что в бóльшей степени было характерно для ЭКС, который также увеличивал содержание хлорофилла а и каротиноидов (на 11 и 18% в листьях, соответственно). БС стимулировали активность антиоксидантных ферментов (ЭБЛ повышал в 4.6 раза активность СОД, ЭКС увеличивал активности СОД и пероксидазы (на 48%)), что могло влиять на развитие состояния прайминга у растений. Предобработка проростков рапса БС повышала устойчивость к последующему солевому стрессу. Протекторный эффект БС проявлялся на уровнях ростовых реакций (прежде всего, у ЭКС), водного статуса и осмотического потенциала листьев. Уровень ПОЛ понижался за счет активации СОД и пероксидазы в случае с ЭБЛ и ЭКС, соответственно. Накопление ионов в растениях, подвергнутых гормональному праймингу, зависело от химической структуры БС. Высказано предположение, что протекторный эффект прайминга БС обусловлен способностью гормонов до стресса активировать антиоксидантные ферменты и воздействовать на систему транспорта неорганических ионов таким образом, что при последующем засолении растения более активно аккумулировали ионы, следствием чего являлось понижение осмотического потенциала клеток и поддержание водного статуса. Полученные результаты могут быть полезны при разработке технологии повышения солеустойчивости рапса.
ВВЕДЕНИЕ
Интенсивное техногенное загрязнение окружающей среды привело к серьезному обострению экологической ситуации в мире, в том числе, к расширению засоленных территорий. В настоящее время засоленные почвы составляют 932.2 млн га и встречаются, по меньшей мере, в 100 странах, прежде всего, в Пакистане, Китае, США, Индии, Аргентине, в странах Центральной и Западной Азии, а также на побережье Средиземного моря [1]. Засоление является следствием неэффективного управления агропроизводством и чрезмерной эксплуатации водных ресурсов, особенно в условиях засушливого климата [2]. В России засолению почв подвержены территории почти половины субъектов страны. Основные сельскохозяйственные угодья России, включая 80% пахотных земель, локализованы в южных регионах, значительная часть которых может быть отнесена к засоленным территориям [3].
Повышенное содержание солей в почве или поливной воде оказывает губительное влияние на растения, в основе которого лежат нарушения клеточного метаболизма, баланса эндогенных регуляторов, основных физиологических процессов и, в конечном итоге, приводит к снижению продуктивности растений и их пищевой ценности [4]. Ситуация усугубляется увеличением в геометрической прогрессии численности населения на планете, что предполагает рост производства продовольствия. При этом производство 90% всей мировой агрономической продукции достигается за счет выращивания 30 видов сельскохозяйственных культур, подавляющее большинство которых являются гликофитами, т. е. растениями, неустойчивыми к избыточному засолению [5].
В настоящее время не существует эффективных технологий снижения степени засоленности земель. По этой причине использование засоленных почвенных ресурсов в интересах аграрного производства требует повышения солеустойчивости хозяйственно ценных сортов растений. Подобная ситуация предполагает изучение физиологических механизмов адаптации растений к засоленным местообитаниям.
Ключевая роль в регуляции онтогенеза и адаптации растений к неблагоприятным условиям, в том числе и засолению, принадлежит фитогормонам, таким как абсцизовая кислота, гиббереллины, ауксины, цитокинины, этилен и брассиностероиды [6]. Брассиностероиды (БС) представляют собою группу стероидных гормонов растений, вовлеченных в регуляцию практически всех физиологических функций [7]. На клеточном уровне это проявляется в дифференциальной регуляции биосинтеза белков и нуклеиновых кислот, способности изменять свойства мембран и других клеточных структур, что приводит к стимуляции роста, оптимизации онтогенетического развития, улучшению пищевой ценности плодов и повышению урожайности [7, 8]. В то же время БС обладают стресс-протекторными и адаптогенными свойствами, повышающими устойчивость растений ко многим повреждающим воздействиям [7, 9, 10].
Среди преимуществ БС можно отметить их экологическую безопасность и способность вызывать биологические эффекты в крайне низких по сравнению с другими гормонами концентрациях. В последние годы была существенно расширена область агроприложений стероидных гормонов растений и созданы новые способы и средства повышения с их помощью урожайности и качества продукции растениеводства [11–13]. Подавляющее большинство опубликованных работ было направлено на изучение протекторных механизмов БС в условиях стресса [13–15], тогда как их способность индуцировать состояние прайминга, повышающего устойчивость растений к отсроченному действию повреждающего фактора в результате кратковременной гормональной обработки растений, практически не изучена [11, 12, 16]. Тем не менее, было установлено, что высокую биологическую активность проявляет лактонсодержащий брассиностероид – 24-эпибрассинолид (ЭБЛ) [17]. Потенциально активным соединением может быть и его предшественник в химическом синтезе – кетон-содержащий 24-эпикастастерон (ЭКС), чей механизм стресс-протекторного действия в настоящее время слабо исследован.
Цель работы – изучение способности лактон- и кетонсодержащего БС индуцировать состояние прайминга у растений рапса, а также специфичности их действия в условиях солевого стресса.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили на растениях рапса (Brassica napus L.) сорта Вестар канадской селекции. Семена проращивали в перлите на дистиллированной воде в течение 7 суток, после чего проростки переносили на жидкую питательную среду Хогланда-Снайдера (ХС) для дальнейшего культивирования под люминесцентными лампами L36W/77 Fluora (“Osram”, Германия) при плотности потока квантов ФАР 100 мкмоль ∙ м–2 ∙ с–1 в фитотроне с 16-часовым фотопериодом и температурой 23 ± 0.5°C (при освещении) и 20 ± 0.5°C (ночью). После 2-недельного роста на гидропонной установке в среде ХС растения переносили на ту же среду с добавлением ЭБЛ или ЭКС в концентрациях 10 нМ на 4 ч. Далее растения находились на среде ХС без добавления БС 20 ч. В дальнейшем их помещали на питательную среду ХС в отсутствие или в присутствии 150 мМ NaCl. Контрольные растения росли на стандартной среде ХС в течение всего эксперимента. Используемые в данной работе концентрации NaCl и БС были подобраны в предварительных опытах. Растительный материал фиксировали через 6 суток, после добавления в среду NaCl.
Для оценки активности антиоксидантных ферментов и оценки интенсивности перекисного окисления липидов (ПОЛ) листья средних ярусов (далее – листья) фиксировали в жидком азоте; для измерения содержания фотосинтетических пигментов – 96% этанолом. С целью определения величины осмотического потенциала клеточного содержимого листья замораживали при –20°С. Для анализа пролина листья, стебли и корни растений фиксировали жидким азотом.
Для оценки содержания фотосинтетических пигментов листья растирали в 96% этаноле, и полученный гомогенат центрифугировали 10 мин при 8 тыс. об/мин (центрифуга MiniSpin, “Eppendorf”, Германия). Оптическую плотность спиртового раствора (итоговый объем вытяжки 1.5 мл) измеряли на спектрофотометре Genesys 10S UV-Vis (“ThermoScientific”, США) при 470.0, 648.6; 664.2, 720.0 нм.
Свежую и сухую биомассы растительного материала оценивали гравиметрическим методом. Сухую массу определяли после фиксации материала при 90°С в течение 1.5 ч и его высушивания при 70°С до постоянного веса. Содержание воды (% от сырой массы) рассчитывали, исходя из отношения разности сырой и сухой биомассы, отнесенной к сырой массе и умноженной на 100%.
Осмотический потенциал клеточного экссудата определяли на криоскопическом осмометре Osmomat 030 (“Gonotec”, Германия) в соответствии с инструкцией производителя. Клеточный сок отжимали из размороженных образцов листьев растений.
Концентрации неорганических ионов (Na, K, Cl, Al, P, Mg, Ca, S и Fe) определяли в высушенных листьях, стеблях и корнях методом энергодисперсионного анализа на электронном ионно-растровом сканирующем микроскопе “Quanta 200 3D” EDAX (Нидерланды). Данные представлены в атомных процентах (At%) от общего количества элементов в данной точке образца (100 At%) за вычетом доли углерода и кислорода. Сканирование каждого варианта проводили не менее шести раз.
Интенсивность ПОЛ оценивали в образцах растений по образованию окрашенного комплекса – продукта малонового диальдегида (МДА) в реакции с тиобарбитуровой кислотой при нагревании. Определение содержания пролина оценивали в образцах растений согласно методике, описанной ранее [12].
Для оценки активности супероксиддисмутазы (СОД) (ЕС 1.15.1.1) и гваякол-зависимой пероксидазы (ПО) (ЕС 1.11.1.7) листья растений растирали в жидком азоте с нерастворимым поливинилпирролидоном, экстрагировали 0.066 М калий-фосфатным буфером (рН 7.4), содержавшим 0.5 М дитиотрейтола, 0.1 М фенилметилсульфонилфторида в диметилсульфоксиде, затем центрифугировали 20 минут при 8000 об/мин и температуре 4°С (“Eppendorf 5430R”, Германия). Из полученного супернатанта отбирали аликвоты для определения активности СОД и ПО. Общую активность СОД определяли по методу, описанному ранее [12]. Реакционная смесь объемом 2 мл содержала: 10 мкл супернатанта, 1.75 мл 50 мМ Трис-HCl-буфера (рН 7.8), 0.2 мл 0.1 М DL-метионина, 0.063 мл 1.7 мМ нитросинего тетразолия (“Fermentas”, США), 0.047 мл 1% Тритона Х-100 и 0.060 мл 0.004% рибофлавина. Реакцию проводили при освещении белыми светодиодными лампами (I = 232 мкмоль ∙ м–2 ∙ с–1) в течение 30 мин. Поглощение раствора измеряли при 560 нм на спектрофотометре Genesys 10S UV-Vis (“ThermoScientific”, США).
Активность ПОЛ определяли так, как описано ранее [12]. Реакционная смесь содержала 50 мкл супернатанта, 1.95 мл 0.066 М калий-фосфатного буфера (рН 7.4), 200 мкл 7 мМ гваякола, 250 мкл 0.01 М H2O2. Поглощение раствора измеряли при 470 нм на спектрофотометре Genesys 10S UV-Vis (“ThermoScientific”, США).
Концентрацию белка оценивали по методу, описанному ранее [12].
Все эксперименты повторяли не менее трех раз. Для каждой биологической повторности использовали 50 растений. Полученные результаты представлены на рисунках в виде средней арифметической со стандартной ошибкой. Для сравнения независимых выборок, подчиняющихся закону нормального распределения, использовали параметрический критерий Стьюдента. Значения t-критерия находили для 95% уровня значимости (Р < 0.05).
РЕЗУЛЬТАТЫ
Влияние ЭБЛ, ЭКС и NaCl на рост растений рапса при солевом стрессе
В оптимальных условиях выращивания внесение БС в питательный раствор на 4 ч стимулировало ростовые процессы. Так, добавление ЭКС приводило к увеличению длины стебля, суммарной площади листовой поверхности и сырой массы растений на 29, 22 и 15%, соответственно. В сравнении с ЭКС, стимулирующий эффект ЭБЛ был менее выражен и проявлялся лишь в ускорении на 13% роста стебля. Хлоридное засоление (150 мМ NaCl) тормозило рост стебля, уменьшало площадь ассимилирующей поверхности и, в конечном итоге, подавляло на 30–35% накопление сырой массы растений. Кратковременное воздействие ЭКС заметно снижало степень подавления роста растений в условиях отсроченного действия солевого стресса. Общая сырая масса растений и их ассимилирующая поверхность составляли 86–88% от значений контрольного варианта (табл. 1).
Таблица 1.
Влияние ЭБЛ (10 нМ), ЭКС (10 нМ) и NaCl (150 мМ) на ростовые показатели растений. Достоверные различия на уровне P ≤ 0.05 отмечены разными буквами.
| Вариант | Длина стебля, см | Суммарная площадь листовой поверхности, см2 | Общая сырая масса растений, г | |
|---|---|---|---|---|
| 0 мМ NaCl | Контроль | 2.84 ± 0.14а | 48.07 ± 2.27а | 2.48 ± 0.12а |
| ЭБЛ | 3.21 ± 0.17ab | 51.00 ± 2.25а | 2.53 ± 0.11а | |
| ЭКС | 3.65 ± 0.18b | 58.61 ± 2.40b | 2.85 ± 0.12b | |
| 150 мМ NaCl | Контроль | 2.05 ± 0.12c | 34.96 ± 2.23с | 1.60 ± 0.11c |
| ЭБЛ | 2.12 ± 0.11c | 36.08 ± 1.88c | 1.81 ± 0.09c | |
| ЭКС | 2.21± 0.10c | 42.21 ± 2.34a | 2.13 ± 0.14а |
Влияние брассиностероидов и NaCl на содержание фотосинтетических пигментов в листьях растений
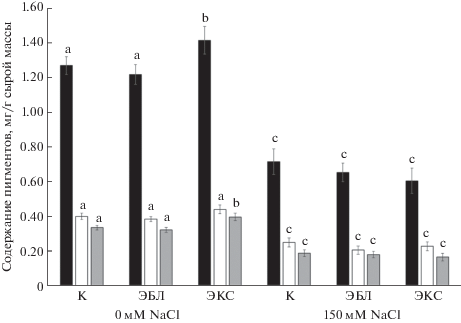
В оптимальных условиях выращивания экзогенный ЭКС стимулировал накопление хлорофилла а и каротиноидов на 11 и 18%, соответственно, тогда как ЭБЛ достоверных изменений в содержании основных фотосинтетических пигментов не вызывал. Хлоридное засоление снижало содержание хлорофиллов a и b и каротиноидов в листьях на 38–44%. Кратковременная гормональная предобработка растений не снижала негативного эффекта последующего солевого стресса на уровне содержания фотосинтетических пигментов (рис. 1).
Влияние ЭБЛ, ЭКС и NaCl на водный статус растений
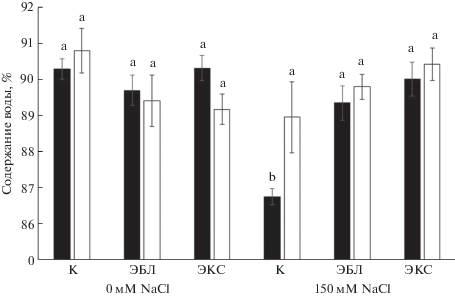
Кратковременное воздействие ЭБЛ и ЭКС достоверно не изменяло содержание воды в листьях и корнях рапса. При действии на растения рапса NaCl содержание воды в расчете на единицу сырой массы достоверно снизилось на 3.54% в листьях. Прайминг растений рапса БС способствовал повышению содержания воды в тканях листа практически до контрольных значений (рис. 2). Показатели содержания воды у растений, подверженных гормональной обработке и последующему солевому стрессу, достоверно не отличались от значений контрольного варианта.
Рис. 2.
Влияние ЭБЛ (10 нМ), ЭКС (10 нМ) и NaCl (150 мМ) на содержание воды в растениях рапса. Столбики черного цвета – побеги, белого цвета – корни растений. Достоверные различия на уровне P ≤ 0.05 отмечены разными буквами.
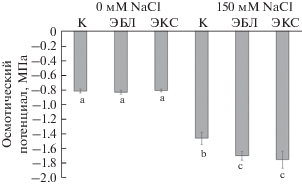
Принципиально важным для поддержания оптимального водного статуса тканей растений при засолении является понижение их осмотического потенциала до уровня, обеспечивающего поступление воды из среды в растение. Осмотический потенциал при хлоридном засолении достигал величины –1.46 МПа, что в 1.7 раз ниже контрольных значений. Кратковременное действие гормонов при последующем солевом стрессе приводило к снижению данного показателя до –1.70 МПа в случае с ЭБЛ и до –1.75 МПа при обработке ЭКС. В оптимальных условиях роста обработка растений БС не влияла на осмотический статус листьев (рис. 3 ).
Влияние брассиностероидов и NaCl на содержание неорганических ионов в листьях, стеблях и корнях растений
Важную роль в формировании осмотического потенциала клеточного содержимого играют неорганические ионы, прежде всего, ионы K, хотя в условиях засоления важная роль принадлежит также и ионам Na. Нами были проанализированы концентрации в атомных процентах (At%) Na, Mg, Al, P, S, Cl, K, Ca и Fe в листьях, стеблях и корнях растений. В корнях контрольных растений, по сравнению с побегом, преобладали все анализируемые ионы, за исключением ионов калия и магния (табл. 2). Как следует из полученных данных, в ответ на воздействие NaCl во всех частях растений значительно возрастали At% натрия и хлора и снижались At% ионов калия, кальция, магния, серы, фосфора, алюминия и железа (табл. 2). При этом концентрации ионов натрия и хлора были несколько выше в листьях, чем в корнях.
Таблица 2.
Влияние ЭБЛ (10 нМ), ЭКС (10 нМ) и NaCl (150 мМ) на содержание неорганических ионов в листьях, стеблях и корнях растений. Достоверные различия на уровне P ≤ 0.05 отмечены разными буквами
| Вариант | Na+, at % | К+, at % | Cl–, at % | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| лист | стебель | корень | лист | стебель | корень | лист | стебель | корень | ||
| 0 мМ NaCl | Контроль | 1.23 ± 0.09а | 1.74 ± 0.40а | 2.72 ± 0.23а | 48.31 ± 2.16a | 56.84 ± 1.30a | 34.85 ± 2.16a | 1.75 ± 0.27a | 1.48 ± 0.19a | 2.11 ± 0.13a |
| ЭБЛ | 2.37 ± 0.46b | 2.18 ± 0.74аb | 2.10 ± 0.36а | 45.21 ± 1.45ab | 62.16 ± 2.63b | 38.34 ± 1.87a | 1.75 ± 0.27a | 1.30 ± 0.16a | 2.10 ± 0.35a | |
| ЭКС | 1.75 ± 0.42a | 3.29 ± 0.46b | 3.11 ± 0.57а | 41.42 ± 2.64b | 53.81 ± 2.50a | 31.40 ± 2.56a | 1.19 ± 0.11a | 1.48 ± 0.34a | 2.70 ± 0.75a | |
| 150 мМ NaCl | контроль | 25.47 ± 1.34c | 24.37 ± 1.95c | 17.25 ± 1.48b | 17.16 ± 2.14c | 29.98 ± 3.36c | 19.45 ± 0.67b | 38.30 ± 1.39b | 25.55 ± 1.88b | 22.69 ± 1.37b |
| ЭБЛ | 23.02 ± 0.80c | 19.31 ± 0.95d | 17.19 ± 0.88b | 14.77 ± 0.90c | 31.76 ± 1.20c | 20.08 ± 2.87b | 38.46 ± 2.22b | 24.52 ± 0.68b | 22.86 ± 1.35b | |
| ЭКС | 22.97 ± 0.80c | 17.52 ± 1.45d | 16.85 ± 0.63b | 16.56 ± 1.32c | 31.55 ± 3.06c | 23.48 ± 0.60b | 23.45 ± 0.79c | 23.07 ± 1.84b | 38.86 ± 1.60c | |
| Вариант | Mg++, at % | Ca++, at % | S++, at % | |||||||
| 0 мМ NaCl | контроль | 7.52 ± 0.57а | 4.87 ± 0.23а | 4.74 ± 0.67а | 21.67 ± 1.34a | 8.28 ± 0.50a | 16.20 ± 1.78a | 7.65 ± 0.48a | 8.16 ± 0.45a | 9.51 ± 1.02a |
| ЭБЛ | 8.38 ± 0.79аb | 3.91 ± 0.59а | 3.30 ± 0.37аb | 16.18 ± 1.31b | 6.70 ± 0.72ab | 16.69 ± 1.24a | 8.70 ± 0.14b | 7.51 ± 0.50a | 8.67 ± 0.35a | |
| ЭКС | 9.28 ± 0.57b | 4.39 ± 0.74а | 4.13 ± 0.44а | 25.15 ± 0.93c | 8.65 ± 1.33a | 22.60 ± 2.52b | 9.51 ± 0.53b | 9.67 ± 0.82a | 8.32 ± 0.77a | |
| 150 мМ NaCl | контроль | 3.61 ± 0.24c | 3.09 ± 0.86а | 2.31 ± 0.38b | 5.38 ± 0.46d | 3.06 ± 0.29c | 9.28 ± 1.09c | 3.43 ± 0.29c | 4.54 ± 0.23b | 7.18 ± 0.43b |
| ЭБЛ | 3.76 ± 0.26c | 4.26 ± 0.28а | 2.76 ± 0.39b | 9.76 ± 1.11e | 4.54 ± 0.38b | 7.78 ± 0.67c | 3.86 ± 0.48c | 4.79 ± 0.38b | 6.65 ± 0.11b | |
| ЭКС | 2.80 ± 0.21c | 3.87 ± 0.51а | 1.75 ± 0.29b | 5.04 ± 0.72d | 5.98 ± 0.67b | 7.18 ± 0.45c | 3.71 ± 0.33c | 4.45 ± 0.18b | 6.37 ± 0.34b | |
| Вариант | P+++, at % | Al+++, at % | Fe++, at % | |||||||
| 0 мМ NaCl | контроль | 7.71 ± 0.72a | 11.31 ± 1.11a | 17.87 ± 1.55a | 1.11 ± 0.06а | 1.00 ± 0.22а | 1.54 ± 0.40а | 7.06 ± 0.64a | 5.82 ± 0.50a | 9.26 ± 0.63a |
| ЭБЛ | 9.09 ± 1.30a | 10.01 ± 0.98a | 17.50 ± 0.56a | 1.27 ± 0.33а | 0.79 ± 0.15а | 0.73 ± 0.18b | 7.34 ± 0.62a | 5.99 ± 0.31a | 9.79 ± 1.01ab | |
| ЭКС | 6.44 ± 0.70a | 14.20 ± 0.79b | 20.81 ± 1.27a | 0.56 ± 0.26b | 1.04 ± 0.31a | 1.04 ± 0.17а | 5.00 ± 0.39b | 5.72 ± 0.32a | 9.86 ± 0.85a | |
| 150 мМ NaCl | контроль | 3.81 ± 0.62b | 5.36 ± 0.28с | 13.42 ± 0.62b | 0.66 ± 0.13b | 0.75 ± 0.02a | 0.63 ± 0.13b | 3.27 ± 0.32c | 3.90 ± 0.29b | 7.81 ± 0.44b |
| ЭБЛ | 2.62 ± 0.24b | 6.51 ± 0.28d | 13.26 ± 0.69b | 0.63 ± 0.13b | 0.39 ± 0.05b | 0.79 ± 0.10b | 2.68 ± 0.25c | 4.44 ± 0.32b | 8.66 ± 0.42ab | |
| ЭКС | 3.37 ± 0.52b | 7.36 ± 0.67d | 12.38 ± 0.49b | 0.56 ± 0.12b | 0.63 ± 0.06a | 0.83 ± 0.26ab | 3.67 ± 0.18c | 4.93 ± 0.33ab | 7.99 ± 0.44b | |
Накопление ионов в растениях, подвергнутых кратковременной обработке БС, было органоспецифичным и определялось химической структурой гормона. Так, кратковременная обработка растений ЭБЛ увеличивала At% ионов натрия и серы в листьях на 90 и 13%, соответственно, в то время как концентрация ионов кальция снизилась на 25%. ЭКС усиливал накопление в листьях ионов серы, магния и кальция на 24, 23 и 16%, при этом концентрации алюминия, железа и калия снижались на 50, 30 и 14%, соответственно (табл. 2).
Прайминг растений БС с последующим солевым стрессом приводил к частичному восстановлению накопления фосфора в стебле, ионов кальция в листьях и стеблях для ЭБЛ, и в листьях – для ЭКС; снижал аккумуляцию ионов натрия в стеблях растений. ЭКС замедлял транспорт ионов хлора в листья растений и тормозил их накопление в корнях, по сравнению с действием одного солевого стресса, при этом суммарные At% ионов хлора во всех вариантах с NaCl были сходными (табл. 2).
Влияние ЭБЛ, ЭКС и NaCl на интенсивность перекисного окисления липидов в растениях
Одним из негативных последствий действия засоления на растения является окислительный стресс, связанный, прежде всего, с нарушениями процессов фотосинтеза и дыхания [18]. Интенсивность окислительного стресса в листьях рапса оценивали по уровню ПОЛ, критерием которого служило содержание МДА в реакции с тиобарбитуровой кислотой.
Как следует из полученных данных, хлоридное засоление повышало уровень ПОЛ в листьях и стеблях растений на 62 и 33% относительно контроля (рис. 4). Кратковременная гормональная обработка рапса в оптимальных условиях выращивания достоверно не влияла на уровень окислительного стресса. Антиоксидантная эффективность БС определялась химической структурой гормона и, в определенной степени, характеризовалась органоспецифичностью. Так, прайминг ЭБЛ полностью снимал NaCl-зависимый окислительный стресс в стеблях и частично – в листьях, в то время как ЭКС полностью нивелировал негативный солевой эффект в листьях и не влиял на величину ПОЛ в стеблях (рис. 4).
Влияние брассиностероидов и NaCl на содержание пролина в растениях
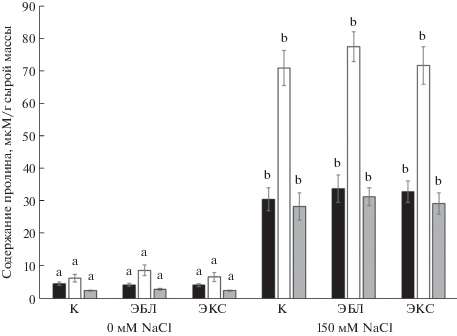
Для поддержания водного гомеостаза между основными внутриклеточными компартментами цитоплазмой и вакуолью в условиях засоления важная роль принадлежит совместимым осмолитам, одним из которых является пролин [19]. В оптимальных условиях выращивания кратковременная обработка растений БС не влияла на эндогенное содержание пролина. Хлоридное засоление повышало уровень пролина в листьях в 6 раз, в стеблях и корнях – в 11 раз по сравнению с контрольным вариантом. Прайминг БС с последующим засолением растений не вызывал достоверных изменений в содержании пролина по сравнению с действием одного 150 мМ NaCl (рис. 5).
Влияние ЭБЛ, ЭКС и NaCl на активности супероксиддисмутазы и пероксидазы в листьях растений рапса
Для снижения негативного влияния окислительного стресса в растениях активируются антиоксидантные защитные системы, действие которых направлено на гашение активных форм кислорода (АФК). Важными ферментами антиоксидантной системы являются СОД и пероксидаза (ПО). В ответ на действие NaCl растения отвечали увеличением активности СОД в 2.3 раза и ПО на 26% относительно контрольных значений (рис. 6, 7).
Рис. 6.
Влияние ЭБЛ, (10 нМ), ЭКС (10 нМ) и NaCl (150 мМ) на активность СОД в листьях растений. Достоверные различия на уровне P ≤ 0.05 отмечены разными буквами.

Рис. 7.
Влияние ЭБЛ (10 нМ), ЭКС (10 нМ) и NaCl (150 мМ) на активность пероксидазы (ПО) в листьях растений рапса. Достоверные различия на уровне P ≤ ≤ 0.05 отмечены разными буквами.

Кратковременное воздействие ЭБЛ и ЭКС повышало активность СОД в 4.6 и 6.7 раз, соответственно, в сравнении с контрольным вариантом (рис. 6). Активность ПО достоверно повышалась только в ответ на действие ЭКС на 48% по сравнению с контролем (рис. 7).
Выявлена специфика действия БС в отношении активации ферментативной антиоксидантной системы у растений на фоне последующего солевого стресса. Так, кратковременная обработка ЭБЛ при последующем засолении приводила к увеличению активности СОД в 2.5 раза относительно соответствующих значений в растениях, подвергнутых хлоридному засолению, в то время как эффект ЭКС был сопоставим с действием одного стрессора (рис. 6). Прайминг растений рапса БС с последующим засолением вызывал достоверное увеличение активности ПО относительно действия стрессора только в случае с ЭКС (рис. 7).
ОБСУЖДЕНИЕ
Одним из основных негативных эффектов засоления является торможение роста растений, в основе которого лежит, прежде всего, прогрессирующий водный дефицит, обусловленный снижением способности клеток корня поглощать воду. Осмотический стресс инициирует развитие в растениях водного дефицита [20], приводящего к нарушению клеточного гомеостаза и снижению продуктивности растений [21]. В нашем исследовании хлоридное засоление ожидаемо ингибировало рост растений рапса. Подавление роста стебля и листьев 150 мМ NaCl снижало накопление биомассы и оводненность тканей (табл. 1, рис. 2). Такие отрицательные последствия засоления сопровождались значительным понижением осмотического потенциала клеточного экссудата в листьях (рис. 3 ). Ранее было показано, что для адаптации к осмотическому стрессу ключевую роль играют K+ и Na+ [22]. В данном исследовании наблюдалось усиление накопления натрия и хлора, и падение концентраций других исследованных ионов на фоне засоления. Известно, что БС повышают устойчивость растений к осмотическому стрессу [12]. Такой эффект достигался за счет повышения эффективности использования воды и снижения устьичной проводимости [23]. Кратковременная обработка растений БС понижала величину осмотического потенциала в листьях при солевом стрессе (рис. 3 ). При этом вызванное ЭКС падение осмотического потенциала, по-видимому, повышало водопоглотительную способность клеток корня, поскольку морфометрические показатели растений и оводненность тканей практически соответствовали контрольным значениям (табл. 1). Возможно, данный эффект мог быть реализован путем гормональной регуляции накопления ионов в разных частях растений.
Известно, что продуктивность растения может определяться фотосинтетической активностью ассимиляционного аппарата, которая напрямую зависит от содержания фотосинтетических пигментов [24]. В настоящей работе показана высокая чувствительность фотосинтетического аппарата растений рапса к действию NaCl, о чем свидетельствует снижение содержания фотосинтетических пигментов на 38–44% (рис. 1). Аналогичные эффекты были обнаружены, например, на растениях риса [25] и картофеля [11]. Кроме того, известно, что NaCl ингибирует первичные процессы фотосинтеза в растениях картофеля посредством снижения скорости транспорта электронов, максимального и эффективного квантовых выходов фотосистемы II. Данные негативные эффекты засоления могут быть вызваны токсичным действием ионов на способность растений окислять пластохиновый пул [12]. Кратковременное воздействие на растения рапса лактон- или кетонсодержащих БС (10 нМ) с последующим солевым стрессом не снимало негативного действия засоления на основные фотосинтетические пигменты (рис. 1). Вероятно, эффект кратковременного действия БС на растения видоспецифичен. Так, корневая предобработка растений картофеля 0.1 нМ ЭБЛ снижала отрицательное воздействие последующего засоления на содержание основных фотосинтетических пигментов, максимальный и эффективный квантовые выходы фотосистемы II и коэффициенты фотохимического тушения флуоресценции qP [12].
Как уже отмечалось выше, NaCl в высоких концентрациях вызывает не только осмотический стресс, но и прямое токсическое действие на клеточный метаболизм, что сопровождается генерацией АФК и развитием окислительного стресса. Основная причина окислительного стресса в этом случае связана с закрыванием устьиц, снижением доступности СО2 и повышением энергии возбуждения электронов [26]. Другой причиной генерации АФК является нарушение дыхания в условиях солевого стресса. АФК вызывают деградацию белков и нуклеиновых кислот, окисление липидов, распад фотосинтетических пигментов и инактивацию ферментных систем. Вызываемое АФК повреждение мембран является основной причиной интоксикации клеток растений [26]. Удобным и широко распространенным методом оценки интенсивности окислительного стресса растений и структурной целостности мембран является определение уровня МДА, продукта реакции с тиобарбитуровой кислотой [12]. Нами была установлена органоспецифичность в накоплении МДА в растениях при солевом стрессе. Содержание МДА у растений рапса, подвергнутых действию NaCl, превышало контрольные значения, что свидетельствует о развитии у растений окислительного стресса. Кратковременная обработка растений БС не вызывала достоверных различий относительно действия одного NaCl (рис. 4).
Для снижения негативного влияния окислительного стресса в растениях активируются антиоксидантные защитные системы, действие которых направлено на гашение АФК. Повышенный интерес в этой связи могут представлять ферментативные (СОД, ПО, каталаза и др.) и неферментативные системы антиоксидантной защиты (каротиноиды, низкомолекулярные фенольные соединения, пролин и др.) [27]. Известно, что каротиноиды участвуют в тушении 1О2 и пероксида радикалов, которые генерируются при избыточном возбуждении хлорофилла [28] из-за падения тургора замыкающих клеток и сокращения, вследствие этого, поступления углекислоты в растение. Данная стратегия адаптации, направленная на снижение интенсивности окислительного стресса за счет аккумуляции каротиноидов, характерна, в основном, для растений галофитов [29]. Наиболее вероятно, что у растений рапса, относящегося к гликофитам, происходит накопление других антиоксидантных соединений, что и может быть причиной отсутствия стимулирующего эффекта ЭБЛ на содержание каротиноидов при хлоридном засолении (рис. 1). Аккумуляция пролина является одной из типичных реакций растений на солевой стресс [19]. Уровень накопления пролина при засолении зависит от вида, сорта, стадии развития растения и интенсивности солевого стресса [30]. Нами показано, что содержание совместимого осмолита пролина в ответ на действие NaCl значительно увеличивалось во всех частях растений. Пролин, являясь “химическим шапероном”, реализует защитное действие через стабилизацию функциональных единиц II комплекса ЭТЦ хлоропластов, поддержание нативной конформации белков и ферментов, таких как РУБИСКО, а также проявляя антиоксидантные свойства и вовлекаясь в тушение активных форм кислорода [19]. Уровень пролина в растениях, подвергнутых праймингу БС, с последующим засолением был сходным с его содержанием в присутствии одного NaCl (рис. 5). Длительное воздействие БС на фоне солевого стресса не только не сопровождался дополнительным накоплением пролина, но и напротив, способствовал понижению его уровня [14].
В то же самое время кратковременное гормональное воздействие, особенно ЭКС, способствовало проявлению выраженного антиоксидантного эффекта (рис. 4, 7). Можно предположить, что подобная активность БС при последующем солевом стрессе в растениях рапса реализуется не через регуляцию накопления пролина, а через иные компоненты клеточной антиоксидантной системы.
Нами показана различная реакция антиоксидантных ферментов на кратковременную предобработку растений ЭБЛ и ЭКС при последующем действии NaCl. Так, растения, подвергнутые праймингу ЭБЛ, отвечали повышением активности СОД, в то время как экзогенный ЭКС способствовал усилению активности ПО по сравнению с действием только солевого стресса (рис. 6, 7). Аналогичный результат показан на колеоптилях пшеницы, подвергнутых термическому стрессу. Отмечено, что через 24 ч инкубации колеоптилей в растворах ЭБС и ЭКС на фоне термического стресса наблюдалась значительная активация СОД, причем для ЭБЛ в бóльшей степени [15]. На растениях картофеля в условиях 0.1 нМ ЭБЛ прайминга также наблюдалась некоторая стимуляция активности СОД и пероксидазы только в течение первых 24 и 48 ч солевого воздействия соответственно [12]. Следует также обратить внимание на тот факт, что кратковременная обработка растений БС приводила к значительной стимуляции активностей СОД и ПО в контрольных растениях (рис. 6, 7). Весьма вероятно, что именно этот эффект ЭБЛ и ЭКС на антиоксидантные ферменты имеет принципиальное значение, поскольку он направлен на упреждающее формирование клеточной антиоксидантной системы для “встречи” растения с отсроченным солевым стрессом, который вызывает интенсивную генерацию АФК.
Таким образом, полученные нами данные свидетельствуют о том, что кратковременная обработка корней рапса лактон- и кетонсодержащими БС индуцирует переход растений в состояние прайминга, которое проявляется в их способности отвечать повышением устойчивости на солевой стресс в будущем. В основе защитного действия БС при заданных условиях, очевидно, лежит их способность еще до стресса формировать клеточную антиоксидантную систему и воздействовать на систему транспорта неорганических ионов таким образом, что она обеспечивает активное поступление несовместимых осмолитов при солевом стрессе, следствием чего является понижение клеточного осмотического потенциала и повышение эффективности поглощения воды. При этом специфика повышения активности антиоксидантных ферментов зависит от химической структуры гормона.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (грант № 19-34-90093).
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Qadir M., Noble A.D., Schubert S., Thomas R.J., Arslan A. Sodicity-induced land degradation and its sustainable management: Problems and prospects // Land Degrad. Dev. 2006. V. 17. P. 661. https://doi.org/10.3390/w5020578
Cuevas J., Daliakopoulos I.N., Moral F., Hueso J.J., Tsanis I. K. A Review of soil-improving cropping systems for soil salinization: Review // Agronomy. 2019. V. 9. P. 295. https://doi.org/10.3390/agronomy9060295
Панкова Е.И. Засоленные почвы: решенные и нерешенные проблемы // Почвоведение. 2015. Т. 2 С. 131. https://doi.org/10.7868/S0869587314020121
Hasanuzzaman M., Nahar K., Fujita M. Plant response to salt stress and role of exogenous protectants to mitigate salt-induced damages // Ecophysiology and Responses of Plants Under Salt Stress / Eds. Ahmad P., Azooz M., Prasad M. Springer, New York, NY,2013. P. 25. https://doi.org/10.1007/978-1-4614-4747-4_2
Zorb C., Geilfus C.M., Diet K.J. Salinity and crop yield // Plant Biol. 2019. V.1. P. 31. https://doi.org/10.1111/plb.12884
Atia A., Barhoumi Z., Debez A., Hkiri S., Abdelly C., Smaoui A., Haouari C.C., Gouia H. Plant hormones: Potent targets for engineering salinity tolerance in plants // Salinity Responses and Tolerance in Plants / Eds. Kumar V., Wani S., Suprasanna P., Tran LS. Springer, Cham., 2018. V. 1. P. 159. https://doi.org/10.1007/978-3-319-75671-4_6
Khripach V., Zhabinskii V., Groot A.D. Twenty years of brassinosteroids: Steroidal plant hormones warrant better crops for the XXI century // Ann Bot. 2000. V. 86. P. 441. https://doi.org/10.1006/anbo.2000.1227
Khripach V.A., Zhabinskii V.N., Khripach N.B. New practical aspects of brassinosteroids and results of their ten-year agricultural use in Russia and Belarus // Brassinosteroids / Eds. Hayat S., Ahmad A. Springer, Dordrecht, 2003. P. 189. https://doi.org/10.1007/978-94-017-0948-4_9
Ahammed G.J., Li X., Liu A., Chen S. Brassinosteroids in plant tolerance to abiotic stress // J. Plant Growth Regul. 2020. https://doi.org/10.1007/s00344-020-10098-0
Nolan T.M., Vukasinovic N., Liu D., Russinova E., Yin Y. Brassinosteroids: Multi-dimensional regulators of plant growth, development, and stress responses // Plant Cell. 2020. V. 32. P. 295. https://doi.org/10.1105/tpc.19.00335
Efimova M.V., Khripach V.A., Boyko E.V., Malofii M.K., Kolomeichuk L.V., Murgan O.K., Vidershpun A.N., Mukhamatdinova E.A., Kuznetsov V.V. The priming of potato plants induced by brassinosteroids reduces oxidative stress and increases salt tolerance // DOBS. 2018. Vol. 478, № 6. P. 33.https://doi.org/10.1134/S0012496618010106
Kolomeichuk L.V., Efimova M.V., Zlobin I.E., Kreslavski Vl.D., Murgan O.K., Kovtun I.S., Khripach Vl.A., Kuznetsov Vl.V., Allakhverdiev S.I. 24‑Epibrassinolide alleviates the toxic effects of NaCl on photosynthetic processes in potato plants // Photosynth. Res. 2020 https://doi.org/10.1007/s11120-020-00708-z
Sytar O., Kumari P., Yadav S., Brestic M., Rastogi A. Phytohormone priming: regulator for heavy metal stress in plants // J. Plant Growth Regul. 2019. V. 38. P. 739. https://doi.org/10.1007/s00344-018-9886-8
Efimova M.V., Savchuk A.L., Hasan J.A.K., Litvinovskaya R.P., Khripach V.A., Kholodova V.P., Kuznetsov V.V. Physiological mechanisms of enhancing salt tolerance of oilseed rape plants with brassinosteroids // Russ. J. Plant Physiol. 2014. V. 61, № 6. P 733. https://doi.org/10.1134/S1021443714060053
Tanveer M., Shahzad B., Sharma A., Biju S., Bhardwaj R. 24-Epibrassinolide; an active brassinolide and its role in salt stress tolerance in plants // Plant Physiol. Biochem. 2018. V. 130. P. 69. https://doi.org/10.1016/j.plaphy.2018.06.035
Wang X., Gao Y., Wang Q., Chen M., Ye X., Li D., Chen X., Li L., Gao D. 24-Epibrassinolide-alleviated drought stress damage influences antioxidant enzymes and autophagy changes in peach (Prunus persicae L.) leaves // Plant Physiol. Biochem. 2019. V. 135 P. 30. https://doi.org/10.1016/j.plaphy.2018.11.026
Sharma I., Ching E., Saini S., Bhardwaj R., Pati P.K. Exogenous application of brassinosteroid offers tolerance to salinity by altering stress responses in rice variety Pusa Basmati-1 // Plant Physiol. Biochem. 2013. V. 69. P. 17. https://doi.org/10.1016/j.plaphy.2013.04.013
Jaarsma R., Vries R.S.M., Boer A.H. Effect of salt stress on growth, Na+ accumulation and proline metabolism in potato (Solanum tuberosum) cultivars // PLoS ONE. 2013. https://doi.org/10.1371/journal.pone.0060183
Kuznetsov Vl.V., Shevyakova N.I. Proline under stress: Biological role, metabolism, and regulation // Russ. J. Plant Physiol. 1999. V. 46. P. 274.
Lisar S.Y.S., Motafakkerazad R., Hossain M.M., Rahman I.M.M. Water stress in plants: Causes, effects and responses // Water Stress / Eds. Rahman I.M.M., Hasegawa H. IntechOpen, 2012. https://doi.org/10.5772/39363
Abdelraheem A., Esmaeili N., O’Connell M., Zhang J. Progress and perspective on drought and salt stress tolerance in cotton // Ind. Crop. Prod. 2019. V. 130. P. 118. https://doi.org/10.1016/j.indcrop.2018.12.070
Gharbi E., Martínez J.P., Benahmed H., Hichri I., Dobrev P.I., Motyka V., Quineta M., Luttsa S. Phytohormone profiling in relation to osmotic adjustment in NaCl-treated plants of the halophyte tomato wild relative species Solanum chilense comparatively to the cultivated glycophyte Solanum lycopersicum // Plant Science. 2017. V. 258. P. 77. https://doi.org/10.1016/j.plantsci.2017.02.006
Tanveer M. Role of 24-Epibrassinolide in inducing thermo-tolerance in plants // J. Plant Growth Regul. 2019. V. 38. P. 945. https://doi.org/10.1007/s00344-018-9904-x
Zivcak M., Olsovska K., Brestic M. Photosynthetic responses under harmful and changing environment: Practical aspects in crop research // Photosynthesis: Structures, Mechanisms, and Applications / Eds. Hou H., Najafpour M., Moore G., Allakhverdiev S. Springer, Cham., 2017. P. 203. https://doi.org/10.1007/978-3-319-48873-8_10
Chutipaijit S., Cha-um S., Sompornpailin K. High contents of proline and anthocyanin increase protective response to salinity in Oryza sativa L. spp. indica // Aust. J. Crop Sci. . 2011. V. 5. P. 1191.
Ahmad P., Jaleel C.A., Salem M.A., Nabi G., Sharma S. Roles of enzymatic and nonenzymatic antioxidants in plants during abiotic stress // Crit. Rev. Biotechnol. 2010. V. 30. P. 161.
Bose J., Rodrigo-Moreno A., Shabala S. ROS homeostasis in halophytes in the context of salinity stress tolerance // J. Exp. Bot. 2014. V. 65. P. 1241. https://doi.org/10.1093/jxb/ert430
Demmig-Adams B., Adams W.W.III. The role of xanthophyll cycle carotenoids in the protection of photosynthesis // Trends Plant Sci. 1996. V. 1. P. 21. https://doi.org/10.1016/S1360-1385(96)80019-7
Ozgur R., Uzilday B., Sekmen A.H., Turkan I. Reactive oxygen species regulation and antioxidant defence in halophytes // Funct. Plant Biol. 2013. V. 40. P. 832. https://doi.org/10.1071/FP12389
Mansour M.M.F., Ali E.F. Evaluation of proline functions in saline conditions // Photochemistry. 2017. V. 140. P. 52. https://doi.org/10.1016/j.drudis.2017.04.016
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений