Физиология растений, 2021, T. 68, № 3, стр. 308-314
Водный потенциал апопласта подустьичной полости листа Suaeda altissima (L.) Pall. при солевом стрессе
П. Ю. Воронин a, *, Н. А. Мясоедов a, Л. А. Халилова a, Ю. В. Балнокин a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: pavel@ippras.ru
Поступила в редакцию 05.09.2020
После доработки 18.10.2020
Принята к публикации 18.10.2020
Аннотация
С помощью метода регистрации водного потенциала апопласта клеток подустьичной полости листа (ψwа), позволяющего измерять на интактном листе одновременно интенсивность фотосинтетического СО2/Н2О газообмена, исследовали у галофита сведы высокой, Suaeda altissima (L.) Pall., в условиях хлоридно-натриевого засоления питательного раствора формирование градиента водного потенциала в системе целого растения, измеряли скорость поглощения CO2 и транспирации, а также содержание ионов Na+ и Cl- в органах. Установлено, что наряду со снижением биологической продуктивности растений, засоление питательного раствора приводит к уменьшению их способности к эквивалентному, по сравнению с Na+, накоплению Cl–; уменьшению градиента водного потенциала между питательным раствором и апопластом клеток подустьичной полости листа за счет повышения ψwа и, соответственно, к уменьшению потока воды из корней в листья и интенсивности СО2/Н2О газообмена листа. Показано, что ключевую роль у S. altissima в регуляции транспорта воды в восходящем направлении в условиях засоления играет падение водного потенциала на границе жидкой и газовой фаз в апопласте подустьичной полости листа, выражаемое величиной ψwа. Мы предполагаем, что наблюдавшееся под действием NaCl возрастание ψwа обусловлено подавлением фотосинтеза, необходимого для биосинтеза осмолитов, а также отражает снижение биологической продуктивности растений и силу стрессорного действия на них NaCl.
ВВЕДЕНИЕ
Почвенное засоление является для растений одним из наиболее вредоносных факторов среды. Более 800 млн га земли и, по крайней мере, 20% площади поливных земель в мире в той или иной степени засолены [1]. Солевой стресс оказывает на растения осмотическое и токсическое действие, приводит к подавлению жизненно важных процессов и физиологических функций (фотосинтеза, минерального питания, роста) и вызывает снижение продуктивности сельскохозяйственных культур. Глобальное потепление и усиление региональной аридизации климата способствует увеличению площади засоленных земель [2]. Поэтому изучение механизмов адаптации и устойчивости растений к засолению традиционно находится в фокусе физиологии растений.
Важную роль в водном обмене растений и устойчивости к солевому и осмотическому стрессам играет формирование градиента водного потенциала в системе почвенный раствор – корень – побег – атмосфера. Значительный вклад в снижение водного потенциала на отдельных этапах транспорта воды играют осмолиты – низкомолекулярные органические соединения, выполняющие как осморегуляторную, так и протекторную по отношению к биополимерам функцию [3]. Эти вещества снижают водный потенциал не только во внутриклеточных компартментах, но также, по-видимому, и в апопласте [4].
Недавно был предложен новый метод измерения водного потенциала апопласта клеток мезофилла в подустьичной полости листа (ψwа) [4]. Этот метод позволяет измерять на интактном листе одновременно с ψwa интенсивность фотосинтетического СО2 газообмена и транспирации. Было показано, что у растений резкое падение водного потенциала происходит на границе водной фазы клеток мезофилла и газовой фазы подустьичной полости листа [4]. Эксперименты, проведенные с использованием этого метода, показали также, что ψwа в условиях солевого стресса и водного дефицита у хвои сосны снижается [5]. На проростках кукурузы были получены данные, позволившие обосновать предположение, что увеличение содержания органических осмолитов в клетках листьев под влиянием водного стресса приводит к снижению ψwа, тогда как уменьшение содержания осмолитов в клетках листьев вызывает повышение этого показателя [6]. Мы предположили, что синтезируемые в клетках осмолиты транспортируются по градиенту концентрации в апопласт, внося вклад в снижение его водного потенциала. Данное исследование продолжает цикл работ, посвященных физиологической роли регуляции ψwа при стрессе. Мы изучали влияние хлоридно-натриевого засоления субстрата выращивания на рост растений, водный потенциал апопласта подустьичной полости листа (ψwа), формирование градиента водного потенциала в системе целого растения и СО2/Н2О-газообмен интактных листьев галофита (Suaeda altissima).
Цель работы – проверка предположения, что в условиях засоления величина ψwа отражает, наряду с биологической продуктивностью, способность сведы высокой противостоять стрессовому воздействию.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Семена сведы высокой, Suaeda altissima (L.) Pall., были собраны с растений, произрастающих на берегу соленого озера Эльтон (Волгоградская обл.). Семена проращивали во влажном песке при комнатной температуре. Через три недели проростки пересаживали в 3‑литровые стеклянные сосуды (4 растения на сосуд) на аэрируемый питательный раствор (ПР) [7]. Растения выращивали в факторостатной камере при 24°С в условиях водной культуры и освещали лампами высокого давления ДHа3 250 Вт (“Reflux”, Россия) с фотопериодом 16/8 ч (день/ночь) при интенсивности света 500 мкмоль/(м2 с). Замену раствора в сосудах проводили каждую неделю в течение первых трех недель. По достижении 42-дневного возраста растений в ПР поэтапно вносили хлористый натрий с инкрементом 50 или 100 мМ до конечных концентраций 0 (контроль), 250 (вариант I) или 750 (вариант II) мМ. Далее растения росли без замены ПР до 60-дневного возраста, после чего были использованы для анализа.
Осмотическое давление растворов определяли криоскопическим методом с помощью осмометра OSMoMaT 030-D-RS (“Gonotec”, Германия) согласно инструкции производителя.
Определение содержания Na+ и Cl– в органах растений. Высушенные при 90°С органы растений измельчали до порошкообразного состояния. Ионы из образцов извлекали кипячением в дистиллированной воде в течение 2 мин, эстракт фильтровали. Концентрацию Na+ в фильтратах определяли с помощью пламенного фотометра ФПА-2-01 (ОАО “ЗОМЗ”, Россия), концентрацию Cl- путем титрования экстрактов ионами ртути согласно ГОСТ Р 4245-72, используя полуавтоматический титратор TopBuret (“Eppendorf”, Германия).
Стационарный фотосинтетический СО2/Н2О-газообмен интактных листьев S. altissima изучали с помощью инфракрасного газоанализатора LI-820 (“Li-Cor”, США) в открытой проточной системе при атмосферной концентрации СО2 и интенсивности ФАР 200 мкмоль/(м2 с) [8]. Для этого неотделенный от растения лист помещали в листовую камеру-прищепку при комнатной температуре и освещали осветителем KL 1500 LCD (“Shott”, Германия) с галогеновой лампой 150 Вт (“Philips”, Нидерланды) через оптоволоконный световод. Лист адаптировали к условиям листовой камеры-прищепки в течение 15–20 мин до достижения стационарного режима фотосинтетического СО2-газообмена. Транспирацию листа рассчитывали на основании разности влажности газа на входе и выходе из листовой камеры. В опорном газовом потоке на входе в листовую камеру поддерживали постоянную влажность при 25°С с помощью увлажнителя LI-610 (“Li-Cor”, США). Для определения влажности воздуха на выходе из листовой камеры использовали психрометрический датчик HMP50 (“Vaisala Intercap”, Финляндия). Питающим газом служил атмосферный воздух, предварительно собранный в 30-литровом полиэтиленовом газгольдере. Расход газа (100 мл/мин) обеспечивал непрерывную работу установки в течение 5 ч. Смесительный узел газового тракта позволял стабильно поддерживать концентрацию СО2 380 ppm в воздушном потоке на входе в листовую камеру.
Определение водного потенциала на границе водной и газовой фаз апопласта на поверхности клеток мезофилла, выстилающих подустьичную полость. Согласно теории общего термодинамического взаимодействия статистической физики [9, с. 274], зависимость равновесного давления водяного пара над поверхностью водного раствора от водного химического потенциала описывается уравнением [10, с. 15]:
(1)
$е = {{e}_{{\text{o}}}}\exp \left( {{{\psi V} \mathord{\left/ {\vphantom {{\psi V} {\left( {RT} \right)}}} \right. \kern-0em} {\left( {RT} \right)}}} \right),$(2)
$\psi = {{\left( {RT{\text{ln}}\left( {{e \mathord{\left/ {\vphantom {e {{{e}_{{\text{o}}}}}}} \right. \kern-0em} {{{e}_{{\text{o}}}}}}} \right)} \right)} \mathord{\left/ {\vphantom {{\left( {RT{\text{ln}}\left( {{e \mathord{\left/ {\vphantom {e {{{e}_{{\text{o}}}}}}} \right. \kern-0em} {{{e}_{{\text{o}}}}}}} \right)} \right)} V}} \right. \kern-0em} V}.$По определению, относительная влажность (RH) представлена уравнением:
(3)
${\text{RH}} = \left( {{e \mathord{\left/ {\vphantom {e {{{e}_{{\text{o}}}}}}} \right. \kern-0em} {{{e}_{{\text{o}}}}}}} \right) \times 100\% ,$Значение влажности воздуха, при которой транспирация прекращается, получали линейной аппроксимацией экспериментально полученной зависимости транспирации от относительной влажности воздуха [4]. Применение уравнений (2) и (3) позволяет рассчитать значение водного потенциала, исходя из экспериментально определенных значений относительной влажности (RH) в подустьичной полости при данной температуре листа.
Статистическая обработка. Все эксперименты проведены в трех биологических повторностях. Представлены средние значения и их стандартные ошибки. Разными латинскими буквами обозначена достоверность различий (двухфакторный анализ ANOVA; Р < 0.05). Одинаковые буквы показывают отсутствие достоверных различий.
РЕЗУЛЬТАТЫ
Исследование роли и регуляции водного потенциала апопласта клеток подустичной полости листа S. altissima в условиях солевого стресса проводили, выращивая растения при концентрациях NaCl в ПР 250 мМ (вариант I) и 750 мМ (вариант II), а также в отсутствие добавленного хлористого натрия (контроль). В последнем случае ПР содержал лишь следовые количества NaCl, поступающие в ПР в виде примеси с другими реагентами.
Рост растений и содержание воды в органах. Хлористый натрий, внесенный в ПР, стимулировал рост растений при концентрации 250 мМ и тормозил его при концентрации 750 мМ. Торможение роста у растений варианта II выражалось более чем в 2-кратном снижении средней сухой биомассы надземных органов в расчете на одно растение, по сравнению с растениями контрольного варианта, и в 5-кратном снижении, по сравнению с растениями варианта I (табл. 1). Различия в сухой биомассе корневой системы между вариантами качественно соответствовали различиям в биомассе надземной части растений, но были выражены еще сильнее. Так, в расчете на одно растение сухая биомасса корней в варианте II была почти в 6 раз меньше, чем у растений варианта I, и в 3 раза меньше, чем у контрольных растений (табл. 1). Содержание воды в корнях во всех вариантах было приблизительно одинаковым и составляло около 90% от общего веса корней (табл. 1). Содержание воды в надземных органах заметно различалось у растений разных вариантов: 78% в контроле, 82% в варианте I и 91% в варианте II.
Таблица 1.
Биомасса листьев (A) и корней (B) S. altissima и содержание в них воды в конце эксперимента (n = 3)
| Вариант | Органы | Сырая масса, г | Сухая масса, г | Содержание воды, % |
|---|---|---|---|---|
| Контроль | Листья (A) | 23.6 ± 2.5 | 5.1 ± 0.5 | 78 |
| Корни (B) | 14.1 ± 1.2 | 1.48 ± 0.2 | 90 | |
| А + B | 37.7 | 6.6 | – | |
| A/B | 1.8 | 3.6 | – | |
| I | Листья (A) | 58.6 ± 3.8 | 10.74 ± 0.6 | 82 |
| Корни (B) | 32.2 ± 2.8 | 2.96 ± 0.18 | 91 | |
| А + B | 90.8 | 13.7 | – | |
| A/B | 1.8 | 3.6 | – | |
| II | Листья (A) | 22.9 ± 2.10 | 2.13 ± 0.12 | 91 |
| Корни (B) | 4.8 ± 0.4 | 0.47 ± 0.10 | 90 | |
| А + B | 27.7 | 2.6 | – | |
| A/B | 4.77 | 4.5 | – |
Содержание Na+ и Cl– в органах. Измерение содержания ионов в органах S. altissima показало, что корни и листья поглощают и накапливают как Na+, так и Cl– при всех наружных концентрациях NaCl в ПР (рис. 1). Даже в контрольном варианте содержание Na+ и Cl– в корнях составило 14 и 46 ммоль/кг в расчете на сырую биомассу (рис. 1а), а в листьях – 79 и 107 ммоль/кг (рис. 1б), соответственно. Содержание ионов в органах было тем больше, чем была выше концентрация Na+Cl– в питательном растворе. При максимальной концентрации NaCl в ПР (вариант II), содержание Na+ и Cl– в корнях составило 478 и 605 ммоль/кг (рис. 1а), а в листьях – 797 и 535 ммоль/кг (рис. 1б), соответственно. Таким образом, по мере увеличения концентрации NaCl в ПР количество поглощенных ионов и Na+, и Cl– возрастало как в корнях, так и в листьях. Данные, представленные на рис. 1, демонстрируют также различие в поглощении растениями катиона Na+ и аниона Cl–. При равных исходных концентрациях Na+ и Cl– в ПР корни S. altissima во всех вариантах опыта содержали заметно больше Cl–, чем Na+ (рис. 1а). Листья, наоборот, содержали больше Na+, чем Cl– (кроме растений контрольного варианта) (рис. 1б). Суммарное содержание Na+ в корнях и листьях преобладало над суммарным содержанием Cl–. Наиболее вероятным претендентом на роль веществ, компенсирующих избыточные положительные заряды ионов натрия в листьях, являются анионы органической природы. По данным, представленным в табл. 1 и на рис. 1а, б, была рассчитана поглотительная способность корней и листьев S. altissima по отношению к ионам в расчете на одно растение (рис. 1в, г). Растения поглощали максимальное количество Na+ и Cl– при оптимальной для роста концентрации NaCl в ПР (250 мМ). При высокой концентрации NaCl (750 мМ) количество поглощенных ионов в расчете на одно растение были более низким, чем при 250 мМ NaCl, хотя в расчете на единицу сырой биомассы соленакопление возрастало по мере увеличения наружной концентрации соли и было максимальным при 750 мМ NaCl в ПР (рис. 1а, б), свидетельствуя о том, что лимитирующим фактором соленакопления при солевом стрессе являлось снижение скорости роста растений, т.е. снижение биомассы корней и листьев.
Рис. 1.
Содержание ионов Na+ (1) и Cl– (2) в корнях (а, в) и листьях (б, г) S. altissima при разных концентрациях NaCl в питательном растворе. а, б – в расчете на кг сырой биомассы; в, г – в расчете на одно растение. Разными буквами обозначены достоверно отличающиеся величины.

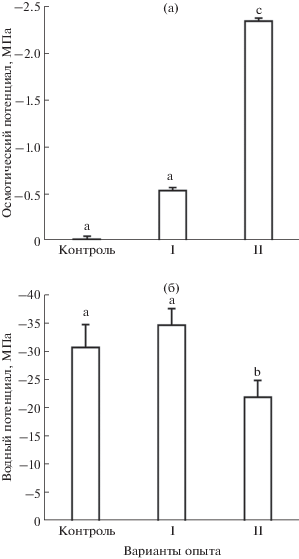
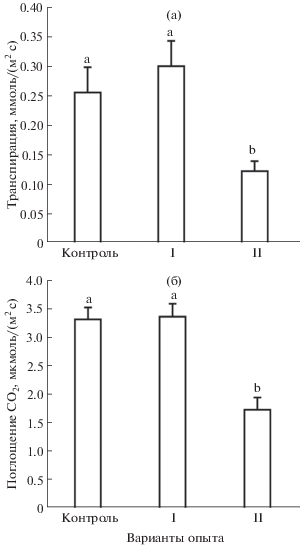
Градиент водного потенциала в системе целого растения и фотосинтетический СО2/Н2О газообмен листьев S. altissima. Движение воды из почвы в корень и далее в надземные органы осуществляется по градиенту водного потенциала [12, с. 81–139]. Для того, чтобы оценить значения градиентов водного потенциала в системе целого растения S. altissima, мы измеряли водный (осмотический) потенциал ПР и водный потенциал подустьичной полости листьев растений (ψwa) в конце эксперимента, т.е. после 60-дневного культивирования растений(рис. 2а, б). Значения водного (осмотического) потенциала ПР разных вариантов опыта существенно различались (рис. 2а). Различия были обусловлены как внесением в питательные растворы NaCl в разных концентрациях, так и разной интенсивностью поглощения ионов растениями в процессе роста. Существенно более низкие значения водного потенциала ПР вариантов I и II, чем в контроле, объясняются внесением в них NaCl в высоких концентрациях. Наименьший осмотический потенциал, равный –2.34 МПа, был обнаружен в ПР варианта II. В ПР варианта I осмотический потенциал составил –0.54 МПа, т.е. в 4 раза больше, чем в варианте II. Осмотический потенциал ПР в контрольном варианте составлял –0.026 МПа, что в 100 раз больше чем в варианте II. Следует, однако, подчеркнуть, что различия между водными потенциалами питательных растворов разных вариантов опыта (рис. 2а) не оказали заметного влияния на их градиенты в системе ПР – корень – надземные органы, т. к. подавляющий вклад в формирование этого градиента обеспечивался снижением водного потенциала апопласта в подустьичной полости листа (ψwa) (рис. 2б). Даже самый низкий водный (осмотический) потенциал ПР в варианте II был почти в 10 раз больше водного потенциала апопласта подустьичной полости листьев растений S. altissima этого варианта (–22 МПа). У контрольных растений и растений варианта I превышение водного (осмотического) потенциала питательного раствора над водным потенциалом апопласта клеток в подустьичной полости листа (ψwa) было выражено еще сильнее (рис. 2а, б). Таким образом, именно существенно более низкий по сравнению с осмотическим (водным) потенциалом питательного раствора водный потенциал апопласта подустьичной полости листьев обеспечивал физическую возможность передвижения воды по ксилеме от корней в листья растений во всех вариантах опыта. Инструментально реализацию этой физической возможности регистрировали измерением скорости транспирации листьев (рис. 3а). В варианте II (наибольшее засоление ПР) скорость транспирации была приблизительно вдвое ниже, чем в контрольном варианте или варианте I. Скорость фотосинтетического поглощения СО2 листьями различных вариантов опыта коррелировала со скоростью транспирации листьев (рис. 3б). Значения скоростей СО2/Н2О газообмена листьев растений варианта I не отличались от таковых контрольных растений. Однако скорости СО2/Н2О газообмена листьев растений варианта II были вдвое ниже соответствующих параметров контрольного варианта (рис. 3).
ОБСУЖДЕНИЕ
Для передвижения воды из корней в надземные органы должен поддерживаться градиент водного потенциала в направлении от корня к побегу. Более высокое содержание веществ в надземных органах, чем в корнях, вносит вклад в поддержание такого градиента. Содержание ионов Na+ и Cl– в органах S. altissima было тем выше, чем была выше концентрация NaCl в питательном растворе. При этом содержание Na+ в листьях поддерживалось на более высоком уровне, чем в корнях, что отвечает условию движения воды в восходящем направлении. Однако концентрационный градиент Cl– у S. altissima в условиях засоления имел противоположную направленность, т.е. в листьях содержание ионов Cl– было заметно ниже, чем в корнях. Учитывая более высокое осмотическое давление (осмолярность) в листьях S. altissima, чем в корнях [11], и принимая во внимание электронейтральность внутриклеточных растворов [12, с. 81–139], можно принять, что недостаток ионов Cl– в органах клетки компенсируют органическими анионами. Последние не только поддерживают электронейтральность внутриклеточных растворов при более интенсивном поглощении клетками Na+, по сравнению с Cl–, но вносят также вклад в поддержание градиента осмотического потенциала и, следовательно, градиента водного потенциала между корнем и надземными органами. Увеличение концентрации NaCl в питательном растворе сопровождалось не только усилением соленакопления в корнях и листьях в расчете на единицу сырой биомассы (рис. 1), но и заметным торможением прироста биомассы (табл. 1).
К концу эксперимента водные (осмотические) потенциалы питательных растворов разных вариантов опыта заметно различались (рис. 2а). Водный потенциал апопласта листьев растений (ψwа) в варианте с наибольшим засолением (II) был приблизительно на треть больше, чем водный потенциал апопласта листьев в контроле и в варианте I (рис. 2б). Вследствие этого градиент водного потенциала между питательным раствором и апопластом листьев в подустьичной полости (движущая сила транспорта воды в восходящем направлении) в варианте II был заметно меньше, чем в контроле и варианте I. Этому соответствовала более низкая скорость транспирации и фотосинтетической ассимиляции CO2 у растений S. altissima варианта II (рис. 3а) по сравнению с контролем и вариантом I (рис. 3б). Поток воды равен произведению градиента водного потенциала и водной проводимости [12, с. 81–139]. Совпадение соотношений фотосинтетического СО2 газообмена, транспирации листьев и градиентов водного потенциала в разных вариантах опыта позволяет сделать вывод об устьичном лимитировании водного потока через листья и в целом о нарушении водоснабжения растений S. altissima в условиях засоления. Можно предположить, что снижение потока воды в растении при солевом стрессе приводит к нарушению донорно-акцепторных отношений, в первую очередь, между корневой и надземной частями растения. Согласно имеющимся в литературе данным [13], в общем случае нельзя исключать возможность неустьичного лимитирования СО2-газообмена на свету. Однако в условиях данного опыта с точностью измерений соответствие снижения СО2-газообмена на свету снижению транспирации листа (рис. 3) позволяет пренебречь вкладом темнового дыхания в устьичное лимитирование СО2/Н2О-газообмена.
Осмолитами, вносящими вклад в снижение ψwа, как было показано ранее, могут быть такие продукты фотосинтеза, как восстанавливающие сахара [3]. Однако более низкое содержание Cl–, по сравнению с Na+, в листьях растений S. altissima указывает на биосинтез органических анионов, компенсирующих избыток положительных зарядов ионов натрия. Органические анионы, по-видимому, также вносят вклад в поддержание градиента водного потенциала в системе целого растения у S. altissima.
Судя по данным СО2 газообмена, фотосинтез листьев растений варианта с наибольшим засолением питательного раствора (II) был в 2 раза ниже, чем в контроле и в варианте I (рис. 3б). Такое понижение скорости фотосинтеза в варианте II должно приводить к заметно меньшему, по сравнению с двумя другими вариантами опыта, образованию органических осмолитов и к смещению вследствие этого водного потенциала апопласта в подустьичной полости (ψwа) к более высоким значениям. В соответствии с этим измеренное значение ψwа в варианте II было приблизительно на треть больше, чем в контроле и в варианте I (рис. 2б). Таким образом, несмотря на накопление соли клетками, приводящее к понижению их водного потенциала, движущая сила поступления воды в растения S. altissima в условиях засоления снижается за счет торможения фотосинтетического газообмена и снижения внутриклеточного содержания органических осмолитов (рис. 2б, 3)). В результате устьичного лимитирования транспорта воды из корней в листья, ограничения фотосинтетического СО2 газообмена и снижения ассимиляционной способности растений происходит замедление нарастания фитомассы (табл. 1). Полученные результаты показывают, что значение водного потенциала апопласта подустьичной полости листьев ψwа, наряду с биопродуктивностью, отражает силу стрессового воздействия засоления на галофит S. altissima. Остается открытым вопрос, какой механизм лежит в основе понижения водного потенциала апопласта подустьичной полости листьев. Как показано в нашей предыдущей работе [4], резкое снижение водного потенциала в апопласте листьев на границе водной и газовой фаз свойственно не только галофитам, но и гликофитам, т.е. носит универсальный характер. Возможно, ключ к пониманию механизма этого снижения кроется в комбинации капиллярных сил, развиваемых в апопласте, в сочетании с понижением осмотического потенциала апопласта за счет переноса органических осмолитов из клеток в капилляры клеточной стенки.
Работа поддержана за счет средств темы государственного задания АААА-А19-119041690035-9.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
FAO. FAO Land and Plant Nutrition Management Service. 2008. http://www.fao.org/ag/agI/agII/spush3
Munns R., Tester M. Mechanisms of salinity tolerance // Annu. Rev. Plant Biol. 2008. V. 59. P. 651. https://doi.org/10.1146/annurev.arplant.59.032607.092911
Ahmad P., Sharma S. Salt stress and phyto-biochemical responses of plants // Plant Soil Environ. 2008. V. 54. P. 89.
Voronin P.Yu., Rakhmankulova Z.F., Shuyskaya E.V., Maevskaya S.N., Nikolaeva M.K., Maksimov A.P., Maximov T.Chr., Myasoedov N.A., Balnokin Yu.V., Rymar V.P., Valdayskih V.V., Kuznetsov Vl.V. New method for quantitative determination of water potential of mesophyll cells’ apoplast in substomatal cavity of the leaf // Russ. J. Plant Physiol. 2017. V. 64. P. 452. https://doi.org/10.1134/S1021443717020133
Voronin P.Yu., Rakhmankulova Z.F., Tarnopolskaya E.E., Kuznetsov Vl.V. Closure of stomata in water-stressed pine needles results from the decreased water potential of the mesophyll apoplast in the substomatal cavity // Russ. J. Plant Physiol. 2018. V. 65. P. 518. https://doi.org/10.1134/S1021443718030081
Voronin P.Yu., Maevskaya S.N., Nikolaeva M.K. Physiological and molecular responses of maize (Zea mays L.) plants to drought and rehydration // Photosynthetica. 2019. V. 57. P. 850. https://doi.org/10.32615/ps.2019.101
Robinson S.R., Downton W.J.S. Potassium, sodium and chlorid ion concentration in leaves and isolated chloroplasts of the halophyte Suaeda australis R. Br. // Aust. J. Plant Physiol. 1985. V. 12. P. 471.
Voronin P.Yu. Experimental installation for measurements of chlorophyll fluorescence, CO2 exchange, and transpiration of a detached leaf of a detached leaf // Russ. J. Plant Physiol. 2014. V. 61. P. 269. https://doi.org/10.1134/S1021443714020174
Рейф Ф. Статистическая физика: Учеб. руковод. Пер. с англ. / Под ред. А.И. Шальникова и А.О. Вайсенберга. 3-е изд., испр. М.: Наука, 1986. 336 с.
Лайск А.Х. Кинетика фотосинтеза и фотодыхания С3-растений. М.: Наука, 1977. 194 с.
Balnokin Yu.V., Kotov A.A., Myasoedov N.A., Khailova G.F., Kurkova E.B., Lun’kov R.V., Kotova L.M. Involvement of long-distance Na+ transport in maintaining water potential gradient in the medium-root-leaf system of a halophyte Suaeda altissima // Russ. J. Plant Physiol. 2005. V. 52. P. 489.
Nobel P.S. Physicochemical and environmental plant Physiology. San Diego, London, Boston, New York, Sydney, Tokyo, Toronto: Academic Press, 1999. 540 p.
Pan T., Liu M., Kreslavski V.D., Sergey K., Zharmukhamedov S.K., Nie Ch.,Yu M., Kuznetsov Vl.V., Allakhverdiev S.I., Shabala S. Non-stomatal limitation of photosynthesis by soil salinity // Crit. Rev. Environ. Sci. Technol. 2020. V. 50. https://doi.org/10.1080/10643389.2020.1735231
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений