Физиология растений, 2021, T. 68, № 3, стр. 279-288
Действие стрессовых фитогормонов на метаболизм стеринов Triticum aestivum L.
А. Г. Ренкова a, *, В. Р. Хабибрахманова b, Ю. Н. Валитова a, Ф. К. Мухитова a, Ф. В. Минибаева a, c
a Казанский институт биохимии и биофизики – обособленное структурное подразделение
Федерального исследовательского центра “Казанский научный центр Российской академии наук”
Казань, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
“Казанский национальный исследовательский технологический университет”
Казань, Россия
c Федеральное государственное автономное образовательное учреждение высшего образования
“Казанский (Приволжский) федеральный университет”
Казань, Россия
* E-mail: renkova@kibb.knc.ru
Поступила в редакцию 22.06.2020
После доработки 21.07.2020
Принята к публикации 21.07.2020
Аннотация
Проблема стрессовой устойчивости сельскохозяйственных растений традиционно находится в фокусе пристального внимания исследователей. Как известно, яровая пшеница проявляет высокую чувствительность к действию различных стрессовых факторов. Важную роль в формировании стрессовой устойчивости растений играют вторичные метаболиты. В настоящей работе методами тонкослойной хроматографии и хромато-масс-спектрометрии комплексно изучены состав и особенности изменения содержания тритерпенов и стеринов в корнях и листьях проростков пшеницы Triticum aestivum L. при действии стрессовых фитогормонов – абсцизовой кислоты, метилжасмоната и салициловой кислоты. Выявлены значительные изменения тритерпенового и стеринового компонентов пшеницы, а также уровня транскриптов ключевых генов стеринового биосинтеза. Обнаружено, что листья и корни проростков пшеницы проявляют различную чувствительность к действию фитогормонов. Полученные данные способствуют расшифровке роли мембранных стеринов в стрессовых ответах растений.
ВВЕДЕНИЕ
Проблема стрессовой устойчивости сельскохозяйственных растений – предмет пристального внимания исследователей в течение многих лет. Как известно, одна из важнейших сельскохозяйственных культур, пшеница, проявляет высокую чувствительность к действию различных стрессовых факторов. В связи с этим актуально выявление эндогенных механизмов защиты растений пшеницы с целью направленного повышения их устойчивости к действию неблагоприятных факторов окружающей среды. Важную роль в формировании стрессовой устойчивости растений играют вторичные метаболиты, в том числе изопреноиды, фенолы, необычные жирные кислоты и другие соединения. К одной из самых многообразных и многочисленных групп вторичных метаболитов растений относятся изопреноиды. В эту группу входят тритерпены (C30) и стерины (C18–C29) – структурно разнообразные молекулы, которые, по большей части, недоступны химическому синтезу [1]. В растениях эти соединения синтезируются по мевалонатному пути из сквалена (рис. 1). В ходе биохимических превращений сначала образуются тритерпены – циклоартенол и ланостерин, из которых далее синтезируются различные стерины, такие как β-ситостерин, стигмастерин, кампестерин и холестерин [2]. Стерины являются важным структурным элементом биологических мембран, а также предшественниками растительных гормонов брассиностероидов, регулирующих рост и развитие растений [3]. В отличие от животных и грибов, где преобладает один стерин (холестерин и эргостерин соответственно), растения характеризуются сложным стериновым составом. В частности, стериновый профиль растений Arabidopsis thaliana включает в себя β-ситостерин в качестве основного соединения (64%), а также 24-метилхолестерин (11%), стигмастерин (6%), изофукостерин (3%) и брассикастерин (2%) и несколько других минорных стеринов [4]. Мевалонатный путь биосинтеза стеринов представляет собой последовательность более чем 30 ферментативно-катализируемых реакций, протекающих в мембранах (рис. 1) [2]. Ключевыми ферментами биосинтеза растительных стеринов, определяющих соотношение их молекулярных видов, являются С24-стерин метилтрансфераза 1 (SMT1), С24-стерин метилтрансфераза 2 (SMT2) и С22-стерин десатураза (CYP710A) [4–6].
Рис. 1.
Схема пути биосинтеза стеринов у растений. HMGR – 3-гидрокси-3-метилглютарил-КоА редуктаза; SQE1 – сквален эпоксидаза; CAS1 – циклоартенол синтаза; LAS1 – ланостерин синтаза; SMT1/2 – C24-cтерин метилтрансфераза; DIM/DWF1 – стерин-Δ24-изомераза/редуктаза; CYP710A – С22-стерин десатураза. Пунктирные стрелки обозначают несколько ферментативных реакций. Прямоугольником показаны метаболиты, которые количественно были определены в этом исследовании. Овалом выделены ферменты, анализ генов которых проводился в данном исследовании.
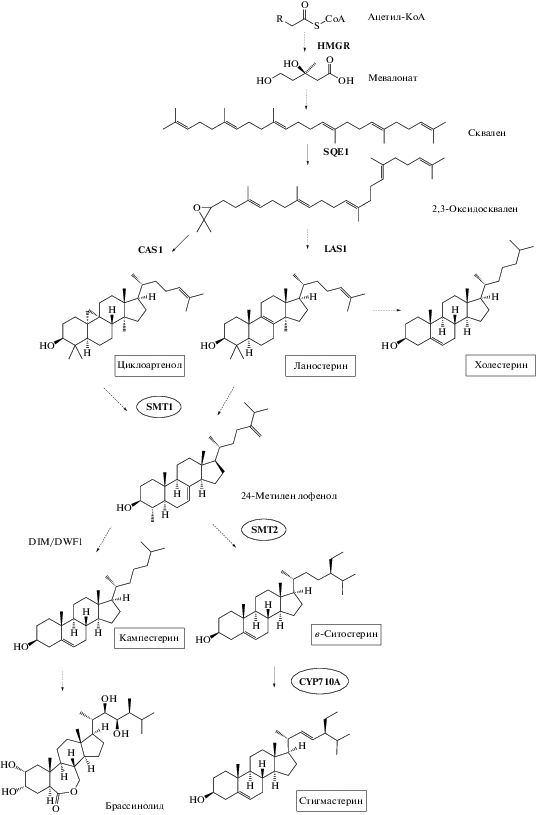
С24-стерин метилтрансфераза катализирует перенос метильной группы от S-аденозил-L-метионина на субстрат с образованием метил-/этилстеринов. Выделяют два фермента SMT, катализирующих первичное и вторичное метилирование, соответственно, SMT1 и SMT2. Предполагают, что С24-метилирование является ключевым регулятором биосинтеза стеринов, от которого зависит получение конечного продукта. C22-стерин десатураза, или CYP710A, относится к подсемейству растительных белков цитохрома P450, семейства 710А, катализирует реакцию десатурации, в результате которой происходит образование стигмастерина из β-ситостерина. Показано, что данная реакция является важной точкой, координирующей соотношение β-ситостерина и стигмастерина, значительные изменения которого происходят в стрессовых условиях [5, 7, 8].
В настоящее время становится ясно, что наряду со структурной функцией, стерины играют роль в регуляции внутриклеточных процессов. При действии различных стрессовых факторов меняется соотношение молекулярных видов стеринов и их общее содержание, происходит изменение содержания специфических вторичных метаболитов, в том числе тритерпенового ряда, и активности стресс-индуцируемых генов. Необходимым этапом при формировании ответной реакции растения на действие биотических и абиотических стрессовых факторов является выработка растительными клетками фитогормонов, таких как абсцизовая кислота (АБК), метилжасмонаты (МеЖ) и салициловая кислота (СК). Например, известно, что содержание АБК увеличивается при солевом стрессе и засухе, а МеЖ и СК при раневом стрессе и атаке патогенов [9, 10]. Кроме того, фитогормоны могут регулировать экспрессию многих генов, имеющих индуцируемые фитогормонами цис-регуляторные элементы в промоторах [11]. К сожалению, роль фитогормонов в регуляции биосинтеза тритерпенов и стеринов в клетках растений в условиях стресса остается малоизученной.
Цель работы – анализ качественных и количественных изменений содержания тритерпенов и стеринов, а также уровня транскриптов ключевых генов ферментов биосинтеза стеринов в корнях и листьях проростков яровой пшеницы при действии фитогормонов АБК, МеЖ и СК.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. В качестве объекта исследований использовали проростки яровой пшеницы (Triticum aestivum L.) сорта “Казанская юбилейная”. Растения выращивали на 0.25 мМ СаCl2 при температуре +22 ± 1° С и освещенности 100 Вт/м2 с 12 ч фотопериодом в течение 4 суток. Затем растения перемещали в растворы фитогормонов АБК, МеЖ и СК в концентрациях 100 мкM в течение 12 ч. Фитогормоны растворяли в 0.25 мМ СаCl2.
Определение содержания тритерпенов и стеринов. Образцы пшеницы экстрагировали смесью изопропанола и хлороформа. Для разделения и идентификации липидных соединений в полученных экстрактах использовали метод ТСХ. Исследование осуществляли на лабораторном комплексе для высокоэффективной тонкослойной хроматографии (“СAMAG”, Швейцария). В состав комплекса входят приборы: Linomat 5 для автоматического нанесения образцов на ТСХ пластину, ADS 2 для элюирования ТСХ пластины в системе растворителей, TLS Scanner 3 для денситометрической обработки ТСХ пластин. Работа комплекса и обработка полученных результатов осуществлялась с помощью специализированной компьютерной программы winCATS, версия 1.4.9. Для количественного определения в образцах тритерпенов и стеринов использовали калибровочные графики по стандартам – циклоартенолу (08172, “Sigma-Aldrich”, США) и β-ситостерину (132720050, “Acros Organics”, Бельгия).
Идентификация молекулярных видов стеринов. Состав стеринов анализировали с помощью газовой хроматографии в сочетании с масс-спектроскопией (ГХ–МС) (GC-17A/MS-QP5050, “Shimadzu”, Япония). Выделенные стерины предварительно подвергали силилированию. Идентификацию стеринов проводили путем сравнения их времен удержания с достоверными стандартами масс-спектрометрии с использованием масс-спектрометрической библиотеки данных ГХ–МС [12]. Количественную обработку осуществляли с использованием специализированной компьютерной программы UNICHROM (http://www.unichrom.com).
Анализ экспрессии генов. Относительный уровень транскриптов генов С24-стерин метилтрансфераз и С22-стерин десатураз определяли методом ПЦР в реальном времени (ПЦР–РВ). Для этого были подобраны ген-специфичные праймеры с использованием Universal ProbeLibrary Assay Design Centre (http://lifescience.roche.com/shop/en/ global/overviews/brand/universal-probe-library) и проведены эксперименты по оптимизации реакции при различной температуре и концентрации праймеров. Праймеры синтезировали в ЗАО “Евроген” (Россия). Нуклеотидные последовательности праймеров представлены в таблице S1 (Supplementary). Тотальную РНК пшеницы выделяли с помощью набора RNeasy Plant Mini Kit (“Qiagen”, Германия), согласно протоколу производителя. Реакцию обратной транскрипции проводили в амплификаторе С1000 TouchTM Thermal Cycler (“Bio-Rad”, США) с использованием набора MMLV RT Kit (“Евроген”, Россия). ПЦР–РВ проводили с использованием готовой реакционной смеси qPCRmix-HS SYBR (“Евроген”, Россия) при следующих условиях: 95°C – 5 мин, 40 циклов амплификации (95°C – 15 сек, 55/60°C – 10 сек, 72°С – 30 сек), 55/60°C – 0.5 сек, 95°С – 5 сек. Количество целевых транскриптов оценивали относительно стабильно экспрессирующихся транскриптов референсных генов, в качестве которых были использованы гены фактора АДФ-рибозилирования (TaARF), ингибитора РНКазы L-подобного белка (TaRLI) и белка контроля клеточного деления (TaCDC) [13]. Амплификацию и флуоресцентный мониторинг проводили с использованием системы детекции ПЦР–РВ CFX96 (“Bio-Rad”, США). Расчеты относительного содержания транскриптов были выполнены с использованием сравнительного ΔCT метода [14]. Нуклеотидные последовательности исследуемых генов определяли с помощью ДНК-анализатора ABI 3130 Genetic Analyser (“Applied Biosystems”, США) [6].
Статистический анализ. Все опыты проводили как минимум в трех биологических и четырех аналитических повторностях. В таблицах и на рисунках данные представлены в виде среднеарифметических значений и их стандартных отклонений. Статистическую обработку результатов осуществляли с использованием t-критерия Стьюдента в Microsoft Excel 2013.
РЕЗУЛЬТАТЫ
Количественное определение тритерпенов и стеринов в корнях и листьях проростков пшеницы
Анализ тритерпенов и стеринов в растениях контрольного варианта показал, что их содержание было значительно выше в листьях, чем в корнях, почти в 10 и 2 раза, соответственно (табл. 1). При действии фитогормонов наблюдались изменения в содержании тритерпенов и стеринов в корнях и листьях проростков пшеницы. Воздействие АБК приводило к активации синтеза тритерпенов и стеринов в корнях и листьях. Содержание тритерпенов в исследуемых объектах увеличивалось в 2 раза по сравнению с контролем. В отличие от корней, в листьях проростков наблюдалось значительное возрастание (более чем в 1.5 раза) содержания стеринов в присутствии АБК (табл. 1). Действие МеЖ индуцировало обратно направленные изменения как в содержании тритерпенов, так и в содержании стеринов. Содержание тритерпенов в корнях увеличивалось, тогда как в листьях мы наблюдали незначительное уменьшение. Содержание стеринов, наоборот, уменьшалось в корнях и увеличивалось почти в 2 раза в листьях (табл. 1). Действие СК вызывало снижение содержания тритерпенов и стеринов в корнях проростков, тогда как в листьях их количество значительно возрастало (табл. 1).
Таблица 1.
Содержание тритерпенов и стеринов в корнях и листьях проростков пшеницы при действии фитогормонов
| Воздействие | Содержание, мкг/г сырой массы | |||
|---|---|---|---|---|
| тритерпены | стерины | |||
| корни | листья | корни | листья | |
| Контроль | 28.39 ± 1.15 | 261.71 ± 4.41 | 150.93 ± 1.18 | 305.89 ± 5.41 |
| АБК | 50.99 ± 1.77 | 544.20 ± 3.14 | 160.54 ± 0.72 | 492.09 ± 2.70 |
| МеЖ | 47.79 ± 0.99 | 213.62 ± 8.26 | 114.87 ± 1.13 | 576.49 ± 2.29 |
| СК | 14.45 ± 1.18 | 607.52 ± 10.8 | 117.69 ± 2.37 | 445.37 ± 4.13 |
Качественный состав стеринов и их количество определили методом ГХ–МС. В корнях и в листьях пшеницы были обнаружены основные молекулярные виды стеринов – β-ситостерин, стигмастерин, кампестерин и холестерин (рис. 2). Установлено, что при действии фитогормонов происходили изменения в содержании стеринов в корнях и листьях пшеницы. На рисунке 2 приведены данные расчета содержания идентифицированных стеринов в процентном соотношении. Значительные изменения в составе стеринов были выявлены при действии АБК на проростки пшеницы, наблюдалось увеличение содержания стигмастерина практически в 2 раза как в корнях, так и в листьях (рис. 2). Стоит отметить, что в листьях увеличение стигмастерина сопровождалось значительным уменьшением содержания β-ситостерина (рис. 2б). При действии МеЖ в листьях происходило увеличение доли холестерина, соотношение других видов стеринов практически не менялось по сравнению с контролем. При действии СК мы также наблюдали увеличение содержания стигмастерина как в корнях, так и в листьях проростков пшеницы (рис. 2).
Рис. 2.
Содержание молекулярных видов стеринов в корнях (а) и листьях (б) пшеницы при действии фитогормонов в процентном соотношении от общего количества стеринов. Последовательность распределения стеринов в гистограмме снизу вверх: β-ситостерин, стигмастерин, кампестерин, холестерин. Представлены данные среднеарифметических значений из трех независимых повторностей. Относительное стандартное отклонение среднего не превышало 5%.

Отличительной структурной особенностью основных растительных стеринов, по сравнению с холестерином, является наличие метильных или этильных групп при 24 атоме углерода боковой цепи [2]. По этому признаку растительные стерины делят на 24-метил- и этилстерины. Кампестерин содержит только одну метильную группу при С24, а β-ситостерин и стигмастерин характеризуются наличием этильной группы при С24. В настоящее время известно, что соотношение количества 24‑метил-/этилстеринов является важным показателем метаболизма растений, а его регуляция – ключевым звеном многих процессов роста, развития, а также стрессовых ответов растений [15].
Анализ изменений в соотношении 24-метил-/ этилстеринов в корнях и листьях проростков пшеницы при действии фитогормонов показал, что в растениях контрольного варианта соотношение содержания 24-метилстеринов к 24-этилстеринам в листьях было ниже, чем в корнях (табл. 2). При действии АБК в корнях соотношение количества 24-метил-/этилстеринов не менялось, тогда как в листьях увеличивался показатель соотношения, что говорит об увеличении доли относительного содержания кампестерина. При действии МеЖ незначительно увеличивалась доля метилстеринов в корнях, тогда как в листьях она оставалась прежней. При действии СК соотношение количества 24-метил-/этилстеринов в корнях также оставалось неизменным, тогда как в листьях наблюдалось уменьшение соотношения 24-метил-/этилстеринов вследствие увеличения относительной доли 24-этилстеринов – β-ситостерина и стигмастерина (табл. 2).
Таблица 2.
Соотношение 24-метил-/этилстеринов в корнях и листьях проростков пшеницы при действии фитогормонов
| Контроль | АБК | МеЖ | СК | |
|---|---|---|---|---|
| Корни | 0.43 ± 0.07 | 0.41 ± 0.04 | 0.50 ± 0.08 | 0.43 ± 0.01 |
| Листья | 0.35 ± 0.02 | 0.60 ± 0.07 | 0.37 ± 0.01 | 0.32 ± 0.01 |
Можно полагать, что изменения содержания тритерпенов и стеринов при действии фитогормонов обусловлены также изменениями на генном уровне. В связи с этим, нами был проведен анализ уровня транскриптов генов, контролирующих биосинтез стеринов.
Экспрессия генов биосинтеза стеринов при действии фитогормонов
Известно, что мягкая пшеница (T. aestivum) обладает одним из сложнейших геномов, встречаемых у растений. Аллогексаплоидный геном пшеницы (2n = 6x = 42, AAВВDD) образован в ходе естественной гибридизации трех геномов. В связи с этим многие гены у данного злака представлены в трех гомеологичных копиях. Нуклеотидные последовательности генов TaSMT1 были ранее нами клонированы и секвенированы [6], нуклеотидные последовательности генов TaSMT2 и TaCYP710A8 были взяты из статьи Tang с соавт. [16]. Кроме того, ранее нами было проведено секвенирование промоторных областей генов TaSMT1-5A/-4B/-4D и их анализ на наличие консервативных сайтов, а также стресс-чувствительных цис-элементов [6].
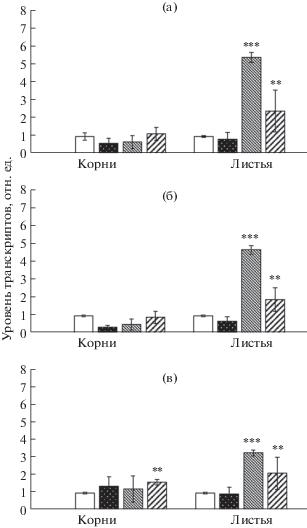
Так, относительное содержание транскриптов генов TaSMT1-5A, TaSMT1-4D и TaSMT2 при действии всех фитогормонов практически не изменялось в корнях проростков пшеницы, лишь незначительное повышение уровня транскриптов гена TaSMT2 мы наблюдали при действии СК (рис. 3в). В листьях так же, как и в корнях, действие АБК не вызывало изменений в уровне транскриптов генов TaSMT1 и TaSMT2 (рис. 3). Напротив, в листьях при действии МеЖ уровень транскриптов генов TaSMT1-5A и TaSMT1-4D увеличивался в 5 раз, а TaSMT2 в 3 раза. Влияние СК также повышало уровень транскриптов генов TaSMT1 и TaSMT2 примерно в 2 раза (рис. 3).
Рис. 3.
Влияние фитогормонов на уровень транскриптов генов TaSMT1-5A (а) и TaSMT1-4D (б) и TaSMT2 (в) в корнях и листьях пшеницы. Варианты воздействий (слева направо): контроль, АБК, МеЖ, СК. Уровень транскриптов контрольных вариантов принят за единицу. Различия достоверны при * P ≤ 0.05, ** P ≤ 0.01 и *** P ≤ 0.001.
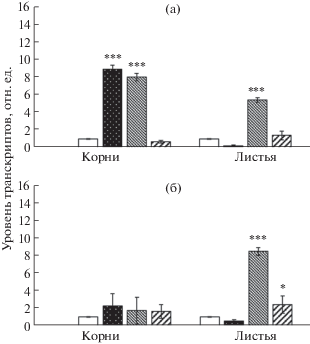
Анализ генов CYP710A8 показал, что при действии АБК в корнях наблюдалось 10-кратное увеличение относительного содержания транскриптов гена TaCYP710A8-3А, а уровень транскриптов TaCYP710A8-3B/3D повышался незначительно (рис. 4). В листьях, напротив, изменения уровня транскриптов генов TaCYP710A8 не происходило. Действие МеЖ также индуцировало повышение уровня транскриптов гена TaCYP710A8-3А в корнях в 8 раз, а в листьях в 6 раз (рис. 4а). Относительное содержание транскриптов другого гена, TaCYP710A8-3B/3D, в корнях практически оставалось на уровне контроля, а в листьях значительно повышалось (в 8 раз) (рис. 4б). Действие СК индуцировало только повышение уровня транскриптов генов TaCYP710A8-3B/3D примерно в 3 раза в листьях (рис. 4б) и не приводило к значительным изменениям уровня транскриптов генов TaCYP710A8 в корнях проростков пшеницы (рис. 4).
Рис. 4.
Влияние фитогормонов на уровень транскриптов генов TaCYP710A8-3А (а) и CYP710A8-3B/3D (б) в корнях и листьях пшеницы. Варианты воздействий (слева направо): контроль, АБК, МеЖ, СК. Уровень транскриптов контрольных вариантов принят за единицу. Различия достоверны при * P ≤ 0.05, ** P ≤ 0.01 и *** P ≤ 0.001.
ОБСУЖДЕНИЕ
Растения обладают богатым стериновым составом, что определяет их вовлечение в разнообразные процессы жизнедеятельности растения, в том числе, в их ответы на стрессовые факторы. Стерины являются важными компонентами клеточных мембран, а также предшественниками гормонов брассиностероидов, участвующих в регуляции роста растений. Тритерпены – вторичные метаболиты, участвующие, в том числе, в защитных реакциях растений. Путь биосинтеза стеринов при стрессе может претерпевать различные изменения, приводя к накоплению промежуточных соединений, которые могут способствовать адаптации растений к воздействиям неблагоприятных факторов окружающей среды. Циклоартенол и ланостерин являются тритерпенами и представляют собой промежуточные продукты биосинтеза стеринов. Их накопление может привести к активации генов ферментов биосинтеза стеринов и, соответственно, к увеличению их содержания. Результаты наших экспериментов показали, что листья и корни проростков пшеницы проявляют различную чувствительность к действию стрессовых фитогормонов.
АБК контролирует в растениях множество жизненно важных процессов, таких как регуляция покоя семян и почек, ранние этапы онтогенеза, закрывание устьиц, ответные реакции растений на стрессовые воздействия – засуху, засоление, пониженную температуру [9]. Показано, что растительные стерины предотвращают вызванное AБК нарушение искусственных бислоев фосфатидилхолин/фосфатидилэтаноламин. Влияние АБК на мембраны в равной степени ингибируется растительными стеринами и холестерином, что может свидетельствовать об участии растительных стеринов в контроле негативного действия АБК на мембраны [17]. Экзогенное действие АБК на растения Cannabis sativa L. индуцировало накопление вторичных метаболитов, таких как α-токоферол и тетрагидроканнабинол, и значительно снижало содержание хлорофилла, каротиноидов, сквалена, стигмастерина, β-ситостерина, а также активность 3-гидрокси-3-метилглютарил-КоА редуктазы (HMGR) [18]. В наших экспериментах при действии АБК мы наблюдали увеличение абсолютного содержания тритерпенов и стеринов как в корнях, так и в листьях проростков пшеницы (табл. 1). Можно полагать, что в растениях при действии АБК происходят изменения в состоянии мембран, что, в свою очередь, индуцирует накопление промежуточных (циклоартенола и ланостерина) и конечных (стеринов) продуктов мевалонатного пути биосинтеза.
Жасмонаты обладают разнообразной биологической активностью, включая ингибирование прорастания семян и пыльцы или ингибирование роста корней и активности фотосинтетического аппарата [19]. Известно, что МеЖ индуцирует биосинтез многих вторичных метаболитов, играющих важную роль в адаптации растений к биотическому стрессу [20]. Наиболее значимой функцией МеЖ является участие в ответных реакциях при повреждении растений патогенами и насекомыми. СК является ключевой сигнальной молекулой в регуляции защиты растений от патогенов. Действие МеЖ и СК вызывает у растений состояние, возникающее при атаке патогенов, в результате чего происходит увеличение концентрации метаболитов, участвующих в защитных механизмах. В некоторых работах МеЖ и СК использовали как индукторы синтеза флавоноидов и полифенолов в клеточной суспензии, каллусах и тканевых культурах различных семейств растений [21]. У Medicago truncatula МеЖ индуцирует накопление сапонинов и активность генов, кодирующих ранние ферменты образования тритерпенового агликона в культурах клеточной суспензии [22]. В наших экспериментах при действии МеЖ была выявлена обратная взаимосвязь между изменениями в содержании тритерпенов и стеринов. Уменьшение содержания стеринов в корнях сопровождалось увеличением содержания тритерпенов, а в листьях, напротив, в присутствии МеЖ уменьшение тритерпенов сопровождалось увеличением стеринов (табл. 1). Наличие таких согласованных изменений тритерпенов и стеринов может свидетельствовать об общей функциональной активности этих метаболитов и предполагает компенсаторный характер изменений. При действии СК мы наблюдали прямую зависимость изменений содержания тритепренов и стеринов (табл. 1). Снижение уровня тритерпенов в корнях на фоне СК сопровождалось снижением стеринов, а значительное повышение уровня тритерпенов в листьях – увеличением стеринов. Аналогичный эффект был показан в одной из работ, где экзогенное применение СК значительно увеличивало синтез вторичных метаболитов (кумаринов, стеринов, ксантопротеинов, сердечных гликозидов и сапонинов) в листьях растений Simarouba glauca в условиях водного стресса [23]. Таким образом, значительные изменения при действии всех фитогормонов наблюдались в содержании тритерпенов по сравнению с изменениями уровня стеринов, что, возможно, связано с более ранним образованием тритерпеновых продуктов в процессе биосинтеза стеринов.
В условиях стресса важным для обеспечения функциональной активности мембран является поддержание соотношения 24-метил-/этилстеринов. Ранее нами было показано увеличение относительного содержания 24-этилстеринов в листьях пшеницы в условиях кратковременного холодового стресса, что, возможно, является одним из механизмов, способствующих повышению устойчивости мембран к изменению температур. Более длительное (12 ч) воздействие низкой температуры сопровождалось восстановлением соотношения 24-метил-/этилстерины до контрольного уровня и в корнях, и в листьях [24]. В настоящих экспериментах заметные изменения соотношения 24-метил-/ этилстеринов в сторону увеличения доли метилстеринов наблюдались в корнях при действии МеЖ и в листьях при действии АБК (табл. 2). В листьях при действии СК обнаружено небольшое увеличение доли этилстеринов, главным образом, стигмастерина. Содержание стигмастерина в корнях и листьях увеличивалось при действии АБК и СК (рис. 2). Известно, что активация синтеза стигмастерина происходит во время абиотического стресса, гравистимуляции, атаки патогенов и в ответ на сигнальные молекулы, такие как АБК, МеЖ, СК, кальций (Ca2+) и перекись водорода (H2O2) [25]. В растениях A. thaliana показано патоген-индуцированное увеличение содержания стигмастерина, что, в свою очередь, приводило к уменьшению проницаемости мембран и, как следствие, к повышению устойчивости растения к неспецифическому патогену. Мутанты A. thaliana с нуль-мутацией гена Atcyp710a1 имели повышенную чувствительность к бактериальным патогенам [5, 7].
Как отмечалось выше, баланс между 24-метил- и этилстеринами специфичен для отдельного вида растения, органа и ткани. Предполагается, что изменение состава и соотношения различных типов стеринов является ключевым звеном регуляции многих клеточных процессов [15]. В частности, соотношение 24-метил- и этилстеринов определяется активностью ферментов С24-стерин метилтрансфераз, которые катализируют реакцию метилирования 24 атома углерода боковой цепи стеринов. Соотношение β-ситостерина и стигмастерина, в свою очередь, определяется активностью С22-стерин десатуразы. Можно полагать, что количественные и качественные изменения стеринов при действии фитогормонов обусловлены изменениями на уровне транскриптов. Анализ относительного содержания транскриптов TaSMT1 и TaSMT2 при действии АБК не выявил изменений как в корнях, так и в листьях проростков пшеницы (рис. 3). Возможно, имеющегося пула транскриптов данных генов было достаточно, однако анализ уровня транскриптов TaCYP710A8-3А показал его значительное повышение в корнях (рис. 4а). Действие МеЖ в корнях индуцировало повышение уровня транскриптов только одного гена TaCYP710A8-3А (рис. 4а). Значительное повышение уровня транскриптов пяти исследованных генов биосинтеза стеринов было выявлено в листьях (рис. 3, 4). Эти данные согласуются с увеличением количественного содержания стеринов в листьях. При действии СК в корнях наблюдалось незначительное повышение уровня транскриптов только одного гена, TaSMT2 (рис. 3в). В листьях, напротив, уровень транскриптов всех исследуемых генов TaSMT1, TaSMT2 и TaCYP710A8 повышался (рис. 3, 4), что также согласуется с повышением содержания стеринов в листьях (табл. 1). Сложно говорить о прямой связи между активацией генов и увеличением продукта, поскольку биосинтез любого продукта является многофакторным процессом. В работе Wentzinger с соавт. [26] показано, что ингибирование ферментов сквален синтазы (SQS) и сквален эпоксидазы (SQE) в клетках табака сопровождалось повышением активности HMGR и снижением содержания стеринов. Анализ экспрессии генов GmSMT2 в сое выявил, что биотические и абиотические факторы, в том числе обезвоживание, холод и АБК, индуцировали экспрессию этих генов в ходе роста проростков [27]. Анализ уровня транскриптов другого гена изопреноидного пути показал, что мРНК гена BfSQS1 у Bupleurum falcatum L. накапливается повсеместно в органах растений и заметно увеличивается в корнях после обработки МеЖ и АБК [28]. Обнаружено влияние МеЖ в качестве элиситора на уровни экспрессии генов, участвующих в изопреноидном пути метаболизма тритерпенов, таких как CaSQS (Centella asiatica), CabAS (C. asiatica β-амирин синтаза) и CaCAS, в культивируемых клетках центеллы [29, 30].
Транскрипционная регуляция играет важную роль в активации или подавлении экспрессии генов и в значительной степени контролируется промоторными областями генов с помощью цис-элементов [11]. Секвенирование и анализ промоторных областей гомеологичных генов TaSMT1, проведенный нами ранее, показал наличие и АБК- и МеЖ- и СК- и элиситор-чувствительных элементов [6]. Можно предположить, что действие фитогормонов на относительное содержание транскриптов генов стеринового биосинтеза различалось в зависимости от наличия того или иного цис-элемента.
Таким образом, нами выявлены изменения тритерпенового и стеринового компонента в проростках пшеницы при действии стрессовых фитогормонов. Полученные данные способствуют расшифровке регуляторных функций мембранных стеринов растений.
Работа выполнена в рамках выполнения государственного задания ФИЦ КазНЦ РАН, а также при финансовой поддержке гранта Российского фонда фундаментальных исследований № 20-04-00988 (для А.Г. Ренковой и Ю.Н. Валитовой), гранта Президента РФ МК-264.2020.4 (для А.Г. Ренковой) и частично Программы Повышения Конкурентоспособности КФУ (для Ф.В. Минибаевой).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Thimmappa R., Geisler K., Louveau T., O’Maille P., Osbourn A. Triterpene biosynthesis in plants // Annu. Rev. Plant Biol. 2014. V. 65. P. 225. https://doi.org/10.1146/annurev-arplant-050312-120229
Benveniste P. Biosynthesis and accumulation of sterols // Annu. Rev. Plant Biol. 2004. V. 55. P. 429. https://doi.org/10.1146/annurev.arplant.55.031903.141616
Schaller H. The role of sterols in plant growth and development // Prog. Lipid Res. 2003. V. 42. P. 163. https://doi.org/10.1016/s0163-7827(02)00047-4
Schaeffer A., Bronner R., Benveniste P., Schaller H. The ratio of campesterol to sitosterol that modulates growth in Arabidopsis is controlled by STEROL METHYL TRANSFERASE 2:1 // Plant J. 2001. V. 25. P. 605. https://doi.org/10.1046/j.1365-313x.2001.00994.x
Griebel T., Zeier J. A role for beta-sitosterol to stigmasterol conversion in plant-pathogen interactions // Plant J. 2010. V. 63. P. 254. https://doi.org/10.1111/j.1365-313X.2010.04235.x
Renkova A., Valitova J., Schaller H., Minibayeva F. The homoeologous genes encoding C24-sterol methyltrasferase 1 in Triticum aestivum: structural characteristics and effects of cold stress // Biologia Plantarum. 2019. V. 63. P. 59. https://doi.org/10.32615/bp.2019.008
Wang K., Senthil-Kumar M., Ryu C.M., Kang L., Mysore K.S. Phytosterols play a key role in plant innate immunity against bacterial pathogens by regulating nutrient efflux into the apoplast // Plant Physiol. 2012. V. 158. P. 1789. https://doi.org/10.1104/pp.111.189217
Senthil-Kumar M., Wang K., Mysore K.S. AtCYP710A1 gene-mediated stigmasterol production plays a role in imparting temperature stress tolerance in Arabidopsis thaliana // Plant Signal. Behav. 2013. V. 8. P. e23142-1. https://doi.org/10.4161/psb.23142
Finkelstein R.R., Gampala S.S.L., Rock C.D. Abscisic Acid Signaling in Seeds and Seedlings // Plant Cell. 2002. V. 14 (Suppl). P. s15. https://doi.org/10.1105/tpc.010441
Beckers G.J., Spoel S.H. Fine-tuning plant defence signalling: salicylate versus jasmonate // Plant Biol. (Stuttg).V. 8. P. 1. https://doi.org/10.1055/s-2005-872705
Zou C., Sun K., Mackaluso J.D., Seddon A.E., Jin R., Thomashow M.F., Shiu S.H. Cis-regulatory code of stress-responsive transcription in Arabidopsis thaliana // Proc. Natl. Acad. Sci. USA. 2011. V. 108. P. 14992. https://doi.org/10.1073/pnas.1103202108
McLafferty F.W., Stauffer D.A., Loh S.Y., Wesdemiotis C. Unknown identification using reference mass spectra. Quality evaluation of databases // J. Am. Soc. Mass Spectrom. 1999. V. 10. P. 1229. https://doi.org/10.1016/S1044-0305(99)00104-X
Paolacci A.R., Tanzarella O.A., Porceddu E., Ciaffi M. Identification and validation of reference genes for quantitative RT-PCR normalization in wheat // BMC Mol. Biol. 2009. V. 10. P. 11. https://doi.org/10.1186/1471-2199-10-11
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method // Methods. 2001. V. 25. P. 402. https://doi.org/10.1006/meth.2001.1262
Dufourc E.J. The role of phytosterols in plant adaptation to temperature // Plant Signal. Behav. 2008. V. 3. P. 133. https://doi.org/10.4161/psb.3.2.5051
Tang J., Ohyama K., Kawaura K., Hashinokuchi H., Kamiya Y., Suzuki M., Muranaka T., Ogihara Y. A new insight into application for barley chromosome addition lines of common wheat: achievement of stigmasterol accumulation // Plant Physiol. 2011. V. 157. P. 1555. https://doi.org/10.1104/pp.111.183533
Stillwell W., Cheng Y.F., Wassall S.R. Plant sterol inhibition of abscisic acid-induced perturbations in phospholipid bilayers // Biochim. Biophys. Acta. 1990. V. 1024. P. 345. https://doi.org/10.1016/0005-2736(90)90364-t
Mansouri H., Asrar Z. Effects of abscisic acid on content and biosynthesis of terpenoids in Cannabis sativa at vegetative stage // Biologia Plantarum. 2012. V. 56. P. 153. https://doi.org/10.1007/s10535-012-0033-2
Rossato L., MacDuff J.H., Laine P., Le Deunff E., Ourry A. Nitrogen storage and remobilization in Brassica napus L. during the growth cycle: effects of methyl jasmonate on nitrate uptake, senescence, growth, and VSP accumulation // J. Exp. Bot. 2002. V. 53. P. 1131. https://doi.org/10.1093/jexbot/53.371.1131
Martin D., Tholl D., Gershenzon J., Bohlmann J. Methyl jasmonate induces traumatic resin ducts, terpenoid resin biosynthesis, and terpenoid accumulation in developing xylem of Norway spruce stems // Plant Physiol. 2002. V. 129. P. 1003. https://doi.org/10.1104/pp.011001
Manivannan A., Soundararajan P., Park Y.G., Jeong B.R. Chemical elicitor-induced modulation and antioxidant metabolism and enhancement of secondary metabolite accumulation in cell suspension cultures of Scrophularia kakudensis Franch // Int. J. Mol. Sci. 2016. V. 17. P. 399. https://doi.org/10.3390/ijms17030399
Suzuki H., Reddy M.S., Naoumkina M., Aziz N., May G.D., Huhman D.V., Sumner L.W., Blount J.W., Mendes P., Dixon R.A. Methyl jasmonate and yeast elicitor induce differential transcriptional and metabolic re-programming in cell suspension cultures of the model legume Medicago truncatula // Planta. 2005. V. 220. P. 696. https://doi.org/10.1007/s00425-004-1387-2
Awate P.D. Gaikwad D.K. Influence of growth regulators on secondary metabolites of medicinally important oil yielding plant Simarouba glauca DC. under water stress conditions // J. Stress Physiol. Biochem. 2014. V.10. P. 222.
Valitova J., Renkova A., Mukhitova F., Dmitrieva S., Minibayeva F. Membrane sterols and genes of sterol biosynthesis are involved in the response of Triticum aestivum seedlings to cold stress // Plant Physiol. Biochem. 2019. V. 142. P. 452. https://doi.org/10.1016/j.plaphy.2019.07.026
Aboobucker S.I., Suza W.P. Why Do Plants Convert Sitosterol to Stigmasterol? // Front. Plant Sci. 2019. V. 10. P. 354. https://doi.org/10.3389/fpls.2019.00354
Wentzinger L.F., Bach T.J., Hartmann M.A. Inhibition of squalene synthase and squalene epoxidase in tobacco cells triggers an up-regulation of 3-hydroxy-3-methylglutaryl coenzyme A reductase // Plant Physiol. 2002. V. 130. P. 334. https://doi.org/10.1104/pp.004655
Neelakandan A.K., Nguyen T.M., Kumar R., Tran L.S., Guttikonda S.K., Quach T.N., Aldrich D.L., Nes W.D., Nguyen H.T. Molecular characterization and functional analysis of Glycine max sterol methyl transferase 2 genes involved in plant membrane sterol biosynthesis // Plant Mol. Biol. 2010. V. 74. P. 503. https://doi.org/10.1007/s11103-010-9692-6
Kim Y.S., Cho J.H., Park S., Han J.Y., Back K., Choi Y.E. Gene regulation patterns in triterpene biosynthetic pathway driven by overexpression of squalene synthase and methyl jasmonate elicitation in Bupleurum falcatum // Planta. 2011. V. 233. P. 343. https://doi.org/10.1007/s00425-010-1292-9
Kim O.K., Kim M.Y., Hwang S.J., Ahn J.C., Hwang B. Cloning and molecular analysis of cDNA encoding cycloartenol synthase from Centella asiatica (L.) Urban // Biotechnol. Bioprocess. Eng. 2005. V. 10. P. 16. https://doi.org/10.1007/BF02931177
Mangas S., Bonfill M., Osuna L., Moyano E., Tortoriello J., Cusido R.M., Piñol M.T., Palazón J. The effect of methyl jasmonate on triterpene and sterol metabolisms of Centella asiatica, Ruscus aculeatus and Galphimia glauca cultured plants // Phytochemistry. 2006. V. 67. P. 2041. https://doi.org/10.1016/j.phytochem.2006.06.025
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


