Физиология растений, 2021, T. 68, № 3, стр. 268-278
Влияние лактон- и кетонсодержащих брассиностероидов на фотосинтетическую активность листьев ячменя при старении
И. С. Ковтун a, *, Н. Е. Кухаренко a, В. В. Кузнецов b, В. А. Хрипач c, М. В. Ефимова a
a Национальный исследовательский Томский государственный университет
Томск, Россия
b Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
c Институт биоорганической химии Национальной академии наук Беларуси
Минск, Республика Беларусь
* E-mail: kovtunirina2@gmail.com
Поступила в редакцию 28.08.2020
После доработки 17.09.2020
Принята к публикации 20.09.2020
Аннотация
Проведено сравнение физиологической активности брассиностероидов (БС) разного химического строения – лактонсодержащего 24-эпибрассинолида (ЭБЛ) и кетонсодержащего брассиностероида 24-эпикастастерона (ЭПК), при темновом старении отсеченных листьев ячменя. Оценивали функциональное состояние фотосинтетического аппарата, количество фотосинтетических пигментов, содержание продуктов перекисного окисления липидов, а также экспрессию гена HvS40 – маркера старения. Отделенные листья ячменя инкубировали на растворах ЭБЛ и ЭПК в диапазоне концентраций 0.01–1 мкМ в чашках Петри на фильтровальной бумаге. В качестве положительного контроля использовали синтетический цитокинин – 6-бензиламинопурин (БАП) в концентрации 10 мкМ, в качестве отрицательного – дистиллированную воду. Чашки Петри с листьями выдерживали в течение пяти суток в темноте. Измерения анализируемых показателей проводили на 1, 3 и 5 сутки с начала инкубации, преимущественно в средней части листовой пластины. ЭПК в концентрации 1 мкМ снижал окислительный стресс к пятым суткам инкубации в большей степени, чем ЭБЛ в аналогичной концентрации. В отношении поддержания уровня хлорофилла a (Хл а) 24-эпикастастерон (1 мкМ) был более эффективен, чем 24-эпибрассинолид. Показано, что экзогенные брассиностероиды проявляли протекторный эффект на основные фотохимические процессы второй фотосистемы при старении листьев ячменя. Причем при оценке коэффициента нефотохимического тушения (qN), показателей регулируемого (Y(NPQ)) и нерегулируемого (Y(NO)) рассеивания тепловой энергии ЭПК демонстрировал более выраженное защитное действие для второй фотосистемы по сравнению с ЭБЛ. Установлено, что обработка брассиностероидами снижала уровень экспрессии гена HvS40 – маркера старения на пятые сутки инкубации, что было особенно характерно для кетонсодержащего брассиностероида. Таким образом, можно заключить, что кетонсодержащий брассиностероид не только проявляет высокую биологическую активность, но и, по ряду параметров, является более эффективным по сравнению с лактонсодержащим брассиностероидом для уменьшения повреждений, вызванных старением.
ВВЕДЕНИЕ
Старение растений представляет собой сложный физиологический процесс, реализация которого значительно влияет на жизнедеятельность растений, приводя к угнетению функционирования фотосинтетического аппарата, снижению продуктивности растений и их естественной гибели [1]. С одной стороны, благодаря искусственной регуляции процессов старения можно добиться сокращения жизненного цикла растений для ускоренного получения плодов и семян, что представляет значительный интерес в регионах с коротким летним периодом в условиях быстрого сокращения длины светового дня. С другой стороны, управляемое ингибирование процесса старения позволит дольше поддерживать активное физиологическое состояние растения, что представляет особый интерес при транспортировке и хранении срезанных цветов, фруктов и овощей. Исследование влияния различных факторов на замедление или ускорение старения растений имеет большое практическое значение [2].
Старение является четко контролируемым процессом, который регулируется и реализуется в определенном порядке. В ходе старения наблюдаются значительные морфологические, физиологические, молекулярные и цитологические преобразования, что выражается в изменении экспрессии определенных генов, колебании уровня и соотношения фитогормонов, а также в запускании процессов разрушения клетки. В листьях одним из начальных признаков старения является деградация хлоропластов, что, в свою очередь, приводит к угнетению фотосинтеза. Кроме того, существуют сведения, что старение может запускаться хлоропластами, а механизмы его развития могут зависеть как от факторов окружающей среды, так и от вида растения [3].
Значительную роль в регуляции старения играют фитогормоны. Известно, что этилен, жасмоновая и абсцизовая кислоты могут способствовать старению, тогда как цитокинины, напротив, замедляют его. Среди всех гормонов особое место занимают брассиностероиды (БС), представляющие собой полигидроксилированные производные стеринов, близкие по строению стероидным гормонам млекопитающих [4]. Они выполняют решающую роль в реализации жизненного цикла растений: от прорастания семян до естественной смерти. БС на протяжении всего онтогенеза растений способны влиять на процессы деления и растяжения клеток, сосудистую дифференцировку, процесс этиоляции, фотоморфогенез, иммунитет, репродуктивное развитие, а также могут оказывать протекторный эффект в ответ на действие различных стрессоров [5]. В настоящее время выделено около 70 природных брассиностероидов. На основании различий в структуре циклической части молекулы их можно отнести к В-лактонам, 6‑кетонам и 6-дезоксопроизводным [6].
Для некоторых представителей брассиностероидов, таких как брассинолид (БЛ), 24-эпибрассинолид и 28-гомобрассинолид, показана высокая биологическая активность, которая обусловлена такими структурными особенностями молекул, как присутствие 6-кето- или 7-окса-6-оксо структурного фрагмента в кольце В, наличие 2α-, 3α-диольной группировки в кольце А, существование диольной системы в положениях 22 и 23 с R‑конфигурацией гидроксильных групп, наличие метильной или этильной группы в положении 24 (боковая цепь), транс-сочленение циклов А/В [7].
Лактонсодержащие брассиностероиды являются продуктом ключевой стадии биосинтеза брассиностероидов из их кетонсодержащих предшественников. 24-эпибрассинолид (ЭБЛ) относится к лактонсодержащим БС, тогда как 24-эпикастастерон (ЭПК) – к кетонсодержащим. Предполагается, что наличие цис-диольной группировки в цикле А, а также присутствие гидроксильных групп в положениях 22 и 23 боковой цепи необходимы для проявления высокой биологической активности БС в растениях [7], что характерно для молекул ЭБЛ и ЭПК. Важно отметить, что физиологическое действие ЭБЛ, как лактонсодержащего брассиностероида, исследовано более детально, в отличие от его кетонсодержащего предшественника.
Исследование влияния брассиностероидов на старение растений представляет значительный интерес, однако до сих пор остается невыясненной их роль в этом процессе. Ряд исследований свидетельствует о том, что брассиностероиды способны ускорять старение [8–11], однако существуют доказательства, указывающие на их способность ингибировать эти процессы [12, 13]. На примере мутантного растения Arabidopsis thaliana, у которого инактивирован ген, кодирующий один из ключевых ферментов биосинтеза брассиностероидов, было показано, что недостаток гормонов приводит к замедлению старения и формированию карликовых растений с продолжительным жизненным циклом [14]. С другой стороны, экзогенные лактонсодержащие брассиностероиды способствуют мобилизации фотосинтетических процессов, повышению уровня пигментов и активности транскрипции хлоропластных генов у растений исходного родительского фенотипа [15]. Показано, что у растений картофеля баланс кетон- и лактонсодержащих БС характеризуется органоспецифичностью, а также зависит от возраста растений. Так, например, в корнях преобладали представители лактонового ряда, в побегах – кетонового, при этом по мере роста растений содержание лактонов снижалось, а кетонов возрастало [16]. Тем не менее, данные о динамике и балансе брассиностероидов разного химического строения в растениях представлены недостаточно, а влияние экзогенных фитогормонов на уровень эндогенных брассиностероидов слабо изучено.
Можно предположить, что в зависимости от химического строения (лактон- или кетонсодержащие) и действующей концентрации брассиностероиды могут оказывать различное по направленности и степени выраженности влияние на процесс старения. Кроме того, до сих пор остается открытым вопрос об эффективности действия лактон- (ЭБЛ) и кетонсодержащих (ЭПК) брассиностероидов на состояние фотосинтетической системы, как одного из основных маркеров оптимального физиологического состояния растений при темновом старении срезанных листьев ячменя. Для исследования специфичности действия ЭБЛ и ЭПК не только на физиологическом, но и на молекулярном уровне изучена активность экспрессии гена HvS40, продукт которого участвует в регуляции старения и может быть использован в качестве молекулярного маркера.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили на растениях ячменя обыкновенного (Hordeum vulgare L.) сорта “Луч”. Это однодольное травянистое растение семейства Злаковые (Poaceae), которое широко используется во многих странах мира как одна из основных сельскохозяйственных культур. Удобство экспериментального использования ячменя для оценки активности и эффективности действия веществ гормональной природы обусловлено доступностью семенного материала, неприхотливостью растений, возможностью их выращивания в лабораторных условиях с быстрым получением большого количества растений.
Семена ячменя проращивали в почве в климатической камере при температуре 21 ± 2°С, с фотопериодом 16/8 ч (день/ночь), при 150 мкмоль фотонов/м2с под люминесцентными лампами (“OSRAM”, Германия) в течение 5 суток. Перед началом эксперимента часть растительного материала фиксировали для определения содержания фотосинтетических пигментов, показателей активности ФС II и оценки уровня транскриптов гена HvS40 – исходная точка (ИТ). Отделенные листья H. vulgare инкубировали на растворах 24‑эпибрассинолида и 24-эпикастастерона в концентрациях 0.01, 0.1 и 1 мкМ в чашках Петри на фильтровальной бумаге. В качестве положительного контроля использовали синтетический аналог природного цитокинина – 6-бензиламинопурин в концентрации 10 мкМ, в качестве отрицательного – дистиллированную воду. Важно отметить, что именно БАП используется в качестве положительного контроля, поскольку ранее были получены данные о его ингибирующем влиянии на старение [17]. Чашки Петри со срезанными листьями выдерживали в течение пяти суток без света. Измерения анализируемых показателей проводили на 1, 3 и 5 сутки после начала инкубации, фиксацию растительного материала осуществляли на зеленом свету низкой интенсивности (0.25 мкмоль/м2 с). Каждый лист условно разделяли на три части – низ (2 см от основания листа), верх (2 см от верхушки листа), середина (часть листа между верхом и низом, около 2–3 см).
О возникновении окислительного стресса при старении отделенных листьев ячменя судили по накоплению веществ, реагирующих с тиобарбитуровой кислотой (ТБК-активные вещества). Зафиксированную в жидком азоте пробу листьев (около 100 мг) растирали в 1 мл 20% трихлоруксусной кислоты (ТХУ). Перемешивали на вортексе, центрифугировали 15 мин, при 12 000 g при 4°C. 500 мкл супернатанта отбирали и добавляли в стеклянные пробирки, содержащие 1.5 мл тиобарбитуровой кислоты. В контрольные образцы вместо супернатанта добавляли равный объем ТХУ. Реакцию с образованием окрашенного комплекса проводили в течение 30 мин при 98°C на водяной бане [18]. Оптическую плотность полученных растворов измеряли на спектрофотометре (Genesys 10S UV-Vis, “ThermoScientific”, США) при длине волны 532 и 600 нм.
Содержание фотосинтетических пигментов в листьях рассчитывали на сырую массу. Навеску растительного материала (около 10 мг), зафиксированную в 96% спирте, растирали и центрифугировали (MiniSpin, “Eppendorf”, Германия) в течение 8 мин при 8000 g. Надосадочную жидкость переносили в чистую пробирку типа Эппендорф и доводили объем до 1.5 мл 96% спиртом. Оптическую плотность растворов промеряли при длине волн: 470, 664, 648, 720 нм на спектрофотометре (Genesys 10S UV-Vis, “ThermoScientific”, США). В качестве контрольного образца использовали 96% этанол. Количество фотосинтетических пигментов в спиртовой вытяжке рассчитывали по формулам согласно Lichtenthaler [19].
Исследование фотохимической активности ассимиляционного аппарата растений проводили при помощи модулирующего импульсного флуориметра Junior-PAM (“Heinz-Walz”, Germany) [20]. Параметры флуоресценции регистрировали при наведении светодиода флуориметра на пробы листьев после 20 минут темновой адаптации. Хлорофиллы фотосистемы II (ФС II) возбуждали светодиодом при длине волны 450 нм. Детекция флуоресценции хлорофилла (ФлХ) осуществлялась PIN-фотодиодом, защищенным фильтром (длина волны при 50% пропускании – 645 нм). Максимальная плотность светового потока составляла 10 000 мкмоль фотонов/(м2с), продолжительность светового импульса – 0.6 с. Параметры флуоресценции рассчитывали в программе WinControl. Параметры флуоресценции хлорофиллов: Fo – базовый уровень ФлХ при низкой интенсивности света, не вызывающей фотохимических реакций; Fm – максимальный уровень ФлХ, вызванный импульсом света после адаптации тканей к темноте; $F_{{\text{m}}}^{'}$ – максимальный уровень ФлХ, вызванный импульсом света после адаптации тканей к свету; Fv – “вариабельность” ФлХ, рассчитывается как разность Fo и Fm; $F_{{\text{v}}}^{'}$ – “вариабельность” ФлХ, рассчитывается как разность Fo и $F_{{\text{m}}}^{'}$; Fv/Fm – максимальный фотохимический квантовый выход ФС II после адаптации тканей к темноте; Y(II), или ${{F_{{\text{v}}}^{'}} \mathord{\left/ {\vphantom {{F_{{\text{v}}}^{'}} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}$ – эффективный фотохимический квантовый выход ФС II после адаптации тканей к свету; qP, или ($F_{{\text{m}}}^{'}$ – Ft)/($F_{{\text{m}}}^{'}$ – Fo) – коэффициент фотохимического тушения ФлХ; qN, или (Fm – $F_{{\text{m}}}^{'}$)/(Fm – Fo) – коэффициент нефотохимического тушения ФлХ; доля открытых центров второй фотосистемы – qL; Y(NPQ) – регулируемое рассеяние тепловой энергии; Y(NO) – нерегулируемое рассеивание тепловой энергии; ETR – плотность транспорта электронов по электрон-транспортной цепи тилакоидных мембран.
Нуклеотидную последовательность гена HvS40 (маркера старения) брали из биоинформатической базы данных NCBI (National Center for Biotechnological Information, USA – FI496079.1). Специфические праймеры подбирали с использованием программ Primer-BLAST и Vector NTI 11 [21]. Выделение ДНК, для проверки специфичности отжига праймеров, проводили с помощью коммерческого набора Сорб-ГМО-А (“Синтол”, Россия). РНК выделяли с использованием коммерческого набора RNeasy miniKit (“Qiagen”, Германия). Для синтеза кДНК использовали набор MMLV RT kit (“Евроген”, Россия). Оценку уровня экспрессии целевого гена проводили методом ПЦР в режиме реального времени в амплификаторе LightCycler96 (“Roсhe”, Швейцария) с применением красителя SybrGreen I (“Евроген”, Россия). Амплификацию проводили с использованием специфических праймеров для референсных генов (Ef1 (KP293845.1), прямой: GAAGATGATTCCCACCAAGC, обратный: TGACACCAACAGCCACAGTT; TubB (AM502854), прямой: TCCAAGGTTTCCAGGTGTG, обратный: AGACGGAGAAGGTGAGCATC [22], при температуре отжига 60°C) и целевого гена – маркера старения – HvS40 (прямой: GGAGACATCGCCAAGGTGTC, обратный: TGCAGTCGTCGTTGCCACT, при температуре отжига 62°C).
Каждый эксперимент был повторен не менее трех раз. Для каждого биологического повтора использовали не менее 25 листьев. Полученные результаты представлены на рисунках в виде средней арифметической со стандартной ошибкой. Для оценки достоверности различий использовали критерий Стьюдента. Значения t-критерия находили для 95% уровня значимости (P < 0.05). Статистическая обработка данных была проведена с использованием программы Statistica 10.
РЕЗУЛЬТАТЫ
Оценка пигментного состава в разных частях листовой пластины
Известно, что листья однодольных растений растут основанием, поэтому распределение фотосинтетических пигментов в разных частях листовой пластины неодинаково. Мы проанализировали содержания фотосинтетических пигментов в разных частях листьев ячменя при их темновой инкубации на 1, 3 и 5 сутки (рис. 1).
Рис. 1.
Содержание фотосинтетических пигментов в разных частях листовой пластины ячменя при темновой инкубации. Столбики черного цвета – хлорофилл a, белого цвета – хлорофилл b, серого цвета – каротиноиды. Достоверные различия в пределах одних суток на уровне P ≤ 0.05 отмечены звездочкой (*).

В исходной точке эксперимента (ИТ) содержание хлорофиллов было одинаково во всех частях листа, при этом уровень каротиноидов в верхней части листовой пластины был выше. После суток инкубации, в нижней части листа, содержание всех исследуемых групп пигментов снизилось примерно в 2 раза. На пятые сутки наибольшее содержание хлорофилла a наблюдалось в средней части листовой пластины (рис. 1).
Оценка функционального состояния второй фотосистемы в разных частях листовой пластины
При исследовании фотохимической активности второй фотосистемы в разных частях листа 5-дневных проростков ячменя было показано, что величины максимального (Fv/Fm) и эффективного (Y(II)) квантового выхода, показатель плотности потока электронов (ETR) существенно не отличались в разных частях листа, тогда как показатели регулируемого (Y(NPQ)) и нерегулируемого (Y(NO)) рассеивания тепловой энергии, коэффициентов фотохимического (qP) и нефотохимического (qN) тушения, а также доля открытых центров второй фотосистемы (qL) были сходны в верхней и средней части листа, при этом значительно отличаясь от данных показателей в нижней части листовой пластины (табл. 1).
Таблица 1.
Параметры фотосинтеза в разных частях листовой пластины.
| низ | середина | верх | |
|---|---|---|---|
| Fv/Fm | 0.764 ± 0.014 | 0.761 ± 0006 | 0.779 ± 0.005 |
| Y (II) | 0.656 ± 0.007 | 0.646 ± 0.006 | 0.651 ± 0.008 |
| Y(NPQ) | 0.072 ± 0.003* | 0.126 ± 0.009 | 0.138 ± 0.010 |
| Y (NO) | 0.272 ± 0.008* | 0.229 ± 0.014 | 0.211 ± 0.003 |
| ETR | 52.322 ± 0.532 | 51.511 ± 0.445 | 51.956 ± 0.589 |
| qP | 0.912 ± 0.021* | 0.962 ± 0.019 | 0.956 ± 0.005 |
| qN | 0.255 ± 0.010* | 0.431 ± 0.033 | 0.470 ± 0.026 |
| qL | 0.745 ± 0.060* | 0.894 ± 0.054 | 0.875 ± 0.017 |
Примечание. Fv/Fm – максимальная фотохимическая эффективность второй фотосистемы, Y(II) – эффективный квантовый выход, Y(NPQ) – регулируемое рассеивание тепловой энергии, Y(NO) – нерегулируемое рассеивание тепловой энергии, ETR – плотность потока электронов, qP – коэффициент фотохимического тушения, qN – коэффициент нефотохимического тушения, qL – доля открытых центров второй фотосистемы. Достоверные различия на уровне P ≤ 0.05 отмечены звездочкой (*).
Таким образом, основываясь на этих результатах, для проведения дальнейших исследований использовали среднюю часть листовой пластины.
Влияние ЭБЛ и ЭПК на пигментный состав листьев ячменя
Для определения оптимальной действующей концентрации гормонов исследовали содержание основных фотосинтетических пигментов в отделенных листьях ячменя при их старении, индуцированном темнотой. Использовали ЭБЛ и ЭПК в диапазоне концентраций 0.01–1 мкМ. Обработка брассиностероидами не оказала значительного влияния на содержание хлорофилла b (Хл b) и каротиноидов. К пятым суткам инкубации наблюдалось большее содержание хлорофилла a при обработке 1 мкМ ЭПК в сравнении с суточным контролем (табл. 2).
Таблица 2.
Влияние ЭБЛ и ЭПК на содержание фотосинтетических пигментов в отделенных листьях ячменя
| Вариант | Концентрация, мкМ | Хл а, мг/г сырой массы |
Хл b, мг/г сырой массы |
Каротиноиды, мг/г сырой массы | |
|---|---|---|---|---|---|
| ИТ | ИТ | 0 | 0.73 ± 0.05 | 0.19 ± 0.02 | 0.22 ± 0.01 |
| 1 сутки | К | 0 | 0.83 ± 0.01 | 0.21 ± 0.01 | 0.26 ± 0.00 |
| БАП | 10 | 0.98 ± 0.06* | 0.26 ± 0.02* | 0.29 ± 0.02* | |
| ЭБЛ | 0.01 | 0.81 ± 0.07 | 0.20 ± 0.02 | 0.24 ± 0.02 | |
| 0.1 | 0.78 ± 0.07 | 0.22 ± 0.02 | 0.23 ± 0.02 | ||
| 1 | 0.90 ± 0.07 | 0.24 ± 0.02 | 0.26 ± 0.02 | ||
| ЭПК | 0.01 | 0.95 ± 0.07* | 0.26 ± 0.02* | 0.27 ± 0.02 | |
| 0.1 | 0.79 ± 0.03 | 0.21 ± 0.01 | 0.24 ± 0.01* | ||
| 1 | 0.85 ± 0.06 | 0.24 ± 0.02 | 0.24 ± 0.02 | ||
| 3 сутки | К | 0 | 0.64 ± 0.06 | 0.17 ± 0.02 | 0.21 ± 0.02 |
| БАП | 10 | 0.83 ± 0.03* | 0.23 ± 0.01* | 0.26 ± 0.01* | |
| ЭБЛ | 0.01 | 0.57 ± 0.04 | 0.15 ± 0.01 | 0.20 ± 0.01 | |
| 0.1 | 0.59 ± 0.05 | 0.16 ± 0.01 | 0.20 ± 0.02 | ||
| 1 | 0.57 ± 0.04 | 0.16 ± 0.01 | 0.19 ± 0.01 | ||
| ЭПК | 0.01 | 0.58 ± 0.04 | 0.17 ± 0.01 | 0.19 ± 0.02 | |
| 0.1 | 0.68 ± 0.04 | 0.19 ± 0.02 | 0.22 ± 0.01 | ||
| 1 | 0.65 ± 0.09 | 0.19 ± 0.03 | 0.20 ± 0.03 | ||
| 5 сутки | К | 0 | 0.29 ± 0.03 | 0.10 ± 0.01 | 0.14 ± 0.01 |
| БАП | 10 | 0.75 ± 0.03* | 0.20 ± 0.01* | 0.24 ± 0.01* | |
| ЭБЛ | 0.01 | 0.22 ± 0.04 | 0.07 ± 0.01* | 0.12 ± 0.01 | |
| 0.1 | 0.23 ± 0.02* | 0.07 ± 0.01* | 0.12 ± 0.01 | ||
| 1 | 0.31 ± 0.03 | 0.08 ± 0.01 | 0.14 ± 0.02 | ||
| ЭПК | 0.01 | 0.26 ± 0.03 | 0.08 ± 0.01 | 0.13 ± 0.02 | |
| 0.1 | 0.25 ± 0.02 | 0.07 ± 0.00* | 0.13 ± 0.00 | ||
| 1 | 0.39 ± 0.04* | 0.08 ± 0.01 | 0.14 ± 0.02 |
Влияние ЭПК и ЭБЛ на перекисное окисление липидов
Наряду с содержанием фотосинтетических пигментов определяли степень окислительного стресса по накоплению веществ, реагирующих с тиобарбитуровой кислотой. Анализ показал, что как лактон-, так и кетонсодержащие БС снижали перекисное окисление липидов к пятым суткам воздействия при большинстве исследуемых концентраций. Особенно ярко данный эффект выражен для ЭБЛ и ЭПК в концентрации 1 мкМ (рис. 2).
Рис. 2.
Влияние ЭБЛ (0.01, 0.1 и 1 мкМ) и ЭПК (0.01, 0.1 и 1 мкМ) на содержание ТБК-активных веществ в средней части листа ячменя в динамике. Достоверные различия относительно суточного контроля на уровне P ≤ 0.05 отмечены звездочкой (*).
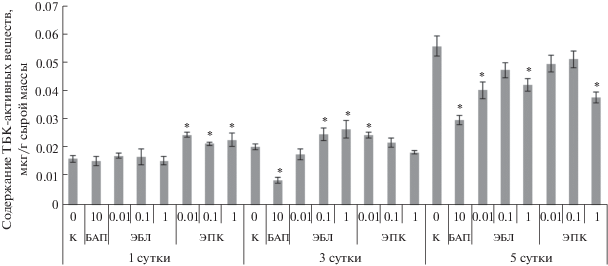
Опираясь на полученные данные, для дальнейшей оценки эффективности функционирования второй фотосистемы нами была использована концентрация брассиностероидов 1 мкМ.
Влияние ЭБЛ и ЭПК на активность фотосинтетических процессов второй фотосистемы
PAM-флуориметрия, основанная на импульсной амплитудной модуляции, широко используется для исследования активности фотосинтетических процессов [23]. Одним из основных показателей функционирования фотосинтетического аппарата является максимальный фотохимический квантовый выход, который определяют как отношение значения переменной флуоресценции к максимальной (Fv/Fm). В течение пяти суток показатель Fv/Fm постепенно снижался у всех вариантов, включая контрольный и варианты с гормональной обработкой (рис. 3а). Тем не менее, на третьи сутки величина данного показателя у контрольного варианта была выше, чем у опытных. На пятые сутки отмечалось некоторое повышение показателя Fv/Fm у опытных вариантов в сравнении с суточным контролем (рис. 3а).
Рис. 3.
Влияние ЭБЛ (1 мкМ) и ЭПК (1 мкМ) на параметры фотосинтеза: максимальный квантовый выход (а), эффективный квантовый выход (б), регулируемое рассеивание тепловой энергии (в), нерегулируемое рассеивание тепловой энергии (г), плотность потока электронов (д), доля открытых центров второй фотосистемы (е), коэффициент фотохимического тушения (ж), коэффициент нефотохимического тушения (з). Черная пунктирная линия – контроль, серая пунктирная линия – БАП, серая сплошная линия – ЭБЛ, черная сплошная линия – ЭПК. Достоверные различия на уровне P ≤ 0.05 отмечены звездочкой (*).

На протяжении всего периода инкубации было отмечено снижение эффективного квантового выхода (Y(II)) во всех исследуемых вариантах. При этом уже на третьи сутки данный показатель увеличивался у вариантов с обработкой брассиностероидами относительно контроля. У всех вариантов с гормональной обработкой на пятые сутки показатель Y(II) был выше примерно на 17%, чем у суточного контроля (рис. 3б).
Для оценки нефотохимического тушения флуоресценции используется параметр регулируемого рассеяния тепловой энергии (Y(NPQ)). Данный показатель служит оценкой интенсивности нефотохимического тушения возбужденных состояний хлорофилла – защитного механизма регуляции фотосинтеза от избыточного облучения. Было отмечено незначительное повышение данного показателя на пятые сутки воздействия ЭПК, тогда как для варианта с ЭБЛ этот параметр был ниже суточного контроля (рис. 3в). Величина нерегулируемого рассеивания тепловой энергии (Y(NO)) повышалась к пятым суткам инкубации, особенно в контрольном варианте. Гормональная обработка приводила к снижению данного показателя на 20–30% (рис. 3г).
О стабильной эффективности ФС II свидетельствует восстановление скорости переноса электронов (ETR) в ответ на гормональное воздействие. Так, на рисунке 3д показано, что относительная скорость транспорта электронов совпадала с динамикой эффективного квантового выхода Y(II).
Показатель qL отражает долю открытых реакционных центров ФС II. ЭПК и ЭБЛ способствовали увеличению данного показателя на третьи и пятые сутки воздействия (рис. 3е).
Данные, представленные на рисунке 3ж, свидетельствуют о том, что значение коэффициента фотохимического тушения флуоресценции (qP) в присутствии лактон- и кетонсодержащих брассиностероидов было выше в сравнении с контролем на третьи и пятые сутки инкубации. qN – коэффициент нефотохимического тушения флуоресценции – к пятым суткам эксперимента повышался при инкубации с 24-эпикастастероном и не отличался от суточного контроля при обработке 24-эпибрассинолидом (рис. 3з).
Оценка экспрессии гена HvS40
Ген HvS40 ячменя относится к семейству генов S40, участвующих в регуляции старения растений, и может быть использован для оценки процесса старения, индуцированного темнотой, у отделенных листьев ячменя. После суток инкубации экспрессия гена HvS40 была выше, чем в исходной точке эксперимента (до начала воздействия) (рис. 4). При этом гормональная обработка листьев снижала активность экспрессии гена старения.
Рис. 4.
Влияние ЭБЛ (1 мкМ) и ЭПК (1 мкМ) на относительный уровень транскриптов гена HvS40 в листьях ячменя. Достоверные различия относительно суточного контроля на уровне P ≤ 0.05 отмечены звездочкой (*).
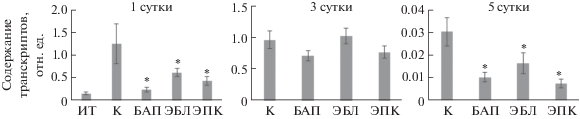
На третьи сутки воздействия наблюдалось выравнивание с суточным контролем уровня транскриптов гена HvS40 при обработке брассиностероидами. К пятым суткам эксперимента экспрессия гена HvS40 в суточном контроле была выше, чем в вариантах с гормональным воздействием (рис. 4).
ОБСУЖДЕНИЕ
Брассиностероиды, как класс фитогормонов, открыты сравнительно недавно и значительные успехи по исследованию их свойств и функций в растениях достигались благодаря использованию мутантных растений. При этом у разных видов растений, содержащих мутации по генам, отвечающим за синтез или сигналлинг брассиностероидов, наблюдалось проявление сходных фенотипических черт, в частности, карликовость [24]. Данные исследования положили начало изучению стероидных гормонов растений, как регуляторов развития, оказывающих значительное воздействие на рост, растяжение, деление и дифференциацию клеток. Позже было установлено, что влияние БС на рост осуществляется путем сложного сигнального каскада, модулирующего активность генов и баланс других фитогормонов [25]. Также было показано, что брассиностероиды способны участвовать в формировании защитного потенциала растений от биотических и абиотических стрессоров [26]. Несмотря на то, что ученые вплотную приблизились к пониманию механизмов действия брассиностероидов, вопрос об их регуляторной роли при старении до сих пор остается открытым. Также не определено, зависит ли направленность действия разных представителей БС от их химической структуры.
Например, отмечено ускорение процессов старения отделенных листьев гороха в результате изменения липидного состава при действии 0.1 мкМ 24-эпибрассинолида [8]. Кроме того, на 15 сутки воздействия снижалось накопление хлорофиллов a и b при действии 0.1 мкМ ЭБЛ по сравнению с контролем и ЭБЛ в концентрациях 1 и 10 нМ [8]. Брассинолид способствовал ускорению старения отделенных семядолей проростков огурца [9] и листьев пшеницы [10]. Было показано, что брассинолид способствовал опосредованному этиленом послеуборочному созреванию плодов томатов, увеличивая содержание растворимых сахаров, аскорбиновой кислоты, содержание ликопина, скорости дыхания и выработки этилена, но значительно снижал содержание хлорофилла по сравнению с контролем. При этом применение брассиназола – ингибитора биосинтеза брассиностероидов – задерживало созревание томатов [11]. В исследованиях по влиянию брассинолида на рост и развитие сои продемонстрировано замедление процесса опадения и пожелтения листьев при физиологическом старении растений. Анализ экспрессии генов белков семейства WRKY, участвующих в регуляции старения, показал снижение их активности при действии брассинолида [12]. Кроме того, важно учитывать зависимость эффекта брассиностероидов от возраста листьев. Было показано, что обработка брассиностероидами зрелых листьев папайи отсрочила их пожелтение и опадение, тогда как развитию старения более молодых листьев она не препятствовала [13]. По большей части исследование влияния брассиностероидов на старение проводится с применением гормонов лактонового ряда – брассинолида, 24-эпибрассинолида. Тогда как кастастерон и 24-эпикастастерон – представители кетонового ряда БС, предшественники БЛ и ЭБЛ, в данном аспекте изучены недостаточно [27].
Ведущая роль в функционировании ассимилирующих систем листа принадлежит фотосинтетическим пигментам. Содержание и соотношение разных групп пигментов отражает состояние фотосинтетического аппарата. Важной характеристикой фотосинтетической активности также является соотношение скорости образования новых и разрушение старых молекул хлорофилла. Последнее же напрямую зависит от физиологического состояния клетки и растения в целом. К условиям, снижающим фотосинтетическую активность, относится и старение. На пятые сутки инкубации листьев ячменя отмечено положительное влияние 1 мкМ 24-эпикастастерона на содержание фотосинтетических пигментов (табл. 2).
Хлорофиллы содержатся в составе фотосистем растений, и снижение их количества может значительно тормозить протекание фотохимических процессов. Оценка функционального состояния второй фотосистемы показала зависимость ее активности от старения. Так, к пятым суткам воздействия наблюдалось значительное снижение максимального и эффективного квантового выхода, плотности потока электронов, регулируемого рассеивания тепловой энергии, коэффициентов фотохимического и нефотохимического тушения электронов, а также доля открытых центров второй фотосистемы. При этом наблюдалось увеличение нерегулируемого рассеивания тепловой энергии (рис. 3а-з). Все это, несомненно, свидетельствует об угнетении активности фотосинтетического аппарата при старении.
ЭБЛ и ЭПК способствовали поддержанию ряда показателей на уровне выше суточного контроля к пятым суткам эксперимента. Величина эффективного квантового выхода, плотности потока электронов и доля открытых центров второй фотосистемы была выше как при обработке ЭБЛ, так и ЭПК в сравнении с суточным контролем (рис. 3б, д, е).
Чтобы избежать повреждений реакционных центров повышенной инсоляцией, растениям необходимо рассеивать в виде тепла часть энергии поглощенных квантов света. Такие процессы также активизируются, когда листья повреждены в результате действия других стрессовых факторов. Ведущую роль в этом процессе играют каротиноиды. Для оценки нефотохимического тушения флуоресценции используется параметр регулируемого рассеяния тепловой энергии (Y(NPQ)), служащий для оценки функционирования защитного механизма регуляции фотосинтеза от избыточного облучения. Исходя из полученных данных, 24-эпикастастерон влиял на поддержание данного показателя на уровне выше суточного контроля, тогда как ЭБЛ снижал его на пятые сутки (рис. 3в). Показатель, характеризующий нерегулируемое рассеивание тепловой энергии, повышался к пятым суткам во всех исследуемых вариантах в сравнении с исходной точкой эксперимента. При этом на пятый день воздействия гормональная обработка значительно снижала данный показатель относительного суточного контроля, а кетонсодержащий брассиностероид – ЭПК, в сравнении с лактонсодержащим – ЭБЛ, оказался более эффективен (рис. 3г).
В основе фотохимического тушения флуоресценции хлорофилла лежит тот факт, что, в зависимости от окислительно-восстановительного состояния первичного акцептора второй фотосистемы – пластохинона, уровень флуоресценции хлорофиллов может различаться в несколько раз: увеличиваться при восстановлении пластохинона и уменьшаться при его окислении. Для оценки доли окисленных пластохинонов используют коэффициент фотохимического тушения (qP). Чем выше значение qP, тем больше количество окисленных пластохинонов, а значит эффективность использования энергии света и пропускной способности фотосинтетической электрон-транспортной цепи достаточно высока для продуктивного функционирования фотосинтетического аппарата. При этом как 24-эпибрассинолид, так и 24-эпикастастерон повышали данный показатель уже на третьи сутки воздействия (рис. 3ж).
Старение способно вызывать разрушение хлоропластов. Во время деструкции пластид одновременно с уменьшением содержания хлорофиллов значительно понижается и содержание воды в листьях. Возникновение водного дефицита ведет к развитию осмотического стресса и, как следствие, к усилению генерации активных форм кислорода [28]. АФК обладают высокой реакционной способностью и могут окислять липиды, значительное количество которых содержится в клеточных мембранах [29]. При распаде жирных кислот, сопровождающим перекисное окисление липидов, первоначально образуются нестойкие и довольно быстро разрушающиеся диеновые коньюгаты [30]. Они быстро разрушаются с образованием вторичных продуктов, таких как малоновый диальдегид, составляющий основной компонент группы так называемых ТБК-активных веществ, которые взаимодействуют с тиобарбитуровой кислотой. Таким образом, нагрузка на фотосинтетический аппарат при старении значительно возрастает не только за счет АФК, образующихся в процессе фотосинтеза, но и за счет окислительного стресса, возникающего в клетках растений. Нами показано значительное увеличение ПОЛ к пятым суткам инкубации в контрольном варианте, при этом гормональная обработка способствовала снижению стрессорного воздействия на липидную мембрану, о чем свидетельствует уменьшение содержания ТБК-активных веществ в пробах. На основании описанных параметров можно сделать заключение об эффективности ЭБЛ и ЭПК в поддержании структуры фотосинтетического аппарата и фотосинтетической активности стареющих листьев ячменя (рис. 2).
Оценка уровня экспрессии гена старения HvS40 на пятые сутки инкубации показала снижение накопления его транскриптов при гормональной обработке, причем кетонсодержащий брассиностероид оказался более эффективен (рис. 4).
Полученные данные свидетельствую о том, что кетонсодержащий брассиностероид – 24-эпикастастерон – оказывает значительное физиологическое действие на растения. В условиях старения отделенных листьев как лактон-, так и кетонсодержащие брассиностероиды оказали протекторное действие, однако при обработке 24-эпикстастероном защитный эффект был выражен сильнее. На фотосинтетический аппарат брассиностероиды также оказали положительное влияние, поддерживая фотохимическую активность второй фотосистемы. Однако в отношении защиты фотосинтетического аппарата кетонсодержащий брассиностероид оказался эффективнее лактонсодержащего. Снижение накопления транскриптов гена HvS40 при действии брассиностероидов на 5 сутки может свидетельствовать о замедлении развития старения в сравнении с суточным контролем. При этом для большинства анализируемых параметров гормоны играли решающую роль к пятым суткам воздействия. Таким образом, кетонсодержащий брассиностероид, как предшественник лактонсодержащего брассиностероида, не менее эффективен, а в некоторых случаях биологически более активен в отношении исследуемых показателей.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, проект № 19-34-50076 мол_нр.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Woo H.R., Koo H.J., Kim J., Jeong H., Yang J.O., Lee H., Jun J.H., Choi S.H., Park S.J., Kang B., Kim Y.W., Phee B.K., Kim J.H., Seo C., Park C., Kim S.C., Park S., Lee B., Hwang D., Nam H.G., Lim P.O. Programming of plant leaf senescence with temporal and inter-organellar coordination of transcriptome in Arabidopsis // Plant physiology. 2016. V. 171. P. 452. https://doi.org/10.1104/pp.15.01929
Woo H.R., Kim H.J., Kim P.O., Nam H.G. Leaf senescence: systems and dynamics aspects // Annu Rev Plant Biol. 2019. V. 70. P. 347. https://doi.org/10.1146/annurev-arplant-050718-095859
Krieger-Liszkay A., Krupinska K., Shimakawa G. The impact of photosynthesis on initiation of leaf senescence // Physiologia plantarum. 2019. V. 166. № 1. P. 148. https://doi.org/10.1111/ppl.12921
Lakhvich F., Khripach V., Zhabinskii V. The synthesis pg brassinosteroids? A new class of plant hormones // Russian chemical reviews. 1991. V. 60. № 6. P. 658. https://doi.org/10.1070/RC1991v060n06ABEH001100
Khripach V., Zhabinskii V., Groot A. Twenty years of brassinosteroids: steroidal plant hormones warrant better crops for the XXI century // Annals of Botany. 2000. V. 86. № 3. P. 441. https://doi.org/10.1006/anbo.2000.1227
Литвиновская Р.П. Применение фитогормональных стероидов в технологии выращивания картофеля // Материалы всероссийской научно-практической конференции с международным участием “Актуальные проблемы картофелеводства: фундаментальные и прикладные аспекты”. Томск, 2018. С. 15.
Kanwar M.K., Bajguz A., Zhou J., Bhardwaj R.J. Analysis of brassinosteroids in plants // J Plant Growth Regul. 2017. V. 36. P. 1002. https://doi.orghttps://doi.org/10.1007/s00344-017-9732-4
Fedina E.O., Yarin A.Y., Mukhitova F.K., Blufard A.S., Chechetkin I.R. Brassinosteroid-induced changes of lipid composition in leaves of Pisum sativum L. during senescence // Steroids. 2017. V. 117. P. 25. https://doi.org/10.1016/j.steroids.2016.10.009
Zhao Y.J., Xu R.J., Luo W.H. Inhibitory effects of abscisic acid on epibrassinolide-induced senescence of detached cotyledons in cucumber seedlings // Chin. Sci. Bull. 1990. V. 35. P. 928.
Saglam-Cag S. The effect of epibrassinolide on senescence in wheat leaves // Biotechnology & Biotechnological Equipment. 2007. V. 21. P. 63. https://doi.org/10.1080/13102818.2007.10817415
Zhu T., Tan W.-R., Deng X.-G., Zheng T., Zhang D.-W., Lin H.-H. Effects of brassinosteroids on quality attributes and ethylene synthesis in postharvest tomato fruit // Postharvest Biology and Technology. 2015. V. 100. P. 196. https://doi.org/10.1016/j.postharvbio.2014.09.016
Yin W., Yin Y., Dong N., Niu M., Zhang X., Li L., Liu J., Liu B., Tong H. Brassinosteroid-regulated plant growth and development and gene expression in soybean // The Crop Journal. 2019. V. 7. P. 411. https://doi.org/10.1016/j.cj.2018.10.003
Assis-Gomes M.D., Pinheiro D.T., Bressan-Smith R.E., Campostrini E. Exogenous brassinosteroid application delays senescence and promotes hyponasty in Carica papaya L. leaves // Theor. Exp. Plant Physiol. 2018. V. 30. P. 193. https://doi.org/10.1007/s40626-018-0114-5
Chory J., Nagpal P., Peto C.A. Phenotypic and genetic analysis of det2, a new mutant that affects light-regulated seedling development in Arabidopsis // The Plant Cell. 1991. V. 3. P. 445. https://doi.org/10.1105/tpc.3.5.445
Ефимова М.В., Кузнецов В.В., Кравцов А.К., Барташевич Д.А., Карначук Р.А., Ковтун И.С., Кузнецов Вл.В. Особенности экспрессии пластидного генома и развития растений Arabidopsis thaliana с нарушенным синтезом брассиностероидов // Физиология растений. 2012. Т. 59. С. 32.
Ефимова М.В., Литвиновская Р.П., Медведева Ю.В., Мурган О.К., Савчук А.Л., Кузнецов Вл.В., Хрипач В.А. Содержание и баланс эндогенных брассиностероидов у микроклонов картофеля определяется органоспецифичностью и скороспелостью сорта // Доклады академии наук. 2019. Т. 485. № 1. С. 117. https://doi.org/10.31857/S0869-56524851117-121
Кулаева О.Н. Цитокинины их структура и функция. Москва: Наука, 1973. 264 с.
Buege J.A., Aust S.D. Microsomal lipid peroxidation // Methods Enzymol. 1978. V. 52. P. 302.
Lichtenthaler H.K. Chlorophylls and carotenoids, the pigments of photosynthetic biomembranes // Methods enzymology. 1987. V. 148. P. 350. https://doi.org/10.1016/0076-6879(87)48036-1
Pfundel E. Junior-PAM Chlorophyll fluorometer: Operator’s guide // Germany, Heinz Walz GmbH. 2007. P. 58.
Ковтун И.С., Ефимова М.В. Особенности подбора праймеров конститутивного гена для проведения полимеразной цепной реакции после обратной транскрипции // Вестник Томского государственного университета. Биология. 2013. № 2 (22). С. 160.
Hua W., Zhu J., Shang Y., Wang J., Jia Q., Yang J. Identification of suitable reference genes for barley gene expression under abiotic stresses and hormonal treatments // Plant Mol. Boil. Rep. 2015. V. 33. P. 1002. https://doi.org/10.1007/s11105-014-0807
Kolomeichuk L.V., Efimova M.V., Zlobin I.E., Kreslavski Vl.D., Murgan O.K., Kovtun I.S., Khripach Vl.A., Kuznetsov Vl.V., Allakhverdiev S.I. 24-Epibrassinolide alleviates the toxic effects of NaCl on photosynthetic processes in potato plants // Photosynth. Res. 2020. V. 146. P. 151. https://doi.org/10.1007/s11120-020-00708-z
Castorina G., Consonni G. The role of brassinosteroids in controlling plant height in Poaceae: a genetic perspective // International journal of molecular sciences. 2020. V. 21. P. 1191. https://doi.org/10.3390/ijms21041191
Clouse S.D. Brassinosteroid signal transduction: from receptor kinase activation to transcriptional networks regulating plant development // Plant Cell. 2011. V. 23. P. 1219. https://doi.org/10.1105/tpc.111.084475
Nolan T., Chen J., Yin Y. Cross-talk of Brassinosteroid signaling in controlling growth and stress responses // Biochem. J. 2017. V. 474. P. 2641. https://doi.org/10.1042/BCJ20160633
Xu Y., Li K., Zhu K., Tian Y., Yu Q., Zhang W., Wang Z. Effect of exogenous plant hormones on agronomic and physiological performance of a leaf early-senescent rice mutant osled // Plant Growth Regulation. 2020. V. 92. P. 517. https://doi.org/10.1007/s10725-020-00653-w
Sharma A., Shahzad B., Kumar V., Kohli S.K., Sidhu G.P.S., Bali A.S., Handa N., Kapoor D., Bhardwaj R., Zheng B. Phytohormones regulate accumulation of osmolytes under abiotic stress // Biomolecules. 2019. V. 9. № 7. P. 285. https://doi.org/10.3390/biom9070285
Rasool S., Hameed A., Azooz M.M., Rehman M., Siddiqi T.O., Ahmad P. Salt stress: causes, types and responses of plants // Ecophysiology and responses of plants under salt stress. Springer, New York, NY. 2013. P. 1.
Alche J.D. A concise appraisal of lipid oxidation and lipoxidation in higher plants // Redox biology. 2019. V. 23. P. 1. https://doi.org/10.1016/j.redox.2019.101136
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


