Физиология растений, 2021, T. 68, № 5, стр. 489-500
Особенности экспрессии гена uidA под управлением тканеспецифичных промоторов генов AP3 и RPT2a Arabidopsis thaliana L. в трансгенных растениях Nicotiana tabacum L.
Ю. В. Сидорчук a, *, Т. В. Маренкова a, В. В. Кузнецов a, И. М. Герасименко b, Ю. В. Шелудько b, Е. В. Дейнеко a
a Федеральное государственное бюджетное научное учреждение “Федеральный исследовательский центр
Институт цитологии и генетики Сибирского отделения Российской академии наук”
Новосибирск, Россия
b Технический университет Дармштадта, факультет биологии, группа биотехнологии растений и метаболической инженерии
Дармштадт, ФРГ
* E-mail: sidorch@bionet.nsc.ru
Поступила в редакцию 05.09.2020
После доработки 03.11.2020
Принята к публикации 03.11.2020
Аннотация
Исследованы особенности экспрессии репортерного гена uidA, кодирующего фермент β-глюкуронидазу, под управлением тканеспецифичных промоторов генов AP3 и RPT2a Arabidopsis thaliana L. в гомозиготных моноинсерционных трансгенных растениях Nicotiana tabacum L. Оба используемых промотора обеспечивали экспрессию репортерного гена в меристематических тканях растений табака, хотя для промотора AP3 выявленный тип экспрессии является эктопическим. В исследованных группах независимых трансформантов и их гибридах выявлена широкая вариабельность как по накоплению мРНК, так и по ферментативной активности β-глюкуронидазы. Показано, что уровень накопления транскрипта репортерного гена uidA не коррелирует с уровнем ферментативной активности его продукта. Выявленная вариабельность среди анализируемых трансгенных растений табака вероятнее всего связана с особенностями организации хроматина в районах Т-ДНК инсерций и (или) обусловлена различным характером взаимодействий между цис-элементами исследуемых промоторов и растительными регуляторными элементами, расположенными вне района Т-ДНК инсерции. По результатам биоинформатического анализа в структуре исследуемых промоторов выявлено около 20-ти цис-регуляторных элементов, часть из которых обнаруживались в обоих исследуемых промоторах. В целом результаты анализа показали, что промоторы генов AP3 и RPT2a A. thaliana могут быть эффективны в качестве регуляторных элементов для экспрессии трансгенов в меристематических тканях других видов растений, в частности, N. tabacum.
ВВЕДЕНИЕ
Современные технологии модификации растений, направленные на улучшение хозяйственно-ценных признаков важных сельскохозяйственных культур, предполагают использование двух основных подходов – трансгенез и геномное редактирование. В случае создания трансгенных растений в растительный геном вводятся фрагменты экзогенных ДНК, включающие гены из различных гетерологичных систем, в случае редактирования – гены, кодирующие белки с нуклеазной активностью. Успешность применения этих подходов в значительной степени зависит от наличия в арсенале исследователей достаточно большого набора регуляторных генетических элементов, в том числе и промоторов, используемых для создания генно-инженерного инструментария. В настоящее время для этих целей применяют промоторы, различающиеся по проявляемой ими активности, например, конститутивные, индуцибельные, тканеспецифичные [1–4]. Использование тканеспецифичных промоторов представляет особый интерес для исследователей, поскольку их применение дает возможность выявлять функционирование генов в определенных типах тканей, а также направленно экспрессировать в них чужеродные целевые гены [1, 4, 5]. Применение данного подхода основано на консервативности регуляторных элементов, детерминирующих экспрессию генов в каком-либо типе тканей растения. Этот факт предполагает возможность использовать их для регуляции экспрессии чужеродного гена в аналогичном типе тканей других видов растений. Поиск новых тканеспецифичных промоторов и оценка активности их экспрессии в гетерологичных растительных геномах с помощью репортерных генов является важным этапом при создании трансгенных растений с заданными хозяйственно-ценными признаками [6–8].
Тканеспецифичные промоторы, обеспечивающие экспрессию целевых генов в меристематических тканях растений, представляют особый интерес для биотехнологии, в частности, при культивировании активно делящихся клеток – продуцентов рекомбинантных белков. Ген APETALA3 (AP3) экспрессируется в цветочных меристемах A. thaliana и кодирует фактор транскрипции группы В, регулирующий развитие цветка [9, 10]. Ген RPT2a кодирует АТФазу в составе 19S регуляторной субъединицы 26S протеасомы A. thaliana и экспрессируется преимущественно в апикальных меристемах корня и стебля [6, 11]. Представляет интерес исследование возможности применения промоторов этих генов в генетических конструкциях в качестве регуляторных элементов и оценка особенности их регуляции в гетерологичных системах. Целью данной работы было выявление особенностей экспрессии гена uidA под управлением тканеспецифичных промоторов генов AP3 и RPT2a A. thaliana в трансгенных растениях N. tabacum.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. В качестве исходного материала использовали моноинсерционные гомозиготные (Т2) трансгенные растения табака (N. tabacum L., сорт Petit Havana, линия SR1) и их гибриды (F1). Исходные трансформанты (Т0) табака были получены нами ранее методом агробактериального переноса двух генетических конструкций на основе вектора pBIN19 [12]. Генетические конструкции включали репортерный ген uidA под управлением промотора гена AP3 или гена RPT2a. Промотор гена AP3 длиной 620 п.н. от точки старта транскрипции в сочетании с 5'-НТР ВТМ (5'-нетранслируемый район вируса табачной мозаики), а также промотор и 5'-НТР гена RPT2a длиной 1667 п.н. от стартового кодона были амплифицированы с геномной ДНК A. thaliana. В работе были проанализированы потомки Т2 7-ми независимо полученных моноинсерционных линий с промотором гена AP3 (линии а1–а7) и 8-ми – с промотором гена RPT2a (линии r1–r8).
Отбор моноинсерционных гомозиготных линий проводили с использованием общепринятого теста на устойчивость к антибиотику канамицину в поколениях T1 и T2. Для получения семян от самоопыления и последующего их анализа соцветия трансформантов предварительно изолировали пергаментными колпачками. Собранные отдельно из каждой коробочки семена анализировали по устойчивости к селективному агенту при посеве на стандартную агаризованную MС-среду с добавлением антибиотика канамицина в концентрации 200 мг/л. В Т1 для дальнейшего анализа отбирали генотипы с расщеплением по устойчивости к канамицину 3Кm+:1Кm- (зеленые : белые), что свидетельствовало об единичной инсерции трансгена. Устойчивые к антибиотику генотипы выращивали в теплице, самоопыляли для получения поколения Т2 и вновь тестировали по устойчивости к антибиотику. Моноинсеционные гомозиготные растения Т2, не дающие расщепления (все зеленые) на среде с канамицином, использовали для изучения особенностей экспрессии uidA-гена под управлением исследуемых тканеспецифичных промоторов. Гибриды F1 между моноинсерционными гомозиготными растениями получали с помощью искусственного опыления путем нанесения пыльцы на пестики предварительно изолированных и кастрированных цветков в соответствии с типом изучаемого промотора.
Растения выращивали в условиях гидропонной теплицы с фотопериодом 16/8 ч и при температуре 22/18°C (день/ночь).
Гистохимическое выявление экспрессии гена uidA в тканях трансгенных растений табака (GUS-окрашивание). Для выявления особенностей экспрессии гена uidA под управлением исследуемых промоторов в цветках в качестве модели использовали бутоны трансгенных растений табака на стадиях развития II, IV и VI согласно классификации по Koltunow с соавт. [13]. Для анализа особенностей экспрессии гена uidA в апикальных меристемах корня и стебля моноинсерционных гомозиготных растений Т2 и их гибридов F1 использовали 6-ти недельные растения табака. Для этого стерилизованные 96%-ным этанолом семена с последующей их двукратной промывкой стерильной дистиллированной водой высевали на агаризованную МС-среду с добавлением антибиотика канамицина (200 мг/л). Растения выращивали из семян в условиях факторостатной комнаты при освещении 10 клк, фотопериоде 16/8 ч (день/ночь) и температуре 24°C. Окрашивание бутонов и растений в возрасте 6-ти недель проводили в реакционной смеси следующего состава: 100 мМ фосфатный буфер (pH = 7.0), 10 мМ EDTA, 0.1% Triton X100 и 1 мМ X-Gluc (Fermentas, США). Для улучшения качества окрашивания свежий растительный материал в реакционной смеси помещали в камеру генной пушки (PSD-1000/He, Biorad, США) и удаляли воздух с помощью вакуумирования. Обработанный таким образом материал оставляли на ночь в термостате при температуре 37°C. После окрашивания материал отмывали от хлорофилла 70%-ным этанолом.
Количественное определение активности репортерного белка β-глюкуронидазы (GUS). Измерение активности GUS в экстрактах растений табака проводили в соответствии со стандартной методикой [14]. Для получения белковых экстрактов 6-ти недельные растения (общей массой около 150 мг) гомогенизировали в 200 мкл экстракционного буфера следующего состава: 50 мМ NaH2PO4, pH 7.0, 10 мМ ЭДТА, 0.1% Triton X-100, 0.1% лауроилсаркозин натриевая соль, 10 мМ β-меркаптоэтанол. Флуоресценцию измеряли на флуориметре Victor3 1420 (“Perkin Elmer”, США) при длине волны возбуждения 355 нм и длине волны испускания 455 нм. Калибровку флуоресценции проводили с помощью стандартного раствора 1 mM 4-метилумбеллиферона (4-MU, Sigma-Aldrich, США) в 0.2 M Na2CO3. Активность β-глюкуронидазы рассчитывали после определения общего растворимого белка в экстрактах по методу Bradford [15] с использованием раствора БСА в экстракционном буфере в качестве стандарта. Измерения проводили в 3 биологических повторностях. Для выявления различий между группами применяли непараметрический дисперсионный анализ Краскела-Уоллиса (программный пакет Statistica 5.5). Критическое значение уровня значимости принималось равным 5%.
Анализ экспрессии гена uidA. Суммарную РНК выделяли из тканей 6-ти недельных растений с помощью набора реактивов RNАeasy® Plant Mini Kit (Quiagen, Германия), РНК обрабатывали DNase I и 4 µg РНК брали для синтеза кДНК (Thermo Scientific RevertAid First Strand cDNA Synthesis Kit, США).
Анализ экспрессии гена uidA проводили при помощи ПЦР в реальном времени на амплификаторе CFX96 (Bio-Rad, США). Структура праймеров и зондов следующая:
gsp_прямой – 5'-TGGAAACTTTAGGGTCCTTACTAC-3',
gsp_обратный – 5'-CAAGCCTTGTAGTGAGCATCTG-3',
gsp_зонд — 5'-FAM‑ATGACTTATCCGCTCCAGCACCAC-BHQ1-3';
uidA_прямой – 5'-CTTCCATGATTTCTTTAACTATGC-3',
uidA_обратный – 5'-GCACAGTTCATAGAGATAACC -3',
uidA_зонд — 5'-FAM‑TACACCACGCCGAACACCTG-BHQ1-3'.
Программа амплификации: 95°С – 3 мин, далее 5 циклов без детекции (95°С – 10 сек, 61°С – 20 сек, 72°С – 5 сек); затем 40 циклов с детекцией на стадии отжига (канал FAM): 95°С – 10 сек, 61°С – 20 сек, 72°С – 5 сек. Каждый образец амплифицировали в трех аналитических повторностях. Уровень экспрессии оценивали при помощи ПО “Bio-Rad CFX Manager 2.1”. Уровень экспрессии гена uidA выражали в процентах относительно экспрессии гена GSP табака, кодирующего глутаминсинтетазу.
Биоинформатический анализ тканеспецифических промоторов генов AP3 и RPT2a A. thaliana. Для предварительной обработки и анализа нуклеотидных последовательностей с использованием общедоступных баз данных использовали онлайн ресурсы Blast (https://blast.ncbi.nlm.nih.gov/Blast. cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch& LINK_LOC=blasthome) и Clustalo (https://www. ebi.ac.uk/Tools/msa/clustalo). Для биоинформатического анализа нуклеотидных последовательностей исследуемых промоторов использовали программы PLACE (https://sogo.dna.affrc.go.jp/cgi-bin/s ogo.cgi?lang=en&pj=640&action=page&page=newplace), PlantCARE (http://bioinformatics.psb.ugent. be/webtools/plantcare/html) в соответствии с руководством и рекомендациями разработчиков, а также TSSP и Softberry (http://www.softberry.com/ berry.phtml?topic=tssp&group=programs&subgroup= promoter).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Особенности экспрессии uidA гена в различных тканях трансгенных растений табака. Результаты сравнительного анализа особенностей экспрессии гена uidA под управлением промоторов тканеспецифичных генов AP3 и RPT2a на модели цветков трансгенных растений табака на стадиях развития II, IV и VI представлены на рис. 1. Интенсивность и локализация гистохимического окрашивания элементов цветка и околоцветника в анализируемых группах трансгенных растений существенно различалась, что свидетельствовало об особенностях функционирования исследуемых регуляторных элементов. В цветках растений табака, у которых uidA ген находился под управлением промотора гена AP3, на всех исследуемых стадиях развития (рис. 1) синее GUS-окрашивание гистохимически выявлялось во всех элементах цветка (за исключением тычиночных нитей). Интенсивность окрашивания цветков у 7-ми независимо полученных трансгенных растений табака варьировала, однако характер окрашивания элементов развивающихся цветков и околоцветников в целом оставался одинаковым.
Рис. 1.
Особенности гистохимического GUS-окрашивания тканей цветков на трех стадиях их развития у трансгенных растений табака с геном uidA под управлением тканеспецифичных промоторов генов AP3 и RPT2a A. thaliana. Масштабная линейка – 5 мм.

Ген AP3 согласно ABC-модели флорального морфогенеза в цветках A. thaliana кодирует транскрипционный фактор группы В и экспрессируется только в лепестках и тычинках [9, 16]. Наличие GUS-окрашивания во всех остальных частях цветка и околоцветника носит эктопический характер. Ранее анализ активности промотора гена AP3 по характеру распределения GUS-окрашивания был проведен на примере трансгенных растений A. thaliana, то есть в его исходном генетическом окружении, и эктопической экспрессии обнаружено не было [10, 17]. Более того, было показано, что длина минимального промотора, обеспечивающего корректную по времени и месту локализации экспрессию репортерного гена uidA в трансгенных растениях A. thaliana, находится в границах 556 – 727 п.н. от точки старта транскрипции [10]. В соответствии с этим клонированный нами фрагмент промотора длиной 620 п.н. от точки старта транскрипции должен содержать набор цис-регуляторных элементов, необходимых для корректной экспрессии репортерного гена. Тем не менее, регуляция экспрессии факторов транскрипции генов флорального морфогенеза весьма сложна. Известно, что положительным активатором транскрипции гена AP3, например, является ген идентичности флоральной меристемы AP1 [16]. Предполагается, что AP1 может действовать в комбинации с другими кофакторами для подавления эктопической экспрессии AP3 в первом и четвертом кругах флоральной меристемы, возможно, путем прямого связывания с блоком CArG 3 [10]. В геноме табака обнаружено как минимум два AP1-подобных гена, экспрессирующихся в цветках [7]. Вполне возможно, что данные транскрипционные факторы табака по каким-то причинам не взаимодействуют с используемым нами фрагментом промотора гена AP3 A. thaliana и, соответственно, не могут ограничить его транскрипционную активность только правильными, 2-м и 3-м кругами флоральной меристемы. Однако данное предположение требует дополнительных исследований.
Можно допустить также, что эктопический характер GUS-окрашивания в исследованных нами растениях объясняется использованием омега-лидерной последовательности ВТМ [18] вместо нативного 5'-НТР гена AP3 A. thaliana. Эта замена была предпринята с целью усиления уровня трансляции трансгена, однако известно, что в ряде случаев тканеспецифичность накопления белка определяется не только на транскрипционном, но и на трансляционном уровне [19].
В цветках растений табака c геном uidA под управлением промотора гена RPT2a на всех исследуемых стадиях развития GUS-окрашивание выявлялось в цветоножке и цветоложе, и очень слабое – в развивающихся лепестках (рис. 1). Окрашивание таких элементов цветка как пестик, завязь, тычинки и тычиночные нити отсутствовало. Слабый характер окрашивания отдельных элементов цветка, либо полное отсутствие окрашивания, было характерно для всех 8-ми независимо полученных трансгенных растений табака.
Ген RPT2a, кодирующий АТФазу в составе 19S регуляторной субъединицы 26S протеасомы у A. thaliana, необходим для поддержания клеточной организации апикальных меристем вегетативных тканей [6, 11]. Его действие заключается в регулировании времени и направления деления клеток как в меристемах побегов, так и в меристемах корней [11]. Кроме того, показано, что RPT2a ингибирует переход от митоза к эндоредупликации в контрольной точке G2/M клеточного цикла [6].
Известно, что в геноме A. thaliana RPT2 АТФаза 19S регуляторной субъединицы 26S протеасомы кодируется двумя дуплицированными генами RPT2a и RPT2b. Транскрипты этих генов обнаруживаются в самых различных тканях и органах, включая стебли, листья, корни и даже цветочные бутоны, а их белковые продукты обладают высокой степенью гомологии и различаются всего тремя аминокислотными остатками [6, 11]. Таким образом, RPT2a и RPT2b промоторы A. thaliana обеспечивают определенный уровень экспрессии гена uidA и после превращения вегетативной меристемы в генеративную, что позволяет объяснить наличие GUS-окрашивания в отдельных элементах цветка и околоцветника у трансгенных растений табака.
На рис. 2 представлены результаты сравнительного анализа GUS-окрашивания трансгенных растений табака, различающихся между собой по двум типам промоторов генов AP3 и RPT2a A. thaliana. Гистохимическое окрашивание выявлялось в апикальных меристемах стебля, вдоль листовых жилок семядолей и первых настоящих листьев (рис. 2а–г; е–и). Ткани гипокотиля у моноинсерционных гомозиготных растений, за редким исключением (рис. 2з), не окрашивались. Также GUS-активность выявлялась во вторичных меристемах зон ветвления корней, в меристемах кончиков корней и в тканях корня, иногда захватывая зону корневых волосков (рис. 2к–н).
Рис. 2.
Особенности гистохимического окрашивания тканей у двух групп трансгенных растений табака с геном uidA под управлением тканеспецифичных промоторов генов AP3 и RPT2a A. thaliana. (а) – (в), (к), (л) – растения AP3; (г) – гибрид F1AP3; (е) – (з), (м), (н) – растения RPT2a; (и) – гибрид F1RPT2a; (д) – нетрансгенный контроль SR1. Масштабная линейка – 3 мм.

Интересен тот факт, что несмотря на вариабельность GUS-окрашивания у независимых трансформантов и их гибридных комбинаций, наблюдаемая картина была схожа для обеих групп исследуемых растений табака. Однако, если для промотора гена RPT2a наблюдаемый тип экспрессии uidA гена является нормой, то для промотора гена AP3, кодирующего фактор транскрипции флорального морфогенеза A. thaliana, экспрессия в меристемах и тканях вегетативных органов является эктопической. У мутанта A. thaliana по гену CLF (curly leaf), относящегося к семейству генов polycomb, наличие транскрипта AP3 детектировалось в листьях [20]. Тем не менее выявленный нами тип эктопического проявления гена uidA под управлением промотора гена AP3 ранее описан в литературе не был.
Показано, что распределение GUS-активности в трансгенных растениях A. thaliana детерминируемой геном uidA под управлением RPT2a и RPT2b промоторов в целом является сходным и отражает локализацию мРНК. Тем не менее, RPT2a промотор обеспечивает более высокую активность репортерного гена в меристемах побегов, а RPT2b – в меристемах побегов и корней [6]. Таким образом, результаты, полученные нами на модели трансгенных растений табака, в которых ген uidA находился под управлением промотора RPT2a, совпадают с результатами, полученными на модели трансгенных растений A. thaliana.
Согласно суммированным данным, представленным в табл. 1, применение промотора гена AP3 в сочетании с 5'-НТР ВТМ в гетерологичной системе (в геноме табака) приводит к экспрессии репортерного гена практически во всех элементах цветка и околоцветника, а также в стеблевых и корневых меристемах растений. Промотор гена RPT2a, напротив, в гетерологичной системе экспрессии высоко активен только в стеблевых апикальных меристемах, менее активен в корневых меристемах, а в цветке обеспечивает экспрессию репортерного гена только в определенных частях (цветоножка, цветоложе и лепестки).
Таблица 1.
Специфичность экспрессии гена uidA в тканях и органах трансформантов табака.
| Промотор | Меристемы | Элементы цветка и околоцветника | ||||||
|---|---|---|---|---|---|---|---|---|
| цветоножка и цветоложе | чашелистики | лепестки | тычинки | пестик | завязь | |||
| стеблевая | корневая | |||||||
| AP3 | + | + | + | + | + | + | + | + |
| RPT2a | + | + | + | – | + | – | – | – |
Таким образом, результаты сравнительного анализа гистохимического GUS-окрашивания тканей цветков двух групп трансгенных растений табака с геном uidA под управлением тканеспецифичных промоторов генов AP3 и RPT2a A. thaliana показали, что узкая специфичность регуляторных элементов не всегда эффективно сохраняется при их сочетании с альтернативными 5'-НТР и/или переносе в новое генетическое окружение других видов растений. При этом можно предположить, что изменение специфичности промотора, как показано нами на примере промотора AP3, может служить расширению возможностей его использования в гетерологичных системах экспрессии, что находит подтверждение и в других исследованиях [21].
Поскольку оба исследуемых промотора генов AP3 и RPT2a A. thaliana были способны сохранять свои функции в геноме трансгенных растений табака, причем активность промотора гена AP3 проявлялась как эктопическая, представляло интерес провести сравнительный анализ эффективности экспрессии гена uidA под управлением этих промоторов в меристемах стебля и корня. Для этого была проведена оценка активности фермента β-глюкуронидазы в меристемах трансгенных растений табака.
Сравнительный анализ активности β-глюкуронидазы в меристемах трансгенных растений табака. Результаты сравнительного анализа по активности β-глюкуронидазы в меристемах Т2-потомков от самоопыления независимо полученных трансгенных растений табака с одной инсерцией гена uidA под управлением промоторов генов AP3 и RPT2a представлены на рис. 3.
Рис. 3.
Активность β-глюкуронидазы в меристемах трансгенных растений табака с геном uidA под управлением тканепецифичных промоторов A. thaliana. a1–a7 – ген uidA под управлением промотора гена AP3; r1–r8 – ген uidA под управлением промотора гена RPT2a.
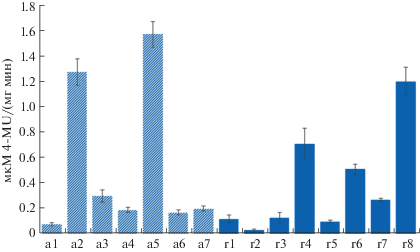
Как видно на рис. 3, для обеих анализируемых групп растений характерна широкая вариабельность по активности β-глюкуронидазы. В тканях растений табака с геном uidA под управлением промотора AP3 выявлены 20-ти кратные превышения максимальных значений по активности анализируемого фермента (1.57 ± 0.10 мкМ 4-MU/ (мг мин) для растения а5) над минимальными (0.08 ± 0.01 для растения а1). Еще более значительные отличия по анализируемому признаку были выявлены для растений табака с геном uidA под управлением промотора RPT2a. Так, например, максимальное значение активности у растения r8 составило 1.20 ± 0.11, а минимальное у растения r2 – 0.03 ± ± 0.01 мкМ 4-MU/ (мг мин), с превышением максимального значения активности фермента по сравнению с минимальным в 40 раз. Согласно критерию Краскела-Уоллиса, для непараметрического сравнения данных по активности фермента между исследуемыми группами растений достоверных отличий (H (1; N = 15) = 0.4821442, p = 0.4875) не выявлено.
Полученные результаты свидетельствуют о том, что оба промотора в целом c одинаковой эффективностью обеспечивают наработку транскрипта исследуемого репортерного гена uidA и могут быть использованы в качестве регуляторных элементов для экспрессии трансгенов в меристематических тканях растений. Несмотря на эктопический характер экспрессии, промотор гена AP3 A. thaliana с успехом может быть использован при создании генно-инженерных векторов для экспрессии целевых генов в стеблевых и корневых меристемах.
Наблюдаемая вариабельность по активности β-глюкуронидазы у анализируемых трансгенных растений табака может быть связана с различными факторами, в частности, с особенностями организации хроматина в районах встройки Т-ДНК, организацией самих инсерций и их копийности. Вариабельность по экспрессии трансгенов, интегрированных в разные районы генома, продемонстрирована во многих работах [22–24]. Достоверное увеличение активности β-глюкуронидазы в тканях трансгенных растений табака при объединении в геноме двух копий гена uidA под управлением конститутивного 35S промотора вируса мозаики цветной капусты было показано нами ранее [25]. В связи с этим представляло интерес проанализировать взаимосвязь между активностью фермента β-глюкуронидазы и количеством мРНК, транскрибируемой с uidA гена, не только у гомозиготных трансгенных растений, различающихся по активности фермента, но и у гибридов между ними.
Анализ взаимосвязи активности β-глюкуронидазы с накоплением мРНК в меристемах трансгенных растений табака. Результаты количественного анализа мРНК, транскрибируемой с uidA гена под управлением двух исследуемых тканеспецифичных промоторов, и активности его белкового продукта у независимо полученных трансгенных растений табака, а также гибридов между ними, представлены в табл. 2. Сопоставляя полученные данные, следует отметить отсутствие очевидной прямой взаимосвязи между этими параметрами, то есть ферментативная активность белка GUS не коррелирует с наблюдаемыми флуктуациями по экспрессии соответствующего транскрипта.
Таблица 2.
Характеристика трансгенных растений табака с геном uidA по накоплению мРНК и активности β‑глюкуронидазы.
| Моноинсерционные гомозиготные растения и их гибриды F1 | Количество мРНК гена uidA, % | Активность β-глюкуронидазы, мкМ 4-MU/ (мг мин) |
|---|---|---|
| a1 | 7.5 ± 0.6 | 0.08 ± 0.01 |
| a2 | 102.1 ± 12.1 | 1.27 ± 0.10 |
| a3 | 19.8 ± 4.2 | 0.30 ± 0.05 |
| a4 | 31.2 ± 4.9 | 0.19 ± 0.02 |
| a5 | – | 1.57 ± 0.10 |
| a6 | – | 0.17 ± 0.02 |
| a7 | – | 0.20 ± 0.02 |
| F1 a3 × a4 | 58.8 ± 4.8 | 0.36 ± 0.05 |
| F1 a2 × a4 | 72.8 ± 7.0 | 0.44 ± 0.03 |
| F1 a2 × a3 | 84.8 ± 8.6 | 0.31 ± 0.01 |
| F1 a1 × a2 | 343.2 ± 41.0 | 0.42 ± 0.03 |
| F1 a1 × a4 | 36.8 ± 5.9 | 0.15 ± 0.03 |
| F1 a1 × a3 | 79.9 ± 6.0 | 0.25 ± 0.05 |
| r1 | – | 0.12 ± 0.03 |
| r2 | – | 0.03 ± 0.01 |
| r3 | – | 0.13 ± 0.04 |
| r4 | 161.6 ± 22.4 | 0.71 ± 0.12 |
| r5 | – | 0.10 ± 0.01 |
| r6 | – | 0.51 ± 0.04 |
| r7 | 37.7 ± 2.6 | 0.27 ± 0.01 |
| r8 | – | 1.20 ± 0.11 |
| F1 r4 × r7 | 90.7 ± 1.2 | 0.80 ± 0.09 |
В качестве примера на рис. 4 представлены данные сравнительного анализа накопления мРНК гена uidA и активности фермента β-глюкуронидазы в тканях 6-ти недельных трансгенных растений табака, контрастно различающихся по экспрессии репортерного гена, а также в тканях гибридов F1, полученных от их скрещивания.
Рис. 4.
Сравнительный анализ накопления мРНК гена uidA и активности β-глюкуронидазы в трансгенных растениях табака и гибридах F1 от их скрещивания. (а), (в) – количество мРНК, % от мРНК гена GSP; (б), (г) – активность β-глюкуронидазы, мкМ 4-MU/ (мг мин). Обозначения: а1, а2 – uidA под управлением промотора ap3, F1 (а1 × а2) – гибрид от скрещивания а1 и а2; r4, r7 – uidA под управлением промотора RPT2a, F1 (r4 × r7) – гибрид от скрещивания r4 и r7.
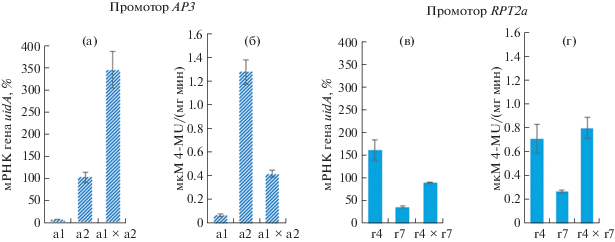
В случае использования промотора AP3 низкий уровень накопления мРНК в тканях моноинсерционных гомозиготных растений линии а1 (7.50 ± 0.60%) соответствовал низкой активности фермента (0.08 ± 0.01 мкМ 4-MU/ (мг мин)), в то же время более высокий уровень мРНК у растений а2 (102.10 ± 12.10%) коррелировал с более высокими значениями ферментативной активности (1.27 ± ± 0.10 мкМ 4-MU/ (мг мин)). Аналогичная ситуация наблюдалась и в случае использования промотора RPT2a (рис. 4). Более низкому значению накопления мРНК (37.70 ± 2.60%) у растений линии r7 соответствовала и низкая активность фермента (0.27 ± 0.01 мкМ 4-MU/ (мг мин)), а более высокому уровню мРНК (161.60 ± ± 22.40%) у растений линии r4 соответствовала более высокая активность фермента (0.71 ± ± 0.12 мкМ 4-MU/ (мг мин)). Однако при объединении двух независимых инсерций Т-ДНК в геноме гибридных растений подобной корреляции между уровнем накопления транскрипта и ферментативной активностью не наблюдалось. Так, у гибридных растений F1 (а1 × а2) с промотором гена AP3 уровень экспрессии uidA-гена по накоплению мРНК значительно превысил этот показатель у родительских форм (343.20 ± 41.00%), в то же время активность β-глюкуронидазы заняла лишь промежуточное положение (0.42 ± 0.03 мкМ 4-MU/ (мг мин)), существенно уступив одной из родительских форм (табл. 2; рис.4а, б). При объединении двух uidA генов под управлением промотора гена RPT2a в гибридном геноме (F1 r4 × r7) активность β-глюкуронидазы, напротив, незначительно возрастала, превысив показатели родительских форм (0.80 ± 0.09 мкМ 4-MU/ (мг мин)), на фоне промежуточных значений (90.70 ± 1.20%) уровня мРНК (табл. 2; рис.4в, г).
Поскольку анализируемые трансгенные растения представляли собой потомство Т2 моноинсерционных гомозигот, полученных в результате интеграции единичных инсерций Т-ДНК в случайные районы растительного генома, наблюдаемый позиционный вклад области интеграции Т-ДНК в геном трансгенного растения сопровождался различной транскрипционной активностью трансгенов в составе инсерции [22, 24]. Однако наблюдаемые нами несоответствия между уровнями мРНК и их белковых продуктов свидетельствуют о существовании сложных и все еще мало изученных механизмов декодирования генома. Дальнейшая судьба любого транскрипта может определяться многочисленными регуляторными элементами, скрытыми в их нуклеотидных контекстах [26]. В настоящий момент поиск таких регуляторных элементов и проверка их активности является весьма важной задачей, поскольку позволяет создавать синтетические промоторы, адаптированные под конкретные биоинженерные задачи, а также исследовать тонкие настройки генной экспрессии как на транскрипционном, так и на трансляционном уровнях [4, 26–28].
Сравнительный анализ нуклеотидных последовательностей тканеспецифичных промоторов генов AP3 и RPT2a A. thaliana. Важную роль в обеспечении специфичности функционирования промотора любого гена играют цис-регуляторные элементы, представляющие собой короткие нуклеотидные последовательности, входящие в его структуру и обеспечивающие взаимодействие с различными транскрипционными факторами, в том числе и в ответ на воздействие внешних факторов среды [1, 2, 27]. При случайной интеграции Т-ДНК инсерций в различные районы чужеродного генома взаимодействие регуляторных элементов трансгена и транскрипционных факторов в районе интеграции инсерции может изменяться и приводить к эктопической экспрессии. В связи с этим было весьма интересно проверить, какие цис-регуляторные элементы могут входить в состав исследуемых тканеспецифичных промоторов, и могут ли они оказывать какое-либо влияние на особенности экспрессии репортерного гена в новом генетическом контексте генома табака.
Следует отметить, что биоинформатический анализ последовательности промотора гена AP3 выявил возможность начала транскрипции на 191 нуклеотид ранее, чем было определено экспериментально. При конструировании векторов для экспрессии в растениях за точку начала транскрипции был принят 5'-конец наиболее длинной мРНК гена AP3 A. thaliana, существование которой было показано экспериментально [29]. Поскольку длина 5'-НТР этой мРНК составляла только 36 п.н., было принято решение с целью повышения эффективности трансляции заменить нативный 5'-НТР гена AP3 A. thaliana на омега-лидер ВТМ [18].
Биоинформатический анализ позволил выявить в структуре исследуемых промоторов около 20 цис-регуляторных элементов, часть которых были перекрывающимися, то есть обнаруживались в обоих промоторах (табл. 3). Среди перекрывающихся элементов были выделены высоко консервативные элементы корового промотора. К ним относятся ТАТА–бокс, СААТ-мотив (табл. 3). Для промотора RPT2a также была выделена последовательность CAN(A/C)(A/C)(C/A)C(C/A) N2A(C/A) сайта инициации транскрипции. Сочетание обнаруженных TATA-бокса и сайта инициации транскрипции характерно для промоторов генов растений с высоким уровнем экспрессии [30].
Таблица 3.
Регуляторные мотивы, обнаруживаемые в последовательностях тканеспецифичных промоторов генов AP3 и RPT2a A. thaliana.
| Промоторы | Мотивы | Последовательности | Источник | Описание |
|---|---|---|---|---|
| AP3 и RPT2a | Перекрывающиеся мотивы | |||
| CAAT-box | CAACCAACTCC (CCAAT) |
A. thaliana | Элемент корового промотора, характерный для генов с высокой экспрессией | |
| TATA-box | TATAA (TATA) | Элемент корового промотора | ||
| STRE | AGGGG | Элемент, участвующий в ответе на стресс | ||
| MYB | CAACCA | Участвует в регуляции развития растений, метаболизма, старении и защитных реакций | ||
| MYC | CATTTG | Участвует в ответе на стрессовые факторы: засуха, низкая температура, засоление и АБК | ||
| Box 4 | ATTAAT | Petroselinum crispum | Часть консервативного участка ДНК, вовлеченного в ответ на свет | |
| ARE | AAACCA | Z. mays | Индукция при анаэробных условиях | |
| WRE3 | CCACCT | Pisum sativum | Ответ на поранение | |
| AP3 | Неперекрывающиеся мотивы | |||
| as-1 | TGACG | A. thaliana | Регуляторный цис-элемент, вовлеченный в метилжасмонатный путь передачи сигнала | |
| CGTCA-motif | CGTCA | H. vulgare | Регуляторный цис-элемент, вовлеченный в метилжасмонатный путь передачи сигнала | |
| CAAT-box | CAAAT | Nicotiana. glutinosa | Элемент корового промотора, характерный для генов с высокой экспрессией | |
| WUN-motif | CAATTACAT | Ответ на поранение | ||
| RPT2a | W-box | TTGACC | A. thaliana | Ответ на поранение и элиситоры фитопатогенных грибов |
| HD-Zip 1 | CAAT(A/T)ATTG | Элемент, вовлеченный в дифференциацию палисадных клеток мезофилла листа | ||
| AuxRE-core | GGTCCAT | N. tabacum | Регуляторный элемент, отвечающий на действие ауксина | |
| TCA-element | CCATCTTTTT | Цис-элемент, участвующий в ответе на салициловую кислоту | ||
| TC-rich repeats | GTTTTCTTAC | Цис-элемент, участвующий в индукции стрессоустойчивости | ||
| ERE | ATTTTAAA | N. glutinosa | Регуляторный элемент, отвечающий на действие этилена | |
| Circadian | CAAAGATATC | L. esculentum | Контроль циркадных ритмов | |
| O2-site | GATGATGTGG | Z. mays | Цис-элемент, участвующий в регуляции метаболизма зеина | |
Следует отметить, что большая часть выявленных цис-регуляторных элементов тем или иным образом связана с ответными реакциями на различные стрессовые воздействия (табл. 3). Вполне вероятно, что именно такой тип регуляции характерен для промоторов генов, функционирующих в меристематических тканях, критически ответственных за рост и развитие растений на разных этапах онтогенеза.
Наибольший интерес в данном исследовании представляли мотивы, имеющие гомологию с цис-регуляторными элементами промоторов, описанными для рода Nicotiana, поскольку именно они с наибольшей долей вероятности могли влиять на экспрессию репортерного гена uidA у полученных трансгенных растений. Анализ последовательностей выявил всего 6 таких регуляторных мотивов, из которых 3 относились к виду N. glutinosa L., и 3 – к N. tabacum (табл. 3). Последовательность промотора гена AP3 включала мотивы, гомологичные элементу корового промотора (CAAT-box) и элементу ответной реакции на поранение (WUN-motif), характерные для N. glutinosa. В последовательности промотора гена RPT2a 19S субъединицы 26S протеасомы обнаружились участки, гомологичные AuxRE и TCA элементам, а также TC-rich повторам, отвечающим на действие ауксина, салициловой кислоты и индуцирующим стрессоустойчивость соответственно. В данном промоторе выявился мотив, гомологичный ERE-элементу N. glutinosa, отвечающему на воздействие этилена (табл. 3). Функциональность цис-регуляторных элементов, описанных для других неродственных табаку видов, в геноме N. tabacum остается под вопросом. Тем не менее, присутствие среди перекрывающихся мотивов элемента Box 4 , указывает на участие света в регуляции активности экспрессии исследуемых тканеспецифичных промоторов (табл. 3).
ЗАКЛЮЧЕНИЕ
Современные способы модификации организмов основаны на создании искусственных генетических конструкций и их переносе, например, в геномы растений с целью улучшения хозяйственно ценных признаков. Такие экзогенные ДНК методами генной инженерии могут быть интегрированы в случайные районы генома или методами геномного редактирования – в заранее выбранные исследователями районы-мишени. В обоих случаях экспрессия чужеродных генов будет определяться различными факторами, которые могут быть связаны как с особенностями района интеграции, так и особенностями их собственной организации, например, входящими в их состав промоторами. Полученные нами результаты показывают, что оба исследованных промотора A. thaliana (AP3 и RPT2a) обеспечивают экспрессию репортерного гена uidA в меристемах растений табака примерно с одинаковой эффективностью. Эктопический характер экспрессии, отмеченный для промотора AP3, свидетельствует о том, что узкая специфичность не всегда сохраняется в новом генетическом окружении. Однако в определенных условиях такую ситуацию можно рассматривать не как нежелательную, а, наоборот, как расширяющую возможности потенциального использования тканеспецифичных промоторов. Возможной причиной изменения специфичности, а также вариабельности уровня экспрессии переносимых генетических конструкций в условиях случайной интеграции, может служить нарушение взаимодействия соответствующих транскрипционных факторов и цис-регуляторных элементов, закодированных в их промоторных последовательностях. Исследование подобных взаимодействий является важным этапом при создании синтетических промоторов, адаптированных под решение конкретных биотехнологических задач.
Работа поддержана бюджетным проектом 0259-2021-0010 “Изучение систем контроля метаболизма живых систем в условиях взаимодействия с окружающей средой, в том числе после генетической модификации”.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Potenza C., Aleman L., Sengupta-Gopalan Ch. Targeting transgene expression in research, agricultural, and environmental applications: promoters used in plant transformation // In Vitro Cell. Dev. Biol.: Plant. 2004. V. 40. P. 1.
Porto M.S., Pinheiro M.P.N., Batista V.G.L., dos Santos R.C., de Albuquerque Melo Filho P., de Lima L.M. Plant promoters: an approach of structure and function // Mol. Biotechnol. 2014. V. 56. P. 38. https://doi.org/10.1007/s12033-013-9713-1
Ali S., Kim W.-Ch. A fruitful decade using synthetic promoters in the improvement of transgenic plants // Front. Plant Sci. 2019. V.10: 1433. https://doi.org/10.3389/fpls.2019.01433
Smirnova O.G., Shumny V.K., Kochetov A.V. Regulatory Sequences for Constitutive, Tissue-Specific, and Induced Expression of Transgenes in Ornamental Plants // Russ. J. Plant Physiol. 2019. V. 66. P. 679. https://doi.org/10.1134/S001533031905018X
Vyacheslavova A.O., Berdichevets I.N., Tyurin A.A., Shimshilashvili Kh.R., Mustafaev O.N., Goldenkova-Pavlova I.V. Expression of heterologous genes in plant systems: new possibilities // Russ. J. Genet. 2012. V. 48. P. 1067.
Sonoda Y., Sako K., Maki Y., Yamazaki N., Yamamoto H., Ikeda A., Yamaguchi J. Regulation of leaf organ size by the Arabidopsis RPT2a 19S proteasome subunit // Plant J. 2009. V. 60. P. 68. https://doi.org/10.1111/j.1365-313X.2009.03932.x
Zhang J., Yan G., Wen Z. An Y.-Q., Singer S.D., Liu Z. Two tobacco AP‑like gene promoters drive highly specific, tightly regulated and unique expression patterns during floral transition, initiation and development // Planta. 2014. V. 239. P. 469. https://doi.org/10.1007/s00425-013-1995-9
Komakhin R.A., Vysotskii D.A., Shukurov R.R., Voblikova V.D., Komakhina V.V., Strelnikova S.R., Vetchinkina E.M., Babakov A.V. Novel strong promoter of antimicrobial peptides gene pro-SmAMP2 from chickweed (Stellaria media) // BMC Biotechnol. 2016. V. 16: 43. https://doi.org/10.1186/s12896-016-0273-x
Krizek B.A., Meyerowitz E.M. The Arabidopsis homeotic genes APETALA3 and PISTILLATA are sufficient to provide the B class organ identity function // Development. 1996. V. 122. P. 11.
Hill Th.A., Day C.D., Zondlo S.C., Thackeray A.G., Irish V.F. Discrete spatial and temporal cis-acting elements regulate transcription of the Arabidopsis floral homeotic gene APETALA3 // Development. 1998. V. 125. P. 1711.
Ueda M., Matsui K., Ishiguro S., Sano R., Wada T., Paponov I., Palme K., Okadae K. The HALTED ROOT gene encoding the 26S proteasome subunit RPT2a is essential for the maintenance of Arabidopsis meristems // Development. 2004. V. 131. P. 2101. https://doi.org/10.1242/dev.01096
Сидорчук Ю.В., Герасименко И.М., Шелудько Ю.В., Дейнеко Е.В. Регуляторные элементы для экспрессии трансгенов в меристемах растений // Вестник Новосибирского государственного аграрного университета. 2017. Т. 4. С. 66.
Koltunow A.M., Truettner J., Cox K.H., Wallroth M., Goldberg R.B. Different temporal and spatial gene expression patterns occur during anther development // The Plant Cell. 1990. V. 2. P. 1201.
Зверева С.Д., Романов Г.А. Репортерные гены для генетической инженерии растений: характеристика и методы тестирования // Физиология растений. 2000. Т. 47. С. 479.
Bradford M.M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding // Anal Biochem. 1976. V. 72. P. 248.
O’Maoileidigh D.S., Graciet E., Wellmer F. Gene networks controlling Arabidopsis thaliana flower development // New Phytologist. 2014. V. 201. P. 16. https://doi.org/10.1111/nph.12444
Tilly J.J., Allen D.W., Jack T. The CArG boxes in the promoter of the Arabidopsis floral organ identity gene APETALA3 mediate diverse regulatory effects // Development. 1998. V. 125. P. 1647.
Gallie D.R., Sleat D.E., Watts J.W., Turner Ph.C., Wilson T.M.A. The 5'-leader sequence of tobacco mosaic virus RNA enhances the expression of foreign gene transcripts in vitro and in vivo // Nucleic Acids Res. 1987. V. 15. P. 3257.
Кочетов А.В., Филипенко Е.А., Смирнова О.Г., Шумный В.К. Энхансеры трансляции для генной инженерии растений // Вавиловский журнал генетики и селекции. 2014. Т. 18. С. 610.
Goodrich J., Puangsomlee P., Martin M., Long D., Meyerowitz E.M., Coupland G.A Polycomb-group gene regulates homeotic gene expression in Arabidopsis // Nature. 1997. V. 386. P. 44.
Arce A.L., Cabello J.V., Chan R.L. Patents on plant transcription factors // Recent Patents on Biotechnology. 2008. V. 2. P. 209. https://doi.org/10.2174/187220808786241024
Butaye K.M.J., Cammue B.P.A., Delaure S.L., De Bolle M.F.C. Approaches to minimize variation of transgene expression in plants // Molecular Breeding. 2005. V. 16. P. 79. https://doi.org/10.1007/s11032-005-4929-9
Bako A., Gell G., Zámbo A., Spitko T., Pok I., Pinter J., Balazs E. Monitoring transgene expression levels in different genotypes of field grown maize (Zea mays L.) // S. Afr. J. Bot. 2013. V. 84. P. 6. https://doi.org/10.1016/j.sajb.2012.09.005
Маренкова Т.В., Сидорчук Ю.В., Носов А.В., Фоменков А.А., Кузнецов В.В., Мурсалимов С.Р., Загорская А.А., Уварова Е.А., Белавин П.А., Дейнеко Е.В. Вариабельность по экспрессии GFP-гена в моноклональных клеточных линиях Arabidopsis thaliana // Биотехнология. 2019. Т. 35. С. 58.
Marenkova T.V., Deineko E.V. A change in the stability of marker nptII and uidA gene expression in transgenic tobacco plants // Russ. J. Genet. 2006. V. 42. P. 518.
Goldenkova-Pavlova I.V., Pavlenko O.S., Mustafaev O.N., Deyneko I.V., Kabardaeva K.V., Tyurin A.A. Computational and experimental tools to monitor the changes in translation efficiency of plant mRNA on a genome-wide scale: advantages, limitations, and solutions // Int. J. Mol. Sci. 2019. V. 20: 33. https://doi.org/10.3390/ijms20010033
Venter M. Synthetic promoters: genetic control through cis engineering // Trends Plant Sci. 2007. V. 12. P. 118. https://doi.org/10.1016/j.tplants.2007.01.002
Hernandez-Garcia C.M., Finer J.J. Identification and validation of promoters and cis-acting regulatory elements // Plant Sci. 2014. V. 217–218. P. 109. https://doi.org/10.1016/j.plantsci.2013.12.007
Jack T., Brockman L.L., Meyerowitz E.M. The homeotic gene apetala3 of Arabidopsis thaliana encodes a mads box and is expressed in petals and stamens // Cell. 1992. V. 68. P. 683.
Sawant S., Singh P., Gupta S., Madnala R., Tuli R. Conserved nucleotide sequences in highly expressed genes in plants // J. Genet. 1999. V. 78. P. 123.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


