Физиология растений, 2021, T. 68, № 5, стр. 501-508
Корреляция содержания аскорбиновой кислоты и профиля экспрессии генов монодегидроаскорбатредуктаз (MDHARs) у лука-порея (Allium porrum L.)
М. А. Филюшин a, *, О. К. Анисимова a, Е. З. Кочиева a, А. В. Щенникова a
a Институт биоинженерии, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
Москва, Россия
* E-mail: michel7753@mail.ru
Поступила в редакцию 10.12.2020
После доработки 04.01.2021
Принята к публикации 13.02.2021
Аннотация
В работе было определено содержание аскорбиновой кислоты и профиль экспрессии генов монодегидроаскорбатредуктаз MDHAR1, MDHAR4 и MDHAR5 в различных частях растений лука-порея (Allium porrum L.), собранных по мере роста (в июле и октябре). В листьях всех анализируемых сортов содержание аскорбата было выше, чем в ложном стебле (в 2.3–3.7 раза в июле и в 2.1–4.1 раза в октябре). Транскрипты MDHAR выявлены во всех анализируемых частях лука-порея. Листья и ложный стебель растений лука-порея характеризовались высоким уровнем экспрессии всех трех генов MDHAR. Для гена MDHAR5 во всех частях растения наблюдался сходный уровень транскрипции и в июле, и в октябре. Для гена MDHAR4 наблюдались два различных профиля экспрессии гена, в зависимости от точки сбора. Было выявлено, что в период формирования ложного стебля у анализируемых сортов лука-порея наблюдаются сходные профили экспрессии генов MDHAR1 и MDHAR4. При этом уровни транскрипции гена MDHAR4 положительно коррелируют с содержанием аскорбиновой кислоты в белой части и зеленых листьях растений лука-порея.
ВВЕДЕНИЕ
L‒аскорбиновая кислота (АК, витамин С) является важным компонентом неферментативной и ферментативной антиоксидантной системы растений [1]. В процессе метаболизма в клетках растений происходит постоянное образование активных форм кислорода (АФК) [2]. Чрезмерное образование и накопление АФК вызывает негативные эффекты – окисление компонентов клеточных мембран и деградацию нуклеиновых кислот, белков и пигментов, что в конечном итоге приводит к гибели клеток [2]. Однако в небольших количествах АФК действуют как сигнальные молекулы, участвуя в процессах роста и деления клеток, а также в ответных реакциях на атаку фитопатогенов [1, 3].
АК обладает способностью нивелировать действие некоторых АФК, напрямую связываясь с ними [4]. Также, АК является субстратом для аскорбатпероксидаз (APX; EC 1.11.1.11), которые нейтрализуют образующийся в различных клеточных компартментах пероксид водорода [4]. Во внеклеточном матриксе (апопласт) в нейтрализации АФК задействован фермент аскорбатоксидаза (АО; ЕС 1.10.3.3), предпочтительно использующий АК в качестве донора электронов [5]. В результате реакций неферментативной нейтрализации АФК и деятельности APX и AO образуется окисленная форма АК – монодегидроаскорбиновая кислота (MDHA), которая затем может самопроизвольно диспропорционировать с образованием дегидроаскорбиновой кислоты (DHA) и молекулы аскорбата [4].
Образующиеся окисленные формы аскорбата (MDHA и DHA) способны восстанавливаться до АК ферментами монодегидроаскорбатредуктазой (MDHAR; EC 1.6.5.4) и дегидроаскорбатредуктазой (DHAR; EC 1.8.5.1), соответственно [4, 6]. В качестве донора электронов эти ферменты используют NAD(P)H (MDHAR) и восстановленный глутатион (DHAR). Таким образом, данные ферменты позволяют растениям рециркулировать окисленные формы АК [7]. Восстановление АК посредством MDHAR является энергетически выгодным для растений, так как расходуется всего одна молекула NAD(P)H [8]. Рециклинг АК является частью аскорбат – глутатионового цикла, одного из основных механизмов поддержания внутриклеточного окислительно ‒ восстановительного статуса [9].
В клетках растений присутствует несколько монодегидроаскорбатредуктаз, которые локализуются в различных органеллах – хлоропластах, митохондриях, пероксисомах и цитозоле [10–13]. Гены MDHAR идентифицированы у многих видов растений. Так, в геноме Arabidopsis thaliana присутствует пять генов, кодирующих ферменты MDHAR различной клеточной локализации [14]. Геном мха Physcomitrella patens содержит три гена MDHAR [15]. Гены различных MDHARs идентифицированы в геномах гороха Pisum sativum [11], пшеницы Triticum aestivum [16], клевера Trifolium repens [17] и других видов растений. Для некоторых видов растений показано существенное увеличение уровня транскрипции генов MDHAR в ответ на абиотические стрессы, что свидетельствует о важной роли MDHAR в реакции растений на окислительный стресс [2, 8, 11, 18].
Лук-порей (Allium porrum L.) является популярной овощной культурой в Западной Европе и Азии, а в последнее время и в РФ. В пищу пригодно практически всё растение – белая часть (ложный стебель) и зеленые листья. Известно всего две работы, касающиеся MDHAR представителей рода Allium и их взаимосвязи с ответом растений на абиотический стресс [19, 20]. Показано, что в ответ на солевой стресс образцы двух генотипов лука репчатого A. cepa реагируют ростом ферментной активности MDHAR в симпласте корня и листа [20]. Также, активность MDHAR была рассмотрена как биомаркер загрязнения воды тяжелыми металлами, поскольку луковицы A. cepa при воздействии разных комбинаций тяжелых металлов демонстрируют рост активности MDHAR [19].
В данной работе впервые были определены профили экспрессии трех генов монодегидроаскорбатредуктаз в различных частях растений лука-порея четырех сортов в процессе роста. В сочетании с данными биохимического анализа были выявлены возможные корреляции между содержанием витамина С и уровнями экспрессии генов MDHAR.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. В работе были использованы растения лука – порея сортов Blauwgroene winter, Columbus, Otina и Pandora. Семена были предоставлены Федеральным научным центром овощеводства (Московская обл.).
По пять растений каждого сорта были выращены в 2020 году в контролируемых условиях (день/ночь – 16/8 ч, 22/16°С, освещенность 190 мкМ/(м2 с)) с использованием экспериментальной установки искусственного климата (Институт биоинженерии ФИЦ Биотехнологии РАН). По два растения лука-порея каждого из четырех сортов были собраны в конце июля (на стадии активного роста и формирования ложного стебля) и середине октября (сформирован ложный белый стебель) (рис. 1). Растения анализируемых сортов лука-порея различались толщиной и длиной ложного стебля: толстый (диаметр 4–6 см) и короткий (13–16 см) у сортов Blauwgroene winter и Pandora; тонкий (2–3 см) и длинный (20–25 см) у сорта Columbus; толстый (4–6 см) и длинный (19–21 см) у сорта Otina.
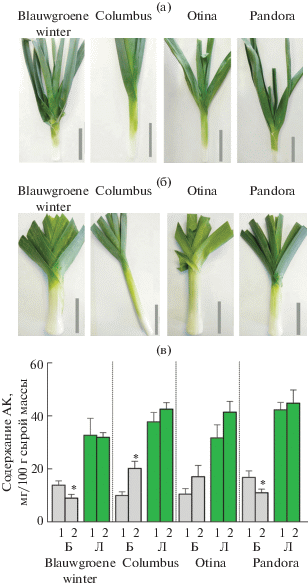
Рис. 1.
Растения лука-порея сортов Blauwgroene winter, Columbus, Otina и Pandora, собранные в июле (а) и октябре (б). Масштабная линия соответствует длине 10 см. Содержание аскорбиновой кислоты (в) в белой части (Б) и зеленых листьях (Л) этих растений; 1 – временная точка отбора июль, 2 – временная точка отбора октябрь. Достоверные различия (P-value ≤ 0.05) между содержанием АК в однотипных тканях в двух анализируемых точках отбора отмечены звездочкой.
Определение аскорбиновой кислоты. Содержание аскорбиновой кислоты определяли с помощью набора “Enzytec™ L-Ascorbic acid” (R-Biopharm AG, Германия) в двух биологических и трех технических повторах.
Выделение РНК, синтез кДНК. Суммарную РНК выделяли из корней, донца (видоизмененный стебель), листьев (фрагменты взрослых листьев в 10 см от белой части) и белой части (ложный стебель; поперечный срез диаметром 0.5 см отбеленного ложного стебля в 2 см от донца) растений. Для выделения и очистки РНК от примесей ДНК использовали наборы RNeasy Plant Mini Kit и RNase free DNasy set (QIAGEN, Германия). На основе полученных препаратов синтезировали кДНК (набор GoScriptтм Reverse Transcription System; Promega, США).
Идентификация генов MDHAR и разработка праймеров для ПЦР‒РВ. Последовательности генов MDHAR идентифицировали в доступных транскриптомных данных (NCBI TSA; https:// www.ncbi.nlm.nih.gov/) видов Allium (A. cepa и A. sativum). На основе найденных последовательностей разрабатывали специфичные для каждого гена MDHAR видов Allium праймеры для проведения ПЦР в реальном времени (ПЦР‒РВ).
Определение профиля экспрессии генов. Профиль экспрессии идентифицированных генов MDHARs определяли методом количественной ПЦР в реальном времени (ПЦР‒РВ) в корнях, донце, зеленых листьях и отбеленной части ложного стебля растений лука ‒ порея. Относительный уровень экспрессии исследуемых генов MDHARs оценивали, используя референсные гены GAPDH [21] и UBQ [22]. Для проведения ПЦР‒РВ использовали набор “Реакционная смесь для проведения ПЦР‒РВ в присутствии SYBR Green I и ROX” (ООО “Синтол”, Россия) и термоциклер CFX96 Real ‒ Time PCR Detection System (Bio-Rad Laboratories, USA). Реакции проводили в двух биологических и трех технических повторах в следующих условиях: 95°C – 5 мин.; 40 циклов (95°C – 15 с, 62°C – 50 с). Для статистической обработки результатов использовали программу GraphPad Prism v. 8 (https:// www.graphpad.com).
РЕЗУЛЬТАТЫ
Содержание аскорбиновой кислоты в листьях и белой части растений лука-порея. У четырех сортов лука-порея, различающихся морфологией ложного стебля (рис. 1а, б), было определено содержание аскорбиновой кислоты в листьях и белой части, в двух временных точках отбора (в июле и октябре) (рис. 1в). У растений, собранных в июле, содержание АК в белой части составило в среднем 10.2 (у сортов Columbus и Otina), 13.8 (Blauwgroene winter) и 16.7 (Pandora) мг/100г, а в зеленых листьях ее содержание было в 2.3–3.7 раза выше, максимальное содержание выявлено в листьях сорта Pandora (около 42.3 мг/100г). В растениях лука-порея, собранных в октябре, содержание АК в белой части в сравнении со значениями в июле либо не изменялось (сорт Otina), либо снижалось (в 1.5 раза у сорта Blauwgroene winter и Pandora), либо увеличивалось (в 1.9 раза у сорта Columbus). В листьях содержание АК было сопоставимо в обеих временных точках, при этом в октябре содержание АК было в 2.1–4.1 раз выше, чем в белой части (рис. 1в).
Разработка праймеров для экспрессионного анализа генов MDHARs у образцов лука-порея. Так как у лука-порея и других видов Allium последовательности генов монодегидроаскорбатредуктаз к настоящему времени не известны, сначала была проведена идентификация генов MDHARs в доступных транскриптомных данных (NCBI TSA) родственных луку-порею видов A. cepa (лук репчатый) и A. sativum (чеснок). В качестве референсных последовательностей для поиска использовали гены монодегидроаскорбатредуктаз спаржи Asparagus officinalis (AoMDHAR1 (XM_020404726.1), AoMDHAR4 (XM_020395983.1), AoMDHAR5 (XM_020385457.1)). В результате проведенного поиска в транскриптомах A. cepa и A. sativum были найдены транскрипты (GEOY01092914.1, GFAK01049639.1 и GFAK01071117.1 – для A. cepa; GFYZ01017298.1, GFAP01048520.1 и GFAP01035120.1 – для A. sativum), гомологичные мРНК генов Ao-MDHAR1, AoMDHAR4 и AoMDHAR5. Аминокислотные последовательности MDHAR видов Allium и As. officinalis были высоко гомологичны (MDHAR1 – сходство 86.6%, MDHAR4 – 84.8%, MDHAR5 – 84.7%). На основе найденных последовательностей трех генов MDHAR были разработаны праймеры для проведения экспрессионного анализа у лука- порея (табл. 1).
Таблица 1.
Последовательности праймеров, использованные для проведения ПЦР−РВ.
| Ген | Последовательности праймеров (5'‒3') | Размер ампликона, п.н. |
|---|---|---|
| MDHAR1 | 5'-TTTGAACCCTGGCGAGCTTG-3' 5'-CTGGCAGTAAGCGTTCTCCA-3' |
155 |
| MDHAR4 | 5'-CGCAGGTTATGCAGCTCTTG-3' 5'-CGCCTACGCAAGTATGAAATGC-3' |
166 |
| MDHAR5 | 5'-GGGGCTCGCATAGATAAGTTGA-3' 5'-TCCCACGGACTTATTCAGCC-3' |
161 |
Определение профиля экспрессии генов MDHARs в различных органах лука-порея. Методом ПЦР‒РВ был определен профиль экспрессии гомологов генов MDHAR1, MDHAR4 и MDHAR5 в различных органах растений лука-порея четырех анализируемых сортов на двух стадиях развития растения: в июле (активный рост и формирование ложного стебля) и в октябре (ложный стебель сформирован) (рис. 2).
Рис. 2.
Профиль экспрессии генов MDHAR1 (a, б), MDHAR4 (в, г) и MDHAR5 (д, е) в корнях (К), донце (Д), белой части (Б) и листьях (Л) растений лука − порея сортов Blauwgroene winter, Columbus, Otina и Pandora, собранных в июле (а, в, д) и октябре (б, г, е).

Экспрессия генов MDHAR выявлена во всех анализируемых частях/органах лука-порея (рис. 2). При этом уровни экспрессии гена MDHAR1 были существенно выше экспрессии двух других генов. Интересно отметить, что у собранных в июле растений лука-порея наблюдался сходный (между сортами) профиль экспрессии гена MDHAR1 (рис. 2a). Максимальный уровень транскрипции MDHAR1 выявлен в белой части растений лука-порея, минимальный – в корнях и/или листьях. У сортов Blauwgroene winter и Pandora уровни транскрипции MDHAR1 в корнях и листьях были сопоставимы, а у сортов Columbus и Otina в корнях уровень экспрессии был выше, чем в листьях, в 1.3 и 1.5 раза, соответственно. В растениях, собранных в октябре, сходный паттерн экспрессии MDHAR1 наблюдался у сортов Blauwgroene winter, Otina и Pandora: максимальный уровень транскрипции – в листьях, минимальный – в донце. У сорта Columbus уровни транскрипции MDHAR1 были сопоставимы в корнях и донце, в белой части и листьях (рис. 2б).
В сравнении с образцами, собранными в июле, в растениях, собранных в октябре, уровень экспрессии MDHAR1 вырос во всех анализируемых органах (Pandora), в корнях, белой части и листьях (Otina), в корнях и листьях (Blauwgroene winter), или только в листьях (Columbus) (рис. 3а). В белой части растений сорта Blauwgroene winter уровень экспрессии MDHAR1 не изменился (рис. 3а).
Рис. 3.
Разница между уровнями экспрессии генов MDHAR1 (а), MDHAR4 (б) и MDHAR5 (в) в июле и в октябре в органах растений лука − порея сортов Blauwgroene winter, Columbus, Otina и Pandora (К – корни, Д – донце, Б – белая часть (ложный стебель), Л – листья). Положительные значения (>0) свидетельствуют о снижении в октябре уровней экспрессии генов MDHARs, отрицательные значения (<0) – об увеличении уровней экспрессии генов MDHARs в октябре.

Профиль экспрессии гена MDHAR4 в растениях лука-порея, собранных в июле, был сходным между сортами – минимальный уровень транскрипции в корнях, максимальный – в листьях (рис. 2в). При этом в листьях сортов Blauwgroene winter и Columbus уровень транскрипции MDHAR4 был выше в 2.3 – 3.1 раза, чем у сортов Otina и Pandora. В растениях, собранных в октябре, экспрессия MDHAR4 в листьях снижалась в 2.4 и 2.9 раза (Blauwgroene winter и Columbus) или, наоборот, увеличивалась в 1.2 и 1.8 раза (Otina и Pandora) (рис. 2г, 3б). В корнях в июле наблюдался минимальный уровень транскрипции MDHAR4 (рис. 2в), а в корнях собранных в октябре в растениях лука-порея уровень транскрипции MDHAR4 значительно возрастал (в 3.2–12.0 раз) (рис. 2г). В донце уровень транскрипции MDHAR4 по мере роста растений снижался (Columbus, Otina и Pandora), либо не изменялся (Blauwgroene winter), а в белой части растений всех четырех сортов наблюдалось снижение уровня транскрипции гена MDHAR4 (рис. 3б).
В случае гена MDHAR5 сходный профиль и сопоставимые уровни экспрессии были выявлены в частях/органах (кроме корней) растений лука-порея сортов Otina и Pandora (рис. 2д). Донце и белая часть растений, собранных в октябре, характеризовались сходным профилем экспрессии MDHAR5 у пар сортов Blauwgroene winter/Otina и Columbus/Pandora (рис. 2е). В сравнении с июлем транскрипция MDHAR5 различалась: у сортов Blauwgroene winter и Columbus (кроме корней) происходило снижение уровня транскрипции данного гена, у сорта Otina – увеличение в корнях и листьях, а у сорта Pandora – рост только в листьях (рис. 3в).
Взаимосвязь содержания аскорбиновой кислоты с уровнями экспрессии генов MDHAR лука − порея. Полученные значения содержания АК в листьях и белой части были сопоставлены с уровнями транскрипции генов MDHAR1, MDHAR4 и MDHAR5 лука ‒ порея (рис. 4). Была обнаружена положительная корреляция (r = 0.60, P-value 0.0139) между экспрессией MDHAR4 и содержанием АК в анализируемых тканях. Корреляции между уровнями транскрипции генов MDHAR1 и MDHAR5 и содержанием АК не выявлено (r = 0.07 и 0.05, P-value > 0.05) (рис. 4).
ОБСУЖДЕНИЕ
Рециклинг аскорбиновой кислоты является одним из основных механизмов поддержания внутриклеточного окислительно-восстановительного статуса [9]. Образующиеся при нейтрализации активных форм кислорода окисленные формы аскорбиновой кислоты (MDHA и DHA) способны восстанавливаться обратно до АК под действием монодегидроаскорбатредуктаз (MDHAR) и дегидроаскорбатредуктаз (DHAR) [4, 6].
Проведенный в настоящей работе поиск в транскриптомных данных видов Allium последовательностей, гомологичных генам MDHAR спаржи A. officinalis, позволил разработать праймеры для анализа экспрессии генов MDHAR1, MDHAR4 и MDHAR5 в частях/органах растения лука-порея A. porrum. Высокий уровень гомологии последовательности ферментов MDHAR спаржи и видов Allium может свидетельствовать о консервативности их роли в рециклинге АК, в том числе у анализируемых сортов лука ‒ порея.
Подобно другим, известным белкам MDHAR высших растений [10, 12, 15], анализируемые MDHAR лука-порея, предположительно, локализованы в трех компартментах (цитозоле (MDHAR1), митохондриях (MDHAR5) и пероксисомах (MDHAR4)) клетки, осуществляя восстановление АК [6, 7]. Для оценки роли данных белков был проведен анализ экспрессии кодирующих их генов в различных частях растений лука-порея четырех сортов, различающихся морфологией белой части.
Профиль экспрессии генов MDHAR1, MDHAR4 и MDHAR5 впервые был определен в корнях, донце, белой части и листьях растений лука-порея, собранных в июле (активный рост и формирование белой части) и в октябре (белая часть сформирована) (рис. 2, 3). Впервые было показано, что зеленые (фотосинтезирующие) листья лука-порея в обеих временных точках характеризуются высоким уровнем экспрессии всех трех генов, что может говорить о постоянном окислительном стрессе в процессе роста и взаимодействия с окружающей средой. В белой части лука ‒ порея, структурно являющейся нижней частью листьев, также наблюдались сравнительно высокие уровни экспрессии генов MDHAR1 и MDHAR5 (рис. 2), что может свидетельствовать о высоком уровне окислительного стресса в белой части, несмотря на отсутствие фотосинтеза.
Интересно отметить, что ген MDHAR5, кодирующий фермент митохондриальной локализации, в обеих точках отбора в целом активен во всех частях растений всех сортов, обеспечивая, возможно, системный ответ на окислительный стресс при дыхании. О системном ответе, вероятно, можно говорить и в отношении цитозольной формы монодегидроаскорбатредуктазы (MDHAR1), хотя наиболее высокие уровни экспрессии гена MDHAR1 соответствуют белой части и листьям, за исключением сорта Columbus, где экспрессия данного гена высокая и в корнях, и в донце. В случае MDHAR4 для всех сортов мы видим два различных профиля экспрессии гена для июля и для октября. В июле экспрессия MDHAR4 растет от корней к листьям, что предполагает наибольшую специфичность пероксисомного фермента к фотосинтезирующей ткани. В октябре профиль экспрессии MDHAR4 в целом сохраняется, за исключением роста уровня транскрипции данного гена в корнях в 3.5–7.0 раз (рис. 2в, г).
Учитывая функцию монодегидроаскорбатредуктаз, увеличение экспрессии генов MDHARs теоретически должно приводить к увеличению содержания АК. В листьях и белой части растений лука-порея было определено содержание аскорбиновой кислоты (рис. 1в). Было выявлено, что растения сортов Blauwgroene winter и Pandora, формирующие толстый короткий ложный стебель (рис. 1б), имеют сходное содержание АК в белой части и динамику ее изменения в июле – октябре (рис. 1в). У сорта Columbus, формирующего длинный тонкий ложный стебель, в октябре содержание АК в белой части увеличилось. У сорта Otina, формирующего длинный толстый ложный стебель, содержание АК в белой части достоверно не изменялось. Полученные данные могут свидетельствовать о различиях в ответе растений лука-порея на окислительный стресс в зависимости от сорта.
Интересно, что содержание АК у растений, выращенных в теплице, оказалось ниже, чем у растений тех же сортов, выращенных в полевых условиях и собранных примерно в те же временные точки [23]. Это может свидетельствовать о большем уровне окислительного стресса, испытываемом растениями в постоянно меняющихся условиях окружающей среды и воздействии стрессовых факторов при выращивании в поле. Тем не менее, надо отметить, что соотношение содержания АК в белой части и в листьях у данных сортов в целом сохраняется.
При сопоставлении данных экспрессии генов MDHARs и содержания АК стало очевидно, что уровень транскрипции MDHAR4 положительно коррелирует с количеством АК в белой части и листьях. В зеленых листьях наблюдалось высокое содержание АК и высокий уровень транскрипции MDHAR4, тогда как в ложном стебле как содержание АК, так и уровень MDHAR4 были значительно ниже. Можно предположить, что высокий уровень транскрипции MDHAR4 (кодирует пероксисомальную форму MDHAR) в зеленых листьях лука-порея связан с активным восстановлением монодегидроаскорбата, образующегося в пероксисомах в результате инактивации АФК [24, 25]. Корреляции между экспрессией генов MDHAR1 и MDHAR5 и содержанием АК у лука-порея не выявлено. Интересно, что у томата (Solanum lycopersicum) ранее была выявлена обратная зависимость между экспрессией гена цитозольно-пероксиcомальной монодегидроаскорбатредуктазы (гомологична MDHAR1 лука ‒ порея) и содержанием АК в плодах и листьях [13], что также было подтверждено в экспериментах с трансгенными растениями томата – сверхэкспрессия гена MDHAR приводила к значительному снижению содержания аскорбата в плодах [26].
Ранее в растениях этих же сортов лука- порея нами была выявлена положительная корреляция между содержанием АК в зеленых листьях и уровнем транскрипции гена VTC2 (кодирует ключевой фермент биосинтеза АК) и отрицательная корреляция между этими показателями в белой части растений [23]. Можно было бы предположить обратную зависимость между уровнями транскрипции VTC2 (синтез АК) и MDHAR (рециклинг АК). Однако сравнение уровней экспрессии гена VTC2 и генов MDHARs с учетом содержания АК не выявила между ними каких-либо явных взаимосвязей, что предполагает существование более сложных механизмов регуляции метаболизма АК.
Таким образом, в настоящей работе впервые были определены профили экспрессии генов MDHAR1, MDHAR4 и MDHAR5 в частях/органах растений четырех сортов A. porrum, собранных в двух временных точках (июль и октябрь), проведен их сравнительный анализ. Показано, что период активного формирования ложного стебля у всех анализируемых сортов лука-порея характеризуется аналогичными профилями экспрессии генов MDHAR1 и MDHAR4. На стадии сформированного ложного стебля и проявления морфологических особенностей строения ложного стебля (длина, диаметр), исследуемые сорта демонстрируют различающиеся профили экспрессии генов MDHARs, однако для всех четырех сортов выявлен значительный рост уровня транскрипции гена MDHAR4 в корнях. Полученные данные могут свидетельствовать о том, что в процессе развития растений лука-порея ответ на окислительный стресс не зависит от сортовых особенностей, в то время как реакция на стресс полностью сформированных растений сортоспецифична. Оценка экспрессии генов MDHARs в сопоставлении с результатами биохимического анализа выявили возможные корреляции между уровнем транскрипции MDHAR4 и содержанием аскорбиновой кислоты в белой части и зеленых листьях растений лука-порея. Существование подобных корреляций может иметь практическое значение для направленной селекции новых сортов лука-порея с повышенным содержанием аскорбиновой кислоты.
Работа выполнена при поддержке Минобрнауки России в рамках соглашения № 075-15-2020-907 от 16.11.2020 о предоставлении гранта в форме субсидий из федерального бюджета на осуществление государственной поддержки создания и развития научного центра мирового уровня “Агротехнологии будущего”.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов.
Список литературы
Mittler R. Oxidative stress, antioxidants and stress tolerance // Trends Plant Sci. 2002. V. 7. P. 405. https://doi.org/10.1016/s1360-1385(02)02312-9.
Gill S.S., Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants // Plant Physiol Biochem. 2010. V. 48. P. 909. https://doi.org/10.1016/j.plaphy.2010.08.016
Venkatesh J., Park S.W. Role of L-ascorbate in alleviating abiotic stresses in crop plants // Bot Stud. 2014. V. 55. Article 38. https://doi.org/10.1186/1999?3110?55?38
Smirnoff N. Ascorbic acid metabolism and functions: A comparison of plants and mammals // Free Radical Biology and Medicine. 2018. V. 22. P. 116. https://doi.org/10.1016/j.freeradbiomed.2018.03.033
De Tullio M.C., Guether M., Balestrini R. Ascorbate oxidase is the potential conductor of a symphony of signaling pathways // Plant Signal Behav. 2013. V. 8. Article e23213. https://doi.org/10.4161/psb.23213
Smirnoff N., Wheeler G.L. Ascorbic acid in plants: biosynthesis and function // Crit Rev Biochem Mol Biol. 2000. V. 35. P. 291. https://doi.org/10.1080/10409230008984166.
Chen Z., Young T.E., Ling J., Chang S.-C., Gallie D.R. Increasing vitamin C content of plants through enhanced ascorbate recycling // PNAS. 2003. V. 100. P. 3525. https://doi.org/10.1073/pnas.0635176100
Negi B., Salvi P., Bhatt D., Majee M., Arora S. Molecular cloning, in silico characterization and functional validation of monodehydroascorbate reductase gene in Eleusine coracana // PLoS ONE. 2017. V. 12. Article e0187793. https://doi.org/10.1371/journal.pone.0187793
Asada K. Production and scavenging of reactive oxygen species in chloroplasts and their functions // Plant Physiol. 2006. V. 141. P. 391. https://doi.org/10.1104/pp.106.082040
Obara K., Sumi K., Fukuda H. The use of multiple transcription starts causes the dual targeting of Arabidopsis putative monodehydroascorbate reductase to both mitochondria and chloroplasts // Plant Cell Physiol. 2002. V. 43. P. 697. https://doi.org/10.1093/pcp/pcf103.
Leterrier M., Corpas F.J., Barroso J.B., Sandalio L.M., del Río L.A. Peroxisomal monodehydroascorbate reductase, genomic clone characterization and functional analysis under environmental stress conditions // Plant Physiol. 2005. V. 138. P. 2111. https://doi.org/10.1104/pp.105.066225
Sano S., Tao S., Endo Y., Inaba T., Hossain M.A., Miyake C., Matsuo M., Akoi H., Asada K., Saito K. Purification and cDNA cloning of chloroplastic monodehydroascorbate reductase from spinach // Biosc Biotechnol Biochem. 2005. V. 69. P. 762. https://doi.org/10.1271/bbb.69.762
Gest N., Garchery C., Gautier H., Jimenez A., Stevens R. Light−dependent regulation of ascorbate in tomato by a monodehydroascorbate reductase localized in peroxisomes and the cytosol // Plant Biotech J. 2013. V. 11. P. 344. https://doi.org/10.1111/pbi.12020.
Chew O., Whelan J., Millar A.H. Molecular definition of the ascorbate-glutathione cycle in Arabidopsis mitochondria reveals dual targeting of antioxidant defenses in plants // J. Biol Chem. 2003. V. 278. P. 46869. https://doi.org/10.1074/jbc.M307525200.
Lunde C., Baumann U., Shirley N.J., Drew D.P., Fincher G.B. Gene structure and expression pattern analysis of three monodehydroascorbate reductase (Mdhar) genes in Physcomitrella patens: implications for the evolution of the MDHAR family in plants // Plant Mol Biol. 2006. V. 60. P. 259. https://doi.org/10.1007/s11103?005?3881?8
Feng H., Liu W., Zhang Q., Wang X., Wang X., Duan X., Li F., Huang L., Kang Z. TaMDHAR4, a monodehydroascorbate reductase gene participates in the interactions between wheat and Puccinia striiformis f. sp. tritici // Plant Physiol Biochem. 2014. V. 76. P. 7. https://doi.org/10.1016/j.plaphy.2013.12.015
Zhang Y., Li Z., Peng Y., Wang X., Peng D., Li Y., He X., Zhang X., Ma X., Huang L., Yan Y. Clones of FeSOD, MDHAR, DHAR genes from white clover and gene expression analysis of ROS−scavenging enzymes during abiotic stress and hormone treatments // Molecules. 2015. V. 20. P. 20939. https://doi.org/10.3390/molecules201119741
Yoon H.S., Lee H., Lee I.A., Kim K.Y., Jo J. Molecular cloning of the monodehydroascorbate reductase gene from Brassica campestris and analysis of its mRNA level in response to oxidative stress // Biochim. Biophys. Acta (BBA) – Bioenerg. 2004. V. 1658. P. 181. https://doi.org/10.1016/j.bbabio.2004.05.013
Fatima R.A., Ahmad M. Certain antioxidant enzymes of Allium cepa as biomarkers for the detection of toxic heavy metals in wastewater // Sci Total Environ. 2005. V. 346. P. 256. https://doi.org/10.1016/j.scitotenv.2004.12.004.
García G., Clemente-Moreno M.J., Díaz-Vivancos P., García M., Hernández J.A. The apoplastic and symplastic antioxidant system in onion: response to long-term salt stress // Antioxidants (Basel). 2020. V. 12. Article 67. https://doi.org/10.3390/antiox9010067.
Liu M., Wu Z., Jiang F. Selection and validation of garlic reference genes for quantitative real-time PCR normalization // Plant Cell Tiss. Organ Cult. 2015. V. 122. P. 435. https://doi.org/10.1007/s11240-015-0780-9
Schwinn K.E., Ngo H., Kenel F., Brummell D.A., Albert N.W., McCallum J.A., Pither-Joyce M., Crowhurst R.N., Eady C., Davies K.M. The onion (Allium cepa L.) R2R3-MYB gene MYB1 regulates anthocyanin biosynthesis // Front. Plant. Sci. 2016. V. 7. Article 1865. https://doi.org/10.3389/fpls.2016.01865
Анисимова О.К., Середин Т.М., Щенникова А.В., Кочиева Е.З., Филюшин М.А. Оценка содержания витамина С и экспрессии гена ГДФ-L-галактозофосфорилазы (VTC2) у сортов лука-порея (Allium porrum L.) // Физиология растений. 2021. Т. 68. С. 75. https://doi.org/10.31857/S0015330320060020
del Rio L.A., Corpas F.J., Sandalio L.M., Palma J.M., Gomez M., Barroso J. B. Reactive oxygen species, antioxidant systems and nitric oxide in peroxisomes // J. Exp. Bot. 2002. V. 53. P. 1255.
Lisenbee C.S., Lingard M.J., Trelease R.N. Arabidopsis peroxisomes possess functionally redundant membrane and matrix isoforms of monodehydroascorbate reductase // Plant J. 2005. V. 43. P. 900. https://doi.org/10.1111/j.1365-313X.2005.02503.x.
Haroldsen V.M., Chi-Ham C.L., Kulkarni S., Lorence A., Bennett A.B. Constitutively expressed DHAR and MDHAR influence fruit, but not foliar ascorbate levels in tomato // Plant Physiol Biochem. 2011. V. 49. P. 1244. https://doi.org/10.1016/j.plaphy.2011.08.003.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений



