Физиология растений, 2021, T. 68, № 5, стр. 553-560
Оценка физиологического состояния микроводорослей с помощью цитометрических и флуоресцентных показателей
Е. С. Соломонова a, *, А. И. Акимов a
a Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр
“Институт биологии южных морей им. А.О. Ковалевского Российской академии наук”
Севастополь, Россия
* E-mail: solomonov83@mail.ru
Поступила в редакцию 09.12.2020
После доработки 20.01.2021
Принята к публикации 23.01.2021
Аннотация
Исследована возможность применения флуорохромного красителя флуореcцеина диацетата (FDA) в комбинации с проточной цитометрией и коэффициента переменной флуоресценции хлорофилла а для оценки функционального состояния клеток микроводорослей в условиях накопительного роста культур и при вариабельности света и температуры от оптимальных до экстремальных уровней. Показано, что величина флуоресценции FDA является более консервативным параметром по сравнению с относительной переменной флуоресценцией хлорофилла а, ее заметные изменения связаны с необратимой потерей функциональной активности клеток водорослей и их гибелью, что позволяет использовать данный показатель в качестве маркера жизнеспособности водорослей при экстремальных условиях культивирования. Заметное снижение значений флуоресценции FDA сопряжено с наступлением глубокой стационарной фазы (фазы отмирания) роста водорослей, а также наблюдается при воздействии на клетки исследуемых культур высокой температуры (>25°C) и ингибирующей интенсивности света (1200 мкЭ/м2 с1).
ВВЕДЕНИЕ
Быстрая ответная реакция микроводорослей на изменение условий существования позволяет использовать их структурно-функциональные характеристики как чувствительные индикаторы экологического состояния водных биоценозов. Применение цитометрических и флуоресцентных показателей клеток водорослей в качестве экспресс-маркеров – практически неисследованный феномен, несмотря на его довольно широкое распространение и универсальность. Создание системы оперативного контроля функционального состояния фитопланктона позволит прогнозировать процессы формирования первичной продукции в море в условиях возрастающего антропогенного воздействия на морские биоценозы.
Метод проточной цитометрии в комбинации с флуорохромом флуоресцеином диацетатом (FDA) применяется для распознавания живых и мертвых клеток микроводорослей на основе проницаемости их клеточных мембран и для оценки ферментативной активности клеток, что открывает возможность поиска новых репрезентативных критериев определения функционального состояния водорослей. В состав FDA входит субстрат, специфичный к ферментам группы эстераз [1]. Его ферментный гидролиз приводит к высвобождению молекулы флуоресцеина и, как следствие, свечению клетки (эмиссия в зеленой области спектра). Однако чаще всего такой подход применяется для определения доли живых/мертвых клеток различных таксономических групп водорослей [1–4]. Нами впервые было предложено использовать удельную флуоресценцию FDA в качестве экспресс-маркера функционального состояния водорослей в условиях накопительного роста культуры [5]. В литературе практически не затрагиваются вопросы оценки роли основных физических факторов (температура и освещенность) в регулировании процессов, связанных с деятельностью внутриклеточных эстераз микроводорослей [3]. Встречаются единичные исследования, где изменение удельной флуоресценции FDA у водорослей рассматривается как отклик на действие токсических веществ. В основном это краткосрочные острые опыты, не связанные с длительным культивированием водорослей в ингибируемой среде [4, 6, 7].
Метод измерения относительной переменной флуоресценции хлорофилла а водорослей обладает высокой чувствительностью и позволяет быстро оценить ряд биофизических характеристик фитопланктона в режиме реального времени [8, 9]. Однако до сих пор слабо изученным остается вопрос влияния физических факторов среды на динамику переменной флуоресценции хлорофилла а [8, 10]. Несмотря на интенсивные исследования флуоресцентных характеристик, сведения о взаимосвязи относительной переменной флуоресценции хлорофилла а с основными структурными, внутриклеточными соотношениями водорослей и скоростью роста водорослей практически отсутствуют. В связи с этим, совершенствование существующих и развитие новых методов прямой детекции стрессового состояния клетки/сообщества – актуальная и востребованная прикладная задача.
Цель работы – оценка физиологического состояния микроводорослей при оптимальных и экстремальных условиях роста с помощью цитометрических и флуоресцентных показателей.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. В качестве объекта исследования были использованы альгологически чистые культуры водорослей: отдел Bacillariophyta: Phaeodactulum tricornutum (Bohlin), Chaetoceros curvisetus (Cleve); отдел Chlorophyta: Chlorella vulgaris suboblonga (Andreeva), Dunaliella salina (Teodoresco) из коллекции отдела экологической физиологии водорослей ИнБЮМ. Выбор видов обусловлен тем, что Phaeodactulum tricornutum, Chlorella vulgaris suboblonga и Dunaliella salina обладают высокой жизнестойкостью при культивировании и часто используются в гидробиологических исследованиях в качестве модельных объектов, а Chaetoceros curvisetus является одним из широко распространенных представителей фитопланктона Черного моря.
Phaeodactylum tricornutum – морской, солоноватоводный, эвригалинный вид, широко распространенный в морских и континентальных водоемах. Вид планктонный, встречается круглогодично, но преимущественно весной и осенью. Клетки одиночные, двух видов: слегка серповидно изогнутые и трехлучевые [11].
Chaetoceros curvisetus – неритический вид, широко распространенный в южных и умеренных морях. Распространен в Черном море у берегов и во всех бухтах, реже в северо-западном районе, осенью и весной в большом количестве, часто вызывает осеннее цветение, споры образует преимущественно в октябре, иногда в заметном количестве ранней весной. Цепочки прямые, ширина 5–30 мкм. Створки эллиптические, слабо вогнутые, с выпуклиной на середине, загиб высокий, около 1/3 высоты клетки, поясок с узкой бороздкой по краю, высота клетки 12.5–30 мкм. Щетинки тонкие, отходят от приподнятых полюсов, скрещиваются у своего основания, направлены сначала перпендикулярно к оси цепочки, затем слегка склоняются к ее концам [11].
Chlorella vulgaris suboblonga – клетки эллипсоидные, 2.8–6.1 мкм длиной и 1.7–5.5 мкм шириной, при образовании автоспор 8.0 и 5.5 мкм, соответственно. Оболочка тонкая. Хлоропласт широкий поясковидный незамкнутый или корытовидный. Положение хлоропласта может быть ориентировано по отношению к длинной оси клетки продольно или поперечно. Автоспоры по 2–4, реже по 8, сразу после освобождения неправильно эллипсоидные. Цвет клеток как молодых, так и взрослых темно-зеленый [12].
Dunaliella salina – клетки водоросли разнообразной формы: овальные, эллипсоидные, яйцевидные, грушевидные, иногда шаровидные, цилиндрические или веретеновидные; радиально- или билатерально симметричные, редко дорсовентральные или слегка ассиметричные [13]. Размеры клеток разнообразны: их длина может колебаться от 2.8 до 40 мкм, ширина от 1.5 до 20 мкм, объем от 8 до 4500 мкм3. Наиболее подробные иллюстрации по изменчивости дуналиелл имеются в [13], где представлены материалы по гомологическим рядам модификационной изменчивости видов дуналиелл.
Во всех сериях экспериментов культуры выращивали в конических колбах объемом 250 мл (объем культур в колбах составлял 150 мл).
Накопительный режим культивирования. Исследовали поведение водорослей и флуоресцентные показатели в накопительном режиме роста при усилении дефицита азота. Культуру P. tricornutum выращивали в двух повторностях при температуре 20°С и интенсивности света 34 мкЭ/м2 с1 в течение 14 сут на среде f/2 [14] с двукратно уменьшенным содержанием азота. Культуру C. vulgaris suboblonga также выращивали в двух повторностях при температуре 18°С и интенсивности света 43 мкЭ/м2 с1 в течение 23 сут на среде f/2 с двукратно уменьшенным содержанием азота. Интенсивность света определяли внутри колб зондирующим 4П датчиком квантометра QSL 2101 (“Biospherical Instruments Inc.”, США), диапазон которого составляет 400–700 нм (ФАР). Концентрационное тушение флуоресценции в накопительных культурах устраняли путем разбавлением пробы непосредственно перед измерением. Осуществляли контроль по измерению кислорода в среде с помощью кислородомера КЛ 115. Минимальное содержание кислорода было не ниже 4 мгО2 /л.
Световой фактор. Для исследования влияния светового фактора на функциональные показатели P. tricornutum и D. salina культуры адаптировали дискретно к освещенностям от 14 до 1720 мкЭ/м2 с1 при температуре 1720°С в течение периода времени, достаточного для соответствующей стабилизации роста при данной освещенности (3–7сут). Облучение осуществлялось светодиодами белого света (4000 К), различные уровни которого достигались изменением расстояния до источника света и применением нейтральных светофильтров.
Температурный фактор. Выращивание водорослей P. tricornutum и C. curvisetus проводили в диапазоне температур от 3 до 27°С при постоянной освещенности 34 мкЭ/м2 с1 в течение периода времени, достаточного для соответствующей стабилизации роста при данной температуре (3–6 сут). Для создания необходимых температурных условий использовали термостатированный бокс, точность поддержания температуры +0.1°С.
Концентрация клеток в культурах поддерживалась примерно на одном уровне в экспоненциальной фазе роста путем периодического (один раз в сутки или реже для слаборастущих культур) разбавления свежей питательной средой при исследовании влияния температурного и светового факторов. Текущий контроль осуществлялся путем измерения оптической плотности суспензии. Оптическая плотность суспензии определялась на спектрофотометре СФ 26 ЛОМО, на длине волны 750 нм в 10-сантиметровой цилиндрической кювете, закрепляемой внутри кюветного отделения в специально изготовленном держателе. Возможность использования оптической плотности как показателя биомассы для разных видов была исследована ранее; получена линейная зависимость между этой величиной и концентрацией клеток [15].
Величина рН культуральной среды составляла 8.2–8.5.
Удельную скорость роста микроводорослей определяли по формуле [16]:
где:
µ – удельная скорость роста, сут–1;
N1 и N2 – исходная концентрация клеток и ее количество через время t, кл/мл;
t – время между измерениями, сут.
Для цитометрического анализа из культивационных сосудов отбирали пробы объёмом 3 мл. Пробы исследовали с помощью проточного цитометра Cytomics TM FC 500 (“Beckman Coulter”, США), оборудованного 488 нм однофазным аргоновым лазером. Окрашивание водорослей витальным красителем флуоресцеином диацетатом (FDA) производили по протоколу, опубликованному в работе [17]. Метаболическую активность и содержание пигментов в клетках оценивали на двух параметрических цитограммах по флуоресценции FDA (канал FL1 в зеленой области спектра, 525 нм) и автофлуоресценции (FL4 в красной области спектра, 675 нм) на безразмерных логарифмических шкалах. С вариантом иллюстраций можно ознакомиться в работе [17], выполненной с участием авторов. Рассчитывали среднее значение аккумулированной флуоресценции FDA на клетку, обозначив данный параметр, как FDAfl.
Изменение переменной флуоресценции хлорофилла а (максимальной квантовой эффективности ФС II) (в литературе встречаются определения: эффективность первичного разделения зарядов, КПД использования световых квантов и др.), под которой далее по тексту будет пониматься коэффициент относительной переменной флуоресценции хлорофилла а [8, 9, 18], определяли на флуориметре МЕГА 25 с возбуждающим излучением на длине волны ~ 455 нм [19], разработанном на кафедре биофизики биологического факультета МГУ имени М.В. Ломоносова по формуле:
(2)
${{{{F}_{{\text{v}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{v}}}}} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}} = \frac{{{{F}_{{\text{m}}}} - {{F}_{{\text{0}}}}}}{{{{F}_{{\text{m}}}}}},$где:
Fm – максимальная флуоресценция после серии световых вспышек, насыщающих реакционные центры фотосинтеза;
F0 – величина флуоресценции при открытых реакционных центрах.
Перед измерением пробы выдерживали 15 мин в темноте при необходимой температуре. Принцип действия флуориметра основан на оптическом явлении флуоресценции хлорофилла – свечении вещества в момент воздействия возбуждающим светом. Индукция флуоресценции регистрируется при фиксированном значении интенсивности возбуждающего света около 5000 мкмоль/м2 с2. Предел допускаемой относительной погрешности измерений не более ± 10%. Управление работой флуориметра осуществляется от персонального компьютера при помощи специализированной программы MEGA25.
Статистическая обработка данных выполнялась по стандартным программным пакетам Microsoft Exel 7.0, Statistica-5, Grapher-9, Sigma Plot для персонального компьютера. Все опыты были выполнены в трех биологических и трех аналитических повторностях. В таблицах и графиках представлены средние значения и их стандартные отклонения. Достоверность различий между средними значениями оценена по t-критерию Стьюдента при Р ≤ 0.05.
РЕЗУЛЬТАТЫ
Накопительный режим культивирования
На рис. 1 и 2 представлена временная динамика параметров флуоресценции FDAfl, параметра Fv/Fm и скорости роста культур P. tricornutum и C. vulgaris suboblonga в условиях накопительного роста водорослей.
Рис. 1.
Динамика изменений флуоресценции FDA (FDAfl), параметра Fv/Fm и удельной скорости роста культуры Phaeodactulum tricornutum в накопительном режиме
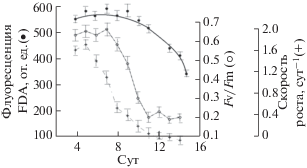
Рис. 2.
Динамика изменений флуоресценции FDA (FDAfl), параметра Fv/Fm и удельной скорости роста культуры Chlorella vulgaris suboblonga в накопительном режиме
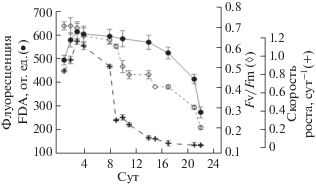
Максимальные значения исследуемых параметров наблюдали в экспоненциальной фазе роста, на 2–3 сут эксперимента для C. vulgaris suboblonga и на 4–6 сут для P. tricornutum, после лаг-периода, связанного с сильным разведением культур. Затем наблюдалось быстрое падение удельной скорости роста µ водорослей и коэффициента относительной переменной флюоресценции хлорофилла а. Значения флуоресценции FDA оставались высокими до наступления стационарной фазы роста. По мере развития стационарной фазы (старение культуры), на фоне снижения концентрации клеток происходило более быстрое падение показателя флуоресценции FDA, однако не столь значительное, как для параметров Fv/Fm и µ, соответственно.
Температурный фактор
Данные на рисунках 3 и 4 показывают изменения значений коэффициента относительной переменной флуоресценции хлорофилла а, флуоресценции FDA (FDAfl) и удельной скорости роста водорослей при их культивировании в условиях различных температур. Температурная зависимость удельной скорости роста водорослей P. tricornutum и C. curvisetus имела одновершинный характер, с максимумом при 20–24°С и сильным ингибированием при 27°С. Значения параметров FDAfl и Fv/Fm у исследуемых видов водорослей сохранялись на высоком, относительно постоянном уровне в диапазоне температур 5–24°С. При температуре 27°С P. tricornutum и C. curvisetus сильно деградировали, что приводило к остановке роста водорослей и паданию значений как активности внутриклеточных эстераз, так и эффективности переноса энергии ФС II. Пролонгированное воздействие этой температуры имело летальный характер.
Рис. 3.
Зависимость параметров FDAfl активности, Fv/Fm и удельной скорости роста от температуры у Phaeodactylum tricornutum
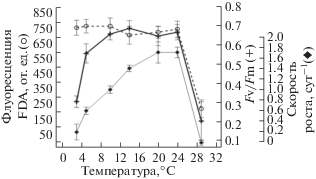
Рис. 4.
Зависимость параметров FDAfl активности, Fv/Fm и удельной скорости роста от температуры у Chaetoceros curvisetus
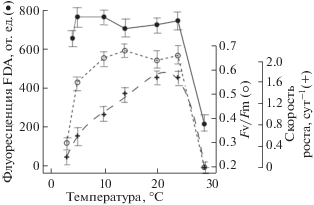
Если сравнивать значения удельной скорости роста водорослей и параметра Fv/Fm в крайних температурных зонах, то наблюдается формально одинаковое поведение: резкое снижение данных показателей. Однако при высоких температурах снижение Fv/Fm, очевидно, отражает частичную (или полную) гибель клеток и утрату ими фотосинтетической активности, а при низких температурах снижение относительной переменной флуоресценции хлорофилла а нельзя объяснить таким же образом, так как клетки сохраняют жизнеспособность и быстро восстанавливаются при повышении температуры. Данный тезис подтверждается полученными значениями флуоресценции FDA. В отличие от относительной переменной флуоресценции хлорофилла а, параметр FDAfl сохранял высокие значения при низкой температуре, что косвенно подтверждает поддержание жизнеспособности водорослей в этих условиях. При этом флуоресценция FDA имела минимальные значения при высоких температурах (>25°C). Температуры, превышающие верхнюю границу толерантной зоны, можно рассматривать как более жесткий фактор, приводящий к возможной гибели водорослей.
Световой фактор
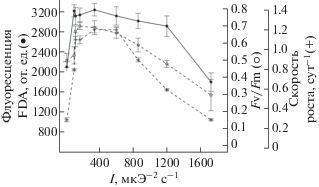
Чтобы определить влияние светового фактора на флуоресценцию FDA, культуры P. tricornutum (рис. 5) и D. salina (рис. 6) выращивали в широком диапазоне интенсивности света. В диапазоне от 14 до 150 мкЭ/м2 с1 у P. tricornutum сохранялись высокие значения квантовой эффективности ФС2 (0.63–0.70), у D. salina данный показатель имел максимальные значения при интенсивности света от 170 до 600 мкЭ/м2 с1. При освещенности свыше 150 мкЭ/м2 с1 наблюдалось постепенное снижение относительной переменной флуоресценции хлорофилла а у P. tricornutum, падение значений удельной скорости роста водорослей отмечено при более высоких значениях освещенности – свыше 600 мкЭ/м2 с1. Снижение значений Fv/Fm у D. salina отмечено при освещенности свыше 600 мкЭ/м2 с1 и было сопряжено со снижением значений удельной скорости роста водорослей. При интенсивности света 1200 мкЭ/м2 с1 наблюдали падение показателей относительной переменной флуоресценции хлорофилла а и ингибирование скорости роста у исследуемых видов водорослей.
Рис. 5.
Зависимость параметров FDAfl активности, Fv/Fm и удельной скорости роста от интенсивности света у Phaeodactylum tricornutum
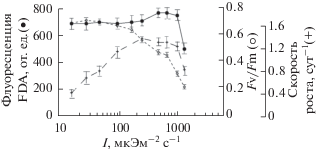
Рис. 6.
Зависимость параметров FDAfl активности, Fv/Fm и удельной скорости роста от интенсивности света у Dunaliella salina
Флуоресценция FDA имела относительно высокие постоянные значения практически во всем световом диапазоне выращивания как у P. tricornutum, так и D. salina. Действие интенсивности света 1200 мкЭ/м2 с1 приводило к резкому падению параметра FDAfl у P. tricornutum, тогда как культура D. salina сохраняла высокие значения флуоресценции FDA при данной освещенности. Это подтверждается высокой подвижностью клеток D. salina, наблюдаемой под электронным микроскопом. Падение параметра FDAfl у D. salina отмечено при интенсивности света 1600 мкЭ/м2 с1, относительная переменная флуоресценция хлорофилла а также имела минимальные значения (0.3) в данных условиях роста водорослей.
Уровень световой энергии выше 600 мкЭ/м2 с1 может считаться избыточным (адаптивное снижение удельного содержания хлорофилла), а затем и ингибирующим 900–1200 мкЭ/м2 с1, вызывающим интенсивное фотоокисление и деструкцию как светопоглощающих пигментов, так и реакционных центров [20, 21].
ОБСУЖДЕНИЕ
Маркерами функционального состояния водорослей могут выступать структурные и внутриклеточные элементы клетки, такие как мембрана и мембранная проводимость, протеины (ферменты) и их активность, рибосомы и их функциональность, ферментативные реакции, накопление АТФ, морфологические признаки, а также более традиционные: скорость роста водорослей, численность клеток и биомасса, соотношение основных внутриклеточных компонентов.
На сегодняшний день в морской гидробиологии, а также в исследованиях по интенсивному культивированию водорослей, все чаще начиняют применяться экспресс-методы оценки функционального состояния фитопланктона и его продукционного потенциала под влиянием внешних условий, в том числе в связи с антропогенными факторами среды. Такими методами являются: метод проточной цитометрии в комбинации с различными витальными красителями и метод переменной флуоресценции хлорофилла а, который дает возможность получать информацию о количестве и активности фототрофных организмов, а также по характеристикам состояния фотосинтетического аппарата оценивать физиологическое состояние клеток водорослей и судить о качестве водной среды [22, 23]. В результате появляется возможность поиска новых более консервативных критериев, отражающих функциональное состояние водорослей. К таким критериям можно отнести интегральные показатели метаболической активности клеток, реализуемые путем окраски суспензии клеток водорослей витальными красителями, например, диацетатом флуоресцеина, карбоксифлюоресцеином диацетатом (cFDA) и кальцеином AM [1, 2, 24, 25], и коэффициент относительной переменной флуоресценции хлорофилла а, характеризующий эффективность переноса и утилизацию энергии в первичных фотохимических процессах [18, 22].
В данной работе рассмотрено влияние абиотических факторов среды (свет, температура и содержание биогенных элементов в среде) на флуоресценцию флуоресцеина диацетата (FDA), удельную скорость роста водорослей и коэффициент относительной переменной флуоресценции хлорофилла а. Если влияние описанных в работе факторов на рост водорослей и параметр Fv/Fm многократно исследовалось раннее [18, 26–28], то данных о световой и температурной зависимости флуоресценции FDA не удалось найти в литературе.
В процессе накопительного роста водорослей P. tricornutum и C. vulgaris suboblonga их функциональное состояние изменялось в зависимости от условий обеспеченности клеток элементами минерального питания. При увеличении плотности культуры концентрация минерального азота в среде снижалась, что приводило к замедлению роста водорослей и снижению значений коэффициента относительной переменной флуоресценции хлорофилла а. Характер наблюдаемых изменений удельной скорости роста и параметра Fv/Fm аналогичен был тем, которые отмечаются в литературе в экспериментах при дефиците биогенных элементов в среде [29, 30]. Величина FDAfl сохраняла высокие значения в широком диапазоне накопительного режима вплоть до полной остановки роста и последующего лизиса клеток исследуемых видов водорослей на поздней стадии стационарной фазы.
Результаты исследований показали, что факторы, приводящие к снижению удельной скорости роста водорослей как в условиях накопительного роста, так и в результате действия различной интенсивности света и температур мало влияли на значение флуоресценции FDA, хотя воздействие условий стационарного состояния, высокой освещенности и высокой температуры наблюдалось. Глубокое стационарное состояние культур (фаза отмирания), высокая освещенность (свыше 1200 мкЭ/м2 с1) и температура больше 25°С приводили к снижению удельной активности внутриклеточных эстераз. Наибольшее падение флуоресценции FDA наблюдалось при воздействии высоких температур и было связано с уже необратимой деструкцией клеток и отмиранием водорослей.
Если рассматривать причины отсутствия значительных изменений флуоресценции FDA в широком диапазоне исследуемых факторов, то здесь можно выдвинуть несколько предположений. Во-первых, возможно, используемые в работе виды водорослей обладают высокой толерантностью и пластичностью к изменениям условий внешней среды и способностью сохранять высокую функциональную активность в этих условиях. Другая возможная причина полученных высоких значений флуоресценции FDA при воздействии на клетки водорослей стресс-факторов заключается в стимуляции активности внутриклеточных эстераз с целью адаптации чего, кого? к неблагоприятным условиям окружающей среды. Подобная теория ранее рассматривалась в исследованиях микроводорослей, подверженных воздействию ряда загрязняющих веществ, например, паракват или медь [4–6]. В-третьих, флуоресценция FDA устойчива к факторам среды, если лимитирование роста водорослей имеет обратимый характер, и уровень воздействующего фактора не приводит к необратимой деструкции клеток и гибели исследуемого объекта.
Нам представляется, что флуоресценция FDA является консервативным параметром, отражающим функциональное состояние клеток водорослей, и ее заметное изменение наблюдается при необратимом воздействии факторов. В подтверждение данного тезиса можно привести работы, где культуры водорослей подвергали воздействию различного рода токсичных веществ. Результаты, отраженные в данных исследованиях, также показали, что флуоресценция FDA не коррелирует с теми функциональными параметрами клеток водорослей, которые способны к восстановлению своих показателей в случае изменений условий окружающей среды в сторону оптимальных значений для роста [4–6].
Таким образом, предложенный консервативный параметр – флуоресценция FDA, отражающая изменение функционального состояния водорослей в результате необратимых воздействий окружающей среды, – может быть использован для: (а) оперативной интегральной оценки состояния и функционирования морских экосистем в связи с естественными и антропогенными влияниями; (б) индикации летальных воздействий на клетки водорослей; (в) контроля санитарно-биологического состояния прибрежных вод. Это позволит избежать трудоемких и длительных во времени традиционных методов оценки функционального состояния водорослей и повысить качество и оперативность диагностирования стрессовых состояний фитопланктонного сообщества.
Работа выполнена в рамках темы государственного задания № АААА-А18-118021490093-4 “Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом”.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Dorsey J. Rapid analytical technique for the assessment of cell metabolic activity in marine microalgae // Cytometry Part A. 1989. V. 10. P. 622. https://doi.org/10.1002/cyto.990100518
Onji M., Sawabe Y., Ezura T. An evaluation of viable staining dyes suitable for marine phytoplankton // Bull. Fac. Fish. 2000. V. 51. P. 151.
Geary S., Ganf G., Brookes J. The use of FDA and flow cytometry to measure the metabolic activity of the cyanobacteria Microcystis aeruginosa // SIL Proceedings, 1922-2010 1998. V. 26. P. 2367. https://doi.org/10.1080/03680770.1995.11901173
Prado R., Rioboo C., Herrero C., Cid A. Characterization of cell response in Chlamydomonas moewusii cultures exposed to the herbicide paraquat: Induction of chlorosis // Aquat. Toxicol. 2011. V. 102. P. 10. https://doi.org/10.1016/j.aquatox.2010.12.013
Соломонова Е., Акимов А. Оценка функционального состояния культуры Chlorella vulgaris suboblonga методами проточной цитометрии и переменной флуоресценции // Мор. экол. журн. 2014. Т. 1. С. 73.
Peterson S., Stauber L. New algal enzyme bioassay for the rapid assessment of aquatic toxicity // Bull. Environ. Contam. Toxicol. 1996. V. 56. P. 750. https://doi.org/10.1007/s001289900110
Franqueira D., Orosa M., Torres E., Herrero C., Cid A. Potential use of flow cytometry in toxicity studies with microalgae // Sci. Total Environ. 2000. V. 247. P. 119. https://doi.org/10.1016/S0048-9697(99)00483-0
Falkowski P., Kolber Z. Variations in chlorophyll fluorescence yields in phytoplankton in the world oceans // Funct. Plant Biol. 1995. V. 22. P. 341. https://doi.org/10.1071/PP9950341
Owens T.G. Energy transformation and fluorescence in photosynthesis. In: Particle Analysis in Oceanography / Ed. Demers S. Berlin, Heidelberg: Springer, 1991. P. 101. https://doi.org/10.1007/978-3-642-75121-9_6
Fujiki T., Taguchi S. Variability in chlorophyll a specific absorption coefficient in marine phytoplankton as a function of cell size and irradiance // J. Plankton Res. 2002. V. 24. P. 859. https://doi.org/10.1093/plankt/24.9.859
Прошкина-Лавренко А.И. Диатомовые водоросли планктона Черного моря. Москва: Изд-во АН СССР, 1955. 222 с.
Грабарник В.И., Карелин Н.В., Богданов Н.И. Патент РФ 2644653 С1, 2018.
Масюк Н.П. Масова культура каротиноносної водоростi Dunaliella salina Teod. // Укр. ботан. журн. 1966. Т. 23. С. 12.
Guillard R., Ryther J. Studies of marine planktonic diatoms: I. Cyclotella Nana Hustedt, and Detonula Confervacea (CLEVE) Gran // J. Can. Microbiol. 1962. V. 8. P. 229. https://doi.org/10.1139/m62-029
Шоман Н., Акимов А. Влияние фотоадаптации на удельную скорость роста и соотношение органического углерода к хлорофиллу а у диатомовой водоросли Phaeodactylum tricornutum // Мор. экол. журн. 2013. Т. 12. С. 97.
Финенко З.З., Ланская Л.А. Рост и скорость деления водорослей в лимитированных объемах воды // Экологическая физиология морских планктонных водорослей (в условия культур) / Под ред. К.М. Хайлова. Киев: Наукова думка, 1971. С. 22.
Соломонова Е., Муханов В. Оценка доли физиологически активных клеток в накопительных культурах Phaeodactylum tricornutum и Nitzschia sp с помощью проточной цитометрии // Мор. экол. журн. 2011. Т. 10. С. 67.
Kromkamp J., Barranguet C., Peene J. Determination of microphytobenthos PSII quantum efficiency and photosynthetic activity by means of variable chlorophyll fluorescence // Mar. Ecol. Prog. Ser. 1998. V. 162. P. 45.
Pogosyan S., Matorin D. Variability in the condition of the photosynthetic system of the Black Sea phytoplankton // Oceanology. 2005. V. 45. P. 139.
Kok B., Gassner E., Rurainski H. Photoinhibition of chloroplast reactions // Photochem. Photobiol. 1956. V. 4. P. 215. https://doi.org/10.1111/j.1751-1097.1965.tb05739.x
Powles S.B. Photoinhibition of photosynthesis induced by visible light // Annu. Rev. Plant Physiol. 1984. V. 35. P. 15. https://doi.org/10.1146/annurev.pp.35.060184.000311
Antal T., Venediktov P., Matorin D., Ostrowska M., Wozniak B., Rubin A. Measurement of phytoplankton photosynthesis rate using a pump-and-probe fluorometer // Oceanology. 2001. V. 43. P. 291.
Beutler M., Wiltshire K., Meyer B., Moldaenke C., Luring C., Meyegho M., Hansen Ansen U., Dau H. A fluorometric method for the differentiation of algal populations in vivo and in situ // Photosnth. Res. 2000. V. 72. P. 39.
Garvey M., Moriceau B., Passow U. Applicability of the FDA assay to determine the viability of marine phytoplankton under different environmental conditions // Mar. Ecol. Prog. Ser. 2007. V. 352. P. 17. https://doi.org/10.3354/meps07134
Peperzak L., Brussaard C. Flow cytometric applicability of fluorescent vitality probes of phytoplankton // J. Phycol. 2011. V. 47. P. 692. https://doi.org/10.1111/j.1529-8817.2011.00991.x
Claquin P., Probert I., Lefebvre S., Veron B. Effects of temperature on photosynthetic parameters and TEP production in eight species of marine microalgae // Aquat. Microb. Ecol. 2008. V.51. P. 1. https://doi.org/10.3354/ame01187
Chalifour A., Juneau P. Temperature-dependent sensitivity of growth and photosynthesis of Scenedesmus obliquus, Navicula pelliculosa and two strains of Microcystis aeruginosa to the herbicide atrazine // Aquat. Toxicol. 2011. V. 103. P. 9. https://doi.org/10.1016/j.aquatox.2011.01.016
Kulk G., Poll W. van de, Visser R., Buma A. Low nutrient availability reduces high-irradiance-induced viability loss in oceanic phytoplankton // Limnol. Oceanogr. 2013. V. 58. P. 1747. https://doi.org/10.4319/lo.2013.58.5.1747
Franklin D., Berges J. Mortality in cultures of the dinoflagellate Amphidinium carterae during culture senescence and darkness // Proc. R. Soc. London, Ser. B. 2004. V. 271. P. 2099. https://doi.org/10.1098/rspb.2004.2810
Parkhill J., Maillet G., Cullen J. Fluorescence-based maximal quantum yield for PS II as a diagnostic of nutrient stress // J. Phycol. 2001. V. 37. P. 517. https://doi.org/10.1046/j.1529-8817.2001.037004517.x
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


