Физиология растений, 2021, T. 68, № 6, стр. 644-653
Изменение активности инвертаз при закаливании Nicotiana tabacum L. и Arabidopsis thaliana Heynh. (L.) к гипотермии
В. Н. Попов a, *, Н. В. Астахова a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: vnpopov@mail.ru
Поступила в редакцию 24.12.2020
После доработки 30.12.2020
Принята к публикации 01.01.2021
Аннотация
Исследовали изменение активности инвертаз при закаливании теплолюбивых растений Nicotiana tabacum L. и холодостойких – Arabidopsis thaliana Heynh. (L.) к гипотермии. Показано, что при закаливании у табака наблюдалось 20% снижение активности цитоплазматической и вакуолярной инвертаз и почти двукратное увеличение активности инвертазы клеточной стенки. У арабидопсиса за время закаливания происходило более чем двукратное увеличение активности всех трех типов инвертаз. В процессе закаливания у табака наблюдался 20% рост содержания сахаров. При этом доли сахарозы и гексоз (фруктоза и глюкоза) как до, так и после закаливания были равными и составляли примерно по 50%. В растениях арабидопсиса за время закаливания содержание сахаров возрастало в 2.5 раза, при этом происходило уменьшение доли сахарозы в общей массе сахаров (с 44 до 24%) и увеличение доли гексоз (с 56 до 76%). Сделано предположение, что повышение активности инвертазы клеточной стенки у обоих видов исследуемых растений тормозило отток ассимилятов и создавало предпосылки для накопления продуктов фотосинтеза в клетках мезофилла листа у растений табака и арабидопсиса. Снижение активности цитоплазматической и вакуолярной инвертаз у N. tabacum ограничивало образование гексоз в клетках и снижало эффективность закаливания растений табака. Более чем двукратный рост содержания растворимых углеводов у арабидопсиса достигался, главным образом, за счет накопления гексоз, в результате повышения активности цитоплазматической и вакуолярной инвертаз, что обеспечивало высокую эффективность закаливания A. thaliana к гипотермии.
ВВЕДЕНИЕ
Гипотермия является одним из наиболее распространенных экологических факторов, влияющих на метаболизм растений и определяющих их продуктивность и географическое распространение на планете. Растения способны существенно повышать устойчивость к повреждающему действию холода и мороза в процессе закаливания, которое происходит при экспозиции растений в условиях низких, но не повреждающих температур [1].
Накопление сахаров при гипотермии – одна из наиболее хорошо изученных защитных реакций растений, которая реализуется в процессе закаливания [2]. Сахароза, глюкоза и фруктоза служат основным источником энергии и предшественниками при синтезе других веществ с защитным эффектом, выполняют осморегуляторную, криопротекторную, антиоксидантную и сигнальную функции [3].
Реализация защитных свойств сахаров при гипотермии во многом зависит от активности гидролитического фермента инвертазы (β−фруктофуранозидаза, КФ 3.2.1.26), которая расщепляет основную транспортную форму сахаров – сахарозу – на глюкозу и фруктозу [4]. В растениях имеется три типа инвертаз, различающихся по субклеточной локализации, растворимости и рН оптимуму. Локализованная в клеточной стенке и связанная с ней ионными связями инвертаза, а также растворимая вакуолярная форма фермента, проявляют максимальную активность при рН от 4.5 до 5.0. Растворимая инвертаза, локализованная в цитоплазме растительной клетки, имеет рН оптимум в области 7.0–7.8 [4].
В литературе имеются многочисленные и довольно разнообразные данные, касающиеся изменения активности инвертаз в условиях низких температур. Как правило, участие инвертаз в закаливании растений к гипотермии связывают с мобилизацией растворимых углеводов, необходимых для формирования повышенной холодоустойчивости. Так, в работе [5] было показано, что двукратное увеличение активности инвертазы клеточной стенки при закаливании Solanum tuberosum L. приводило к существенному росту содержания сахаров внутриклеточной и апопластной локализации и к повышению устойчивости растений картофеля к гипотермии. Растения арабидопсиса, трансформированные геном CsINV5 вакуолярной инвертазы из Camellia sinensis L., отличались от контрольных растений измененным соотношением сахароза/гексозы, увеличенным содержанием гексоз и повышенной устойчивостью к гипотермии [6].
Показано участие вакуолярной инвертазы в стабилизации фотосинтеза у растений A. thaliana в условиях низких температур [7]. Авторы этой работы установили, что имеющие пониженную активность вакуолярной инвертазы мутанты арабидопсиса inv4, отличались от растений дикого типа более низкими значениями максимального квантового выхода ФС II и скорости ассимиляции СО2 при гипотермии. При этом увеличение активности цитоплазматической инвертазы не могло компенсировать дефицит активности вакуолярной инвертазы [7].
Имеются данные о вовлечении инвертаз в процесс защиты растений от окислительного стресса. Так, мутанты A. thaliana по генам, кодирующим цитоплазматическую инвертазу, характеризовались повышенным уровнем экспрессии генов, участвующих в защите от окислительного стресса [8]. В другой работе показано, что растения S. tuberosum, трансформированные геном инвертазы дрожжей апопластной локализации, в условиях гипотермии имели повышенное содержание сахаров и значительно меньшую интенсивность перекисного окисления липидов по сравнению с нетрансформированными растениями [9].
Помимо работ, описывающих существенный вклад инвертаз в закаливание растений к гипотермии, имеются публикации, в которых авторы отрицают участие инвертаз в этом процессе. Так, было показано значительное снижение активности вакуолярной инвертазы в процессе закаливания Brassica oleracea L. При этом содержание сахаров, особенно глюкозы и фруктозы, в листьях капусты возрастало в 3–4 раза. На основе этих данных авторы сделали вывод о том, что вакуолярная инвертаза не играет существенной роли в аккумуляции сахаров и в формировании устойчивости растений капусты к низким температурам [10].
Таким образом, представленные в литературе данные об участии инвертаз в закаливании растений к гипотермии сильно различаются в зависимости от видовой специфики исследуемых растений и условий проведения экспериментов. Кроме того, значительное число публикаций не содержит данных об активности всех типов инвертаз имеющихся в клетке, что затрудняет анализ роли этих ферментов в формировании устойчивости к гипотермии.
Цель работы – исследование изменения активности вакуолярной, цитоплазматической и связанной с клеточной стенкой инвертаз у теплолюбивых (Nicotiana tabacum L.) и холодостойких (Arabidopsis thaliana Heynh. (L.)) растений в связи с особенностями аккумуляции растворимых углеводов при закаливании этих растений к гипотермии.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. Объектами исследования являлись теплолюбивые растения табака (Nicotiana tabacum L., сортотип Samsun) и холодостойкие растения арабидопсиса (Arabidopsis thaliana Heynh. (L.), экотип Columbia). Растения выращивали в вазонах с почвой в камерах фитотрона ИФР РАН при следующих условиях: табак – температура 22°С, 16-часовой фотопериод и освещенность 100 мкмоль/(м2 с), арабидопсис – температура 22°С, 8-часовой фотопериод и освещенность 100 мкмоль/(м2 с). Выбор 8-часового режима светового дня для арабидопсиса обусловлен тем, что он относится к длиннодневным растениям и при использовании короткого дня достигает необходимой для исследований биомассы розетки, не переходя в фазу цветения. Для опытов использовали растения в возрасте шести недель. Закаливание растений проводили в климатической камере KBW – 240 (“Binder”, Германия) в течение 5 сут при температуре 8°С для табака и 2°С для арабидопсиса, оставляя другие условия выращивания без изменений. Данные режимы закаливания были подобраны в ходе предварительных опытов. В качестве контроля использовали растения, не подвергнутые воздействию закаливающей температуры.
Устойчивость растений к гипотермии. Для оценки устойчивости N. tabacum и A. thaliana к низким температурам незакаленные и закаленные растения обоих видов тестировали в климатической камере MIR−153 (“Sanyo”, Япония) в течение 1 сут при температурах от –1 до –4°С для табака и при температурах от –1 до –8°С для арабидопсиса. После промораживания растения переносили в оптимальные для вегетации условия на одну неделю. Выживаемость растений рассчитывали как количество выживших растений в % от общего количества растений подвергнутых тестированию при каждой температуре.
Определение содержания сахаров. Навески листьев N. tabacum и A. thaliana (~500 мг) фиксировали 96% кипящим этанолом. Ткань растирали в фарфоровой ступке и сахара извлекали трехкратной экстракцией 80% этанолом. В полученных экстрактах определяли содержание глюкозы – глюкозооксидазным методом, сахарозы и фруктозы – по методу Рое [11]. Полученные результаты выражали в мг/г сухой массы.
СО2-газообмен растений. Изучение СО2-газообмена растений N. tabacum и A. thaliana проводили на установке открытого типа с инфракрасным газоанализатором URAS 2T (Германия) при 22°С (контроль), 8°С (закаленные растения табака) и 2°С (закаленные растения арабидопсиса), т.е. при температурах, идентичных температурам вегетации и холодового закаливания. Измерения газообмена включали определение скорости видимой ассимиляции СО2 и темнового дыхания, которые выражали в мг СО2/(г сухой массы ч). На основе этих параметров рассчитывали отношение видимый фотосинтез/темновое дыхание [12].
Электронно-микроскопическое исследование ультраструктуры хлоропластов. Для получения препаратов для микроскопии использовали фрагменты из срединной части хорошо развитых листьев N. tabacum и A. thaliana. Растительный материал фиксировали в течение 4 ч 2.5% глутаровым альдегидом в 0.1 М фосфатном буфере (pH 7.4) при температуре 4°С. После 4-кратной промывки фосфатным буфером материал фиксировали 1% раствором OsO4, обезвоживали последовательно растворами этанола в возрастающих концентрациях и ацетоном, а затем заливали в Epon – 812. Ультратонкие срезы листьев растений получали на ультрамикротоме LKB3 (“LKB”, Швеция). Срезы просматривали при помощи электронного микроскопа LIBRA120 (“ZEISS”, Германия) при увеличении ×4000. Измерение площади крахмальных зерен в хлоропластах проводили при помощи встроенного программного обеспечения электронного микроскопа LIBRA120 (“ZEISS”, Германия), при этом просматривали не менее 100 хлоропластов каждого варианта [13].
Определение активности инвертаз. Навески листьев N. tabacum и A. thaliana (по 1 г) растирали в фарфоровой ступке на холоде в фосфатно-цитратной буферной смеси рН 7.0, состоящей из 0.1 М лимонной кислоты и 0.2 М Na2HPO4·2H2O. Полученный гомогенат для удаления сахаров, содержащихся в тканях, диализовали 20 ч при температуре 4°С против разбавленной в 10 раз фосфатно-цитратной буферной смеси. Затем гомогенат центрифугировали 20 мин при 18 600 g при помощи центрифуги К24D (“MLW”, Германия). Супернатант использовали для определения активности растворимых вакуолярной и цитоплазматической инвертаз. Осадок трижды промывали разбавленным буфером, центрифугируя суспензию каждый раз при 200 g и получая фракцию клеточных стенок, которую использовали для определения активности инвертазы клеточной стенки. Инкубационная смесь общим объемом 0.5 мл содержала 0.2 мл фракции фермента, 0.3 мл буфера с сахарозой, конечная концентрация которой в смеси составляла 150 мМ. Для определения активности кислых инвертаз (вакуолярная инвертаза и инвертаза клеточной стенки) использовали 1 М ацетатный буфер (рН 4.7), для щелочной (цитоплазматическая инвертаза) – фосфатно-цитратную буферную смесь (рН 7.5). Время инкубации составляло 1 ч, при температуре 30°С. Об активности фермента судили по количеству образовавшейся в инкубационной среде глюкозы, которую определяли глюкозооксидазным методом [14].
Во всех экспериментах биологическая повторность измерений была 6-кратной, аналитическая 3–4-кратной. Каждый эксперимент повторяли не менее 3–4 раз. Результаты экспериментов обработаны статистически с помощью программы SigmaPlot 12.3. На гистограммах представлены средние значения и их стандартные ошибки. Достоверность различий между средними значениями оценена по t-критерию Стьюдента для 95% уровня значимости (P < 0.05). Достоверно различающиеся между собой величины обозначены разными надстрочными буквами.
РЕЗУЛЬТАТЫ
Устойчивость растений N. tabacum и A. thaliana к гипотермии
Об устойчивости исследуемых растений к гипотермии судили по их выживаемости после промораживания при различных температурах. Из данных представленных в табл. 1 видно, что незакаленные растения табака после промораживания при температуре –1°С полностью сохраняли свою жизнеспособность. При снижении температуры до –2°С выживаемость N. tabacum составляла 57%, а после –3°С все незакаленные растения погибали. Закаленные растения табака успешно выдерживали температуру –2°С (выживаемость 100%). При температуре –3°С выживало 65% растений, а при –4°С все растения погибали.
Таблица 1.
Выживаемость (%) незакаленных и закаленных растений табака и арабидопсиса после промораживания в течение 1 сут
| Температура промораживания | Выживаемость, % | |||
|---|---|---|---|---|
| Nicotiana tabacum L. | Arabidopsis thaliana Heynh. (L.) | |||
| незакаленные растения | закаленные растения | незакаленные растения | закаленные растения | |
| –1°C | 100 | 100 | 100 | 100 |
| –2°C | 57 ± 9 | 100 | 100 | 100 |
| –3°C | 0 | 65 ± 8 | 100 | 100 |
| –4°C | 0 | 0 | 55 ± 5 | 100 |
| –5°C | 0 | 0 | 0 | 100 |
| –6°C | 0 | 0 | 0 | 100 |
| –7°C | 0 | 0 | 0 | 45 ± 6 |
| –8°C | 0 | 0 | 0 | 0 |
Все незакаленные растения арабидопсиса выживали при температурах промораживания вплоть до ‒3°С. При температуре –4°С выживаемость снижалась почти в 2 раза (до 55%), а при –5°С падала до нуля. После закаливания растения арабидопсиса демонстрировали 100% выживаемость при температурах до –6°С. Промораживание при –7°С вызывало снижение выживаемости A. thaliana до 45%, а при –8°С – до нуля.
Содержание сахаров в растениях N. tabacum и A. thaliana
Данные по изменению содержания сахаров в листьях растений табака и арабидопсиса при низкотемпературном закаливании представлены в табл. 2. В процессе закаливания у табака происходил ~20% рост содержания сахаров (с 15.5 до 19.6 мг/г сухой массы), который достигался за счет почти равномерного увеличения содержания фруктозы, глюкозы и сахарозы. При этом соотношение разных форм сахаров за время низкотемпературного закаливания практически не изменялось (табл. 3). Доли сахарозы и гексоз (фруктоза и глюкоза) как до, так и после закаливания были равными и составляли примерно по 50%.
Таблица 2.
Изменение содержания сахаров в листьях растений табака и арабидопсиса при закаливании к гипотермии
| Вариант опыта | Содержание сахаров, мг/г сухой массы | |||
|---|---|---|---|---|
| фруктоза | глюкоза | сахароза | сумма сахаров | |
| Nicotiana tabacum L. | ||||
| Незакаленные растения | 1.8 ± 0.1a | 5.7 ± 0.4a | 8.0 ± 0.4a | 15.5 ± 0.8a |
| Закаленные растения | 2.4 ± 0.2b | 7.5 ± 0.3b | 9.7 ± 0.5b | 19.6 ± 0.9b |
| Arabidopsis thaliana Heynh. (L.) | ||||
| Незакаленные растения | 1.4 ± 0.3a | 11.8 ± 0.9c | 10.5 ± 0.6b | 23.7 ± 1.7c |
| Закаленные растения | 4.9 ± 0.5c | 41.1 ± 2.2d | 14.3 ± 0.5c | 60.3 ± 3.4d |
Таблица 3.
Изменение соотношения разных форм сахаров в листьях растений табака и арабидопсиса при закаливании к гипотермии
| Вариант опыта | Содержание сахаров, % от суммы сахаров | |||
|---|---|---|---|---|
| фруктоза | глюкоза | сумма гексоз | сахароза | |
| Nicotiana tabacum L. | ||||
| Незакаленные растения | 12 ± 1a | 37 ± 3a | 49 ± 4a | 51 ± 3a |
| Закаленные растения | 12 ± 1a | 38 ± 2a | 50 ± 4a | 50 ± 3a |
| Arabidopsis thaliana Heynh. (L.) | ||||
| Незакаленные растения | 6 ± 1b | 50 ± 4b | 56 ± 5a | 44 ± 3a |
| Закаленные растения | 8 ± 1b | 68 ± 4c | 76 ± 5b | 24 ± 1b |
В растениях арабидопсиса за время закаливания суммарное содержание сахаров возрастало в 2.5 раза (с 23.7 до 60.3 мг/г сухой массы). Такой результат был получен за счет увеличения содержания сахарозы почти на 40%, а фруктозы и глюкозы – в 3.5 раза. При закаливании A. thaliana значительно изменялось соотношение разных форм сахаров в сторону уменьшения доли сахарозы в общей массе сахаров (с 44 до 24%) и увеличения доли гексоз (с 56 до 76%).
СО2-газообмен растений N. tabacum и A. thaliana
В ходе проведенных экспериментов было установлено, что у обоих видов исследуемых растений, параметры СО2-газообмена в процессе закаливания к гипотермии изменялись практически одинаково (рис. 1а, б). Интенсивность видимого фотосинтеза снижалась в 2 раза: с 6.5 до 3.1 мг СО2/г сухой массы ч у табака, и с 9.4 до 4.7 мг СО2/г сухой массы ч у арабидопсиса. Интенсивность темнового дыхания уменьшалась примерно в 3 раза: с 4.8 до 1.5 мг СО2/г сухой массы ч у табака, и с 6.3 до 2.1 мг СО2/г сухой массы ч у арабидопсиса. Такие изменения СО2-газообмена приводили к 1.5-кратному росту отношения видимый фотосинтез/темновое дыхание у обоих видов.
Рис. 1.
Изменение параметров СО2-газообмена растений табака (а) и арабидопсиса (б) при закаливании к гипотермии (1 – видимый фотосинтез, 2 – темновое дыхание, 3 – отношение видимый фотосинтез/темновое дыхание). Достоверные различия средних значений при Р < 0.05 отмечены разными латинскими буквами над барами.

Площадь крахмальных зерен в хлоропластах N. tabacum и A. thaliana
Электронно-микроскопические наблюдения показали, что в процессе закаливания N. tabacum и A. thaliana наблюдались существенные изменения как площади, так и количества крахмальных зерен в хлоропластах (рис. 2, 3). У табака площадь одного крахмального зерна и суммарная площадь крахмальных зерен в хлоропласте увеличивалась более чем в 2 раза (табл. 4). В результате таких изменений доля крахмальных зерен от площади хлоропласта возрастала с 24 до 46%.
Рис. 2.
Изменение площади и количества крахмальных зерен в хлоропластах растений табака при закаливании к гипотермии (а – незакаленные растения, б – закаленные растения). КЗ – крахмальное зерно. Масштабная шкала – 1 мкм.
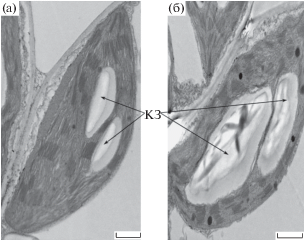
Рис. 3.
Изменение площади и количества крахмальных зерен в хлоропластах растений арабидопсиса при закаливании к гипотермии (а – незакаленные растения, б – закаленные растения). КЗ – крахмальное зерно. Масштабная шкала – 1 мкм.

Таблица 4.
Изменение площади крахмальных зерен в хлоропластах растений табака и арабидопсиса при закаливании к гипотермии
| Измеряемый параметр | Nicotiana tabacum L. | Arabidopsis thaliana Heynh. (L.) | ||
|---|---|---|---|---|
| незакаленные растения | закаленные растения | незакаленные растения | закаленные растения | |
| Площадь одного крахмального зерна, мкм2 | 1.20 ± 0.10a | 2.70 ± 0.15b | 0.44 ± 0.08c | 0.40 ± 0.07c |
| Суммарная площадь крахмальных зерен в хлоропласте, мкм2 | 3.13 ± 0.26a | 8.23 ± 0.40b | 0.86 ± 0.11c | 1.12 ± 0.08d |
| Доля крахмальных зерен от площади среза хлоропласта, % | 24 ± 2a | 46 ± 3b | 12 ± 1.6c | 16 ± 1.2d |
У арабидопсиса, в отличие от табака, площадь одного крахмального зерна за время закаливания не изменялась, но за счет увеличения количества крахмальных зерен (рис. 3), суммарная площадь крахмальных зерен в хлоропласте возрастала почти на 25% (табл. 4). Это приводило к увеличению доли крахмальных зерен, рассчитанной от площади среза хлоропласта с 12 до 16%.
Активность инвертаз в растениях N. tabacum и A. thaliana
Данные по изменению активности инвертаз в листьях растений табака и арабидопсиса при низкотемпературном закаливании представлены на рисунке 4. В процессе закаливания у табака наблюдалось ~20% снижение активности цитоплазматической и вакуолярной инвертаз и почти двукратное увеличение активности инвертазы клеточной стенки (рис. 4а).
Рис. 4.
Изменение активности инвертаз в листьях растений табака (а) и арабидопсиса (б) при закаливании к гипотермии (1 – цитоплазматическая инвертаза, 2 – вакуолярная инвертаза, 3 – инвертаза клеточной стенки). Достоверные различия средних значений при Р < 0.05 отмечены разными латинскими буквами над барами.

В листьях арабидопсиса за время закаливания к гипотермии происходило более чем двукратное увеличение активности всех трех типов инвертаз (рис. 4б).
ОБСУЖДЕНИЕ
Закаливание растений приводит к формированию повышенной устойчивости к гипотермии, позволяющей растениям выдерживать более низкие повреждающие температуры по сравнению с незакаленными растениями [15]. Одним из наиболее часто используемых методов, позволяющих достоверно оценить эффективность закаливания, является метод прямого промораживания целых растений с последующей оценкой их выживаемости [16]. Полученные нами данные показали, что растения N. tabacum и A. thaliana в результате закаливания повышали свою устойчивость к отрицательным температурам, хотя и в разной степени. Если судить по температуре выживания всех тестируемых растений (выживаемость 100%), то можно констатировать, что в результате закаливания растения табака повышали свою устойчивость к морозу на 1°С (с –1 до –2°С). Эффективность закаливания A. thaliana оказалась значительно выше. Закаленные растения арабидопсиса повышали свою морозоустойчивость на 3°С (с –3 до –6°С).
Известно, что причиной повреждения и гибели растений при отрицательных температурах является образование льда в их тканях. Образование кристаллов льда внутри клетки всегда приводит к ее гибели. Внеклеточное образование льда позволяет предотвратить механические внутриклеточные повреждения и сохранить жизнеспособность клеток растений [17]. Поэтому стратегия адаптации растений к морозу основана на образовании льда в межклетниках и избегании возникновения льда внутри клетки [2].
В реализации этой стратегии существенная роль принадлежит растворимым углеводам, которые накапливаются в растениях в период низкотемпературного закаливания [18]. Проведенные нами эксперименты выявили значительные различия между N. tabacum и A. thaliana по их способности к накоплению сахаров при закаливающих температурах. У растений табака содержание сахаров в листьях увеличивалось лишь на 20%, а у арабидопсиса – в 2.5 раза по сравнению с незакаленными растениями. Эти результаты хорошо согласуются с данными по устойчивости растений табака и арабидопсиса к отрицательным температурам (табл. 1) и могут объяснять большие различия в эффективности закаливания между N. tabacum и A. thaliana.
Возможность накопления сахаров в клетке при закаливающих температурах во многом зависит от соотношения интенсивности процессов фотосинтеза (донор ассимилятов) и дыхания (акцептор ассимилятов) [12]. Наши эксперименты показали, что у обоих исследуемых видов растений интенсивность видимого фотосинтеза в процессе закаливания снижалась в меньшей степени, чем интенсивность темнового дыхания, что приводило к 1.5-кратному росту отношения видимый фотосинтез/темновое дыхание. Одинаковые изменения параметров СО2-газообмена не давали возможности объяснить большие различия в содержании растворимых сахаров у N. tabacum и A. thaliana с точки зрения соотношения процессов фотосинтеза и дыхания.
В литературе имеются данные о том, что деградация крахмальных зерен в хлоропластах может служить в качестве дополнительного источника сахаров при низкотемпературном закаливании [19]. Для проверки этого предположения мы определили площадь крахмальных зерен в хлоропластах, используя методы электронной микроскопии. Оказалось, что площадь крахмальных зерен у N. tabacum и A. thaliana не только не сокращалась за время закаливания, а наоборот, увеличивалась. При этом у арабидопсиса рост суммарной площади крахмальных зерен в хлоропласте ограничивался 25%, а доля крахмальных зерен не превышала 16% от площади среза хлоропласта. У табака синтез крахмала при закаливающих температурах происходил настолько интенсивно, что площадь крахмальных зерен достигала почти половины от площади среза хлоропласта (табл. 4). Таким образом, N. tabacum и A. thaliana существенно отличались по характеру накопления фотоассимилятов при закаливании к гипотермии. Можно предположить, что растения табака аккумулировали большую часть продуктов фотосинтеза в виде крахмала, что ограничивало их способность к накоплению растворимых углеводов в листьях и снижало эффективность закаливания. У растений арабидопсиса, в отличие от табака, большая часть ассимилятов, по-видимому, накапливалась в виде сахаров в листьях, что создавало потенциал для формирования повышенной устойчивости к отрицательным температурам.
Наряду с накоплением сахаров, закаливание к гипотермии изменяло и соотношение разных форм сахаров в листьях исследуемых растений. Если у табака доли сахарозы и гексоз как до, так и после закаливания составляли примерно по 50%, то у арабидопсиса значительно увеличивалась доля гексоз (главным образом, глюкозы) в общей массе сахаров, за счет почти двукратного сокращения доли сахарозы (табл. 3). Поскольку изменение соотношения сахарозы и гексоз зависит от активности инвертаз, осуществляющих гидролиз сахарозы в клетках [20], мы провели серию экспериментов по определению активности инвертаз до и после закаливания.
Наши исследования выявили как общие для растений табака и арабидопсиса изменения в активности инвертаз при закаливании, так и существенные различия между исследуемыми видами. К числу общих для обоих видов можно отнести реакцию инвертазы клеточной стенки на закаливание, а именно – увеличение ее активности в два раза по сравнению с незакаленными растениями. Как известно, инвертаза клеточной стенки принимает участие в регуляции загрузки флоэмы ассимилятами [21]. В зависимости от организации контактов между клетками мезофилла и флоэмы, различают симпластный и апопластный типы загрузки флоэмы ассимилятами. Виды растений, имеющие единый для мезофилла и флоэмы симпласт и транспортирующие ассимиляты по межклеточной сети плазмодесм, называют симпластными. Виды с разобщенными симпластными доменами мезофилла и флоэмы, использующие апопласт в качестве промежуточного накопителя ассимилятов перед их загрузкой во флоэму, относят к апопластным [22]. Для растений N. tabacum и A. thaliana, имеющих апопластный тип загрузки флоэмы [23], активность инвертазы клеточной стенки в апопласте имеет большое значение в регуляции процесса оттока ассимилятов из листьев в корни. Можно предположить, что повышение активности инвертазы клеточной стенки приводило к ускорению расщепления сахарозы в апопласте и, тем самым, к торможению загрузки флоэмы у закаленных растений табака и арабидопсиса. Образовавшиеся в процессе гидролиза сахарозы гексозы поступали обратно в клетки мезофилла, увеличивая содержание сахаров в листьях [24].
Основные различия в активности инвертаз между N. tabacum и A. thaliana были связаны с функционированием внутриклеточных инвертаз. За время закаливания к гипотермии в клетках табака и арабидопсиса происходили разнонаправленные изменения активности цитоплазматической и вакуолярной инвертаз, которые могли определять особенности накопления сахаров в листьях исследуемых видов. В наших экспериментах наблюдалось ~20% снижение у табака и двукратное увеличение активности данных инвертаз у арабидопсиса. Снижение активности внутриклеточных инвертаз у N. tabacum ограничивало образование гексоз в клетках, поэтому соотношение сахарозы и гексоз за время низкотемпературного закаливания у этих растений практически не изменялось. Значительное увеличение доли гексоз одновременно со снижением доли сахарозы при закаливании A. thaliana можно объяснить повышением активности цитоплазматической и вакуолярной инвертаз. Работа инвертаз, приводящая к увеличению доли гексоз в общей массе сахаров, при закаливании имеет важное значение для формирования устойчивости растений к отрицательным температурам [25]. Образование в результате гидролиза молекулы сахарозы двух молекул (глюкозы и фруктозы) повышает осмотический потенциал клетки, что позволяет снижать температуру замерзания раствора, при которой происходит образование кристаллов льда [26].
Высокое содержание глюкозы в клетках закаленных растений A. thaliana, помимо осмотической и криопротекторной функции, могло иметь и сигнальную функцию. В литературе имеются данные об участии глюкозы в передаче внутриклеточных сигналов [27]. В качестве сенсора глюкозы рассматривается гексокиназа 1 (HXK1), локализованная в цитозоле, хлоропластах, митохондриях и ядре [28]. В литературе представлены данные об активации экспрессии генов COR15B и LEA3 в ответ на увеличение содержания гексоз в клетках растений арабидопсиса в условиях низких температур [6, 19]. Одна из основных функций белков, кодируемых генами холодового ответа (COR), а также генами белков позднего эмбриогенеза (LEA) заключается в защите клеточных структур от дегидратации [29]. Поэтому можно предположить, что HXK1 могла воспринимать увеличение концентрации глюкозы в клетках арабидопсиса, участвовать в трансдукции глюкозного сигнала и, тем самым, активировать экспрессию генов, отвечающих за формирование устойчивости клеток к обезвоживанию, что имеет большое значение для повышения морозоустойчивости растений [30].
Таким образом, на основе полученных данных можно констатировать, что у растений N. tabacum и A. thaliana инвертазы играли существенную роль в закаливании к гипотермии. Можно предположить, что повышение активности инвертазы клеточной стенки у обоих видов исследуемых растений тормозило загрузку флоэмы и отток ассимилятов из листьев в корни. Это создавало предпосылки для накопления продуктов фотосинтеза в клетках мезофилла листа у растений табака и арабидопсиса. Снижение активности цитоплазматической и вакуолярной инвертаз у табака приводило к торможению гидролиза сахарозы в клетках этого растения. Низкий уровень накопления гексоз одновременно с интенсивным синтезом крахмала в хлоропластах ограничивал способность к накоплению сахаров и снижал эффективность низкотемпературного закаливания растений табака. Растения арабидопсиса, в отличие от табака, аккумулировали большую часть ассимилятов в виде растворимых углеводов, а не крахмала в хлоропластах. Более чем двукратный рост содержания сахаров у арабидопсиса достигался, главным образом, за счет накопления гексоз, в результате повышения активности цитоплазматической и вакуолярной инвертаз, что обеспечивало высокую эффективность закаливания A. thaliana к гипотермии.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ в рамках государственного задания (номер темы 121040800153-1 “Механизмы адаптации растений к факторам аридизации глобального климата и антропогенному загрязнению окружающий среды”).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Larcher W. Physiological Plant Ecology. Ecophysiology and stress physiology of functional groups. Springer: Berlin, Heidelberg, New York, 2003. P. 513.
Трунова Т.И. Растение и низкотемпературный стресс. 64-е Тимирязевские чтения. М.: Наука, 2007. 54 с.
Tarkowski L.P. and Van den Ende W. Cold tolerance triggered by soluble sugars: a multifaceted countermeasure // Front Plant Sci. 2015. V. 6. Article 203. https://doi.org/10.3389/fpls.2015.00203
Sturm A. Invertases. Primary structures, functions, and roles in plant development and sucrose partitioning // Plant Physiol. 1999. V. 121. P. 1. https://doi.org/10.1104/pp.121.1.1
Deryabin A.N., Burakhanova E.A., Trunova T.I. Apoplastic sugars and cell wall invertase are involved in formation of the tolerance of cold_resistant potato plants to hypothermia // Doklady Biochemistry and Biophysics. 2015. V. 465. P. 366.
Qian W., Xiao B., Wang L., Hao X., Yue C., Cao H., Wang Y., Li N., Yu Y., Zeng J., Yang Y., Wang X. CsINV5, a tea vacuolar invertase gene enhances cold tolerance in transgenic Arabidopsis // BMC Plant Biology. 2018. V. 18. Article 228. https://doi.org/10.1186/s12870-018-1456-5
Weiszmann J., Furtauer L., Weckwerth W., Nagele T. Vacuolar sucrose cleavage prevents limitation of cytosolic carbohydrate metabolism and stabilizes photosynthesis under abiotic stress // FEBS Journal. 2018. V. 285. P. 4082. https://doi.org/10.1111/febs.14656
Xiang L., Le Roy K., Bolouri-Moghaddam M.R., Vanhaecke M., Lammens W., Rolland F., Van den Ende W. Exploring the neutral invertase – oxidative stress defence connection in Arabidopsis thaliana // J. Exp. Bot. 2011. V. 62. P. 3849. https://doi.org/10.1093/jxb/err069
Deryabin A.N., Dubinina I.M., Burakhanova E.A., Astakhova N.V., Sabelnikova E.P., Trunova T.I. Influence of yeast-derived invertase gene expression in potato plants on membrane lipid peroxidation at low temperature // J. Therm Biol. 2005. V. 30. P. 73. https://doi.org/10.1016/j.jtherbio.2004.07.002
Sasaki H., Ichimura K., Imada S., Yamaki S. Sucrose synthase and sucrose phosphate synthase, but not acid invertase, are regulated by cold acclimation and deacclimation in cabbage seedlings // J. Plant Physiol. 2001. V. 158. P. 847.
Туркина М.В., Соколова С.В. Методы определения моносахаридов и олигосахаридов // Биохимические методы в физиологии растений / Под ред. Павлиновой О.А. М.: Наука, 1971. 7 с.
Климов С.В. Холодовое закаливание растений – результат поддержания повышенного отношения фотосинтез/дыхание при низких температурах // Известия РАН. Серия биологическая. 2003. Т. 30. С. 57.
Трунова Т.И., Астахова Н.В., Дерябин А.Н., Сабельникова Е.П. Ультраструктурная организация хлоропластов листьев растений картофеля, трансформированного геном дрожжевой инвертазы, в норме и при гипотермии // Доклады АН. 2003. Т. 389. С. 842.
Klimov S.V., Popov V.N., Dubinina I.M., Burakhanova E.A., Trunova T.I. The decreased cold-resistance of chilling-sensitive plants is related to suppressed CO2 assimilation in leaves and sugar accumulation in roots // Russ. J. Plant Physiol. 2002. V. 49. P. 776.
Xin Z., Browse J. Cold comfort farm: the acclimation of plants to freezing temperatures // Plant Cell Environ. 2000. V. 23. P. 893.
Zuther E., Schulz E., Childs L.H., Hincha D.K. Clinal variation in the non-acclimated and cold–acclimated freezing tolerance of Arabidopsis thaliana accessions // Plant Cell Environ. 2012. V. 35. P. 1860. https://doi.org/10.1111/j.1365-3040.2012.02522.x
Ashworth E.N., Pearce R.S. Extracellular freezing in leaves of freezing-sensitive species // Planta. 2002. V. 214. P. 798.
Ma Y., Zhang Y., Lu J., Shao H. Roles of plant soluble sugars and their responses to plant cold stress // Afr. J. Biotechnol. 2009. V. 8. P. 2004.
Sicher R. Carbon partitioning and the impact of starch deficiency on the initial response of Arabidopsis to chilling temperatures // Plant Science. 2011. V. 181. P. 167. https://doi.org/10.1016/j.plantsci.2011.05.005
Barau J., Grandis A., Carvalho V.M., Teixeira G.S., Zaparoli G.H.A., Scatolin do Rio M.A., Rincones J., Buckeridge M.S., Pereira G.A.G. Apoplastic and intracellular plant sugars regulate developmental transitions in witches broom disease of cacao // J. Exp. Bot. 2015. V. 66. P. 1325. https://doi.org/10.1093/jxb/eru485
Roitsch T., Gonzalez M.C. Function and regulation of plant invertases: sweet sensations // Trends Plant Sci. 2004. V. 9. P. 606.
Гамалей Ю.В. Флоэма листа. СПб.: Наука, 1990. 144 с.
Gamalei Y.V., Pakhomova M.V., Sjutkina A.V. Ecological aspects of assimilate export. Temperature // Fiziol. Rast. 1992. V. 39. P. 1068.
Chikov V.I. Bakirova G.G. Role of the apoplast in the control of assimilate transport, photosynthesis, and plant productivity // Russ. J. Plant Physiol. 2004. V. 51. P. 420.
Livingston D.P., Henson C.A. Apoplastic sugars, fructans, fructan exohydrolase, and invertase in winter oat: responses to second-phase cold hardening // Plant Physiol. 1998. V. 116. P. 403. https://doi.org/10.1104/pp.116.1.403
Reyes-Diaz M., Ulloa N., Zuniga-Feest A., Gutierrez A., Gidekel M., Alberdi M., Corcuera L.J., Bravo L.A. Arabidopsis thaliana avoids freezing by supercooling // J. Exp. Bot. 2006. V. 57. P. 3687.
Gupta A.K., Kaur N. Sugar signaling and gene expression in relation to carbohydrate metabolism under abiotic stresses in plants // J. BioSci. 2005. V. 30. P. 761.
Moore B., Zhou L., Rolland F., Hall Q., Cheng W.H., Liu Y.X. Role of the Arabidopsis glucose sensor HXK1 in nutrient, light, and hormonal signaling // Science. 2003. V. 300. P. 332.
Wilhelm K.S., Thomashow M.F. Arabidopsis thaliana cor15b, an apparent homologue of cor15a, is strongly responsive to cold and ABA, but not drought // Plant Mol. Biol. 1993. V. 23. P. 1073.
Jang J.C., Leόn P., Sheen J. Hexokinase as a sugar sensor in higher plants // Plant Cell. 1997. V. 9. P. 5.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


