Физиология растений, 2021, T. 68, № 6, стр. 631-643
Влияние NaCl на продуктивность и показатели флуоресценции у Nasturtium officinale R. Br. применительно к искусственным замкнутым экосистемам
А. М. Павлова a, b, *, Н. А. Гаевский a, О. В. Анищенко b, Н. А. Тихомирова b, А. А. Тихомиров b, c
a Федеральное государственное автономное образовательное учреждение высшего образования
“Сибирский федеральный университет”
Красноярск, Россия
b Федеральный исследовательский центр “Красноярский научный центр, Институт биофизики
Сибирского отделения Российской академии наук”
Красноярск, Россия
c Федеральное государственное бюджетное образовательное учреждение высшего образования
“Сибирский государственный университет науки и технологий им. академика М.Ф. Решетнева”
Красноярск, Россия
* E-mail: Okcy92@mail.ru
Поступила в редакцию 22.10.2020
После доработки 29.01.2021
Принята к публикации 11.02.2021
Аннотация
Исследованы продуктивность, накопление натрия в абсолютно сухой надземной биомассе (АСНБ) и показатели фотосинтеза у листьев растений водяного кресс-салата (Nasturtium officinale) в условиях, приближенных к искусственным замкнутым экосистемам (ЗЭС). Растения выращивали при различных уровнях содержания NaCl в питательных растворах (0.7, 1.4, 1.8 г/л) в течение 7, 14 и 19 сут после перенесения растений на солевой раствор, соответственно. Продуктивность растений с увеличением уровня засоления на 7 сут не отличалась от контрольных растений. Снижение продуктивности растений отмечали во всех опытных вариантах, начиная с 14 сут после переноса растений на солевой раствор. Повышение концентрации NaCl в питательном растворе от 0.7 до 1.8 г/л приводило к значительному увеличению относительного содержания Na+ в тканях растений вне зависимости от продолжительности действия NaCl. Отмечали значительное снижение отношения суммы хлорофиллов (а + b) к каротиноидам на 7 и 14 сут у растений, выращенных при 1.8 г/л NaCl, и повышение содержания хлорофиллов а и b и каротиноидов на 7 сут у растений, выращенных при 0.7 и 1.4 г/л NaCl, что указывает на устойчивость N. officinale к условиям ЗЭС. Уровень засоления раствора не повлиял на долю хлорофиллов а и b в составе светособирающего хлорофилл (a + b) комплекса растений. Зарегистрированы высокие значения максимального квантового выхода (Y(II)max) ФС II (0.755 ± 0.007) у растений N. officinale. С использованием Imaging PAM Maxi показано, что различия между опытными и контрольными вариантами в характере световой зависимости эффективного квантового выхода фотохимического тушения (Y(II)) и квантового выхода нефотохимического тушения (Y(NPQ)) флуоресценции проявляются преимущественно при длительном действии (19 сут) засоления в вариантах 0.7 и 1.4 г/л. Показано, что NaCl в концентрации 1.8 г/л в период между 14 и 19 сут после переноса растений на раствор не повлиял на характер световых зависимостей Y(II) и Y(NPQ). Обосновываются возможности использования N. officinale как источника NaCl для человека в условиях ЗЭС.
ВВЕДЕНИЕ
Высшие растения обеспечивают газообмен в замкнутых экологических системах (ЗЭС), являются источником воды и растительной пищи, а также активно участвуют в вовлечении органических отходов во внутрисистемный массообмен. В повышении замкнутости такого массообмена значительные трудности возникают при включении в круговорот жидких органических выделений человека, содержащих хлорид натрия, который с ростом концентрации в питательном растворе приводит к ингибированию роста растений. Одним из способов решения этой проблемы является включение в фотосинтезирующее звено замкнутой экосистемы съедобных для человека соленакапливающих растений, что позволяет извлечь из питательного раствора NaCl и вернуть его человеку в виде съедобной биомассы с повышенным содержанием поваренной соли. Такая возможность была успешно продемонстрирована в исследованиях физиологии съедобного соленакапливающего галофита солероса европейского (Salicornia europaea) применительно к условиям ЗЭС [1]. Для усиления изъятия из питательного раствора NaCl и улучшения разнообразия растительной диеты представляется целесообразным включить в структуру фототрофного звена дополнительный вид солеустойчивого съедобного растения. Как показали предварительные исследования, таким кандидатом может быть водяной кресс-салат (Nasturtium officinale), который может культивироваться в условиях, приближенных к ЗЭС, является солеустойчивым видом и может произрастать в диапазоне нарастающих концентраций NaCl от 0.7 до 2.1 г/л [2]. В связи с этим актуально исследовать возможности адаптации N. officinale к различным уровням засоления, характерным для ЗЭС, и оценить некоторые возможные механизмы такой адаптации.
Известно, что у растений с разной степенью устойчивости к засолению происходят изменения как в росте растений, так и в процессах фотосинтеза. В частности, воздействуя на отдельные реакции фотосинтеза, NaCl приводит к изменению его активности и в результате влияет на общую продуктивность растений [3]. Однако применительно к условиям ЗЭС возможности адаптации фотосинтетического аппарата растений (в данном случае N. officinale) к разной степени засоления еще недостаточно изучены. Одним из эффективных способов оценки состояния фотосинтетического аппарата растений при различных видах стресса является флуоресценция хлорофилла (Хл) а [4, 5].
Цель работы – оценка влияния концентрации NaCl на накопление абсолютно сухой надземной биомассы, содержание фотосинтетических пигментов и показатели флуоресценции хлорофилла а, связанные с процессом фотосинтеза у водяного кресс-салата (Nasturtium officinale), а также оценка возможности использования данного вида для культивирования в условиях ЗЭС.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Водяной кресс-салат (Nasturtium officinale R.Br., сем. Brassicacea).
Условия выращивания. Растения выращивали в вегетационной камере при 24-часовом фотопериоде в вегетационных сосудах из нержавеющей стали объемом 2.5 л с посевной площадью 0.032 м2. Условия в камере в течение суток: температура воздуха – 24 ± 1°C, концентрация СО2 – 0.03%, относительная влажность воздуха – 60–70%. Источник света – металлогалогенная лампа ДМ3-3000 (МЭЛЗ, СССР). Величина квантового потока в области ФАР – 690 мкмоль фотонов×м-2×с-1.
Питательный раствор по минеральному составу имитировал раствор, который образуется после выращивания растений пшеницы (Triticum aestivum L.) на минерализованных органических отходах человека в ЗЭС [2], (мг/л): NO3 – 150, P – 41, K – 216, Na – 8, Ca – 229, Mg – 41, S – 86. Раствор готовили на отстоянной водопроводной воде. Дополнительно вносили лимоннокислое железо (2.4 мг/л) и микроэлементы по Кнопу [6].
Получение посадочного материала. Семена проращивали в вегетационной камере на влажном мелком керамзите в течении 7 сут при величине квантового потока в области ФАР 400 мкмоль фотонов × м–2 × × с–1. На стадии 3–4 настоящих листьев для адаптации корней к водной среде молодые растения помещали в отверстия (d = 0.7 см) на вспененной пищевой подложке, находящейся в сосуде с отстоянной водопроводной водой. По истечении 1 сут молодые растения перемещали в сосуды (2.5 л) с питательным раствором, состоящим в равных частях из питательного раствора и отстоянной водопроводной воды. Через 3 сут растения перемещали на контрольные и опытные растворы объемом 2 л. Растворы постоянно аэрировали. По мере испарения воды в сосуды добавляли отстоянную водопроводную воду. Питательные растворы заменяли на свежеприготовленные один раз в неделю. Плотность посадки – 3 растения на сосуд (3 растения/0.032 м2; 94 растения/м2).
Условия проведения экспериментов. Действие NaCl (засоления) на растения исследовали в трех независимых экспериментах. Содержание NaCl в контрольном растворе составляло 0.02 г/л. В опытных вариантах содержание NaCl составляло 0.7, 1.4 и 1.8 г/л. Физиологические показатели растений определяли на 7, 14 и 19 сут после переноса растений на контрольный и солевой растворы.
Определение АСНБ. Образцы надземной части растений нагревали при +105°С в течении 5 мин, затем высушивали при +70°С до постоянной массы. АСНБ определяли на аналитических весах с точностью до 0.001 г.
Определение содержания натрия. Анализ проводили в аналитической лаборатории Института биофизики Сибирского отделения Российской академии наук. Сухую навеску массой 0.2 г озоляли в смеси азотной и хлорной кислоты (1 : 1), затем переносили в пробирку и доводили деионизированной водой до 14 мл с последующим разведением в 100 раз [7]. Содержание натрия определяли с помощью спектрометра iCAP-6300 Duo (“Thermo Sсientific”, США). Ошибка метода не превышала 15% (получено при сравнении со стандартным образцом травосмеси ТР-1 (ГСО№8922-2007, Иркутск, Институт геохимии им. А.П. Виноградова СО РАН).
Определение содержания фотосинтетических пигментов. Содержание фотосинтетических пигментов определяли непосредственно после измерения параметров флуоресценции Хл а. Отдельный лист помещали в пробирку, в которую добавляли 5–10 мл 96% этилового спирта и 10 мг сухого CaСО3. Пробирки нагревали на водяной бане при +70°С в течение 30 мин, охлаждали до комнатной температуры и помещали в холодильник на 24 ч для окончательной экстракции пигментов. Оптическую плотность растворов определяли на Spekol 1300 (“Analytik Jena”, (Германия) при длинах волн 440.5, 649, 665 и 720 нм. Расчет концентрации Хл а, b и суммы каротиноидов (Кар) проводили по методу [8]. Содержание пигментов выражали на мг/г сухой массы листьев. Дополнительно рассчитывали отношения Хл (а + b)/Кар.
Долю хлорофиллов в составе ССК рассчитывали согласно Lichtentaler [9]:
(1)
${{({{{\text{С}}}_{{{\text{Хл}}b}}} + {\text{ }}1.2{{{\text{С}}}_{{{\text{Хл}}b}}})} \mathord{\left/ {\vphantom {{({{{\text{С}}}_{{{\text{Хл}}b}}} + {\text{ }}1.2{{{\text{С}}}_{{{\text{Хл}}b}}})} {({{{\text{С}}}_{{{\text{Хл}}a}}} + {{{\text{С}}}_{{{\text{Хл}}b}}})}}} \right. \kern-0em} {({{{\text{С}}}_{{{\text{Хл}}a}}} + {{{\text{С}}}_{{{\text{Хл}}b}}})}},$Регистрация параметров флуоресценции Хл а. Во всех экспериментах использовали хорошо развитые листья без видимых повреждений контрольных и опытных растений. При отборе проб на 7 сут, после переноса растений на контрольные и солевые растворы, от побегов отделяли по одному листу растений из каждого из трех сосудов одного варианта, на 14 и 19 сут – по два листа. После отделения от растений листья адаптировали к темноте в течение 15–20 мин во влажной камере. Затем листья перемещали на рабочий стенд флуориметра Imaging PAM Maxi (“Walz”, Германия) с влажной фильтровальной бумагой. В режиме визуальной регистрации нулевого уровня флуоресценции (F0) на каждом листе выделяли по 4 зоны, не затрагивая края листьев (рис. 1). В пределах каждой зоны программа Imaging PAM Maxi регистрировала усредненные параметры флуоресценции.
Рис. 1.
Серия изображений листьев N. officinale в режиме регистрации F0 с помощью программы Imaging Win.

Функциональные показатели фотосинтетического аппарата регистрировали в режиме “световая кривая”. Величина квантового потока ступенчато изменялась от 21 до 701 мкмоль фотонов × м–2 × с–1, время световой экспозиции на каждом из девяти уровней возбуждения – 20 с. Световые кривые строили по 10 точкам, включая 0. С помощью программы Imaging Win определяли следующие параметры: максимальный квантовый выход фотохимического тушения флуоресценции ФС II – Y(II)max, эффективный квантовый выход, зависящий от интенсивности света ФС II – Y(II) и квантовый выход нефотохимического тушения флуоресценции – Y(NPQ).
Максимальный квантовый выход ФС II Y(II)max определяли согласно [10] после темновой экспозиции листьев до включения актиничного света:
(2)
${\text{Y}}{{\left( {{\text{II}}} \right)}_{{\max }}} = {{\left( {{{F}_{{\text{m}}}} - {{F}_{0}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{F}_{{\text{m}}}} - {{F}_{0}}} \right)} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}},$где F0 и Fm – нулевой и максимальный уровень, соответственно.
Значения эффективного квантового выхода ФС II определяли для каждой интенсивности актиничного света на основе соответствующих значений максимального ($F_{{\text{m}}}^{'}$) и стационарного (Fs) уровня флуоресценции [10]:
(3)
${\text{Y}}\left( {{\text{II}}} \right) = {{\left( {F_{{\text{m}}}^{'} - {{F}_{{\text{s}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {F_{{\text{m}}}^{'} - {{F}_{{\text{s}}}}} \right)} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}.$Скорость нециклического электронного транспорта (ETR), мкмоль электронов × м–2 × с–1 рассчитывали по формуле:
где коэффициент 0.5 – доля квантов возбуждающего света, поглощенных пигментами антенного комплекса ФС II при нециклическом электронном транспорте, Y(II) – эффективный квантовый выход фотохимического тушения флуоресценции, ФАР – величина квантового потока в области ФАР (мкмоль фотонов × м–2 × с–1), коэффициент 0.84 – доля фотонов, поглощенных фотосинтетическими пигментами зеленого листа [11].
Параметры световой кривой ETR: (α) – угол наклона касательной на начальном участке световой кривой, который связан с квантовой эффективностью ФС II, (ETRmPot) – максимальная потенциальная скорость электронного транспорта, ФАР – величина квантового потока в области ФАР, которую аппроксимировали при R2 приближенной к 0.97, используя выражение [11]:
(5)
${\text{ETR}} = {\text{ET}}{{{\text{R}}}_{{{\text{mPot}}}}}\left( {1 - {{e}^{{{{\alpha {\text{ФАР}}} \mathord{\left/ {\vphantom {{\alpha {\text{ФАР}}} {{\text{ETRmPot}}}}} \right. \kern-0em} {{\text{ETRmPot}}}}}}}} \right).$Также фиксировали максимальную экспериментальную скорость электронного транспорта (ETRmax), зарегистрированную при величине квантового потока 700 мкмоль электронов × м–2 × с–1.
Статистическая обработка данных. В табл. 1 и на рисунках 2–6 приведены средние значения и стандартные ошибки среднего в ходе независимых экспериментов, каждый из которых был проведен в трех биологических повторностях. Биологическая повторность представляла собой измерения, проведенные на группе из трех растений из одного сосуда. Для определения значимости различий средних значений использовали t-тест Стьюдента при P < 0.05.
Таблица 1.
Параметры световой кривой нециклического транспорта электронов в зависимости от концентрации соли и сроков выращивания растений N. officinale в экспериментах с 0.7, 1.4 и 1.8 г/л NaCl на 7, 14 и 19 сут после переноса растений на контрольные и солевые растворы, соответственно
| Эксперимент | Вариант засоления | Срок действия NaCl, сут | Y(II)max | α | ETRmax, мкмоль электронов × м–2 × с–1 |
|---|---|---|---|---|---|
| № 1 | 0.02 г/л NaCl | 7 | 0.71 ± 0.01a | 0.14 ± 0.01a | 58.1 ± 3.70a |
| 0.7 г/л NaCl | 7 | 0.77 ± 0.00b | 0.14 ± 0.01a | 61.7 ± 2.20a | |
| № 2 | 0.02 г/л NaCl | 7 | 0.77 ± 0.01a | 0.19 ± 0.01a | 71.5 ± 3.20a |
| 1.4 г/л NaCl | 7 | 0.78 ± 0.01a | 0.18 ± 0.02a | 66.2 ± 16.9a | |
| № 3 | 0.02 г/л NaCl | 7 | 0.74 ± 0.00a | 0.12 ± 0.00a | 53.5 ± 2.54a |
| 1.8 г/л NaCl | 7 | 0.75 ± 0.00b | 0.10 ± 0.00b | 41.6 ± 2.02b | |
| № 1 | 0.02 г/л NaCl | 14 | 0.79 ± 0.00a | 0.19 ± 0.01a | 76.9 ± 2.82a |
| 0.7 г/л NaCl | 14 | 0.77 ± 0.02a | 0.19 ± 0.01a | 67.6 ± 5.34b | |
| № 2 | 0.02 г/л NaCl | 14 | 0.75 ± 0.00a | 0.14 ± 0.01a | 52.9 ± 2.81a |
| 1.4 г/л NaCl | 14 | 0.75 ± 0.00a | 0.16 ± 0.00b | 58.7 ± 1.73b | |
| № 3 | 0.02 г/л NaCl | 14 | 0.75 ± 0.00a | 0.14 ± 0.01a | 52.9 ± 2.81a |
| 1.8 г/л NaCl | 14 | 0.75 ± 0.00a | 0.14 ± 0.01a | 41.7 ± 1.31b | |
| № 1 | 0.02 г/л NaCl | 19 | 0.67 ± 0.03a | 0.15 ± 0.01a | 64.4 ± 4.29a |
| 0.7 г/л NaCl | 19 | 0.75 ± 0.01b | 0.18 ± 0.01b | 64.9 ± 2.17а | |
| № 2 | 0.02 г/л NaCl | 19 | 0.74 ± 0.01a | 0.12 ± 0.00a | 50.3 ± 1.92a |
| 1.4 г/л NaCl | 19 | 0.76 ± 0.01a | 0.15 ± 0.00b | 62.0 ± 1.46b | |
| № 3 | 0.02 г/л NaCl | 19 | 0.77 ± 0.00a | 0.18 ± 0.01a | 66.8 ± 1.57a |
| 1.8 г/л NaCl | 19 | 0.79 ± 0.00b | 0.18 ± 0.01a | 61.7 ± 2.40b |
Рис. 2.
Относительное содержание Na+ в АСНБ и АСНБ при выращивании N. officinale в контрольных растениях и после переноса растений на 0.7 г/л NaCl (а, г), на 1.4 г/л NaCl (б, д) и на 1.8 г/л NaCl (в, е). Показаны средние значения и ошибка среднего при Р < 0.05 (на 7 сут при n = 9, на 14 и 19 сут при n = 9). Значимые различия между контрольными и опытными вариантами обозначены разными латинскими буквами.

Рис. 3.
Содержание фотосинтетических пигментов (Хл. а, Хл. b, каротиноидов (Кар)) и их соотношений (отношение суммы хлорофиллов к каротиноидам (Хл (а + b)/Кар), светособирающий хлорофилл (a + b) комплекс (ССК)) в листьях N. officinale у контрольных растений и после переноса растений на 0.7 г/л NaCl (а, г), на 1.4 г/л NaCl (б, д) и на 1.8 г/л NaCl (в, е). Показаны средние значения и ошибка среднего при Р < 0.05 (на 7 сут при n = 3, 14 и на 19 сут при n = 6). Значимые различия между контрольными и опытными вариантами обозначены разными латинскими буквами.
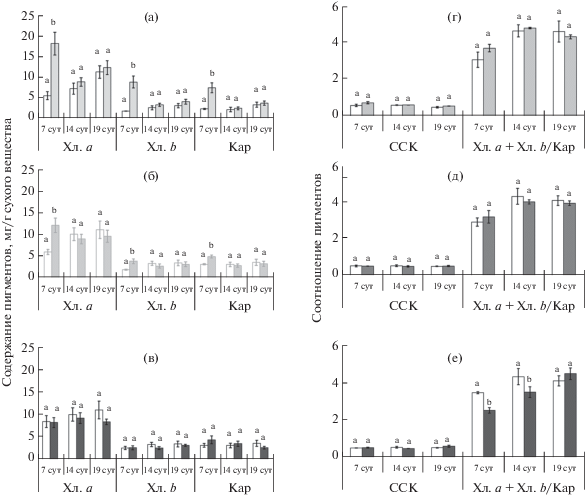
Рис. 4.
Эффективный квантовый выход фотохимического тушения и квантовый выход нефотохимического тушения флуоресценции в листьях контрольных (пунктирная линия 1) и опытных (сплошная линия 2) вариантах N. officinale в первом эксперименте при 0.7 г/л NaCl: (а, г) – на 7 сут при n = 3; (б, д) – на 14 сут при n = 6, (в, е) – на 19 сут после переноса растений на контрольные и солевые растворы при n = 6. Показаны средние значения и ошибка среднего при Р < 0.05. * – Значимые различия между контрольными и опытными вариантами.

Рис. 5.
Эффективный квантовый выход фотохимического тушения и квантовый выход нефотохимического тушения флуоресценции в листьях контрольных (пунктирная линия 1) и опытных (сплошная линия 2) вариантах N. officinale во втором эксперименте при 1.4 г/л NaCl: (а, г) – на 7 сут при n = 3; (б, д) – на 14 сут при n = 6 (в, е) – на 19 сут после переноса растений на контрольные и солевые растворы при n = 6. Показаны средние значения и ошибка среднего при Р < 0.05. * – Значимые различия между контрольными и опытными вариантами.

Рис. 6.
Эффективный квантовый выход фотохимического тушения и квантовый выход нефотохимического тушения флуоресценции в листьях контрольных (пунктирная линия 1) и опытных (сплошная линия 2) вариантах N. officinale в третьем эксперименте при 1.8 г/л NaCl: (а, г) – на 7 сут при n = 3; (б, д) – на 14 сут при n = 6 (в, е) – на 19 сут после переноса растений на контрольные и солевые растворы при n = 6. Показаны средние значения и ошибка среднего. * – Значимые различия между контрольными и опытными вариантами.

РЕЗУЛЬТАТЫ
Влияние NaCl на содержание натрия в АСНБ и продуктивность растений
Так как в ЗЭС необходимо решить проблему утилизации хлористого натрия из минерализованной урины человека и обеспечить возврат NaCl человеку со съедобной растительной биомассой, было определено содержание натрия в абсолютно сухой надземной биомассе (АСНБ) и сама АСНБ растений (рис. 2а–е). Содержание Na в АСНБ растений увеличивалось после 7 сут выращивания на солевых растворах (рис. 2д–е). Так, в вариантах с засолением 0.7, 1.4 и 1.8 г/л содержание Na в АСНБ растений превосходило контроль в 16, 17 и 35 раз, соответственно (рис. 2а–в). При этом АСНБ во всех опытных вариантах на 7 сут выращивания на солевых растворах достоверно не отличалась от контрольных вариантов. Ингибирование роста растений, а вместе с этим и накопление Na происходило в период от 7 до 14 сут после перенесения растений на солевой раствор во всех опытных вариантах. По сравнению с контрольным вариантом содержание натрия в АСНБ на 14 сут достоверно возрастало, соответственно, при концентрациях NaCl: 0.7 г/л – в 18 раз, при 1.4 г/л – в 30 раз, при 1.8 г/л – в 40 раз. При этом АСНБ в вариантах 0.7 и 1.4 г/л NaCl была практически в 2 раза ниже, а в варианте 1.8 г/л NaCl в 3 раза ниже, чем в контрольных вариантах. На 19 сут культивирования у растений не регистрировали достоверных различий в накоплении Na в АСНБ в вариантах 0.7, 1.4 и 1.8 г/л NaCl. При этом значения АСНБ на 19 сут не отличалась от АСНБ на 14 сут у контрольных вариантов (рис. 2г–е). Содержание Na на 19 сут у опытных и контрольных вариантов различалось в 25, 34 и 33 раз, а сама АСНБ различалась соответственно в 1.5, 2.0 и 2.2 раз (рис. 2а–е). Отметим, что засоление растворов (0.7, 1.4 и 1.8 г/л) стало причиной перехода растений в стадию бутонизации на 14 сут, и в варианте с засолением 1.8 г/л – в стадию цветения на 19 сут после переноса растений на солевой раствор.
Влияние NaCl на пигментный состав растений
Одним из ключевых критериев в выборе растений применительно к условиям ЗЭС является способность фотосинтетического аппарата активно функционировать при засолении питательного раствора. Надежным показателем устойчивости фотосинтеза к засолению выступают фотосинтетические пигменты, абсолютное и относительное содержание которых откликается на стрессовые условия среды [12]. Так, содержание Хл а, Хл b и Кар на 7 сут выращивания растений при 0.7 г/л NaCl было в 3.2, 4.5 и 3 раза, соответственно выше, чем в контроле (рис. 3а). Содержание Хл a, Хл b и Кар к 14 сут выращивания растений на солевых растворах снизилось в варианте 0.7 г/л NaCl на 50, 61.5 и 65%, соответственно, при этом в контрольных вариантах за данный период достоверных изменений данных показателей не обнаружили (рис. 3а). К 19 сут выращивания растений при 0.7 г/л NaCl произошло незначительное увеличение содержания Хл a, как и в контрольных вариантах. При этом не происходило изменений в содержании Хл b и Кар в контрольных и опытных вариантах (рис. 3а). Между контрольными и опытными вариантами (0.7 г/л NaCl) за период 7–19 сут после переноса растений на солевые и контрольные растворы не обнаружили различий в Хл (a + b)/Кар. При этом между 7 и 14 сут выращивания растений в контрольном и опытном вариантах происходило увеличение в Хл (a + b)/Кар на 34 и 23%, соответственно. При увеличении длительности действия NaCl до 19 сут достоверных различий в данном параметре не выявили, как и в контрольном варианте (рис. 3г). Максимальное значение доли хлорофиллов в ССК в варианте 0.7 г/л NaCl обнаружили на 7 сут (0.73 ± 0.06) после переноса растений на солевые растворы.
При повышении уровня засоления до 1.4 г/л происходило снижение содержания хлорофиллов и Кар (рис. 3б). Содержание Хл а, Хл b и Кар на 7 сут выращивания растений при 1.4 г/л NaCl было в 2.0, 2.0 и 1.6 раза, соответственно, выше, чем в контроле. Между 7 и 14 сут происходило незначительное снижение содержания Хл а, Хл b и Кар у растений N. officinale, выращенных при 1.4 г/л NaCl. При этом в контрольных вариантах в данный период выращивания растений происходило увеличение в содержания Хл а и Хл b на 40 и 44%, соответственно. В отношении Хл (a + b)/Кар в период 7–19 сут выращивания растений между 1.4 г/л NaCl и контролями не обнаружили достоверных различий. При этом между 7 и 14 сут выращивания растений при 1.4 г/л NaCl, как и в контролях, происходило увеличение данного параметра на 20 и 32%, соответственно. Отметим, что при переходе растений в стадию бутонизации (14–19 сут выращивания растений на солевых растворах) не происходило изменения в отношении Хл (a + b)/Кар, как и в контрольных вариантах. Концентрация NaCl в растворе 1.4 г/л не повлияла на ССК растений водяного кресс-салата на 7, 14 и 19 сут после переноса растений на солевые растворы (рис. 3д).
Содержание Хл а, Хл b и Кар в период 7–19 сут выращивания растений при концентрации NaCl 1.8 г/л не отличалось от контроля (рис. 3в). При этом на 7 сут выращивания растений при 1.8 г/л NaCl отмечено снижение в отношении Хл (a + b)/Кар в 1.3 раза, соответственно, по сравнению с контролем (рис. 3е). В период между 7 и 14 сут выращивания растений при концентрации NaCl 1.8 г/л происходило достоверное повышение данного параметра на 28%, а в контроле – на 20%. При длительном засолении (14–19 сут) 1.8 г/л происходило повышение в отношении Хл (a + b)/Кар на 22%, при этом в контрольном варианте различий не выявили (рис. 3е).
Концентрация NaCl в растворе 1.8 г/л не повлияла на ССК растений водяного кресс-салата, убранных на 7, 14 и 19 сут после переноса растений на солевые растворы. Кроме того, ССК опытных растений не отличалась от контрольных растений.
Влияние NaCl на параметры флуоресценции Хл а в листьях растений
Световые зависимости эффективного квантового выхода ФС II (Y(II)) и квантового выхода нефотохимического тушения флуоресценции (Y(NPQ)) (рис. 4–6), полученные в режиме регистрации световой кривой на РАМ-флуориметрах, кроме влияния величины квантового потока отражали характер изменений, происходящих в индукционный период после включения актиничного света. Оба показателя зависели от электрохимического градиента протонов на мембране тилакоида. Обратная зависимость Y(II) от Y(NPQ) для сопряженных значений на световых кривых имела линейный характер. Оба параметра достигали близких к стационарному уровню значений при 200 мкмоль фотонов × м–2 × с–1 (через 1.5 мин после включения актиничного света (рис. 4–6)). Некоторые кинетические различия между контрольными вариантами повторялись в соответствующих опытных вариантах (рис. 6). В экспериментах №1 (0.7 г/л NaCl) и №2 (1.4 г/л NaCl) после 19 сут культивирования абсолютные значения Y(II) и Y(NPQ) в контрольном и опытном вариантах достоверно различались. При этом в опытном варианте возрастал вклад Y(II) и снижался вклад Y(NPQ) в процесс тушения флуоресценции хлорофилла. Такие изменения могли быть следствием уменьшения электрохимического градиента протонов на мембране тилакоида в опытном варианте. В свою очередь, снижение градиента могло быть связано как с разобщающим действием NaCl, так и с увеличением скорости темновых реакций, использующих энергию АТФ [13].
В табл. 1 представлены результаты влияния NaCl на параметры световой кривой нециклического транспорта электронов в зависимости от концентрации соли и времени выращивания растений. Максимальный квантовый выход ФС II (Y(II)max) в контрольных и опытных вариантах варьировал слабо. Коэффициент вариации составил 3.8%. Средние значения показателя (0.755 ± 0.007) указывали на высокую эффективность захвата энергии возбуждения в открытых реакционных центрах ФС II [4]. Достоверное снижение Y(II)max регистрировали в эксперименте №1 после 19 сут выращивания растений в контрольном растворе.
Тангенс угла наклона касательной на начальном участке световой кривой (параметр α, табл. 1), характеризующий квантовую эффективность транспорта электронов через реакционный центр ФС II, и максимальная скорость нециклического транспорта электронов (ETRmax) при световом потоке 701 мкмоль фотонов × м–2 × с–1 варьировали в большей степени (16.8 и 15.4%, соответственно) по сравнению с Y(II)max. Различия параметра α зависели как от сроков вегетации, так и от концентрации NaCl в питательном растворе. При этом различия между соответствующими контрольными вариантами в трех экспериментах были существенно выше, чем между контролем и опытом в каждом из трех экспериментов. Относительно низкие значения параметра (α < 0.15) регистрировали на 7 сут вегетации в контрольном и опытном вариантах эксперимента №1 (0.7 г/л NaCl) и эксперимента №3 (1.8 г/л NaCl), а также в контрольном варианте эксперимента №2 (1.4 г/л NaCl) на 14 сут действия NaCl. Влияние NaCl на параметры α и ETRmax в ряде случаев было сопряженным. NaCl снижал показатели в эксперименте №3 на 7 сут культивирования и увеличивал в эксперименте № 2 на 14 и 19 сут культивирования (табл. 1). В экспериментах № 1 и № 3 после 14 сут, а также в эксперименте № 3 после 19 сут NaCl вызывал снижение ETRmax при одинаковых значениях α.
ОБСУЖДЕНИЕ
В результате выращивания растений N. officinale в контролируемых условиях среды было показано, что снижение АСНБ растений и поглощение Na в трех экспериментах свидетельствует о реакции растений на солевой стресс (рис. 2а–е). Аналогичные данные были получены рядом авторов. Так, у растений шпината (Spinacia oleracea) при 200 мМ NaCl (10.6 г/л NaCl) Robinson с соавт. [14] не обнаружили снижения продуктивности на 7 сут действия соли, что согласуется с результатами во всех опытных вариантах культивирования водяного кресс-салата (рис. 2г–е). На 14 сут отметили снижение продуктивности на 30% по сравнению с контролем [14], при этом в нашем эксперименте уже при 0.7 г/л NaCl продуктивность снизилась на 50% (рис. 2г–е). Guo с соавт. [15] сообщают, что уровни засоления 0.1 моль/л (5.8 г/л), 0.3 моль/л (17.5 г/л), 0.5 моль/л (29.2 г/л) среды (почва + перегной) у молодых растений не повлияли на продуктивность Lycium ruthenicum. Однако при более длительном действии солевого фактора (21 сут) происходило снижение роста растений в 1.3 раза [15]. Интересные результаты были получены Kaddоur с соавт. [16] при исследовании солеустойчивости водяного кресс-салата: растение относится к солеустойчивому виду и может выдерживать до 150 мМ NaCl (8.8 г/л); при данной концентрации NaCl отмечали задержку в росте растений. При 50 и 100 мМ NaCl (2.7, 5.9 г/л) авторы отмечали снижение продуктивности на 22 и 27%, соответственно. Возможной причиной различий в более высокой устойчивости к засолению растений в настоящей работе и в исследованиях Kaddоur с соавт. [16] были другие условия культивирования: величина квантового потока в области ФАР – 150 мкмоль фотонов × м–2 × с–1, фотопериод – 12 ч, длительность культивирования растений в условиях солевого стресса – 24 сут [16].
Одним из первых негативных действий засоления на растения является торможение роста. Последнее наблюдали у N. officinale во всех опытных вариантах на 14 и 19 сут после переноса растений на солевые растворы (рис. 2г–е). Торможение роста обуславливается влиянием различных факторов. Во-первых, это появление водного дефицита при действии ионов Na+ и Cl- на растения. Во-вторых, проявление токсического действия высоких концентраций хлористого натрия на корни растений при длительном действии данного фактора [17]. При совместном действии этих факторов возможно ускорение перехода растений в репродуктивную фазу, как описано в работе Генкеля [18], где автор отметил, что наименьшая солеустойчивость проявлялась у молодых растений; при формировании вегетативной биомассы солеустойчивость повышалась, а при переходе растений к бутонизации происходило снижение солеустойчивости. При этом, если новые листья постоянно воспроизводились со скоростью большей, чем та, при которой старые листья отмирали, то у растения достаточно активной фотосинтетической поверхности, чтобы войти в репродуктивную фазу [17]. Возможно поэтому, начиная с молодых растений и до перехода их в репродуктивную фазу, происходит основное накопление ионов Na+ и Cl- в АСНБ на 19 сут после переноса растений на солевые растворы (рис. 2а–в).
При меньших концентрациях NaCl (0.7, 1.4 г/л) на 14–19 сут после переноса растений на питательные растворы не обнаружили достоверных различий по сравнению с контролем в содержании Хл а, Хл b и Кар, отношении Хл (а + b)/Кар и ССК (рис. 3а, б, г, д ). При большей концентрации NaCl (1.8 г/л) в период 7–19 сут действия соли также не обнаружили достоверных различий в содержании Хл а, Хл b и Кар, ССК за исключением Хл (а + b)/Кар (рис. 3в, е). В целом изменения в фотосинтетических пигментах и продуктивности свидетельствуют об устойчивости изучаемого вида растений к условиям засоления, характерным для ЗЭС (0.7–1.8 г/л) [2].
Отмечено значительное превышение содержания фотосинтетических пигментов (Хл а, Хл b и Кар) на 7 сут выращивания при 0.7 г/л NaCl в 3.2, 4.5 и 3 раза по сравнению с контролем (рис. 3а) и аналогичен с результатами у солеустойчивых экотипов люцерны (Medicago sativa L.). А именно повышение суммы хлорофиллов у экотипов M. sativa обнаружено при засолении 100 мМ (5.9 г/л) и 200 мМ (10.6 г/л) NaCl [19]. Исходя из этого, можно предположить, что повышение содержания хлорофиллов связано с генетической устойчивостью определенного вида растений к засолению.
Снижение содержания фотосинтетических пигментов (Хл а, Хл b и Кар) при 0.7 г/л и 1.4 г/л NaCl между 7 и 14 сут (рис. 3а, б), как считают Hernandez с соавт. [20], связано с развитием окислительного стресса в результате образования активных форм кислорода, например, супероксидного и гидроксильного радикалов, а также с увеличением антиоксидантной активности за счет CuZn-супероксиддисмутазы в хлоропластах устойчивого к засолению сорта Pisum sativa (cv Granada) [20].
Для ЗЭС важно оценить не только устойчивость фотосинтетических пигментов к солевому стрессу, но и необходимо рассмотреть стабильность фотохимических реакций у N. officinale. В данной работе выявили достоверные изменения в световых зависимостях Y(II) и Y(NPQ) в листьях растений на 14 сут выращивания при засолениях 1.4 г/л (рис. 5в) и на 19 сут при засолениях 0.7 и 1.4 г/л (рис. 4в, е,рис. 5в, е). При этом характер световых кривых Y(II) и Y(NPQ) был одинаков как у контрольных, так и у опытных растений при выращивании на растворах, содержащих 0.7, 1.4 и 1.8 г/л NaCl (рис. 4а–в, 5а–в, 6а–в). Ряд авторов считают, что при действии 100 мМ (5.9 г/л) и 150 мМ (8.9 г/л) NaCl на гликофит Arabidopsis происходит снижение световой кривой квантового выхода по сравнению с контролем. Кроме того, повышение данного показателя у опытных вариантов, выращенных при 150 мМ (8.9 г/л) и при более длительном засолении (14 дней после переноса растений на солевой раствор), отмечали как в гликофите Arabidopsis, так и у солеустойчивого Thellungiella. При этом, из представленных авторами рисунков видно, что кинетика световых кривых Y(II) контрольных и опытных растений у Arabidopsis не отличалась [21], как и у исследуемого нами N. officinale (рис. 4а–в, 5а–в, 6а–в). Robinson с соавт. [14] отметили, что индукционные кривые флуоресценции контрольных растений S. oleracea не отличались от опытных, как и в вариантах с засолением 0.7 г/л на 7 и 14 сут после переноса растений на солевые растворы (рис. 4а–б) в нашей работе. Эти же авторы также установили, что даже при 200 мМ (10.6 г/л) NaCl первичные фотосинтетические процессы в S. oleracea не нарушаются [14]. Belkhodja с соавт. [22] обнаружили, что при засолении 100 мМ (5.9 г/л) значения Y(II) на световой кривой были выше, чем в варианте без засоления у Hordeum vulgare сорта Albacete, что согласуется с нашими данными по световой кривой Y(II) на 19 сут выращивания при 0.7 и 1.4 г/л NaCl (рис. 4в, 5в) и на 14 сут в варианте 1.4 г/л NaCl (рис. 5б). Предполагается, что при солевом стрессе снижается протонный градиент за счет повышения проницаемости мембран [17] и при этом включается защитный механизм, связанный с быстрым восстановлением QA [23], а остальная энергия, вероятно, диссипирует в тепло через нефотохимическое тушение флуоресценции.
Увеличение α на 14 сут выращивания при засолении 1.4 г/л и в вариантах с засолением 0.7 и 1.4 г/л на 19 сут по сравнению с контролем (табл. 1), вероятно, связано с устойчивостью растений к засолению и нормальной работой ФС II в условиях стресса. Отметим, что значения Y(II)max на 7, 14 и 19 сут выращивания контрольных растений находились в диапазоне от 0.70 до 0.77, кроме значений контроля на 19 сут в третьем эксперименте – 0.67 (табл. 1), а во всех опытных вариантах были выше – в диапазоне от 0.73 до 0.79, что свидетельствовало о сохранении фотохимической активности ФС II в условиях стресса [24]. Высокая фотосинтетическая активность у растений сем. Brassicaceae в условиях солевого стресса может быть связана как с транспортом и накоплением NaCl и работой антипортера Na+/H+ в вакуоли [3, 25], так и со снижением содержания галактолипидов в мембранах хлоропласта [26].
Известно, что реальное обеспечение всеми необходимыми человеку растительными продуктами возможно только за счет комплекса культур, что достигается для ЗЭС разработкой многокомпонентного звена высших растений [27 с. 38]. Ранее нами для возврата NaCl человеку в условиях ЗЭС было предложено растение S. europaea. Было рассчитано количество растений S. europaea (175 шт) и их АСНБ (1750 г), необходимые для того, чтобы удовлетворить суточную потребность человека в NaCl (12 г) [12]. S. europaea является устойчивой к засолению культурой и может культивироваться при 10 г/л NaСl. Известно, что S. europaea содержит больше необходимых человеку жирных кислот (линолевую, докозановую и тетракозановую) по сравнению с N. officinale. В то же время N. officinale не только достаточно солеустойчивый гликофит, но и источник дополнительных жирных кислот (гексадекатриеновой, вакценовой, гексакозановой) и углеводов, необходимых человеку. Кроме этого N. officinale отличается более быстрым ростом, по сравнению с S. europaea. Поэтому представляется целесообразным совместное использование этих двух видов растений для обеспечения человека NaCl в ЗЭС. Можно определить количество растений N. officinale и их АСНБ в перерасчете на площадь для того, чтобы обеспечить человека половиной нормы (6 г) от суточной потребности в NaCl, т. к. остальную часть NaCl можно получить за счет S. europaea. Из наших данных известно, что N. officinale может поглощать до 1.5% Na при средней АСНБ одного растения, равной 3 г. Если исходить из суточной нормы потребления и выделения человеком NaCl за счет N. officinale, равной 6 г, что соответствует примерно 2.4 г Na, ежесуточно необходимо будет убирать и включать в рацион питания около 157 г АСНБ растений N. officinale. При длительности засоления до 19 сут, для утилизации всего Na, выделенного за этот период человеком, потребуется вырастить около 50 растений N. officinale. В наших экспериментах мы выращивали по 3 растения на площади 0.032 м2. Из этого следует, что для ЗЭС одновременное выращивание растений N. officinale и S. europea на площади 3 м2 может обеспечить NaCl одного человека.
Таким образом, полученные данные свидетельствуют о том, что в условиях ЗЭС, достигнутая продуктивность N. officinale, благодаря устойчивости его фотосинтетического аппарата к засолению, может служить дополнительным источником NaCl для человека. Установлено, что засоление сопровождалось накоплением натрия в АСНБ N. officinale на 7, 14 и 19 сут после переноса растений на солевые растворы. Показано, что в зависимости от уровня засоления питательного раствора и длительности его действия усиливалось ингибирование накопления АСНБ у растений N. officinale, за исключением растений, выращенных в течение 7 сут после переноса на солевые растворы. Ограничения применения водяного кресс-салата в ЗЭС могут быть связаны с длительностью культивирования N. officinale свыше 19 сут и при концентрации NaCl свыше 1.8 г/л.
Данная работа выполнена в рамках программы фундаментальных научных исследований государственных академий наук на 2013–2020 гг. по теме № 56.1.4 “Оценка устойчивости ценозов высших растений замкнутых экологических систем, включающих человека, к выращиванию на питательных средах из минерализованных органических отходов”.
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Ushakova S.A., Kovaleva N.P., Gribovskaya I.V., Dolgushev V.A., Tikhomirova N.A. Effect of NaCl concentration on productivity and mineral composition of Salicornia europaea as a potential crop for utilization NaCl in LSS // Adv. Space Res. 2005. V. 36. P. 1349. https://doi.org/10.1016/j.asr.2004.09.017
Тихомирова Н.А., Павлова А.М., Ушакова С.А., Трифонов С.В., Грибовская И.В., Тихомиров А.А. Продукционные характеристики зеленных растений при выращивании на жидких продуктах переработки экзометаболитов человека применительно к биолого–технической системе жизнеобеспечения // Авиакосмическая и экологическая медицина. 2017. Т. 51. С. 51. https://doi.org/10.21687/0233-528X-2017-51-1-51-57
Srivastava A.K., Srivastava S., Lokhande V.H., D’Souza S.F., Lokhande V. H., Suprasanna P. Salt stress reveals differential antioxidant and energetics responses in glycophyte (Brassica juncea L.) and halophyte (Sesuvium portulacastrum L.) // Front. Environ. Sci. 2015. V. 3. P. 1. https://doi.org/10.3389/fenvs.2015.00019
Kitajima M., Butler W.L. Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromothymoquinone // Biochim. Biophys. Acta. 1975. V. 376. P. 105. https://doi.org/10.1016/0005-2728(75)90209-1
Креславский В.Д., Карпентиер Р., Климов В.В., Мурата Н., Аллахвердиев С.И. Молекулярные механизмы устойчивости фотосинтетического аппарата к стрессу // Биологические мембраны. 2007. Т. 24. С. 195.
Ушакова С.А., Тихомиров А.А., Величко В.В., Головко Т.К., Табаленкова Г.Н., Захожий И.Г., Матусевич В.В. Сравнительная оценка продуктивности зеленных культур, возможных представителей звена высших растений биорегенеративных систем жизнеобеспечения // Авиакосмическая и экологическая медицина. 2010. Т. 44. С. 42.
Anishchenko O.V., Tolomeev A.P., Ivanova E.A., Drobotov A.V., Kolmakova A.A., Zuev I.V., Gribovskaya I.V. Accumulation of elements by submerged (Stuckenia pectinate (L.) Börner) and emergent (Phragmites australis (Cav.) Trin. ex Steud.) macrophytes under different salinity levels // PPB. 2020. V. 154. P. 328. https://doi.org/10.1016/j.plaphy.2020.05.019
Wintermans I.F.G.M., De Mots A. Spectrophotometric characteristics of chlorphylls a and b and their pheophytins in ethanol // Biochim. Biophys. Acta. 1965. V. 109. P. 448. https://doi.org/10.1016/0926-6585(65)90170-6
Lichtenthaler H.K. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes // Methods in Enzymology / Eds. Colowick S.P., Kaplan N.O. San Diego: Academic Press, 1987. P. 350-382. https://doi.org/10.1016/0076-6879(87)48036-1
Genty B., Briantais J.M., Baker N.R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence // Biochim. Biophys. Acta. 1989. V. 990 P. 87. https://doi.org/10.1016/S0304-4165(89)80016-9
Platt T., Gallegos C.L., Harrison W.G. Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton // J. Mar. Res. 1980. V. 38 P. 687.
Тихомирова Н.А. Влияние внешних факторов среды на газообмен и продуктивность растений Salicornia europaea L., как возможной составной части фототрофного звена системы жизнеобеспечения: Автореф. дисс … канд. биол. наук. Т.: ТГУ, 2006. 128 с.
Kramer D.M., Johson G., Kiirats O., Edwards G. New fluorescence parameters for determination of Qa redox state and excitation energy fluxes // Photosyn. Res. 2004. V. 79. P. 209. https://doi.org/10.1023/B:PRES.0000015391.99477.0d
Robinson S.R., John W., Downton S., Millhouse J.A. Photosynthesis and ion content of leaves and isolated chloroplasts of salt-stressed spinach // Plant Physiol. 1983. V. 73. P. 238 https://doi.org/10.1104/pp.73.2.238
Guo Y.-Y., Nie H.-S., Yu H.-Y. Kong D.-S., Wu J.-Y. Effect of salt stress on the growth and photosystem II photochemical characteristics of Lycium ruthenicum Murr. seedlings // Photosynthetica. 2019. V. 57. P. 564. https://doi.org/10.32615/ps.2019.068
Kaddour R., Draoui E., Baâtour O. Mahmoudi H., Tarchoune I., Nasri N., Gruber M., Lachaâl M. Assessment of salt tolerance of Nasturtium officinale R. Br. using physiological and biochemical parameters // Acta Physiol. Plant. 2013. V. 35. P. 3427. https://doi.org/10.1007/s11738-013-1377-8
Munns R. Physiological processes limiting plant growth in saline soils: some dogmas and hypotheses // Plant Cell Environ. 1993. V. 16. P. 15. https://doi.org/10.1111/j.1365-3040.1993.tb00840.x
Генкель П.А. Физиология жаро- и засухоустойчивости растений. Москва: Наука, 1982. 280 с.
Monirifar H., Barghi M. Identification and selection for salt tolerance in alfalfa (Medicago sativa L.) ecotypes via physiological traits // Notulae Sci. Biol. 2009. V. 1. P. 63. https://doi.org/10.15835/nsb.1.1.3498
Hernandez J.A., Jimenez A., Mullineaux P., Sevilla F. Tolerance of pea plants (Pisum sativum) to long term salt stress is associated with induction of antioxidant defences // Plant Cell Environ. 2000. V. 23. P. 853. https://doi.org/10.1046/J.1365-3040.2000.00602.x
Stepien P., Johnson G.N. Contrasting responses of photosynthesis to salt stress in the glycophyte Arabidopsis and the halophyte Thellungiella: Role of the plastid terminal oxidase as an alternative electron sink // Plant Physiol. 2009. V. 149. P. 1154. https://doi.org/10.1104/pp.108.132407
Belkhodja R., Morales F., Abadia A., Gomez-Aparisi J., Abadia J. Chlorophyll fluorescence as a possible tool for salinity tolerance screening in barley (Hordeum vulgare L.) // Plant Physiol. 1994. V. 104. P. 667. https://doi.org/10.1104/pp.104.2.667
Sharma P., Jha A.B., Dubey R.S., Pessarakli M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions // J. Bot. 2012. P. 1. https://doi.org/10.1155/2012/217037
Souza R.P., Machado E.C., Silva J.A.B., Lagoa A.M.M.A., Silveira J.A.G. Photosynthetic gas exchange, chlorophyll fluorescence and some associated metabolic changes in cowpea (Vigna unguiculata) during water stress and recovery // Environ. Exp. Bot. 2004. V. 51. P. 45. https://doi.org/10.1016/S0098-8472(03)00059-5
Apse M.P., Aharon G.S., Snedden W.A., Blumwald E. Salt tolerance conferred by overexpression of a vacuolar Na+/H+ antiporter in Arabidopsis // Science. 1999. V. 285. P. 1256. https://doi.org/10.1126/science.285.5431.1256
Müller M., Santarius K.A. Changes in chloroplast membrane lipids during adaptation of barley to extreme salinity // Plant Physiol. 1978. V. 62. P. 326. https://doi.org/10.1104/pp.62.3.326
Замкнутая система: человек – высшие растения / Под ред. Г.М. Лисовского. Новосибирск: Наука, 1979. 160 с.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


