Физиология растений, 2021, T. 68, № 6, стр. 664-672
Влияние бактерий рода Bacillus на содержание Н2О2 и экспрессию генов ингибиторов гидролаз в растениях картофеля при инфицировании Phytophthora infestans (Mont.) de Bary
Л. Г. Яруллина a, *, В. О. Цветков b, Г. Ф. Бурханова a, А. В. Сорокань a, Е. А. Заикина a
a Институт биохимии и генетики – обособленное структурное подразделение
Уфимского федерального исследовательского центра Российской академии наук
Уфа, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
“Башкирский государственный университет”
Уфа, Россия
* E-mail: yarullina@bk.ru
Поступила в редакцию 02.03.2021
После доработки 17.03.2021
Принята к публикации 17.03.2021
Аннотация
Изучено влияние обработки различными штаммами бактерий Bacillus subtilis Cohn (штаммы 26Д и 11ВМ) и B. thuringiensis Berliner (штаммы B-5351 и B-6066) на содержание пероксида водорода (Н2О2), активность антиоксидантных (каталазы, пероксидазы) и гидролитических (протеазы и амилазы) ферментов и экспрессию генов ингибиторов гидролаз в растениях картофеля (Solanum tuberosum L.) в связи с устойчивостью к возбудителю фитофтороза – оомицету Phytophthora infestans (Mont.) de Bary. Исследования проводили на 15-дневных растениях картофеля восприимчивого к фитофторозу сорта Ранняя Роза, выросших из микроклубней. Растения опрыскивали суспензией различных штаммов бактерий B subtilis и B. thuringiensis (108 кл./мл). Спустя 5 суток часть растений инфицировали зооспорами P. infestans (105 спор/мл). Через 6, 24 и 48 ч после заражения растения фиксировали для оценки биохимических параметров. Выявлено снижение степени пораженности листьев P. infestans под влиянием обработки бактериями B. subtilis и B. thuringiensis в зависимости от штамма. Бактерии повышали устойчивость картофеля к инфицированию P. infestans за счет увеличения концентрации Н2О2 и усиления экспрессии генов ингибиторов протеазы и амилазы. Выявлены различия в степени активации транскрипционной активности генов ингибиторов гидролаз под влиянием бактерий B. subtilis и B. thuringiensis, что предполагает штамм-зависимые пути формирования устойчивости растений картофеля к возбудителю фитофтороза P. infestans.
ВВЕДЕНИЕ
Фитофтороз – одно из опаснейших заболеваний картофеля, поражающее практически все части растения: листья, стебли, клубни, цветки и ягоды. Потери от инфицирования выражаются в снижении массы и качества клубней, гибели пораженной ботвы в период клубнеобразования и в массовом гниении клубней во время хранения. Возбудитель фитофтороза – оомицет Phytophthora infestans (Mont.) de Bary является гемибиотрофным патогеном, на начальных стадиях болезни проявляющим свойства биотрофа, а позднее переходящим на некротрофный тип питания. Инфицирование происходит путем проникновения зооспор через чечевички, устьица, места повреждения растительных тканей. Зооспорангии способны прорастать гифами, сразу инфицируя растение, либо образуют множество зооспор, каждая из которых способна к прорастанию [1].
Повышение устойчивости растений к патогенам является актуальным вопросом современного растениеводства. В связи с этим наиболее перспективными являются микробиологические подходы и приемы, которые основаны на использовании потенциала растений и почвенных микроорганизмов. Основу экологически безопасных препаратов для защиты растений от стрессов биотической и абиотической природы составляют стимулирующие рост растений бактерии (СРРБ) (или PGPB от Plant Growth Promoting Bacteria) [2]. Особенно привлекательными являются высокоэффективные и сохраняющие в течение длительного времени свою жизнеспособность бактерии рода Bacillus. На основе бактерий рода Bacillus разработаны многие биопрепараты для защиты растений от фитопатогенов, которые рассматриваются как перспективные агенты биологического контроля болезней и вредителей растений в силу их широко распространенного природного антагонизма ко многим фитопатогенным грибам [3].
Особенностью биопрепаратов на основе микроорганизмов является неспецифическая активация защитных механизмов растений. Известна способность некоторых представителей бактерий рода Bacillus эндофитно развиваться в тканях растений и подавлять рост и развитие возбудителей болезней посредством секреции гидролитических ферментов и низкомолекулярных липопептидов, запускающих в растениях генерацию пероксида водорода (Н2О2) и оксилипиновую сигнальную защитную систему, регулирующую активность ингибиторов протеиназ [4]. Защитное действие биопрепаратов на основе Bacillus spp. может быть обусловлено опосредованным участием Н2О2 в усилении экспрессии генов PR-белков. Возможно, способствуя генерации АФК, бактерии рода Bacillus индуцируют передачу сигналов, запускающих работу других защитных механизмов. Показано, что обработка растений Bacillus subtilis способствует развитию индуцированной системной устойчивости (ИСУ), опосредованной действием жасмоновой кислоты [5]. Однако формирование устойчивости растений к патогенам под воздействием бактерий рода Bacillus может развиваться и через салицилатный сигнальный путь по типу системной приобретенной устойчивости (СПУ) [6]. Несмотря на наличие большого количества данных о подавлении развития фитопатогенов бактериями рода Bacillus, механизмы формирования устойчивости под их воздействием остаются до конца не выясненными. Предполагается, что особенности формирования защитных реакций растений под действием бактерий рода Bacillus могут быть связаны с природой организма-продуцента [3].
Цель данной работы – изучение влияния различных штаммов бактерий Bacillus subtilis Cohn и B. thuringiensis Berliner на содержание пероксида водорода, активность антиоксидантных и гидролитических ферментов, транскрипционную активность генов ингибиторов гидролаз в растениях картофеля в связи с устойчивостью к возбудителю фитофтороза P. infestans (Mont.) de Bary.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования. В работе были использованы растения картофеля (Solanum tuberosum L.), выросшие из микроклубней восприимчивого к фитофторозу сорта Ранняя Роза. Для получения растений микроклубни высаживали в контейнеры с грунтом “TerraVita” (Норд Палп, Россия), включающим верховой торф различной степени разложения, очищенный речной песок, перлит, комплексное минеральное удобрение и биогумус (pH 6.0–6.5), на глубину 3−4 см. Растения выращивали на светоплощадке в течение 15 суток, затем их инокулировали суспензионной культурой (5 мл/растение, конечный титр 108 кл/мл) штаммов бактерий B. thuringiensis В-6066 и B-5351, полученными из Всероссийской коллекции промышленных микроорганизмов, B. subtilis 26Д – из коммерческого биопрепарата “Фитоспорин-М” (“Башинком”, Россия) и B. subtilis 11ВМ – из коллекции Института биохимии и физиологии микроорганизмов РАН.
Заражение растений и оценка симптомов болезни. Через 5 дней после обработки бактериями часть растений инфицировали суспензией зооспор (106 спор/мл) возбудителя фитофтороза P. infestans изолята Башкирский из коллекции Института биохимии и генетики УФИЦ РАН (5 мл/растение). Через 6, 24 и 48 ч после инфицирования контрольные и зараженные растения фиксировали в жидком азоте и хранили при температуре –80°C до проведения биохимических исследований. Бактерии культивировали на жидкой среде Луриа-Бертани в течение 72 ч, затем суспензия была разбавлена дистиллированной водой до необходимой концентрации.
Развитие симптомов заболевания оценивали через 5 суток после инфицирования по % площади поражения листовой пластинки. Листья фотографировали, и цифровые изображения анализировали в программе ImageJ (“National Institutes of Health”, Bethesda, США).
Определение содержания H2O2. Листья гомогенизировали в 0.025 М Na-фосфатном буфере (ФБ), pH 6.2, в соотношении 1 : 3 и центрифугировали 20 мин при 10 000 g. Здесь и далее использовали центрифугу Eppendorf 5415R (“Eppendorf”, Германия). Супернатант использовали для определения содержания H2O2. Содержание Н2О2 определяли с использованием красителя ксиленолового оранжевого [7]. Реагент содержал 0.074% соли Мора в 5.81% серной кислоты и 0.009% ксиленолового оранжевого в 1.82% сорбита (в соотношении 1 : 100). Оптическую плотность продуктов реакции измеряли на спектрофотометре Biospek-Mini (“Shimadzu”, Япония) при 560 нм.
Определение активности каталазы (КАТ). Для определения активности КАТ (КФ 1.11.1.6) растительную ткань гомогенизировали в 50 мМ растворе ФБ (рН 7.8). Соотношение массы навески к объему буфера составляло 1 : 10. После центрифугирования в течение 10 мин при 12 000 g супернатант использовали для анализа активности фермента [8]. Реакцию инициировали добавлением 0.1 мл супернатанта к 0.2 мл 0.03% раствора Н2О2. В контрольную пробу вместо супернатанта вносили 0.1 мл дистиллированной воды. Реакцию останавливали через 10 мин добавлением 1 мл 4% раствора молибдата аммония. Интенсивность развившейся окраски измеряли на спектрофотометре Biospek-Mini (“Shimadzu”, Япония) при длине волны 410 нм. Активность КАТ рассчитывали по формуле:
где Е – активность КАТ (мкат/л), Ак и Ао – поглощение контрольной и опытной проб, соответственно, V – объем вносимой пробы, 0.1 мл, t – время инкубации, 600 с, К – коэффициент молярного поглощения Н2О2, равный 22.2 × 103 моль–1 см–1.
Определение активности пероксидазы (ПО). Для выделения цитоплазматической фракции ПО (КФ 1.11.1.7) отрезки листьев гомогенизировали в 0.01 М ФБ, рН 6.2. Отношение массы навески листьев к объему ФБ составляло 1 : 3. Экстракт центрифугировали 25 мин при 12 000 g и супернатант использовали для анализа активности ПО. Активность ПО определяли микрометодом [9] по окислению субстрата − ортофенилендиамина. Измерение оптической плотности растворов проводили на спектрофотометре для иммуноферментного анализа Benchmark Microplate Reader (“BioRad”, США) при 490 нм. За единицу ферментативной активности принимали изменение оптической плотности за 1 мин.
Оценка транскрипционной активности генов ингибиторов протеазы и амилазы картофеля. Тотальную РНК из растений выделяли с помощью тризола, согласно протоколу фирмы-поставщика (“Molecular Research Center, Inc.”, США). Для получения кДНК на основе мРНК изучаемых образцов проводили реакцию обратной транскрипции с использованием M-MuLV обратной транскриптазы, согласно протоколу фирмы-поставщика (“Синтол”, Россия). Анализ накопления транскриптов генов ингибитора амилазы (номер в GenBank XM006351484) и ингибитора протеазы (номер в GenBank JX683427) (Дополнительные материалы, таблица 1 ) проводили методом количественной ПЦР в режиме реального времени на приборе “iCycler iQ5 Real-Time PCR Detection System” (“Bio-Rad”, США) с использованием интеркалирующего красителя SYBR Green I (“Синтол”, Россия). Изменения в транскрипционной активности генов (оценка числа копий мРНК для каждого гена) определяли на основании вычисления уровня нормализованной экспрессии c помощью программного обеспечения “iCycler iQ5 Real-Time Detection System software” (“Bio-Rad”, США). На гистограммах представлены значения экспрессии генов по отношению к исходной точке (контроль без обработки).
Активность амилаз и протеаз определяли по гидролизу иммобилизованных крахмала и БСА, соответственно [10]. Субстраты ферментов с конечной концентрацией 1% иммобилизовали в 4% ПААГ. Растворы, обладающие ферментативной активностью, наносили на ПААГ, выдерживали 20 мин при 37°C, затем окрашивали раствором Люголя или Кумасси G-250. Активность ферментов определяли методом денситометрии по калибровочным кривым, построенным с использованием стандартных препаратов амилазы Aspergillus niger и бычьего трипсина (“Sigma”, США). Ферментативную активность выражали в мкмоль субстрата/(г белка мин). Содержание растворимого белка в образцах определяли по методу Брэдфорд.
Статистическая обработка данных. Опыты проводили в 5-кратной биологической повторности. Биохимические параметры и транскрипционную активность измеряли не менее трех раз. На гистограммах показаны выборочные средние, а в качестве показателя погрешности показан 95% доверительный интервал. Для оценки достоверности различий выборочных средних проводили дисперсионный анализ ANOVA и последующий многоранговый тест Дункана в программе Statistica 13 (уровень надежности 95%). Достоверно различающиеся значения обозначены на гистограммах разными буквами.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние различных штаммов бактерий B. subtilis и B. thuringiensis на устойчивость растений картофеля к инфицированию P. infestans
Сравнительный анализ развития возбудителя фитофтороза на растениях картофеля восприимчивого сорта Ранняя Роза выявил различия в степени пораженности листьев P. infestans между контролем и вариантами с обработкой бактериями B. subtilis и B. thuringiensis (рис. 1). В контроле степень поражения листьев составляла 65 ± 15%. Предобработка растений бактериями значимо снижала пораженность листьев: в вариантах опыта со штаммами B. subtilis 26Д и 11ВМ – до 20 ± 11%, и 28 ± 11%, а c обработкой штаммами B. thuringiensis B-6066 и B-5351 – до 36 ± 13% и 41 ± 15% соответственно. Результаты показали, что все исследуемые штаммы бактерий повышали устойчивость растительных тканей к инфицированию возбудителем фитофтороза, но в различной степени. Наиболее эффективное защитное действие на растения картофеля к инфицированию P. infestans оказывали бактерии B. subtilis 26Д, что согласуется с данными, полученными на клубнях S. tuberosum [11] и в культуре in vitro [12].
Рис. 1.
Влияние различных штаммов бактерий B. subtilis и B. thuringiensis на степень поражения листьев картофеля возбудителем фитофтороза Phytophthora infestans (1 – контроль, 2 – Bacillus subtilis 26Д, 3 – Bacillus subtilis 11ВМ, 4 – Bacillus thuringiensis B-5351, 5 – Bacillus thuringiensis B-6066). Разными буквами обозначены достоверно различающиеся значения.

Влияние различных штаммов бактерий B. subtilis и B. thuringiensis на содержание Н2О2 в листьях картофеля при инфицировании P. infestans
Некоторые механизмы повышения устойчивости картофеля к инфицированию P. infestans под влиянием бактерий рода Bacillus могли быть связаны с изменением концентрации Н2О2 в растительных тканях. Исследования показали, что в обработанных бактериями B. subtilis неинфицированных растениях накопление Н2О2 происходило постепенно (рис. 2). Наиболее значимые различия по содержанию Н2О2 между инокулированными B. subtilis 11ВМ и B. thuringiensis B-6066 и контрольными растениями выявлялись через 48 ч после инфицирования (рис. 2).
Рис. 2.
Содержание Н2О2 в растениях картофеля при обработке различными штаммами бактерий B. subtilis и B. thuringiensis и инфицировании P. infestans (1 – контроль, 2 – B. subtilis 26D, 3 – B. subtilis 11ВМ, 4 – B. thuringiensis B-5351, 5 – B. thuringiensis B-6066, 6 – P. infestans, 7 – B. subtilis 26D + P. infestans, 8 – B. subtilis 11ВМ + P. infestans, 9 – B. thuringiensis B-5351 + P. infestans, 10 – B. thuringiensis B-6066 + P. infestans): 1 – 6 ч, 2 – 24 ч, 3 – 48 ч после инфицирования. Разными буквами обозначены достоверно различающиеся значения, относящиеся к одному времени эксперимента. Звездочками обозначены достоверно различающиеся значения, относящиеся к одному варианту обработки, но различающиеся временем эксперимента.

Возможно, это обусловлено антистрессовым воздействием метаболитов бактерий B. subtilis. Известно, что под воздействием эндофитных бактерий рода Bacillus индуцируется активность актиоксидантных ферментов [13]. В то же время, в листьях предобработанных бактериями растениях при инфицировании P. infestans уровень Н2О2 заметно повышался на раннем этапе (6 ч) инфекционного процесса, особенно под воздействием бактерий B. subtilis 26D и B. thuringiensis B-6066 (рис. 2). Однако через 48 ч после инфицирования концентрация Н2О2 в растениях, обработанных различными штаммами бактерий рода Bacillus, не отличалась от контрольных инфицированных растений (рис. 2).
Как известно, устойчивость картофеля к возбудителю фитофтороза P. infestans во многом определяется развитием реакции сверхчувствительности (СВЧ). Это предполагает изменения концентрации Н2О2 в растительных тканях в ответ на внедрение патогена. Н2О2 можно рассматривать в качестве важнейшей молекулы, вовлеченной в передачу внутриклеточных сигналов, регулирующих экспрессию генов и активацию защитных систем растения. Повышение уровня Н2О2 вызывает увеличение концентрации в цитозоле ионов кальция, выполняющих важную роль в процессах передачи сигнальной информации в геном растения [14]. Возможно, бактерии B. subtilis и B. thuringiensis способствуют ранней генерации АФК, индуцируют передачу сигналов, запускающих работу других защитных механизмов. Показано, что бактерии рода Bacillus повышают устойчивость растений к патогенам не только посредством секреции антибиотиков, но и в результате индукции накопления в зоне инфицирования фенолов и ферментов про-/антиоксидантной системы [15]. Вероятно, СРРБ вызывают сенсибилизацию, то есть повышают чувствительность растительных тканей к проникновению патогенов и подготавливают защитную систему растений к последующим ранним ответным реакциям.
Влияние различных штаммов бактерий B. subtilis и B. thuringiensis на активность антиоксидантных ферментов в листьях картофеля при инфицировании P. infestans
Изменение концентрации Н2О2 в растительных тканях при патогенезе может происходить в результате многих метаболических процессов, но в большей степени это происходит в результате изменения активности антиоксидантных ферментов. Важнейшим антиоксидантным ферментом является КАТ [16]. Активность КАТ в отсутствие заражения достоверно повышалась лишь в растениях, обработанных штаммом B. subtilis 26D (рис. 3). В необработанных растениях при заражении фитофторой выявлено снижение активности КАТ в ходе инфекционного процесса. Существенное повышение активности КАТ проявлялось на протяжении 24 ч в инфицированных растениях, предобработанных штаммом B. thuringiensis B-6066, но особенно, штаммом B. subtilis 11ВМ (рис. 3).
Рис. 3.
Активность каталазы в растениях картофеля при обработке различными штаммами бактерий B. subtilis и B. thuringiensis и инфицировании P. infestans (1 – контроль, 2 – B. subtilis 26D, 3 – B. subtilis 11ВМ, 4 – B. thuringiensis B-5351, 5 – B. thuringiensis B-6066, 6 – P. infestans, 7 – B. subtilis 26D + P. infestans, 8 – B. subtilis 11ВМ + P. infestans, 9 – B. thuringiensis B-5351 + P. infestans, 10 – B. thuringiensis B-6066 + P. infestans): 1 – 6 ч, 2 – 24 ч, 3 – 48 ч после инфицирования. Разными буквами обозначены достоверно различающиеся значения, относящиеся к одному времени эксперимента. Звездочками обозначены достоверно различающиеся значения, относящиеся к одному варианту обработки, но различающиеся временем эксперимента.
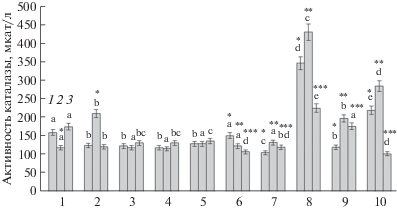
Активность КАТ может существенно модифицироваться с участием сигнальных молекул. Н2О2 является не только сигнальной молекулой, но и субстратом КАТ. В то же время ее воздействие на активность КАТ у растений неоднозначно. Например, в проростках пшеницы Н2О2 в зависимости от концентрации либо ингибировала [17], либо стимулировала [18] активность КАТ. Способностью к ингибированию КАТ обладает и салициловая кислота, что является одним из механизмов развития СВЧ-реакции. Ингибирование фермента под действием салициловой кислоты может приводить в дальнейшем к активации экспрессии гена КАТ и усилению синтеза фермента [19].
Ферментом, вовлеченным как в систему генерации, так и утилизации Н2О2, является пероксидаза (ПО). Основной функцией ПО является защита растительного организма от воздействия АФК и непосредственное участие в процессах дифференциации тканей и органов высших растений.
В незараженных растениях только обработка штаммом B. subtilis 11ВМ приводила к повышению активности ПО по сравнению с контрольными растениями (рис. 4). Активность ПО в зараженных растениях по сравнению с незараженными повышалась через 24 ч после инфицирования P. infestans. Можно отметить, что в инфицированных растениях все исследованные штаммы бактерий B. subtilis и B. thuringiensis вызывали повышение активности ПО по сравнению с контролем, подобно заражению фитофторой.
Рис. 4.
Активность пероксидазы в растениях картофеля при обработке различными штаммами бактерий B. subtilis и B. thuringiensis и инфицировании P. infestans (1 – контроль, 2 – B. subtilis 26D, 3 – B. subtilis 11ВМ, 4 – B. thuringiensis B-5351, 5 – B. thuringiensis B-6066, 6 – P. infestans, 7 – B. subtilis 26D + P. infestans, 8 – B. subtilis 11ВМ + P. infestans, 9 – B. thuringiensis B-5351 + P. infestans, 10 – B. thuringiensis B-6066 + P. infestans): 1 – 6 ч, 2 – 24 ч, 3 – 48 ч после инфицирования. Разными буквами обозначены достоверно различающиеся значения, относящиеся к одному времени эксперимента. Звездочками обозначены достоверно различающиеся значения, относящиеся к одному варианту обработки, но различающиеся временем эксперимента.

Важной особенностью ПО является ее способность переключаться на каталазную активность, предотвращая образование избытка Н2О2. Такое явление, в частности, зарегистрировано для нескольких форм апопластных пероксидаз [20]. Обширное мультигенное семейство классических ПО растений класса III участвует также в укреплении клеточных стенок за счет окислительных реакций между белками и фенοлами, катализируя процесс отложения лигнина, что повышает их устойчивость к действию гидролаз патогенов. Вероятно, регуляция содержания Н2О2 в растениях картофеля под действием бактерий рода Bacillus может происходить различными путями: через снижение активности КАТ и путем модулирующего воздействия на активность ПО.
Влияние различных штаммов бактерий B. subtilis и B. thuringiensis на транскрипционную активность генов ингибиторов протеазы и амилазы и активность ферментов в растениях картофеля при инфицировании P. infestans
Важнейшим компонентом оценки воздействия патогена на растения являются продуцируемые ими гидролитические ферменты, разрушающие клеточные стенки растений и обеспечивающие его проникновение в ткани [21]. Ответная защитная реакция растений сопровождается синтезом ингибиторов этих ферментов [22].
Обработка всеми исследованными штаммами бактерий B. subtilis и B. thuringiensis, как и инфицирование P. infestans, стимулировала накопление транскриптов гена ингибитора амилазы в растениях картофеля по сравнению с контрольными растениями. Обработка штаммами бактерий B. thuringiensis B-5351 и B. thuringiensis B-6066 приводила к достоверному повышению уровня транскрипции гена ингибитора амилазы в инфицированных растениях по сравнению с неинфицированными. Следует отметить, что наибольший уровень транскрипционной активности гена ингибитора протеазы наблюдался при обработке картофеля штаммом бактерий B. thuringiensis B-6066 как в неинфицированных, так и в инфицированных растениях (рис. 5). Вероятно, в ответ на инфицирование P. infestans в растениях картофеля могут синтезироваться de novo ингибиторы ферментов, которые способны подавлять активность амилаз и протеиназ. Повышение содержания ингибиторов гидролаз в растении происходит, как правило, не за счет увеличения концентрации конститутивных соединений, а за счет синтеза новых форм ингибиторов [23]. Наиболее распространенными в растениях являются ингибиторы протеаз и амилаз [20].
Рис. 5.
Транскрипционная активность генов ингибиторов амилазы и протеазы в растениях картофеля при обработке различными штаммами бактерий B. subtilis и B. thuringiensis и инфицировании P. infestans (1 – контроль, 2 – B. subtilis 26D, 3 – B. subtilis 11ВМ, 4 – B. thuringiensis B-5351, 5 – B. thuringiensis B-6066, 6 – P. infestans, 7 – B. subtilis 26D + P. infestans, 8 – B. subtilis 11ВМ + P. infestans, 9 – B. thuringiensis B-5351 + P. infestans, 10 – B. thuringiensis B-6066 + P. infestans): 48 ч после инфицирования. Разными буквами обозначены достоверно различающиеся значения, относящиеся к одному гену.
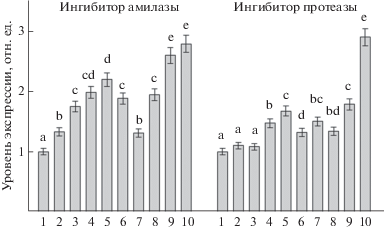
Известно, что амилолитическая активность характерна для представителей большинства таксономических групп возбудителей болезней растений, и почти всегда эти ферменты представлены конститутивными белками. Однако амилаза отсутствует у оомицетов, в частности у представителей рода Phytophthora, которые используют для расщепления крахмала ферменты картофеля, активируя их биосинтез в пораженных тканях [24]. Можно предположить, что повышение уровня транскрипционной активности высокоспецифичных ингибиторов амилаз под действием бактериальных метаболитов препятствует росту и развитию P. infestans в растительных тканях.
Наши исследования показали, что в обработанных B. thuringiensis B-5351 неинфицированных растениях активность амилаз была достоверно ниже, чем в контроле, в то же время обработка картофеля B. subtilis 11ВМ приводила к заметному повышению этого показателя (рис. 6). Активность протеаз в зараженных растениях достоверно понижалась при обработке B. thuringiensis B-6066.
Рис. 6.
Активность амилаз (1) и протеаз (2) в растениях картофеля при обработке различными штаммами бактерий B. subtilis и B. thuringiensis и инфицировании P. infestans (1 – контроль, 2 – B. subtilis 26D, 3 – B. subtilis 11ВМ, 4 – B. thuringiensis B-5351, 5 – B. thuringiensis B-6066, 6 – P. infestans, 7 – B. subtilis 26D + P. infestans, 8 – B. subtilis 11ВМ + P. infestans, 9 – B. thuringiensis B-5351 + P. infestans, 10 – B. thuringiensis B-6066 + P. infestans): 48 ч после инфицирования. Разными буквами обозначены достоверно различающиеся значения, относящиеся к одному ферменту.

Высокая протеолитическая активность в зараженных тканях не только обеспечивает аминокислотами рост и развитие патогенного микроорганизма, но и может нейтрализовать защитные белки картофеля, такие как лектины − ингибиторы гидролаз. Так, показано, что экстрацеллюлярная металлопротеиназа фитопатогенной бактерии Erwinia carotovora (Jones) Waldee расщепляет лектин картофеля, принимающий участие в защите растений [25]. Повышение транскрипционной активности гена ингибитора протеазы направлено на подавление активности ингибиторов экзогенных протеаз и способствует повышению устойчивости картофеля. Ключевую роль в инициации образования ингибиторов протеаз защитной реакции играет мембранный рецептор системин, белок с молекулярной массой около 160 кДа [26]. Реагируя на поранение, он вызывает деполяризацию мембраны, что приводит к открытию ионных каналов и резкому повышению уровня внутриклеточного содержания ионов кальция. В результате активируются МАР-киназы и фосфолипазы, и в ходе ряда реакций образуется жасмоновая кислота, которая, вероятно, и служит активатором транскрипции генов защитных белков [27].
Предполагается, что у СРРМ существуют индивидуальные для каждого штамма соединения, вырабатываемые и секретируемые во внеклеточную среду. Например, пептиды с антибиотическими свойствами, а также универсальные сигнальные молекулы − этилен, салициловая и жасмоновая кислоты [28]. Например, в формирование устойчивости растений перца к бактериальной гнили Xantomonas axonopodis pv. vesicatoria под влиянием штамма B. cereus BS107 вовлекались гены защитных PR-белков, активируемых при патогенезе, часть которых, например, РR-1, индуцировались салициловой кислотой, часть (РR-4, РR-10) – жасмоновой кислотой и этиленом, а часть – Н2О2 [29]. Показано, что инокуляция растений томата штаммом B. subtilis BEB-DN приводила к усилению экспрессии ряда генов ИСУ, среди которых наибольшей активностью характеризовались гены ингибиторов протеаз и ферментов синтеза лигнина [30].
Полученные результаты свидетельствуют о том, что механизм активации защитных систем в растениях картофеля различными штаммами бактерий рода Bacillus связан с накоплением Н2О2, повышением активности антиоксидантных ферментов и ингибиторов гидролаз. Выявленные различия в степени активации транскрипционной активности генов ингибиторов гидролаз под влиянием бактерий B. subtilis и B. thuringiensis предполагают штамм-зависимые пути формирования устойчивости картофеля к P. infestans.
Работа выполнялась частично по теме госзадания (номер государственной регистрации AAAA-A21-121011990120-7), при финансовой поддержке Российского фонда фундаментальных исследований и Белорусского республиканского фонда фундаментальных исследований в рамках научного проекта № 20-516-00005, на оборудовании Центра коллективного пользования “Биомика” (Отделение биохимических исследований и нанобиотехнологии Регионального центра коллективного пользования “Агидель”) и Уникальной научной установки “Кодинк”.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Новотельнова Н.С., Пыстина К.А., Голубева О.Г. Фитофторовые грибы (Сем. Phytophthoraceae). Л.: Наука, 1974. 208 с.
Verma P., Yadav A.N., Kumar V., Singh D.P., Saxena A.K. Beneficial plant-microbes interactions: biodiversity of microbes from diverse extreme environments and its impact for crop improvement // Plant-Microbe Interactions in Agro-Ecological Perspectives / Eds. Singh D.P., Singh H.B., Prabha R. Singapore: Springer, 2017. P. 543.
Мелентьев А.И. Аэробные спорообразующие бактерии Bacillus Сohn в агроэкосистемах. Москва: Наука, 2007. 148 с.
Yarullina L.G., Kasimova R.I., Kuluev B.R., Surina O.B., Yarullina L.M., Ibragimov R.I. Comparative study of bunt pathogen resistance to the effects of fungicides in callus co-cultures Triticum aestivum with Tilletia caries // Agricultural Sciences. 2014. V. 5. P. 906. https://doi.org/10.4236/as.2014.510098
Veselova S.V., Nuzhnaya T.V., Maksimov I.V. Jasmonic acid: biosynthesis, functions and role in plant development // Series Plant Science Research and Practices / Ed. Morrison L. USA: Nova Science Publishers, 2015. P. 33.
Cawoy H., Mariutto M., Henry G., Fisher C., Vasilyeva N., Thonart P., Dommes J., Ongena M. Plant defense stimulation by natural isolates of bacillus depends on efficient surfactin production // Mol. Plant Microbe Interact. 2014. V. 27. P. 87. https://doi.org/10.1094/MPMI-09-13-0262-R
Bindschedler L.V., Minibayeva F., Gardner S.L., Gerrish C., Davies D.R., Bolwell G.P. Early signalling events in the apoplastic oxidative burst in suspension cultured French bean cells involve cAMP and Ca2+ // New Phytol. 2001. V. 151. P. 185. https://doi.org/10.1046/j.1469-8137.2001.00170.x
Яруллина Л.Г., Ибрагимов Р.И., Цветков В.О., Яруллина Л.М., Шпирная И.А. Цитохимические и биохимические методы исследования микроорганизмов – возбудителей болезней растений: учебное пособие. Уфа: РИЦ БашГУ, 2016. 92 с.
Maksimov I.V., Sorokan A.V., Burkhanova G.F., Abizgildina P.P. Regulation of peroxidase activity under the influence of signaling molecules and Bacillus subtilis 26D in potato plants infected with Phytophthora infestans // Appl. Biochem. Microbiol. 2014. V. 50. P. 173. https://doi.org/10.1134/S0003683814020136
Цветков В.О., Шпирная И.А., Максутова В.О., Ибрагимов Р.И. Определение активности амилаз и протеаз с использованием субстратов, иммобилизованных в полиакриламидном геле // Известия Уфимского научного центра РАН. 2018. № 3–5. С. 81.
Yarullina L.G., Akhatova A.R., Kasimova R.I. Hydrolytic enzymes and their proteinaceous inhibitors in regulation of plant–pathogen interactions // Rus. J. Plant Physiol. 2016. V. 63. P. 193. https://doi.org/10.1134/S1021443716020151
Yarullina L.G., Sorokan A.V., Burkhanova G.F., Tsvetkov V.O. Signal regulation of activity of protective proteins in potato plants in vitro with the defeat potato late blight // Theoretical and Applied Ecology. 2019. № 4. P. 136. https://doi.org/10.25750/1995-4301-2019-4-136-141
Berg G. Plant-microbe interactions promoting plant growth and health: perspectives for controlled use of microorganisms in agriculture // Appl. Microbiol. Biotehnol. 2009. V. 84. P. 11. https://doi.org/10.1007/s00253-009-2092-7
Chanda B., Xia Y., Mandal M.K., Sekine K.T., Gao Q.M., Selote D. Glycerol-3-phosphate is a critical mobile inducer of systemic immunity in plants // Nat. Genet. 2011. V. 43. № 5. P. 421. https://doi.org/10.1038/ng.798
White J.F., Torres M.S. Is plant endophyte-mediated defensive mutualism the result of oxidative stress protection? // Physiol. Plant. 2010. V. 138. P. 440. https://doi.org/10.1111/j.1399-3054.2009.01332.x
Mittler R. Oxidative stress, antioxidants and stress tolerance // Trends Plant Sci. 2002. V. 7. № 9. P. 405. https://doi.org/10.1016/S1360-1385(02)02312-9
Bakalova S., Nikolova A., Wedera D. Isoenzyme profiles of peroxidase catalase and superoxide dismutase as affected by dehydration stress and ABA during germination of wheat seeds // J. Plant Physiol. 2004. V. 30. P. 64.
Колупаев Ю.Е., Карпец Ю.В. Формирование адаптивных реакций растений на действие абиотических стрессоров. Киев: Основа. 2010. 352 с.
Guan L.M., Scandalios J.G. Hydrogen-peroxide-mediated catalase gene expression in response to wounding // Free Radic. Biol. Med. 2000. V. 28. № 8. P. 1182. https://doi.org/10.1016/S0891-5849(00)00212-4
Minibayeva F., Kolesnikov O., Chasov A., Beckett R.P., Luthje S., Vylegzhanina N., Buck F., Bottger M. Wound-induced apoplastic peroxidase activities: their roles in the production and detoxification of reactive oxygen species // Plant, Cell & Environment. 2009. V. 32. P. 497. https://doi.org/10.1111/j.1365-3040.2009.01944.x
Maksimov I.V., Sorokan’ A.V., Chereoanova E.A., Surina O.B., Troshina N.B., Yarullina L.G. Effects of salicylic and jasmonic acids on the components of pro/antioxidant system in potato plants infected with late blight // Rus. J. Plant Physiol. 2011. V. 58. P. 299. https://doi.org/10.1134/S1021443711010109
Yarullina L.G., Kasimova R.I., Akhatova A.R., Maksimov I.V., Ibragimov R.I., Umarov I.A. Qualitative and quantitative changes of potato tuber proteome under the influence of signal molecules and infection with Phytophthora infestans // Appl. Biochem. Microbiol. 2016. V. 52. P. 71. https://doi.org/10.1134/S0003683816010154
Lastochkina O.V., Aliniaeifard S., Seifikalhor M., Yuldashev R., Pusenkova L., Garipova S. Plant growth-promoting bacteria: biotic strategy to cope with abiotic stresses in wheat // Wheat Production in Changing Environments. Responses, Adaptation and Tolerance / Eds. Hasanuzzaman M., Nahar K., Hossain A. Singapore: Springer, 2019. P. 579. https://doi.org/10.1007/978-981-13-6883-7_23
Gappa-Adachi R., Yano1 K., Takeuchi S., Morita Y., Uematsu S. Phytophthora blight of southern star (Oxypetalum caeruleum) caused by Phytophthora palmivora in Japan // J. Gen Plant Pathol. 2012. V. 78. P. 39. https://doi.org/10.1007/s10327-011-0351-9
Feng T., Nyffenegger C., Hojrup P., Vidal-Melgosa S., Yan K., Ulrik Fangel J., Meyer A.S., Kirpekar F. Characterization of an extension-modifying metalloprotease: N-terminal processing and substrate cleavage pattern of Pectobacterium carotovorum // Appl. Microbiol. Biotechnol. 2014. V. 98. № 24. P. 10077. https://doi.org/10.1007/s00253-014-5877-2
Gancheva M.S., Malovichko Y.V., Poliushkevich L.O., Dodueva I.E., Lutova L.A. Plant peptide hormones // Rus. J. Plant Physiol. 2019. V. 66. P. 171. https://doi.org/10.1134/S1021443719010072
Vasyukova N.I., Ozeretskovskaya O.L. Jasmonate-dependent defense signaling in plant tissues // Rus. J. Plant Physiol. 2009. V. 56. P. 581. https://doi.org/10.1134/S102144370905001X
Schoonbeek H.J., Jacquat-Bovet A.C., Mascher F., Métraux J.P. Oxalate-degrading bacteria can protect Arabidopsis thaliana and crop plants against Botrytis cinerea // Mol. Plant Microbe Interact. 2007. V. 20. № 12. P. 1535. https://doi.org/10.1094/MPMI-20-12-1535
Yang J.W., Yu S.H., Ryu C.-M. Priming of defense related genes confers root-colonizing Bacilli-elicited induced systemic resistance in pepper // Plant Pathol. J. 2009. V. 25. P. 389. https://doi.org/10.5423/PPJ.2009.25.4.389
Valenzuela-Soto J.H., Estrada-Hernández M.G., Laclette E.I., Délano-Frier J.P. Inoculation of tomato plants (Solanum lycopersicum) with growth-promoting Bacillus subtilis retards whitefly Bemisia tabaci development // Planta. 2010. V. 231. P. 397. https://doi.org/10.1007/s00425-009-1061-9
Дополнительные материалы
- скачать ESM.docx
- Таблица 1. Последовательности праймеров, использованных для оценки транскрипционной активности генов PR-белков.
Инструменты
Физиология растений


