Физиология растений, 2022, T. 69, № 1, стр. 105-112
Жизненный цикл двух токсикогенных видов Bacillariophyta: Pseudo-nitzschia calliantha Lundholm, Moestrup et Hasle и P. pungens (Grunow ex P.T. Cleve) Hasle
С. Л. Полякова a, *, Н. А. Давидович a, И. В. Стоник b, Т. Ю. Орлова b
a Карадагская научная станция им. Т. И. Вяземского – природный заповедник Российской академии наук – филиал Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Институт биологии южных морей имени А. О. Ковалевского Российской академии наук”
Феодосия, Россия
b Национальный научный центр морской биологии им. А. В. Жирмунского Дальневосточного отделения
Российской академии наук
Владивосток, Россия
* E-mail: svietlana.poliakova.77@mail.ru
Поступила в редакцию 24.02.2021
После доработки 08.04.2021
Принята к публикации 08.04.2021
- EDN: YQONSN
- DOI: 10.31857/S0015330321060154
Аннотация
Работа посвящена изучению особенностей жизненного цикла потенциально токсикогенных диатомовых водорослей Pseudo-nitzschia calliantha Lundholm, Moestrup et Hasle и P. pungens (Grunow ex P.T. Cleve) Hasle, обитающих в Черном море. Изучена скорость уменьшения длины клеток при содержании в культуре. Установлена продолжительность жизненного цикла и критическая граница размеров, определяющая переход из одной фазы жизненного цикла в другую. Рассчитана продолжительность дорепродуктивной фазы. Показано изменение длины клеток P. calliantha от 147 мкм у самых крупных инициальных клеток в начале жизненного цикла до 21 мкм у предельно измельчавших, что позволило расширить ранее известные границы диапазона размеров, характерных для вида. Для P. calliantha показано отсутствие зависимости размера инициальных клеток от размера родительских.
ВВЕДЕНИЕ
Диатомовые водоросли представлены большим количеством видов, порядка 100 тысяч [1]. Важным этапом в жизни диатомовых является половая репродукция, необходимая для сохранения вида [2]. При этом следует заметить, что жизненный цикл подавляющего большинства остается неизученным, хотя именно он обусловливает развитие природных популяций, в том числе предопределяет, предположительно, периоды массового развития (“цветения”). В Мировом океане широко распространены представители рода Pseudo-nitzschia H.Peragallo. Отдельные виды этого рода способны продуцировать токсичную домоевую кислоту. В период “цветения” этот нейротоксин, накапливаясь в тканях моллюсков, передается по пищевым цепям [3], вызывая амнезийное отравление [4–6]. Для Черного моря указано семь потенциально опасных видов Pseudo-nitzschia [7], некоторые встречаются в планктоне в прибрежной зоне вблизи Карадага (юго-восточное побережье Крымского полуострова). В пробах нам чаще всего попадались P. pungens (Grunow ex Cleve) Hasle и P. calliantha Lundholm, Moestrup et Hasle. Если вид P. pungens известен с начала прошлого века (он выбран в качестве типового для рода Pseudo-nitzschia), то название P. calliantha появилось не так давно. В 2003 году была опубликована статья, описывающая новый вид [8], показано, что он встречается в Черном море у берегов Турции [9]. Однако первые данные о половом воспроизведении и отдельных элементах жизненного цикла этого вида (под другим названием) были получены задолго до этого [10]. О половом воспроизведении P. pungens стало известно позднее [11]. Сегодня мы имеем достаточно полное представление о жизненных циклах диатомовых водорослей [11–16], и это позволяет при наличии фактического материала анализировать состояние их популяций. Задача данной работы состояла в изучении особенностей жизненного цикла, его продолжительности, минимальных и максимальных размеров клеток характерных для P. calliantha и P. pungens, клоны которых были выделены из планктонных проб, отобранных у берегов Крымского полуострова.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлись планктонные пеннатные диатомовые водоросли рода Pseudo-nitzschia H. Peragallo, 1900: P. calliantha Lundholm, Moestrup et Hasle (рис. 1) и P. pungens (Grunow ex Cleve) Hasle (рис. 2). Отбор проб проводили в нескольких местах вдоль восточного, юго-восточного и юго-западного побережья Крыма: Керченский пролив (г. Керчь), восточная оконечность мыса Опук, Карадагская бухта, бухта Ласпи, Севастопольская бухта (Графская пристань), Каламитский залив (вблизи г. Евпатория), оз. Донузлав (рис. 3). Для отбора проб использовали малую планктонную сеть Джедди. Диаметр входного отверстия сети – 25 см, ячея газ-сита, изготовленного из синтетических нитей, – 74 мкм (ГОСТ 4403-91, ЗАО “Рахмановский шелковый комбинат”, Россия). Микропипеточным способом [17] с использованием инвертированных оптических микроскопов Nib-100 и Bif-100 (Biobase, Китай) из проб выделены одиночные клетки и введены в клоновые культуры. Измерение размеров клеток производили на микроскопе Biolar PI (PZO, Польша) с помощью окулярной линейки, калиброванной по объект-микрометру. Фотографии сделаны при помощи микроскопа NIB-100 и фотокамеры Canon PoverShort A95. Электронные фотографии панцирей получены с помощью трансмиссионного электронного микроскопа (ТЭМ) Carl Zeiss LIBRA-120 (Carl Zeiss Group, Германия). Фотографии использованы для биометрических измерений и для определения видов, встречающихся в исследуемых районах. Постоянные препараты панцирей, залитые высокопреломляющей средой, готовили, используя упрощенный метод [13], при котором живые клетки культуры выдерживали в дистиллированной воде до разрушения содержимого клеток, затем панцири заливали этанолом, используя капиллярную пипетку, переносили на покровное стекло и поджигали. Повторяли манипуляцию с новой порцией. Очищенные панцири заключали в высокопреломляющую смолу Naphrax (Naphrax Ltd. United Kingdom). Культуры содержали в стеклянных чашках Петри диаметром 10 см и колбах Эрленмейера объемом 100 мл в изолированном помещении с постоянной температурой 20 ± 2°C и естественном освещении от окон с северной стороны. Для смешанных посевов использовали чашки Петри диаметром 5 см. В качестве культуральной среды применяли модифицированную искусственную среду ESAW [18]. Пересев в свежую среду осуществлялся с периодичностью 10 дней. Зависимость длины клеток от времени содержания в культуре и размера инициальных клеток от размера родительских аппроксимировали линейным уравнением вида:
Рис. 1.
Pseudo-nitzschia cf. calliantha Lundholm, Moestrup et Hasle, клетки клона 8.0123-G. (а) – общий вид клеток, (б–д) – фрагменты створок, показывающие фибулы и штрихи; (а) – световая микроскопия, (б–д) – трансмиссионная электронная микроскопия. Масштаб линейки – 2 мкм.

где y – длина клеток; x – дата; а, b – коэффициенты.
Методом наименьших квадратов [19] были рассчитаны значения коэффициента b уравнения, показывающего скорость уменьшения размеров клеток. В таблицах и тексте средние значения приводятся с указанием ошибки среднего и количества измерений (n).
РЕЗУЛЬТАТЫ
Изученные клоны Pseudo-nitzschia проявили способность к гетероталлическому половому воспроизведению. За период наблюдений, с августа 2017 года по настоящее время, внутриклоновое (гомоталлическое) воспроизведение не отмечалось. В ходе экспериментов по скрещиванию клонов, выделенных из локальных природных популяций, у Pseudo-nitzschia calliantha наиболее сексуально активными оказались клоны 8.0123-E, 8.0123-G, 7.0804-L и 7.0804-Si5; у P. pungens – 8.0123-D и 7.1023-А (табл. 1). Продемонстрировано отсутствие межвидовой гибридизации.
Таблица 1.
Репродуктивная совместимость клонов Pseudo-nitzschia calliantha и P. pungens, выделенных из локальных природных популяций у побережья Крымского полуострова.
| Место отбора проб | Клон | Пол морфологический/ поведенческий |
P. calliantha | P. pungens | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 8.0123-E | 8.0123-G | 7.0804-L | 7.0806-A | 7.0804-N | 7.0804-F | 7.0804-Si5 | 8.0822-H | 8.0123-D | 8.0111-A | 8.0111-B | 7.1018-B | 7.1018-T | 7.1023-B | 7.1023-А | 7.0806-U | |||||
| mt* | mt2 | mt1 | mt1 | mt1 | mt1 | mt1 | mt2 | mt2 | ||||||||||||
| P. calliantha | оз. Донузлав | 8.0123-E | F | mt2 | – | – | – | – | 0 | 0 | – | – | ||||||||
| оз. Донузлав | 8.0123-G | M | mt1 | 3 | 0 | – | 0 | – | 0 | 0 | – | 0 | ||||||||
| б. Лисья | 7.0804-L | M | mt1 | 3 | 0 | – | 0 | 0 | – | 0 | 0 | 0 | – | |||||||
| б. Актинометрическая | 7.0806-A | M | mt1 | 0 | – | – | – | – | – | 0 | – | – | 0 | – | ||||||
| б. Коктебель | 7.0804-N | M | mt1 | 3 | 0 | 0 | – | 0 | 0 | – | – | – | 0 | – | – | |||||
| б. Львиная | 7.0804-F | M | mt1 | 3 | – | – | – | – | 0 | – | 0 | – | – | – | – | – | ||||
| б. Львиная | 7.0804-Si5 | F | mt2 | – | 3 | 0 | 3 | 0 | 3 | 0 | 0 | 0 | – | 0 | – | 0 | – | |||
| оз. Донузлав | 8.0822-H | F | mt2 | – | 3 | 3 | 3 | – | – | – | – | – | – | – | – | – | – | – | ||
| P. pungens | оз. Донузлав | 8.0123-D | ||||||||||||||||||
| Севастополь | 8.0111-A | – | ||||||||||||||||||
| Севастополь | 8.0111-B | – | – | |||||||||||||||||
| Керчь | 7.1018-B | – | – | 1 | ||||||||||||||||
| Керчь | 7.1018-T | 0 | 0 | – | – | |||||||||||||||
| Керчь | 7.1023-B | – | – | – | – | – | ||||||||||||||
| Керчь | 7.1023-А | 2 | 0 | 0 | – | – | – | |||||||||||||
| б. Биостанция* | 7.0806-U | – | – | – | 2 | – | – | – | ||||||||||||
Рис. 2.
Pseudo-nitzschia pungens (Grunow ex Cleve) Hasle, клетки клона 7.1023-A. (а) – общий вид клеток, (б–д) – фрагменты створок, показывающие фибулы и штрихи, (в) – фрагмент поясковых ободков; (а) – световая микроскопия, (б–д) – трансмиссионная электронная микроскопия. Масштаб линейки – 2 мкм.

Рис. 3.
Станции отбора проб вдоль побережья Крымского полуострова: Керченский пролив (г. Керчь), восточная оконечность мыса Опук, Карадагская бухта, бухта Ласпи, Севастопольская бухта (Графская пристань), Каламитский залив (вблизи г. Евпатория), озеро Донузлав.

Данные, полученные в ходе наблюдения за уменьшением апикальной длины клеток в клонах, позволили расширить диапазон размерных характеристик вида P. calliantha. С 20.05.2018 по 16.01.2019 были измерены 153 инициальные клетки, полученные в процессе межклонового полового воспроизведения. В весенне-летний период в смешанных посевах репродуктивно совместимых клонов была измерена самая длинная инициальная клетка (147 мкм). Среднее значение размера инициальных клеток в этот период – 130.5 ± 1.0 мкм (n = = 143). При этом длина родительских клеток в среднем составила 61.4 ± 1.4 мкм (n = 100). В процессе скрещивания зимой отмечен минимальный размер инициальных клеток – 119 мкм, среднее значение – 125.1 ± 4.3 мкм (n = 10). Длина родительских клеток изменилась и составила в среднем 47.7 ± 2.3 мкм (n = 60). При этом у P. calliantha отсутствует значимая корреляция между размером инициальных и родительских клеток (рис. 4).
Рис. 4.
Зависимость размера инициальных клеток в смешанных посевах клоновых культур Pseudo-nitzschia calliantha от родительских.

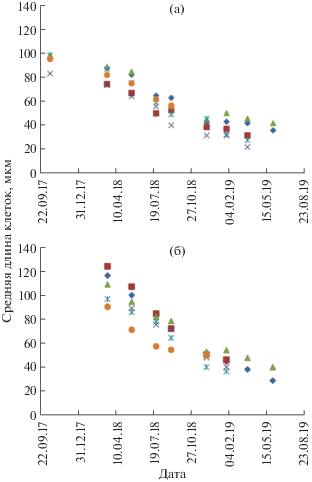
Во всех выделенных черноморских клонах, содержавшихся в культурах, происходило постепенное равномерное уменьшение апикальной длины клеток (рис. 5). Полученные данные позволили оценить скорость уменьшения размеров клеток при содержании в заданных условиях (табл. 2). Наименьшего размера (21 мкм) достигли клетки клона 7.0804-D5, которые продолжали делиться вегетативно, но уже потеряли способность воспроизводиться половым путем. Культуры, достигавшие этого размера, погибали независимо от условий содержания.
Рис. 5.
Изменение длины клеток (а) Pseudo-nitzschia calliantha (клоны: 8.0123-E, 8.0123-G, 7.0804-Si5, 7.0804-D5, 7.0804-N, 7.0804-F) и (б) P. pungens (клоны: 8.0123-D, 8.0123-C, 7.1018-В, 7.1018-С, 7.1018-Т, 7.1023-А) при содержании в культуре (среда ESAW) в условиях постоянной температуры 20 ± 2°C при естественном освещении со стороны северного окна.
В природной популяции самая крупная клетка вида, который нами был идентифицирован на основании морфологических признаков как P. calliantha [20], была найдена в марте 2020 года. Ее длина составила 157 мкм. Средний размер инициальных клеток был равен 136.7 ± 7.4 (n = 44) мкм. Длина родительских клеток лежала в диапазоне 66–91 мкм, среднее значение длины – 83.6 ± 6.3 мкм (n = 81).
Принимая в расчет установленные в лабораторных условиях кардинальные размеры клеток и скорость уменьшения размеров, рассчитали продолжительность дорепродуктивной фазы и всего жизненного цикла, которые составили 12 и 35 мес. (табл. 3).
ОБСУЖДЕНИЕ
Ранее уже была отмечена способность рода Pseudo-nitzschia к гетероталлическому половому воспроизведению [10]. Применяя биологическую концепцию вида, утверждающую, что “виды представляют собой группы фактически или потенциально скрещивающихся природных популяций, которые репродуктивно изолированы от других таких групп” [21], мы можем определить видовые границы большинства гетероталлически воспроизводящихся диатомовых водорослей. В конце 90-х годов XX столетия из Черноморской природной популяции в районе Карадага были выделены и введены в культуру клоны Pseudo-nitzschia, на тот момент идентифицированные как P. pseudodelicatissima. Попытки скрещивания выделенных клонов с другими, принадлежащими к этому виду, результатов не дали [10]. Это инициировало описание нового вида P. calliantha Lundholm, Moestrup et Hasle [8].
Изучение размерных характеристик P. calliantha показало вариабельность границ, от 40 до 110 мкм [8, 22, 23]. Следует заметить, что эти данные были получены на природных популяциях, и вероятнее всего, не отражают изменения размеров во всем жизненном цикле, поскольку при изучении природных популяций в большинстве случаев обычно не удается установить максимальные видоспецифические размеры в силу редкости событий ауксоспорообразования и связанной с этим сложности обнаружения инициальных клеток. В лабораторных условиях, напротив, можно инициировать половой процесс с появлением инициальных клеток, самых крупных, находящихся в начале жизненного цикла, и определить клетки минимального жизнеспособного размера. Данные, полученные нами в лабораторных условиях, позволили существенно расширить известный диапазон размеров, до 21–147 мкм. Примечательно, что в природной популяции были найдены клетки еще большего размера. Однако идентификация вида в этом случае производилась на основании световой микроскопии в прижизненном состоянии, что могло привести к неточности определения вида.
Границей перехода к репродуктивной фазе стало уменьшение клеток предыдущей генерации до 60–70% от максимально видоспецифического размера [25]. Ранее уже была отмечена граница перехода в 63–70% для других видов Pseudo-nitzschia [2, 26]. У представителей этого рода критическая граница, таким образом, выше, чем у большинства изученных диатомовых [27]. Следовательно, продолжительность дорепродуктивной фазы оказывается существенно более короткой.
Таблица 2.
Скорость уменьшения длины клеток Pseudo-nitzschia calliantha и P. pungens при содержании в клоновых культурах
| Станция отбора | Клон | Скорость уменьшения длины клеток, мкм | |
|---|---|---|---|
| день–1 | мес.–1 | ||
| Pseudo-nitzschia calliantha | |||
| оз. Донузлав | 8.0123-E | 0.12 ± 0.04 (n = 8) | 3.7 ± 1.2 |
| оз. Донузлав | 8.0123-G | 0.11 ± 0.03 (n = 7) | 3.4 ± 0.9 |
| б. Львиная | 7.0804-D5 | 0.12 ± 0.04 (n = 8) | 3.7 ± 1.2 |
| б. Львиная | 7.0804-Si5 | 0.11 ± 0.04 (n = 9) | 3.4 ± 0.9 |
| б. Коктебель | 7.0804-N | 0.14 ± 0.05 (n = 8) | 4.3 ± 1.5 |
| б. Лисья | 7.0804-F | 0.12 ± 0.04 (n = 5) | 3.7 ± 1.2 |
| Средняя | 0.12 ± 0.01 (n = 45) | 3.7 ± 0.3 | |
| Минимальная | 0.11 | 3.4 | |
| Максимальная | 0.14 | 4.3 | |
| Pseudo-nitzschia pungens | |||
| оз. Донузлав | 8.0123-D | 0.20 ± 0.01 (n = 8) | 6.1 ± 0.3 |
| оз. Донузлав | 8.0123-C | 0.26 ± 0.07 (n = 6) | 7.9 ± 2.1 |
| Керчь | 7.1018-В | 0.16 ± 0.05 (n = 8) | 4.9 ± 1.5 |
| Керчь | 7.1018-С | 0.20 ± 0.04 (n = 5) | 6.1 ± 0.9 |
| Керчь | 7.1018-Т | 0.20 ± 0.05 (n = 6) | 6.1 ± 1.5 |
| Керчь | 7.1023-А | 0.15 ± 0.04 (n = 5) | 4.6 ± 0.9 |
| Средняя | 0.20 ± 0.02 (n = 38) | 6.0 ± 0.6 | |
| Минимальная | 0.15 | 4.6 | |
| Максимальная | 0.26 | 7.9 | |
Согласно полученным нами данным дорепродуктивная фаза для P. calliantha составляет приблизительно 12 мес. (табл. 3). Если использовать данные о максимальной длине клеток и значения кардинального размера, обуславливающего переход из дорепродуктивной в репродуктивную фазу, известные из литературных источников, то продолжительность дорепродуктивной фазы у P. calliantha и P. pungens должна составить 15 и 14 мес., а всего жизненного цикла – 18.5 и 19 мес. соответственно.
Таблица 3.
Расчетная продолжительность дорепродуктивной фазы и всей продолжительности жизненного цикла у Pseudo-nitzschia calliantha и P. pungens
| Вид | Длина клеток, мкм | Источник данных | Граница перехода в репродуктивную фазу, мкм | Расчетная продолжительность, дни (мес.) | ||
|---|---|---|---|---|---|---|
| минимальная | максимальная | дорепродуктивной фазы | всего жизненного цикла | |||
| P. calliantha | 40 | 110 | [22, 23] | 55* | (110 – 55)/0.12 ≈ ≈458 (15) | (110 – 40)/0.12 ≈ ≈583 (19) |
| 21 | 147 | Настоящая работа | 103** | (147 – 102.9)/0.12 ≈ ≈368 (12) | (147 – 21)/0.12 ≈ ≈1050 (35) | |
| P. pungens | 61 | 174 | [24] | 87* | (174 – 87)/0.20 ≈ ≈435 (14) | (174 – 61)/0.20 ≈ ≈565 (18.5) |
Заметим, что продолжительность отдельных фаз зависит от скорости уменьшения размера клеток, которая в свою очередь определяется толщиной панциря и темпом вегетативного деления [13]. Отмеченная нами разница в скорости уменьшения длины клеток Pseudo-nitzschia pungens и P. calliantha, по нашему мнению, связана в первую очередь с толщиной панциря в зоне перекрытия эпитеки и гипотеки, а не темпом деления.
P. calliantha, как и другие представители рода [28], имеет выраженный сезонный цикл развития. Мониторинг динамики численности в Карадагской бухте показал, что максимумы приходились на ранневесенний (март–апрель) и позднелетний (август–сентябрь) периоды. Массовое развитие, по-видимому, является необходимым условием для успешного полового воспроизведения, поскольку вероятность слияния гамет в трехмерном пространстве возрастает при большой численности [10].
Таким образом, представленные нами размерные характеристики позволяют не только уточнить диагноз вида P. calliantha, имеющего важное практическое значение с точки зрения токсикогенности, но и дают дополнительную информацию для понимания закономерностей протекания жизненного цикла, анализа природных популяций, моделирования динамики численности.
Работа выполнена в рамках госзадания Карадагской научной станции им. Т. И. Вяземского – природного заповедника Российской академии наук – филиала Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Институт биологии южный морей имени А.О. Ковалевского Российской академии наук” – “Изучение фундаментальных физических, физиолого-биохимических, репродуктивных, популяционных и поведенческих характеристик морских гидробионтов”, номер гос. регистрации 121032300019-0. Электронные фотографии диатомей получены в Центре коллективного пользования “Дальневосточный центр электронной микроскопии” Национальный научный центр морской биологии им. А. В. Жирмунского Дальневосточного отделения Российской академии наук.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Mann D.G., Vanormelingen P. An inordinate fondness? The number, distributions and origins of diatom species // J. Eukaryotic Microbiol. 2013. V. 60. P. 414. https://doi.org/10.1111/jeu.12047
Bates S.S., Davidovich N.A. Factors affecting the sexual reproduction of diatoms, with emphasis on Pseudo-nitzschia spp. // Harmful marine algal blooms. Proc. of the sixth international conference on toxic marine phytoplankton / Eds. Lassus P., Arzul G., Erard E., Gentien P., Marcaillou C. Nantes, France: Technique et documentation. Lavoisier, Intercept Ltd, 1995. P. 31.
Bates S.S. Toxic phytoplankton on the Canadian east coast: implications for aguaculture // Bull. Aguacult. Assoc. Canada. 1997. V. 3. P. 9.
Montresor M., Vitale L., D’Alelio D., Ferrante M.I. Sex in marine planktonic diatoms: insights and challenges // Perspectives in Phycology. 2016. V. 3. P. 61. https://doi.org/10.1127/pip/2016/0045
Wright J.L.C., Quilliam M.A. Methods for domoic acid, the amnesic shellfish poisons // Manual onharmful microalgae / Eds. Hallegraeff G.M., Anderson D.M., Cembella A.D. IOC Manual sand Guides № 33: UNESCO, 1995. P. 113.
Rhodes L., White D., Syhre M., Atkinson M. Pseudo-nitzschia species isolated from New Zealand coastal waters: domoic acid production in vitro and links to shellfish toxicity // Harmful and toxic algal blooms / Eds. Yasumoto T., Oshima Y., Fukuyo Y. Paris: IOC of UNE-SCO, 1996. P. 155.
Рябушко Л.И., Besiktepe S., Ediger D., Илмаз Д., Зенгинер А., Рябушко В.И., Ли Р.И. Токсичная диатомовая водоросль Pseudo-nitzschia calliantha Lundholm, Moestrup et Hasle из Черного моря: морфология, таксономия, экология // Морской экологический журнал. 2008. Т. 7. С. 51. https://doi.org/10.2478/v10279-012-0004-8
Lundholm N., Moestrup Ø., Hasle G.R., HoefEmden K. A study of the Pseudo-nitzchia pseudodelicatissima / cuspidata complex (Bacillariophyceae): what is P. pseudodelicatissima? // J. Phycol. 2003. V. 39. P. 797. https://doi.org/10.1046/j.1529-8817.2003.02031.x
Bargu S., Koray T., Lundholm N. First report of Pseudo-nitzschia calliantha Lundholm, Moestrup et Hasle 2003, a new potentially toxic species from Turkish coasts // E.U. Journal of Fisheries and Aquatic Sciences. 2002. V. 19. P. 479. https://doi.org/10.1016/j.ecss.2011.01.002
Davidovich N.A., Bates S.S. Sexual reproduction in the pennate diatoms Pseudo-nitzschia multiseries and P. pseudodelicatissima (Bacillariophyceae) // J. Phycol. 1998. V. 34. P. 126. https://doi.org/10.1046/j.1529-8817.1998.340126.x
Chepurnov V.A., Mann D.G., Sabbe K., Vannerum K., Casteleyn G., Verleyen I., Peperzak L., Vyverman W. Sexual reproduction, mating system, chloroplast dynamics and abrupt cell size reduction in Pseudo-nitzschia pungens from the North Sea (Bacillariophyta) // Eur. J. Phycol. 2005. V 40. P. 379. https://doi.org/10.1080/09670260500254735
Round F.E., Crawford R.M., Mann D.G. The Diatoms. Biology and Morphology of the Genera. Cambridge: Cambridge University Press, 1990. 747 p.
Рощин А.М. Жизненные циклы диатомовых водорослей. Киев: Наукова думка, 1994. 171 с.
Mann D.G. Size and Sex // The Diatom World, Cellular Origin, Life in Extreme Habitats and Astrobiology / Eds. Seckbach J., Kociolek J.P. New York: Springer Science + Business Media, 2011. P. 145. https://doi.org/10.1007/978-94-007-1327-7_6
Davidovich N.A., Davidovich O.I., Podunai Yu. A., Shorenko K.I., Kulikovskiy M.S. Reproductive properties of diatoms significant for their cultivation and biotechnology // Russ. J. Plant Physiol. 2015. V. 62. P. 153.
Poulíčková A., Mann D.G. Diatom sexual reproduction and life cycles // Diatoms: Fundamentals and Applications / Eds. Seckbach J., Gordon R. USA, Beverly, Massachusetts: Scrivener Publishing LLC, 2019. P. 245. https://doi.org/10.1002/9781119370741
Andersen R.A., Berges J.A., Harrison P.J., Watanabe M.M. Algal culturing techniques // London: Elsevier Academic Press, 2005. 578 p.
Полякова С.Л., Давидович О.И., Подунай Ю.А., Давидович Н.А. Модификация среды ESAW, используемой для культивирования морских диатомовых водорослей // Морской биологический журнал. 2018. Т. 3. С. 73. https://doi.org/10.21072/mbj.2018.03.2.06
Рокицкий П.Ф. Биологическая статистика. Минск: Вышейш. школа, 1973. 320 с.
Gogorev R.M., Chudaev D.A., Stepanova V.A., Kulikovskiy M.S. Russian and English terminological glossary on morphology of diatoms // Novosti sistematiki nizshikh rastenii. 2018. V. 52. P. 265.
Mayr E. Systematics and the Origin of Species from the Viewpoint of a Zoologist. New York: Columbia University Press, 1942. 372 p.
Cusack C., Raine R., Patching J.W. Occurrence of Species from the Genus Pseudo-nitzschia Peragallo in Irich Waters // Biology and Environment: Proceedings of the Royal Irish Academy, 2004. V. 104. P. 55. https://doi.org/10.3318/BIOE.2004.104.1.55
Caroppo C., Congestri R., Bracchini L., Albertano P. On the presence of Pseudo-nitzschia calliantha Lundholm, Moestrup et Hasle and Pseudo-nitzschia delicatissima (Cleve) Heiden in the Southern Adriatic Sea (Mediterranean Sea, Italy) // J. Plankton Res. 2005. V. 27. P. 763. https://doi.org/10.1093/plankt/fbi050
Bates S.S., Hiltz M.F., Léger C. Domoic acid toxicity of large new cells of Pseudo-nitzschia multiseries resulting from sexual reproduction // Proceedings of the Sixth Canadian Workshop on Harmful Marine Algae / Eds. Martin J.L., Haya K. New Brunswick, Canada: Fisheries and Oceans Canada, 1999. V. 2261. P. 21.
Полякова С.Л., Давидович Н.А. Положение верхней границы репродуктивной фазы у представителей рода Pseudo-nitzschia // Материалы II Международной научно-практической конференции “Биологическое разнообразие: изучение, сохранение, восстановление, рациональное использование”. Керчь, 2020. С. 51.
Hiltz M., Bates S.S., Kaczmarska I. Effect of light: dark cycles and cell apical length on the sexual reproduction of the pennate diatom Pseudo-nitzschia multiseries (Bacillariophyceae) in culture // Phycologia. 2000. V. 39. P. 59. https://doi.org/10.2216/i0031-8884-39-1-59.1
Davidovich N.A. Species-specific sizes and size range of sexual reproduction in diatoms // Proc. 16th International Diatom Symposium. Athens and Aegean Islands, 2000.
Congestri R., Polizzano S., Albertano P. Toxic Pseudo-nitzschia Populations from the Middle Tyrrhenian Sea (Mediterranean Sea, Italy) // Algal Toxins: Nature, Occurrence, Effect and Detection, Chapter in NATO Security through Science Series A: Chemistry and Biology. 2008. P. 197. https://doi.org/10.1007/978-1-4020-8480-5_7
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


