Физиология растений, 2022, T. 69, № 1, стр. 88-104
Мутация гена ARA7/AtRabF2b, увеличивающая содержание белка ARA7, вовлеченного в регуляцию эндоцитоза, повышает солеустойчивость растений Arabidopsis thaliana (L.) Heynh.
О. В. Сергиенко a, Л. А. Халилова a, Ю. В. Орлова a, А. В. Шувалов a, Н. А. Мясоедов a, И. В. Карпычев a, *
a Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: ikarpichev@gmail.com
Поступила в редакцию 10.02.2021
После доработки 30.04.2021
Принята к публикации 30.04.2021
- EDN: CYDYNN
- DOI: 10.31857/S0015330322010195
Аннотация
C помощью инсерционного мутанта по гену ARA7/AtRabF (AT4G19640) с повышенной экспрессией кодируемого им белка – малой ГТФазы Rab5, являющейся одним из ключевых регуляторов везикулярного транспорта, исследовали связь эндоцитоза с ионным гомеостатированием и солеустойчивостью у Arabidopsis thaliana. У мутантного аллеля было выявлено наличие делеции из 14 нуклеотидов в 5'-нетранслируемой области (5'-НТО) и отсутствие первых трех нуклеотидов на 5'-конце мРНК. Хотя эти изменения и несколько уменьшили относительный уровень транскриптов данного гена в листьях мутантных растений при нормальных условиях, при этом в листьях наблюдалось повышенное содержание соответствующего белка ARA7. Это в свою очередь вызвало заметные фенотипические изменения у растений, выращенных на питательных средах с NaCl. Электронно-микроскопические исследования выявили у мутанта изменения в ультраструктуре клеток корней. Наиболее заметные отличия мутантных растений от дикого типа (ДТ) состояли в наличии электронно˗плотных отложений на тонопласте, повышенной вакуолизации и везикуляции цитозоля, увеличенном содержании сливающихся друг с другом микровакуолей, а также в увеличенном содержании мультивезикулярных тел и аутофагических структур, что указывает на изменение пути эндоцитоза и динамики формирования вакуоли. На уровне целого растения фенотип данного мутанта выражался в позитивной реакции на длительный солевой стресс по сравнению с растениями дикого типа. Мутантные растения имели прирост по массе корней и листьев, повышенное содержание K+ и сниженное среднее содержание Na+ в органах, указывая в целом на более высокую солеустойчивость мутанта по сравнению с растениями ДТ. Предполагается, что вызванные мутацией изменения ультраструктуры отражают пертурбации в везикулярном транспорте и аутофагии, результатом которых являются изменения в ионном гомеостатировании и солеустойчивости растений.
ВВЕДЕНИЕ
Везикулярный транспорт (ВТ) играет важную роль в распределении (sorting) и доставке веществ в различные локусы клетки и за ее пределы. Существует два основных пути ВТ: (1) экзоцитоз, или секреторный путь, посредством которого белки, липиды и другие молекулы, синтезированные в цитоплазме, транспортируются через эндоплазматический ретикулум (ЭР), аппарат Гольджи (АГ) и транс-Гольджи сеть/ранние эндосомы (ТГС/РЭ) к плазмалемме (ПМ) или в экстрацеллюлярное пространство, а также в вакуоль и другие органеллы клетки, и (2) эндоцитоз, осуществляющий интернализацию находящихся в ПМ белков и липидов, а также поглощение молекул из экстрацеллюлярного пространства. Главной ветвью эндоцитозного пути является транспорт в вакуоли [1].
Ключевую роль в регуляции сортинга, связывания везикул с мембранами-мишенями и их последующего слияния, играют RAB ГТФазы и комплексы SNARE (soluble N˗ethylmaleimide˗sensitive factor attachment protein receptors), осуществляющие слияние транспортируемых везикул с мембранами-мишенями. Каждый транспортный путь в клетке характеризуется специфическим набором молекул Rab ГТФаз и SNARE [2]. Регуляторные белки изменяют соотношение между ГТФ- и ГДФ-связывающими формами Rab5, изменяя этим направление и активность ВТ [3, 4]. Из 57 представителей Rab A. thaliana, три белка принадлежат семейству Rab5 ГТФаз. Два из них, консервативные среди эукариот белки ARA7/AtRabF2b и RHA1/AtRabF2a, и белок, специфический для наземных растений ARA6/AtRabF1, локализованы на разных популяциях эндосом с частичным перекрыванием [2, 5]. ARA7 и RHA1 функционируют на поздних стадиях эндоцитозного пути, а именно на стадии слияния мультивезикулярных тел/поздних эндосом (МВТ/ПЭ) с вакуолью [6, 7]. Ингибирование поздних стадий эндоцитоза приводит к нарушению ВТ на всем пути от ПМ к вакуоли [8]. ARA6, в отличие от ARA7 и RHA1, регулирует транспорт веществ на пути от ТГС к ПМ [2, 5, 9].
Ряд исследований указывает на вовлечение ВТ в механизмы ионного гомеостатирования и солеустойчивости растений, хотя имеющиеся в этой области сведения ограничены и противоречивы [10–15]. Например, нокаут-мутация по гену ARA6 (AT3G54840) вызывала у A. thaliana сверхчувствительность к NaCl, а сверхэкспрессия мутантного гена ARA6Q93L, фиксирующего ARA6 в ГТФ-связанной форме, повышала их солеустойчивость, что указывает на регуляторную функцию ARA6 при ответе растений на засоление [10]. Сверхэкспрессия гена AtRabG3e (AtRab7, AT1G49300) активировала эндоцитоз в клетках A. thaliana, приводила к накоплению натрия в вакуолях и увеличению его содержания в побегах. Трансгенные растения по сравнению с диким типом обнаружили более высокую устойчивость к NaCl [11].
В настоящей работе мы сосредоточили внимание на Rab5 ГТФазе AtARA7, являющейся одним из ключевых регуляторов везикулярного транспорта. С помощью инсерционного мутанта по гену AtARA7, с повышенным содержанием кодируемого им белка, мы исследовали связь эндоцитоза с ионным гомеостатированием и солеустойчивостью A. thaliana. С этой целью данная мутация была охарактеризована и определен фенотип мутантных растений. Характеристика мутации включала определение точного положения вставки Т-ДНК в последовательности мутантной аллели гена ARA7, выявление изменений в первичной последовательности ДНК в соседних со вставкой областях, произошедших в процессе интеграции, а также влияния данных хромосомных перестроек на относительный уровень транскриптов гена AtARA7 и количество соответствующего белка, а также относительный уровень транскриптов соседнего с ним гена TRAM (AT4G19645), относящегося к семейству белков, содержащих липид-сенсорный домен. Для определения фенотипа мутанта изучали рост, содержание Na+ и K+ в органах, ультраструктуру клеток корня у мутантных растений и растений ДТ, выращенных в условиях водной культуры при наличии или отсутствии NaCl в питательном растворе (ПР).
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал и выращивание растений. Работу выполняли на растениях Arabidopsis thaliana (L.) Heynh. (экотип Col˗0) (ДТ) и его инсерционном мутанте по гену AtARA7 (SALK_090266C) (http://signal.salk.edu/index.html). Все эксперименты, за исключением исследования ультраструктуры клеток, проводили на растениях, выращенных в условиях водной культуры. Семена проращивали на агаризованной среде, приготовленной на модифицированном питательном растворе (ПР) 1/2 Гибо [16], при температуре 23 ± 2°С, относительной влажности воздуха 70 ± 5%, фотопериоде 16/8 ч (день/ночь) и интенсивности света 80 мкмоль квантов/(м2 · с), полученного от люминесцентных ламп ЛБ-80. Проростки 14-дневного возраста переносили на жидкий ПР 1/2 Гибо, который барботировали воздухом. Остальные условия выращивания растений на жидком ПР были такими же, как при проращивании семян. В вариантах с засолением через 3 сут после перенесения растений на жидкие ПР в них начинали вносить NaCl. Концентрацию соли увеличивали постепенно на 25 мМ в сутки до конечных концентраций 50 или 100 мМ. Смену ПР осуществляли еженедельно. Измерения проводили на растениях 45-дневного возраста. Для исследования ультраструктуры клеток корня использовали 4-дневные проростки, выращенные согласно [17] на агаризованной питательной среде 1/2 Мурасиге-Скуга (MС-среда), дополнительно содержащей 1% сахарозу, с добавлением или без добавления 100 мМ NaCl. Температурный и световой режимы были такими же, как для водной культуры.
Выделение ДНК и определение гомозиготности растений по гену ARA7. Геномную ДНК выделяли из листьев методом, приведенным на сайте (http:// www.monsanto.com/products/documents/dna-detection/dna_im.pdf). Полученную ДНК использовали в качестве матрицы для определения гомозиготности растений методом ПЦР и для амплификации необходимых фрагментов. Последовательности использованных нами праймеров приведены в Дополнительных материалах (таблица 1). Амплифицированные фрагменты при необходимости секвенировали в компании Евроген. Для определения гомозиготности растений A. thaliana были выбраны праймеры LBa1, Ara7F и Ara7R. Пара праймеров, LBa1 и Ara7F, использовалась для амплификации фрагмента размером 1080 п.о. из мутантного аллеля SALK_090266C гена АRA7, в то время как пару, Ara7F и Аra7R, использовали для амплификации фрагмента размером 1180 п.о. из аллеля ДТ того же гена. Продукты амплификации разделяли в 1% неденатурирующем агарозном геле, содержавшем 0.5 мкг/мл бромистого этидия.
Определение наличия возможных дополнительных вставок Т-ДНК в геноме ara7 мутантных растений методом инвертированной ПЦР. Две пары праймеров (LBa1 и M13F; LBb1 и M13F) и геномную ДНК растений гомозиготных генотипов (ДТ и ara7) использовали для определения местоположения Т-ДНК-вставки и возможного наличия дополнительных вставок методом инвертированной ПЦР (inverse PCR). Заметим, что Т-ДНК-вставка из вектора рROK2, использованного для инсерционного мутагенеза, содержит полилинкер и последовательность праймера M13F, расположенную непосредственно перед ним. Данный полилинкер находится на расстоянии около 650 п.о. от конца левой пограничной области Т-ДНК, что позволяет использовать вышеупомянутые пары праймеров и различные рестрикционные эндонуклеазы, сайты которых присутствуют в полилинкере, для постановки инвертированной ПЦР после лигирования. Пять мкг геномной ДНК обрабатывали 50 ед. рестрикционной эндонуклеазы BamHI в объеме 75 мкл в течение двух суток, после инактивации эндонуклеазы (экстракция смесью фенол/хлороформ с последующим двукратным переосаждением этиловым спиртом) лигировали с помощью Т4 ДНК-лигазы (1 ед. Вейса) (Takara, США) в объеме 100 мкл в течение ночи при комнатной температуре. После экстракции смесью фенол/хлороформ с последующим двукратным переосаждением этиловым спиртом осадок ДНК растворяли в 25 мкл деионизованной воды. Для ПЦР (25 мкл) с Taq-полимеразой (Евроген, Россия) брали 2 мкл лигированной ДНК. Параметры программы амплификации: 94°C – 3 мин, затем 35 циклов: 94°C – 1 мин, 58°C − 1 мин, 72°C – 3 мин, и затем 72°C в течение 10 мин. Продукты амплификации разделяли в 1% неденатурирующем агарозном геле, выделяли из геля с помощью набора Clean up Mini (Евроген, Россия) и секвенировали в той же компании для определения геномной последовательности, прилегающей к Т-ДНК-вставке.
Выделение тотальной РНК из A. thaliana и синтез первой цепи кДНК. Для экстракции тотальной РНК из корней и листьев использовали методику, приведенную в работе [18]. РНК выделяли из листьев и корней растений 45-дневного возраста, выращенных в водной культуре, как описано в разделе “Растительный материал и выращивание растений”. Образцы (400 мг) отбирали из трех “средних” смесей, каждая из которых состояла из мелко порезанных листьев или корней 20 индивидуальных растений. После выделения для дополнительной очистки от примесей фенола РНК переосаждали тремя объемами этанола, предварительно внося в раствор РНК 1/10 объема 3М ацетата натрия (pH 5.9). Для проверки целостности препараты РНК анализировали методом электрофореза в 1% неденатурирующем агарозном геле, содержащем бромистый этидий. Примеси геномной ДНК в выделенных препаратах РНК удаляли при помощи ДНКазы I (Thermo Fisher Scientific, США) в соответствии с инструкцией изготовителя. Синтез первой цепи кДНК осуществляли с использованием набора MMLV RTkit (Евроген, Россия) в соответствии с рекомендацией производителя.
Определение старта транскрипции мРНК гена ARA7. Для амплификации 5'-фрагмента мРНК гена ARA7 использовали метод Step-Out RACE с набором праймеров Mint RACE primer set (Евроген, Россия) и ген-специфичным праймером Ara7F. Полученные ПЦР-продукты клонировали в T-A вектор pAL2-T (Евроген, Россия) и секвенировали в компании Евроген.
Количественная ПЦР в реальном времени на матрице кДНК (кОТ-ПЦР). кОТ-ПЦР использовали для анализа экспрессии генов ARA7 и TRAM в мутантных растениях и растениях ДТ. Праймеры подбирали с использованием программы Light Cycler Probe Design 2.0 (Roсhe, США) предпочтительно в 1/3 кодирующей части мРНК, прилегающей к 3'-нетранслируемой области (3'-НТР). Последовательности генов были взяты из базы данных (http://www.arabidopsis.org). Размер ампликона при использовании выбранной пары (Ara71F и Ara71R) для гена ARA7 составлял 105 п.о., a для гена TRAM (при использовании пары праймеров – TR1 и TRAM_R) − 144 п.о. В качестве референсного гена использовали ACT2 (NM_001338358.1), последовательности праймеров к которому были опубликованы ранее [19]. Программа для амплификации была создана в соответствии с рекомендациями производителя прибора АНК-32 (Синтол, Россия) и инструкции к набору Готовая Смесь для ПЦР qPCRmix-HS SYBRmix (Евроген, Россия); тот же набор использовали для приготовления реакционного коктейля. В образец вносили 30 нг матрицы (исходя из количества РНК, взятой для синтеза кДНК). Относительный уровень представленности транскрипта (R) определяли с помощью программы Microsoft Excel по формуле:
(1)
${\text{R}} = {{{{{\text{С}}}_{0}}(ARA7)} \mathord{\left/ {\vphantom {{{{{\text{С}}}_{0}}(ARA7)} {{{{\text{C}}}_{0}}(ACT2)}}} \right. \kern-0em} {{{{\text{C}}}_{0}}(ACT2)}} = {{2}^{{{{{\text{N}}}_{{\text{t}}}}(}}}{{^{{ARA7}}}^{{) - {{{\text{N}}}_{{\text{t}}}}(ACT2)}}},$Содержание Na+ и K+ в органах. Высушенные при 90°С органы 45-дневных растений измельчали. Ионы извлекали водной экстракцией при 100°С, экстракт фильтровали. Концентрацию Na+ и K+ в фильтратах определяли с помощью пламенного фотометра ФПА-2-01 (ОАО ЗОМЗ, Россия).
Электронная микроскопия. Ультраструктуру клеток изучали с помощью трансмиссионной электронной микроскопии. Образцы подготавливали в соответствии со стандартной методикой, как описано ранее [20]. Срезы на сетках контрастировали уранилацетатом и цитратом свинца и просматривали в электронном микроскопе LIBRA 120 (Германия). Площади органелл на срезах измеряли с помощью программы ZEN-2012 Microsoft, используя инструмент “контур”.
Статистический анализ. Статистическую обработку проводили с помощью однофакторного дисперсионного анализа, используя Microsoft Excel 2007. Данные представлены как средние значения и их стандартные ошибки. Достоверность различий между мутантами и растениями ДТ оценивали при разных значениях вероятности: Р ≤ 0.05 (*), Р ≤ 0.01 (**), Р ≤ 0.001 (***).
Продукция антител против AtARA7. Кроличьи поликлональные антитела к белку AtARA7 были получены компанией PhytoAbInc (Рэдвуд Сити, Калифорния, США). Синтетический пептид Leu185-Val194 (LPDRAMDRAV) из AtARA7, имеющий уникальную последовательность среди всех других последовательностей белков семейства Rab5 резуховидки Таля, был использован для иммунизации двух кроликов. Титр полученных иммунных сывороток был определен нами с использованием в качестве положительного контроля экспрессированного в E. coli полноразмерного белка AtARA7, который также содержал дополнительную C-концевую последовательность 6 × His. Данный химерный белок был получен путем амплификации открытой рамки считывания (ОРС) AtARA7 с помощью пары праймеров, ARA7NCOIp28aF и ARA7NCOIp28aR, на матрице кДНК A. thaliana, клонирования полученного продукта амплификации в вектор pET-28a(+) (Novagen, США) по сайтам BamHI и NcoI и последующей экспрессии рекомбинантного atARA7-6 × His в штамме E. coli BL-21 (pLysS) (Novagen, США). Наличие анти-AtARA7 антител в сыворотках было определено путем сравнения молекулярных масс белка в лизате штамма-продуцента BL-21 (pLysS)-atARA7-6 × His, реагирующего как с анти˗6 × His антителами, так и с иммунными сыворотками, методом Вестерн-блот анализа. После этого анти-AtARA7 антитела из сыворотки с большими титром и авидностью были аффинно очищены на фирме Phyto Ab. После определения нами титра аффинно очищенных антител, они были использованы для Вестерн-блот анализа препаратов белков A. thaliana на присутствие AtARA7.
Иммуноблоттинг. Растительные клеточные лизаты готовили с использованием буфера Е (125 мМ Трис-HCl, рН 8.8; 1% (w/v) SDS; 10% (v/v) глицерина; 50 мМ Na2S2O5). После завершения электрофореза в 13% SDS-PAGE белки переносили на нитроцеллюлозную мембрану с диаметром пор 0.45 мкм (Schleicher and Schuell, Германия) с помощью прибора для полусухого переноса Semy-Dry в соответствии с инструкцией изготовителя (Хеликон, Россия) и затем окрашивали с помощью красителя Ponceau S. Для детекции atARA7 кроличьи поликлональные аффинно очищенные антитела (1 мг/мл) к белку atARA7 использовали в разведении 1 : 1000 в растворе TBS-Tw-BSA (1 × TBS, 0.2% Tween 20, 1% Бычий Сывороточный Альбумин (BSA), 0.01% NaN3), а вторичные антитела (анти˗кроличьи козьи Ab, конъюгат с пероксидазой хрена (HRP) (Imtek, Россия)) в разведении 1 : 2500 в растворе TBS-Tween 20-DM (1 × TBS, 0.2% Tween 20, 5% Carnation non˗fat dry milk (Nestle, США)). После последовательной обработки первичными, а затем вторичными антителами, мембрану отмывали и проводили детекцию с использованием ECL (GEHeathcare, США). Для визуализации результатов иммуноблоттинга использовали систему гель-документации Chemi Doc XRS + System (BioRad, США). Количественный анализ содержания белка ARA7 осуществляли с использованием программы ImageJ (http://rsb.info.nih.gov/ij/). Для данного анализа на блоте для каждой дорожки выбирали область, содержащую обе близкие полосы ARA7 и пространство между ними.
РЕЗУЛЬТАТЫ
Характериcтика инсерционного мутанта ara7 (OEARA7). Согласно данным сайта TAIR (www.arabidopsis.org) левая граница вставки Т-ДНК в последовательности гена ARA7 в инсерционном мутанте (SALK_090266C) (http://signal.salk.edu/index.html) располагается в 5'-НТО первого экзона. Для определения точной локализации вставки в промоторе мы амплифицировали и секвенировали фрагмент ДНК из генома гомозиготных мутантных растений с использованием пары праймеров – LBa1 и Ara7F (рис. 1а). Оказалось, что левая граница вставки прилегает к четвертому нуклеотиду вниз от старта транскрипции, который был определен для аллеля гена ARA7 ДТ. Далее ниже вставки находится участок, соответствующий нуклеотидам +4…+15 от старта транскрипции. Сразу за нуклеотидом +15 следует нуклеотид +30, дальнейшая секвенированная последовательность полностью идентична приведенной в базе данных TAIR для ДТ. Таким образом, 5'-НТО мутантного аллеля гена ARA7 содержит делецию из 14 нуклеотидов (рис. 1б).
Рис. 1.
Структура мутантного гена OEARA7 и соседнего с ним гена At4g19645.1 (TRAM) A. thaliana. (а) – cхема расположения функциональных элементов мутантного аллеля (SALK_090266C) гена ARA7 и гена At4g19645.1 (TRAM). Прямоугольниками обозначены экзоны (последние экзоны показаны прямоугольниками со стрелкой), нетранслируемые области и межгенный спейсер. Прерывистой линией обозначены последовательности интронов. Стрелками ниже показаны положения праймеров, использованных в данном исследовании. 1 – делеция, которая располагается в положении от +16 до +29 нуклеотида в 5'-НТО; 2 – фрагмент ДНК неизвестной природы; 3 – последовательность, идентичная началу 5'-НТО ARA7; 4 – последовательность межгенного спейсера; (б) – скорректированная последовательность промотора мутантного аллеля (SALK_090266C) гена ARA7. Полужирным шрифтом выделена последовательность первого экзона согласно данным TAIR. Стрелкой указано место вставки Т-ДНК. Строчными буквами обозначена делеция (от +16 до +29 нуклеотида вниз от старта транскрипции). Последовательность инициирующего кодона подчеркнута.

Мы предположили, что наличие вставки Т-ДНК в промоторе ARA7 может изменить место старта транскрипции данного гена. Для определения точного местоположения старта транскрипции в инсерционном мутанте амплифицированные 5'‑фрагменты РНК клонировали в T-A вектор и секвенировали. Оказалось, что мутантная мРНК не содержит первых трех нуклеотидов на 5'-конце, которые присутствуют в ДТ. Также мы обнаружили в мутантной мРНК отсутствие нуклеотидов +16…+29, показанное нами на уровне геномной ДНК (см. выше).
Мы также определили относительную представленность транскриптов аллелей ARA7 в гомозиготных мутантных растениях и в растениях ДТ методом кОТ-ПЦР. Оказалось, что при нормальных условиях выращивания, относительная представленность мРНК аллели гена ARA7 в листьях мутантных растений была примерно в два раза ниже, чем в растениях ДТ, и эта разница была статистически достоверной (рис. 2а). В остальных случаях, мы не нашли существенных различий между растениями ДТ и мутантами. Таким образом, наличие вставки Т-ДНК в ARA7-промоторе и изменения в первичной структуре самого промотора уменьшило экспрессию (и/или стабильность?) мРНК мутантного аллеля ARA7 в листьях растений при нормальных условиях и не оказало существенного влияния на уровень относительной представленности транскриптов в листьях при засолении и в корнях при всех условиях выращивания по сравнению с ДТ. Была также секвенирована последовательность, прилегающая к правой границе вставки Т-ДНК в мутантном аллеле гена ARA7. Для этой цели нами был получен и секвенирован фрагмент геномной ДНК мутантов размером 1400 п.о., амплифицированный с использованием праймеров RBa1 (находящегося в последовательности правого приграничного участка Т-ДНК) и TR1 (локализованного в последовательности соседнего с ARA7 гена TRAM) (рис. 1а). Оказалось, что между последовательностью Т-ДНК и межгенным спейсером находится фрагмент ДНК неизвестной природы, состоящий из 111 п.о. Непосредственно за ним следует последовательность, состоящая из 27 п.о., идентичная началу 5'-НТО ARA7 (включая 14 п.о., отсутствующих у мутанта). Вышеупомянутая неизвестная последовательность не относится ни к последовательности Т-ДНК, ни к последовательности генома A. thaliana и не депонирована в базе данных NCBI (www.ncbi.nlm.nih.gov). Таким образом, изменения в структуре ДНК, возникшие в процессе инсерционного мутагенеза, непосредственно не затрагивают последовательность гена TRAM и его нетранслируемых областей.
Рис. 2.
Экспрессия гена AtARA7 в органах мутанта OEARA7 и растений ДТ A. thaliana. (а) – относительная представленность мРНК гена AtARA7 в органах A. thaliana, выращенных при различных концентрациях NaCl в питательной среде. Эксперименты проведены в трех независимых повторностях, каждая из которых включала смесь органов 20 индивидуальных растений на каждый вариант. Статистически достоверные различия между мутантом и ДТ показаны звездочкой: (*) – Р ≤ 0.05. 1 − ДТ, лист; 2 − OEARA7; лист; 3 − ДТ, корень; 4 − OEARA7, корень. (б) – иммуноблоттинг и квантификация экспрессии белка atARA7 в суммарных клеточных лизатах, приготовленных из растений A. thaliana ДТ и мутантов OEARA7 (три пары индивидуальных растений I–III), выращенных в нормальных условиях. 40 мкг лизатов были подвергнуты электрофорезу в 13% SDS-PAGE, перенесены на нитроцеллюлозную мембрану и подвергнуты Вестерн-блоттингу с анти-atARA7 антителами. Результирующие изображения были подвергнуты количественному анализу на относительную экспрессию гена ARA7 с использованием программы ImageJ, как описано в Материалах и Методах. ДТ – дикий тип, OEARA7 – мутантная линия OEARA7, ПК – лизат штамма-продуцента BL-21 (pLysS) − atARA7-6 × His (положительный контроль), анти-atARA7 – детекция с антителами, Ponceau S – окраска красителем Ponceau S (контроль нанесения), средние значения − средние значения, вычисленные из значений, полученных для индивидуальных растений из трех пар.

Определение относительнoй представленности транскриптов гена TRAM, граничащего с ARA7, в гомозиготных мутантных растениях и в растениях ДТ методом кОТ-ПЦР не выявило заметных различий между растениями ДТ и мутантами в одних и тех же органах растений (данные не приведены). Как было показано выше, относительный уровень транскриптов мутантного аллеля гена ARA7 в листьях был несколько снижен. При этом 5'-НТО данного аллеля была изменена в результате мутагенеза. Из этого можно предположить, что проявление мутантного фенотипа гена ARA7, возможно, является следствием изменений и в эффективности трансляции мРНК мутантного аллеля гена ARA7.
Для проверки данного предположения, мы использовали Вестерн-блот анализ суммарных белков A. thaliana с поликлональными антителами к синтетическому пептиду, уникальному для atARA7 среди трех белков семейства Rab5 A. thaliana. Данный подход позволил идентифицировать иммунореактивный белок, имеющий молекулярную массу, приблизительно отвечающую молекулярной массе, предсказанной для atARA7 (22 кДа) (рис. 2б). При более внимательном анализе изображения оказалось, что иммунореактивный белок представлен, по крайней мере, двумя полосами с близкими молекулярными массами, что, вероятно, отражает наличие в клетке двух форм atARA7 – мембраносвязанной и растворимой [4, 5]. Нами также было показано, что содержание белка atARA7 в мутантных растениях более чем в два раза превышало его содержание в растениях дикого типа (рис. 2б), несмотря на пониженную относительную представленность ARA7 мРНК в данных растениях. Количественный анализ результатов Вестерн-блоттинга показал, что уровень экспрессии белка ARA7 в листьях мутантных растений в среднем превышал таковой в растениях ДТ более чем в два раза (рис. 2б). Таким образом, используемый в данной работе инсерционный мутант растений A. thaliana по гену AtARA7 является мутантной линией с повышенной экспрессией (т. е. “сверхэкспрессирующей” линией), названной нами OEARA7. Следует заметить, что термин “сверхэкспрессия” подразумевает повышенную экспрессию исследуемого белка сверх нормы, без какого-либо знания его нормальных уровней экспрессии и характера этой экспрессии [20]. Однако, в нашем случае, наблюдалась довольно скромная сверхэкспрессия (примерно в 2.5 раза), поэтому мы предпочли использовать выражение “повышенная экспрессия” вместо “сверхэкспрессия”.
Проверка наличия дополнительных вставок Т-ДНК в геноме ara7 (OEARA7) мутантов. По данным сайта (www.arabidopsis.org) не исключается наличие дополнительных вставок Т-ДНК в геноме мутантов OEARA7. Для определения наличия и местоположения в геноме возможных дополнительных Т-ДНК-вставок использовали метод инвертированной ПЦР. При амплификации с использованием в качестве матрицы переваренной BamHI и затем лигированной геномной ДНК обнаруживался продукт, соответствующий только гену ARA7 в случае матрицы, полученной из мутантных растений. В случае ДТ данный продукт не наблюдался (данные не приведены). Не наблюдались также специфические продукты амплификации других размеров, что позволило нам сделать вывод, что, скорее всего, мутанты OEARA7 не содержат дополнительных Т-ДНК вставок в других участках генома.
Масса органов мутанта OEARA7 и ДТ A. thaliana в норме и в условиях засоления ПР. Сравнение масс корней ДТ и OEARA7 показывает, что мутация практически не повлияла на рост корней в отсутствие засоления. Напротив, мутация заметно стимулировала рост листьев при отсутствии соли в ПР (на 39%), но не оказала влияния на рост цветочных стрелок.
Хлористый натрий, внесенный в ПР в концентрации 50 мМ не оказал влияния на рост корней растений ДТ, 100 мМ NaCl незначительно подавил их рост. У мутантных растений реакция корней на засоление была иной. NaCl в концентрациях 50 и 100 мМ стимулировал их рост на 117 и 78% соответственно. Сравнение масс корней ДТ и OEARA7 показывает, что мутация оказала сильное стимулирующее действие на их рост в условиях засоления (на 86 и 78% при концентрациях NaCl в ПР 50 и 100 мМ соответственно). На рост надземных органов (листьев и цветочных стрелок) NaCl оказал сильное угнетающее действие, как у растений ДТ, так и у мутанта. 100 мМ NaCl подавил рост надземных органов сильнее, чем 50 мМ NaCl (рис. 3а–в). Тем не менее, мутация, как и в случае контроля, заметно стимулировала рост листьев при засолении (44 и 37% при 50 и 100 мМ NaCl соответственно). Не было обнаружено условий, при которых мутация OEARA7 привела бы к снижению массы корней и надземных органов (рис. 3а–в).
Рис. 3.
Сырая масса (а–в) и оводненность (г–е) органов мутанта OEARA7 и растений ДТ A. thaliana при разных концентрациях NaCl в ПР. 1 – ДТ, 2 – OEARA7; (а), (г) – корень; (б), (д) – лист; (в), (е) – цветочная стрелка. Представлены средние значения и их стандартные ошибки. Эксперименты проведены в четырех независимых повторностях, каждая из которых включала по четыре растения на каждый вариант. Статистически достоверные различия между мутантом и ДТ при разных значениях достоверности показаны звездочками: (*) – Р ≤ 0.05, (**) – Р ≤ 0.01, (***) − Р ≤ 0.001.
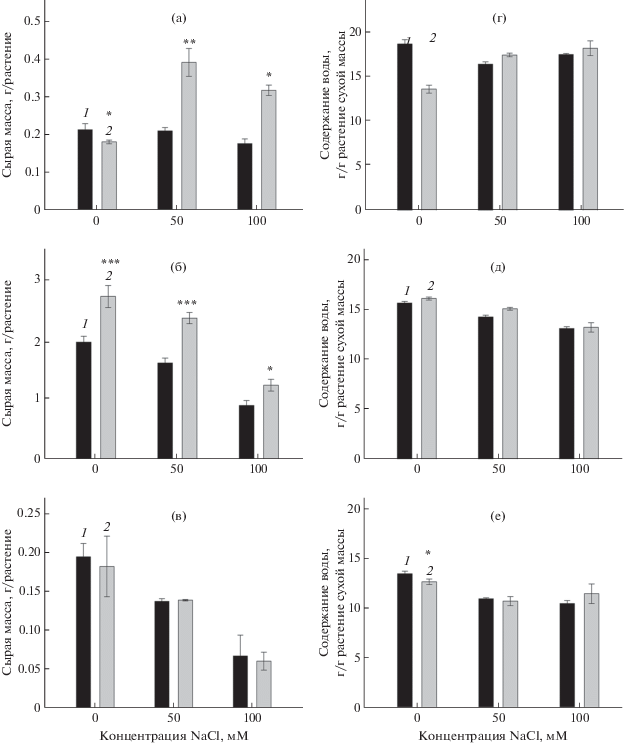
Водный статус органов мутанта OEARA7 и ДТ A. thaliana в норме и в условиях засоления ПР. На рис. 3г–е представлено действие мутации OEARA7 на водный статус органов A. thaliana при разных концентрациях NaCl в ПР. Мутация привела к снижению оводненности корней на 27%, когда соль отсутствовала в ПР. Не было найдено различий в оводненности надземных органов (листьев и цветочных стрелок) между OEARA7 и ДТ при отсутствии NaCl. NaCl, понижающий водный потенциал ПР, практически не оказал влияния на оводненность (содержание воды в расчете на единицу сухой массы) корней ДТ и привел к заметному повышению оводненности корней мутанта (на 28 и 25% при 50 и 100 мМ NaCl соответственно). Под действием NaCl наблюдалось относительно небольшое снижение оводненности надземных органов, как у OEARA7, так и у ДТ. Наиболее заметный эффект соли наблюдался на цветочных стрелках ДТ (снижение оводненности на 19 и 24% при 50 и 100 мМ NaCl соответственно). Мы не увидели различий в оводненности надземных органов между мутантом и ДТ в присутствии соли в среде. В условиях засоления (50 и 100 мМ NaCl) оводненность корней мутанта была такой же, как у ДТ.
Содержание ионов K+ и Na+ в органах мутанта OEARA7 и ДТ A. thaliana. В отсутствие засоления содержание K+ в листьях и цветочных стрелках мутанта OEARA7 и ДТ было одинаковым. Содержание K+ в корнях у OEARA7 в отсутствие соли были выше, чем у ДТ (статистически достоверное различие 19%). Наличие NaCl в ПР в целом привело к снижению содержания K+ в корнях и надземных органах, как у растений ДТ, так и у мутанта (рис. 4а–в). Средние значения содержания K+ в корнях у OEARA7 были выше, чем у ДТ при обеих концентрациях NaCl в ПР (50 и 100 мМ). В листьях OEARA7 более высокое содержание K+ по сравнению с ДТ было обнаружено при 100 мМ NaCl (на 27%). При 50 мМ NaCl содержание K+ в листьях обоих типов растений было одинаковым. В цветочных стрелках мутация привела к увеличению содержания K+ на 17 и 56% при 50 и 100 мМ NaCl соответственно. Не было найдено условий, при которых содержание K+ в корнях и надземных органах OEARA7 было бы ниже, чем у ДТ.
Рис. 4.
Содержание K+ (а–в) и Na+ (г–е) в органах мутанта OEARA7 и растений ДТ A. thaliana при разных концентрациях NaCl в ПР 1 – ДТ, 2 – OEARA7; (а), (г) – корень; (б), (д) – лист; (в), (е) – цветочная стрелка. Представлены средние значения и их стандартные ошибки. Эксперименты проведены в четырех независимых повторностях, каждая из которых включала по четыре растения на каждый вариант. Статистически достоверные различия между мутантом и ДТ при разных значениях достоверности показаны звездочками: (*) – Р ≤ 0.05, (**) – Р ≤ 0.01, (***) − Р ≤ 0.001.

Мутация не привела к изменению содержания Na+ во всех органах растений при нормальных условиях (рис. 4г–е). Содержание Na+ в корнях, листьях и цветочных стрелках растений, как мутанта OEARA7, так и растений ДТ многократно возрастало по мере увеличения концентрации NaCl в ПР. Мутация OEARA7 в целом привела к снижению содержания Na+ в органах растений, выращенных в условиях засоления. В корнях OEARA7 при 100 мМ NaCl в ПР содержание Na+ было ниже, чем у ДТ на 42%, однако при 50 мМ NaCl статистически достоверного снижения содержания Na+ в корнях у мутанта не произошло. Снижение содержания Na+ в листьях у OEARA7 по сравнению с ДТ составило 43% при 50 мМ NaCl, при этом не было обнаружено статистически достоверного снижения содержания Na+ в листьях при 100 мМ NaCl. Мутация привела к сильному снижению содержания Na+ в цветочных стрелках (на 76 и 46% при 50 и 100 мМ NaCl соответственно). Ни при каких условиях данного эксперимента мутация не вызвала увеличения содержания Na+ в корнях, листьях и цветочных стрелках A. thaliana. В целом можно заключить, что мутация OEARA7 привела к снижению содержания Na+ и увеличению содержания K+ в органах A. thaliana.
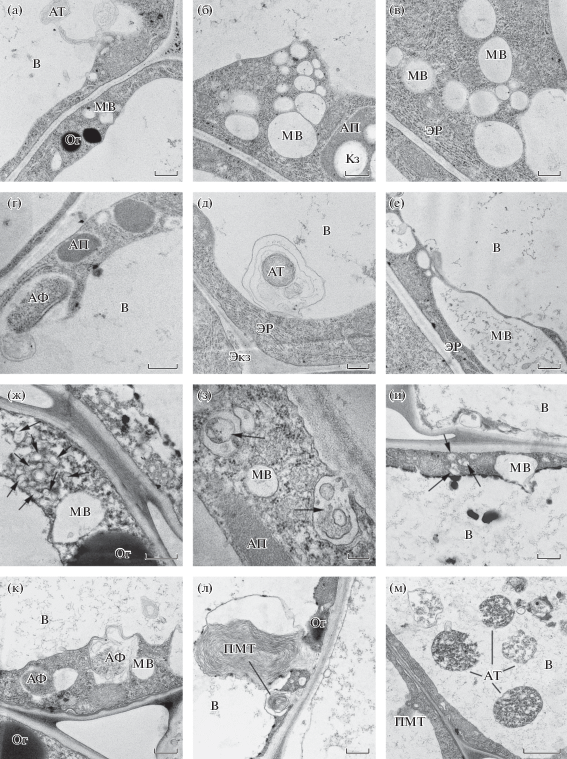
Ультраструктура клеток корней мутанта OEARA7 и ДТ A. thaliana, выращенных на засоленном питательном растворе. Электронно-микроскопическое исследование клеток эпидермы и коры корней мутанта OEARA7 и ДТ A. thaliana проводили на 4-дневных проростках, выращенных на ПР, который содержал или не содержал NaCl. Ультраструктура клеток корня растений ДТ, выращенных на ПР без NaCl, была типичной для растений, растущих на пресном субстрате (рис. 5а–е). Цитоплазма содержала различные органеллы и включения. Эндоплазматический ретикулум (ЭР) был хорошо развит. Помимо большой центральной вакуоли встречались микровакуоли (МВ), которые иногда сливались друг с другом или с центральной вакуолью (рис. 5а). Некоторые из микровакуолей содержали мембранный материал, который подвергался лизису. При этом обнаруживались мультивезикулярные тела (МВТ/ПЭ) (рис. 5д, е). Иногда наблюдалось слияние наружной мембраны МВТ с ПМ и выход внутренних везикул МВТ в периплазматическое пространство (ПП), т. е. происходило образование экзосом (Экз) (рис. 5д). Можно было также наблюдать слияние МВТ с тонопластом (рис. 5е). Диктиосомы аппарата Гольджи (АГ) были плотно упакованы, на транс-стороне иногда наблюдались отпочковывающиеся от диктиосом везикулы ТГС/РЭ (рис. 5в, г, е). В цитоплазме встречались аутофагосомы (АФ), а в вакуолях аутофагические тела (АТ), содержащие разного рода цитоплазматический материал, который, по-видимому, подвергался деградации (рис. 5б–г).
Рис. 5.
Ультраструктура клеток корня 4-дневных проростков A. thaliana ДТ, выращенных на ПР без NaCl (а–е) или ПР, содержащем 100 мМ NaCl (ж–м). Обозначения: МВ – микровакуоль, В – вакуоль, АТ – аутофагическое тело, ЭР – эндоплазматический ретикулум, Экз – экзосомы, АГ – аппарат Гольджи, АФ – аутофагосома, АП – амилопласт, ПМТ – парамуральное тело. Стрелками отмечены мультивезикулярные тела (МВТ). Масштабный отрезок ‒ 0.5 мкм (а, г–ж); 1 мкм (б, в, з–м).
В клетках корней растений OEARA7, выращенных на ПР без NaCl, не было обнаружено заметных качественных отличий в структуре большинства органелл от растений ДТ (рис. 6а–е). Так же как у ДТ, наблюдалось слияние микровакуолей друг с другом или с центральной вакуолью и сливающиеся с тонопластом МВТ/ПЭ (рис. 6б, в, е). ЭР был хорошо развит, цистерны ЭР не были набухшими. АФ в цитоплазме и АТ в вакуолях имели такой же вид, как у растений ДТ, выращенных в ПР без NaCl. В отличие от ДТ у OEARA7 наблюдались некоторые количественные отличия. Содержание МВТ в расчете на единицу площади срезов у OEARA7 имело тенденцию к снижению, однако различие с ДТ не было статистически достоверным. Средняя площадь МВТ в результате мутации стала на 47% меньше, чем у ДТ (табл. 1). У мутанта также на 31% снизилось содержание АГ. В отсутствие засоления мутация не привела к изменениям количества МВ и их средней площади, а также количеств АФ в цитоплазме и АТ в вакуолях (табл. 2).
Рис. 6.
Ультраструктура клеток корня 4-дневных проростков мутанта OEARA7 A. thaliana, выращенных на ПР без NaCl (а–е) или ПР, содержащем 100 мМ NaCl (ж–м). Обозначения: МВ – микровакуоль, Ог – осмиофильные глобулы, В – вакуоль, АТ – аутофагическое тело, АП – амилопласт, АФ – аутофагосома, ЭР – эндоплазматический ретикулум, Экз – экзосомы, ПМТ – парамуральное тело. Стрелками отмечены мультивезикулярные тела (МВТ). Масштабный отрезок ‒ 0.2 мкм (з); 0.5 мкм (а–е, ж, и–л); 1 мкм (м).
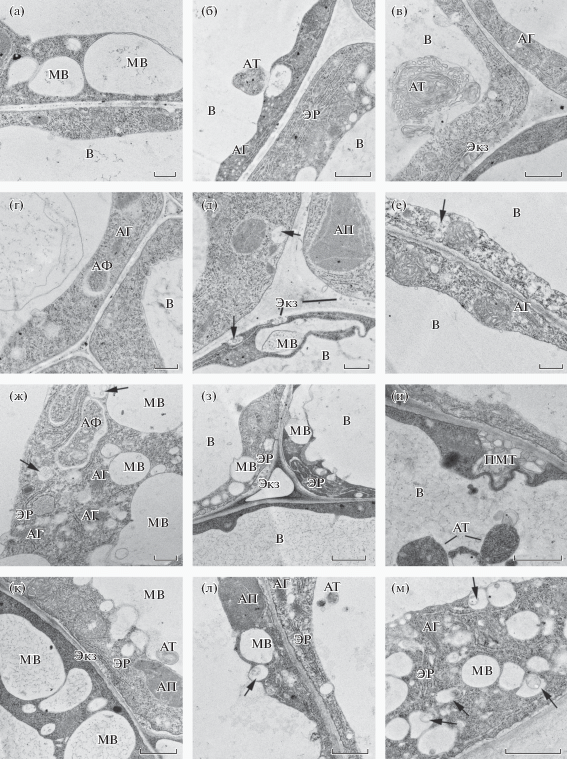
Таблица 1.
Количество и размеры мультивезикулярных тел (МВТ) на срезах клеток корней проростков ДТ и мутанта OEARA7 А. thaliana
| Варианты | Количество МВТ/100 мкм2 |
Средняя площадь МВТ, мкм2 | % площади всех МВТ к площади всех срезов |
|---|---|---|---|
| ДТ | 2.01 ± 0.1b | 0.36 ± 0.08c | 0.72 |
| ДТ + NaCl | 3.94 ± 0.18c | 0.12 ± 0.03a | 0.48 |
| ara7 | 1.39 ± 0.02a | 0.19 ± 0.04ab | 0.20 |
| ara7 + NaCl | 4.49 ± 0.3d | 0.25 ± 0.06b | 1.11 |
Таблица 2.
Количество комплексов Гольджи, аутофагосом и аутофагических тел на срезах клеток корней проростков ДТ и мутанта OEARA7 А. thaliana
| Варианты | Количество КГ/100 мкм2 |
Количество АФ/100 мкм2 |
Количество АТ/100 мкм2 |
|---|---|---|---|
| ДТ | 2.56 ± 0.13b | 0.91 ± 0.05a | 1.00 ± 0.09a |
| ДТ + NaCl | 2.88 ± 0.16b | 1.41 ± 0.09b | 1.31 ± 0.11b |
| ara7 | 1.76 ± 0.1a | 0.89 ± 0.03a | 1.27 ± 0.13b |
| ara7 + NaCl | 1.69 ± 0.08a | 1.71 ± 0.1c | 2.98 ± 0.19c |
Ультраструктура клеток корня ДТ A. thaliana в условиях засоления ПР претерпела ряд изменений (рис. 5ж–м). В частности, наблюдалось набухание цистерн ЭР, которые фрагментировались и формировали микровакуоли угловатой формы (рис. 5ж, з). Наблюдалась более выраженная вакуолизация цитоплазмы в целом, чем при отсутствии NaCl в ПР. Число вакуолей в расчете на единицу площади поверхности срезов и их средняя площадь возросли на 70 и 32% соответственно (табл. 3). Инвагинации тонопласта в вакуоль, а также микровакуоли, сливающиеся друг с другом или с центральной вакуолью в условиях засоления у ДТ встречались чаще, чем при отсутствии NaCl в ПР (рис. 5ж, з, к–м). Иногда обнаруживались двумембранные инвагинации, в сторону вакуоли, образованные одновременно двумя мембранами – ПМ и тонопластом (рис. 5и). Такие структуры, известные как парамуральные тела (ПМТ) [3], ранее наблюдались нами у галофита Suaeda altissima [21]. У растений ДТ в отсутствие засоления они практически не встречались. При засолении у ДТ увеличилось также количество МВТ/ПЭ. Их число в расчете на единицу площади поверхности срезов возросло практически в 2 раза, при этом их средняя площадь уменьшилась в 3 раза (табл. 1, рис. 5ж, л, м). Экзосомы в ПП в варианте с NaCl встречались чаще, чем в отсутствие засоления (рис. 5з–м). Аппарат Гольджи у растений ДТ, выращенных на ПР с NaCl, казался более активным, то есть больше отпочковывал от себя везикул ТГС/РЭ, чем в отсутствие засоления (рис. 5ж, л, м). При этом количество комплексов Гольджи (КГ) в расчете на единицу площади срезов было таким же, как у растений, выращенных на ПР без NaCl (табл. 2). АФ в цитоплазме и АТ в вакуолях растений ДТ в условиях засоления встречались на 55% чаще, чем при его отсутствии (табл. 2, рис. 5ж, и, к, л). Наблюдалась также тенденция к увеличению содержания АТ в вакуолях, хотя различие в этом параметре в присутствии и отсутствии NaCl в ПР не была статистически достоверной.
Таблица 3.
Количество и размеры микровакуолей (МВ) на срезах клеток корней проростков ДТ и мутанта OEARA7 А. thaliana
| Варианты | Количество МВ/100 мкм2 |
Средняя площадь МВ, мкм2 | % площади всех МВ к площади всех срезов |
|---|---|---|---|
| ДТ | 10 ± 0.96a | 0.47 ± 0.11a | 4.73 |
| ДТ + NaCl | 17 ± 0.51c | 0.62 ± 0.15a | 10.80 |
| ara7 | 11 ± 0.98a | 0.54 ± 0.11a | 6.08 |
| ara7 + NaCl | 13 ± 0.44b | 0.47 ± 0.12a | 5.96 |
Наличие NaCl в ПР вызвало небольшое (18%), но статистически достоверное увеличение количества МВ у мутанта. В результате мутации произошло снижение, как количества, так и средней площади МВ в условиях засоления (на 24 и 32% соответственно) (табл. 3). И мутация, и NaCl оказали существенное влияние на количество и размеры МВТ. Засоление ПР привело к увеличению содержания МВТ у OEARA7 в 3 раза, при этом средняя площадь МВТ возросла на 37%. В условиях засоления влияние мутации выразилось в небольшом (14%), но статистически достоверном увеличении количества МВТ и в двукратном увеличении их средней площади (табл. 1), а также в снижении на 41% содержания АГ (табл. 2). Клетки мутантов, выращенных на ПР с NaCl, характеризовались повышенным содержанием АФ в цитоплазме и АТ в вакуоли, что может указывать на активный процесс аутофагии и перенос цитоплазматического материала в вакуоль посредством аутофагии (табл. 2, рис. 6к, м). При этом увеличение содержания аутофагических структур было результатом, как засоления ПР, так и мутации. При выращивании растений на ПР с NaCl в клетках OEARA7, также как в клетках ДТ, встречались ПМТ (рис. 5л). Следует отметить, что у мутанта в условиях засоления мы не наблюдали набухания цистерн ЭР и формирования МВ неправильной формы, а также редко встречали экзосомы в ПП. Характерной особенностью ультраструктуры клеток мутантных растений, выращенных на ПР с NaCl (рис. 6ж–м), было наличие на тонопласте и в вакуоли электронно-плотного материала, который имел вид отдельных точечных скоплений (рис. 6ж, и, л) и часто, отделившись от тонопласта, оказывался в вакуоли (рис. 6и). Не исключено, что отложение этого материала на вакуолярной мембране приводит к нарушению переноса веществ в вакуоль.
ОБСУЖДЕНИЕ
В данной работе мы использовали инсерционный мутант OEARA7 (SALK_090266C), белка семейства малых ГТФаз Rab5. Определение точной локализации вставки Т-ДНК и секвенирование примыкающих к ней областей хромосомы выявили многочисленные изменения в первичной последовательности ДНК. Данные изменения привели к статистически достоверному уменьшению относительной представленности мРНК гена ARA7 в листьях мутантных растений, примерно в два раза по сравнению с ДТ, при нормальных условиях (рис. 2а). Можно предположить, что мутации в промоторе гена ARA7 изменили последовательность сайта связывания и вызвали ослабление связывания или полностью предотвратили связывание транскрипционного фактора(ов) – положительного регулятора при нормальных условиях, и менее активного или неактивного при условиях засоления. Также возможно, что вставка Т-ДНК изменила расстояние между сайтом связывания вышеупомянутого фактора и ТАТА-боксом гена ARA7, уменьшив вклад этого фактора в активацию транскрипции. Это, в свою очередь, привело к уменьшению экспрессии гена ARA7 в мутантных растениях. Также не исключено, что данная мутация каким-то образом привела к уменьшению стабильности ARA7 мРНК при выращивании растений в условиях засоления. В остальных случаях, изменения в первичной структуре примыкающих к вставке областей хромосомы не оказали существенного влияния на относительную представленность мРНК гена ARA7, а также соседнего с ним гена TRAM (At4g19645.1) при всех условиях выращивания. Таким образом, мутантный фенотип не является следствием нарушения экспрессии гена TRAM.
Вестерн-блот анализ тотальных клеточных лизатов листьев растений ДТ и мутантов показал, что иммунореактивный белок представлен, по крайней мере, двумя полосами с близкими молекулярными массами (рис. 2б), что, возможно, отражает наличие в клетке двух форм AtARA7 – мембраносвязанной (верхней) и растворимой (нижней) [4, 5]. Молекулярная масса нижней полосы меньше, чем у контрольного рекомбинантного белка atARA7-6 X His, какую и следует ожидать у посттрансляционно немодифицированного белка AtARA7. Возможно также, что множественность иммунореактивных форм (полос) отражает посттрансляционные модификации данного белка, например, его фосфорилирование.
С использованием Вестерн-блот анализа мы показали, что мутантные растения содержали в 2.5 раза больше белка ARA7, чем растения ДТ, при нормальных условиях выращивания (рис. 2б). Выяснение точной природы повышенной экспрессии гена ARA7 у данной мутантной линии OEARA7 A. thaliana не входило в цели данного исследования. Можно предположить, что это увеличение могло произойти в результате мутаций, произошедших в 5'-НТО гена ARA7 при проведении инсерционного мутагенеза. Хорошо известно, что лидерная 5'-НТО мРНК участвует в регуляции ее трансляции c использованием множественных механизмов, а также в регуляции ее экспорта из ядра клетки. Например, эффективность инициации трансляции мутантной мРНК ARA7 может быть повышена, т. к. три первых нуклеотида в ее 5'-НТО отсутствуют, что, в свою очередь, может повлиять на кэпирование и, как следствие этого, привести к повышению эффективности рекрутирования eIF4F – инициирующего комплекса данной мутантной мРНК. Участие других механизмов регуляции трансляции через 5'-НТО также возможно, т. к. описанная нами делеция в данной области ARA7 должна изменить ее вторичную структуру, важную для регуляции трансляции (например, по механизму riboswitches). Нельзя исключить и комбинацию вышеописанных механизмов. Необходимо также отметить, что изменение стабильности белка ARA7 в мутантных растениях в данном случае маловероятно, т. к. его первичная последовательность в результате инсерционного мутагенеза осталась неизменной. Все вышеприведенные возможные механизмы являются только гипотетическими и требуют экспериментальной проверки. По-видимому, увеличение синтеза белка в мутантных растениях “пересилило” уменьшение экспрессии мРНК гена ARA7, что в конечном итоге и привело к накоплению ARA7 в мутантных растениях.
Следует отметить, что фенотипы растений, сверхэкспрессирующие различные формы (аллели) белка ARA7, были описаны ранее [9]. Было показано, что сверхэкспрессия конститутивно активного мутанта ARA7, GFP-ARA7 (Q69L), индуцирует увеличение МВТ с образованием больших кольцеобразных структур, что также может быть вызвано экспрессией мутантного белка ARA7 (Q69L), не слитого с GFP. В то же время, при сверхэкспрессии ДТ версии белка GFP-ARA7 подобного не наблюдалось. Более подробного описания фенотипа растений, сверхэкспрессирующих ДТ версию белка GFP-ARA7, в том числе, на уровне ультраструктуры, авторами не приводится. Таким образом, наша работа является первым исследованием, где подробно описывается фенотип растений, экспрессирующих повышенные количества ДТ версии белка ARA7, в том числе и на ультраструктурном уровне.
В нашем случае, мутация OEARA7 привела к существенному увеличению биомассы корней и листьев A. thaliana при выращивании растений в условиях засоления, а листьев также и при отсутствии NaCl в ПР (рис. 3а–в). Мутантные растения, выращенные на ПР с NaCl, были способны поддерживать содержание воды на уровне, наблюдавшемся у растений ДТ (рис. 3г–е). В корнях, листьях и цветочных стрелках у мутантов в условиях засоления содержание K+ было выше, а содержание Na+ ниже, чем у ДТ (рис. 4). Соответственно, отношение содержания Na+ к содержанию K+ в органах (K+/Na+), используемое как индикатор солеустойчивости растений, у мутанта было более высоким, чем у ДТ. В целом, эти данные показывают, что мутация OEARA7 стимулирует рост и улучшает ионный и водный статус растений в условиях засоления, что позволяет сделать вывод о более высокой солеустойчивости мутанта OEARA7, чем растений ДТ.
Проведенное нами электронно-микроскопическое исследование клеток корня OEARA7 и ДТ A. thaliana выявило у мутанта существенные изменения в структурах, вовлеченных в эндосомальный транспорт и аутофагию (рис. 5, 6). Интегральный показатель степени вакуолизации клеток – процент площади, занятой на срезах микровакуолями (табл. 3), возрастал, как вследствие засоления ПР, так и в результате мутации, хотя не наблюдалось синергизма в действии этих двух факторов. Наоборот, у мутанта, выращенного на ПР с NaCl этот показатель был ниже, чем у ДТ, выращенного в тех же условиях. Повышенная вакуолизация цитоплазмы клеток корней мутанта и растений ДТ при засолении, по-видимому, связана с необходимостью компартментализации Na+. С этим предположением согласуется более высокое содержание Na+ в корнях ДТ, чем в корнях мутанта, при выращивании растений на ПР с NaCl (рис. 4). По-видимому, существенный вклад в вакуолизацию цитоплазмы растений ДТ при засолении вносил ЭР, формирующий в этих условиях МВ неправильной формы (рис. 5ж, з). Соответствующий интегральный показатель для МВТ, процент площади, занятой этими органеллами на срезах, отражающий как их среднюю площадь, так и их количество (табл. 1), снижался в результате мутации и в ответ на засоление. Однако при совместном действии этих двух факторов он возрастал, указывая в целом на интенсивное образование и развитие МВТ у мутанта в условиях засоления. МВТ играют важную роль в везикулярном транспорте. Эти органеллы вовлечены как в секреторный, так и в эндоцитозный пути переноса веществ и участвуют в реконструкции белкового состава мембран [1, 22]. Интенсивное образование и развитие МВТ/ПЭ могут указывать на активирование путей эндосомального транспорта и более эффективную доставку белков в мембраны, необходимых для преодоления солевого стресса. Такими белками могут быть ионные каналы, транспортеры, транспортные АТФазы и компоненты путей передачи сигналов.
МВТ/ПЭ образуются в результате созревания РЭ, которые, в свою очередь, являются продуктом АГ [1, 22]. Вовлеченные в ВТ органеллы, в том числе аппарат Гольджи, являются динамичными структурами [23, 24]. Уменьшенное содержание комплексов Гольджи в цитоплазме клеток корня мутанта OEARA7 (табл. 2) может быть связано с ускорением биогенеза пост-Гольджи органелл (ранних и поздних эндосом). Изменения в размерах МВТ под действием мутагенеза и NaCl (табл. 1, рис. 5ж, л, м) также можно отнести к изменениям в скоростях образования и последующего превращения этих органелл.
Недавно было показано, что МВТ/ПЭ у растений вовлечены не только в эндоцитозный и секреторный пути транспорта веществ, но также и в деградацию белков посредством аутофагии [23]. Мы обнаружили, что количество аутофагических структур в клетках A. thaliana возрастало, как в ответ на засоление, так и в результате мутации OEARA7 (табл. 2). Активирование этого процесса было особенно выражено при одновременном действии этих двух факторов и сопровождалось возрастанием содержания МВТ/РЭ (табл. 3). Полученный результат подтверждает наличие взаимодействия между эндосомальным транспортом и аутофагией и указывает на вовлечение ARA7 в регуляцию переноса цитоплазматического материала в вакуоль посредством аутофагии при действии на растение NaCl. Известно, что аутофагия является ответом растений на засоление и водный дефицит [25], а также на окислительный стресс [26], который является вторичным по отношению к другим стрессам, в том числе, к вызванному высокими концентрациями NaCl.
Мы предполагаем, что мутантный фенотип связан с изменениями содержания ион-транспортирующих белков в мембранах, опосредованными везикулярным транспортом. Имеются сведения о динамической регуляции содержания ион-транспортирующих белков в мембранах посредством ВТ. Например, абсцизовая кислота (АБК), контролирующая ионный транспорт и транспирацию при водном дефиците, индуцировала селективный эндоцитоз входного (inward rectifying) K+-канала KAT1 в ПМ замыкающих клеток устьиц A. thaliana. Это, в свою очередь, уменьшало поток K+ в клетки, приводило к снижению тургорного давления и стимулировало закрывание устьиц [26, 27]. Другим примером регуляции транспортного белка посредством эндоцитоза у растений являются индуцированные высокими концентрациями бора в среде изменения в содержании транспортера BOR1 плазмалеммы, который загружает бор в ксилему корня A. thaliana. Транспортер BOR1 в этих условиях подвергался эндоцитозу и с везикулами транспортировался от ПМ к ТГС/РЭ, которые созревали затем в ПЭ/МВТ/ПВК. Находясь в составе мембран внутренних везикул ПЭ, наружная мембрана которых сливалась с тонопластом, BOR1, в конце концов, оказывался в вакуоли, где подвергался деградации [28].
Встает вопрос, каким образом изменения в экспрессии белка ARA7, регулирующего ВТ, могут быть связаны с предполагаемыми изменениями в содержании ион-транспортирующих белков мембран. В нашем случае, увеличение экспрессии активной формы ARA7 могло быть причиной таких изменений. Известно, что биологические последствия сверхпродукции исследуемого белка часто определяются не наличием самой этой сверхпродукции, а, скорее, являются результатом изменения баланса между начавшим экспрессироваться сверх нормы целевым белком и другими белками или мультисубъединичными белковыми комплексами клетки [29, 30]. Подобный “loss of fidelity” фенотип является индикатором участия изучаемого белка в клеточных процессах, интересующих исследователей. Например, повышение уровней экспрессии индивидуальных факторов, участвующих в адресации мембранных везикул к целевым мембранам может уменьшить специфичность этого процесса, что в результате приведет к нарушению правильной локализации целевых белков. Так, у пекарских дрожжей Saccharomyces cerevisiae, сверхэкспрессия Sec22 (R-SNARE, циркулирует между ЭР и Гольджи), Bet1 (V-SNARE, необходим для транспорта между ЭР и Гольджи) или Sly41 (необходим для транспорта между ЭР и Гольджи, упакован в везикулы CopII), способна восстанавливать даже летальную для клетки полную потерю функции малой Rab ГТФазы Ypt1 (SNARE˗связывающая ГТФаза, необходима для причаливания и отпочковывания везикул и мембранных взаимодействий внутри комплекса Гольджи, локализована в ЭР и Гольджи), что, скорее всего, связано с “loss of fidelity” фенотипом, как следствие нарушения правильной доставки вышеупомянутых сверхпродуцируемых белков [29, 30]. Возможно, в нашем случае, вызванное мутацией OEARA7 повышение количества ARA7 в клетке изменило баланс между тремя Rab5 ГТФазами (ARA6, ARA7 и RHA1), что, в свою очередь, привело к пертурбациям секреторного пути к ПМ, модификации состава ион-транспортирующих белков ПМ и, соответственно, к изменению ионного статуса растений A. thaliana. Повышенное содержание K+ и сниженное содержание Na+ в клетках, в свою очередь, стимулировало рост мутантных растений в условиях засоления.
В целом проведенное исследование показывает, что повышенный уровень экспрессии гена ARA7, участвующего в регуляции ВТ, приводит к повышению солеустойчивости A. thaliana. Наши дальнейшие исследования будут направлены на выяснение роли везикулярного транспорта в регуляции содержания ион-транспортирующих белков в ПМ в условиях солевого стресса.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (тема № АААА-А121040800153-1). Авторы благодарят к.б.н Е.С. Пожидаеву за рекомендации в постановке кОТ-ПЦР экспериментов на приборе АНК-32 и к.б.н. Д. В. Беляева за помощь в подборе праймеров для определения гомозиготности растений по гену ARA7.
О.В. Сергиенко и Л.А. Халилова внесли равный вклад в данную работу.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Otegui M.S., Spitzer C. Endosomal function sinplants // Traffic. 2008. V. 9. P. 1589.
Ebine K., Miyakawa N., Fujimoto M., Uemura T., Nakano A., Ueda T. Endosomal trafficking pathway regulated by ARA6, a RAB5 GTPase unique to plants // Small GTPases. 2012. V. 3. P. 23.
Goh T., Uchida W., Arakawa S., Ito E., Dainobu T., Ebine K., Takeuchi M., Sato K., Ueda T., Nakano A. VPS9a, the common activator for two distinct types of Rab5 GTPases, is essential for the development of Arabidopsis thaliana // Plant Cell. 2007. V. 19. P. 3504.
Ebine K., Ueda T. Unique mechanism of plant endocytic/vacuolar transport pathways // J. Plant Res. 2009. V. 122. P. 21.
Ueda T., Yamaguchi M., Uchimiya H., Nakano A. Ara6, a plant − unique novel type Rab GTPase, functions in the endocytic pathway in Arabidopsis thaliana // EMB-O J. 2001. V. 20. P. 4730.
Sohn E.J., Kim E.S., Zhao M., Kim S.J., Kim H., Kim Y. W., Lee Y.J., Hillmer S., Sohn U., Jiang L., Hwang I. Rha1, an Arabidopsis Rab5 homolog, plays a critical role in the vacuolar trafficking of soluble cargo proteins // Plant Cell. 2003. V. 15. P. 1057.
Kotzer A. M., Brandizzi F., Neumann U., Paris N., Moore I., Hawes C. AtRabF2b (Ara7) acts on the vacuolar trafficking pathway in tobacco leaf epidermal cells // J. Cell Sci. 2004. V. 117. P. 6377.
Dhonukshe P., Baluška F., Schlicht M., Hlavacka A., Šamaj J., Friml J., Gadella Jr. T.W.J. Endocytosis of cell surface material mediates cell plate formation during plant cytokinesis // Dev. Cell. 2006. V. 10. P. 137.
Jia T., Gao C., Cui Y., Wang J., Ding Y., Cai Y., Ueda T., Nakano A., Jiang L. ARA7(Q69L) expression in transgenic Arabidopsis cells induces the formation of enlarged multivesicular bodies // J. Exp. Bot. 2013. V. 64. P. 2817.
Ebine K., Fujimoto M., Okatani Y., Nishiyama T., Goh T., Ito E., Dainobu T., Nishitani A., Uemura T., Sato M. H., Thordal-Christensen H., Tsutsumi N., Nakano A., Ueda T. A membrane trafficking pathway regulated by the plant − specific RAB GTPase ARA6 // Nature Cell Biol. 2011. V. 13. P. 853.
Mazel A., Leshem Y., Tiwari B.S., Levine A. Induction of salt and osmotic stress tolerance by overexpression of an intracellular vesicle trafficking protein AtRab7 (AtRabG3e) // Plant Physiol. 2004. V. 134. P. 118.
Mimura T., Kura˗Hotta M., Tsujimura T., Ohnishi M., Miura M., Okazaki Y., Mimura M., Maeshima M., Washitani-Nemoto S. Rapid increase of vacuolar volume in response to salt stress // Planta. 2003. V. 216. P. 397.
Hamaji K., Nagira M., Yoshida K., Ohnishi M., Oda Y., Uemura T., Goh T., Sato M.H., Morita M.T., Tasaka M., Hasezawa S., Nakano A., Hara-Nishimura I., Maeshima M., Fukaki H. et al. Dynamic aspects of ion accumulation by vesicle traffic under salt stress in Arabidopsis // Plant Cell Physiol. 2009. V. 50. P. 2023.
Leshem Y., Melamed-Book N., Cagnac O., Ronen G., NishriY., Solomon M., Cohen G., Levine A. Suppression of Arabidopsis vesicle − SNARE expression inhibited fusion of H2O2 containing vesicles with tonoplast and increased salt tolerance // PNAS. 2006. V. 103. P. 18008.
Baral A., Irani N. G., Fujimoto M., Nakano A., Mayor S., Mathew M. K. Salt − induced remodeling of spatially restricted clathrin − independent endocytic pathways in Arabidopsis root // Plant Cell. 2015. V. 27. P. 1297.
Gibeaut D.M., Hulett J., Cramer G.R., Seemann J.R. Maximal biomass of Arabidopsis thaliana using a simple, low − maintenance hydroponic method and favorable environmental conditions // Plant Physiol. 1997. V. 115. P. 317.
Malinska K., Jelinkova A., Petrasek J. The use of FM dyes to analyze plant endocytosis // Plant endosomes. Methods and protocols. / Ed. Otegui M.S. New York: Humana Press, 2014. P. 1.
de Vries S., Hoge H., Bisseling T. Isolation of total and polysomal RNA from plant tissues // Plant molecular biology manual. / Eds. Gelvin S.B., Schilperoort R.A., Verma D.P.S. Netherlands, Dordrecht: Kluwer Academic Publishers. 1988. P. 1.
Wang H., Wang J., Jiang J., Chen S., Guan Z., Liao Y., Chen F. Reference genes for normalizing transcription in diploid and tetraploid Arabidopsis // Sci. Rep. 2014. V. 4. P. 6781.
Prelich G. Gene overexpression: uses, mechanisms, and interpretation // Genetics. 2012. V. 190. P. 841.
Balnokin Yu.V., Kurkova E.B., Myasoedov N.A., Khalilova L.A., Yusufov A.G. Pinocytosis in the root cells of a salt-accumulating halophyte Suaeda altissima and its possible involvement in chloride transport // Russ. J. Plant Physiol. 2007. T. 54. C. 797.
Sutter J.-U., Sieben C., Hartel A., Eisenach C., Thiel G., Blatt M.R. Abscisic acid triggers the endocytosis of the Arabidopsis KAT1 K+ channel and its recycling to the plasma membrane // Curr. Biol. 2007. V. 17. P. 1396.
Mulet J.M., Llopis-Torregrosa V., Primo C., Marques M.C., Yenush L. Endocytic regulation of alkali metal transport proteins in mammals, yeast and plants // Curr. Genet. 2013. V. 59. P. 207.
Cui Y., Shen J., Gao C., Zhuang X., Wang J., Jiang L. Biogenesis of plant prevacuolar multivesicular bodies // Mol. Plant. 2016. V. 9. P. 774.
Zhuang X., Cui Y., Gao C., Jiang L. Endocytic and autophagic pathways crosstalk in plants // Curr. Opin. Plant Biol. 2015. V. 28. P. 39.
Ito Y., Toyooka K., Fujimoto M., Ueda T., Uemura T., Nakano A. The trans−Golgi network and the Golgi stacks behave independently during regeneration after Brefeldin A treatment in tobacco BY-2 cells // Plant Cell Physiol. 2017. V. 58. P. 811.
Liu Y., Xiong Y., Bassham D.C. Autophagy is required for tolerance of drought and salt stress in plants // Autophagy. 2009. V. 5. P. 954.
Minibayeva F., Dmitrieva S., Ponomareva A., Ryabovol V. Oxidative stress − induced autophagy in plants: The role of mitochondria // Plant Physiol. Biochem. 2012. V. 59. P. 11.
Rine J. Gene overexpression in studies of Saccharomyces cerevisiae // Guide to Yeast Genetics and Molecular Biology. Methods in Enzymology. / Academic Press, 1991. V. 194 P. 239.
Dascher C., Ossig R., Gallwitz D., Schmitt H.D. Identification and structure of four yeast genes (SLY) that are able to suppress the functional loss of YPT1, a member of the RAS superfamily // Mol. Cell. Biol. 1991. V. 11 P. 87.
Дополнительные материалы
- скачать ESM.docx
- Таблица 1. Праймеры, использованные в данном исследовании.
Инструменты
Физиология растений


