Физиология растений, 2022, T. 69, № 1, стр. 3-19
Сигнальные пути регуляции экспрессии генов альтернативной оксидазы растений
Е. В. Гармаш *
Институт биологии Коми научного центра Уральского отделения
Российской академии наук
Сыктывкар, Россия
* E-mail: garmash@ib.komisc.ru
Поступила в редакцию 28.04.2021
После доработки 01.06.2021
Принята к публикации 07.06.2021
- EDN: AATESI
- DOI: 10.31857/S0015330322010055
Аннотация
В обзоре рассмотрены актуальные вопросы регуляции терминальной альтернативной оксидазы митохондрий растений (АО), являющиеся предметом современных исследований и дискуссий. АО обеспечивает транспорт электронов по альтернативному нефосфорилирующему цианидустойчивому пути в митохондриальной ЭТЦ (ЭТЦ) и играет важную роль в поддержании окислительно-восстановительного баланса клетки и защите от стресса. Основные сведения по сигналингу АО получены в работах по изучению экспрессии гена АОХ1а Arabidopsis thaliana (AtAOX1a). Проанализирована информация об экспрессии АОХ у различных видов растений. Описаны механизмы транскрипционного и посттранскрипционного контроля экспрессии генов АОХ. Рассмотрена роль некоторых цис-регуляторных элементов промотора AtАОХ1а и связанных с ними транскрипционных факторов. Показано, что трансдукция сигнала, вызывающего экспрессию генов АОХ, может происходить по антероградному и ретроградному пути. Приведены сведения о митохондриальной ретроградной регуляции АО, АФК-зависимых и АФК-независимых сигнальных путях индукции экспрессии АОХ. Дана гипотетическая последовательность сигнальных событий индукции светом экспрессии АОХ1а в клетке листа пшеницы в процессе зеленения. Описано взаимодействие сигналинга АО с гормональными сигнальными путями и индукция АОХ сигналами пластидного происхождения. В заключении подчеркнуто, что АО интегрирована в общую сигнальную сеть клетки, являясь как мишенью, так и регулятором сигнальных событий.
ВВЕДЕНИЕ
Во внутренней мембране растительных митохондрий, наряду с основным (цитохромным) путем транспорта электронов (ЦП), присутствует альтернативный путь (АП) через терминальную оксидазу, названную альтернативной оксидазой (АО). АО катализирует четырехэлектронное восстановление убихинолом кислорода до воды и устойчива к действию цианида. АП транспорта электронов минует два пункта генерации электрохимического градиента протонов (комплексы III и IV), а энергия окисления убихинола кислородом выделяется в виде тепла. Это снижает энергетическую эффективность дыхания, но снимает дыхательный контроль, регулирующий скорость образования АТФ и НАД·Н в зависимости от нужд клетки [1]. АП выявлен не только у высших растений, но и у представителей всех царств (кроме Archaebacteria) – бактерий, водорослей, мхов, папоротников, некоторых грибов и даже животных, ведущих малоподвижный или прикрепленный образ жизни (губки, актинии, нематоды, моллюски и др.) [1].
Первоначально интерес к АО был вызван ее участием в процессе термогенеза тканей цветка у некоторых представителей сем. Araceae. Повышение температуры термогенных тканей способствует испарению соединений, привлекающих насекомых-опылителей. Этот феномен описан еще в XVIII веке Ламарком, а цианидрезистентное дыхание было открыто в 30-х гг. XX века [2]. Нефосфорилирующая особенность АП в течение долгого времени вызывала вопросы о функции АП в нетермогенных тканях. Обсуждению природы, механизмов регуляции и физиологического значения АО в растениях посвящено немало обзоров [1, 3–7]. К настоящему времени большинство исследователей сходятся во мнении, что на клеточном и биохимическом уровне вовлечение АП способствует поддержанию окислительно-восстановительного баланса в митохондриальной ЭТЦ за счет более быстрого окисления НАД·Н и предотвращает генерацию избыточного количества АФК. Это влияет на метаболизм не только митохондрий, но и клетки в целом. Признано, что роль АО заключается в обеспечении метаболической пластичности клетки и растения в изменяющихся условиях среды [6].
Исследование альтернативного пути дыхания вышло из рамок только фундаментальной проблемы. Альтернативную оксидазу предложено использовать в качестве функционального маркера перепрограммирования клетки (“cell reprogramming”) при стрессе в селекции генотипов с высокой продуктивностью и устойчивостью [8], для выявления реакции растений в ответ на изменение условий среды (глобальное потепление, увеличение СО2 в атмосфере) [9], в борьбе с митохондриальными заболеваниями человека [10]. За последние два десятилетия благодаря применению современных физико-химических и молекулярно-генетических методов достигнут значительный прогресс в исследовании структуры белка, генов и функций AO. Полагают, что АО является не только мишенью, но и регулятором стресс-сигнала [11]. Вместе с тем, исследование различных аспектов сигналинга АО на молекулярном уровне пока только начинаются [1, 7, 12, 13].
В настоящем обзоре приведены известные к настоящему времени сведения о генах АО, сигнальных путях и механизмах индукции их экспрессии, интеграции сигналинга АО с другими клеточными сигнальными путями; проанализирована роль АО в поддержании сигнальных внутриклеточных взаимодействий; обсуждаются механизмы посттрансляционных модификаций белка АО. В обзор также включены собственные экспериментальные данные, свидетельствующие об участии АО в модуляции митохондриальной функции.
ГЕНЫ АО И ИХ ПОЛИМОРФИЗМ
У двудольных растений АО кодируется двумя подсемействами ядерных генов – АОХ1 и АОХ2, у однодольных – одним подсемейством АОХ1 [14], за исключением некоторых представителей древней, рано дивергировавшей группы сем. Araceae [15]. Образование двух подсемейств и варьирование количества генов, по-видимому, является результатом дупликации и дивергенции [14, 15]. АОХ2 присутствует в водорослях и голосеменных растениях, но не найден во мхах, папоротниках и плаунах. В геноме грибов обнаружен ген АОХ только одного из двух подсемейств. Arabidopsis thaliana содержит четыре гена АОХ1(a–d) и один АОХ2, соя Glycine max, напротив, – один ген АОХ1 и два гена АОХ2(а, b) [14]. Рис содержит четыре гена АОХ1(a–d) [14], а у пшеницы идентифицированы только гены АОХ1a и АОХ1c [16], хотя не исключена возможность обнаружения других генов этого подсемейства – AOX1d и AOX1e [17]. Геном моркови Daucus carota L. уникален, он содержит два гена каждого подсемейства: AOX1(a, b) и AOX2(a, b) [18].
Большинство генов имеют консервативную интрон-экзонную организацию, состоящую из четырех экзонов, чередующихся тремя интронами. Вариации структуры генов АОХ среди видов связаны с потерей или включением интрона [14]. Исследования индукции АОХ на уровне транскрипции в основном проведены на растениях с секвенированным геномом – Arabidopsis thaliana (L.) Heynh., A. lyrata L., Nicotiana tabacum L., Zea mays L. и некоторых других видах, что позволяет определить молекулярные механизмы сигналинга, регуляции активности АО и ее роль в реакции на стресс.
Гены АОХ могут проявлять полиморфизм, как правило, связанный с однонуклеотидными заменами (SNP). SNP в АОХ могут встречаться как в экзонах, так и в интронах [14]. SNP обнаружены в нескольких областях гена АОХ2 в трех сортах Olea europaea L. [19]. Найдены также полиморфные сайты АОХ со вставкой/делецией и копированием фрагментов ДНК. В частности, полиморфизм АОХ моркови (DcAOX2a) выявлен в интроне 3 [20]. Функциональное значение всех найденных SNP в АОХ пока точно не определено. Известно, что замена Лиз (K) на Асн (N) в 96 позиции аминокислоты в белке АО арбуза была результатом SNP в единственном гене АО арбуза – ClAOX [21]. Как показано, этот SNP связан с локусом хозяйственно-полезных количественных признаков, отвечающих за устойчивость к гипотермии [22]. Вариации в последовательности гена АО предложено использовать как молекулярные маркеры стрессоустойчивости вида, в том числе, для селекции в растениеводстве, а также наследственной изменчивости для объяснения индивидуальных различий между растениями одного вида [8, 14]. В результате точечного мутагенеза в гене АОХ1а риса получена однонуклеотидная замена; замена K71 на N71 в белке привела к повышению устойчивости сорта к пониженным температурам [23].
Другой аспект полиморфизма генов АО связан с микрогетерогенностью 3'-нетранслируемой области транскриптов АОХ (3'-UTR) в результате альтернативного полиаденилирования [14]. Модуляция длины 3'-UTR может значительно влиять на регуляцию экспрессии AOX, хотя сведений об этом очень мало. В 3'-UTR АОХ1а кукурузы идентифицирован предполагаемый сайт связывания с микроРНК (miR163) [14, 24]. Этот сайт находится между двумя сайтами расщепления, указывая на то, что только транскрипты с достаточно длинной 3'-UTR могут подвергаться микроРНК-сайленсингу. Около половины молекул мРНК AOX1a в проростках кукурузы, транскрипция которых была индуцирована обработкой H2O2, имели короткие 3'-UTR без сайта связывания микроРНК и, следовательно, избегали микроРНК-сайленсинга [24]. В интроне 3 AОХ2a Daucus carota найдена повторяющаяся делеция, которая, предположительно, влияет на сайт связывания с микроРНК [20]. Множественные вариации длины 3'-UTR выявлены в АОХ2 у разных сортов оливы (Olea europaea L.) [19]. Это может быть консервативным признаком среди сортов с разной способностью к укоренению черенков, которое связано со стресс-индуцируемой экспрессией АОХ2 [19].
Хотя информация о полиморфизме генов АО пока фрагментарна, становится все более понятно, что полиморфизм АОХ является эволюционным механизмом регуляции экспрессии АОХ на различные сигналы, повышающим устойчивость растения к стрессу.
ТРАНСКРИПЦИОННЫЙ И ПОСТТРАНСКРИПЦИОННЫЙ КОНТРОЛЬ ЭКСПРЕССИИ ГЕНОВ АО
Регуляция активности транскрипции гена в значительной степени связана со структурой его промоторной области. Наиболее полно изучены промоторы генов АО A. thaliana [25, 26] и Glycine max [27]. Ген АОХ1а A. thaliana (AtAOX1a) служит моделью для изучения транскрипционного контроля экспрессии АОХ при стрессе [5, 26, 28].
Область промотора содержит цис-регуляторные элементы (CAREs), как правило, находящиеся близко к ССТ (сайт старта транскрипции). Эти элементы могут взаимодействовать с РНК-полимеразой и транскрипционными факторами (ТФ), контролирующими экспрессию генов.
Анализ промотора AtAOX1a с использованием делеций и мутагенеза выявил область длиной 93 п.н. (отрезок между 313 и 406 позицией нуклеотидных оснований выше ССТ; далее все позиции выше ССТ обозначены со знаком “–”), обозначенную как регулятор экспрессии AtAOX1a митохондриального ретроградного пути [13, 28]. Эта область промотора регулирует экспрессию гена при воздействии антимицина – ингибитора комплекса III ЭТЦ, и ингибитора ЦТК (аконитазы) – МФА (монофторацетат). Позже был выявлен CARE, обозначенный как MDM (Mitochondrial Dysfunction Motif), имеющий последовательность CTTGNNNNNCA(A/C)G и регулирующий экспрессию так называемых 24 MDS-генов (Mitochondrial Dysfunction Stimulon), в том числе АОХ1а [29].
Анализ промотора AtAOX1a длиной 1800 п.н. выше ССТ выявил 15 CAREs, из которых 12 были функционально активными (A1, А2, B2, C, D, E, F, G, H, I1, I2, J), участвующими в регуляции транскрипции гена в ответ на воздействие таких стресс-агентов как Н2О2 и ротенон (ингибитор комплекса I ЭТЦ), либо обоих [26]. В нормальных условиях промотор AtAOX1a репрессирован под контролем элемента B2 (CGTGAG, –1576 п.н.). Этот элемент является сайтом связывания с ТФ ABI4 (ABA-Insensitive 4). Полагают, что ABI4 – репрессор митохондриальной ретроградной регуляции (MРР), поскольку мутанты abi4 имели повышенный уровень транскриптов гена [30].
CAREs A2, E, I1 и I2 функционируют как активаторы МРР. При воздействии стресс-агентов уровень репрессии снижался и наблюдалась положительная регуляторная активность других CAREs, что свидетельствует о комбинаторной природе регуляции экспрессии генов [26].
Элементы B и I содержат сайт ABRE (ABA-Responsive Element) (ACGT), а элемент I1 (ACGTG, –93 п.н.) находится в непосредственной близости к I2, формируя пару ABRE-ABRE. ABRE распознается ТФ bZIP (лейциновая молния); две копии ABRE, вероятно, обеспечивают высокую чувствительность гена к АБК [26].
CARE I1 в промоторе AtАОХ1а также перекрывается с фоточувствительным элементом G-box (CACGTG), что предполагает существование прямых механизмов, связывающих экспрессию гена с фотосинтетической функцией [26, 31, 32]. Сведения о фоточувствительных элементах промотора АОХ и светозависимом характере индукции АОХ приведены далее в разделе о сигнальных путях.
Генетический скрининг выявил сайты (T/G)CGTGT и W-box ((a/t)TTGAC(a/c/t)) в промоторе AtAOX1a, с которыми связываются ТФ семейства NAC и WRKY соответственно [28, 33]. В A. thaliana ANAC017, ANAC013 и другие ANAC являются положительными регуляторами экспрессии AtAOX1a [29, 34], а WRKY – как положительные, так и отрицательные регуляторы экспрессии AtAOX1a [33].
Анализ промотора длиной 1000 п.н. другого гена АО – AtAOX1c, не проявляющего индукцию в ответ на окислительный стресс, выявил 9 CAREs (A–I), в основном находящихся в области 500 п.н. выше ССТ [25]. Семь элементов из них присутствовали и в промоторной области гена АО сои – GmAOX2b, который не является стресс-индуцируемым [27]. Делеции больших фрагментов и CAREs промоторов AtAOX1c и GmAOX2b показали, что элементы функционировали по-разному, проявляя как негативную, так и позитивную регуляцию экспрессии генов в зависимости от тестируемой ткани и сигналов. Например, все элементы промотора AtAOX1c, кроме C (–342 п.н.), проявляли в линии ΔAt2g19080 (c повышенным уровнем транскриптов AOX1c и белка АО) положительную регуляцию экспрессии, тогда как в суспензии клеток и листьях растений A. thaliana экотипа Col-0 некоторые элементы, в частности E (–230 п.н.), функционировали как негативные регуляторы [25]. Полногеномный анализ на основе программы Expression Angler и ACT выявил общие функциональные элементы в промоторе AtAOX1c и генов, экспрессия которых связана с процессами деления и роста клеток. Это дало основание полагать, что экспрессия AtAOX1c регулируется сигналами, связанными с ростом и развитием [25].
Проведенный нами анализ промоторов всех генов AtAOX выявил во всех генах общие CAREs, участвующие в обеспечении чувствительности к стрессам разной природы [35, 36]. G-box (CACGTG) присутствует в промоторе не только АОХ1а, но и АОХ2 [36]. Гены AOX1a, AOX1c и AOX1d обогащены в промоторах такими CAREs, как MYB4-BSM (Binding Site Motif), SORLEP3, SORLIP2 и CCA1-BSM, что указывает на зависимость их экспрессии от изменений функционирования хлЭТЦ (ЭТЦ хлоропластов) на свету. В A. thaliana CCA1-BSM может участвовать в регулируемой фитохромом экспрессии генов LHCB, кодирующих хлорофилл a/b-связывающие белки [37]. Полная последовательность UVBoxANAC13 (CCAAGG), участвующего в обеспечении высокой чувствительности к УФ-В [38], обнаружена в генах AOX1a и AOX1c [35]. При этом промоторы всех генов АОХ1 содержали укороченную версию этого элемента (CCAAG), свойственную генам с более поздним (по сравнению с генами, имеющими полную последовательность UVBoxANAC13) характером УФ-В-индуцируемой экспрессии [38]. Светочувствительные CAREs, так называемые MRECHS-like box и ACECHS-like box, найдены в промоторах всех генов AtАОХ, за исключением AOX1b [35], и в большом количестве содержатся в промоторах УФ-индуцируемых генов, таких как CHS (ген халкон-синтазы) [38]. Наличие общих CAREs указывает на комплементарный характер взаимодействия генов AtАОХ на транскрипционном уровне в определенном диапазоне ответа на стресс. Так, при действии повышенной физиологически допустимой дозы УФ-В и умеренного уровня освещенности (400 мкмоль/(м2 с)) антисмысловые по AOX1a растения A. thaliana проявляли компенсаторную индукцию экспрессии других генов АО [35, 36]. Вместе с тем, активность генов AO, в частности, при действии повышенной освещенности, скорее всего, регулировалась по разным сигнальным путям. На это указывал кластерный анализ, который выделил гены АО в разные кластеры в зависимости от характера их экспрессии [36].
Механизмы посттранскрипционного контроля экспрессии генов АО, связанные с процессингом РНК, изучены слабо. Первые сведения о регуляции генов АО на посттранскрипционном уровне появились в работе по изучению экспрессии SgАОХ в початках Sauromatum guttatum [39]. Было обнаружено многократное усиление экспрессии гена при отсутствии изменения скорости транскрипции в изолированных ядрах. Полагают, что помимо альтернативного полиаденилирования, выявленного в нескольких генах АО [14], в процессинге РНК АОХ велика роль кэпирования, связанного с фосфорилированием 5'-конца транскрипта и присоединением через трифосфатный мостик 7-метилгуанозина (кэп-структуры) [40]. В животных клетках кэпирование частично регулируется мишенью рапамицина (TOR) – протеинкиназы серин-треониновой специфичности. TOR есть у всех эукариот. TOR в составе мультимолекулярных сигнальных комплексов (у животных и дрожжей их два, у растений только один) регулирует клеточный рост и выживание, активируя быстрый синтез белка, что особенно важно при стрессе. В растениях A. thaliana TOR может служить акцептором протеинкиназы KIN10, возможно, через посредника в ядре – циклинзависимой киназы Е1 (CDKE1), индуцирующей экспрессию AOX1a [40].
ПАТТЕРНЫ ЭКСПРЕССИИ И ТРИГГЕРЫ АКТИВАЦИИ АОХ
Экспрессия генов АО стала интенсивно изучаться после клонирования первой кДНК АОХ из Sauromatum guttatum [41]. К настоящему времени получено много информации о характере экспрессии АОХ у различных видов. Показано, что экспрессия АОХ может быть конститутивной в процессе роста и развития, а в условиях стресса – сильно меняться [5, 14, 42]. Ортологичные гены, как правило, проявляют одинаковый характер экспрессии, например, Aox2a и Aox2b сои и вигны китайской [43]. Однако есть и противоположные примеры. Ортологичные гены АОХ1а и АОХ1с пшеницы и риса проявляли разный характер экспрессии в процессе зеленения листа [44, 45].
Индукция экспрессии АОХ выявлена при воздействии абиотических и биотических факторов – температуры [46, 47], засоления [48], засухи [49], гипоксии [50], высокой освещенности [31, 36, 51, 52], УФ-В облучения [35], тяжелых металлов [52, 54], озона [55], дефицита азота [56], патогенов [57] и других видах стресса [52, 58]. Некоторые имеющиеся в литературе сведения об экспрессии АОХ высших растений обобщены в Дополнительных материалах (таблица 1), из которой видно, что гены АО проявляют дифференциальный характер экспрессии, паттерны экспрессии одного и того же гена АО могут зависеть от типа ткани, условий роста, продолжительности действия стресс-фактора.
Гены подсемейства АОХ1, как правило, стресс-индуцируемые. АОХ1а A. thaliana наиболее чувствителен к стрессу, но у других видов растений этот ген может и не проявлять подобную реакцию (Дополнительные материалы, таблица 1). Экспрессия АОХ2 чаще регулируется процессами роста и развития, что не исключает вовлечение AOX2 в ответы на действие стрессоров. В частности, экспрессия всех четырех генов обоих подсемейств AOX у Daucus carota имела дифференциальный орган- и рост-специфичный характер [18]. Ген DcAOX1a проявлял более выраженный конститутивный характер экспрессии в листе и в процессе образования de novo вторичной флоэмы корня эксплантов. Известными триггерами индукции генов АОХ являются дисфункции митохондрий, вызванные как действием ингибиторов ЭТЦ [28, 51], так и мутациями генов, кодирующих митохондриальные белки комплексов ЭТЦ [59, 60]. Полагают, что дефекты ЭТЦ вследствие мутаций генов и ингибиторы ЭТЦ и ЦТК формируют редокс-сигналы, которые передаются в ядро и индуцируют экспрессию АОХ и других, не только “дыхательных”, генов [26, 28, 60]. Экспрессия AOX (на примере AtAOX1a) – широко используемая модель в изучении митохондриального ретроградного сигналинга.
Таким образом, дифференциальный характер экспрессии генов АОХ связан с генотипическим и фенотипическим разнообразием клеток, регуляцией активности генов в зависимости от поступающих сигналов, контролем экспрессии АОХ на разных уровнях реализации наследственной информации. Это обеспечивает пластичность метаболизма растительной клетки, в которую вовлечена энергодиссипирующая функция митохондрий [5, 8, 14, 34].
СИГНАЛЬНЫЕ ПУТИ РЕГУЛЯЦИИ ЭКСПРЕССИИ АОХ
Трансдукция сигнала, вызывающего экспрессию АОХ, может происходить по антероградному и ретроградному путям [11, 13, 30]. Антероградная регуляция экспрессии генов представляет собой нисходящий (top-down) путь от ядра к органелле. Ретроградная регуляция направлена по восходящему (bottom-up) пути от органелл к ядру [12, 61]. Принято считать, что антероградный сигналинг протекает на нескольких уровнях – от транскрипционных до посттрансляционных; сигналы, как правило, связаны с процессами роста и развития растений, и действием внешних факторов. Ретроградная регуляция экспрессии генов происходит в ответ на изменение условий внутренней среды и позволяет органеллам влиять на экспрессию ядерных генов [12, 30, 61].
Митохондриальная ретроградная регуляция экспрессии АОХ. Наиболее полно описана митохондриальная ретроградная регуляция (МРР-путь) экспрессии АОХ, подтверждением существования которого являются не только данные об индукции экспрессии АОХ ингибиторами ЭТЦ, ЦТК и вследствие дефектов комплексов ЭТЦ, но и наличие в промоторе АОХ (на примере AtAOX1a) МРР-участка, необходимого для индукции экспрессии гена [28, 34]. Ингибиторы – антимицин и монофторацетат – имитируют соответственно АФК-зависимый и АФК-независимый сигнальные пути индукции экспрессии генов АО [11, 13, 28].
Дисфункции в ЭТЦ, связанные с нарушением потока электронов, приводят к образованию избыточного количества АФК – супероксид-радикала (${\text{O}}_{2}^{{\centerdot - }}$) и перекиси водорода (Н2О2). Местом генерации ${\text{O}}_{2}^{{\centerdot - }}$ являются комплекс I, II и III, а донором электронов для кислорода – убисемихиноновый интермедиат [13]. Образуемый в ЭТЦ ${\text{O}}_{2}^{{\centerdot - }}$ нестабилен (время жизни – 10–12 с) и быстро нейтрализуется в Н2О2 при участии Mn-зависимой супероксиддисмутазы (MnSOD), а также спонтанно. Показано, что сверхэкспрессия MnSOD снижала экспрессию АОХ1а и АОХ1b при воздействии холодового стресса в растениях риса [62], а нокаутная по MnSOD линия Arabidopsis thaliana проявляла усиление экспрессии AOX1а в ответ на обработку AlCl3 по сравнению с линией дикого типа [63]. Эти данные свидетельствуют о том, что содержание АФК в митохондриях, тесно связанное с активностью MnSOD, может быть первичным сигналом, индуцирующим МРР-зависимую индукцию экспрессии АОХ. Н2О2 является вторичным мессенджером АФК-зависимой МРР-экспрессии АОХ [13].
Ранее считалось, что H2O2 индуцирует экспрессию AOX путем прямого окисления или модулирования процессов фосфорилирования ТФ, контролируя инициацию транскрипции [64]. Однако стало известно, что антимицин – ингибитор комплекса III – вызывал более быструю индукцию экспрессии АОХ1 в клетках табака, чем экзогенная перекись, накапливающаяся во внутриклеточном пространстве [65]. Это дало основание полагать, что АФК митохондриального происхождения более эффективны в индукции экспрессии АОХ1, чем АФК цитоплазмы или хлоропластов. В этой работе было также показано, что бонгкрековая кислота, ингибитор митохондриальной поры проницаемости (PTP), участвующей в запуске апоптоза у животных, блокировала антимицин-, H2${\text{O}}_{2}^{ - }$ и СК-зависимую индукцию АОХ1. Поэтому возникла альтернативная гипотеза, объясняющая АФК-зависимую индукцию экспрессии АОХ, которая построена на аналогии запуска процесса программируемой гибели клетки (ПГК) у животных [65, 66]. АФК, в частности перекись, накапливающаяся при стрессе во внутриклеточном пространстве и способная легко проникать через клеточные мембраны, может вызывать дисфункции митохондрий и открытие митохондриальных пор (PTP), что сопровождается диссипацией мембранного потенциала и является решающим этапом сигналинга индукции АОХ [65, 66]. Полагают, что временное открытие PTP – важный механизм клеточного редокс-сигналинга и способ коммуникации митохондрий с ядром [65].
NAC-содержащие ТФ (ANAC017, ANAC013) являются прямыми активаторами транскрипции АОХ1а [29, 34] (рис. 1). ANAC017 – конститутивно экспрессируемый ТФ, связанный с эндоплазматическим ретикулумом (ЭР) через С-концевой трансмембранный домен. В ответ на антимицин или при митохондриальных дисфункциях происходит протеолитическое отщепление C-концевого домена ромбовидной протеазой, а N-концевой домен высвобождается из ЭР и мигрирует в ядро, связываясь с промотором AOX1а. В ANAC017 обнаружен сайт расщепления ромбовидной протеазой между двумя доменами, а ингибиторы ромбовидной протеазы снижают индуцируемую антимицином экспрессию AOX1а [34]. Предполагается, что ромбовидная протеаза активируется H2O2 митохондриального происхождения, так как мутанты ANAC017, как правило, не проявляют экспрессию АОХ1а при обработке экзогенной H2O2. ANAC017 непосредственно связывается с сайтом (T/G)CGTGT промотора AtAOX1a и может активировать другие ТФ семейства NAC, например, ANAC013, являющимися положительными регуляторами экспрессии АОХ1а. Однако другие ТФ NAC не могут компенсировать отсутствие ANAC017 [29].
Рис. 1.
Схема сигнальных путей регуляции экспрессии генов AОХ. Внешние и внутренние (митохондриальные и пластидные) сигналы поступают в ядро для активации АОХ (на основе схем, представленных в работах [1, 5, 12]). Путь митохондриальной ретроградной регуляции экспрессии АОХ (МРР-путь) (на примере AOX1a Arabidopsis thaliana, AtAOX1a) включает поступление сигнала из митохондрий (АФК, цитрат, редокс-сигнал) с последующим высвобождением транскрипционного фактора (ТФ) семейства NAC (NAC17) из эндоплазматического ретикулума (ЭР), который (как и другие ТФ NAC) является положительным регулятором экспрессии AtAOX1a. ABI4 – репрессор AtAOX1a. ТФ WRKY могут быть как положительными (WRKY63), так и отрицательными (WRKY15/40) регуляторами экспрессии АОХ1а. Другой путь трансдукции сигнала включает активацию протеинкиназы (KIN10), которая взаимодействует с медиаторным в ядре комплексом CDKE1, индуцирующим АОХ1а. Ауксин и ТФ MYB29 – негативные регуляторы экспрессии АОХ1а.
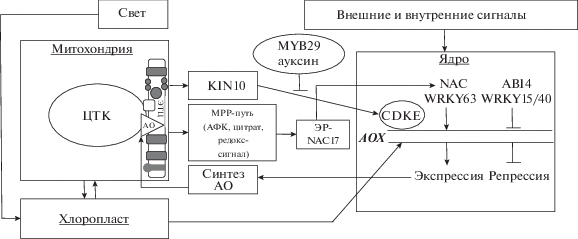
Промотор AtАОХ1a находится под контролем разных ТФ, напрямую взаимодействующих с регуляторными элементами и влияющих на экспрессию AtAOX1a [5]. Выявлено, что WRKY связываются в трех сайтах W-box (–291, –373 и –412 п.н.) промотора AtAOX1a. WRKY15 и WRKY40 являются репрессорами ретроградной экспрессии АОХ1а и двух других ядерно-кодируемых генов митохондриальных белков A.thaliana – NDB2 (гена “внешней” НАДФ·Н-дегидрогеназы) и UPOX (UP-regulated by OXidative stress), чувствительных к окислительному стрессу [33]. Но если ABI4 – репрессор АОХ1а в нормальных условиях, то WRKY15 и WRKY40 ограничивают экспрессию АОХ1а в условиях дисфункции ЭТЦ, в частности, при обработке антимицином. Предположительно, WRKY63 функционирует как активатор экспрессии АОХ1а. Установлено, что WRKY63 участвует в реакции на высокую освещенность [33]. Авторы полагают, что WRKY40 и WRKY63 конкурируют за сайты связывания с промотором гена. Показано, что ауксин и ТФ MYB29 – это негативные регуляторы экспрессии AtАОХ1а, функционирующие через гормональные сигнальные пути и взаимодействующие с ТФ ERFs (Ethylene Response Factors) и WRKY [30, 67].
Трансдукция сигнала из митохондрий также может идти по пути активации протеинкиназы KIN10, которая взаимодействует с CDKЕ1, являющейся в ядре частью медиаторного комплекса, индуцирующего АОХ1а [40]. В исследованиях на rao1 мутантах выявлено, что CDKE1 участвует в восприятии любых клеточных сигналов, в том числе, антероградного происхождения (например, вызываемых накоплением H2O2, холодовым воздействием) с последующей индукцией АОХ1а.
Разделение АФК-зависимого и АФК-независимого путей МРР-сигналинга АОХ условно, поскольку АФК является потенциальной молекулой в трансдукции сигнала, получаемого из митохондрий вследствие ингибирования как антимицином, так и МФА [28]. Генерация АФК обнаружена в клетках суспензии табака при воздействии на них 5 мМ МФА [68]. Однако это не исключает возможность передачи сигнала к промоторной области [13, 28]. На это указывает тот факт, что разные концентрации МФА, регулирующие экспрессию АОХ, могут по-разному влиять на образование АФК, вплоть до отсутствия эффекта [28]. Показано также, что ТФ WRKY участвует как в антимицин-, так и в МФА-зависимой индукции AtAOX1a по МРР-пути, однако мутанты в области W-бокса сильнее реагировали экспрессией АОХ1а на антимицин, чем на МФА.
Помимо Н2О2, другими сигнальными молекулами, участвующими в регуляции экспрессии АОХ, являются NO, салициловая кислота (СК), жасмоновая кислота, этилен, ионы Ca2+ [12, 13]. Хорошо известен эффект накопления Н2О2, NO и СК, а также увеличение экспрессии АОХ1а и содержания белка АО в процессе развития реакции сверхчувствительности (СВЧ) растений в ответ на атаку патогена [57]. Развитие СВЧ – хорошая модель изучения сигнальных путей, однако до сих пор все этапы этих путей не расшифрованы. Показано, что генерация супероксидного взрыва (“${\text{O}}_{2}^{{\centerdot - }}$ burst”) в ответ на инокуляцию Nicotiana tabacum бактериями-патогенами зависела от наличия АОХ1а в геноме растения [57]. Именно генерация ${\text{O}}_{2}^{{\centerdot - }}$ в митохондриях инициировала реакцию СВЧ, хотя другие АФК также участвовали в ее развитии. Отсутствие АОХ1а приводило к задержке ${\text{O}}_{2}^{{\centerdot - }}$ взрыва, колоколизации NO, ONOO– (пероксинитрита – продукта взаимодействия ${\text{O}}_{2}^{{\centerdot - }}$ и NO) и развития реакции СВЧ в ответ на внедрение патогена так же, как и влияние антимицина, ингибирующего комплекс III. Однако позже (по сравнению с диким типом) происходил резкий супероксидный взрыв. ONOO– участвует в нитровании тирозиновых остатков белков, что влияет на их модификацию, чувствительность к протеазам и развитие ПГК. Сверхэкспрессия АОХ1а, напротив, предотвращала развитие супероксидного взрыва, вызываемого действием антимицина. Сделано предположение, что электронный транспорт, очевидно на уровне комплекса III, является мишенью реакции, вызывающей сигнал для развития СВЧ, а АОХ – ключевая детерминанта митохондриальной динамики АФК в ответ на атаку патогена [57, 66]. Причиной супероксидного взрыва на ранних этапах развития СВЧ является скоординированное совместное подавление экспрессии генов и активности АО и MnSOD.
Усиление экспрессии АОХ1а как защитная ответная реакция на биотический стресс, скорее всего, связано с влиянием СК. В низких концентрациях (менее 1 мМ) СК как аналог хинона взаимодействует с комплексом I и II, нарушая транспорт электронов в ЭТЦ, что инициирует сигнальные пути, приводящие к экспрессии генов АО [66]. Вместе с тем, СК индуцирует экспрессию АОХ не напрямую через ТФ, связывающиеся с промотором гена (СК-чувствительный элемент as1 отсутствует в промоторе AtАОХ1а), а скорее всего посттранскрипционно [26]. Полагают, что EDS1 (Enhanced Desease Susceptibility 1) и PAD4 (PhytoAlexin Defficiency 4) – липазоподобные белки, контролирующие СВЧ-ответ, накопление СК и СК-зависимый сигналинг, но функционирующие в upstream-части СК-сигналинга, регулируют экспрессию АОХ1а (показано на примере AtAOX1a). Возможно, что EDS1/PAD4-сигнальный путь является уникальным в индукции экспрессии АОХ1а; это объясняет, в частности, причину отсутствия в некоторых случаях коэкспрессии АОХ1а с NDB2 при действии Н2О2 или ротенона – триггеров запуска МРР-пути [26].
Белки EDS1 и PAD4 как посредники участвуют в трансдукции сигнала ПГК, обусловленного активацией Тоll-подобных рецепторов иммунного ответа [69]. Известно, что АО участвует в процессе ПГК. В митохондриальном пути передачи сигнала, по которому реализуется большинство форм апоптоза, формированию PTP и выходу цитохрома с и эндонуклеаз в межмембранное пространство митохондрий, а затем в цитоплазму, предшествует резкое увеличение АФК. У животных выход цитихрома с – ключевое событие, индуцирующее запуск каскада реакций активации каспаз и реализацию ПГК. Регуляция митохондриального пути ПГК включает механизмы, контролирующие уровень АФК. Показано, что перенос электронов по АП препятствует накоплению АФК и поддерживает митохондриальное дыхание, когда ЦП ограничен ингибиторами или индуцирующими ПГК соединениями [69]. Таким образом, АО регулирует клеточный уровень АФК, который, в свою очередь, определяет восприимчивость к развитию апоптоза, поэтому AO назван “белком выживания” [69].
Роль ионов Ca2+ в МРР-зависимой индукции АОХ1а менее ясна. Накопление Ca2+ в клетке является признаком развивающегося стресса. В животной клетке митохондрии являются “хранилищем” ионов Ca2+ и обмениваются ими с ЭР, создавая кальциевые микродомены. В растительной клетке обмен кальция между компартментами осуществляется, скорее всего, консервативными белками-транспортерами, в частности, Ca2+/H+-антипортерами семейства LETM (Leucine zipper, EF hand-containing Transmembrane Protein), имеющими митохондриальную локализацию [11]. Показано, что при солевом стрессе обмен Ca2+ между митохондриями и ЭР в растениях A. thaliana был связан с индукцией АОХ1а. При этом Н2О2-стимулируемый синтез ТФ WRKY15 указывал на участие МРР в реакции на этот стресс, и важную роль в этом играет индукция АОХ1а [70]. Известно, что ЭР посылает сигналы в ядро в процессе индукции реакции на мисфолдинг белков (UPR, Unfolded Protein Response), представляющего эволюционно консервативный транскрипционный ответ для сохранения гомеостаза ЭР при накоплении неправильно сложенных белков. UPR может участвовать в Са2+-опосредованной индукции AOX1a, регулируя активность кальциевой помпы ЭР, что свидетельствует о тесной связи между ЭР, ядром и МРР [70].
Антероградная регуляция экспрессии генов АОХ. Трансдукцию сигнала, вызывающего экспрессию АОХ, по антероградному пути могут запускать АФК или другие сигнальные молекулы внутриклеточного происхождения, а также внешние сигналы разной природы [11–13]. Считается, что экспрессия ядерно-кодируемых генов митохондриальных белков в значительной степени представляет собой антероградный контроль функции митохондрий [12]. Усиление экспрессии генов митохондриальных белков обнаружено при прорастании семян и при прохождении других важных фаз развития растения. Это указывает на скоординированный характер экспрессии генов с процессами роста и развития, а также на их вовлеченность в гормональный сигналинг целостного растения [12].
Экспрессия генов АО A. thaliana обнаружена, главным образом, в органах с потенциально высокой скоростью метаболизма [42]. Усиленная экспрессия AtAОХ2 выявлена в семенах, AtAОХ1b – в молодых соцветиях; экспрессия AtAOX1d функционально приурочена к процессу старения. Экспрессия всех генов AtАОХ зависела также от фазы роста и развития [42]. Промотор гена AtАОХ1с содержит близко к ССТ элементы сайта II [25], взаимодействующие с ТФ семейства TCP (Teosinte branched 1 Cycloidea Proliferating cell factor) класса II – негативных факторов клеточного деления [67]. TCP класса I считаются позитивными регуляторами роста и пролиферации клеток. Однако специфичность последовательности сайта связывания TCP обоих классов не является абсолютно консервативной, что оставляет возможность конкуренции за сайты связывания между TCP класса I и II. TCP участвуют в трансдукции сигналов гормонального происхождения и являются редокс-чувствительными регуляторами ядерно-кодируемых митохондриальных белков компонентов ЭТЦ, играя важную роль в митохондриальном биогенезе [67].
Экспрессия АОХ не только находится под гормональным контролем регуляции, но и сигнальные пути активации АОХ вовлечены и пересекаются с сигналингом гормонов. Мутанты A. thaliana с нарушением полярного транспорта ауксина (rao3/big, rao4/pin-formed1, rao5/multidrug-resistance1/abcb19) проявляли усиление экспрессии АОХ1а [67]. Индукция экспрессии репортерного гена люциферазы светлячка, контролируемого промотором AOX1a, подавлялась аналогами ауксина и усиливалась блокированием транспорта гормона. Кроме того, антимицин ингибировал передачу сигналов ауксина и индуцировал экспрессию АОХ1а, а обработка ауксином частично снимала этот эффект. Это свидетельствует об антагонистической взаимосвязи между МРР-сигналингом и кинетикой клеточного ответа на ауксин. Показано, что ответ клетки на ауксин может положительно регулироваться митохондриальной функцией через TCP. Сделано предположение, что передача сигнала митохондриального стресса и трансдукция сигналов ауксина регулируются реципрокно, уравновешивая ростовую и стрессовую реакцию организма [67].
Свет является источником энергии для всех растений. Восприятие светового сигнала клеткой осуществляется через фоторецепторы (фитохромы, фототропины, криптохромы и др.) [71]. Сигнальные антероградные каскады, приводящие к изменениям экспрессии регулируемых светом генов, начинаются с активирования фоторецептора и его миграции в ядро (у фитохромов). В ядре активированный фоторецептор взаимодействует с Е3-убиквитин-лигазным комплексом СОР1/SPA1, высвобождающим ТФ HY5, который инициирует транскрипцию целевых генов. Фитохромы непосредственно могут взаимодействовать с фитохром-инактивирующими факторами, например, PIF3, содержащими домен связывания ДНК, свойственный факторам транскрипции. В трансдукции воспринимаемого фоторецепторами светового сигнала могут участвовать вторичные мессенджеры – Ca2+, cAMP, cGMP, G-белки и другие компоненты. Считается, что фитохром А играет ключевую роль в процессе деэтиоляции и фотоморфогенеза, особенно в условиях слабой освещенности, а фитохром B – в реакции растений на повышенную освещенность, хотя оба фитохрома важны в процессе фотоморфогенеза [71].
Проблема световой регуляции экспрессии АОХ в настоящее время интенсивно исследуется, в том числе и в наших работах [7, 32, 36, 44, 72]. Считается, что АО участвует в окислении избытка НАДФ·Н хлоропластного происхождения, способствуя тем самым “разгрузке” хлЭТЦ [73, 74]. Показано, что в световой регуляции экспрессии АОХ1а A. thaliana могут участвовать фитохромы А, B, криптохромы 1, 2 и фототропины 1, 2 [31, 75]. Полагают, что сигнал от фоторецепторов до этапа транскрипции АОХ передается по известным механизмам фототрансдукции фоторегулируемых, в первую очередь, фотосинтетических генов [76]. Светозависимый характер индукции АОХ1а выявлен в листьях A. thaliana [36, 51, 75], Triticum aestivum [32], AOX2a – семядолях Glycine max [77], АОХ1с – листьях Oryza sativa [44].
Анализ промотора AtAOX1a длиной 1000 п.н. выше ССТ выявил 27 светозависимых CARE, из них 9 были строго индуцируемыми светом [31]. В промоторе гена АОХ1а A. thaliana также найден часто встречающийся мотив G-box (CACGTG) [78] и CARE I1 (ACGTG, –93 п.н. от ССТ), перекрывающийся с G-box [26]. Известно, что G-box – это палиндромный консервативный CARE промоторов большинства фоторегулируемых генов, является сайтом связывания транскрипционных факторов GBFs (G-box-Binding Factors) семейства bZIP [79]. Фотоиндуцируемый транспорт GBFs (в частности, GBF-1) из цитоплазмы в ядро является важным этапом трансдукции сигнала между фоторецепцией и светозависимой экспрессией генов. G-box также найден в промоторе АОХ1а Triticum urartu (GenBank: KD149474.1, –221 и –340 п.н. от ССТ), диплоидного прародителя гексоаллоплоида Triticum aestivum [32]. Анализ имеющихся данных дает основание предполагать наличие механизма, посредством которого АОХ1а (по крайней мере, в A. thaliana и Triticum aestivum) связан с фотосинтетической функцией. Таким образом, изучение промотора AtAOX1a позволило выявить светоиндуцируемые CARE, управляемые пока неизвестными ТФ, а также элемент I1, возможно отвечающий за связь АОХ с фотосинтезом. Роль разных CAREs в промоторе АОХ1а и распознающих их ТФ в фотозависимой регуляции экспрессии AOX1a остается предметом исследований.
На основе усредненных величин экспрессии генов в процессе зеленения относительно величин экспрессии генов в этиолированном листе пшеницы, нами предложена схема индукции АОХ и генов других дыхательных компонентов энергодиссипирующих систем ЭТЦ в процессе зеленения листа пшеницы [7]. “Внешние” и “внутренние” альтернативные (НАД(Ф)·Н-дегидрогеназы участвуют в транспорте электронов к убихинону в обход комплекса I. К системам, рассеивающим протонный градиент, образуемый в ходе реакций в ЭТЦ, относятся разобщающие белки (UCP), подобные UCP животных. Свет по фитохром-опосредованному пути индуцирует экспрессию АОХ1а, затем вовлечение АО в дыхание. В период быстрого развития тилакоидной системы это способствовало синтезам de novo и предотвращению окислительного стресса [32]. После 6 ч зеленения снижение АП изменяло редокс-состояние ЭТЦ и формировало редокс-сигнал, передающийся от митохондрий к ядру по ретроградному пути, что инициировало экспрессию генов других дыхательных нефосфорилирующих путей и антиоксидантных ферментов, участвующих в поддержании редокс-баланса клетки. После 24 ч сигналы из зрелых хлоропластов [80] поступали в ядро, регулируя экспрессию соответствующих генов [32]. Возможно, это были биогенные сигналы, главным участником которых является GUN1 (Genome UNcopled1) – локализованный в хлоропластах белок, участвующий в гомеостазе пластидных белков. Предполагается, что GUN1 генерирует и передает неизвестный сигнал, активирующий ТФ ABI4, который далее блокирует экспрессию ядерных фотосинтетических генов [81, 82]. Считается, что GUN1 интегрирует многочисленные пластидные сигналы, связанные с состоянием тетрапирролов, хлЭТЦ и, в целом, редокс-состоянием пластид. Участие GUN1/ABI4-сигнального пути в регуляции экспрессии АОХ1а и других “дыхательных” генов в процессе становления фотосинтетического аппарата – абсолютно не изученный вопрос.
При этом не исключена и роль МРР-зависимого пути индукции AOX1a в процессе зеленения, в частности, через изменение содержания органических кислот ЦТК [7]. Нами обнаружено усиление дыхания митохондрий и потенциальной активности АП в присутствии малата в первые 6 ч деэтиоляции, что могло свидетельствовать не только об интенсификации функционирования комплекса I ЭТЦ в этот период, но и увеличении активности малатдегидрогеназы ЦТК [7]. Известно, что ЦТК на свету продолжает функционировать с некоторыми модификациями [83]. Показано, что изменения в содержании органических кислот ЦТК (цитрата, малата, 2-оксоглуатарата) влияют на экспрессию генов АО [68]. В частности, в сигналинге AtAOX1a при ингибировании ЦТК может быть (как и в АФК-зависимом пути) задействован МРР-участок промотора гена. Сообщалось о роли WRKY в ответе AtAOXla на МФА, который ингибирует аконитазу ЦТК и приводит к накоплению цитрата [28]. Отметим также, что участие АФК-зависимого МРР-пути сигналинга АОХ1а при зеленении листа пшеницы менее очевидно. Известно, что этиолированные клетки защищены от чрезмерного образования АФК функционированием светозависимой НАДФ·Н-протохлорофиллидоксидоредуктазы (LPOR); образуемые тройные комплексы хлорофиллид-LPOR-НАДФ·Н являются мощными гасителями энергии [84]. В нашем исследовании образование АФК в листьях пшеницы даже снижалось на ранних стадиях биогенеза хлоропластов [32].
Полученные нами данные позволили заключить, что альтернативный путь дыхания через АО действует как модулятор митохондриальной функции во время деэтиоляции и предположить роль АО в координации вовлечения других дыхательных нефосфорилирующих путей (НФП) для усиления стресс-ответа и стресс-сигнала. Идея о роли АО в координации вовлечения других дыхательных путей и клеточных защитных систем высказана и другими авторами [1, 60]. Исследования с АОХ1а-мутантами A. thaliana показывают, что дефицит (экспрессии гена или количества белка) АО, в отличие от компонентов других НФП, вызывал модификацию профилей экспрессии многих генов и целого транскриптома [1, 11, 36, 85]. Существуют также данные, которые подтверждают АОХ1а-зависимую экспрессию генов других НФП [51, 56], но показывают отсутствие зависимости АОХ1а от этих генов [86]. Растения A. thaliana с одновременной сверхэкспрессией АОХ1а и NDB2 легко переносили воздействие засухи и высокой освещенности, как и растения со сверхэкспрессией только одного гена – АОХ1а, в отличие от растений со сверхэкспрессией NDB2 [87]. Промоторы большинства генов НФП A. thaliana имеют общие с АОХ1а стресс-чувствительные CAREs [26, 35, 36]. Однако наличие и количество общих мотивов в промоторах не всегда коррелировало с экспрессией генов, что указывает лишь на потенциальную способность генов взаимодействовать на транскрипционном уровне [35, 36, 51].
Хлоропласт-зависимые сигнальные пути экспрессии АОХ. Хлоропласты и митохондрии тесно связаны не только метаболическими реакциями, но и взаимодействиями на уровне ретроградных и антероградных сигналов [1, 13, 30]. Эта взаимосвязь позволяет избежать окислительного стресса в хлоропластах и, в целом, в фотосинтезирующей клетке. Считается, что АО совместно с другими компонентами ЭТЦ участвует в окислении избытка восстановителей, транспортируемых посредством разных челночных механизмов из хлоропластов в митохондрии [73, 74]. АФК, редокс-статус компонентов ЭТЦ (главным образом, пластохинонов (PQ)), редокс-активные молекулы стромы пластид (тиоредоксин, глутатион), а также интермедиаты биосинтеза тетрапирролов выполняют роль сигнальных молекул пластидных ретроградных путей, контролирующих экспрессию целевых ядерных генов, в том числе компонентов митохондриального дыхания [81, 82, 88].
Экспрессия АОХ тесно связана со статусом хлоропластов. В зеленеющих при повышенном освещении (500 мкмоль/(м 2 с)) листьях A. thaliana с нокаутом AOX1a (aox1a) и растений дикого экотипа, обработанных салицилгидроксамовой кислотой, ингибитором АОХ, уменьшение соотношения НАДФ+/НАДФ·Н сопровождалось снижением эффективности импорта пластидного белка [89]. Сверхэкспрессия AOX1a, напротив, индуцировала накопление хлорофилла и усиливала импорт пластидного белка. Пул убихинона (UQ) и PQ в aox1a мутантах уже при умеренном освещении (350 мкмоль/(м2 с)) имел более восстановленный статус [90], а величина максимального квантового выхода фотосистемы II (Fv/Fm) – более низкие значения, чем у растений дикого типа [91]. На мутантах Nicotiana tabacum L. с разным уровнем экспрессии АОХ1а показано, что акклиматизация растений в условиях повышенного освещения и засухи была направлена на избежание перевосстановления пула PQ путем снижения количества белка светособирающего комплекса II LHCB2 и увеличения количества АО [92]. Авторы предположили, что исходящий из хлЭТЦ сигнал регулировал количество обоих белков, способствуя поддержанию энергетического баланса хлоропластов при стрессе. Полученные данные подтверждают, что редокс-сигнал, ведущий к быстрой индукции экспрессии АОХ, направлен непосредственно из хлоропластов, а редокс-сенсором является уровень восстановленности пула PQ [1, 88].
Современные данные позволяют полагать, что митохондриальные ретроградные сигнальные пути связаны с сетью трансдукции клеточных сигналов и способны интегрировать информацию из нескольких источников, включая хлоропласт, а АО является активным участником в поддержании клеточного сигналинга и взаимосвязи хлоропластов и митохондрий. Ключевые ТФ регуляции экспрессии AtАОХ1а (ABI4, ANAC013, ANAC017, WRKY40, WRKY63) являются компонентами пластидного ретроградного сигналинга [12, 34, 82]. Сверхэкспрессия ANAC017 увеличивала экспрессию АОХ, но снижала экспрессию генов, кодирующих белки хлоропластов, включая LHCB [34]. В темноте митохондриальные дисфункции в листьях Nicotiana tabacum L., вызванные действием разных ингибиторов, усиливали экспрессию MDS-генов, включая гены АОХ1 [93]. Однако на свету экспрессия генов АОХ1 при действии антимицина снижалась, в отличие от миксотиазола, в присутствии которого экспрессия генов оставалась повышенной. Антимицин, как и миксотиазол, является ингибитором комплекса III ЭТЦ, но одновременно и ингибитором ферредоксин-хинон-редуктазы, участвующей в переносе электронов от акцепторного участка ФС I к PQ при циклическом транспорте электронов (ЦТЭ) в ФС I хлЭТЦ. Полагают, что ограничение с акцепторной стороны ЦТЭ в ФС I является источником ретроградных сигналов из хлоропластов. При этом миксотиазол увеличивал NPQ, а антимицин – снижал величину этого коэффициента [93]. Таким образом, снижение экспрессии АОХ1 при действии антимицина на свету было результатом взаимодействия сигналов, исходящих из обеих органелл. При этом в растениях со сверхэкспрессией АОХ1а ингибирование ЦТЭ при действии антимицина не влияло на экспрессию других MDS-генов на свету. Другими словами, редокс-состояние хлоропласта действительно влияет на экспрессию АОХ и других MDS-генов, но митохондриальная дисфункция, сопровождающаяся нарушением потока электронов к кислороду, является первичным условием индукции экспрессии генов. В целом, интеграция сигналов является одним из средств координации метаболических взаимодействий между органеллами, определяющими энергетический статус клетки. Ключевым сигналом этой интеграции, скорее всего, являются АФК, генерируемые обеими органеллами [1, 13].
Предполагается, что в фотосинтезирующей клетке, особенно в условиях высокой освещенности, перевосстановление пула UQ может быть также результатом увеличения фотодыхательного НАД·Н, и может привести к усилению образования АФК и, соответственно, открытия PTP с последующей индукцией АОХ [66, 88]. Фотосинтетическая активность вызывает изменение содержания основных углеродных метаболитов (сахаров, аминокислот, интермедиатов ЦТК), восстановительного потенциала пиридиннуклеотидов и тиоловых групп белков. Все это, предположительно, может влиять на экспрессию генов и активность митохондриальных белков, в том числе на АО [88]. Показано, что суточные изменения уровня сахаров (снижение – к концу ночи, увеличение – к середине дня), сопровождающиеся изменениями уровня различных гормонов (ауксина и цитокинина – к концу ночи, АБК – к середине дня), контролируют экспрессию многих генов, включая переносчиков ЭТЦ [76]. Это предполагает гормон-зависимую природу трансдукции сигналов, регулирующих экспрессию генов в течение суток. Возможно, этот механизм функционирует и в световой регуляции экспрессии АОХ, учитывая, что промотор гена AtAOX1a содержит мотивы ABRE [26]. Выявлено, что активность цитохромного и альтернативного пути in vivo в двойных cytc (cytc 1b2a и cyt c1b2b) мутантах A. thaliana зависела от условий фотопериода, определяющего функционирование и состав интермедиатов ЦТК, аминокислот и других метаболитов [94]. Изменения в метаболоме “сигнализировали” о стрессе, участвуя в запуске реакций по пути изменения первичного метаболизма для адаптации к разному фотопериоду. В частности, в условиях длинного дня cytc имели повышенную концентрацию гамма-аминомасляной кислоты (ГАМК) и активность АО. ГАМК может действовать в качестве внутреннего стресс-сигнала в растениях, изменяя активность ионных транспортеров. Помимо медиаторного эффекта, ГАМК непосредственно участвует в метаболизме, превращаясь в янтарную кислоту (сукцинат) с последующим включением в ЦТК. Так называемый ГАМК-шунт обеспечивает альтернативную поставку углерода в ЦТК в виде сукцината в обход сукцинил-КоА-синтетазы и снижает возможность циклической работы ЦТК, а вовлечение АО позволяет поддерживать редокс-статус ЭТЦ при дисфункции основного цитохромного пути. Полагают, что цитохром с как ключевой компонент ЦП играет важную роль в процессах роста и развития растений. Мутанты cytc имели низкий уровень гиббереллинов и характеризовались повышенным содержанием белков DELLA – репрессоров гибберелинового сигналинга. Поэтому метаболическая связь ГАМК-шунта и активации АО, скорее всего, также интегрирована в сеть гормонального сигналинга [94].
БЕЛОК АО И ПОСТТРАНСЛЯЦИОННАЯ РЕГУЛЯЦИЯ ЕГО АКТИВНОСТИ
Проявлением экспрессии гена является транскрипция информации с ДНК на мРНК с последующей трансляцией в последовательность белковой молекулы. Альтернативная оксидаза (EC. 1.10.3.11) – убихинол: кислород-оксидоредуктаза – белок-гомодимер (масса одного полипептида около 32 кДа). Белок закреплен в одном слое внутренней митохондриальной мембраны с матриксной стороны большой гидрофобной частью, образованной спиралями [95]. АО содержит связанный гидроксо-мостиками двухъядерный центр из двух атомов железа смешанной валентности (Fe(II)/Fe(III)). Каждый из железных центров находится в пределах четырех-спиральной связки мономера, консервативен для всех изоформ АО и является активным сайтом восстановления кислорода до воды. Домены N-концов мономеров АО взаимодействуют ковалентной дисульфидной связью путем образования мостика между остатками цистеина, что и является основным в формировании структуры димера [95].
АО синтезируется на циторибосомах в виде белка-предшественника с соответствующей на N-конце сигнальной последовательностью (пресиквенсом) [96]. Импорт белка-предшественника АО в митохондрии происходит через специфические белковые поры-транслокаторы при участии шаперонов. После вхождения белка-предшественника в митохондрию пресиквенс удаляется ассоциированной с комплексом III митохондриальной пептидазой процессинга [96].
Восстановление дисульфидной связи в сульфгидрильную приводит к активации АО. Активность АО in vitro (в изолированных митохондриях) зависит от редокс состояния фермента, наличия субстрата (уровня восстановленности UQ), ключевых метаболитов (α-кетокислот), а также определяется количеством синтезированного белка. Механизмы активации АО in vitro изучены достаточно полно [3–5]. Система тиоредоксина (Trx) ответственна за восстановление белка АО, в свою очередь, она зависит от окислительно-восстановительного состояния пула НАД(Ф)·Н. Белок Trx, имеющий дисульфидную связь, использует для своего восстановления электроны и протоны от НАД(Ф)·Н, восстанавливая АО. При этом редокс-состояние пула НАД(Ф)·Н зависит от функционирования НАДФ+-зависимой изоцитратдегидрогеназы [5].
Активность восстановленной формы АО остается низкой и повышается в условиях высокой восстановленности UQ и/или в присутствии органических кислот. Основными метаболитами, активирующими восстановленный димер АО, являются α-кетокислоты – пируват и глиоксилат. Полагают, что взаимодействие остатков цистеина с α-кетокислотой приводит к образованию тиополуацеталя – полностью активированной формы АО [5].
В зависимости от кодирующих АО генов, существуют и разные изоформы АО. Большинство изоформ имеют два остатка цистеина, но есть исключения. Изоформы АОХ1А и АОХ1В A. thaliana и изоформы АО некоторых видов, например, томата и лотоса, имеют третий остаток цистеина около каталитического центра, содержащего атом железа [5]. Анализ посттрансляционной активации АО выявил специфичность изоформ белка по отношению к метаболитам-активаторам АО. АОХ1А более чувствительна к α-кетокислотам, чем АОХ1С и АОХ1D [97]. Кислоты ЦТК также активируют АО в изоформ-специфической манере. АОХ1А стимулируется ОА или 2-оксоглутаратом (2-OГ), АОХ1D – только 2-ОГ, а АОХ1С нечувствительна к интермедиатам ЦТК. При этом не все изоформы АО в позиции первого остатка цистеина содержат эту аминокислоту. Изоформы АОХ1В томата, лотоса, риса и АОХ3 NCS-мутантов кукурузы в этой позиции содержат серин и нечувствительны к α-кетокислотам, но активируются сукцинатом через образование эфирной связи [59, 97]. Изоформы АОХ2 менее изучены в отношении их активации метаболитами, однако имеющиеся в литературе данные показывают, что основным активатором АОХ2 является пируват [5].
Уровень экспрессии генов АО не всегда соответствует количеству белка АО, а последнее – способности или активности фермента in vivo (Дополнительные материалы, таблица 1, [6]). Более того, активность АО in vivo часто ниже, чем его способность (или максимальная активность), что связано с ограничением доступности субстрата, аллостерических активаторов (α-кетокислот), другими механизмами посттрансляционной активации фермента [6]. Активность АП in vivo (valt) может быть исследована методом изотопной (18О/16О) дискриминации [6]. Способность или максимальная активность АО (Valt) определяется методом специфических ингибиторов, который широко используется в настоящее время [3, 6]. Ингибиторами АО являются гидроксамовые кислоты и n‑пропилгаллат. Величину Valt получают по степени чувствительности дыхания к ингибитору АО и ингибитору цитохромоксидазы – цианида (CN–) за вычетом остаточного дыхания (в присутствии обоих ингибиторов). Оптимальные концентрации ингибиторов получают путем титрования образца возрастающими концентрациями ингибиторов до насыщения скорости поглощения О2 [3]. Иногда для обозначения дыхания по АП используют величину цианид-резистентного дыхания (ЦРД) – дыхания в присутствии только ингибитора ЦП. ЦРД не отражает корректно величину Valt.
В исследованиях часто наблюдают более высокую способность АО по сравнению с активностью АО in vivo, а также отсутствие изменения уровня белка АО при действии стресс-факторов, что, по-видимому, связано с поддержанием способности быстрой активации фермента в обход высоко энергозатратных процессов синтеза белка de novo [6, 76]. Это придает дыхательному метаболизму пластичность и адаптивность, позволяет клетке быстро реагировать на изменения внутренней и внешней среды.
Вместе с тем, пока мало сведений, подтверждающих существование механизмов посттрансляционной регуляции AO in vivo. С использованием генетически модифицированных по АОХ растений показано, что уровень белка АО не является главным фактором регуляции активности фермента in vivo, но может влиять на активность АО in vivo при стрессе. В частности, в нормальных контролируемых условиях роста листья растений табака с повышенным содержанием белка АО (линия S24) имели более высокую величину ЦРД в отличие от антисенсовой линии AS8 со сниженным содержанием белка АО [98]. При этом все линии, включая дикий тип, не отличались по активности АП in vivo. Однако при действии разных видов стресса (засуха, фотоингибирование) листья линии S24, в отличие от дикого типа, проявляли повышенную активность АП in vivo. В другой работе, при кратковременном действии высокого уровня освещенности (800 мкмоль/(м2 с)) активность АО in vivo усиливалась в листьях линии ХХ-2 с повышенным содержанием белка АО и не изменялась в антисенсовых по АОХ1а растениях A. thaliana (линия AS-12) [99]. Отметим, что неспособность к увеличению дыхания по АП в листьях AS-12 компенсировалась в данных условиях активацией дыхания по ЦП. Это дает основание полагать, что изменение метаболических процессов и/или биохимических механизмов регуляции активности белка АО являются решающими при распределении электронов по АП.
Роль АО в стабилизации пула убихинона обсуждается давно, но явных экспериментальных доказательств тому, что пул убихинона, а именно соотношение восстановленного убихинона к общему пулу убихинона (Qr/Qt), является фактором, регулирующим активность АО in vivo, пока нет [4]. Существуют лишь сведения, косвенно подтверждающие эту идею. В частности, при кратковременном фотоингибировании листья антисенсовой по АОХ1а линии A. thaliana показывали повышенный уровень Qr/Qt при отсутствии вовлечения АО in vivo и насыщения ЦП одновременно [99]. Известно также, что уровень восстановленности пула убихинона частично регулируется НАД(Ф)·Н-дегидрогеназой, при этом некоторые гены, кодирующие НАД(Ф)·Н-дегидрогеназы, коэкспрессируются с генами АО [35, 36, 51, 76, 78]. Все эти пока немногочисленные данные позволяют полагать, что уровень восстановленности пула убихинона, зависящий от концентрации НАД·Н в цитозоле и митохондриях, влияет на активность АО in vivo [6]. Высказано мнение, что для активации АО in vivo достаточны очень малые изменения величины Qr/Qt [4]. Существование механизмов посттрансляционной регуляции АО in vivo α-кетокислотами и системой Trx, регулирующей редокс-состояние фермента, пока еще не нашло экспериментальных подтверждений и требует дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Альтернативная оксидаза митохондрий является ключевым ферментом, напрямую участвующим в регуляции энергетического и окислительно-восстановительного баланса митохондрий и целостной клетки. Анализ имеющихся в литературе данных свидетельствует о существовании разных механизмов и сложных комбинаций сигнальных путей, регулирующих экспрессию генов АО. AO может напрямую влиять на сигнализацию стресса, снижая генерацию АФК, и косвенно – через изменение энергетического статуса клетки, инициируя определенные сигнальные каскады. Обращает на себя внимание функционирование в клетке множества механизмов транскрипционного и посттранскрипционного контроля как подавления экспрессии генов АО в нормальных условиях, так и быстрой индукции их экспрессии при стрессе (на примере AtAOX1a). АО кодируется несколькими генами, что позволяет синтезировать разные формы белка, имеющие различные механизмы посттрансляционной активации. Это повышает защиту выполняемой белком функции в растительной клетке. В настоящее время у растений наиболее хорошо изучена митохондриальная ретроградная регуляция экспрессии АОХ. Нечеткие различия между митохондриальными и пластидными ретроградными сигнальными путями подчеркивают тесную взаимосвязь между органеллами, но усложняют исследования роли сигналинга АО в управлении энергетическим метаболизмом фотосинтезирующей клетки. Стало ясно, что сигнальные пути регуляции экспрессии АОХ пересекаются с гормональной системой сигналинга. Появились пока немногочисленные сведения о том, что АО является не только мишенью, но и регулятором стресс-сигнала, координируя экспрессию других генов ЭТЦ, формируя и/или усиливая стресс-сигнал. Все эти вопросы нуждаются в дальнейших исследованиях. Углубление знаний о сигналинге АО предопределяет их практическое использование в экологических, медицинских и сельскохозяйственных целях уже в неотдаленной перспективе.
Автор благодарна проф., д.б.н. Т.К. Головко, к.б.н. И.О. Велегжанинову и анонимным рецензентам за ценные замечания и советы при подготовке статьи к публикации.
Работа поддержана грантом Российского фонда фундаментальных исследований (проект № 20-14-50366 Экспансия).
Автор заявляет об отсутствии конфликта интересов. Настоящий обзор не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Vanlerberghe G.C., Dahal K., Alber N.A., Chadee A. Photosynthesis, respiration and growth: A carbon and energy balancing act for alternative oxidase // Mitochondrion. 2020. V. 52. P. 197.
Meeuse B.J.D. Thermogenic respiration in aroids // Plant Physiol. 1975. V. 26. P. 117.
Shugaev A.G. Alternative cyanide-resistant oxidase in plant mitochondria: structure, regulation of activity, and presumable physiological role // Russ. J. Plant Physiol. 1999. V. 46. P. 262.
Millenaar F.F., Lambers H. The Alternative oxidase: In vivo regulation and function // Plant Biol. 2003. V. 5. P. 2.
Selinski J., Scheibe R., Day D.A., Whelan J. Alternative oxidase is positive for plant performance // Trends Plant Sci. 2018. V. 23. P. 588.
Del-Saz N. F., Ribas-Carbo M., McDonald A. E., Lambers H., Fernie A.R., Florez-Sarasa I. An in vivo perspective of the role(s) of the alternative oxidase pathway // Trends Plant Sci. 2018. V. 23. P. 206.
Garmash E.V. Role of mitochondrial alternative oxidase in the regulation of cellular homeostasis during development of photosynthetic function in greening leaves // Plant Biol. 2021. V. 23. P. 221.
Arnholdt-Schmitt B., Costa J.H., de Melo D.F. AOX – a functional marker for efficient cell reprogramming under stress? // Trends Plant Sci. 2006. V. 11. P. 281.
González-Meler M.A., Blanc-Betes E., Flower C.E., Ward J.K. Plastic and adaptive responses of plant respiration to changes in atmospheric CO2 concentration // Physiol. Plant. 2009. V. 137. P. 473.
Saari S., Garcia G.S., Bremer K., Chioda M.M., Andjelkovic A., Debes P.V., Nikinmaa M., Szibor M., Dufour E., Rustin P., Oliveira M.T., Jacobs H.T. Alternative respiratory chain enzymes: therapeutic potential and possible pitfalls // Biochim. Biophys. Acta, Mol. Basis Dis. 2018. V. 1865. P. 854.
Van Aken O., Giraud E., Clifton R., Whelan J. Alternative oxidase: a target and regulator of stress responses // Physiol. Plant. 2009. V. 137. P. 354.
Ng S., De Clercq I., Van Aken O., Law S.R., Ivanova A., Willems P., Giraud E., Van Breusegem F., Whelan J. Anterograde and retrograde regulation of nuclear genes encoding mitochondrial proteins during growth, development, and stress // Mol. Plant. 2014. V. 7. P. 1075.
Van Aken O. Mitochondrial redox systems as central hubs in plant metabolism and signaling // Plant Physiol. 2021. V. 186. P. 36.
Polidoros A.N., Mylona P.V., Arnholdt-Schmitt B. Aox gene structure, transcript variation and expression in plants // Physiol. Plant. 2009. V. 137. P. 342.
Costa J.H., Pereira dos Santos C., de Sousa e Lima B., Moreira Netto A. N., da Cruz Saraiva K.D., Arnholdt-Schmitt B. In silico identification of alternative oxidase 2 (AOX2) in monocots: A new evolutionary scenario // J. Plant Physiol. 2017. V. 210. P. 58.
Takumi S., Tomioka M., Eto K., Naydenov N., Nakamura C. Characterization of two non-homoeologous nuclear genes encoding mitochondrial alternative oxidase in common wheat // Genes Genet. Syst. 2002. V. 77. P. 81.
Brew-Appiah R.A.T., York Z.B., Krishnan V., Roalson E., Sanguinet K.A. Genome-wide identification and analysis of the ALTERNATIVE OXIDASE gene family in diploid and hexaploid wheat // PLoS ONE. 2018. V. 13: e0201439. doi.org/https://doi.org/10.1371/journal.pone.0201439
Campos M.D., Cardoso H.G., Linke B., Costa J.H., Fernandes de Melo D., Justo L., Frederico A.M., Arnholdt-Schmitt B. Differential expression and co-regulation of carrot AOX genes (Daucus carota) // Physiol. Plant. 2009. V. 137. P. 578.
Macedo E.S., Cardoso H.G., Hernandez A., Peixe A.A., Polidoros A., Ferreira A., Cordeiro A., Arnholdt-Schmitt B. Physiologic responses and gene diversity indicate olive alternative oxidase as a potential source for markers involved in efficient adventitious root induction // Physiol. Plant. 2009. V. 137. P. 532.
Cardoso H.G., Campos M.D., Costa A.R., Campos M.C., Nothnagel T., Arnholdt-Schmitt B. Carrot alternative oxidase gene AOX2a demonstrates allelic and genotypic polymorphisms in intron 3 // Physiol. Plant. 2009. V. 137. P. 592.
Ding C., Chen C., Su N., Lyu W., Yang J., Hu Z., Zhang M. Identification and characterization of a natural SNP variant in ALTERNATIVE OXIDASE gene associated with cold stress tolerance in watermelon // Plant Sci. 2021. V. 304: 110735 https://doi.org/10.1016/j.plantsci.2020.110735
Arnholdt-Schmitt B. Efficient cell reprogramming as a target for functional-marker strategies? Towards new perspectives in applied plant-nutrition research // J. Plant Nutr. Soil Sci. 2005. V. 168. P. 617.
Abe F., Saito K., Miura K., Toriyama K. A single nucleotide polymorphism in the alternative oxidase gene among rice varieties differing in low temperature tolerance // FEBS Lett. 2002. V. 527. P. 181.
Polidoros A.N., Mylona P.V., Pasentsis K., Scandalios J.G., Tsaftaris A.S. The maize alternative oxidase 1a (Aox1a) gene is regulated by signals related to oxidative stress // Redox Report. 2005. V. 10. P. 71.
Ho L.H.M., Giraud E., Lister R., Thirkettle-Watts D., Low J., Clifton R., Howell K.A., Carrie C., Donald T., Whelan J. Characterization of the regulatory and expression context of an alternative oxidase gene provides insights into cyanide-insensitive respiration during growth and development // Plant Physiol. 2007. V. 143. P. 1519.
Ho L.H.M., Giraud E., Uggalla V., Lister R., Clifton R., Glen A., Thirkettle-Watts D., Aken O.V., Whelan J. Identification of regulatory pathways controlling gene expression of stress-responsive mitochondrial proteins in Arabidopsis // Plant Physiol. 2008. V. 147. P. 1858.
Thirkettle-Watts D., McCabe T.C., Clifton R., Moore C., Finnegan P.M., Day D.A., Whelan J. Analysis of the alternative oxidase promoters from soybean // Plant Physiol. 2003. V. 133. P. 1158.
Dojcinovic D., Krosting J., Harris A.J., Wagner D.J., Rhoads D.M. Identification of a region of the Arabidopsis AtAOX1a promoter necessary for mitochondrial retrograde regulation of expression // Plant Mol. Biol. 2005. V. 58. P. 159.
De Clercq I., Vermeirssen V., Van Aken O., Vandepoele K., Murcha M.W., Law S.R., Inzé A., Ng S., Ivanova A., Rombaut D., van de Cotte D., Jaspers P., Van de Peer Y., Kangasjärvi J., Whelan J., Van Breusegem F. The membrane-bound NAC transcription factor ANAC013 functions in mitochondrial retrograde regulation of the oxidative stress response in Arabidopsis // Plant Cell. 2013. V. 25. P. 3472.
Giraud E., Aken O.V., Ho L.H.M., Whelan J. The transcription factor ABI4 is a regulator of mitochondrial retrograde expression of alternative oxidase1a // Plant Physiol. 2009. V. 150. P. 1286.
Zhang D.-W., Xu F., Zhang Z.-W., Chen Y.-E., Du J.-B., Jia S-D., Yuan S., Lin H.-H. Effects of light on cyanide-resistant respiration and alternative oxidase function in Arabidopsis seedlings // Plant Cell Environ. 2010. V. 33. P. 2121.
Garmash E.V., Velegzhaninov I.O., Grabelhych O.I., Borovik O.A., Silina E.V., Voinikov V.K., Golovko T.K. Expression profiles of genes for mitochondrial respiratory energy-dissipating systems and antioxidant enzymes in wheat leaves during de-etiolation // J. Plant Physiol. 2017. V. 215. P. 110.
Van Aken O., Zhang B., Law S., Narsai R., Whelan J. AtWRKY40 and AtWRKY63 modulate the expression of stress-responsive nuclear genes encoding mitochondrial and chloroplast proteins // Plant Physiol. 2013. V. 162. P. 254.
Ng S., Ivanova A., Duncan O., Law S.R., Van Aken O., De Clercq I., Wang Y., Carrie C., Xu L., Kmiec B., Walker H., Van Breusegem F., Whelan J., Giraud E. A membrane-bound NAC transcription factor, ANAC017, mediates mitochondrial retrograde signaling in Arabidopsis // The Plant Cell. 2013. V. 25. P. 3450.
Garmash E.V., Velegzhaninov I.O., Ermolina K.V., Rybak A.V., Malyshev R.V. Altered levels of AOX1a expression result in changes in metabolic pathways in Arabidopsis thaliana plants acclimated to low dose rates of ultraviolet B radiation // Plant Science. 2020. V. 291: 110332. https://doi.org/10.1016/j.plantsci.2019.110332
Garmash E.V., Belykh E.S., Velegzhaninov I.O. The gene expression profiles of mitochondrial respiratory components in Arabidopsis plants with differing amounts of ALTERNATIVE OXIDASE1a under high intensity light // Plant Signal. Behav. 2021. V. 16: 3. https://doi.org/10.1080/15592324.2020.1864962
Nagel D.H., Doherty C.J., Pruneda-Paz J.L., Schmitz R.J., Ecker J.R., Kay S.A. Genome-wide identification of CCA1 targets uncovers an expanded clock network in Arabidopsis // Proc. Natl. Acad. Sci. USA. 2015. V. 112: E4802-10. https://doi.org/10.1073/pnas.1513609112
Safrany J., Haasz V., Mate Z., Ciolfi A., Feher B., Oravecz A., Stec A., Dallmann G., Morelli G., Ulm R., Nagy F. Identification of a novel cis-regulatory element for UV-B-induced transcription in Arabidopsis // Plant J. 2008. V. 54. P. 402.
Rhoads D.M., McIntosh L. Salicylic acid regulation of respiration in higher plants: alternative oxidase expression // The Plant Cell. 1992. V. 4. P. 1131.
Ng S., Giraud E., Duncan O., Law S.R., Wang Y., Xu L., Narsai R., Carrie C., Walker H., Day D.A., Blanco N.E., Strand A., Whelan J., Ivanova A. Cyclin-dependent kinase E1 (CDKE1) provides a cellular switch in plants between growth and stress responses // J. Biol. Chem. 2013. V. 288. P. 3449.
Rhoads D.M., McIntosh L. Isolation and characterization of a cDNA clone encoding an altemative oxidase protein of Sauromatum guttatum (Schott) // Proc. Natl. Acad. Sci. USA. 1991. V. 88. P. 2122.
Clifton R., Millar A.H., Whelan J. Alternative oxidases in Arabidopsis: a comparative analysis of differential expression in the gene family provides new insights into function of non-phosphorylating bypasses // Biochim. Biophys. Acta. 2006. V. 1757. P. 730.
Costa J.H., Hasenfratz-Sauder M.P., Pham-Thi A.T., Lima M.D.S., Dizengremel P., Jolivet Y., de Melo D.F. Identification in Vigna unguiculata (L.) Walp. of two cDNAs encoding mitochondrial alternative oxidase orthologous to soybean alternative oxidase genes 2a and 2b // Plant Sci. 2004. V. 167. P. 233.
Feng H.Q., Li H.Y., Zhou G.M., Liang H.G., Duan J.G., Zhi D.J., Li X., Ma J. Influence of irradiation on cyanide-resistant respiration and AOX1 multi-gene family expression during greening of etiolated rice seedlings // Photosynthetica. 2007. V. 45. P. 272.
Garmash E.V., Grabelhych O.I., Velegzhaninov I.O., Borovik O.A., Dalke I.V., Voinikov V.K., Golovko T.K. Light regulation of AOX pathway during greening of etiolated wheat seedlings // J. Plant Physiol. 2015. V. 174. P. 75.
Mizuno N., Sugie A., Kobayashi F., Takumi S. Mitochondrial alternative pathway is associated with development of freezing tolerance in common wheat // J. Plant Physiol. 2008. V. 165. P. 462.
Grabelnych O.I., Borovik O.A., Tauson E.L., Pobezhimova T.P., Katyshev A.I., Pavlovskaya N.S., Koroleva N.A., Lyubushkina I.V., Bashmakov V.Yu., Popov V.N., Borovskii G.B., Voinikov V.K. Mitochondrial energy-dissipating systems (alternative oxidase, uncoupling proteins, and external NADH dehydrogenase) are involved in development of frost-resistance of winter wheat seedlings // Biochemistry (Moscow). 2014. V. 79. P. 506.
Smith C.A., Melino V.J., Sweetman C., Soole K.L. Manipulation of alternative oxidase can influence salt tolerance in Arabidopsis thaliana // Physiol. Plant. 2009. V. 137. P. 459.
Wang J., Vanlerberghe G.C. A lack of mitochondrial alternative oxidase compromises capacity to recover from severe drought stress // Physiol. Plant. 2013. V. 149. P. 461.
Gupta K.J., Shah J.K., Brotman Y., Jahnke K., Willmitzer L., Kaiser W.M., Bauwe H., Igamberdiev A.U. Inhibition of aconitase by nitric oxide leads to induction of the alternative oxidase and to a shift of metabolism towards biosynthesis of amino acids // J. Exp. Bot. 2012. V. 63. P. 1773.
Yoshida K., Noguchi K. Differential gene expression profiles of the mitochondrial respiratory components in illuminated Arabidopsis leaves // Plant Cell Physiol. 2009. V. 50. P. 1449.
Zhu L.-J., Deng X.-G., Zou L.-J., Zhang D.-W., Lin H.-H. Enhancement of stress tolerance in cucumber seedlings by proanthocyanidins // Biol. Plant. 2017. V.61. P. 323.
Panda S.K., Sahoo L., Katsuhara M., Matsumoto H. Overexpression of alternative oxidase gene confers aluminum tolerance by altering the respiratory capacity and the response to oxidative stress in tobacco cells // Mol. Biotechnol. 2012. V. 54. P. 551.
Keunen E., Jozefczak M., Remans T., Vangronsveld J., Cuypers A. Alternative respiration as a primary defense during cadmium-induced mitochondrial oxidative challenge in Arabidopsis thaliana // Environ. Exp. Bot. 2013. V. 91. P. 63.
Pasqualini S., Paolocci F., Borgogni A., Morettini R., Ederli L. The overexpression of an alternative oxidase gene triggers ozone sensitivity in tobacco plants // Plant Cell Environ. 2007. V. 30. P. 1545.
Watanabe C.K., Hachiya T., Takahara K., Kawai-Yamada M., Uchimiya H., Uesono Y., Terashima I., Noguchi K. Effects of AOX1a deficiency on plant growth, gene expression of respiratory components and metabolic profile under low-nitrogen stress in Arabidopsis thaliana // Plant Cell Physiol. 2010. V. 51. P. 810.
Cvetkovska M., Vanlerberghe G.C. Alternative oxidase impacts the plant response to biotic stress by influencing the mitochondrial generation of reactive oxygen species // Plant Cell Environ. 2013. V. 36. P. 721.
Matos A.R., Mendesa A.T., Scotti-Campos P., Arrabaca J.D. Study of the effects of salicylic acid on soybean mitochondrial lipids and respiratory properties using the alternative oxidase as a stress-reporter protein // Physiol. Plant. 2009. V. 137. P. 485.
Karpova O.V., Kuzmin E.V., Elthon T.E., Newton K.J. Differential expression of alternative oxidase genes in maize mitochondrial mutants // The Plant Cell. 2002. V. 14. P. 3271.
Juszczuk I.M., Szal B., Rychter A.M. Oxidation-reduction and reactive oxygen species homeostasis in mutant plants with respiratory chain complex I dysfunction // Plant Cell Environ. 2012. V. 35. P. 296.
Yurina N.P., Odintsova M.S. Signal transduction pathways of plant mitochondria: Retrograde regulation // Russ. J. Plant Physiol. 2010. V. 57. P. 7.
Li C.R., Liang D.D., Xu R.F., Li H., Zhang Y.P., Qin R.Y., Li L., Wei P.C., Yang J.B. Overexpression of an alternative oxidase gene, OsAOX1a, improves cold tolerance in Oryza sativa L. // Genet. Mol. Res. 2013. V. 12. P. 5424.
Liu J., Li Z., Wang Y., Xing D. Overexpression of ALTERNATIVE OXIDASE1a alleviates mitochondria-dependent programmed cell death induced by aluminium phytotoxicity in Arabidopsis // J. Exp. Bot. 2014. V. 65. P. 4465.
Wagner A.M. A role for active oxygen species as second messengers in the induction of alternative oxidase gene expression in Petunia hybrida cells // FEBS Lett. 1995. V. 368. P. 339.
Maxwell D.P., Nickels R., McIntosh L. Evidence of mitochondrial involvement in the transduction of signals required for the induction of genes associated with pathogen attack and senescence // Plant Journal. 2002. V. 29. P. 269.
Amirsadeghi S., Robson C.A., Vanlerberghe G.C. The role of the mitochondrion in plant responses to biotic stress // Physiol. Plant. 2007. V. 129. P. 253.
Ivanova A., Law S.R., Narsai R., Duncan O., Lee J.H., Zhang B., Van Aken O., Radomiljac J.D., van der Merwe M., Yi K., Whelan J. A. Functional antagonistic relationship between auxin and mitochondrial retrograde signaling regulates Alternative Oxidase1a expression in Arabidopsis // Plant Physiol. 2014. V. 165. P. 1233.
Gray G.R., Maxwell D.P., Villarimo A.R., McIntosh L. Mitochondria/nuclear signaling of alternative oxidase gene expression occurs through distinct pathways involving organic acids and reactive oxygen species // Plant Cell Rep. 2004. V. 23. P. 497.
Robson C.A., Vanlerberghe G.C. Transgenic plant cells lacking mitochondrial alternative oxidase have increased susceptibility to mitochondria-dependent and -independent pathways of programmed cell death // Plant Physiol. 2002. V. 129. P. 1908.
Vanderauwera S., Vandenbroucke K., Inze A., van de Cotte B., Muhlenbock P., De Rycke R., Naouar N., Van Gaever T., Van Montagu M.C., Van Breusegem F. AtWRKY15 perturbation abolishes the mitochondrial stress response that steers osmotic stress tolerance in Arabidopsis // Proc. Natl. Acad. Sci. U S A. 2012. V. 109. P. 20113.
Kreslavski V.D., Carpentier R., Klimov V.V., Allakhverdiev S.I. Transduction mechanisms of photoreceptor signals in plant cells. // J. Photochem. Photobiol. C: Photochem Rev. 2009. V. 10. P. 63.
Ribas-Carbó M., Aroca R., Gonzàlez-Meler M.A., Irigoyen J.J., Sanchez-Diaz M. The electron partitioning between the cytochrome and altenative respiratory pathways during chilling recovery in two cultivars of maize differing in chilling sensitivity // Plant Physiol. 2000. V. 122. P. 199.
Noguchi K., Yoshida K. Interaction between photosynthesis and respiration in illuminated leaves // Mitochondrion. 2008. V. 8. P. 887.
Dinakar C., Raghavendra A.S., Padmasree K. Importance of AOX pathway in optimizing photosynthesis under high light stress: Role of pyruvate and malate in activating of AOX // Physiol. Plant. 2010. V. 139. P. 13.
Tepperman J.M., Hudson M.E., Khanna R., Zhu T., Chang S.H., Wang X., Quail P.H. Expression profiling of phyB mutant demonstrates substantial contribution of other phytochromes to red-light-regulated gene expression during seedling de-etiolation // Plant Journal. 2004. V. 38. P. 725.
Rasmusson A.G., Escobar M. Light and diurnal regulation of plant respiratory gene expression // Physiol. Plant. 2007. V. 129. P. 57.
Finnegan P.M., Whelan J., Millar A.H., Zhang Q., Smith M.K., Wiskich J.T., Day D.A. Differential expression of the multigene family encoding the soybean mitochondrial alternative oxidase // Plant Physiol. 1997. V. 114. P. 455.
Clifton R., Lister R., Parker K.L., Sappl P.G., Elhafez D., Millar A.H., Day D.A., Whelan J. Stress-induced co-expression of alternative respiratory chain components in Arabidopsis thaliana // Plant Mol. Biol. 2005. V. 58. P. 193.
Menkens A.E., Schindler U., Cashmore A.R. The G-box: a ubiquitous regulatory DNA element in plants bound by the GBF family of bZIP proteins // Trends Biochem Sci. 1995. V. 20. P. 506.
Garmash E.V., Dymova O.V., Malyshev R.V., Plyusnina S.N., Golovko T.K. Developmental changes in energy dissipation in etiolated wheat seedlings during the greening process // Photosynthetica. 2013. V. 51. P. 497.
Kusnetsov V.V. Chloroplasts: Structure and expression of the plastid genome // Russ. J. Plant Physiol. 2018. V. 65. P. 465.
Yurina N.P., Odintsova M.S. Chloroplast Retrograde Signaling System // Russ. J. Plant Physiol. 2019. V. 66. P. 509.
Tcherkez G., Boex-Fontvieille E., Mahe A., Hodges M. Respiratory carbon fluxes in leaves // Curr. Opin. Plant Biol. 2012. V. 15. P. 308.
Schoefs B., Franck F. Protochlorophyllide reduction: mechanisms and evolution // Photochem. Photobiol. 2003. V. 78. P. 543.
Wallström S.V., Florez-Sarasa I., Wagner L., Araújo W.L., Escobar M.A., Geisler D.A., Aidemark M., Lager I., Fernie A.R., Ribas-Carbo M., Rasmusson A.G. Suppression of NDA-type alternative mitochondrial NAD(P)H dehydrogenases in Arabidopsis thaliana modifies growth and metabolism, but not high light stimulation of mitochondrial electron transport // Plant Cell Physiol. 2014. V. 55. P. 881.
Sweetman C., Waterman C.D., Rainbird B.M., Smith P.M.C., Jenkins C.D., Day D.A., Soole K.L. AtNDB2 is the main external NADH dehydrogenase in mitochondria and is important for tolerance to environmental Stress // Plant Physiol. 2019. V. 181. P. 774.
Giraud E., Ho L.H.M., Clifton R., Carroll A., Estavillo G., Tan Y.F., Howell K.A., Ivanova A., Pogson B.J., Millar A.H., Whelan J. The absence of ALTERNATIVE OXIDASE1a in Arabidopsis results in acute sensitivity to combined light and drought stress // Plant Physiol. 2008. V. 147. P. 595.
Van Lis R., Atteia A. Control of mitochondrial function via photosynthetic redox signals // Photosynth. Res. 2004. V. 79. P. 133.
Zhang D.-W., Yuan S., Xu F., Zhu F., Yuan M., Ye H.-X., Guo H.-Q., Lv X., Yin Y., Lin H.-H. Light intensity affects chlorophyll synthesis during greening process by metabolite signal from mitochondrial alternative oxidase in Arabidopsis // Plant Cell Environ. 2016. V. 39. P. 12.
Yoshida K., Watanabe C.K., Hachiya T., Tholen D., Shibata M., Terashima I., Noguchi K. Distinct responses of the mitochondrial respiratory chain to long- and short-term high-light environments in Arabidopsis thaliana // Plant Cell Environ. 2011. V. 34. P. 618.
Watanabe C.K.A., Yamori W., Takahashi S., Terashima I., Noguchi K. Mitochondrial alternative pathway-associated photoprotection of photosystem II is related to the photorespiratory pathway // Plant Cell Physiol. 2016. V. 57. P. 1426.
Dahal K., Martyn G.D., Vanlerberghe G.C. Improved photosynthetic performance during severe drought in Nicotiana tabacum overexpressing a nonenergy conserving respiratory electron sink // New Phytol. 2015. V. 208. P. 382.
Alber N.A., Vanlerberghe G.C. Signaling interactions between mitochondria and chloroplasts in Nicotiana tabacum leaf // Physiol. Plant. 2019. V. 167. P. 188.
Florez-Sarasa I., Welchen E., Racca S., Gonzalez D.H., Vallarino J.G., Fernie A.R., Ribas-Carbo M., Del-Saz N.F. Cytochrome c deficiency differentially affects the in vivo mitochondrial electron partitioning and primary metabolism depending on the photoperiod // Plants. 2021. V. 10: 444. https://doi.org/10.3390/plants10030444
Albury M.S., Elliott C., Moore A.L. Towards a structural elucidation of the alternative oxidase in plants // Physiol. Plant. 2009. V. 137. P. 316.
Tanudji M., Sjöling S., Glaser E., Whelan J. Signals required for the import and processing of the alternative oxidase into mitochondria // J. Biol. Chem. 1999. V. 274 P. 1286.
Selinski J., Hartmann A., Kordes A., Deckers-Hebestreit G., Whelan J., Scheibe R. Analysis of posttranslational activation of alternative oxidase isoforms // Plant Physiol. 2017. V. 174. P. 2113.
Guy R.D., Vanlerberghe G.C. Partitioning of respiratory electrons in the dark in leaves of transgenic tobacco with modified levels of alternative oxidase // Physiol. Plant. 2005. V. 125. P. 171.
Florez-Sarasa I., Flexas J., Rasmusson A.G., Umbach A.L., Siedow J.N., Ribas-Carbo M. In vivo cytochrome and alternative pathway respiration in leaves of Arabidopsis thaliana plants with altered alternative oxidase under different light conditions // Plant Cell Environ. 2011. V. 34. P. 1373.
Priault P., Vidal G., De Paepe R., Ribas-Carbo M. Leaf age-related changes in respiratory pathways are dependent on complex I activity in Nicotiana sylvestris // Physiol. Plant. 2007. V. 129.
Дополнительные материалы
- скачать ESM.docx
- Таблица 1. Данные о реакции альтернативного пути дыхания (АП) растений на изменение условий среды.
Инструменты
Физиология растений


