Физиология растений, 2022, T. 69, № 1, стр. 20-37
Разнообразие типов диацилглицерин ацилтрансфераз растений и особенности их функционирования, или сколько DGAT нужно растениям
О. С. Павленко a, *, Ю. В. Акашкина a, А. В. Сухорукова a, Р. А. Сидоров a, В. Д. Цыдендамбаев a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: Helliga.p@gmail.com
Поступила в редакцию 05.04.2021
После доработки 07.05.2021
Принята к публикации 07.05.2021
- EDN: OHNLNR
- DOI: 10.31857/S001533032201016X
Аннотация
Появление sn-1,2-диацил-3-ацилтрансфераз (DGAT, ДАГАТ) – ключевых ферментов биосинтеза триацилглицеринов (ТАГ) – можно рассматривать как важный ароморфоз в эволюции и органического мира в целом, и растений в частности, так как возникновение способности запасать углерод, энергию, воду и “строительные блоки” в виде гидрофобных соединений позволило повысить “емкость” запасных веществ в клетках и одновременно уменьшить объем органов запаса. DGAT есть практически у всех живых организмов от слизевиков, мхов, грибов, водорослей до млекопитающих и человека. Несмотря на такую распространенность в мире живой материи, проследить закономерности в организации, эволюции и функционировании этих ферментов очень непросто – у организма может быть несколько DGAT, принадлежащих к разным типам, имеющих разную локализацию в клетке, способных использовать разные субстраты или конкурировать за один. Их роднит только выполняемая функция – перенос от ацил-КоА остатка жирной кислоты (ЖК) на sn-1,2-диацил-глицерин (а в некоторых случаях DGAT могут ацилировать стерины, высшие жирные спирты и другие субстраты), чтобы сформировать молекулу ТАГ. Активные исследования этих ферментов, продолжающиеся последние 50 лет, пока задают больше вопросов, чем ответов; вместе с тем, ясное понимание особенностей организации и функционирования DGAT открывает невероятные возможности в области биотехнологии и генной инженерии функциональных липидов для пищевой, фармацевтической и сельскохозяйственной индустрии и т. д. В нашем обзоре мы предприняли попытку суммировать результаты исследований последних лет о структурных и функциональных особенностях DGAT, влиянии эндогенных и экзогенных факторов на уровень экспрессии их генов, и адаптивной роли генов этих белков в эволюции живых организмов.
ВВЕДЕНИЕ
За последние 20 лет мировое потребление растительных масел резко возросло и составляет около 200 млн тонн в год, вероятно, эта динамика сохранится и в ближайшие десятилетия [1]. Причина такого роста состоит в том, что растительные масла служат важнейшим продуктом питания людей (на их долю приходится до 25% калорийности дневного рациона), а содержащиеся во многих из них значительные количества таких жирных кислот (ЖК), как линолевая и α-линоленовая, представляют собой незаменимые компоненты питания млекопитающих. Кроме того, растительные масла широко используются в качестве сырья для получения смазок, олифы, технических масел и др., а также в качестве корма для животных.
Начиная с 2000-х годов, стремительно растет производство СО-нейтрального биотоплива, в том числе из растительных масел – этиловых и метиловых эфиров жирных кислот (биодизель). Так, только в США производство биодизеля в период с 2010 по 2019 годы выросло более чем в 8 раз и составляет на данный момент 9.8 млн м3 в год [2]. Несмотря на то, что доля биодизеля, вырабатываемого из растительных масел, не превышает 20% (остальное приходится на биоэтанол, производимый из пшеницы, картофеля, сахарной свеклы и кукурузы), его производство растет синхронно с общим спросом на возобновляемые источники энергии [3, 4]. Не меньшее значение сегодня имеют масла с необычным составом ЖК, которые используются в качестве промышленных лубрикантов и в медицинских целях. Все это обусловливает интенсивные исследования в области биосинтеза ЖК и масел (запасных липидов) в растениях, поиска источников новых необычных масел, изучения ферментов, ответственных за их биосинтез и генов, их кодирующих, на протяжении последних нескольких десятилетий.
Основой практически всех растительных масел являются триацилглицерины (ТАГ) – сложные эфиры глицерина и ЖК. Причина такой распространенности ТАГ среди растений состоит в том, что они, обладая относительно небольшой молекулярной массой, позволяют запасать большое количество углерода, энергии и ацилов ЖК [5]. От того, какие ЖК (или радикалы) этерифицируют sn-положения глицеринового остатка в молекуле ТАГ, непосредственно зависят не только их физические свойства, такие как температура плавления или точка кристаллизации [6], но и нутрицевтические, такие как окислительная стабильность [7], скорость абсорбции в желудочно-кишечном тракте теплокровных [8], способность влиять на атерогенез [8]. Так, жирные кислоты в sn-1 и sn-3 положениях легче гидролизуются липазой, в то время как ЖК в sn-2-положении гораздо лучше абсорбируются в форме sn-2-моноацилглицеринов. Например, дети лучше усваивают пальмитиновую кислоту из sn-2-положения ТАГ, которыми богато материнское молоко, чем аналогичную кислоту из растительных масел, где она этерифицирует исключительно sn-1 и sn-3 положения [9]. ТАГ, содержащие полиненасыщенные ЖК (ПНЖК; в особенности, арахидоновую и эйкозапентаеновую) преимущественно в sn-2-положении, гораздо лучше абсорбируются, чем молекулярные виды ТАГ, у которых ПНЖК случайно распределены между всеми тремя sn-положениями глицеринового остатка [7]. В свете этих сведений для исследователей представляет интерес поиск или создание источников так называемых “структурированных ТАГ” (сТАГ), которые содержали бы в sn-1 и sn-3 положениях ЖК с короткой цепью (например, миристиновую или лауриновую), а в sn-2-положении – ПНЖК. сТАГ подобного строения могут защитить организм от гипертриглицеридемии и ожирения, вызванных диетами с высоким содержанием жиров [10]. Помимо того, сТАГ могут применяться для ускорения снижения веса, замедления накопления жира липоцитами, а также для снижения уровня холестерина в крови [11, 12].
Если в составе ТАГ во всех трех положениях находится одна и та же ЖК, то такая молекула является симметричной и не проявляет оптических свойств, если ТАГ содержит две или три разных ЖК, то такая молекула становится асимметричной и начинает обнаруживать оптическую активность. Наиболее высокая оптическая активность характерна для ТАГ, содержащих необычные ЖК [13]. ТАГ из семян Monnina emarginata, содержащих кориолиновую (13-окси-цис-9-транс-11-октадекадиеновую) кислоту, обнаруживают высокую оптическую активность, которая обусловлена ацилами необычных ЖК в sn-3-положении [14]. Как отмечалось выше, симметричные и асимметричные ТАГ обладают разными свойствами. Например, с середины 90-х годов прошлого века активно изучаются необычные асимметричные sn-1,2-диацил-3-ацетил-глицерины (АсДАГ), sn-3-положение которых этерифицировано уксусной кислотой. По сравнению с ТАГ обычного состава, они обладают пониженной на 30% вязкостью и почти вдвое меньшей калорийностью (5 против 9 ккал/г у ТАГ), эти свойства позволяют рассматривать АсДАГ в качестве пищевой добавки для диетического питания людей [15]. В качестве “функциональной еды”АсДАГ интересны по той причине, что подобные им соединения, известные под торговой маркой SALATRIM®, в клинических испытаниях достоверно снижали чувство голода и повышали ощущение сытости, по сравнению с продуктами, содержащими ТАГ обычного состава [16]. Относительно недавно стало известно еще одно свойство АсДАГ. В 2004 году Yang с соавторами показали, что АсДАГ, выделенные из пантов пятнистого оленя (Cervus nippon Temminck), способны стимулировать гемопоэз [17], позднее было показано, что sn-1-пальмитоил-2-линолеоил-3-ацетилглицерин (PLAG) – главный молекулярный вид фракции АсДАГ в пантах пятнистого оленя – оказывает влияние на хемотаксис эозинофилов, вследствие чего облегчает течение астмы у пациентов [18]. Позднее было показано, что PLAG способен облегчать гемопоэтические повреждения при гамма-индуцированной острой лучевой болезни и уменьшать смертность от облучения даже при отсроченном введении [19]. PLAG также ослабляет вызванную химиотерапией нейтропению у онкологических больных посредством ингибирования синтеза хемокинов [20]. В свете этих данных, АсДАГ природного происхождения представляют не только технологический и нутрицевтический, но и терапевтический интерес.
ТАГ некоторых растений имеют уникальный состав. Так, необычные ω-фенилалкановые и ω-фенилалкеновые кислоты содержатся в составе TAГ семян растений рода Dracunсulus (Белокрыльник, или Калла) [21]. У растения Lilium longiflorum (лилия длинноцветковая) встречаются необычные аналоги ДАГ, у которых вместо остатков ЖК в sn-1- или в sn-3-положениях находятся остатки уксусной кислоты, а в sn-2-положении содержится глюкоза [22].
Несмотря на большое многообразие “типов” (молекулярных видов) ТАГ, практически у всех организмов прослеживаются сходные пути их биосинтеза [23]: последовательное ацилирование sn-глицеро-3-фосфата различными ацилтрансферазами – этот механизм более известен как “путь Кеннеди”. Ключевой и последней реакцией биосинтеза ТАГ в нем является ацилирование sn-1,2-диацилгицерина (ДАГ) ацилом жирной кислоты, которую осуществляет фермент sn-1,2-диацил-3-ацилтрансфераза (ДАГАТ, DGAT, EC 2.3.1.20, далее DGAT). Этот фермент использует в качестве субстратов ДАГ и ацил-КоА, в результате чего образуется молекула ТАГ. Активность этого фермента, его субстратная специфичность являются решающими факторами в образовании различных молекулярных видов ТАГ, а потому, резонно предположить, что, управляя DGAT, можно получать масла с заданными физическими или нутрицевтическими свойствами, повышать масличность важнейших культур, создавать новые продуценты различных видов ТАГ. Несмотря на значимость вопросов, решение которых невозможно без точного понимания механизмов работы DGAT, их структуры, способов регуляции активности данных ферментов, DGAT растений до сих пор недостаточно изучены. В представленном обзоре мы обобщили актуальную информацию о DGAT растений, уделив пристальное внимание структурным особенностям DGAT разных типов.
ПУТИ БИОСИНТЕЗА ТАГ И РОЛЬ DGAT В ЭТОМ ПРОЦЕССЕ
Прежде чем рассматривать структуру и функции DGAT у растений, мы считаем целесообразным кратко описать основные пути биосинтеза ТАГ с акцентом на том, какую роль в этом процессе играют различные типы DGAT и как их активность влияет на накопление ТАГ у растений. В зависимости от того, какой субстрат является донором ЖК для реакций ацилирования глицеринового остатка, выделяют ацил-СоА-зависимый и ацил-СоА-независимый пути биосинтеза ТАГ [24].
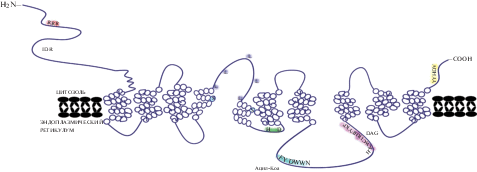
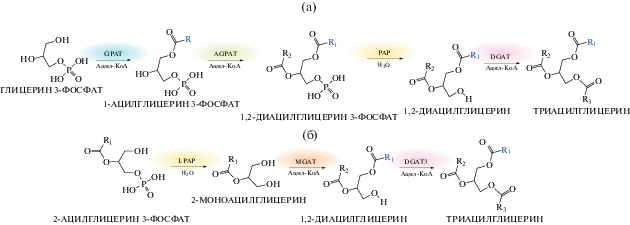
Ацил-СоА-независимый путь формирования ТАГ представляет собой перенос остатка ЖК на ДАГ от фосфолипида, в этом процессе важную роль играет фермент фосфолипид : диацилглицерин ацилтрансфераза (ФЛДАТ, PDAT, EC 2.3.1.158) [25]. В ацил-СоА-зависимом пути синтеза ТАГ, также известном как “путь Кеннеди”, донорами ацильных остатков для синтеза ТАГ являются молекулы ацил-СоА [26]. Биосинтез ТАГ из глицерол-3-фосфата и остатков ЖК осуществляется в ходе трех последовательных реакций ацилирования, с помощью ферментов sn-глицеро-3-фосфат-ацилтрансферазы (Г3Ф-АТ, GPAT, 2.3.1.15), ацилтрансферазы лизофосфатидной кислоты (АТЛФК, LPАAT, 2.3.1.51) и sn-1,2-диацил-3-ацилтрансферазы (DGAT) [24]. Все реакции пути Кеннеди протекают на мембранах эндоплазматического ретикулума (ЭР) или липосом. Существует и так называемый, альтернативный путь синтеза ТАГ, происходящий в цитозоле: sn-2-моноацилглицерин (МАГ) образуется из лизофосфатидной кислоты ферментом LPA-фосфатазой (3.1.3.106), далее с помощью моноацилглицерин ацилтрансферазы (МАГАТ, MGAT, 2.3.1.22) МАГ превращается в ДАГ, а растворимая DGAT осуществляет ацилирование ДАГ до ТАГ (рис. 1) [27].
Рис. 1.
Схема биосинтеза триацилглицеринов, идущего по пути Кеннеди (а) и по альтернативному цитозольному пути (б). GPAT – глицеро-3-фосфатацилтрансфераза, AGPAT –ацилглицерин-3-фосфатацилтрансфераза, PAP – фосфогидролаза фосфатидной кислоты, DGAT – диацилглицеринацилтрансфераза, LPAP – фосфогидролаза лизофосфатидной кислоты, MGAT – моноацилглицеринацилтрансфераза.
Долгое время считалось, что все ацилтрансферазы обладают высокой специфичностью как к ацил-содержащему субстрату, так и к молекуле, на которую они переносят ацильную группу [28]. Недавние исследования показывают, что существуют формы DGAT, способные использовать в качестве субстрата вещества различной химической природы: липофильные диацилглицерины и гидрофильные ацил-СоА, например, ацетил-СоА [15]. Помимо этого известно, что на субстратную специфичность DGAT влияют такие факторы, как ЖК- и позиционно-видовой состав пула ДАГ конкретного организма, концентрация и ЖК-состав ацил-СоА, а также температура окружающей среды [24].
Уровень активности ферментов семейства DGAT можно считать одним из лимитирующих факторов при накоплении запасных липидов. Так, на примере Arabidopsis thaliana (резуховидка Таля) и Glycine max (соя культурная) было показано, что в отсутствие активности DGAT достоверно снижался уровень ТАГ в семенах [29, 30]. И наоборот, высокоэффективная экспрессия генов, кодирующих DGAT, у A. thaliana приводила к повышению накопления масла в семенах, а подавление экспрессии этих генов – к снижению масличности семян [29]. Следует отметить, что активность DGAT, возможно, важна и для корректного распределения ацилов необычных ЖК в запасных липидах семян [27]. Следовательно, ферменты семейства DGAT могут определять и качественный состав ТАГ, и уровень их накопления. Исходя из вышесказанного, DGAT можно назвать ключевыми регуляторными ферментами липидного гомеостаза эукариот, объединяющими потоки углерода и энергии за счет биосинтеза TAГ. Функциональные особенности DGAT интенсивно изучаются на протяжении нескольких десятилетий, однако до сих пор остается открытым ряд вопросов, касающихся свойств данного фермента.
КЛАССИФИКАЦИЯ DGAT
Существует несколько подходов к классификации этих ферментов: по времени их открытия, по субстратной специфичности и по локализации в клетке. Так, первым трем типам в зависимости от времени их обнаружения были присвоены числовые индексы (DGAT1, DGAT2, DGAT3). Названия еще двух типов DGAT отражают их функциональные особенности (WS/DGAT, DAcT). К первому типу ферментов семейства DGAT относятся белки (DGAT1), впервые обнаруженные в печени кур (Gallus gallus domesticus) [31]. DGAT1 является гомологом ацилтрансферазы ацил-СоА/холестеринэстеразы (АСАТ, EC 2.3.1.26) млекопитающих и имеет с ней структурное сходство, а расхождение в их аминокислотных последовательностях определяет субстратную специфичность DGAT1 к ДAГ. Оба фермента принадлежат к большому семейству мембраносвязанных O-ацилтрансфераз (MBOAT) [32]. Все представители MBOAT характеризуются наличием конcервативных остатков гистидина в С-концевой области фермента и переносят ЖК на гидроксильные группы мишеней, внедренных в мембрану. Так ACAT осуществляют перенос ЖК на холестерин, DGAT1 – на ДАГ, Are1/2 – на стерины, WS (waxsynthase) – на высшие жирные спирты [32]. Локализуется DGAT1 главным образом в ЭР, но также может присутствовать в мембранах пластид и олеосом. В настоящее время гомологи гена DGAT1 найдены у растений рода Arabidopsis [33], Olea europaea (олива европейская) [34], Brassica napus (рапс обыкновенный) [35], Ricinus communis (клещевина обыкновенная) [36], Vernicia fordii (тунг Форда) [37], Tropaeolum majus (настурция большая) [38], Helianthus annuus (подсолнечник однолетний) [39], Macadamia tetraphylla (макадамия четырехлистная) [40] и др.
Ко второму типу относят ферменты, называемые DGAT2, которые имеют сходство с ацил-СоА: моноацилглицерин ацилтрансферазами (MGAT, EC 2.3.1.22) и с ацил-CoA ацилтрансферазами восковых спиртов (Awat, EC 2.3.1.75). Ферменты этого типа были обнаружены у грибов, круглых червей, человека и у некоторых видов растений, таких как A. thaliana [41], V. fordii [37] и O. europaea [42]. DGAT2 является мембраносвязанным ферментом и локализуется в ЭР и на поверхности олеосом.
К третьему типу относятся DGAT3, участвующие в альтернативном пути синтеза ТАГ, происходящем в цитозоле. На данный момент это единственный известный растворимый фермент семейства DGAT. Первоначально этот фермент был выделен из семядолей Аrachis hypogaеa (арахис культурный) [27], а недавно был обнаружен также у видов рода Arabidopsis [43], в дрожжах Rhodotorula glutinis [44] и у некоторых водорослей [45].
Четвертый тип ферментов представлен бифункциональными белками WS/DGAT, проявляющими, преимущественно, свойства синтетаз восковых эфиров, а также ацетил-СоА диацилглицерин ацилтрансфераз. Впервые этот фермент был обнаружен у Acinetobacter calcoaceticus [46]. Гомологи WS/DGAT также охарактеризованы у Petunia hydrida (петуния гибридная) [47] и Arabidopsis [48], на этих же растениях было показано, что данный фермент локализуется на мембранах ЭР.
Помимо этого, недавно у Euonymus alatus (бересклет крылатый) была обнаружена особая форма DGAT (EaDAcT), ответственная за синтез ацетилированных диацилглицеринов (AcДАГ). Как и DGAT1, эта форма принадлежит к семейству мембраносвязанных O-ацилтрансфераз (MBOAT), но, в отличие от других представителей данного семейства, EaDAcT катализирует передачу коротких ацильных групп (С2–С6), причем эффективность использования ацил-КоА в качестве доноров ацила увеличивается с уменьшением углеродной цепи жирнокислотного остатка [49].
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ DGAT РАЗНЫХ ТИПОВ
За исключением DGAT3, все ферменты семейства DGAT являются мембраносвязанными белками, что значительно осложняет исследование их трехмерной структуры существующими физическими методами. Наиболее демонстративной моделью, полученной с помощью рентгеноструктурного анализа, является модель WS/DGAT из Marinobacter aquaeolei [50]. Пространственная структура ни одного из DGAT, принадлежащих высшим организмам, в настоящее время не определена. Большинство сведений о структурных особенностях этих ферментов получено с использованием методов in silico. В 2011 году группой ученых из университета Нового Орлеана методами биоинформатики был проведен структурно-функциональный анализ аминокислотных последовательностей DGAT1 и DGAT2 из семидесяти организмов [51], в 2017 году Bagnatoc с cоавторами был проведен большой сравнительный анализ всех DGAT, обнаруженных у водорослей [45], также некоторые сведения об аминокислотных последовательностях данных ферментов были получены при анализе их изоформ у конкретных организмов. По существу, биохимические функции всех типов DGAT сходны, что должно указывать на наличие общих консервативных последовательностей у этих ферментов. Однако оказалось, что они не обнаруживают гомологии последовательностей друг с другом. Так, множественное выравнивание пятидесяти девяти аминокислотных последовательностей DGAT1, выделенных из 48 организмов, и пятидесяти восьми последовательностей DGAT2 из 44 организмов показало наличие только 2-х консервативных аминокислотных остатков: фенилаланина в положении F225 и пролина в положении Р248 [51].
Использованные в разных исследованиях биохимические и биофизические методы, а также in silico анализ в совокупности дают довольно четкие представления о пространственной структуре DGAT1. Как правило, это большие белки размером около 500 аминокислотных остатков (а.о.) (табл. 1). Распределение разных типов а.о. в DGAT1 выглядит следующим образом: приблизительно 26% – заряженные а.о. (7% – кислотные остатки, представленные преимущественно глутаминовой и аспарагиновой кислотами; 10% – основные остатки, представленные в основном лизином и аргинином), 25% – нейтрально полярные, и 42% – гидрофобные а.о. [51], что согласуется с мембранным положением фермента. Изученные растительные DGAT1 имеют длинный (около 100 а.о.) гидрофильный N-концевой сегмент, за которым следуют трансмембранные (ТМ) домены, по мнению разных исследователей у растений их количество варьирует от 6 до 10, но всегда четное (рис. 2) [52, 53]. У B. napus N-концевой сегмент DGAT1 имеет сайт связывания с ацил-СоА (с 81 по 113 а.о.) [35], однако нахождение данного сайта в цитозоле говорит в пользу того, что он обеспечивает аллостерическое взаимодействие, а не функциональное. Первые 80 а.о. представляют собой так называемый неупорядоченный регуляторный регион (Intrinsically desorted region – IDR [54]), который содержит в себе вероятные участки димеризации и аутоингибирования [55]. Это согласуется с другими исследованиями, отмечающими, что порядка 50% мембранных белков имеют длинные IDR [56], локализованные в цитоплазме и выполняющие функции регуляции, в том числе ингибирования активности фермента [57], и клеточной сигнализации [58]. Наличие IDR также подтверждает возможность аллостерической регуляции активности DGAT1. Все известные DGAT1 объединяет наличие в IDR кластера аргининовых остатков, который, возможно, важен для регуляции активности фермента [59]. Считается, что N-концевой сегмент целиком закодирован в первом экзоне, всего же большинство DGAT1 растений имеют 16 экзонов [53]. На основе in silico анализа аминокислотных последовательностей были предсказаны некоторые функциональные мотивы DGAT, которые пока требуют экспериментального подтверждения (табл. 2). Так, у B. napus была описана лейциновая застежка, состоящая из пяти остатков лейцина, последовательно разделенных семью а.о. (L205, L212, L219, L226 и L233). Полагают, что этот мотив может служить сайтом связывания модулирующих белков или облегчать взаимодействие DGAT1 с другими ферментами в пути биосинтеза ТАГ [35]. В ряде исследований описывались вероятные сайты фосфорилирования DGAT1. Эксперименты по внесению замен в эти сайты показали изменение активности фермента. Так, у T. majus замена серина на аланин в 197 положении приводила к повышению активности DGAT1 [38]. У B. napus важным для активности DGAT1 считается также консервативный остаток серина в положении 237 (S237). Остатки S197 и S237 являются аналогичными сайтам фосфорилирования SnRK1 и тирозинкиназы соответственно [35]. Фосфорилирование может оказывать большое влияние на активность DGAT1, поскольку в качестве субстрата для этого фермента выступает ДАГ, а фосфорилирование определенных а.о. повышает сродство других ферментов с ним [59]. У большинства растительных DGAT1 обнаруживаются консервативные мотивы HxxxD и HxxxxD около 4-го и 5-го ТМ-доменов соответственно, предполагается, что подобная пара гистидина и аспарагиновой кислоты способствует увеличению нуклеофильности гидроксигруппы ДАГ, облегчая взаимодействие с Ацил-СоА [59]. В тоже время у A. thaliana описанную функцию выполняет мотив N(S/A/G)R(L/V)(I/F/A)(I/L)EN(L/V), в котором роль гистидина и аспарагиновой кислоты выполняют аргинин и глутаминовая кислота соответственно [29]. В 2011 году Сао с соавторами провели сравнительный анализ аминокислотных последовательностей всех известных DGAT1, который выявил 41 строго консервативный а.о., причем большинство этих а.о. было локализовано в С-концевой области фермента. Эти высококонсервативные а.о. могли указывать на активные сайты, играть важную функциональную роль, в том числе сказываться на субстратной специфичности и/или формировании пространственной структуры молекулы. Позже с помощью моделирования пространственных структур in silico было предсказано наличие у DGAT1 из B. napus в С-концевой области белка большой внемембранной петли, локализованной в полости ЭР и содержащей два функциональных пептида. Пептид Sit1 (356FGDREFYRDWWNSES370) включает в себя мотив FYxDWWN, который является высококонсервативным между ферментами DGAT и ацил-CoA холестеринацилтрансферазой млекопитающих (ACAT), и, вероятно, отвечает за связывание с ацилом. Пептид Sit2 (379NIPVHKWSIRHFY391) включает предполагаемый диацилглицерин-связывающий мотив HKWCIRHFYKP, обнаруженный ранее в протеинкиназе С и диацилглицеринкиназах (табл. 2). Дальнейшие исследования с помощью SRCD (synchrotron radiation circular dichroism) и флуоресцентной микроскопии подтвердили эти предположения [60]. Анализ топологии DGAT1 показал, что N- и С-концевые области фермента ориентированы в цитоплазму, что подтверждает четное число ТМ-доменов [61]. В 2004 году McCartney с соавторами описали у десатураз жирных кислот несколько С-концевых мотивов, определяющих локализацию ферментов относительно ЭР [62], на основе которых аналогичные мотивы были обнаружены у DGAT1 и DGAT2 [37, 63] (табл. 2). Некоторые важные аминокислотные остатки последовательностей DGAT были определены благодаря изучению естественных мутаций. Так, у B. napus замена пролина на аргинин в 216 положении почти полностью ингибировала активность фермента. Также существует мнение, что у B. napus аминокислотные замены в 9-м предсказанном трансмембранном домене (PTMD9) приводят к повышению эффективности работы DGAT1 [64]. У кукурузы аллель ASKC28IB1 DGAT1-2, ответственный за высокий уровень накопления масла, отличается от аллеля PH09B, ответственного за средний уровень содержания масла, инсерцией фенилаланина в 469 положении. Zheng с соавторами выяснили, что именно этот а.о. играет ключевую роль в повышении содержания масла и концентрации олеиновой кислоты у кукурузы [65]. Интересно отметить, что этот остаток фенилаланина консервативен для растительных DGAT1, но не характерен ни для одного из DGAT1 животных, а также для DGAT2 [51].Таким образом, имеющиеся на сегодняшний момент данные позволяют довольно подробно описать локализацию, структуру и вероятные взаимодействия DGAT1, некоторые высказанные ранее предположения были подтверждены экспериментально, в тоже время ряд тезисов все еще требует детального исследования.
Таблица 1.
Сравнительная характеристика разных типов фермента DGAT
| DGAT1 | DGAT2 | DGAT3 | WS/DGAT | EaDAcT | |
|---|---|---|---|---|---|
| Размер | 515 а.о. | 340 а.о. | 458 а.о. | ||
| 41 кДа | 42 кДа | ||||
| Число ТМ-доменов | 6–10 | 1–3 | 0 | 0–3 | 4–5 |
| Количество экзонов | 16 | 5–9 | 2–3 | 6–8 | – |
| Локализация в клетке | ЭР, пластиды | ЭР, липидные капли, митохондрии | цитозоль | ЭР | ЭР |
Таблица 2.
Выявленные функциональные мотивы ферментов DGAT.
| Фермент | Мотив | Функция | Организм | Источник |
|---|---|---|---|---|
| DGAT1 | YYHDV | Локализация на ЭР | Echium | 63 |
| RTRESPLSSDAIFKQSHA | Аллостерическое взаимодействие с Ацил-КоА | B. napus | 24 | |
| FYXDWWN | Взаимодействие с Ацил-КоА | B. napus | 60 | |
| HKWCIRHFYKP | Взаимодействиес ДАГ | B. napus | 60 | |
| L205, L212, L219, L226, L233 | Лейциновая застежка | B. napus | 35 | |
| HXXXD и HXXXXD | Активный сайт | plants | 59 | |
| N(S/A/G)R(L/V)(I/F/A)(I/L)EN(L/V) | Активный сайт | A. thaliana | 29 | |
| DGAT2 | LKLEI | Локализация на ЭР | V. fordii | 37 |
| FLXLXXXn | Связывание с нейтральными липидами | M. musculus | 69 | |
| RXKXXK | Митохондриальный сигнал | M. musculus | 69 | |
| YFP | Активность фермента | S. cerevisiae | 59 | |
| HFP | Активность фермента | R. communis | 70 | |
| HPHG | Активный сайт | S. cerevisiae | 59 | |
| EPHS | Активный сайт | V. fordii | 37 | |
| DGAT3 | HVQYYGD KKRVLFDDL HHNAVELFSRNND |
Ацилтрансферазные мотивы | A. hypogaea | 27 |
| RKAETMIL | Сайт фосфорилирования | A. hypogaea | 27 | |
| RIEVCMGNKCKKSGXXALLXEFERXXGEVVGCKCMGKCXXXPNVR | [2Fe-2S] домен | A. thaliana | 72 | |
| WS/ DGAT |
HHXXXDG | Активный сайт | A. calcoaceticu | 46 |
| HHXLGDG | Активный сайт | A. thaliana | 53 | |
| DAcT | VREKI | Локализация на ЭР | E. alatus | 49 |
| SxxxHDxxxxV | Активный сайт | E. alatus | 75 |
Ферменты типа DGAT2 в сравнении с DGAT1 изучены значительно хуже. Они, как и DGAT1, локализуются в мембране ЭР, а также обнаруживаются в мембранах микросом [41] (табл. 1). Известно, что средний размер DGAT2 составляет 340 а.о., что соответствует разнице в молекулярном весе в 20 кДа по сравнению с DGAT1 [51]. DGAT1 и DGAT2 имеют аналогичные частоты встречаемости а.о. разных функциональных групп, но не гомологичны друг другу. Интересно, что процент гидрофобных а.о. у них тоже примерно равный (42% у DGAT1 и 41% у DGAT2), хотя число ТМ-доменов у большинства известных DGAT2 варьирует от 1 до 4, в то время как у DGAT1 может достигать 10 [51]. Среди всех DGAT2 топология лучше всего изучена у Saccharomyces cerevisiae. Ниже мы приводим описание DGAT2, основанное на этой модели, с некоторыми уточнениями относительно DGAT2 растений (рис. 3). Модель DGAT2 S. cerevisiae, построенная с помощью методов in silico, имела четыре ТМ-домена, а N- и C-концевые области были ориентированы в цитозоль. Аналогичная ориентация наблюдалась у растительного DGAT2 (V. fordii), у которого обе концевые области также обращены в цитозоль [37]. Однако анализ степени гидрофобности аминокислотных последовательностей V. fordii и Elaeis guineensis (пальма масличная) показал, что DGAT2 этих растений с большой вероятностью имеют по два ТМ-домена и длинный С-концевой регион [37, 66]. Про N-концевую область известно, что первые 30–50 а.о. не проявляют каталитической активности и представляют собой неупорядоченный регион [67]. У растений этот регион, возможно, важен для регулирования активности фермента, поскольку у B. napus в 25-м положении находится остаток серина, имеющий окружение, аналогичное сайту фосфорилирования SnRK1 киназы (х1х2х2х2Sх2х2х2х1, где х1 – гидрофобный а.о., а х2 – основный а.о.) [35]. Первый TM-домен S. cerevisiae, вероятно, охватывает участок от 66 до 97 а.о. и содержит предполагаемый мотив связывания с нейтральными липидами – FVLF. Мотив с такой последовательностью обнаруживается только у S. cerevisiae, у млекопитающих ему соответствует последовательность FLxLxxxn (где n неполярный а.о.) [68] (табл. 2). Растения же, вероятно, имеют свою уникальную последовательность липидсвязывающего домена в DGAT2, которая пока не идентифицирована. При этом у B. napus в 75 положении находится консервативный остаток серина, который по аналогии с S237 DGAT1 может быть важен для регуляции активности фермента [35]. Интересно отметить, что делеция первого ТМ-домена хоть и приводила к снижению активности фермента, не влияла на ассоциацию ScDGAT2 с микросомальными мембранами, подтверждая предположение, что другие сегменты DGAT2 могут опосредовать взаимодействие с мембранными бислоями. За первым ТМ-доменом следует длинная люменальная петля ЭР, содержащая мотив YFP (рис. 3), замены в котором приводили к значительному снижению активности фермента [59]. Примечательно, что этот мотив консервативен у известных DGAT2, за исключением R. communis, у которой данному мотиву соответствует HFP [69]. Здесь важно отметить, что такая длинная люменальная петля характерна для DGAT2 S. cerevisiae и не наблюдалась у растений и млекопитающих. За этой областью следуют еще два TM-домена, расположенные между остатками 188 и 236. Второй TM-домен содержит консервативный мотив HPHG, который, вероятно, важен для каталитической активности фермента, поскольку Н195, аналогично консервативному гистидину из DGAT1, может указывать на ДАГ-связывающий мотив [59]. У растений мотив HPHG соответствует мотиву EPHS, который локализуется в свободной С-концевой области (рис. 3), что укаывает на отличную от DGAT1 роль DGAT2 в синтезе ТАГ, в частности, формирование липидных капель непосредственно в цитоплазме клеток. Четвертый ТМ-домен в своей С-концевой области имеет мотив LKLEI, ответственный за локализацию DGAT2 в ЭР. Такой мотив был обнаружен и у S. cerevisiae, и у V. fordii [37]. Однако, как упоминалось выше, у растений этот мотив расположен на краю длинного свободного С-концевого участка и не может непосредственно отвечать за локализацию в ЭР, но, по-видимому, важен для более тонкого распознавания клеточным механизмом локализации белков, в частности для определения в конкретный субдомен ЭР [37]. О потенциальных сайтах связывания DGAT2 с ацил-CоА на данный момент не сообщалось.
DGAT3 имеет размер около 360 а.о. и содержит примерно 31% гидрофобных остатков, на основе анализа расположения которых и отсутствия сигналов локализации в ЭР данный фермент был отнесен к растворимым белкам (табл. 1), а по наличию нескольких частично консервативных мотивов (54HVQYYGD60, 81KKRVLFDDL89, 205HHNAVELFSRNND217) – к ацилтрансферазам (табл. 2) [27]. Пространственная структура DGAT3 не известна, несмотря на то, что она лучше, чем у других DGAT, может быть исследована существующими методами. DGAT3 имеет 11 полностью консервативных а.о., причем 10 из них расположены в С-концевой области белка, что говорит о возможной функциональной значимости этого региона (рис. 4) [70]. У DGAT3 было описано несколько потенциально функциональных сайтов: так, у некоторых видов растений первые 35–45 а.о. соответствуют транзитному пептиду хлоропластов [71]; мотив 183RKAETMIL190 гомологичен сайту фосфорилирования тирозинкиназы [27], а мотив, содержащий с 244 по 295 аминокислоты, – домену тиоредоксиноподобных [2Fe-2S]-ферредоксинов [72]. Также исследованные последовательности DGAT3 содержат полисериновый и два полилизиновых региона, функциональная роль которых пока не определена (рис. 4) [73].
WS/DGAT сопоставим по размеру с DGAT1, он также локализован в мембране ЭР и относится к семейству MBOAT, но имеет меньшее число ТМ-доменов (от одного до трех) (табл. 1), а у некоторых гомологов WSD1 (WS/DGAT) из А. thaliana не предсказано ни одного ТМ-домена [61]. О пространственной структуре растительных WS/DGAT известно довольно мало. In silico анализ показал, что вне зависимости от числа ТМ-доменов белок имеет большую цитозольную N-концевую область, которая включает в себя высококонсервативный мотив HHxLGDG (табл. 2), вероятно являющийся активным сайтом [53]. Для WS/DGAT из M. aquaeolei VT8 была получена кристаллическая структура (ID PDB: 6CHJ) [50]. Данный WS/DGAT кристаллизовался в виде димера, у которого N-концевой и С-концевой домены были связаны через α-спиральный линкер. Оба домена состояли из β-листов, окруженных α-спиралями (рис. 5). Несколькими годами ранее для M. hydrocarbonoclasticus VT8 in silico была построена модель, имеющая большое сходство с упомянутой выше [74]. К сожалению, структура WS/DGAT из M. aquaeolei VT8 имела неупорядоченные области, но на данный момент это единственная модель DGAT, построенная с применением физических методов, а не исключительно в результате in silico предсказания. В описываемой модели консервативный мотив 135HHxxxDG141 расположен на петле, которая связывает N-концевой домен с α-спиральным линкером (рис. 5), при этом ориентация и пространственное окружение позволяет предположить, что Н136 выполняет каталитическую роль, а Н135 и D140 – структурную. Описанный мотив находится между двумя полостями, в которых по аналогии с другими трансферазами, по-видимому, и происходит синтез. При анализе последовательностей “выстилающих” эти полости не было выявлено строго консервативных а.о., хотя некоторые исследования указывали, что замены в этом регионе приводили к потере активности WS/DGAT. У G. max, A. thaliana и O. sativа был выявлен ряд консервативных мотивов, но предположить их функциональную роль пока не удалось [53].
DAcT из Euonymus alatus, отвечающий за синтез АсДАГ, представляет собой белок массой 42 кДа (табл. 1). В нескольких исследованиях было показано наличие четырех ТМ-доменов, локализованных между 10–30, 157–177, 240–260 и 309–333 а.о. (рис. 6) [75]. Обе концевые области фермента ориентированы в полость ЭР, что отличает EaDAcT от DGAT1 и DGAT2, и N-, и С-регионы которых обращены к цитоплазме. Как было описано выше, свободная N-концевая область способствует аллостерическому взаимодействию DGAT1 и DGAT2 с ацил-СоА, для DAcT и ацетил-СоА подобной зависимости выявлено не было [49]. При этом третий ТМ-домен содержит сигнатуру, характерную для представителей семейства MBOAT (SxxxHDxxxxV), активный гистидин которой располагается на границе мембраны с цитозолем, что делает его доступным для ацетил-СоА (табл. 2). Остаток валина (V263), не характерный для других DGAT, в данном сайте, вероятно, выполняет важную структурную функцию. В дополнение к упомянутому мотиву, были выявлены два консервативных цистеина (С187 и С293), замены в которых приводили к значительному уменьшению активности фермента. DAcT имеет свой собственный мотив локализации в ЭР (табл. 2; рис. 6) [75].
ЭВОЛЮЦИЯ DGAT РАСТЕНИЙ
Экспоненциальный рост данных о последовательностях генов, в том числе и генов DGAT из разных видов растений, позволяет проводить филогенетический анализ и на его основе строить гипотезы о происхождении и эволюции этих ферментов. Так, в 2011 году филогенетический анализ аминокислотных последовательностей всех четырех типов DGAT растений показал, что каждый тип фермента образует отдельную кладу на филогенетическом дереве, причем последовательности, относящиеся к классам двудольных и однодольных, образуют в каждой кладе отдельные подклады (кластеры) [76]. Филогенетический и эволюционный анализ генов DGAT1 и DGAT2 показал, что в процессе эволюции эукариот эти гены произошли за счет функциональной конвергенции [76]. На основе филогенетического анализа всех генов DGAT3 и WS/DGAT, а также предположительно относящихся к этим генам последовательностей, выдвинута гипотеза, что они либо произошли от общего предкового гена до появления высших растений, либо имеют независимое происхождение, как в случае с DGAT1 и DGAT2. В поддержку второго предположения свидетельствуют данные по сравнению последовательностей генов WS/DGAT растений и гена WS/DGAT Acinetobacter calcoaceticu, которые показали высокую степень идентичности, что свидетельствует о том, что данный тип DGAT возник до выхода растений на сушу и подтверждает гипотезу независимого происхождения всех типов DGAT [53]. На основании результатов филогенетического анализа было показано, что последовательность ADP1 (WS/DGAT) из Acinetobacter sp. образует одну подкладу с WS/DGAT A. thaliana и предсказанными WS/DGAT других видов растений и водорослей, благодаря чему выдвинуто предположение, что этот тип DGAT образовался до возникновения высших растений. При этом, близкое родство WS/DGAT Simmondsia chinensis (симмондсия китайская, хохоба) с последовательностями DGAT1, может указывать и на общее происхождение DGAT1 и WS/DGAT [53].
Следует подчеркнуть, что об эволюции белков можно судить по характеру дупликации их генов, и в этом отношении каждый тип DGAT имеет свои особенности. Так, в исследовании Turchetto-Zolet с соавторами выявлено, что WS/DGAT наиболее вариабельный ген и более двух вариантов его последовательности имеют многие растения: G. max, A. thaliana, B. rapa, R. communis, M. truncatula, A. hypogaea, O. sativa, Z. mays. Ген DGAT3 присутствует в единственном числе практически у всех растений, за исключением G. max, у которой выявлена дупликация этого гена. DGAT1 и DGAT2 представлены двумя и более копиями этих генов у многих растений. Согласно текущему мнению, дупликации генов DGAT, вероятно, произошли уже после отделения группы наземных растений, так как гены всех типов DGAT у водорослей представлены в единственном числе [53].
Анализ последовательностей генов DGAТ также свидетельствует о различной эволюционной истории четырех типов фермента. Гены DGAT3, содержат два экзона, исключением являются зеленые водоросли Volvox carteri, у которых три экзона, а у мха Physcomitrella patens и Populus trichocarpa (тополя волосистоплодного), обнаружен недостаток интронов. Гены WS/DGAT большинства видов растений характеризуются высокой консервативностью их структурной организации и имеют семь экзонов (табл. 1). Консервативность структуры WS/DGAT сохраняется даже среди генов с шестью или восемью экзонами, и такие изменения могут быть связаны с утратой или увеличением экзонов в процессе эволюции. Сравнение структурной организации четырех различных типов генов DGAT (DGAT1, DGAT2, DGAT3 и WS/DGAT) из G. max и А. thaliana выявило различные степени консервативности в структуре этих генов. Гены DGAT1 G. max и А. thaliana содержат по 16 экзонов, гены DGAT2 – от 5 до 9 экзонов, DGAT3 – 2 и WS/DGAT – 7 экзонов (табл. 1) [53]. Таким образом, экзонно-интронный анализ последовательностей DGAТ показал высокую степень консервативности относительно их генной структуры у всех организмов.
ЗНАЧЕНИЕ РАЗНЫХ ТИПОВ DGAT В БИОСИНТЕЗЕ ТРИАЦИЛГЛИЦЕРИНОВ
Имеющиеся исследования позволяют утверждать, что у каждого вида живых организмов имеется от одного до пяти типов DGAT, при этом некоторые из них могут иметь несколько копий одного гена. Разнообразие DGAT до конца не объяснено, вероятно, такая “избыточность” типов играет компенсационную роль, хотя возможны и более уникальные сценарии. По-видимому, DGAT1 является основным типом DGAT, отвечающим за синтез запасных липидов у большинства организмов. Так, экспрессия гена DGAT1 из E. alatus в клетках дрожжей приводила к увеличению содержания ТАГ в 40 раз по сравнению с пустым вектором [77]. У A. thaliana обнаружен только один гомолог гена DGAT1 (At2g19450), его экспрессия и функциональная роль детально охарактеризована in planta. Инактивация DGAT1 приводила к снижению содержания масла в семенах до 40% [78]. Имеющиеся у A. thaliana DGAT2, DGAT3 и WS/DGAT, вероятно, страхуют в этой неблагоприятной для семени ситуации, сохраняя количество липидов на приемлемом для выживания и прорастания зародыша уровне. У слизевика Dictyostelium discoideum ключевой вклад в синтез ТАГ вносит фермент DGAT1, а не DGAT2, хотя именно DGAT2 специализирован для синтеза ТАГ, в то время как DGAT1 наравне с ТАГ способен синтезировать восковые эфиры и, что особенно необычно, эфиры нейтральных липидов, например, моноалкил-моно- и диацилглицерины. Предполагается, что одновременная активность двух DGAT необходима слизевику для роста на бактериях – его естественном пищевом субстрате [79]. У дрожжей S. cerevisiae основной вклад в синтез ТАГ вносит фермент DGAT2 [80], поскольку мутанты, с выключенной экспрессией соответствующего гена, характеризовались меньшей продолжительностью жизни по сравнению с контрольным штаммом. При этом аналогичные опыты на другом виде дрожжей Yarrowia lipolytica показали, что определяющую роль в липидном обмене у этого вида играет DGAT1 [81].
Несмотря на различия в строении молекул DGAT1 и DGAT2, их функциональная обособленность до сих пор не до конца ясна. Ряд исследований позволяет предположить, что DGAT1 проявляет субстратную специфичность к насыщенным ЖК, а DGAT2 – к ненасыщенным ЖК, например, в сравнительном исследовании DGAT1 и DGAT2 из A. thaliana DGAT1 отдавал предпочтение C16 : 0, в то время как DGAT2 – C16 : 1 [82]. Также существует мнение, что DGAT1 отвечает за синтез и накопление ТАГ, содержащих только обычные ЖК, тогда как DGAT2 играет ключевую роль в синтезе липидов у тех растений, в составе ТАГ которых преобладают необычные ЖК [21, 36, 70]. Например, DGAT1 является основным ферментом для накопления масла в семенах G. max, в составе ТАГ которой присутствуют только обычные ЖК [83], а V. fordii является одним из примеров того, что DGAT2 отвечает за синтез TAГ у тех видов растений, в составе ТАГ которых присутствуют необычные жирные кислоты. Масло V. fordii, которое широко используется в Китае как сырье для химической и фармацевтической промышленности, а также в качестве источника биотоплива, содержит до 80% ненасыщенной элеостеариновой кислоты, при этом в плодах этого растения одновременно функционируют DGAT1, DGAT2 и DGAT3. Предполагается, что основной вклад в накопление масла у V. fordii вносит именно DGAT2, поскольку высокий уровень экспрессии его гена коррелировал с высоким уровнем накопления элеостеариновой кислоты, в то время как уровень экспрессии генов VfDGAT1 и VfDGAT3 оставался константным [37, 71, 84]. Сходная взаимосвязь между увеличением экспрессии гена DGAT2 и содержанием рицинолевой кислоты в масле была показана и у R. communis [70, 85]. Активность DGAT2 на примере V. fordii и R. communis позволяет говорить о том, что данный тип фермента обладает сродством к большому разнообразию субстратов, т. е. способен ацилировать ДАГ ацилами необычных ЖК. К эксклюзивным функциям DGAT2 можно отнести активацию синтеза феромонов у Bombyx mori (тутовый шелкопряд) [86]. Часто DGAT2 обнаруживают на мембранах ассоциированных с микротрубочками олеосом, что, возможно, указывает на роль этого фермента в ремоделировании мембран в процессе клеточного роста [87].
Экспериментальные исследования говорят в пользу того, что субстратная специфичность DGAT зависит от вида растения. Так, у A. thaliana DGAT1 присоединяет преимущественно ЖК с длинной цепью, а DGAT1 из E. guineensis – ЖК со средней длиной цепи [82]. У Jatropha curcas (ятрофа куркас) DGAT1 вводит в состав ТАГ преимущественно линоленовую кислоту. И экспрессия гена, кодирующего DGAT1 J. curcas (JcDGAT1), в гетерологичной системе (A. thaliana) приводила не только к увеличению содержания масла, но и изменению соотношения ненасыщенных жирных кислот, а именно: вне зависимости от использованного в конструкции промотора (конститутивный или семя-специфичный) отмечалось увеличение содержания линолевой и линоленовой кислот на 6 и 12% соответственно и снижение уровня олеиновой кислоты на 20%. Отклонений в морфологии семян при этом не наблюдалось [88].
Следует отметить, что различия в биосинтезе запасных липидов характерны не только для разных организмов, но и для разных тканей одного вида. Например, показано, что у растений уровень экспрессии разных генов DGAT и их изоформ варьирует в широких пределах в разных тканях, органах и на разных этапах развития, а также в результате действия стрессовых факторов среды. На основе имеющихся экспериментальных данных сложно констатировать строгую ткане- и органоспецифичность для каждого типа DGAT, поскольку это, по-видимому, также зависит от вида растения. В целом можно с определенной долей уверенности утверждать, что гены, кодирующие все типы DGAT, функционируют и в генеративных, и в вегетативных органах растения (рис. 7). Так, для A. hypogaеa показано, что ген AhDGAT1-2 экспрессируется в корнях, семенах и семядолях, в то время как в органах цветка –AhDGAT1-1 и AhDGAT3-3 [73]. У G. max экспрессия генов G-mDGAT1, GmDGAT2 и GmDGAT3 выше в семенах, чем в листьях, в отличие от гена WS/DGAT, для которого характерен высокий уровень экспрессии в листьях (что согласуется с его основной функцией – синтезом восков) по сравнению с семенами. Максимальные уровни экспрессии предполагаемых генов GmDGAT3 характерны для околопучковых мезофильных клеток, клеток палисадной паренхимы, пыльцы, апикальной меристемы, семенной оболочки, одно- и трехлепестных листьев. У А. thaliana AtDGAT1 имеет важное значение для развития пыльцы и семян. AtDGAT2 может вносить основной вклад в образование TAГ в вегетативных тканях. Высокий уровень экспрессии AtDGAT3 отмечен в корне, пыльце, как в молодых, так и в стареющих листьях и ксилеме, а также во время прорастания семян. WS/DGAT А. thaliana характерен для клеток женских генеративных органов (лепестки, пестик, семязачаток, плодоножка) [53]. У E. guineensis экспрессия WS/DGAT на высоком уровне обнаруживалась в клетках эндосперма, мезокарпа, пыльцы, а также корня [67]. У O. europaea, одной из немногих плодовых культур, которая накапливает ТАГ не только в семенах, но и в мезокарпии плодов, за накопление TAГ в семенах ответственен, главным образом, DGAT1. А в мезокарпии в течение последних стадий созревания плода, когда ТАГ все еще синтезируются, наблюдается повышение экспрессии OeDGAT2 на фоне снижения экспрессии OeDGAT1 [42]. У E. guineensis было показано увеличение экспрессии генов EgDGAT1_1, EgDGAT3_1 и EgWS/DGAT_1 в семенах по сравнению с мезокарпием [67]. Для 14 видов из рода Euonymus было показано, что на стадии зрелого плода семена содержат около 5% ТАГ, а на долю АсДАГ приходится до 95% запасных липидов, в то время как в ариллусах наблюдается обратное соотношение между этими молекулярными видами ТАГ [15, 89], это, по-видимому, свидетельствует о том, что в разных частях плода Euonymus за накопление разных типов запасных липидов отвечают ферменты разных типов DGAT. Следует отметить, что в целом изменение уровня экспрессии генов, кодирующих разные типы DGAT, в процессе онтогенеза коррелирует в первую очередь с накоплением тех или иных ТАГ в составе запасных липидов. Так, например, у A. hypogaеa уровень экспрессии AhDGAT1-1 повышается в процессе формирования семян и достигает максимума на конечных стадиях развития [73]. Однако в исследовании, проведенном на R. communis, обнаружилась совершенно иная тенденция, а именно: когда уровень экспрессии DGAT1 R. communis достигал максимума (между 19 и 26 днями после опыления), соответствующий фермент выявлялся только на 47–54 день после опыления [90]. Тот факт, что накопление транскрипта значительно опережает трансляцию фермента указывает на то, что функционирование гена RcDGAT1 регулируется на пост-транскрипционном уровне. У А. thaliana, у которого выявлены четыре типа DGAT, в клетках зародыша и эндосперма не была обнаружена экспрессия генов AtDGAT3 и WS/DGAT [42].
Как отмечено выше, уровень экспрессии разных генов DGAT может варьировать в результате действия стрессовых факторов среды. Например, гомологи гена DGAT2 у Candida tropicalis могут быть ответственны за повышение накопления запасных ТАГ в условиях недостатка азота [91]. Среди растений было обнаружено, что экспрессия DGAT1 коррелирует с толерантностью к холоду у линий B. stricta [92].
Исследования по экспрессии дополнительной копии генов DGAT, выполненные на насекомых, млекопитающих, клетках дрожжей, водорослей и растениях, показали, что уровень экспрессии различных DGAT у живых организмов влияет на накопление и состав ТАГ. Например, экспрессия гена DGAT1 из А. thaliana в табаке и клетках дрожжей достоверно увеличивала содержание TAГ у трансформантов [93]. Гены DGAT1 А. thaliana (AtDGAT1) и B. napus (BnDGAT1) экспрессировали под контролем семя-специфичного промотора в семенах трансгенных растений B. napus. При этом ген AtDGAT1 экспрессировали в растениях B. napus сорта Quantum, а ген BnDGAT1 – в двойной гаплоидной линии DH12075 B. napus. Обе линии трансформантов растений продемонстрировали повышение содержания масла от 2.5 до 7% от массы сухого зерна, как в вегетационном опыте, так и в полевых испытаниях [94]. Экспрессия синтетической последовательности гена EaDAcT под контролем семя-специфичного промотора в А. thaliana привела к увеличению содержания АсДAГ, которые составили 40% от общего количества TAГ в масле семян А. thaliana [15]. Экспрессия дополнительной копии гена PtDGAT2 в водоросли Phaeodactylum tricornutum стимулировала образование большего количества олеосом и повышала содержание нейтральных липидов на 35%. Анализ состава ЖК при этом показал значительное увеличение доли полиненасыщенных ЖК [95]. Экспрессия гена DGАT2 из микроводоросли Chlamydomonas reinhardtii в А. thaliana увеличивала уровень TAГ, содержащих ЖК с очень длинной цепью (С24:0), в листьях [96]. Таким образом, многочисленные экспериментальные данные подтверждают, что уровень экспрессии различных DGAT у живых организмов влияет на накопление и состав ТАГ. Следует подчеркнуть, что эффективная экспрессия дополнительной копии гена DGAT у сельскохозяйственных культур открывает возможность для производства масел с измененными свойствами и тем самым способствует удовлетворению потребностей различных отраслей промышленности. Управление уровнем экспрессии генов ключевых ферментов пути Кеннеди на сегодняшний день является наиболее успешной стратегией по модификации количественного и качественного состава запасных липидов у B. napus, A. thaliana и Nicotiana tabacum (табак обыкновенный).
ЗАКЛЮЧЕНИЕ
Липиды и масла, получаемые из растений, являются основным источником жирных кислот в рационе человека и составляют большую часть ежедневно потребляемого калоража, а также источником химического сырья для различных отраслей промышленности и основой для получения высокоэнергетических биопродуктов. Фундаментальные исследования в отношении механизмов регуляции липидного обмена растений в сочетании с достижениями в области синтетической биологии делают возможным моделирование качественного и количественного состава липидов растений, т. е. обеспечивать возможность синтеза липидов с желательными биологическими, физическими и химическими свойствами. И хотя определенные успехи в этом направлении уже сделаны, дополнительные фундаментальные исследования все же требуют целостного подхода, поскольку многие вопросы метаболизма липидов, такие как сложность ацильного обмена и ремоделирование липидов, характеристика ортологичных ферментов для модификации липидов, доступность и локализация множественных пулов липидных субстратов в субклеточных компартментах и перемещение этих липидных составляющих между органеллами остаются мало изученными. Идентификация генов, кодирующих ферменты липидного метаболизма, в частности, DGAT, понимание их эволюционной истории у разных видов растений представляют собой важный шаг для полного знания потенциала DGAT в метаболической инженерии липидов, в частности, и биотехнологии растений, в целом. Хотя гены DGAT1, DGAT2, DGAT3, WS/DGAT и DAcT кодируют ферменты, которые выполняют общую функцию в образовании TAГ, они могут иметь разнящиеся картины экспрессии у разных видов растений, а также в разных органах и тканях у одного и того же вида. До сих пор мало известно о механизмах действия DGAT в синтезе ТАГ необычного состава. Существуют проблемы и в понимании эволюции растительных DGAT, поскольку крайне недостаточно данных о последовательностях генов DGAT1, DGAT2, DGAT3, WS/DGAT и DAcT для большинства видов растений (в том числе не масличных), происхождении каждого типа генов в отдельности и взаимоотношении эволюционных путей всех типов DGAT в целом. Для преодоления недостатка знаний о метаболизме растительных липидов требуется использовать комплексный подход, включающий современные биохимические, молекулярные и биоинформатические методы исследования. Новые акценты в характеристике тонкого механизма липидного обмена у растений, а также применение улучшенных технологий редактирования геномов и генов в будущем позволят исследователям контролировать и целенаправленно управлять метаболизмом липидов у растений, и эти знания и технологии сделают возможным получать растительные масла со строго заданными физико-химическими свойствами.
Работа выполнена в рамках научного проекта, при финансовой поддержке госзадания 0106-2019-0002 и при поддержке Российского научного фонда в рамках реализации проекта 17-74-10127 “Особенности функционирования растительных sn-1,2-диацил-3-ацил-трансфераз с различной субстратной специфичностью”.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
База данных статистической информации (2001). https://www.statista.com/statistics/263978/global-vegetable-oil-production-since-2000-2001/ Cited 27 January 2021.
База данных информации о биодизеле (2021). http://biodiesel.org/production/production-statistics. Cited 7 May 2021.
Сайт Министерства сельского хозяйства США, служба экономических исследований (2021). https:// www.ers.usda.gov/data-products/us-bioenergy-statistics/ Cited 20 April 2021.
Сайт Министерства сельского хозяйства США (2021). http://usda.mannlib.cornell.edu/MannUsda/ viewDocumentInfo.do?documentID=1290. Cited 7 May 2021.
Zweytick D., Athenstaedt K., Daum G. Intracellular lipid particles of eukaryotic cells // Biochim. Biophys. Acta. 2000. V. 1469. P. 101. https://doi.org/10.1016/S0005-2736(00)00294-7
Верещагин А.Г. Биохимия триглицеридов. Москва: Наука, 1972. 308 с.
Rezanka T., Lukavsky J., Nedbalova L., Sigler K. Production of structured triacylglycerols from microalgae // Phytochemistry. 2014. V. 104. P. 95. https://doi.org/10.1016/J.PHYTOCHEM.2014.04.013
Mu H., Porsgaard T. The metabolism of structured triacylglycerols // Prog. Lipid Res. 2005. V. 44. P. 430. https://doi.org/10.1016/J.PLIPRES.2005.09.002
Kubow S. The influence of positional distribution of fatty acids in native, interesterified and structure-specific lipids on lipoprotein metabolism and atherogenesis // J. Nutr. Biochem. 1996. V. 7. P. 530. https://doi.org/10.1016/S0955-2863(96)00106-4
Quinlan P., Moore S. Modification of triglycerides by lipases: process technology and its application to the production of nutritionally improved fats // Inform. 1993. V. 4. P. 580.
Takeuchi H., Kasai M., Taguchi N., Tsuji H., Suzuki M. Effect of Triacylglycerols Containing Medium- and Long-Chain Fatty Acids on Serum Triacylglycerol Levels and Body Fat in College Athletes. // J. Nutr. Sci. Vitaminol. 2002. V. 48. P. 109. https://doi.org/10.3177/jnsv.48.109
Kunesova M., Braunerova R., Hlavaty P., Tvrzicka E., Stankova B., Skrha J., Hilgertova J., Hill M., Kopecky J., Wagenknecht M., Hainer V., Matoulek M., Parizkova J., Zak A., Svacina S. The Influence of n-3 Polyunsaturated Fatty Acids and Very Low Calorie Diet during a Short-term Weight Reducing Regimen on Weight Loss and Serum Fatty Acid Composition in Severely Obese Women // Physiol. Res. 2006. V. 55. P. 63.
Andrikopoulos N.K. Triglyceride species compositions of common edible vegetable oils and methods used for their identification and quantification // Food Rev. Int. 2002. V. 18. P. 71. https://doi.org/10.1081/FRI-120003418
Phillips B.E., Smith C.R. Stereospecific analysis of triglycerides from Monnina emarginata seed oil // Lipids. 1972. V. 7. P. 215. https://doi.org/10.1007/BF02533067
Durrett T.P., McClosky D.D., Tumaney A.W., Elzinga D.A., Ohlrogge J., Pollard M. A distinct DGAT with sn-3 acetyltransferase activity that synthesizes unusual, reduced-viscosity oils in Euonymus and transgenic seeds // Proc. Natl. Acad. Sci. U. S. A. 2010. V. 107. P. 9464. https://doi.org/10.1073/pnas.1001707107
Sorensen L.B., Cueto H.T., Andersen M.T., Bitz C., Holst J.J., Rehfeld J.F., Astrup A. The Effect of Salatrim, a Low-Calorie Modified Triacylglycerol, on Appetite and Energy Intake // Am. J. Clin. Nutr. 2008. V. 87. P. 1163.
Yang H., Park J., Yoon J., Kim M., Jhon G., Han S., Kim S. Stimulatory effects of monoacetyldiglycerides on hematopoiesis // Biol. Pharm. Bull. 2004. V. 27. P. 1121.
Jeong J., Kim Y.-J., Yoon S.Y., Kim Y.-J., Kim J.H., Sohn K.-Y., Kim H.-J., Han Y.-H., Chong S., Kim J.W. PLAG (1-Palmitoyl-2-Linoleoyl-3-Acetyl-rac-Glycerol) Modulates Eosinophil Chemotaxis by Regulating CCL26 Expression from Epithelial Cells // PLoS One. 2016. V. 11: e0151758. https://doi.org/10.1371/journal.pone.0151758
Kim Y.-J., Jeong J., Shin S.-H., Lee D.Y., Sohn K.-Y., Yoon S.Y., Kim J.W. Mitigating Effects of 1-Palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) on Hematopoietic Acute Radiation Syndrome after Total-Body Ionizing Irradiation in Mice // Radiat. Res. 2019. V. 192. P. 602. https://doi.org/10.1667/rr15440.1
Jeong J., Kim Y.J., Lee D.Y., Moon B.G., Sohn K.Y., Yoon S.Y., Kim J.W. 1-Palmitoyl-2-linoleoyl-3-acetyl-rac-glycerol (PLAG) attenuates gemcitabine-induced neutrophil extravasation 11 Medical and Health Sciences 1112 Oncology and Carcinogenesis // Cell Biosci. 2019. V. 9: 4. https://doi.org/10.1186/s13578-018-0266-7
Řezanka T., Schreiberová O., Čejková A., Sigler K. The genus Dracunculus – A source of triacylglycerols containing odd-numbered ω-phenyl fatty acids // Phytochemistry. 2011. V. 72. P. 1914. https://doi.org/10.1016/J.PHYTOCHEM.2011.04.020
Kaneda M., Mizutani K., Takahashi Y., Kurono G., Nishikawa Y. Lilioside A and B − two new glycerol glucosides isolated from Lilium longifolium Thunb. // Tetrahedron Lett. 1974. V. 15. P. 3937.
Athenstaedt K., Daum G. The life cycle of neutral lipids: synthesis, storage and degradation // Cell. Mol. Life Sci. 2006. V. 63. P. 1355. https://doi.org/10.1007/s00018-006-6016-8
Lung S.-C., Weselake R.J. Diacylglycerol acyltransferase: a key mediator of plant triacylglycerol synthesis. // Lipids. 2006. V. 41. P. 1073.
Dahlqvist A., Stahl U., Lenman M., Banas A., Lee M., Sandager L., Ronne H., Stymne S. Phospholipid:diacylglycerol acyltransferase: An enzyme that catalyzes the acyl-CoA-independent formation of triacylglycerol in yeast and plants // Proc. Natl. Acad. Sci. U. S. A. 2000. V. 97. P. 6487. https://doi.org/10.1073/pnas.120067297
Kennedy E.P. Biosynthesis of complex lipids // Fed. Proc. 1961. V. 20. P. 934.
Saha S., Enugutti B., Rajakumari S., Rajasekharan R. Cytosolic Triacylglycerol Biosynthetic Pathway in Oilseeds. Molecular Cloning and Expression of Peanut Cytosolic Diacylglycerol Acyltransferase // Plant Physiol. 2006. V. 141. P. 1533. https://doi.org/10.1104/pp.106.082198
Frentzen M. Acyltransferases and triacylglycerols // Lipid metabolism in plants / Ed. Moore T.S. Boca Raton: CRC Press Taylor and Francis Group, 1993. P. 195.
Jako C., Kumar A., Wei Y., Zou J., Barton D.L., Giblin E.M., Covello P.S., Taylor D.C. Seed-specific over-expression of an Arabidopsis cDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight // Plant Physiol. 2001. V. 126. P. 861.
Wang H., Guo J., Lambert K.N., Lin Y. Developmental control of Arabidopsis seed oil biosynthesis // Planta. 2007. V. 226. P. 773. https://doi.org/10.1007/s00425-007-0524-0
Weiss S.B., Kesnedy E.P., Kiyasu J.Y. The Enzymatic Synthesis of Triglycerides // J. Biol. Chem. 1960. V. 235. P. 40.
Hofmann K. A superfamily of membrane-bound O-acyltransferases with implications for Wnt signaling // Trends Biochem. Sci. 2000. V. 25. P. 111. https://doi.org/10.1016/S0968-0004(99)01539-X
Hobbs D.H., Lu C., Hills M.J. Cloning of a cDNA encoding diacylglycerol acyltransferase from Arabidopsis thaliana and its functional expression // FEBS Lett. 1999. V. 452. P. 145. https://doi.org/10.1016/S0014-5793(99)00646-8
Giannoulia K., Haralampidis K., Poghosyan Z., Murphy D.J., Hatzopoulos P. Differential expression of diacylglycerol acyltransferase (DGAT) genes in olive tissues // Biochem. Soc. Trans. 2000. V. 28. P. 695. https://doi.org/10.1042/BST0280695
Nykiforuk C.L., Furukawa-Stoffer T.L., Huff P.W., Sarna M., Laroche A., Moloney M.M., Weselake R.J. Characterization of cDNAs encoding diacylglycerol acyltransferase from cultures of Brassica napus and sucrose-mediated induction of enzyme biosynthesis // Biochim. Biophys. Acta. 2002. V. 1580. P. 95. https://doi.org/10.1016/S1388-1981(01)00200-1
He X., Turner C., Chen G.Q., Lin J.-T., McKeon T.A. Cloning and characterization of a cDNA encoding diacylglycerol acyltransferase from castor bean // Lipids. 2004. V. 39. P. 311. https://doi.org/10.1007/s11745-004-1234-2
Shockey J.M., Gidda S.K., Chapital D.C., Kuan J.-C., Dhanoa P.K., Bland J.M., Rothstein S.J., Mullen R.T., Dyer J.M. Tung tree DGAT1 and DGAT2 have nonredundant functions in triacylglycerol biosynthesis and are localized to different subdomains of the endoplasmic reticulum. // Plant Cell. 2006. V. 18. P. 2294. https://doi.org/10.1105/tpc.106.043695
Xu J., Francis T., Mietkiewska E., Giblin E.M., Barton D.L., Zhang Y., Zhang M., Taylor D.C. Cloning and characterization of an acyl-CoA-dependent diacylglycerol acyltransferase 1 (DGAT1) gene from Tropaeolum majus, and a study of the functional motifs of the DGAT protein using site-directed mutagenesis to modify enzyme activity and oil conten // Plant Biotechnol. J. 2008. V. 6. P. 799. https://doi.org/10.1111/j.1467-7652.2008.00358.x
Sun L., Ouyang C., Kou S., Wang S., Yao Y., Peng T., Xu Y., Tang L., Chen F. Cloning and characterization of a cDNA encoding type 1 diacylglycerol acyltransferase from sunflower (Helianthus annuus L.) // Z. Naturforsch., C: J. Biosci. 2011. V. 66. P. 63.
Arroyo-Caro J.M., Mañas-Fernández A., Alonso D.L., García-Maroto F. Type I Diacylglycerol Acyltransferase (MtDGAT1) from Macadamia tetraphylla: Cloning, Characterization, and Impact of Its Heterologous Expression on Triacylglycerol Composition in Yeast // J. Agric. Food Chem. 2016. V. 64. P. 277. https://doi.org/10.1021/acs.jafc.5b04805
Zhou X.-R., Shrestha P., Yin F., Petrie J.R., Singh S.P. AtDGAT2 is a functional acyl-CoA:diacylglycerol acyltransferase and displays different acyl-CoA substrate preferences than AtDGAT1 // FEBS Lett. 2013. V. 587. P. 2371. https://doi.org/10.1016/j.febslet.2013.06.003
Banilas G., Karampelias M., Makariti I., Kourti A., Hatzopoulos P. The olive DGAT2 gene is developmentally regulated and shares overlapping but distinct expression patterns with DGAT1 // J. Exp. Bot. 2011. V. 62. P. 521. https://doi.org/10.1093/jxb/erq286
Hernández M.L., Whitehead L., He Z., Gazda V., Gilday A., Kozhevnikova E., Vaistij F.E., Larson T.R., Graham I.A. A cytosolic acyltransferase contributes to triacylglycerol synthesis in sucrose-rescued Arabidopsis seed oil catabolism mutants // Plant Physiol. 2012. V. 160. P. 215. https://doi.org/10.1104/pp.112.201541
Rani S.H., Saha S., Rajasekharan R. A soluble diacylglycerol acyltransferase is involved in triacylglycerol biosynthesis in the oleaginous yeast Rhodotorula glutinis // Microbiology. 2013. V. 159. P. 155. https://doi.org/10.1099/mic.0.063156-0
Bagnato C., Prados M.B., Franchini G.R., Scaglia N., Miranda S.E., Beligni M. V. Analysis of triglyceride synthesis unveils a green algal soluble diacylglycerol acyltransferase and provides clues to potential enzymatic components of the chloroplast pathway // BMC Genomics. 2017. V. 18. P. 223. https://doi.org/10.1186/s12864-017-3602-0
Kalscheuer R., Steinbüchel A. A novel bifunctional wax ester synthase/acyl-CoA:diacylglycerol acyltransferase mediates wax ester and triacylglycerol biosynthesis in Acinetobacter calcoaceticus ADP1 // J. Biol. Chem. 2003. V. 278. P. 8075. https://doi.org/10.1074/jbc.M210533200
King A., Nam J.W., Han J., Hilliard J., Jaworski J.G. Cuticular wax biosynthesis in petunia petals: Cloning and characterization of an alcohol-acyltransferase that synthesizes wax-esters // Planta. 2007. V. 226. P. 381. https://doi.org/10.1007/s00425-007-0489-z
Li F., Wu X., Lam P., Bird D., Zheng H., Samuels L., Jetter R., Kunst L. Identification of the wax ester synthase/acyl-coenzyme A: diacylglycerol acyltransferase WSD1 required for stem wax ester biosynthesis in Arabidopsis // Plant Physiol. 2008. V. 148. P. 97. https://doi.org/10.1104/pp.108.123471
Bansal S., Durrett T.P. Defining the extreme substrate specificity of Euonymus alatus diacylglycerol acetyltransferase, an unusual membrane-bound O-acyltransferase // Biosci. Rep. 2016. V. 36: e00406. https://doi.org/10.1042/BSR20160277
Petronikolou N., Nair S.K. Structural and Biochemical Studies of a Biocatalyst for the Enzymatic Production of Wax Esters // ACS Catal. 2018. V. 8. P. 6334. https://doi.org/10.1021/acscatal.8b00787
Cao H. Structure-function analysis of diacylglycerol acyltransferase sequences from 70 organisms // BMC Res. Notes. 2011. V. 4. P. 249. https://doi.org/10.1186/1756-0500-4-249
Lopes J.L.S., Beltramini L.M., Wallace B.A., Araujo A.P.U. Deconstructing the DGAT1 Enzyme: Membrane Interactions at Substrate Binding Sites. 2015. V. 10: e0124336. https://doi.org/10.1371/journal.pone.0118407
Turchetto-Zolet C.A., Christoff P.A., Kulcheski F.R., Loss-Morais G., Margis R., Margis-Pinheiro M. Diversity and evolution of plant diacylglycerol acyltransferase (DGATs) unveiled by phylogenetic, gene structure and expression analyses // Genet. Mol. Biol. 2016. V. 39. P. 524. https://doi.org/10.1590/1678-4685-GMB-2016-0024
Light S., Sagit R., Ekman D., Elofsson A. Long indels are disordered: A study of disorder and indels in homologous eukaryotic proteins // Biochim. Biophys. Acta. 2013. V. 1834. P. 890. https://doi.org/10.1016/j.bbapap.2013.01.002
Caldo K.M.P., Acedo J.Z., Panigrahi R., Vederas J.C., Weselake R.J., Lemieux M.J. Diacylglycerol Acyltransferase 1 Is Regulated by Its N-Terminal Domain in Response to Allosteric Effectors // Plant Physiol. 2017. V. 175. P. 667. https://doi.org/10.1104/pp.17.00934
Bürgi J., Xue B., Uversky V.N., Gisou Van Der Goot F. Intrinsic Disorder in Transmembrane Proteins: Roles in Signaling and Topology Prediction // PLoS One. 2016. V. 11: e0158594. https://doi.org/10.1371/journal.pone.0158594
Trudeau T., Nassar R., Cumberworth A., Wong E.T.C., Woollard G., Gsponer J. Structure and intrinsic disorder in protein autoinhibition // Structure. 2013. V. 21. P. 332. https://doi.org/10.1016/j.str.2012.12.013
Wright P.E., Dyson H.J. Intrinsically Disordered Proteins in Cellular Signaling and Regulation HHS Public Access // Nat. Rev. Mol. Cell Biol. 2015. V. 16. P. 18. https://doi.org/10.1038/nrm3920
Liu Q., Siloto R.M.P., Lehner R., Stone S.J., Weselake R.J. Acyl-CoA:diacylglycerol acyltransferase: Molecular biology, biochemistry and biotechnology // Prog. Lipid Res. 2012. V. 51. P. 350. https://doi.org/10.1016/j.plipres.2012.06.001
Lopes J.L.S., Nobre T.M., Cilli E.M., Beltramini L.M., Araújo A.P.U., Wallace B.A. Deconstructing the DGAT1 enzyme: Binding sites and substrate interactions // Biochim. Biophys. Acta. 2014. V. 1838. P. 3145. https://doi.org/10.1016/J.BBAMEM.2014.08.017
Xu Y., Caldo K.M.P., Pal-Nath D., Ozga J., Lemieux M.J., Weselake R.J., Chen G. Properties and Biotechnological Applications of Acyl-CoA:diacylglycerol Acyltransferase and Phospholipid:diacylglycerol Acyltransferase from Terrestrial Plants and Microalgae // Lipids. 2018. V. 53. P. 663. https://doi.org/10.1002/lipd.12081
McCartney A.W., Dyer J.M., Dhanoa P.K., Kim P.K., Andrews D.W., McNew J.A., Mullen R.T. Membrane-bound fatty acid desaturases are inserted co-translationally into the ER and contain different ER retrieval motifs at their carboxy termini // Plant J. 2004. V. 37. P. 156. https://doi.org/10.1111/j.1365-313X.2004.01949.x
Mañas-Fernández A., Vilches-Ferrón M., Garrido-Cárdenas J.A., Belarbi E.H., Alonso D.L., García-Maroto F. Cloning and molecular characterization of the acyl-CoA:Diacylglycerol Acyltransferase 1 (DGAT1) gene from echium // Lipids. 2009. V. 44. P. 555. https://doi.org/10.1007/s11745-009-3303-9
Jolivet P., Boulard C., Bellamy A., Larré C., Barre M., Rogniaux H., d’Andréa S., Chardot T., Nesi N. Protein composition of oil bodies from mature Brassica napus seeds // Proteomics. 2009. V. 9. P. 3268. https://doi.org/10.1002/pmic.200800449
Zheng P., Allen W.B., Roesler K., Williams M.E., Zhang S., Li J., Glassman K., Ranch J., Nubel D., Solawetz W., Bhattramakki D., Llaca V., Deschamps S., Zhong G.Y., Tarczynski M.C., Shen B. A phenylalanine in DGAT is a key determinant of oil content and composition in maize // Nat. Genet. 2008. V. 40. P. 367. https://doi.org/10.1038/ng.85
Zhou X.-R., Shrestha P., Yin F., Petrie J.R., Singh S.P. AtDGAT2 is a functional acyl-CoA:diacylglycerol acyltransferase and displays different acyl-CoA substrate preferences than AtDGAT1 // FEBS Lett. 2013. V. 587. P. 2371. https://doi.org/10.1016/j.febslet.2013.06.003
Rosli R., Chan P.-L., Chan K.-L., Amiruddin N., Low E.-T.L., Singh R., Harwood J.L., Murphy D.J. In silico characterization and expression profiling of the diacylglycerol acyltransferase gene family (DGAT1, DGAT2, DGAT3 and WS/DGAT) from oil palm, Elaeis guineensis // Plant Sci. 2018. V. 275. P. 84. https://doi.org/10.1016/J.PLANTSCI.2018.07.011
Liu Q., Siloto R.M.P., Snyder C.L., Weselake R.J. Functional and topological analysis of yeast acyl-CoA:diacylglycerol acyltransferase 2, an endoplasmic reticulum enzyme essential for triacylglycerol biosynthesis // J. Biol. Chem. 2011. V. 286. P. 13115. https://doi.org/10.1074/jbc.M110.204412
Stone S.J., Levin M.C., Farese R.V. Membrane topology and identification of key functional amino acid residues of murine acyl-CoA:diacylglycerol acyltransferase-2 // J. Biol. Chem. 2006. V. 281. P. 40273. https://doi.org/10.1074/jbc.M607986200
Kroon J.T.M., Wei W., Simon W.J., Slabas A.R. Identification and functional expression of a type 2 acyl-CoA:diacylglycerol acyltransferase (DGAT2) in developing castor bean seeds which has high homology to the major triglyceride biosynthetic enzyme of fungi and animals // Phytochemistry. 2006. V. 67. P. 2541. https://doi.org/10.1016/J.PHYTOCHEM.2006.09.020
Cao H., Shockey J.M., Klasson K.T., Chapital D.C., Mason C.B., Scheffler B.E. Developmental Regulation of Diacylglycerol Acyltransferase Family Gene Expression in Tung Tree Tissues // PLoS One. 2013. V. 8: e76946. https://doi.org/10.1371/journal.pone.0076946
Aymé L., Arragain S., Canonge M., Baud S., Touati N., Bimai O., Jagic F., Louis-Mondésir C., Briozzo P., Fontecave M., Chardot T. Arabidopsis thaliana DGAT3 is a [2Fe-2S] protein involved in TAG biosynthesis // Sci. Rep. 2018. V. 8. https://doi.org/10.1038/s41598-018-35545-7
Chi X., Hu R., Zhang X., Chen M., Chen N., Pan L., Wang T., Wang M., Yang Z., Wang Q., Yu S. Cloning and functional analysis of three diacylglycerol acyltransferase genes from peanut (Arachis hypogaea L.) // PLoS One. 2014. V. 9. P. 1. https://doi.org/10.1371/journal.pone.0105834
Villa J.A., Cabezas M., de la Cruz F., Moncalián G. Use of limited proteolysis and mutagenesis to identify folding domains and sequence motifs critical for wax ester synthase/acyl coenzyme A:Diacylglycerol acyltransferase activity // Appl. Environ. Microbiol. 2014. V. 80. P. 1132. https://doi.org/10.1128/AEM.03433-13
Tran T.N.T., Shelton J., Brown S., Durrett T.P. Membrane topology and identification of key residues of EaDAcT, a plant MBOAT with unusual substrate specificity // Plant J. 2017. V. 92. P. 82. https://doi.org/10.1111/tpj.13636
Turchetto-Zolet C.A., Maraschin F.S., De Morais G.L., Cagliari A., Andrade C.M.B., Margis-Pinheiro M., Margis R. Evolutionary view of acyl-CoA diacylglycerol acyltransferase (DGAT), a key enzyme in neutral lipid biosynthesis // BMC Evol. Biol. 2011. V. 11. P. 263. https://doi.org/10.1186/1471-2148-11-263
Milcamps A., Tumaney A.W., Paddock T., Pan D.A., Ohlrogge J., Pollard M. Isolation of a gene encoding a 1,2-diacylglycerol-sn-acetyl-CoA acetyltransferase from developing seeds of Euonymus alatus // J. Biol. Chem. 2005. V. 280. P. 5370. https://doi.org/10.1074/jbc.M410276200
Zou J., Wei Y., Jako C., Kumar A., Selvaraj G., Taylor D.C. The Arabidopsis thaliana TAG1 mutant has a mutation in a diacylglycerol acyltransferase gene // Plant J. 1999. V. 19. P. 645. https://doi.org/10.1046/j.1365-313x.1999.00555.x
Du X., Herrfurth C., Gottlieb T., Kawelke S., Feussner K., Rühling H., Feussner I., Maniak M. Dictyostelium discoideum Dgat2 can substitute for the essential function of Dgat1 in triglyceride production but not in ether lipid synthesis // Eukaryot. Cell. 2014. V. 13. P. 517. https://doi.org/10.1128/EC.00327-13
Bouvier-Navé P., Benveniste P., Oelkers P., Sturley S.L., Schaller H. Expression in yeast and tobacco of plant cDNAs encoding acyl CoA:diacylglycerol acyltransferase // Eur. J. Biochem. 2000. V. 267. P. 85. https://doi.org/10.1046/j.1432-1327.2000.00961.x
Zhang H., Damude H.G., Yadav N.S. Three diacylglycerol acyltransferases contribute to oil biosynthesis and normal growth in Yarrowia lipolytica // Yeast. 2012. V. 29. P. 25. https://doi.org/10.1002/yea.1914
Aymé L., Jolivet P., Nicaud J.-M., Chardot T. Molecular Characterization of the Elaeis guineensis Medium-Chain Fatty Acid Diacylglycerol Acyltransferase DGAT1-1 by Heterologous Expression in Yarrowia lipolytica // PLoS One. 2015. V. 10: e0143113. https://doi.org/e0143113. https://doi.org/10.1371/journal.pone.0143113
Li R., Yu K., Hildebrand D.F. DGAT1, DGAT2 and PDAT Expression in Seeds and Other Tissues of Epoxy and Hydroxy Fatty Acid Accumulating Plants // Lipids. 2010. V. 45. P. 145. https://doi.org/10.1007/s11745-010-3385-4
Chen Y., Cui Q., Xu Y., Yang S., Gao M., Wang Y. Effects of tung oilseed FAD2 and DGAT2 genes on unsaturated fatty acid accumulation in Rhodotorula glutinis and Arabidopsis thaliana // Mol. Genet. Genomics. 2015. V. 290. P. 1605. https://doi.org/10.1007/s00438-015-1011-0
Burgal J., Shockey J., Lu C., Dyer J., Larson T., Graham I., Browse J. Metabolic engineering of hydroxy fatty acid production in plants: RcDGAT2 drives dramatic increases in ricinoleate levels in seed oil // Plant Biotechnol. J. 2008. V. 6. P. 819. https://doi.org/10.1111/j.1467-7652.2008.00361.x
Du M., Liu X., Liu X., Yin X., Han S., Song Q., An S. Glycerol-3-phosphate O-acyltransferase is required for PBAN-induced sex pheromone biosynthesis in Bombyx mori // Sci. Rep. 2015. V. 5: 8110. https://doi.org/10.1038/srep08110
Barbosa A.D., Lim K., Mari M., Edgar J.R., Gal L., Sterk P., Jenkins B.J., Koulman A., Savage D.B., Schuldiner M., Reggiori F., Wigge P.A., Siniossoglou S. Compartmentalized Synthesis of Triacylglycerol at the Inner Nuclear Membrane Regulates Nuclear Organization // Dev. Cell. 2019. V. 50. P. 755. https://doi.org/10.1016/j.devcel.2019.07.009
Misra A., Khan K., Niranjan A., Nath P., Sane V.A. Over-expression of JcDGAT1 from Jatropha curcas increases seed oil levels and alters oil quality in transgenic Arabidopsis thaliana // Phytochemistry. 2013. V. 96. P. 37. https://doi.org/10.1016/J.PHYTOCHEM.2013.09.020
Sidorov R.A., Zhukov A.V., Pchelkin V.P., Vereshchagin A.G., Tsydendambaev V.D. Content and Fatty Acid Composition of Neutral Acylglycerols in Euonymus Fruits // J. Am. Oil Chem. Soc. 2014. V. 91. P. 805. https://doi.org/10.1007/s11746-014-2425-2
McKeon T.A., He X. Castor diacylglycerol acyltransferase type 1 (DGAT1) displays greater activity with diricinolein than Arabidopsis DGAT1 // Biocatal. Agric. Biotechnol. 2015. V. 4. P. 276. https://doi.org/10.1016/j.bcab.2015.01.005
Dey P., Chakraborty M., Kamdar M.R., Maiti M.K. Functional characterization of two structurally novel diacylglycerol acyltransferase2 isozymes responsible for the enhanced production of stearate-rich storage lipid in Candida tropicalis SY005 // PLoS One. 2014. V. 9: e94472. https://doi.org/10.1371/journal.pone.0094472
Arisz S.A., Heo J.Y., Koevoets I.T., Zhao T., van Egmond P., Meyer A.J., Zeng W., Niu X., Wang B., Mitchell-Olds T., Schranz M.E., Testerink C. Diacylglycerol acyltransferase1 contributes to freezing tolerance // Plant Physiol. 2018. V. 177. P. 1410. https://doi.org/10.1104/pp.18.00503
Xu Y., Chen G., Greer M.S., Caldo K.M.P., Ramakrishnan G., Shah S., Wu L., Lemieux M.J., Ozga J., Weselake R.J. Multiple mechanisms contribute to increased neutral lipid accumulation in yeast producing recombinant variants of plant diacylglycerol acyltransferase 1 // J. Biol. Chem. 2017. V. 292. P. 17819. https://doi.org/10.1074/jbc.M117.811489
Taylor D.C. Zhang Y., Kumar A., Francis T., Giblin E.M., Barton D.L., Ferrie J.R., Laroche A., Shah S., Zhu W., Snyder C.L., Hall L., Rakow G., Harwood J.L., Weselake R.J. Molecular modification of triacylglycerol accumulation by over-expression of DGAT1 to produce canola with increased seed oil content under field conditions // Botany. 2009. V. 87. P. 533. https://doi.org/10.1139/B08-101
Niu Y.-F., Zhang M.-H., Li D.-W., Yang W.-D., Liu J.-S., Bai W.-B., Li H.-Y. Improvement of neutral lipid and polyunsaturated fatty acid biosynthesis by overexpressing a type 2 diacylglycerol acyltransferase in marine diatom Phaeodactylum tricornutum // Mar. Drugs. 2013. V. 11. P. 4558. https://doi.org/10.3390/md11114558
Sanjaya, Miller R., Durrett T.P., Kosma D.K., Lydic T.A., Muthan B., Koo A.J.K., Bukhman Y.V., Reid G.E., Howe G.A., Ohlrogge J., Benning C. Altered Lipid Composition and Enhanced Nutritional Value of Arabidopsis Leaves following Introduction of an Algal Diacylglycerol Acyltransferase 2 // Plant Cell. 2013. V. 25. P. 677. https://doi.org/10.1105/tpc.112.104752
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений