Физиология растений, 2022, T. 69, № 1, стр. 54-67
Нитратный сигналинг в растениях. Эволюционные аспекты
А. В. Никитин a, *, С. Ф. Измайлов a
a Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: nitrogenexchange@mail.ru
Поступила в редакцию 11.02.2021
После доработки 15.04.2021
Принята к публикации 17.04.2021
- EDN: PAQQHP
- DOI: 10.31857/S0015330322010158
Аннотация
В сопряжении с распознаванием (сенсинг) и транспортом рассматриваются сигнальные свойства нитрата (${\text{NO}}_{3}^{ - }$) у видов, различающихся в эволюционно-таксономическом отношении, от примитивных прокариот до цветковых растений. На основании сравнительно-физиологического анализа авторы делают предположения о некоторых путях филогенетического становления сигнальных каскадов, запускаемых указанным ионом. Возможно, нитрат возник на Земле еще в катархее при анаэробном характере первичной атмосферы. Далее появился оксигенный фотосинтез, создав предпосылки для нитрификации как главного источника ${\text{NO}}_{3}^{ - }$. Возрастающий градиент уровней нитрата в среде способствовал созданию полиморфизма его низко- и высокоаффинных сенсоров и транспортеров. Система сенсинга и сигналинга нитрата от прокариот была унаследована эукариотами, получив у них дальнейшее развитие. У цветковых растений налицо становление новых регуляторных механизмов, определяющих возможность тонкой настройки сенсинга и поглощения разных доз ${\text{NO}}_{3}^{ - }$ с участием транспортеров соответствующего сродства. В зависимости от органно-тканевой локализации данного иона расширяется спектр его сенсоров, что определяет метаболическую направленность основных функций растений, связанную с усвоением азота, фотосинтезом, ростовыми и продукционными процессами.
ВВЕДЕНИЕ
Обзор является логическим продолжением серии наших предшествующих публикаций, посвященных создающемуся за последние десятилетия новому разделу физиологии и биохимии − нитратному сигналингу. В предшествующих обзорах [1, 2] освещались вопросы, относящиеся к возникновению исследований в этой области как следствию создания новых инструментальных возможностей в ряде смежных биологических дисциплин на рубеже XX−XXI веков. Подводились итоги результатам первых изысканий по идентификации путей сенсинга и транспорта нитрата в связи с дальнейшей каскадной природой сигналинга азотного, углеродного, вторичного обмена, а также механизмов ее реализации. В данном обзоре рассматривается процесс эволюции нитратного сигналинга как явления, начиная от его формирования с последующей модификацией и усложнением. Используемый сравнительно-физиологический подход позволяет не только рассмотреть филогенетическое развитие механизмов регуляторного действия нитрата, но и его современный результат − полиморфизм проявлений на организменном уровне.
ПРЕДПОСЫЛКИ НИТРАТНОГО СИГНАЛИНГА В КАТАРХЕЕ
Бытует представление, что нитрат (${\text{NO}}_{3}^{ - }$) практически полностью представляет собой продукт биогенной нитрификации. Это обстоятельство, а также гипотеза об анаэробном характере первичной атмосферы, позволили предположить, что азот в добиологический катархейский эон − 4.5−4.0 млрд. лет назад (далее млрд. л. н.) был в восстановленных формах, таких как аммоний и цианид. Однако уже тогда, по-видимому, происходил электрохимический синтез нитрата с участием СО2 как донора кислорода [3–5]. Ввиду фотолиза и восстановления двухвалентным железом вероятная концентрация нитрата при рН 6−8 и температуре 0−50°С была не более 1 мкМ [3, 5].
Однако существует и другая точка зрения. Уже в самом начале существования географической оболочки Земли было возможно и локальное обогащение среды нитратом до концентрации 10–20 мМ [3, 4]. В частности, оно могло иметь место в дождевой воде, вследствие образования при грозовых разрядах оксидов азота и их дальнейшей реакции с капельно-жидкой водой в облаках. С учетом того, что в круг продуктов первичного электросинтеза наряду с органическими веществами входил и нитрат, было весьма вероятно совместное их накопление, в силу чего указанный ион оказался своего рода маркером гидрохимической обстановки, необходимой для абиогенеза. Отсюда и следствие − возможность появления первичных реакций сенсинга нитрата уже у ранних организмов как адаптации к поиску абиогенных органических соединений.
СТАНОВЛЕНИЕ НИТРАТНОГО СИГНАЛИНГА В АРХЕЕ
Изменение окружающей среды
В архее (4.0−2.5 млрд. л. н.) началось активное преобразование среды обитания прокариотами. Не позднее 3.2 млрд. л. н. появились цианобактерии с оксигенным фотосинтезом, их колонии на поверхности биогенных карбонатных построек − строматолитов стали первыми аэробными оазисами [6]. 2.7 млрд. л. н. последние распространились по всему шельфу [7]. Уже в самых древних образцах строматолитов выявлены следы активности диазотрофов, нитрификаторов и денитрификаторов, совместно реализующих замкнутый цикл азота современного типа [8–10]. Вероятно, соответствующие прокариоты находились в разных слоях бактериальных матов, различающихся по уровню кислорода и, соответственно, нитрата. Иными словами, последний был маркером аэробной микросреды. Однако, как отражено на рис. 1а, на протяжении всего архейского эона основная часть Мирового океана оставалась анаэробной, что обусловило преобладание аммонийной формы азота.
Рис. 1.
Геохимия нитрата в основные эоны геологической истории: а – архей, б – протерозой, в – фанерозой. Вертикальными стрелками обозначено отложение пирита (FeS) и оксидов железа (FexOy).

Вышеописанные особенности архейских биогеоценозов определили возможность дифференцированного сенсинга нитрата в низких (микромолярных) и высоких (миллимолярных) концентрациях, начиная с наиболее ранних этапов биологической эволюции. Весьма вероятно, что связь определенных диапазонов уровня указанного иона с микроусловиями среды, оптимальными для конкретных групп прокариот, стала движущей силой эволюционного становления первичных каскадов нитратного сигналинга.
Сенсинг и поглощение нитрата прокариотами
Активные исследования сенсинга нитрата бактериями имели место уже в конце 1980-х гг., что было связано со сравнительной легкостью работы с указанными объектами. Так, у Escherichia coli были выявлены рецепторные гистидиновые протеинкиназы NarX, NtrB и NarQ [11, 12]. У других протеобактерий обнаружены Nar-белки одного типа − NarX или NarQ [13]. Показана способность названных сенсоров нитрата к автофосфорилированию в его присутствии [12].
У ряда прокариот найдены высокоаффинные сенсоры и транспортеры нитрата: NreА (константа диссоциации соответствующего комплекса KD 22 мкМ) Staphylococcus carnosus Schliefer & Fischer [14] и NrtB (KM порядка 1 мкМ) Synechococcus sp. PCC7942 [15], одной из наиболее примитивных цианобактерий [16], соответственно. Такие белки могли быть унаследованы от видов первичной биосферы, где указанный ион находился преимущественно в следовых количествах. Свидетельством в пользу трансцепторной природы цианобактериального NrtB является то, что у Anabaena sp. он ассоциирован с фактором транскрипции NtrC [17].
У прокариот выявлены и низкоаффинные транспортеры нитрата, например, NrtS (KM 2.5 мМ) Synechococcus elongatus [18]. Его гомологи найдены у цианобактерий, протеобактерий и актинобактерий и, по-видимому, унаследованы от видов кислородных оазисов, став адаптивным преимуществом указанных групп в аэробной среде.
Сродство белков NrtS к нитрату у ряда видов сравнительно высокое (KM 0.49 мМ, γ-протеобактерия Marinomonas mediterranea) [18], что может быть как примитивным признаком, так и поздней адаптацией к олиготрофным экотопам. У филогенетически продвинутого штамма Synechococcus sp. PCC 7002 [16] обнаружены два близких между собой транспортера нитрата низкого сродства ‒ NrtS1 и NrtS2 (KM > 3 мМ), гетеромерный комплекс которых имеет высокое сродство к субстрату (KM 0.15 мМ) [18].
Трансдукция нитратного сигнала у прокариот
К концу 1980-х гг. уже было известно, что запускаемые нитратом двухкомпонентные прокариотические каскады трансдукции сигнала состоят из рецепторной гистидинкиназы и фосфорилируемого ей фактора транскрипции [11]. У E. coli последний представлен двумя белками ‒ NarL и NtrC [11]. У других протеобактерий обнаружено лишь по одному модулю трансдукции нитратного сигнала ‒ NarX-NarL или NarQ-NarP [13].
Фосфорилированный NarL индуцировал ряд белков, задействованных в “нитратном дыхании” ‒ формиатдегидрогеназу (fdnG), диссимиляторную нитратредуктазу (narG) у E. coli [19] и Mycobacterium tuberculosis [20], экспортер нитрита (narK), фумаратредуктазу (frdA) E. coli [21], периплазматическую нитратредуктазу (napF) Haemophilus influenzae Rd и E. coli [22]. У Klebsiella pneumoniae M5al NarL индуцировал респираторную, но не ассимиляторную нитратредуктазу [23], что подтверждает связь сигнального действия нитрата с использованием последнего как донора кислорода.
Одна из прокариотических систем совместного сигналинга нитрата и кислорода, сложившаяся как механизм выбора доступного акцептора электронов, исследована у S. carnosus и представляет собой комплекс Nre-белков, включающий вышеупомянутый рецептор NreА, O2-сенсорную протеинкиназу NreB и фактор транскрипции NreC [14]. При сочетании нитрата с аноксией у S. carnosus индуцируются плазмалеммная нитратредуктаза, транспортеры нитрата и нитрита, цитозольная нитритредуктаза, участвующие в “нитратном дыхании”. Ввиду высокой чувствительности NreА к нитрату можно предположить, что S. carnosus способен использовать указанный ион как окислитель уже в микромолярных концентрациях, которые имели место в архейский период.
Вышеописанные сигнальные каскады задействованы, в первую очередь, во включении “нитратного дыхания” у факультативно анаэробных прокариот. Такая особенность согласуется с предположением, что в условиях исходных архейских биогеоценозов именно нитрат как акцептор электронов мог мигрировать на сравнительно далекие расстояния, а кислород расходовался еще в пределах бактериальных матов, сформированных с участием цианобактерий.
У примитивной цианобактерии ‒ Synechococcus WH5701 описан типичный для всего отдела каскад C/N-сигналинга, включающий белки PII, NtcA и PipX [24]. Первый из них является цитозольным сенсором отношения АТФ/АДФ, а также С-акцептора аммиака ‒ 2-оксоглутарата. При достаточном уровне энергии и углерода PII дефосфорилируется, что приводит к диссоциации его комплекса с PipX. Последний активирует фактор транскрипции NtcA, который индуцирует нитрат- и нитритредуктазу [24], а у Anabaena PCC7120 и глутаминсинтетазу (glnA) [25]. В результате интенсифицируются восстановление нитрата и ассимиляция аммония. Напротив, фосфорилированный PII активирует N-ацетилглутаматкиназу (ключевой фермент синтеза аргинина) и ингибирует транспортеры нитрата [26], вызывая переход от поглощения к депонированию азота. Описанная регуляторная система характерна для цианобактерий [26]. Соответствующие представления отражены на рис. 2.
Рис. 2.
Ключевые звенья C- и N-сигналинга у цианобактерий. АГК ‒ N-ацетилглутаматкиназа, АКК ‒ ацетил-КоА-карбоксилаза, ГС ‒ глутаминсинтетаза. Международные обозначения: NrtB ‒ транспортер нитрата, NrtC ‒ белок, взаимодействующий с предыдущим, NtcA ‒ фактор транскрипции генов азотного обмена, P ‒ фосфат, PipX ‒ коактиватор транскрипции генов азотного обмена. Стрелки: 1 – метаболические пути, 2 – позитивное сигнальное действие, 3 – негативное сигнальное действие, 4 – подавленное в отсутствие активного комплекса с PipX действие фактора транскрипции NtcA, 5 – переходы между возможными состояниями регуляторных молекул.

У нефотосинтезирующих прокариот при дефиците 2-оксоглутарата фосфорилированный PII активирует глюкозамин-6-фосфатдеаминазу, но ингибирует ацетил-КоА-карбоксилазу (ключевой фермент синтеза липидов), транспортеры нитрата и аммония, глутаминсинтетазу, а также фактор транскрипции генов азотного обмена GlnR [26]. В результате происходит эффективное использование органических источников азота и углерода. Налицо архаичный сигнальный каскад, позволяющий клетке определить, какой из макроэлементов ‒ углерод или азот ‒ находится в минимуме, и переключить метаболизм на преимущественную утилизацию дефицитного ресурса. Сохранение такого рода “молекулярной машины” до наших дней свидетельствует в пользу ее эффективности в постоянно менявшейся на протяжении геологической истории окружающей среде.
Отметим, что активность белков PII у Proteobacteria и Actinobacteria регулируется посредством уридинилирования и аденилирования, соответственно, а не фосфорилирования, характерного именно для Cyanobacteria [27].
У E. coli и ряда других протеобактерий [28], а также цианобактерии Anabaena sp. [17] мишенью PII является вышеназванный рецептор нитрата NtrB. У Rhodobacter capsulatus появилась дополнительная гистидинкиназа NtrY, способная фосфорилировать два фактора транскрипции ‒ NtrC и NtrX [28]. У Herbaspirillum seropedicae SmR1 выявлены независимые каскады передачи сигнала о наличии азота в среде ‒ NtrB-NtrC и NtrY-NtrX, причем последний индуцирует рецептор нитрата NarX и соответствующий фактор транскрипции NarL [29]. Такая многоплановость регуляции становится понятной исходя из того, что H. seropedicae ‒ диазотроф. Сенсинг низкого C/N-баланса с участием как NtrB, NtrY, так и PII-белков приводит к репрессии генов, задействованных в азотфиксации, после чего индуцируемый в таких условиях сенсор NarX определяет адаптацию метаболизма бактерий к утилизации собственно нитрата.
По-видимому, уже у ранних прокариот наряду с нитратным сложился и сигналинг монооксида азота. При этом основным его источником является не нитрат, а аргинин – субстрат NO-синтазы [30]. Сенсинг оксида азота в клетках прокариот, по-видимому, осуществляется с участием связывающего его и кислород гемопротеида, а сигналинг – ассоциированного с последним ц-ди-ГМФ-расщепляющего фермента [31]. Аналогично, по крайней мере, у Burkholderia pseudomallei 1026b нитрат с участием фактора транскрипции NarL индуцировал ц-ди-ГМФ-фосфодиэстеразу (cdpA), тем самым снижая уровень вторичного мессенджера ‒ ц-ди-ГМФ [32]. Конечным эффектом и нитрата, и оксида азота было подавление образования биопленок и/или их распад на отдельные клетки. Такой параллелизм может быть связан с тем, что биопленки – универсальная адаптация прокариот к азотному голоданию, связанная с их межклеточной кооперацией. Этот вопрос еще требует своего экспериментального изучения.
Как видно из вышеизложенного, в ранней эволюции прокариот, происходившей в условиях преобладания аноксии, происходила адаптация к использованию нитрата как окислителя, распространяющегося за пределы аэробных сообществ. Тем не менее, уже тогда появились приспособления к утилизации указанного иона и как основного источника азота. Среди них: высоко- и низкоаффинные сенсоры и трансцепторы нитрата, возможность регуляции их сродства к иону, способность указанных белков к автофосфорилированию, активация факторов транскрипции путем фосфорилирования последних. Соответственно, в процессе эволюции произошла специализация с дополнением C/N-сигналинга собственно нитратным.
РАЗВИТИЕ НИТРАТНОГО СИГНАЛИНГА В ПРОТЕРОЗОЕ
Изменение окружающей среды
Как отображено на рис. 1б, в протерозое (2.5−0.54 млрд. л. н.) уровень свободного кислорода в атмосфере достиг 7% [33]. Одной из причин этого было освоение цианобактериями новых экологических ниш. Так, уже в самом начале протерозоя произошел переход от пленок к матам из нитевидных колоний [16]. В период 1.6−1.0 млрд. л. н. сложились как экологическая группа планктонные цианобактерии [34]. Также произошло накопление связанного азота в среде, что отражено в увеличении концентрации указанного макроэлемента в протерозойских осадочных породах в 3.8 раз [35]. В планетарном масштабе распространился биогеохимический цикл азота современного типа, включающий нитрификацию [36].
Отметим, что 2.2 млрд. л. н. вследствие уменьшения пула атмосферного CO2 уменьшилась электрохимическая наработка оксидов азота, что увеличило значение азотфиксации [37]. Кроме того, 0.85−0.64 млрд. л. н. повысилась биодоступность молибдена и ванадия, что обеспечило нитратредуктазу необходимыми кофакторами [38]. В результате сложились условия для биологического прогресса диазотрофов [38].
Эволюция прокариот
Изученным в молекулярно-биологическом аспекте примером эволюционно продвинутых цианобактерий, отличающихся такими инновациями, как нитчатые колонии и гетероцисты, является Anabaena [39]. Для нее характерна регуляция экспрессии нитрат- и нитритредуктазы не только C/N-балансом, но и самим нитратом с участием уже двух факторов транскрипции ‒ NtcA и NtcB [17]. Вероятно, это позволяет дифференцировать реакции клетки на уровни указанного иона. У представителей рода найдены типичные для всего отдела транспортеры и сенсоры нитрата, рассмотренные выше ‒ NrtB [17].
В связи с накоплением свободного кислорода в среде цианобактерии приобрели различные варианты пространственно-временного разграничения оксигенного фотосинтеза и анаэробной диазотрофии [38, 39]. В частности, сформировался специальный тип азотфиксирующих клеток ‒ гетероцисты. Их адаптивными особенностями являются: многослойная оболочка с низкой проницаемостью для кислорода, отсутствие процесса фотосинтеза и наличие интенсивного дыхания. В связи с появлением гетероцист расширилось разнообразие мишеней тех факторов транскрипции, что ранее регулировали лишь использование связанного азота. Так, белок NtcA стал индуцировать hetR (запуск формирования гетероцист), nifH (редуктаза динитрогеназы), gor (глутатионредуктаза) и репрессировать rbcLS (фотосинтез). У мутантов ntcA нарушалось усвоение как нитратного, так и молекулярного азота [26]. С другой стороны, у цианобактерий Calothrix rhizosoleniae SC01 и Richelia intracellularis HH01, имеющих гетероцисты, нет генов, определяющих формирование альтернативных кислородных барьеров ‒ гопаноидсодержащих мембран [40].
Судя по филогении ключевого для диазотрофии гена nifD, формы с гетероцистами имеют монофилетическое происхождение [41]. По-видимому, данное эволюционное приобретение стало удачным ароморфозом, за которым быстро (в геологическом масштабе) последовала адаптивная радиация группы с заполнением практически всех доступных экологических ниш.
Сенсинг и поглощение нитрата эукариотами
Как отражено на рис. 3, у эукариот системы сенсинга и сигналинга нитрата, унаследованные от прокариот, получили дальнейшее развитие. Ранние этапы такой эволюции видны на примере примитивных пикопланктонных водорослей порядка Mamiellales (класс Mamiellophyceae) [42]. Так, у Micromonas sp. RCC299, Ostreococcus lucimarinus CCE9901, O. tauri OTH95 обнаружено по одному низкоаффинному транспортеру нитрата из семейства NRT1 [43]. У типичной зеленой водоросли − хламидомонады Рейнхардта (Chlamydomonas reinhardtii P.A. Dang.) также выявлен лишь один белок NRT1 [44]. Прослеживается родство NRT1-семейства и прокариотических пептидных транспортеров POT и PTR с сохранением механизма симпорта лиганда с протоном, а также обусловленных им консервативных особенностей структуры [45]. Некоторые из них определяют и возможность сенсинга нитрата. Можно предположить эволюционную смену узнаваемых NPF/POT/PTR лигандов от органических форм азота, типичных продуктов абиогенного синтеза, до нитрата как характерного компонента аэробного биологического круговорота. Отметим, что Nrt-белки прокариот относятся к транспортерам АВС-типа, а не NPF/POT/PTR [17], и, очевидно, стали сенсорами нитрата независимо от последних.
Рис. 3.
Предполагаемая схема нитратного сигналинга у зеленых водорослей. CDPK – кальцийзависимые протеинкиназы, NIT − специфичный для водорослей фактор транскрипции генов, регулируемых нитратом, NRT − трансцепторы нитрата, PLC − фосфолипаза С, P ‒ фосфат, И-3-Ф − инозиттрифосфат.
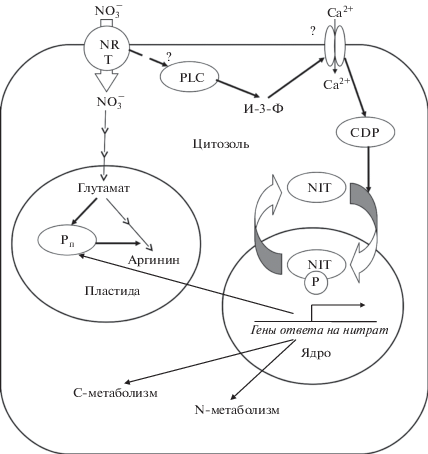
По последовательностям генов высокоаффинных транспортеров нитрата из семейства NRT2 Mamiellales занимают промежуточное положение между другими зелеными водорослями (Ch. reinhardtii, Chlorella sorokiniana Shihira & R.W. Krauss и Dunaliella salina (Dunal) Teodor.) и прокариотами [43]. Авторы исследования предполагают, что филогения NRT2 отражает примитивность указанного порядка в ряду одноклеточных растений. У Ch. reinhardtii обнаружено четыре белка NRT2, узнающих нитрат, и два транспортера нитрита того же семейства [44]. Отсюда видно, что у ранних фототрофных эукариот субстратная специфика представителей семейства NRT2 еще находилась в состоянии своего становления.
Экспрессия NRT2 динофлагеллят Lingulodinium polyedra (F.Stein) J.D. Dodge не индуцировалась нитратом [46]. Вероятно, механизм такой индукции сложился у эволюционно продвинутых одноклеточных водорослей. У Arabidopsis в ней участвует нитратный сенсор NRT1.1 [47]. Возможно, исходно белки NRT1 были трансцепторами нитрата, тогда как NRT2 только его транспортерами.
Трансдукция нитратного сигнала у эукариот
По-видимому, уже у ранних эукариот складывалось взаимодействие транспортеров NRT2 с адапторными белками NAR2, необходимое для локализации их комплекса на плазмалемме, а также осуществления сенсорной и транспортной функций. У плесневого гриба Aspergillus nidulans (Eidam) G.Winter NRT2 функционирует автономно [48]. У Chlamydomonas лишь два из шести транспортеров указанного семейства взаимодействуют с белками NAR2 [44]. У цветковых растений, таких как Arabidopsis, NAR2 необходим для работы всех известных NRT2-белков [49]. Налицо становление нового механизма “тонкой настройки” сенсинга и поглощения микродоз нитрата.
Сигнальные белки PII были унаследованы от прокариот растениями, у которых локализованы в появившихся в ходе симбиогенеза пластидах и стали сенсорами глутамина, основного маркера N-статуса организма [50, 51]. На преемственность хлоропластов по отношению к цианобактериям указывает и общий тип посттрансляционной модификации указанных белков фосфорилированием, а не иными путями, характерными для других прокариот [28]. Также произошла специализация круга мишеней белков PII. В пластидах последние регулируют наработку аргинина (что характерно и для прокариот) и поглощение цитозольного нитрита [52].
У Ch. reinhardtii сам нитрат (4 мМ) индуцирует PII [51]. В результате создается основа для последующего C/N-сигналинга, что обратно последовательности молекулярных событий, характерной для цианобактерий. Вероятная причина ‒ эволюционное увеличение значимости нитрата как источника азота и регулятора разнообразных физиологических процессов.
В нашем предыдущем обзоре рассмотрено участие в передаче нитратного сигнала у высших растений ионов кальция и кальцийзависимых протеинкиназ [2]. Как оказалось, такого рода звенья появились уже у весьма примитивных эукариот. Так, у O. tauri выявлена индукция, по крайней мере, одного из генов упомянутых протеинкиназ, OtCDPK1, при дефиците минерального азота в среде [53]. Аналогично у Arabidopsis в подобных условиях происходит активация протеинкиназ CIPK7, CIPK12 и CIPK14 с участием сенсора кальция ‒ кальцийнейрин-В-подобного белка CBL8 [54]. Здесь можно говорить о конвергенции, а не о гомологии.
Для большинства водорослей характерны белки с консервативным RWP-RK-доменом, например, NIT2, близкие к факторам транскрипции нитратиндуцибельных генов высших растений – NLP и, по-видимому, являющиеся их эволюционными прототипами [55]. NLP-белки найдены уже у Micromonas pusilla CCMP1545, M. sp. RCC299, Ostreococcus lucimarinus из порядка Mamiellales [56]. Возможно, это результат горизонтального переноса ДНК либо независимого сохранения указанных белков, унаследованных от общего предка, в линиях Mamiellophyceae и Embryophyta. В последнем случае гены NIT зеленых водорослей являются результатом филогенетической девиации.
С появлением и ранней эволюцией эукариот претерпел ряд изменений не только нитратный, но и NO-сигналинг. В частности, увеличилось разнообразие ферментов, участвующих в передаче сигнала. Среди них растворимые гуанилатциклазы, цГМФ-зависимые протеинкиназы и фосфодиэстеразы, регулируемые циклическими нуклеотидами каналы. Однако далеко не всегда упомянутые звенья каскада передачи сигнала, даже у водорослей, присутствуют совместно с NO-синтазой [57]. Последняя характерна для животных, но среди растений присутствует даже не у всех водорослей. Вероятно, сохранение генов NO-синтазы у ряда потомков первичных фотосинтезирующих эукариот либо их горизонтальный перенос между таксономически отдаленными группами растений [58]. Среди видов, скорее всего, имеющих указанный фермент как архаичную особенность, вышеупомянутый пикопланктонный O. tauri [59]. Уже у Chlamydomonas оксид азота нарабатывают нитрат- и нитритредуктаза, причем первый фермент способен выполнять ту же функцию и у высших растений [44]. В итоге эволюционной смены источников оксида азота последний стал маркером доступности экзогенного нитрата, а не величины эндогенного N-пула, представленного аргинином. Однако и в этом случае сохранился принцип сенсинга оксида азота специальным гемопротеидом ‒ гемоглобином.
Как видим, уже у ранних эукариот (водоросли и грибы), по существу, появились основные компоненты того каскада нитратного сигналинга, что известен на примере Arabidopsis. Однако разнообразие соответствующих белков невелико, что, вероятно, связано с отсутствием дифференцировки на функционально разные типы клеток.
РАЗВИТИЕ НИТРАТНОГО СИГНАЛИНГА В ФАНЕРОЗОЕ
Изменение окружающей среды
В фанерозое (541 млн. л. н. и далее) содержание кислорода в атмосфере варьировало от 10% в периоды массовых вымираний до 30% ‒ при наибольшем расцвете жизни [33]. Возросла и интенсивность нитрификации. Лишь для глобальных биосферных кризисов был характерен анаэробный Мировой океан с преобладанием аммония [60]. Кроме того, весь фанерозойский эон продолжалось накопление связанного азота в среде, что отразилось в увеличении уровня азотсодержащих веществ в осадочных породах в 1.5 раза [35]. В итоге уже на рубеже эдиакария (635−541 млн. л. н.) и кембрия (541−485 млн. л. н.) именно нитрат стал основным источником азота для растений, определяющим продуктивность морских экосистем [61, 62]. В настоящее время в составе океанского фитопланктона господствующее положение занимают нитрофильные зеленые водоросли, а не аммониофильные или диазотрофные цианобактерии [61, 63, 64]. Суммация изложенного выше приведена на рис. 1в.
Представляет интерес то обстоятельство, что с геологической динамикой биогеохимического цикла азота связывают чередование холодных и теплых эпох, характерное для фанерозоя [65]. Так, холодные (“ледниковые”) эпохи приурочены к относительно высокому содержанию нитрата в Мировом океане, вследствие этого – депонированию углерода фитопланктоном, что уменьшало уровень одного из основных природных парниковых газов CO2. В теплые эпохи ситуация обратная, уровень нитрата находился в минимуме и преобладало гетеротрофное высвобождение углерода в атмосферу. Отрицательные обратные связи (в первом случае уменьшение пула доступных фитопланктону макроэлементов из-за ограничения стока рек при оледенении, во втором – накопление биогенных элементов в Мировом океане вследствие интенсификации их вымывания) обеспечили колебательный характер описанных изменений.
Сенсинг и поглощение нитрата высшими растениями
В первую очередь усложнение механизмов сигналинга нитрата коснулось его трансцепторов. У высших растений появились многочисленные NRT1-белки, различающиеся по своей локализации и функциям [44, 66]. Среди них и основной сенсор нитрата у Arabidopsis – NRT1.1, находящийся практически во всех органах растения, но прежде всего, в меристемах [66, 67]. Такое широкое распространение свидетельствует в пользу как физиологической значимости функций, так и древнего происхождения данного белка.
Разнообразие транспортеров нитрата низкого сродства хорошо изучено на примере Arabidopsis. NRT1.5 локализован в перицикле, а NRT1.8 ‒ в паренхиме ксилемы корня [66, 68]; NRT1.9 ‒ в клетках-спутниках флоэмы корня [69]; NRT1.4 ‒ в проводящей системе черешка листа [70]; NRT1.7, NRT1.11 и NRT1.12 ‒ в жилках зрелых листьев [71, 72], тогда как NRT1.6 ‒ в проводящих пучках семязачатков [73]. Такой полиморфизм связан с регуляцией не только органного распределения нитрата (данную функцию мог бы выполнять NRT1.1), но и морфогенеза вегетативных и генеративных органов. Вероятно, диверсификация семейства NRT1 происходила при становлении многоклеточной организации и выходе растений на сушу, когда в условиях гетерогенности окружающей среды начала складываться органная компартментация пулов нитрата.
На примере Arabidopsis можно проследить полиморфизм транспортеров нитрата высокого сродства семейства NRT2. Так, NRT2.1 сосредоточен в ризодерме и коре корня [49], тогда как NRT2.5 ‒ в жилках сформированных листьев [74], а NRT2.7 ‒ на тонопласте клеток зародыша [75]. В последнем случае функционирование именно высокоаффинного транспортера позволяет обеспечить успех семенного размножения даже при азотном голодании. Соответственно, показана стимуляция экзогенным нитратом прорастания семян уже в концентрациях от 100 (Arabidopsis, гулявник лекарственный Sisymbrium officinale (L.) Scop.) до 200 мкМ (овсюг Avena fatua L., ячмень двурядный Hordeum distichum L.) [76, 77]. 1 мМ нитрат также стимулировал прорастание спор щитовника мужского Dryopteris filix-mas (L.) Schott, систематически отдаленного от цветковых растений представителя папоротников [78]. В приведенных случаях действие указанного иона было связано с эффектом фитохрома, подавлялось хлоратом и не зависело от ингибитора нитратредуктазы ‒ вольфрамата. Это позволяет сделать вывод о наличии консервативного механизма сигналинга, задействующего трансцепторы нитрата.
В ходе эволюции от одноклеточных водорослей до цветковых в транспорте и распределении нитрата стали участвовать хлоридные каналы CLC/CLV [66], а также не найденные у Chlamydomonas медленные анионные каналы SLAC1/SLAH и белки семейства активируемых алюминием транспортеров малата ALMT [44, 79, 80]. Практически все они участвуют в адаптации растений к водному дефициту. Например, белок Arabidopsis SLAH3 с низким сродством к субстрату (Км 8.3 мМ) обеспечивает выход нитрата из замыкающих клеток устьиц и далее закрытие устьичной щели. Сам указанный ион в концентрациях 20−100 мМ активирует SLAH3, подавляя транспирацию [80]. Аналогичный эффект нитрата (>3 мМ) как активирующего SLAC1 антитранспиранта показан для однодольных растений ‒ финика пальчатого Phoenix dactylifera L. и ячменя обыкновенного Hordeum vulgare L., что связано с двумя точечными мутациями в третьем трансмембранном домене указанного канала [81, 82]. Вероятно, чувствительность SLAC1 злаков и пальм к нитрату сложилась как одна из адаптаций к нараставшей в неогене (23.0−2.6 млн. л. н.) засушливости климата.
В результате совершенствования систем транспортеров нитрата увеличивалась эффективность его поглощения у видов из прогрессивных таксономических групп, тогда как примитивные растения часто оказывались адаптированными к минимальному уровню азота нитрофобами. У псилота голого Psilotum nudum (L.) Beauvois уже 3.5 мкМ нитрат более чем вдвое угнетал прорастание спор, а 35 мкМ ‒ практически полностью блокировал процесс независимо от присутствия в среде аммония [83]. Последний как единственная форма азота уже в концентрации 3.5 мкМ на 50% увеличивал рост гаметофита псилота, а в концентрации 35 мкМ ‒ практически в 4 раза. Аналогичные результаты были получены для гроздовника рассеченного Botrychium dissectum f. obliquum (Muhl.) Fernald [84]. Оба исследованных вида весьма примитивны в эволюционном плане и могли унаследовать экстремальную аммониофильность от ранних наземных растений. Напротив, как это было упомянуто выше, прорастание спор эволюционно продвинутого папоротника – щитовника мужского стимулируется 1 мМ нитратом, подобно прорастанию семян исследованных цветковых растений [78]. Возможно, это пример физиологической конвергенции.
Менее олиготрофный, чем псилот и гроздовник, пример растений, также предпочитающих нитрату аммоний – хвойные, более древние, чем цветковые растения. Особое место занимает такой примитивный их представитель, как араукария бразильская Araucaria angustifolia (Bertol.) Kuntze, у которой рост на 4 мМ аммонии был удовлетворительным, тогда как на 4 мМ нитрате наблюдалось азотное голодание [85]. На примере сосны Массона Pinus massoniana Lamb. показано, что толерантность к высоким дозам аммония связана с депонированием азота в форме аспарагина [86], в котором участвует архаичный регуляторный белок PII [52]. Весьма вероятно, что данная физиологическая основа аммониофильности унаследована от древнейших эукариот.
У прогрессивных хвойных предпочтение нитрата или другого источника азота зависит от условий. Так, сосны корейская Pinus koraiensis Siebold & Zucc. и обыкновенная Pinus sylvestris L., ель корейская Picea koraiensis Nakai и особенно лиственница ольгинская Larix gmelinii var. olgensis (A.Henry) Ostenf. & Syrach при низкой обеспеченности азотом предпочтительно поглощали $^{{15}}{\text{NO}}_{3}^{ - }$, а не $^{{15}}{\text{NH}}_{4}^{ + }$, тогда как при высокой ‒ наоборот [87]. В условиях теплицы сосна корейская поглощала преимущественно глицин, тогда как лиственница тонкочешуйчатая Larix kaempferi (Lamb.) Carrière, дуб монгольский Quercus mongolica Fisch. ex Ledeb. и орех маньчжурский Juglans mandshurica Maxim. – нитрат [88]. Здесь и выше налицо примеры постепенного становления нитратофильности.
Трансдукция нитратного сигнала у высших растений
В ходе эволюционного усложнения морфогенеза высших растений на базе семейства трансцепторов нитрата низкого сродства NRT1/NPF сложился общий принцип котранспорта указанного иона и различных фитогормонов (ИУК, АБК, жасмонат, гиббереллины) [89]. На основе такого рода фактов была выдвинута гипотеза, что рецепторы эндогенных сигнальных молекул произошли от трансцепторов и их гомологов с исключительно рецепторной функцией [90]. В ходе эволюции могли последовательно происходить деспециализация NRT-белков по отношению к лигандам, включение в их число фитогормонов, появление гормон-транспортной функции и ее сопряжение с сенсингом нитрата. В результате появилась возможность регуляции указанным ионом многих морфогенетических процессов, связанных с корнепобеговой организацией.
Ярким подтверждением такого предположения является подавление 1−10 мМ нитратом экспорта ИУК из клеток корневых примордиев у Arabidopsis, что приводило к локальному накоплению ауксина с участием NRT1.1 [91]. Последний индуцировался указанным гормоном в области местного максимума внеклеточной концентрации нитрата [92]. Такая положительная обратная связь могла быть в основе эволюционно ранних механизмов ветвления осевых органов еще до того, как сложилась современная система транспорта и взаимодействия фитогормонов, вовлекающая в себя многообразные транспортеры, рецепторы и белки каскадов сигнальной трансдукции. Локализация NRT1.1, прежде всего, в зачатках различных частей растения [67] свидетельствует в пользу универсальности связанного с ним процесса местного сосредоточения ИУК в участках меристемы с последующей дифференцировкой их по темпам роста.
Другой пример эволюционной надстройки механизмов нитратного сигналинга ‒ появление NLP-белков, основных регуляторов транскрипции индуцируемых нитратом генов у различных видов с корнепобеговой организацией и мохообразного Physcomitrella patens (Hedw.) Bruch & Schimp., но не у большинства исследованных красных и зеленых водорослей [56]. Процессы появления и диверсификации NLP-белков коррелировали с усложнением органно-тканевой организации растений, став основой для широкого круга морфогенетических реакций, запускаемых нитратом. Примерами могут служить связь NLP7 белка с ростом корневой системы, а также NLP8 ‒ с прорастанием семян Arabidopsis [93, 94]. Различиям в структуре указанных факторов транскрипции соответствуют специфические наборы генов-мишеней. Показано, что белок NLP7 индуцировал ген другого регулятора транскрипции ‒ ANR1, локализованного в апексах боковых корней и поддерживающего их рост в обогащенной нитратом почве, а также ген рецептора ИУК, AFB3, участвующий в гормональной регуляции ризогенеза [93]. Мишенью NLP8 был ген АБК-8'-гидроксилазы CYP707A, которая катализировала первую реакцию деградации АБК и тем самым выводила семена из состояния покоя [94]. Круг знаний о молекулярных механизмах такого рода дифференцированных нитратзависимых процессов роста морфогенеза продолжает расширяться. Становится понятным, что важное значение в эволюции белков семейства NLP имело изменение распознаваемых регуляторных последовательностей ДНК. Напротив, сам принцип передачи сигнала с трансцепторов, узнающих различные лиганды, на протеинкиназы, фосфорилирующие консервативные факторы транскрипции, которые затем мигрируют в ядро, где взаимодействуют с генами-мишенями, типичен для современных эукариот и, вероятно, унаследован ими от общего предка [95].
Нами показано на примере гороха посевного Pisum sativum L., что среди мишеней позитивного сигнального действия нитрата у высших растений находится и стартовый фермент углеводного метаболизма − сахарозосинтаза, обеспечивающая субстратом наработку структурных полисахаридов и ряд других биосинтезов [96, 97]. Учитывая, что указанный белок выявлен даже у цианобактерий [98], можно предполагать широкое распространение и его регуляции нитратом у широкого круга растений как способа стимуляции роста гетеротрофных органов. Среди них: семязачаток, зародышевая ось, корень, гипокотиль, а также практически все меристемы разной локализации. В упомянутых примерах возможны различия в соотношении интенсивностей конститутивной (например, с участием цитозольной инвертазы) и нитратзависимой утилизации сахарозы, что, в конечном счете, на донорно-акцепторном уровне определяет варианты перестройки архитектоники растения в зависимости от обеспеченности нитратом. Вклад позитивного нитратного сигналинга сахарозосинтазы в конкретные морфогенетические процессы − актуальная проблема, по существу, остающаяся неразработанной.
ЗАКЛЮЧЕНИЕ
Прогрессивная направленность эволюции систем сенсинга и передачи сигнала нитрата в целом выражается в появлении организмов со все более высокой приспосабливаемостью к широкому диапазону концентраций указанного иона в окружающей среде. От первых прокариот к разнообразным современным растениям постепенно сложились дифференцированные механизмы сенсинга и передачи сигналов нитрата, участвующие в результирующих физиологических реакциях. При этом реализовались различные типы эволюционных изменений (параллелизм, конвергенция на основе исходной гомологии, девиация, а также дифференциация семейств белков от одного предшественника). В ближайшей перспективе предстоит развитие исследований по изучению органно-тканевой и внутриклеточной специфики сигнальных каскадов, запускаемых нитратом, и их взаимодействию с другими агентами (свет, фитогормоны, углеводы и др.). С учетом важности популяции как единицы эволюционного процесса важно выявить внутри- и межвидовую специфику трансцепторов нитрата и связанных с ними путей передачи сигналов, вплоть до полиморфизма генов-мишеней у представителей разных экологических ниш с целью повышения продуктивности культурных растений и сохранения биоразнообразия природных комплексов.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит описания каких-либо экспериментов с участием людей и животных в качестве объектов исследования.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (тема № 121033000137-1).
Список литературы
Izmailov S.F., Nikitin A.V., Rodionov V.A. Nitrate signaling in plants: Introduction to the problem // Russ. J. Plant Physiol. 2018. V. 65. P. 477. https://doi.org/10.1134/S1021443718040027
Izmailov S.F., Nikitin A.V. Nitrate signaling in plants: Mechanisms of implementation // Russ. J. Plant Physiol. 2020. V. 67. P. 31. https://doi.org/10.1134/S1021443720010082
Wong M.L., Charnay B.D., Gao P., Yung Y.L., Russell M.J. Nitrogen oxides in early Earth’s atmosphere as electron acceptors for life’s emergence // Astrobiol. 2017. V. 17. P. 975. https://doi.org/10.1089/ast.2016.1473
Laneuville M., Kameya M., Cleaves H.J. Earth without life: A systems model of a global abiotic nitrogen cycle // Astrobiol. 2018. V. 18. P. 897. https://doi.org/10.1089/ast.2017.1700
Ranjan S., Todd Z.R., Rimmer P.B., Sasselov D.D., Babbin A.R. Nitrogen oxide concentrations in natural waters on early Earth // Geochem. Geophys. Geosyst. 2019. V. 20. P. 2021. https://doi.org/10.1029/2018GC008082
Eickmann B., Hofmann A., Wille M., Thi H.B., Boswell A.W., Schoenberg R. Isotopic evidence for oxygenated Mesoarchaean shallow oceans // Nature Geosci. 2018. V. 11. P. 133. https://doi.org/10.1038/s41561-017-0036-x
Yang J., Junium C.K., Grassineau N.V., Nisbet E.G., Izon G., Mettam C., Martin A., Zerkle A.L. Ammonium availability in the Late Archaean nitrogen cycle // Nature Geosci. 2019. V. 12. P. 553. https://doi.org/10.1038/s41561-019-0371-1
Ruvindy R., White III R.A., Neilan B.A., Burns B.P. Unravelling core microbial metabolisms in the hypersaline microbial mats of Shark Bay using high-throughput metagenomics // ISME J. 2016. P. 183. https://doi.org/10.1038/ismej.2015.87
Molina V., Dorador C., Fernández C., Bristow L., Eissler Y., Hengst M., Hernandez K., Olsen L.M., Harrod C., Marchant F., Anguita C., Cornejo M. The activity of nitrifying microorganisms in a high-altitude Andean wetland // FEMS Microbiol. Ecol. 2018. V. 94. Art. fiy062. P. 1. https://doi.org/10.1093/femsec/fiy062
Mettam C., Zerkle A.L., Claire M.W., Prave A.R., Poulton S.W., Junium C.K. Anaerobic nitrogen cycling on a Neoarchaean ocean margin // Earth Planet. Sci. Lett. 2019. 527. Art. 115800. https://doi.org/10.1016/j.epsl.2019.115800
Nohno T., Noji S., Taniguchi S., Saito T. The narX and narL genes encoding the nitrate-sensing regulators of Escherichia coli are homologous to a family of prokaryotic two-component regulatory genes // Nucl. Acid Res. 1989. V. 17. P. 2947. https://doi.org/10.1093/nar/17.8.2947
Cavicchioli R., Schröder I., Constanti M., Gunsalus R.P. The NarX and NarQ sensor-transmitter proteins of Escherichia coli each require two conserved histidines for nitrate-dependent signal transduction to NarL // J. Bacteriol. 1995. V. 177. P. 2416. https://doi.org/10.1128/jb.177.9.2416-2424.1995
Stewart V. Nitrate- and nitrite-responsive sensors NarX and NarQ of proteobacteria // Biochem. Soc. Trans. 2003. V. 31 (Pt 1). P. 1. https://doi.org/10.1042/bst0310001
Niemann V., Koch-Singenstreu M., Neu A., Nilkens S., Götz F., Unden G., Stehle T. The NreA protein functions as a nitrate receptor in the staphylococcal nitrate regulation system // J. Mol. Biol. 2014. V. 426. P. 1539. https://doi.org/10.1016/j.jmb.2013.12.026
Omata T., Andriesse X., Hirano A. Identification and characterization of a gene cluster involved in nitrate transport in the cyanobacterium Synechococcus sp. PCC7942 // Mol. Gen. Genet. 1993. V. 236. P. 193. https://doi.org/10.1007/BF00277112
Uyeda J.C., Harmon L.J., Blank C.E. A comprehensive study of cyanobacterial morphological and ecological evolutionary dynamics through deep geologic time // PLoS ONE. 2016. V. 11. Art. e0162539. P. 1. https://doi.org/10.1371/journal.pone.0162539
Herrero A., Flores E. Genetic responses to carbon and nitrogen availability in Anabaena // Environ Microbiol. 2019. V. 21. P. 1. https://doi.org/10.1111/1462-2920.14370
Maeda S.-I., Aoba R., Nishino Y., Omata T. A novel bacterial nitrate transporter composed of small transmembrane proteins // Plant Cell Physiol. 2019. V. 60. P. 2180. https://doi.org/10.1093/pcp/pcz112
Darwin A.J., Li J., Stewart V. Analysis of nitrate regulatory protein NarL-binding sites in the fdnG and narG operon control regions of Escherichia coli K-12 // Mol. Microbiol. 1996. V. 20. P. 621. https://doi.org/10.1046/j.1365-2958.1996.5491074.x
Shivakumar K.V., Karunakar P., Chatterjee J. Inhibition of NarL of Mycobacterium tuberculosis: an in silico approach // Interdiscip. Sci. 2014. V. 6. P. 292. https://doi.org/10.1007/s12539-014-0179-z
Li J., Kustu S., Stewart V. In vitro interaction of nitrate-responsive regulatory protein NarL with DNA target sequences in the fdnG, narG, narK and frdA operon control regions of Escherichia coli K-12 // J. Mol. Biol. 1994. V. 241. P. 150. https://doi.org/10.1006/jmbi.1994.1485
Stewart V., Bledsoe P.J. Fnr-, NarP- and NarL-dependent regulation of transcription initiation from the Haemophilus influenzae Rd napF (periplasmic nitrate reductase) promoter in Escherichia coli K-12 // J. Bacteriol. 2005. V. 187. P. 6928. https://doi.org/10.1128/JB.187.20.6928-6935.2005
Stewart V., Cali B.M. Genetic evidence that NarL function is not required for nitrate regulation of nitrate assimilation in Klebsiella pneumoniae M5al // J. Bacteriol. 1990. V. 172. P. 4482. https://doi.org/10.1128/jb.172.8.4482-4488.1990
Laichoubi K.B., Beez S., Espinosa J., Forchhammer K., Contreras A. The nitrogen interaction network in Synechococcus WH5701, a cyanobacterium with two PipX and two P(II)-like proteins // Microbiol. 2011. V. 157. Pt. 4. P. 1220. https://doi.org/10.1099/mic.0.047266-0
Golden J.W., Yoon H.S. Heterocyst formation in Anabaena // Curr. Opin. Microbiol. 1998. V. 1. P. 623. https://doi.org/10.1016/S1369-5274(98)80106-9
Forchhammer K., Selim K.A. Carbon/nitrogen homeostasis control in cyanobacteria // FEMS Microbiol. Rev. 2019. pii: fuz025. P. 1. https://doi.org/10.1093/femsre/fuz025
Merrick M. Post-translational modification of PII signal transduction proteins // Front. Microbiol. 2015. V. 5. Art. 763. P. 1. https://doi.org/10.3389/fmicb.2014.00763
Drepper T., Wiethaus J., Giaourakis D., Gross S., Schubert B., Vogt M., Wiencek Y., McEwan A.G., Masepohl B. Cross-talk towards the response regulator NtrC controlling nitrogen metabolism in Rhodobacter capsulatus // FEMS Microbiol. Lett. 2006. V. 258. P. 250. https://doi.org/10.1111/j.1574-6968.2006.00228.x
Bonato P., Alves L.R., Osaki J.H., Rigo L.U., Pedrosa F.O., Souza E.M., Zhang N., Schumacher J., Buck M., Wassem R., Chubatsu L.S. The NtrY-NtrX two-component system is involved in controlling nitrate assimilation in Herbaspirillum seropedicae strain SmR1 // FEBS J. 2016. V. 283. P. 3919. https://doi.org/10.1111/febs.13897
Rafferty S. Nitric oxide synthases of bacteria-and other unicellular organisms // Open Nitric Oxide J. 2011. V. 3. P. 25. https://doi.org/10.2174/1875042701103010025
Arora D.P., Hossain S., Xu Y., Boon E.M. Nitric oxide regulation of bacterial biofilms // Biochem. 2015. V. 54. P. 3717. https://doi.org/10.1021/bi501476n
Mangalea M.R., Plumley B.A., Borlee B.R. Nitrate sensing and metabolism inhibit biofilm formation in the opportunistic pathogen Burkholderia pseudomallei by reducing the intracellular concentration of c-di-GMP // Front. Microbiol. 2017. V. 8. Art. 1353. P. 1. https://doi.org/10.3389/fmicb.2017.01353
Large R.R., Mukherjee I., Gregory D., Steadman J., Corkrey R., Danyushevsky L.V. Atmosphere oxygen cycling through the Proterozoic and Phanerozoic // Mineral. Deposita. 2019. V. 54. P. 485. https://doi.org/10.1007/s00126-019-00873-9
Sánchez-Baracaldo P. Origin of marine planktonic cyanobacteria // Sci. Rep. 2015. V. 5. Art. 17418. P. 1. https://doi.org/10.1038/srep17418
Johnson B.W., Goldblatt C. A secular increase in continental crust nitrogen during the Precambrian // Geochem. Persp. Let. 2017. V. 4. P. 24. https://doi.org/10.7185/geochemlet.1731
Garvin J., Buick R., Anbar A.D., Arnold G.L., Kaufman A.J. Isotopic evidence for an aerobic nitrogen cycle in the latest Archean // Sci. 2009. V. 323. P. 1045. https://doi.org/10.1126/science.1165675
Navarro-González R., McKay C.P., Mvondo D.N. A possible nitrogen crisis for Archaean life due to reduced nitrogen fixation by lightning // Nature. 2001. V. 412. P. 61. https://doi.org/10.1038/35083537
Sánchez-Baracaldo P., Ridgwell A., Raven J.A. A neoproterozoic transition in the marine nitrogen cycle // Curr. Biol. 2014. V. 24. P. 652. https://doi.org/10.1016/j.cub.2014.01.041
Uyeda J.C., Harmon L.J., Blank C.E. A comprehensive study of cyanobacterial morphological and ecological evolutionary dynamics through deep geologic time // PLoS ONE. 2016. V. 11. Art. e0162539. P. 1. https://doi.org/10.1371/journal.pone.0162539
Cornejo-Castillo F.M., Zehr J.P. Hopanoid lipids may facilitate aerobic nitrogen fixation in the ocean // Proc. Natl. Acad. Sci. USA. 2019. V. 116. P. 18269. https://doi.org/10.1073/pnas.1908165116
Esteves-Ferreira A.A., Cavalcanti J.H.F., Vaz M.G.M.V., Alvarenga L.V., Nunes-Nesi A., Araújo W.L. Cyanobacterial nitrogenases: phylogenetic diversity, regulation and functional predictions // Genet. Mol. Biol. 2017. V. 40. P. 261. https://doi.org/10.1590/1678-4685-gmb-2016-0050
Marin B., Melkonian M. Molecular phylogeny and classification of the Mamiellophyceae class. nov. (Chlorophyta) based on sequence comparisons of the nuclear-and plastid-encoded rRNA operons // Protist. 2010. V. 161. P. 304. https://doi.org/10.1016/j.protis.2009.10.002
McDonald S.M., Plant J.N., Worden A.Z. The mixed lineage nature of nitrogen transport and assimilation in marine eukaryotic phytoplankton: a case study of Micromonas // Mol. Biol. Evol. 2010. V. 27. P. 2268. https://doi.org/10.1093/molbev/msq113
Calatrava V., Chamizo-Ampudia A., Sanz-Luque E., Ocaña-Calahorro F., Llamas A., Fernandez E., Galvan A. How Chlamydomonas handles nitrate and the nitric oxide cycle // J. Exp. Bot. 2017. V. 68. P. 2593. https://doi.org/10.1093/jxb/erw507
Longo A., Miles N.W., Dickstein R. Genome mining of plant NPFs reveals varying conservation of signature motifs associated with the mechanism of transport // Front. Plant Sci. 2018. V. 4. Art. 1668. P. 1. https://doi.org/10.3389/fpls.2018.01668
Bellefeuille S.D., Morse D. The main nitrate transporter of the dinoflagellate Lingulodinium polyedrum is constitutively expressed and not responsible for daily variations in nitrate uptake rates // Harmful Algae. 2016. V. 55. P. 272. https://doi.org/10.1016/j.hal.2016.03.021
Ho C.H., Lin S.H., Hu H.C., Tsay Y.F. CHL1 functions as a nitrate sensor in plants // Cell. 2009. V. 138. P. 1184. https://doi.org/10.1016/j.cell.2009.07.004
Kotur Z., Unkles S.E., Glass A.D.M. Comparisons of the Arabidopsis thaliana High-affinity Nitrate Transporter Complex AtNRT2.1/AtNAR2.1 and the Aspergillus nidulans AnNRTA: structure function considerations // Israel J. Plant Sci. 2017. V. 64. P. 21. https://doi.org/10.1080/07929978.2016.1246147
Orsel M., Chopin F., Leleu O., Smith S.J., Krapp A., Daniel-Vedele F., Miller A.J. Nitrate signaling and the two component high affinity uptake system in Arabidopsis // Plant Signal Behav. 2007. V. 2. P. 260. https://doi.org/10.4161/psb.2.4.3870
Lapina T., Selim K.A., Forchhammer K., Ermilova E. The PII signaling protein from red algae represents an evolutionary link between cyanobacterial and Chloroplastida PII proteins // Sci. Rep. 2018. V. 8. Art. 790. P. 1. https://doi.org/10.1038/s41598-017-19046-7
Zalutskaya Z., Kochemasova L., Ermilova E. Dual positive and negative control of Chlamydomonas PII signal transduction protein expression by nitrate/nitrite and NO via the components of nitric oxide cycle // BMC Plant Biol. 2018. V. 18. Art. 305. P. 1. https://doi.org/10.1186/s12870-018-1540-x
Uhrig R.G., Ng K.K., Moorhead G.B. PII in higher plants: a modern role for an ancient protein // Trends Plant Sci. 2009. V. 14. P. 505. https://doi.org/10.1016/j.tplants.2009.07.003
Caló G., Scheidegger D., Martínez-Noël G.M.A., Salerno G.L. Ancient signal for nitrogen status sensing in the green lineage: Functional evidence of CDPK repertoire in Ostreococcus tauri // Plant Physiol. Biochem. 2017 V. 118. P. 377. https://doi.org/10.1016/j.plaphy.2017.07.009
Yasuda S., Aoyama S., Hasegawa Y., Sato T., Yamaguchi J. Arabidopsis CBL-interacting protein kinases regulate carbon/nitrogen-nutrient response by phosphorylating ubiquitin ligase ATL31 // Mol. Plant. 2017. V. 10. P. 605. https://doi.org/10.1016/j.molp.2017.01.005
Chardin C., Girin T., Roudier F., Meyer C., Krapp A. The plant RWP-RK transcription factors: key regulators of nitrogen responses and of gametophyte development // J. Exp. Bot. 2014. V. 65. P. 5577. https://doi.org/10.1093/jxb/eru261
Mu X., Luo J. Evolutionary analyses of NIN-like proteins in plants and their roles in nitrate signaling // Cell. Mol. Life Sci. 2019. V. 76. P. 3753. https://doi.org/10.1007/s00018-019-03164-8
Astier J., Mounier A., Santolini J., Jeandroz S., Wendehenne D. The evolution of nitric oxide signalling diverges between animal and green lineages // J. Exp. Bot. 2019. V. 70. P. 4355. https://doi.org/10.1093/jxb/erz088
Jeandroz S., Wipf D., Stuehr D.J., Lamattina L., Melkonian M., Tian Z., Zhu Y., Carpenter E.J., Wong G.K., Wendehenne D. Occurrence, structure, and evolution of nitric oxide synthase-like proteins in the plant kingdom // Sci. Signal. 2016. V. 9. Art. re2. https://doi.org/10.1126/scisignal.aad4403
Weisslocker-Schaetzel M., André F., Touazi N., Foresi N., Lembrouk M., Dorlet P., Frelet-Barrand A., Lamattina L., Santolini J. The NOS-like protein from the microalgae Ostreococcus tauri is a genuine and ultrafast NO-producing enzyme // Plant Sci. 2017. V. 265. P. 100. https://doi.org/10.1016/j.plantsci.2017.09.019
Sun Y.D., Zulla M.J., Joachimski M.M., Bond D.P.G., Wignall P.B., Zhang Z.T., Zhang M.H. Ammonium ocean following the end-Permian mass extinction // Earth Planet. Sci. Lett. 2019. V. 518. P. 211. https://doi.org/10.1016/j.epsl.2019.04.036
Xiang L., Schoepfer S.D., Zhang H., Cao C.-Q., Shen S.-Z. Evolution of primary producers and productivity across the Ediacaran-Cambrian transition // Precambr. Res. 2018. V. 313. P. 68. https://doi.org/10.1016/j.precamres.2018.05.023
Chen Y., Diamond C.W., Stüeken E.E., Cai C., Gill B.C., Zhang F., Bates S., Chu X., Ding Y., Lyons T.W. Coupled evolution of nitrogen cycling and redoxcline dynamics on the Yangtze Block across the Ediacaran-Cambrian transition // Geochim. Cosmochim. Acta. 2019. V. 257. P. 243. https://doi.org/10.1016/j.gca.2019.05.017
Stüeken E.E., Kipp M.A., Koehler M.C., Buick R. The evolution of Earth’s biogeochemical nitrogen cycle // Earth-Sci. Rev. 2016. V. 160. P. 220. https://doi.org/10.1016/j.earscirev.2016.07.007
Van Oostende N., Fawcett S.E., Marconi D., Lueders-Dumont J., Sabadel A.J.M., Woodward E.M.S., Jönsson B.F., Sigman D.M., Ward B.B. Variation of summer phytoplankton community composition and its relationship to nitrate and regenerated nitrogen assimilation across the North Atlantic Ocean // Deep Sea Res. Part I: Oceanogr. Res. Pap. 2017. V. 121. P. 79. https://doi.org/10.1016/j.dsr.2016.12.012
Kvale K.F., Turner K.E., Landolfi A., Meissner K.J. Phytoplankton calcifiers control nitrate cycling and the pace of transition in warming icehouse and cooling greenhouse climates // Biogeosci. 2019. V. 16. P. 1019. https://doi.org/10.5194/bg-16-1019-2019
Wang Y.-Y., Hsu P.-K., Tsay Y.-F. Uptake, allocation and signaling of nitrate // Trends Plant Sci. 2012. V. 17. P. 458. https://doi.org/10.1016/j.tplants.2012.04.006
Guo F.-Q., Wang R., Chen M., Crawford N.M. The Arabidopsis dual-affinity nitrate transporter gene AtNRT1.1 (CHL1) is activated and functions in nascent organ development during vegetative and reproductive growth // Plant Cell. 2001. V. 13. P. 1761. https://doi.org/10.1105/TPC.010126
Zhang G.-B., Yi H.-Y., Gong J.-M. The Arabidopsis ethylene/jasmonic acid-NRT signaling module coordinates nitrate reallocation and the trade-off between growth and environmental adaptation // Plant Cell. 2014. V. 26. P. 3984. https://doi.org/10.1105/tpc.114.129296
Wang Y.-Y., Tsay Y.-F. Arabidopsis nitrate transporter NRT1.9 is important in phloem nitrate transport // Plant Cell. 2011. V. 23. P. 1945. https://doi.org/10.1105/tpc.111.083618
Chiu Ch.-Ch., Lin Ch.-S., Hsia A.-P., Su R.-Ch., Lin H.-L., Tsay Y.-F. Mutation of a nitrate transporter, AtNRT1.4, results in a reduced petiole nitrate content and altered leaf development // Plant Cell Physiol. 2004. V. 45. P. 1139. https://doi.org/10.1093/pcp/pch143
Fan Sh.-Ch., Lin Ch.-S., Hsu P.-K., Lin Sh.-H., Tsay Y.-F. The Arabidopsis nitrate transporter NRT1.7, expressed in phloem, is responsible for source-to-sink remobilization of nitrate // Plant Cell. 2009. V. 21. P. 2750. https://doi.org/10.1105/tpc.109.067603
Hsu P.-K., Tsay Y.-F. Two phloem nitrate transporters, NRT1.11 and NRT1.12, are important for redistributing xylem-borne nitrate to enhance plant growth // Plant Physiol. 2013. V. 163. P. 844. https://doi.org/10.1104/pp.113.226563
Almagro A., Lin S.H., Tsay Y.F. Characterization of the Arabidopsis nitrate transporter NRT1.6 reveals a role of nitrate in early embryo development // Plant Cell. 2008. V. 20. P. 3289. https://doi.org/10.1105/tpc.107.056788
Lezhneva L., Kiba T., Feria-Bourrellier A.-B., Lafouge F., Boutet-Mercey S., Zoufan P., Sakakibara H., Daniel-Vedele F., Krapp A. The Arabidopsis nitrate transporter NRT2.5 plays a role in nitrate acquisition and remobilization in nitrogen-starved plants // Plant J. 2014. V. 80. P. 230. https://doi.org/10.1111/tpj.12626
Chopin F., Orsel M., Dorbe M.F., Chardon F., Truong H.N., Miller A.J., Krapp A., Daniel-Vedele F. The Arabidopsis ATNRT2.7 nitrate transporter controls nitrate content in seeds // Plant Cell. 2007. V. 19. P. 1590. https://doi.org/10.1105/tpc.107.050542
Luna B., Moreno J.M. Light and nitrate effects on seed germination of Mediterranean plant species of several functional groups // Plant Ecol. 2009. V. 203. P. 123. https://doi.org/10.1007/s11258-008-9517-8
Duermeyer L., Khodapanahi E., Yan D., Krapp A., Rothstein S.J., Nambara E. Regulation of seed dormancy and germination by nitrate // Seed Sci. Res. 2018. V. 28. P. 150. https://doi.org/10.1017/S096025851800020X
Haas C.J., Scheuerlein R. Nitrate effect on phytochrome-mediated germination in fern spores: Investigations on the mechanism of nitrate action // J. Plant Physiol. 1991. V. 138. P. 350. https://doi.org/10.1016/S0176-1617(11)80299-3
Sasaki T., Mori I.C., Furuichi T., Munemasa Sh., Toyooka K., Matsuoka K., Murata Y., Yamamoto Y. Closing plant stomata requires a homolog of an aluminum-activated malate transporter // Plant Cell Physiol. 2010. V. 51. P. 354. https://doi.org/10.1093/pcp/pcq016
Geiger D., Maierhofer T., AL-Rasheid Kh.A.S., Scherzer S., Mumm P., Liese A., Ache P., Wellmann Ch., Marten I., Grill E., Romeis T., Hedrich R. Stomatal closure by fast abscisic acid signaling is mediated by the guard cell anion channel SLAH3 and the receptor RCAR1 // Sci. Signal. 2011. V. 4. Art. ra32. P. 1. https://doi.org/10.1126/scisignal.2001346
Müller H.M., Schäfer N., Bauer H., Geiger D., Lautner S., Fromm J., Riederer M., Bueno A., Nussbaumer T., Mayer K., Alquraishi S.A., Alfarhan A.H., Neher E., Al-Rasheid K.A.S., Ache P., Hedrich R. The desert plant Phoenix dactylifera closes stomata via nitrate-regulated SLAC1 anion channel // New Phytol. 2017. V. 216. P. 150. https://doi.org/10.1111/nph.14672
Schäfer N., Maierhofer T., Herrmann J., Jørgensen M.E., Lind C., von Meyer K., Lautner S., Fromm J., Felder M., Hetherington A.M., Ache P., Geiger D., Hedrich R. A tandem amino acid residue motif in guard cell SLAC1 anion channel of grasses allows for the control of stomatal aperture by nitrate // Curr. Biol. 2018. V. 28. P. 1370. https://doi.org/10.1016/j.cub.2018.03.027
Whittier D.P. Effects of nitrogen source on spore germination and gametophyte growth in Psilotum // Bot. Gaz. 1990. V. 151. P. 50. https://doi.org/10.1086/337804
Melan M.A., Whittier D.P. Effects of inorganic nitrogen sources on spore germination and gametophyte growth in Botrychium dissectum // Plant Cell Environ. 1990. V. 13. P. 477. https://doi.org/10.1111/j.1365-3040.1990.tb01325.x
Garbin M.L., Dillenburg L.R. Effects of different nitrogen sources on growth, chlorophyll concentration, nitrate reductase activity and carbon and nitrogen distribution in Araucaria angustifolia // Braz. J. Plant Physiol. 2008. V. 20. P. 295. https://doi.org/10.1590/S1677-04202008000400005
Ren Q., Zhou Y., Zhou X. Combined transcriptome and proteome analysis of masson pine (Pinus massoniana Lamb.) seedling root in response to nitrate and ammonium supplementations // Int. J. Mol. Sci. 2020. V. 21(20). P. 7548. https://doi.org/10.3390/ijms21207548
Zhou X., Wang A., Hobbie E.A., Zhu F., Qu Y., Dai L., Li D., Liu X., Zhu W., Koba K., Li Y., Fang Y. Mature conifers assimilate nitrate as efficiently as ammonium from soils in four forest plantations // New Phytol. 2020. V. 229. P. 3184. https://doi.org/10.1111/nph.17110
Zhu F., Dai L., Hobbie E.A., Koba K., Liu X., Gurmesa G.A., Huang S., Li S., Li Y., Han S., Fang Y. Uptake patterns of glycine, ammonium, and nitrate differ among four common tree species of northeast China // Front. Plant Sci. 2019. V. 10. Art. 799. https://doi.org/10.3389/fpls.2019.00799
Corratgé-Faillie C., Lacombe B. Substrate (un)specificity of Arabidopsis NRT1/PTR FAMILY (NPF) proteins // J. Exp. Bot. 2017. V. 68. P. 3107. https://doi.org/10.1093/jxb/erw499
Thevelein J.M., Voordeckers K. Functioning and evolutionary significance of nutrient transceptors // Mol. Biol. Evol. 2009. V. 26. P. 2407. https://doi.org/10.1093/molbev/msp168
Krouk G., Lacombe B., Bielach A., Perrine-Walker F., Malinska K., Mounier E., Hoyerova K., Tillard P., Leon S., Ljung K., Zazimalova E., Benkova E., Nacry P., Gojon A. Nitrate-regulated auxin transport by NRT1.1 defines a mechanism for nutrient sensing in plants // Dev Cell. 2010. V. 18. P. 927. https://doi.org/10.1016/j.devcel.2010.05.008
Guo F.Q., Wang R., Crawford N.M. The Arabidopsis dual-affinity nitrate transporter gene AtNRT1.1 (CHL1) is regulated by auxin in both shoots and roots // J. Exp. Bot. 2002. V. 53. P. 835. https://doi.org/10.1093/jexbot/53.370.835
Yu L.-H., Wu J., Tang H., Yuan Y., Wang S.-M., Wang Y.-P., Zhu Q.-S., Li S.-G., Xiang C.-B. Overexpression of Arabidopsis NLP7 improves plant growth under both nitrogen-limiting and -sufficient conditions by enhancing nitrogen and carbon assimilation // Sci. Rep. 2016. V. 6. Art. 27795. https://doi.org/10.1038/srep27795
Yan D., Easwaran V., Chau V., Okamoto M., Ierullo M., Kimura M., Endo A., Yano R., Pasha A., Gong Y., Bi Y.-M., Provart N., Guttman D., Krapp A., Rothstein S.J., Nambara E. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis // Nat. Commun. 2016. V. 7. Art. 13179. https://doi.org/10.1038/ncomms13179
Konishi M., Yanagisawa S. Arabidopsis NIN-like transcription factors have a central role in nitrate signalling // Nat. Commun. 2013. V. 4. Art. 1617. https://doi.org/10.1038/ncomms2621
Bruskova R.K., Nikitin A.V., Satskaya M.V., Izmailov S.F. Effect of nitrate on pea sucrose synthase // Russ. J. Plant Physiol. 2009. V. 56. P. 74. https://doi.org/10.1134/S1021443709010117
Nikitin A.V., Izmailov S.F. Enzymes of sucrose dissimilation as targets for nitrate in early ontogenesis of garden pea // Russ. J. Plant Physiol. 2016. V. 63. P. 152. https://doi.org/10.1134/S1021443715060138
Curatti L., Giarrocco L., Salerno S.L. Sucrose synthase and RuBisCo expression is similarly regulated by the nitrogen source in the nitrogen-fixing cyanobacterium Anabaena sp. // Planta. 2006. V. 223. P. 891. https://doi.org/10.1007/s00425-005-0142-7
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


