Физиология растений, 2022, T. 69, № 1, стр. 68-79
Структура хлоренхимы и липидный профиль мембран в листьях галофитов сем. Chenopodiaceae с разным типом фотосинтеза
О. А. Розенцвет a, *, Е. В. Шуйская b, Е. С. Богданова a, В. Н. Нестеров a, Л. А. Иванова c, d
a Самарский федеральный исследовательский центр Российской академии наук,
Институт экологии Волжского бассейна Российской академии наук
Тольятти, Россия
b Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К. А. Тимирязева Российской академии наук
Москва, Россия
c Федеральное государственное бюджетное учреждение науки Ботанический сад
Уральского отделения Российской академии наук
Екатеринбург, Россия
d Тюменский государственный университет
Тюмень, Россия
* E-mail: olgarozen55@mail.ru
Поступила в редакцию 31.03.2021
После доработки 19.04.2021
Принята к публикации 20.04.2021
- EDN: GTUUYY
- DOI: 10.31857/S0015330322010171
Аннотация
Изучены структура мезофилла и липидный профиль мембран в листьях четырех видов галофитов сем. Chenopodiaceae с разным типом фотосинтеза: однолетников Salicornia perennans (C3-тип фотосинтеза) и Sedobassia sedoides (С3-С4-тип), Climacoptera crassa (С4-НАД-тип) и многолетнего полукустарничка Kochia prostrata (С4-НАДФ-тип), произрастающих в биотопах с разной степенью засоления и увлажнения почвы. Однолетники с суккулентными листьями накапливали в 7–15 раз больше Na+, чем многолетний полукустарничек. Установлена тесная положительная взаимосвязь толщины листа с оводненностью листьев (r = 0.98, P = 0.04) и суммой накопленных элементов (r = 0.96, P = 0.04) в них. Клетки мезофилла С3-вида S. perennans были существенно крупнее в сравнении с клетками мезофилла и обкладки С4-видов и имели в 1.5–3.5 раза больше хлоропластов. Виды с Кранц-анатомией различались размерами и соотношением числа клеток обкладки и мезофилла. Суммарная площадь поверхности хлоропластов в единице площади листа у растений с Кранц-анатомией в клетках мезофилла оказалась выше, чем в клетках обкладки. Обнаружено сходство значений ассимилирующей поверхности мезофилла и хлоропластов у растений С3- и С3-С-4-типов фотосинтеза, а также С4-НАД- и С4-НАДФ-типов. Общее число клеток и число хлоропластов клеток мезофилла положительно коррелировали с содержанием общих липидов в расчете на единицу площади листа (r = 0.95, P = 0.04). Содержание кислоты 18:2(n-6) снижалось, а 18:1(n-9) увеличивалось в ряду С3→ C3–С4 → C4- НАД → C4-НАДФ-видов. Сделан вывод, что увеличение различий между объемом и поверхностью клеток и хлоропластов мезофилла и обкладки проводящих пучков, а также снижение количества мембранных липидов клеток, хлоропластов и митохондрий в единице площади листа связано с выраженностью С4-синдрома. Состав липидов и жирных кислот поддерживает метаболическую активность хлоропластов и митохондрий в зависимости от типа фотосинтеза.
ВВЕДЕНИЕ
Cемейство, или клада Chenopodiaceae Vent. (Amarantháceae) – один из самых разнообразных в структурно-функциональном отношении таксонов растений. Согласно современным представлениям, Chenopodiaceae часто рассматривается в составе Amaranthaceae Juss. (s.l.) как приоритетного названия или как клада Chenopodiaceae/Amaranthaceae [1]. Большинство видов Chenopodiaceae адаптированы к галофитным, гипергалофитным, ксерофитным и ксерогалофитным сообществам или рудеральным местам обитания [2].
Структурно-функциональные свойства отражают разнообразие механизмов адаптации видов Chenopodiaceae к специфическим почвенно-климатическим условиям и определяют их экологические стратегии. Представители данного семейства способны регулировать поглощение солей, усиливая их внутриклеточную компартментацию (эугалофиты) или ограничивая проникновение в метаболически активные части (крино- и гликогалофиты) [3, 4]. Среди них широко распространены виды с разными метаболическими типами фотосинтеза [3]. Виды с С3-типом фотосинтеза встречаются по всему градиенту засоления почв, вплоть до пухлых солончаков, на которых, например, произрастает однолетний С3-эугалофит Salicornia perennans. На средне-засоленных участках часто встречаются виды с С4-НАД-МЭ типом фотосинтеза (аспартатный подтип С4-фотосинтеза), типичным представителем которых является однолетник Climacoptera crassa. Виды с С4-НАДФ-МЭ типом фотосинтеза (малатный подтип), например, полукустарничек Kochia prostrata, предпочитают менее засоленные и песчаные почвы [5]. Кроме того, в сем. Chenopodiaceae встречаются промежуточные С3–С4 виды с С2-фотосинтезом, примером которых, на основе анатомических особенностей, а также анализа газообмена и иммунолокализации глициндекарбоксилазы [6], является однолетнее растение Sedobassia sedoides. Вид S. sedoides имеет специфическое анатомическое строение, которое выделено в отдельный тип – Sedobassia [7, 8].
В процесс фотосинтеза вовлечены сложные взаимодействия отдельных фотосистем, органелл, клеток и тканей листа для создания оптимального соотношения структуры и функции. Каждый из этих уровней организации фотосинтетического аппарата характеризуется определенными критериями, которые могут меняться в зависимости от внешних условий [9, 10]. Например, листовая архитектоника определяется типом строения мезофилла листа, количеством, размерами и формой фотосинтезирующих клеток [11]. Интегральные параметры мезофилла, такие как число хлоропластов в единице площади листа и общая площадь поверхности мезофильных клеток и хлоропластов, характеризуют величину поверхности обмена для CO2 и в значительной степени влияют на его проводимость [12]. Скорость диффузии СО2 из межклеточных пространств мезофилла до стромы хлоропласта зависит также от проницаемости клеточной стенки и мембран клетки и хлоропласта.
Фотосинтезирующая органелла – хлоропласт – имеет двойную внешнюю оболочку и содержит внутренние тилакоидные мембраны [13]. Тилакоиды являются участками фотосинтеза, отвечая за световые реакции. В них локализованы четыре основные субъединицы: ФС I, ФС II, цитохром b6f и АТФ-синтаза. Обе ФС связывают хлорофиллы (Хл) и каротиноиды (Кар) и состоят из ядра и светособирающих комплексов (ССК). Структурными элементами мембран тилакоидов являются липиды: моногалактозилдиацилглицерин (МГДГ), дигалактозилдиацилглицерин (ДГДГ), сульфохиновозилдиацилглицерин (СХДГ) и фосфорсодержащий липид фосфатидилглицерин (ФГ) [14].
Функции хлоропластов тесно связаны с митохондриями [15]. Обе органеллы в растительных клетках служат внутриклеточными энергетическими центрами, которые снабжают клетку энергией посредством деятельности дыхательных и фотосинтетических цепей, локализованных в мембранах. Для выполнения этой роли им требуется активный обмен ионами, метаболитами, липидами [16]. Митохондриальные мембраны растений содержат два преобладающих класса липидов – фосфатидилхолин (ФХ) и фосфофатидилэтаноламин (ФЭ), а также другие классы липидов – ФГ, фосфатидилинозит (ФИ) и специфичный для митохондрий дифосфатидилглицерин (ДФГ) [15]. Липиды в мембранах хлоропластов и митохондрий не только обеспечивают их целостность, но и поддерживают функциональную специфичность интегральных белков, вовлеченных в ионное гомеостатирование, фотохимические и электронтранспортные и другие процессы [17].
Структурные и биохимические различия между видами с разными типами фотосинтеза на уровне строения фотосинтезирующих тканей и клеток хорошо известны [5]. В отличие от клеточного уровня, тонкие различия в структурной организации отдельных органелл между галофитами и гликофитами, а также галофитами с разным типом фотосинтеза остаются в значительной степени неизученными.
Цель работы – выявление мезо- и ультраструктурных особенностей фотосинтетических органов и тканей у галофитов сем. Chenopodiaceae с разными типами фотосинтетического метаболизма.
МАТЕРИАЛЫ И МЕТОДЫ
Район исследования входит в состав Прикаспийской низменности. Климатические условия территории характеризуются недостаточным увлажнением, сильной засушливостью, особенно в весенне-летний период. Максимальная температура июля за последние 5 лет составила 41.4°С. Среднегодовое количество осадков – 181.9–190.0 мм, среднемесячная влажность воздуха наиболее теплого месяца – 47%, величина гидротермического коэффициента ~ 0.4 [18].
Растительный материал. Объектами исследования стали четыре галофита сем. Chenopodiaceae с разными типами фотосинтеза: однолетники солерос солончаковый (Salicornia perennans Willd., C3-тип фотосинтеза) и седобассия очитковая (Sedobassia sedoides (Pall.) Freitag & Kadereit, промежуточный С3-С4-тип), климакоптера мясистая (Climacoptera crassa (M. Bieb.) Botsch., С4-НАД-тип) и многолетний полукустарничек кохия распростертая (Kochia prostrata (L.) Schrad., С4-НАДФ-тип). Для анализов использовали листья C. crassа, S. sedoides, K. prostrata и листья, сросшиеся с побегом у S. perennans. Образцы растений отбирали на площадках размером 20 х 20 м. Виды C. crassa, K. prostrata и S. sedoides произрастали на верхней надпойменной террасе в северо-западной части оз. Эльтон (49°10′12′′ с. ш., 46°34′30′′ в. д.), а S. perennans – в непосредственной близости от уреза воды (49°10′09′′ с. ш., 46°34′36′′ в. д.). Биоценоз первого экотопа представлен разреженным мятликово-прутняковым сообществом с участием черной полыни, тип почвы – солонец мелкий непромытый от солей. Второй экотоп представлен монодоминантным солеросовом сообществом, тип почвы – солончаки луговые.
Растительный материал отбирали в первой декаде июня 2018 г. в первой половине дня. Для биохимических анализов использовали полностью сформировавшиеся листья среднего яруса (или в случае S. perennans – среднюю часть побега) из 5–10 растений одного и того же вида в пределах одного экотопа. Для анализа пигментов отбирали навески по 0.5 г сырой массы, для липидов – по 1 г, для определения содержания воды и ионов – по 1 г. Для выделения фракций хлоропластов и митохондрий отбирали пробы по 5 г для каждого вида растений. Все образцы в трех биологических повторностях замораживали в жидком азоте и хранили вплоть до проведения анализа.
Cодержание ионов в листьях (побегах) определяли в сухом размолотом материале после минерализации проб с применением метода оптической эмиссионной спектроскопии с индуктивно связанной плазмой на приборе Spectro Ciros-ССD (“SPECTRO Analytical Instruments”, Германия) [19].
Содержание воды определяли после высушивания образцов до постоянного веса при 60°С и выражали в % от сырой массы.
Количественные показатели мезоструктуры листа получены согласно методике анализа мезоструктуры листа и проекционного метода определения параметров клеток мезофилла [11]. Высечки свежих листьев 5–10 растений фиксировали в 3.5% растворе глутарового альдегида в фосфатном буфере (рН = 7.4) в полевых условиях. Число клеток в единице площади листа определяли в суспензии клеток, полученной после мацерации листовых высечек известной площади в 20% растворе КОН при нагревании до кипения. Подсчитывали количество клеток мезофилла и обкладки (NcellM/BS) проводящих пучков в счетной камере Горяева под световым микроскопом Zeiss Axiostar (“Zeiss”, Германия) при увеличении ×200. Число хлоропластов в клетках (Сhp) и размеры клеток измеряли в суспензии клеток после мацерации листовых высечек в 1NHCl при нагревании до 50°С в течение 10 мин. Объем клеток (Vcel) рассчитывали с помощью проекционного метода, используя для расчетов средние значения площади и периметра проекции и коэффициенты, зависящие от формы клетки. Двумерный коэффициент формы клетки K2d рассчитывали, как безразмерное отношение квадрата периметра проекции к ее площади [11]. Размеры хлоропластов измеряли на поперечных срезах листьев, используя световой микроскоп Zeiss Axiostar и программу SIAMS Mesoplant (“SIAMS”, Россия). Путем умножения числа хлоропластов (Сhp) в клетке на число клеток в единице площади листа мезофилла и обкладки определяли количество хлоропластов в единице площади листа (NchpМ/BS). Клеточный объем одного хлоропласта (КОХ) – объем клетки, соответствующий одному хлоропласту (мкм3) – рассчитывали как отношение объема клетки к числу хлоропластов в ней, суммарную площадь поверхности клеток мезофилла (Ames/A(М) и обкладки (Ames/A(BS)) определяли в единице площади листа, см2/см2.
Анализ фотосинтетических пигментов и расчет ССК. Содержание фотосинтетических пигментов определяли спектрофотометически на приборе ПЭ-3000 УФ (ООО ПромЭкоЛаб, Россия) в ацетоновой вытяжке (90%) при длинах волн 662, 664 нм (Хл а, b) и 470 нм (Кар). Расчет концентрации выделенных пигментов производили по методу [20]. Долю Хл в ССК рассчитывали по формуле (1.2 Хл b + + Хл b)/ ∑ (Хл а + Хл b).
Выделение и анализ хлоропластов и митохондрий. Навеску растений массой 5 г после извлечения из жидкого азота гомогенизировали с помощью фарфоровой ступки и пестика с добавлением 15 мл охлажденной среды выделения (0.5 М сахарозы, 50 мМтрис-НС1, 5 мМ ЭДТА, 5 мкМ меркаптоэтанола, рН 7.8), фильтровали через три слоя капрона. На первом этапе гомогенат центрифугировали 1 мин при 500 g для отделения тяжелых элементов клетки, затем супернатант центрифугировали 10 мин при 3500 g. В полученном осадке содержится фракция хлоропластов. Супернатант центрифугировали при 15 000 g (при +4°C) в течение 15 мин для получения фракции митохондрий. Полученный осадок ресуспендировали в среде, содержащей 0.5 М сахарозы и 5 мМ Трис-HCl (pH 7.2) и центрифугировали при 15 000 g (при +4°C) в течение 15 мин для получения очищенных митохондрий. Чистоту фракций хлоропластов и митохондрий проверяли с помощью электронного микроскопа JEM 100B (“JEOL”, Япония). Все операции проводили при температуре 4°С.
Липиды из листьев и из фракций хлоропластов и митохондрий экстрагировали смесью хлороформа и метанола 1 : 2 (по объему) и разделяли методом тонкослойной хроматографии. Экстракцию, разделение и анализ липидов осуществляли, как описано ранее [21]. Содержание общих липидов (ОЛ) рассчитывали как сумму проанализированных отдельно нейтральных липидов, гликолипидов (ГЛ) и фосфолипидов (ФЛ). Количество ФЛ, ГЛ и стеринов определяли денситометрически с помощью программы Денскан-04 (ООО НТЦ Ленхром, Россия), в отдельных случаях – с помощью специфических реакций на спектрофотометре ПЭ-3000 УФ. На денситометре хроматограммы анализировали в режиме параболической аппроксимации по калибровочным кривым, используя МГДГ и ФХ (“Sigma”, Германия) в качестве стандартов [22].
Жирные кислоты (ЖК) анализировали в виде их метиловых эфиров, используя газовый хроматограф Кристалл-5000.1 (ЗАО СКБ Хроматэк, Россия), в изотермическом режиме на капиллярной колонке Rtx Т-2330 (“Restek”, США) длинной 105 м и диаметром 0.25 мм. Температура колонки – 180°С, испарителя и детектора – 260°С, скорость тока газа-носителя (гелий) – 2 мл/мин.
Анализ каждого компонента проводили трижды в каждой биологической пробе. В таблицах и рисунках приведены средние арифметические значения (M) со стандартной ошибкой (±SE). Сравнение количественных признаков данных проводилось c помощью однофакторного дисперсионного анализа (One-way ANOVA). Расчеты выполняли в программах Statistica 6.0 for Windows, Past 3 и Microsoft Excel 2007. Для выявления информативных признаков, характеризующих растения с разным типом фотосинтеза, был использован метод главных компонент РСА.
РЕЗУЛЬТАТЫ
Содержание катионов и воды в надземной массе растений
Все исследованные виды преимущественно накапливали ионы Na+. При этом в клетках однолетников с суккулентными листьями накапливалось в 7–15 раз больше Na+, чем многолетнего полукустарничка K. prostratа. Различались растения и по накоплению ионов K+, большая концентрация которых обнаружена в клетках K. prostratа. Содержание ионов Mg2+ в побегах травянистого однолетника S. perennans и листьях полукустарничка K. prostratа было в 2–3 раза больше по сравнению с однолетниками C. crassa и S. sedoides. Количество ионов Ca2+ в листьях изученных видов было низким, за исключением С3–С4-вида S. sedoides (табл. 1). Содержание основных одно- и двухвалентных катионов в надземной массе исследованных галофитов в пересчете на сухую массу суммарно составляло от 1.2 до 18%.
Таблица 1.
Содержание водорастворимых катионов и воды в надземной массе исследованных видов сем. Chenopodiaceae с разными типами фотосинтеза
| Параметр | Виды растений | |||
|---|---|---|---|---|
| S. perennans (С3) |
S. sedoides (С3–С4) |
C. crassa (С4-НАД) |
K. prostrata (С4-НАДФ) |
|
| Ca2+ | 0.6 ± 0.1c | 5.3 ± 0.2a | <0.04d | 1.0 ± 0.0b |
| Mg2+ | 36.5 ± 0.2b | 18.3 ± 0.1c | 14.8 ± 0.2d | 49.4 ± 0.3a |
| Na+ | 612.4 ± 30.1c | 856.5 ± 2.6b | 1342.2 ±14.6a | 87.0 ± 0.4d |
| K+ | 13.8 ± 2.9d | 29.1 ± 0.4b | 17.0 ± 1.4c | 47.1 ± 0.4a |
| ∑ катионов, % от сухой массы | 17.8 | 11.1 | 17.7 | 1.2 |
| H2O, % | 91.3 ± 2.2a | 80.7 ± 7.0b | 82.0 ± 4.0b | 60.0 ± 5.0c |
Количественные параметры мезоструктуры листа
Анализ параметров мезоструктуры листа показал, что С3-вид S. perennans имел недифференцированную по форме клеток хлоренхиму в фотосинтезирующих побегах. У С3–С4-вида и двух С4-видов, обладающих Кранц-анатомией, ткани дифференцированы на мезофилл и хлорофиллсодержащую обкладку проводящих пучков. Число фотосинтезирующих клеток у С3-вида S. perennans было в 2–5 раз ниже, чем суммарное число хлорофиллоносных клеток у других видов растений. В листьях С3–С4-вида и C4-видов содержалось большее число клеток мезофилла по сравнению с клетками обкладки. При этом число клеток обкладки увеличивалось в ряду видов С3–С4 – С4-НАД – С4-НАДФ (табл. 2 ).
Параметры фотосинтезирующих клеток характеризовались высокой степенью видоспецифичности. Клетки мезофилла С3-вида S. perennans были существенно крупнее в сравнении с клетками мезофилла и обкладки С4-видов (рис. 1а) и имели в 1.5–3.5 раз больше хлоропластов. Виды с Кранц-анатомией различались размерами и соотношением числа клеток обкладки и мезофилла. Клетки обкладки и мезофилла у С3–С4-вида S. sedoides имели равные размеры. У С4-вида C. crassa объем клеток обкладки был в 2.5 раза больше, чем объем клеток мезофилла, а у K. prostrata это отношение увеличивалось до 5. При этом пластиды у C. crassa и S. sedoides в клетках мезофилла и обкладки были сходными по размерам, сравнимые с размерами хлоропластов у С3-вида (рис. 1б). В отличие от них, у K. prostratа хлоропласты в клетках обкладки имели большие размеры, чем в клетках мезофилла. У C. crassa число хлоропластов в клетках обкладки было вдвое выше, чем в мезофилле, а у K. prostrata и S. sedoides количество хлоропластов в обоих типах клеток достоверно не отличалось. Объем, приходящийся на один хлоропласт, в клетках мезофилла оказался наибольшим у С3-вида, а в клетках обкладки – у С4-НАДФ-вида (рис. 1в). Однако суммарно хлоропласты С4-видов занимали больший объем клетки, чем С3- и С3–С4-видов (рис. 1г).
Рис. 1.
Объемные параметры мезофилла листа изученных видов сем. Chenopodiaceae: а – объем клетки мезофилла/обкладки (Vcell); б – объем хлоропласта (Vchp); в – объем клетки, приходящийся на один хлоропласт (КОХ); г – относительнй объем хлоропластов в клетке мезофилла/обкладки (VchpM/Vcell); д – суммарная площадь поверхность клеток мезофилла/обкладки (Acell/A) в единице площади листа; е – суммарная площадь поверхности хлоропластов в клетках мезофилла/обкладки (Achp/A). 1 – мезофилл, 2 –обкладка. Cc – C. crassa, Kp – K. prostrate, Ss – S. sedoides, Sp – S. perennans. Примечание. Разными буквами обозначены достоверные различия между видами растений при P < 0.05.
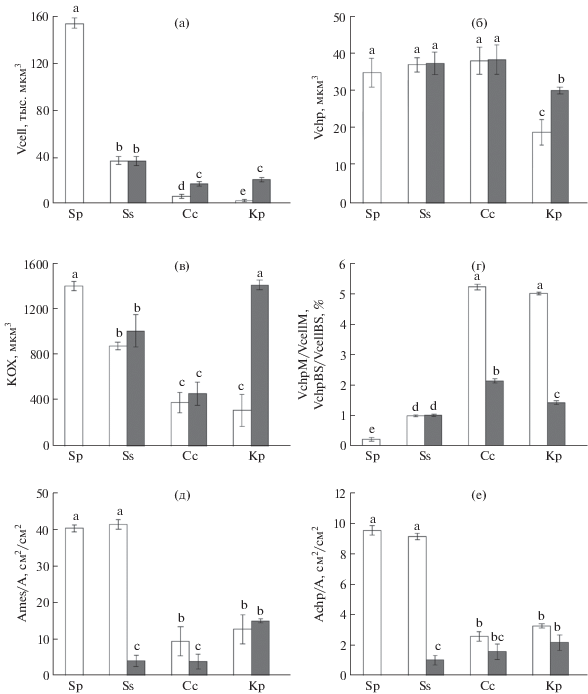
Размеры клеток и хлоропластов и их число в единице площади листа определяли общую ассимилирующую поверхность хлоренхимы (Ames/A) и суммарную площадь поверхности хлоропластов (Achp/A). Ассимилирующая поверхность клеток мезофилла у видов S. perennans и S. sedoides была равна по величине и в 2–3 раза больше, чем у С4-видов (рис. 1д). Суммарная площадь поверхности хлоропластов в единице площади листа (Achp/A) у растений с Кранц-анатомией в клетках мезофилла была больше, чем в клетках обкладки (рис. 1е). В целом наблюдалось сходство значений ассимилирующей поверхности мезофилла и хлоропластов (Ames/A и Achp/A) у растений с С3- и С3–С–4-типом фотосинтеза, а также С4-НАД- и С4-НАДФ-типом (рис. 1д, е), хотя у растений малатного метаболического подтипа фотосинтеза показатель Ames/A выше, чем у аспартатного подтипа.
Содержание фотосинтетических пигментов
Суммарное содержание Хл между отдельными видами различалось в 1.7 раз (табл. 3). Меньшая концентрация Хл обнаружена у С4-НАД-вида C. crassa. Для С3-вида S. perennans характерным оказалось низкая величина показателя отношения Хл а/b, но большая доля Хл, локализованного в ССК. Максимальным значением отношения Хл а/b, но при этом низким отношением Хл/Кар, характеризовался С4-НАДФ-вид K. prostrata.
Таблица 2.
Морфологические параметры листа видов сем. Chenopodiaceae с разным типом фотосинтеза
| Параметр | Виды растений | |||
|---|---|---|---|---|
| S. perennans (С3) |
S. sedoides (С3–С4) |
C. crassa (С4-НАД) |
K. prostrata (С4-НАДФ) |
|
| Толщина листа, мкм | 2300 ± 120a | 430 ± 3.4c | 870 ± 12b | 370 ± 7d |
| Число клеток мезофилла (М) 103 см–2 | 247 ± 11d | 577 ± 5b | 411 ± 10c | 881 ± 80a |
| Число клеток обкладки (BS) 103 см–2 | – | 77 ± 5c | 120 ± 5b | 392 ± 6a |
| Общее число клеток 103 см–2 | 247 ± 11d | 654 ± 5b | 531 ± 10c | 1237 ± 73a |
| Отношение числа клеток, М/BS | 7 | 3.4 | 2.2 | |
| Число хлоропластов в клетке М, шт. | 110 ± 10a | 43 ± 3b | 19 ± 2c | 12 ± 1d |
| Число хлоропластов в клетке BS, шт. | – | 37 ± 3a | 39 ± 4a | 15 ± 3b |
Таблица 3.
Состав и содержание пигментов (мг/г сухой массы) в листьях исследованных видов сем. Chenopodiaceae
| Параметр | Виды растений | |||
|---|---|---|---|---|
| S. perennans (С3) |
S. sedoides (С3–С4) |
C. crassa (С4-НАД) |
K. prostrata (С4-НАДФ) |
|
| Хл а | 1.95 ± 0.19c | 2.90 ± 0.30a | 1.70 ± 0.21c | 2.24 ± 0.22b |
| Хл b | 0.92 ± 0.06a | 0.83 ± 0.04a | 0.57 ± 0.05b | 0.57 ± 0.06b |
| Кар | 0.69 ± 0.01b | 0.98 ± 0.06a | 0.51 ± 0.03c | 0.70 ± 0.03b |
| Хл а/b | 2.13 | 3.50 | 3.00 | 3.93 |
| Хл/Кар | 4.17 | 3.79 | 4.44 | 4.01 |
| ССК, % | 70.4 | 48.9 | 55 | 44.6 |
Липиды и жирные кислоты
Содержание ОЛ в клетках и органеллах галофитов представлено в таблице 4. Количество мембранных липидов, включая ГЛ, ФЛ и стерины, составляло от 68 (K. prostrata) до 88% (C. crassa) от общего содержания липидов клетки (табл. 4). Более низкое содержание мембранных липидов в клетках K. prostrata связано с накоплением нейтральных липидов, выполняющих, в основном, запасающую функцию.
Таблица 4.
Общие и мембранные липиды клетки, выделенные из тканей листьев галофитов сем. Chenopodiaceae с разным типом фотосинтеза
| Клетка/ органелла |
Липиды, мкг/см2 листа | |||
|---|---|---|---|---|
| S. perennans (С3) |
S. sedoides (С3–С4) |
C. crassa (С4-НАД) |
K. prostrata (С4-НАДФ) |
|
| ОЛ клетки | 950 ± 94a | 910 ± 89a | 940 ± 30a | 310 ± 30b |
| МЛ клетки | 790 ± 80a | 740 ± 60a | 830 ±30a | 210 ± 25b |
Более подробный анализ состава липидов, определяющих мембраны хлоропластов показал, что по относительному вкладу отдельных классов липидов у S. sedoides доминировал МГДГ, у остальных видов относительные количества МГДГ и ДГДГ были равны (рис. 2). Для С3-вида S. perennans характерно одинаковое содержание анионных липидов ФГ и СХДГ, а для С4-НАДФ-вида K. prostrata – большее содержание ФГ, чем СХДГ.
Рис. 2.
Состав ГЛ (а) и ФЛ (б) мембран хлоропластов и митохондрий галофитов сем. Chenopodiaceae с разным типом фотосинтеза:Cc – C. crassa, Kp – K. prostrate, Ss – S. sedoides, Sp – S. perennans. (а) 1 – МГДГ, 2 – ДГДГ, 3 – СХДГ, 4 – ФГ; (б) 1 – ФХ, 2 – ФЭ, 3 – ФГ, 4 – ФИ, 5 – ФК, 6 – ДФГ. Разными буквами обозначены достоверные различия между видами растений при P < 0.05.

В составе липидов митохондрий исследованных видов доминировал ФХ (36–57% от суммы ФЛ). У всех видов обнаружено высокое относительное содержание фосфатидной кислоты (ФК) – около 20%). Кроме того, у С4-видов в составе липидов оказалась высокая доля ФГ (13–16% от суммы липидов против 6–8% у S. perennans и S. sedoides, соответственно). В целом, в митохондриях наблюдалась тенденция увеличения содержания ФГ в ряду С3 → С3–4 → С4. Содержание специфичного для митохондрий липида ДФГ варьировало в интервале 5–8%.
В липидах хлоропластов и митохондрий галофитов, также как в суммарных липидах клетки, преобладали ЖК с длиной цепи 16 и 18 атомов углерода (табл. 5). Относительное содержание пальмитиновой (16:0), линолевой (18:2(n-6)) и α-линоленовой (18:3(n-3)) кислот составляло более 90% у всех видов растений. Сравнение состава ЖК исследованных видов с данными литературы показывает общую закономерность распределения ненасыщенных ЖК от наибольшего содержания α-линоленовой кислоты к наименьшему олеиновой кислоты 18:1(n-9), а также преобладание среди насыщенных ЖК 16:0 [23]. Однако состав ЖК в липидах обеих фракций С4-видов отличался от С3-вида S. perennans высоким, пятикратно превышающим относительным содержанием 18:1(n-9) и меньшим количеством 18:2(n-6). Относительное содержание основной насыщенной ЖК 16:0 было наименьшим у С4-НАДФ-вида как в хлоропластах, так и митохондриях.
Таблица 5.
Состав жирных кислот липидов клетки, хлоропластов и митохондрий галофитов сем. Chenopodiaceae с разным типом фотосинтеза, % от суммы ЖК
| ЖК1 | Виды растений | |||
|---|---|---|---|---|
| S. perennans (С3) |
S. sedoides (С3–С4) |
C. crassa (С4-НАД) |
K. prostrata (С4-НАДФ) |
|
| Клетка | ||||
| 16:0 | 24.8 ± 1.4a | 18.7 ± 1.7b | 21.6 ± 1.8b | 19.4 ± 1.6b |
| 16:1(n-9) | 1.6 ± 0.1b | 1.6 ± 0.1b | 1.7 ± 0.1b | 2.0 ± 0.1a |
| 18:0 | 2.1 ± 0.2a | 2.1 ± 0.2a | 1.9 ± 0.1a | 1.9 ± 0.1a |
| 18:1(n-9) | 4.1 ± 0.3c | 16.5 ± 1.1b | 19.7 ± 1.7a | 4.1 ± 0.2c |
| 18:2(n-6) | 22.0 ± 2.1a | 10.3 ± 0.9c | 16.8 ± 1.3b | 9.0 ± 0.8c |
| 18:3(n-3) | 40.3 ± 2.1a | 46.0 ± 3.2a | 35.1 ± 1.8b | 43.9 ± 2.7a |
| Другие ЖК | 5.1 ± 0.4b | 4.8 ± 0.4b | 3.2 ± 0.2c | 19.7 ± 1.5a |
| Хлоропласты | ||||
| 16:0 | 26.3 ± 1.1b | 19.9 ± 1.7a | 23.0 ± 0.5c | 18.0 ± 0.2 |
| 16:1(n-9) | 2.1 ± 0.2b | 2.2 ± 0.1b | 1.7 ± 0.1c | 3.3 ± 0.2a |
| 18:0 | 2.5 ± 0.2a | 1.9 ± 0.2b | 2.4 ± 0.2a | 2.2 ± 0.1ab |
| 18:1(n-9) | 3.3 ± 0.3c | 15.3 ± 1.2b | 16.7 ± 1.4ab | 19.0 ± 1.2a |
| 18:2(n-6) | 17.6 ± 1.5a | 12.4 ± 0.9b | 13.2 ± 1.1b | 8.0 ± 1.0c |
| 18:3(n-3) | 44.5 ± 1.8a | 44.3 ± 1.5a | 37.3 ± 2.5b | 43.0 ± 2.4a |
| Другие ЖК | 3.7 ± 0.4b | 4.0 ± 0.4b | 5.7 ± 0.6a | 6.5 ±0.6a |
| Митохондрии | ||||
| 16:0 | 34.3 ± 2.0a | 21.7 ± 1.7b | 24.7 ± 1.4b | 18.0 ± 1.0c |
| 16:1(n-9) | 1.6 ± 0.1b | 1.7 ± 0b | 1.6 ± 0.1b | 2.0 ± 0.2a |
| 18:0 | 3.6 ± 0.3a | 3.4 ± 0.4a | 2.3 ± 0.3b | 2.0 ± 0.2b |
| 18:1n9c | 6.5 ± 1.0c | 16.9 ± 1.9b | 19.5 ± 1.5ab | 20.6 ± 0.6a |
| 18:2n6c | 23.2 ± 1.0a | 10.3 ± 0.3c | 16.6 ± 1.0b | 9.4 ± 0.4d |
| 18:3n3 | 25.0 ± 2.0c | 40.6 ± 1.6a | 31.4 ± 1.4b | 40.3 ± 1.3a |
| Другие ЖК | 5.8 ± 0.5b | 5.4 ±0.4b | 3.9 ± 0.4c | 7.7 ± 0.5a |
ОБСУЖДЕНИЕ
Полученные нами результаты показывают, что исследованные галофиты сем. Chenopodiaceae обладают разными биохимическими типами фотосинтеза, разной регуляцией водно-солевого обмена и жизненной стратегией. Содержание ионов Na+, также как суммарное содержание ионов у однолетних трав S. perennans (С3-вид), S. sedoides (С3–С4-вид) и C. crassа (С4-НАД-вид) многократно выше, чем у многолетнего полукустарничка K. prostrata (С4-НАДФ-вид). Большее содержание ионов у однолетних растений связано с высокой долей суккулентности их листьев – необходимой чертой для поддержания осмотического баланса у растений-галофитов с поверхностной корневой системой. Многолетний полукустарничек K. prostrata отличается более длинными (до 6.5 м) корнями, благодаря чему имеет возможность добывать воду из более глубоких слоев почвы. Расчет коэффициентов корреляции для всех видов растений показал тесную положительную взаимосвязь толщины листа с оводненностью листьев (r = 0.98, P = 0.04), а также с суммой накопленных элементов в расчете на сухую массу листа (r = 0.96, P = 0.04).
Согласно современным представлениям, эволюция фотосинтетического углеродного метаболизма высших растений шла по пути формирования “надстроек” к восстановительному пентозофосфатному циклу Бенсона–Кальвина С3-растений, сопряженного с изменением характеристик клеток и их генетическим контролем в ряду С3 → C3–С4 → C4 [24]. Анатомическая структура листьев высших С3-растений обычно представлена клетками палисадной и губчатой паренхимы, не отличающимися по типу метаболизма. Диморфные и функционально разные фототрофные ткани считаются необходимым условием функционирования С4-фотосинтеза [25]. Растения с промежуточным типом фотосинтеза, такие как S. sedoides, имеют Кранц-подобную структуру листа с клетками обкладки, которые отличаются от обычных клеток мезофилла более компактной округлой формой, утолщенными стенками и специфическим расположением хлоропластов и митохондрий вдоль внутренней периклинальной и антиклинальной стенок [8]. В наших исследованиях фотосинтетическую функцию С3-вида S. perennans выполняет стебель с однотипной крупноклеточной внутренней паренхимой с большим содержанием воды, что соответствует галоморфному типу строения. У растений с дифференцированной хлоренхимой просматривается уменьшение отношения числа клеток мезофилла к обкладке с нарастанием С4 синдрома в ряду S. sedoides (С3–С4) > C. crassa (С4-НАД) > K. prostrata (С4-НАДФ) (табл. 2). В такой же последовательности менялось отношение размеров клеток мезофилла к клеткам обкладки.
Фотосинтетический потенциал листа зависит от интегральных параметров мезофилла, определяемых числом клеток и хлоропластов и их размерами. Так, общие поверхности клеток мезофилла и хлоропластов в единице площади листа у однолетников с С3- и С3–С4-типом фотосинтеза практически равны, но в 4 раза выше, чем у однолетника и многолетника с С4-типом фотосинтеза. У K. prostrata – слабого соленакопителя – выявлено самое большое число клеток и самое низкое число хлоропластов в клетках. Можно полагать, что количественные и качественные показатели мезоструктуры листа галофитов сем. Chenopodiaceae зависят как от проявления С4-синдрома, так и жизненной формы.
Сравнивая площадь поверхности клеток у двух С4-видов, можно увидеть различия в показателе величины общей поверхности мезофилла. У K. prostrata Ames/A доля клеток мезофилла выше, чем у C. crassа в 1.3 раза, а поверхность клеток обкладки в 3.7 раз, за счет большего числа клеток. Площадь поверхности хлоропластов в клетках обкладки у K. prostrata также выше в 1.3 раза по сравнению с C. crassа. Известно, что фотосинтетический аппарат НАДФ-МЭ более дифференцирован по сравнению с НАД-МЭ как в структурном, так и биохимическом отношениях [26]. У растений аспартатного подтипа система метаболизации С4-кислот связана только с митохондриями. У С4-малатных растений функция декарбоксилирования перешла к хлоропластам вместе с появлением специализированной малатдегидрогеназы – НАДФ-МЭ [27]. Все эти особенности отразились на количественных параметрах клетки и хлоропластов С4-видов галофитов, имеющих разные биохимические пути усвоения СО2. Обнаружена положительная взаимосвязь содержания ОЛ на единицу площади листа с общим числом клеток (r = 0.95, P = 0.04) и величиной общей поверхности клеток (r = 0.94 при Р < 0.06). На уровне строения тилакоидов НАДФ–МЭ- типу соответствует наличие крупных гран в хлоропластах мезофилла и агранальные или слабогранальные хлоропласты обкладки. В хлоропластах клетки обкладки растений этого подтипа снижена активность ФС II за счет дефицита гран, а в клетках мезофилла преобладают хлоропласты гран, содержащие как ФС II, так и ФС I. Клетки мезофилла подтипа НАД–МЭ имеют низкое содержание гран в хлоропласте и обладают высокой активностью ФС I, тогда как клетки обкладки, напротив, обогащены гранами с активной ФС II [28]. Образование и функционирование внутреннего пространства хлоропластов, в частности формирование гран, зависит, в том числе, от количества и состава пигментов и липидного профиля. Так, Хл b выступает в качестве основного регулятора размера антенны фотосинтетического аппарата и участвует в поддержании надмолекулярной организации тилакоидных мембран. В отличие от Хл а, который входит в состав реакционных центров и антенных комплексов ФС, Хл b локализуется в ССК ФС II. В хлоропластах мутантов с нарушениями биосинтеза Хл b снижена способность образовывать граны, а также изменен характер упаковки пигмент-белковых комплексов в гранальной мембране. Обнаруженное снижение концентрации Хл b с нарастанием С4 синдрома в исследованных галофитах (табл. 3) может быть связано с уменьшением количества гран в тилакоидном пространстве хлоропластов обоих типов клеток.
Хорошо известно, что эффективность работы субъединиц фотосинтетического аппарата, локализованных в мембранах тилакоидов, в значительной степени определяется физическим состоянием бислоя мембран. Создание оптимальной для функционирования мембранных белков среды определяется степенью ненасыщенности ЖК, балансом между стабилизирующими бислой липидами (“бислойные” и “небислойные”), а также количеством стеринов [13, 23]. Наиболее значимые события в составе ЖК в липидах клетки и органелл исследованных галофитов связаны с кислотами 18:1(n-9) и 18:2(n-6), а именно снижением содержания второй и увеличением первой в ряду С3→ C3–С4 → C4- НАД → C4-НАДФ-видов. Наличие в мембранных липидах 18:2(n-6) является критическим и достаточным условием для формирования характерной для организма текучести мембраны [23]. Снижение концентрации 18:2(n-6) способствует более плотной упаковке бислоя и меньшей его проницаемости. Благодаря способности С4-растений концентрировать СО2 в клетках, по-видимому, отпадает необходимость в повышенной проводимости мембран.
В отношении показателя, характеризующего соотношение “бислойных” и “небислойных” липидов, таких как МГДГ и ДГДГ в хлоропластах, связи с типом фотосинтеза не установлено. В липидах митохондрий отмечено высокое накопление ФГ, особенно у С4-видов (рис. 3в). По некоторым сведениям, накопление в органеллах ФГ может облегчать транспорт метаболитов через мембраны [29], что особенно важно для С4-растений с диморфными клетками и органеллами. Среди липидов митохондрий обнаружено также необычно высокое содержание ФК. Как правило, содержание этого класса липидов в митохондриях растений не превышает 1%. Липиды данного типа, подобно МГДГ и ФЭ, склонны к образованию гексагональной фазы, вследствие чего не способны образовывать классический бислой [29], но обеспечивают формирование мембран с большим количеством изгибов. Высокое относительное содержание ФК (более 20%) в мембранных липидах отражало общую закономерность для исследуемых растений. В липидах мембран митохондрий обнаружено такое же высокое содержание полиеновых ЖК, как и в мембранах клетки и пластид с такой же направленностью изменения содержания 18:2(n-6) и 18:3(n-3).
Рис. 3.
Анализ взаимосвязи мезоструктурных и биохимических показателей с типом фотосинтеза растений методом РСА. Обозначения векторов: Тип ФС – тип фотосинтеза; Na – содержание натрия в листьях; H2O – оводненность листьев; Ncell – число клеток; NcellBS – число клеток обкладки; NChpM – число хлоропластов в клетках мезофилла; МtФГ – содержание ФГ в митохондриях; Мt18:1 – содержание 18:1(n-9) в митохондриях; Мt18:2 – содержание 18:2(n-6) в митохондриях; Мt18:3 – содержание 18:3(n-3) в митохондриях; ФГChpМ – содержание ФГ в хлоропластах мезофилла; Chp18:1 – содержание 18:1(n-9) в хлоропластах; Chp18:2 – содержание 18:2(n-6) в хлоропластах; Хл а/b – отношение хлорофиллов a/b; Хл b – содержание хлорофилла b; ССК – доля хлорофиллов в светособирающем комплексе.

Необходимо добавить, что мембранные системы галофитов важны не только для обеспечения фотосинтетической функции, но и для транспорта ионов [16]. Поддержание Na+/K+ гомеостаза клетки, кроме эффективности работы трансмембранных переносчиков, может зависеть от состава и свойств клеточных мембран, структуры клетки и ее размеров. Для выявления характеристик, связанных с усилением С4-синдрома и аккумуляции Na+, а также возможных взаимосвязей между показателями мезо- и ультраструктры листа, был использован многофакторный анализ по методу главных компонент. Для основного набора характеристик было создано двухфакторное пространство на основе корреляционной матрицы. Фактор 1 описывает 79% общей вариации, фактор 2 – 13% (рис. 3). Вектор “тип фотосинтеза” (тип ФС) обозначает переход от С3-типа к промежуточному С3–С4 – и далее к C4-типу фотосинтеза. Он положительно связан с фактором 1 (r = 0.86) и с фактором 2 (r = 0.41). Вектор “содержание Na+” (Na) отражает накопление Na+ в листьях, данный вектор отрицательно взаимосвязан с фактором 1 (r = –0.78) и положительно с фактором 2 (r = 0.62). Однонаправленность векторов “тип ФС” и векторов таких переменных, как число клеток обкладки (NcellO), содержание кислоты 18:1(n-9) в хлоропластах (Chp18:1) и митохондриях (Мt18:1), содержание ФГ (МtФГ) и 18:3(n-3) в митохондриях (Мt18:3), отношение Хл а/b (a/b), говорит о положительной корреляции, которая тем сильнее, чем ближе они находятся друг к другу. Обратная связь установлена с такими переменными как содержание Хл b и число хлоропластов в клетках мезофилла (NChpM). С вектором “содержание Na” больше всего связан показатель оводненности листа (Н2О). Такие показатели, как содержание ФГ в хлоропластах мезофилла (ФГChpМ), содержание кислоты 18:2(n-6) в хлоропластах (Chp18:2) и митохондриях (Mt18:2), доля Хл в ССК, также имели положительную связь с накоплением Na+.
ЗАКЛЮЧЕНИЕ
Накопление ионов солей в листьях видов сем. Chenopodiaceae тесно связано с толщиной фотосинтетических органов и степенью их суккулетности, но не со степенью выраженности С4-синдрома. Выраженность С4-синдрома у изученных представителей сем. Chenopodiaceae проявляется в мезо- и ультраструктурных характеристиках листьев, прежде всего, в увеличении различий между объемом и поверхностью клеток и хлоропластов мезофилла и обкладки проводящих пучков, а также в снижении количества мембранных липидов клеток, хлоропластов и митохондрий в единице площади листа. Это способствует функциональной разгрузке фотосинтетических органов и снижению затрат на построение единицы площади листа. Увеличение концентрации ФГ в митохондриях, а также 18:1(n-9) в липидах митохондрий и хлоропластов происходит при усилении С4-синдрома. Вероятно, выраженность С4-типа фотосинтеза тесно связана с метаболической активностью хлоропластов и митохондрий.
Работа выполнена в рамках плана научных исследований в соответствии с государственным заданием № АААА-А17-117112040039-7, подтема 1.8 “Изучение механизмов адаптации в регуляции устойчивости ресурсных видов растений в экосистемах в связи с прогнозируемым изменением климата”, а также при поддержке проекта Министерства науки и высшего образования FEWZ-2020-0009.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Сухоруков А.П. Карпология семейства Chenopodiaceae в связи с проблемами филогении, систематики и диагностики его представителей. Тула: Гриф и К, 2014. 400 с.
Kühn U. Chenopodiaceae // The families and genera of vascular plants. V. 2: Flowering Plants, Dicotyledons: Magnoliid, Hamamelid and Caryophyllid families / Eds. Kubitzki K., Rohwer J.G., Bittrich V. New York: Springer, 1993. P. 253.
Flowers T.J., Colmer T.D. Plant salt tolerance: adaptations in halophytes // Ann. Bot. 2015. V. 115. P. 327. https://doi.org/10.1093/aob/mcu267
Shabala S., Mackay A. Ion transport in halophytes // Advan. Bot. Res. 2011. V. 57. P. 151. https://doi.org/10.1016/B978-0-12-387692-8.00005-9
P’yankov V.I., Ziegler H., Hossein A., Deigele C. Lüttge U. European plants with C4 photosynthesis: geographical and taxonomic distribution and relations to climate parameters // Bot. J. Linnean Soc. 2010. V. 163. P. 283. https://doi.org/10.1111/j.1095-8339.2010.01062.x
Voznesenskaya E.V., Koteyeva N.K., Akhani H., Roalson E.H., Edwards G.E. Structural and physiological analyses in Salsoleae (Chenopodiaceae) indicate multiple transitions among C3, intermediate, and C4 photosynthesis // J. Exp. Bot. 2013. V. 64. P. 3583.https://doi.org/10.1093/jxb/ert191
Ueno O. Structural and biochemical characterization of the C3-C4 intermediate Brassica gravinae and relatives, with particular reference to cellular distribution of Rubisco // J. Exp. Bot. 2011. V. 62. P. 5347. https://doi.org/10.1093/jxb/err187
Freitag H., Kadereit G. C3 and C4 leaf anatomy types in Camphorosmeae (Camphorosmoideae, Chenopodiaceae) // Plant Syst. Evol. 2014. V. 300, 665. https://doi.org/10.1007/s00606-013-0912-9
Cornelissen J.H.C., Lavorel S., Garnier E., Díaz S., Buchmann N., Gurvich D.E., Reich P.B., ter Steege H., Morgan H.D., van der Heijden M.G.A., Pausas J.G.H., Poorter H.A. Handbook of protocols for standardised and easy measurement of plant functional traits worldwide // Austral. J. Bot. 2003. V. 51. P. 335. https://doi.org/10.1071/BT02124
Ivanova L.A., Yudina P.K., Ronzhina D.A., Ivanov L.A., Hölzel N. Quantitative mesophyll parameters rather than whole-leaf traits predict response of C3 steppe plants to aridity // New Phytol. 2018. V. 217. P. 558. https://doi.org/10.1111/nph.14840
Ivanova L.A., P’yankov V.I. Structural adaptation of the leaf mesophyll to shading // Russ. J. Plant Physiol. 2002. V. 49. P. 419. https://doi.org/10.1023/A:1015513607202
Terashima I., Miyazawa S.I., Hanba Y.T. Why are sun leaves thicker than shade leaves? Consideration based on analyses of CO2 diffusion in the leaf // J. Plant Res. 2001. V. 114. P. 93. https://doi.org/10.1007/PL00013972
Kobayashi K. Role of membrane glycerolipids in photosynthesis, thylakoid biogenesis and chloroplast development // J. Plant Res. 2016. V. 129. P. 565. https://doi.org/10.1007/s10265-016-0827-y
Hölzl G., Witt S., Gaude N. Melzer M., Schöttler M.A., Dörmann P. The role of diglycosyl lipids in photosynthesis and membrane lipid homeostasis in Arabidopsis // Plant Physiol. 2009. V. 150. P. 1147. https://doi.org/10.1104/pp.109.139758
Horvath S.E., Daum G. Lipids of mitochondria // Prog. Lipid Res. 2013. V. 52. P. 590. https://doi.org/10.1016/j.plipres.2013.07.002
Pottosin I., Shabala S. Transport across chloroplast membranes: optimizing photosynthesis for adverse environmental conditions // Mol. Plant. 2016. V. 9. P. 356. https://doi.org/10.1016/j.molp.2015.10.006
Tsydendambaev V.D., Ivanova T.V., Khalilova L.A., Kurkova E.B., Myasoedov N.A., Balnokin Yu.V. Fatty acid composition of lipids in vegetative organs of the halophyte Suaeda altissima under different levels of salinity // Russ. J. Plant Physiol. 2013. V. 60. P. 661. https://doi.org/10.1134/S1021443713050142
Мелихов В.В., Зибаров А.А., Мелихова Н.П., Романова А.В. Характер и направленность изменений климатических параметров Волгоградской области // Бюл. Нижневолж. Агроунивер. компл.: наука и высш. проф. обр. 2019. Т. 1. С. 60.
Методические указания по уничтожению органических веществ в природных, питьевых, сточных водах и пищевых продуктах в СВЧ-системе “Минотавр-2”. Санкт-Петербург: Люмекс, 2005. 20 с.
Lichtenthaller H.K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes // Methods in enzymol. 1987. V. 148. P. 350. https://doi.org/10.1016/0076-6879(87)48036-1
Rozentsvet O.A., Bogdanova E.S., Ivanova L.A., Ivanov L.A., Tabalenkova G.N., Zakhozhiy I.G, Nesterov V.N. Structural and functional organisation of the photosynthetic apparatus in halophytes with different strategies of salt tolerance // Photosynthetica. 2016. V. 54. P. 405.
Rozentsvet O., Nesterov V., Bogdanova E., Kosobryukhov A., Zubova S., Semenova G. Structural and molecular strategy of photosynthetic apparatus organization of wild flora halophytes // Plant Physiol. Biochem. 2018. V. 129. P. 213. https://doi.org/10.1016/j.plaphy.2018.06.006
Лось Д.А. Десатуразы жирных кислот. Москва: Научный мир, 2014. 361 с.
Lundgren M.R., Osborne C.P., Christin P.-A. Deconstructing Kranz anatomy to understand C4 evolution // J. Exp. Bot. 2014. V. 65. P. 3357. https://doi.org/10.1093/jxb/eru186
Edwards G.E., Franceschi V.R., Voznesenskaya E.V. Single-cell C4 photosynthesis versus the dual-cell (Kranz) paradigm // Annu. Rev. Plant Biol. 2004. V. 55. P. 173. https://doi.org/10.1146/annurev.arplant.55.031903.141725
Пьянков В.И., Вахрушева Д.В. Пути первичной фиксации СО2 у С4-растений семейства маревых аридной зоны Средней Азии // Физиология растений. 1989. Т. 36. С. 228.
Omoto E., Kawasaki M., Taniguchi M., Miyake H. Salinity induces granal development in bundle sheath chloroplasts of NADP-malic enzyme type C4 plants // Plant Prod. Sci. 2009. V. 12. P. 199. https://doi.org/10.1626/pps12.199
Michaud M., Prinz W.A., Jouhet J. Glycerolipids synthesis and lipid trafficking in plant mitochondria // FEBS J. 2017. V. 284. P. 376. https://doi.org/10.1111/febs.13812
Jouhet J. Importance of the hexagonal lipid phase in biological membrane organization // Front. Plant. Sci. 2013. V. 4. Art. 494. P. 1. https://doi.org/10.3389/fpls.2013.00494
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


