Физиология растений, 2022, T. 69, № 2, стр. 171-178
Состав полифенолов растений Dracocephalum charkeviczii Prob. в условиях in situ и in vitro
О. В. Наконечная a, *, И. В. Гафицкая a, В. П. Григорчук a, Т. Ю. Горпенченко a, А. Б. Безделев b, Ю. Н. Журавлев a
a Федеральный научный центр биоразнообразия наземной биоты Восточной Азии
Дальневосточного отделения Российской академии наук
Владивосток, Россия
b Филиал Федерального государственного бюджетного учреждения науки
“Национальный научный центр морской биологии им. А.В. Жирмунского” Дальневосточного отделения
Российской академии наук – Научно-образовательный комплекс “Приморский океанариум”
Владивосток, Россия
* E-mail: markelova@biosoil.ru
Поступила в редакцию 16.03.2021
После доработки 03.06.2021
Принята к публикации 07.06.2021
- EDN: LWQBXJ
- DOI: 10.31857/S0015330322010146
Аннотация
Определен состав полифенолов змееголовника Харкевича (Dracocephalum charkeviczii Prob., сем. Lamiaceae) у растений из природной популяции и микрорастений, полученных in vitro. В метанольных экстрактах растений методом ВЭЖХ с УФ- и масс-селективным детектированием обнаружено 15 компонентов полифенольной природы, преимущественно, производные кофейной кислоты, а также три гликозилированных флавона – производные акацетина (дигидрокси-метокси-флавон). Профили полифенолов в экстрактах микрорастений и растений из природной популяции совпадали. В микрорастениях преобладали розмариновая кислота (в листьях – 63 мкмоль/г сухой массы, в корнях – 11 мкмоль/г сухой массы), кофейная кислота (в корнях – 2 мкмоль/г), рабдозиин (в корнях – 8 мкмоль/г). В корнях растений из природной популяции преобладал рабдозиин в гликозилированной форме (в виде моногликозида – 13 мкмоль/г сухой массы и дигликозида – 4 мкмоль/г сухой массы).
ВВЕДЕНИЕ
Вторичные метаболиты растений являются биологически активными веществами, которые уже много веков использует человек в народной медицине. Они являются основой многих фармакологически важных препаратов и косметических средств. В природе растения производят эти вещества для защиты от неблагоприятных условий среды, что способствует их выживанию [1]. По своему строению “вещества вторичного метаболизма” представлены широким спектром соединений, среди которых многочисленная группа веществ с фенольной структурой [2].
Представители рода Dracocephalum (сем. Lamiaceae) содержат большое разнообразие биологически активных вторичных метаболитов (терпеноиды, флавоноиды, алкалоиды, лигнаны, фенолы, кумарины, глюкозиды) [3], многие из которых находят свое применение в медицине. Одним из таких соединений является розмариновая кислота. Она обладает противовирусным и противовоспалительным действием [4], кроме того, ее используют как противоопухолевое средство [5]. Имеются сообщения об активности розмариновой кислоты против вируса простого герпеса 1 (HSV-1), вируса иммунодефицита человека (HIV-1) и Helicobacter pylori [6]. Другое вещество – рабдозиин – обладает противоаллергической, антиоксидантной, нейропротекторной и анти-ВИЧ активностью [7]. Некоторые виды, например, D. kotsychyi Boiss., благодаря наличию в них розмариновой кислоты, используются как противоопухолевое средство [8].
Известно, что у растений в стрессовых условиях повышается синтез вторичных метаболитов [9]. Растения морских побережий находятся в стрессовых условиях из-за воздействия критических факторов окружающей среды (засоленность почвы, влияние ветра определенной направленности, импульверизация соленой водой, специфический температурный режим) [10]. Следовательно, виды, обитающие в таких экологических условиях, обладают повышенной устойчивостью к воздействию среды, и, вероятно, увеличивают биосинтетические процессы в сторону накопления защитных веществ (в том числе, вторичных метаболитов).
Одним из представителей рода Dracocephalum является змееголовник Харкевича (D. charkeviczii Prob.) − эндемичный (сихотэалинско-южнокурильский) вид [11]. D. charkeviczii встречается на склонах морских террас, на приморских песках и галечниках. Это циркум-япономорский прибрежноморской луговой и псаммо-петрофильный вид [12]. D. charkeviczii произрастает на островах залива Петра Великого, в окрестностях г. Владивостока, Уссурийском, Партизанском, Хасанском и Тернейском районах Приморского края, в Сихотэ-Алинском заповеднике и г. Южно-Курильске (о. Кунашир) Сахалинской области. За пределами России вид встречается в приморских районах Японии и Китая [12].
Информации о вторичных метаболитах, находящихся в растениях D. charkeviczii, и о лекарственном применении частей растения в известной нам литературе не приведено. Но принадлежность D. charkeviczii к семейству Lamiaceae, где у растений разных видов наблюдается накопление ценных для человека вторичных метаболитов, а также приуроченность к морским побережьям позволяют предположить их наличие.
Микроклональное размножение редких и малоизученных видов растений является одним из методов, способствующих увеличению доступности биологического материала для всестороннего изучения, а также сохранения и воспроизведения его ресурсов. Литературные данные по клональному микроразмножению D. charkeviczii отсутствуют. К тому же смена условий произрастания и культивирования часто приводит к изменениям в биосинтетических процессах [13] и, как следствие, в продукции вторичных метаболитов.
Цель работы состояла в изучении качественного и количественного состава полифенолов у растений малоизученного вида D. charkeviczii, взятых из природной популяции in situ и полученных в культуре in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования были проведены в Федеральном научном центре биоразнообразия наземной биоты Восточной Азии Дальневосточного отделения Российской академии наук (ФНЦ Биоразнообразия ДВО РАН) в секторе микроклонального размножения лесных, сельскохозяйственных и декоративных растений (г. Владивосток) в 2018 г.
Объект исследования – змееголовник Харкевича (Dracocephalum charkeviczii Prob., сем. Lamiaceae) – многолетний летнезеленый травянистый короткокорневищный симподиально нарастающий поликарпик с удлиненным приподнимающимся монокарпическим побегом [14]. Растения D. charkeviczii произрастали в природной популяции на пологих участках приморских щебнисто-каменистых обрывов, покрытых растительностью, характерной для приморских лугов, на полуострове Житкова (о. Русский). Для исследования полифенолов использовали растения из природной популяции и микрорастения, полученные в культуре in vitro.
Введение в культуру in vitro. Для введения в культуру in vitro в апреле 2018 г. были взяты экспланты с растений D. charkeviczii. В качестве эксплантов использовали листовой узел с пазушной почкой. Для стерилизации эксплантов использовали методику Р.Г. Бутенко [c. 27, 13], основанную на применении 0.1% раствора диацида (время обработки 4 мин). Для получения стерильных побегов из пазушных почек применяли агаризованную (0.4%) питательную среду с минеральной основой по Мурасиге и Скугу (MС-среда) [15], взятую в половинной концентрации, с добавлением витаминов по Р.Г. Бутенко [с. 203, 13] и 2% сахарозы. Питательную среду автоклавировали при 0.8 атм в течение 20 мин. Пробирки с эксплантами содержали в культуральной комнате при температуре 24 ± 1°С, 16-часовом фотопериоде, освещении люминесцентными лампами с интенсивностью 4000 лк и 70% относительной влажности воздуха.
Микроклональное размножение. Для дальнейшего клонального размножения микропобегов D. charkeviczii использовали вышеприведенную питательную среду с добавлением 1.0 мг/л индолилмасляной кислоты (ИМК), pH 4.6. Культивирование микропобегов проводили в условиях культуральной комнаты.
Исследование состава полифенолов. Для исследования профиля полифенолов использовали корни и листья микрорастений и растений D. charkeviczii из природной популяции. Сухой измельченный материал массой 100 мг (точная навеска) экстрагировали в 2 мл 80% метилового спирта в течение 30 мин на ультразвуковой бане и выдерживали при комнатной температуре в темноте 20 ч. Затем экстракты центрифугировали (15 000 g, 10 мин) и полученный супернатант фильтровали через нейлоновый фильтр с диаметром пор 0.45 мкм (Millipore, Bedford, MA, США). Аликвоту (1.0 мкл) полученного раствора использовали для аналитической хроматографии.
Экстракты анализировали с помощью оборудования Центра коллективного пользования “Биотехнология и генетическая инженерия” ФНЦ Биоразнообразия ДВО РАН: хроматографа 1260 Infinity (Agilent, США) и тандемного масс-спектрометра Bruker HCT ultra PTM Discovery System (Bruker Daltonik, GmbH, Германия), оснащенного ионной ловушкой. Разделение компонентов экстрактов проводили на аналитической колонке Zorbax C18 (150 × 2.1 мм, 3.5 мкм, Agilent, США) при 40оС. УФ-спектры записывали в диапазоне длин волн от 200 до 400 нм с использованием детектора на диодной матрице G1315D (Agilent, США). Подвижная фаза состояла из раствора муравьиной кислоты (0.1%) в деионизированной воде и ацетонитрила. Градиентное элюирование проводили со скоростью потока растворителей 0.2 мл/мин. УФ-сигнал для количественного определения записывали при λ = 265 и 330 нм. Масс-спектрометрический (МС) сигнал записывали в режиме ионизации электрораспылением и регистрации отрицательных и положительных ионов в диапазоне значений m/z (отношение массы к заряду) 100–1000. Тандемную масс-спектрометрию проводили в автоматическом режиме при напряжении фрагментации 1.0 В.
Аналитическую ВЭЖХ с масс-спектрометрией высокого разрешения (ВЭЖХ-МСВР) для подтверждения идентификации биологически активных веществ проводили в лаборатории сравнительной биохимии “Национального научного центра морской биологии им. А.В. Жирмунского” ДВО РАН с использованием хроматомасс-спектрометра Shimadzu LCMS-IT-TOF (Kyoto, Япония), оснащенным жидкостным хроматографом высокого давления LC-20A Prominence и времяпролетным масс-спектрометром с ионной ловушкой. Условия хроматографического разделения оставили без изменений. МС данные получали в режиме ионизации электрораспылением и регистрации отрицательных ионов с разрешением 12000.
Идентификацию компонентов проводили путем сравнения времени удерживания, УФ и МС данных, а также имеющихся в наличии стандартных образцов и/или литературных данных [7, 16–21].
Количественное определение идентифицированных компонентов экстрактов D. charkeviczii проводили методом абсолютной градуировки с использованием коммерчески доступных стандартных образцов кемпферола (Sigma, Германия) и кофейной кислоты (Sigma, США). Для идентификации использовали хлорогеновую кислоту (Sigma, США) и выделенные и описанные ранее розмариновую кислоту и рабдозиин [22].
Калибровочные кривые построены с использованием кофейной кислоты (для определения содержания кофейной кислоты и ее производных) и кемпферола (для определения содержания производных акацетина) в диапазоне концентраций 0.007–5.5 мкмоль/мл, с коэффициентом корреляции R2 не менее 0.999. Содержание каждого индивидуального компонента представляет собой среднее значение из трех параллельно проведенных анализов и выражено в мкмоль/г сухого веса, а также пересчитано с поправкой на молярную массу искомого компонента и выражено в %/г сухого веса.
Полученные данные обрабатывали с использованием пакета “Statistica” версии 10.0. Для выявления отличий между группами микрорастений, выращенных на разных вариантах сред, использовали сравнение с контрольными растениями с учетом t-критерия Стьюдента для 95% уровня значимости. В эксперименте при проверке статистических гипотез критический уровень значимости принимали равным 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Методом ВЭЖХ-УФ-МС/МС исследованы метанольные экстракты D. charkeviczii и определены 15 биологически активных компонентов полифенольной природы (рис. 1). Использование МСВР позволило установить точные массы исследуемых компонентов и определить их элементный состав. В табл. 1 суммированы данные УФ и хроматомасс-спектрометрического обнаружения основных полифенолов D. charkeviczii, среди которых 12 компонентов – это кофейная кислота и ее производные, а также 3 гликозилированных флавона – производные акацетина (дигидрокси-метокси-флавон). Компоненты, соответствующие пикам 2, 4, 9 и 11 (рис. 1), были определены как хлорогеновая (2), кофейная (4), розмариновая (11) кислоты и тетрамер кофейной кислоты рабдозиин (9), благодаря их абсолютному сходству (времени удерживания, УФ и масс-спектры, профиль MС/МС фрагментации) с имеющимися в наличии стандартными образцами (рис. 1). Необходимо отметить, что кофейная и розмариновая кислоты были ранее обнаружены у представителей рода Dracocephalum [3, 6, 8, 16, 17, 21]. Исходя из сходного спектрального поведения компоненты 1 и 3 определены как изомеры хлорогеновой кислоты. Сравнение с литературными данными [18] профилей фрагментации их депротонированных ионов и порядка элюирования на обращенной фазе позволило идентифицировать компоненты 1 и 3 как 3-кофеоилхинная и 4-кофеоилхинная кислоты, соответственно. Вещества, соответствующие пикам 5, 6 и 8, продемонстрировали УФ профили, сходные со спектром рабдозиина. Рассчитанные при помощи МСВР брутто-формулы соединений 6 и 8 (C42H40O21) отличались от формулы рабдозиина (C36H30O16) на один фрагмент гексозы (С6H10O5), а формула компонента 5 (C48H50O26) – на два таких фрагмента. Согласно характеру MС/МС фрагментации [M–H]– ионов и порядку элюирования компоненты 6 и 8 были определены как два изомера гексозида рабдозиина, а компонент 5 как дигексозид рабдозиина. Компонент 7 в МСВР-спектре продемонстрировал интенсивный сигнал с m/z 521.1290, что соответствует молекулярной формуле C24H26O13 и отличается от розмариновой кислоты ([M–H]– с m/z 359.0779, C18H16O8) на один фрагмент гексозы. Фрагментация ионов с m/z 521 показала наличие дочерних ионов с m/z 359, что соответствует потере остатка гексозы (–162), а также наличие нескольких дочерних ионов меньшей интенсивности (с m/z 223, 197, 179, 161), что соответствует профилю фрагментации розмариновой кислоты. Так компонент 7 был идентифицирован как гексозид розмариновой кислоты, что подтверждается ранее опубликованными литературными данными [7, 20]. МСВР-спектр соединения 14 показал наличие сигнала с m/z 717.1452 (C36H30O16), что позволило определить его как изомер рабдозиина, идентифицированный ранее как сальвианоловая кислота В [16, 17]. Для компонента 15 ([M–H]– с m/z 715.1296, C36H28O16), рассчитанная при помощи МСВР формальная непредельность оказалась на единицу больше, чем у рабдозиина ([M–H]– с m/z 717.1453, C36H30O16), что позволило предположить наличие в его структуре еще одной двойной связи. Соединение 15 было предположительно идентифицировано как дегидрорабдозиин (или изомер), описанный ранее в литературе [7].
Рис. 1.
Хроматографические профили ВЭЖХ-УФ анализа метанольных экстрактов из корней (а, б) и листьев (в, г) растений D. charkeviczii из природной популяции и микрорастений, соответственно, зарегистрированные при λ = 330 нм. Нумерация пиков соответствует табл. 1. 1 – 3-кофеоилхинная кислота, 2 – хлорогеновая кислота, 3 – 4-кофеоилхинная кислота, 4 – кофейная кислота, 5 – дигексозид рабдозиина, 6 – моногексозид рабдозиина, 7 − гексозид розмариновой кислоты, 8 – моногексозид рабдозиина изомер, 9 – рабдозиин, 10 – акацетин рамнозил-тригексозид, 11 – розмариновая кислота, 12 и 13 – изомеры акацетина рамнозил-тригексозида ацетилированного, 14 – сальвианоловая кислота В, 15 – дегидрорабдозиин.

Таблица 1.
Список основных соединений, идентифицированных в неочищенных экстрактах Dracocephalum charkeviczii методом ВЭЖХ-УФ-МС
| № пика |
tуд, мин |
λ мах, нм | МСНР, [M–H]–, m/z | MС/МС фрагментация, основные ионы выделены жирным шрифтом, m/z | Формула | МСВР, [M–H]–, m/z | Погрешность, mDa | Результаты идентификации |
|---|---|---|---|---|---|---|---|---|
| 1 | 17.7 | 300sh, 325 | 353 | 191, 179, 135 | C16H18O9 | 353.0884 | 0.6 | 3-кофеоилхинная кислота |
| 2 | 20.1 | 300sh, 325 | 353 | 191 | C16H18O9 | 353.0872 | 0.6 | хлорогеновая кислота |
| 3 | 20.3 | 300sh, 327 | 353 | 191, 179, 173, 135 | C16H18O9 | 353.0869 | 0.9 | 4-кофеоилхинная кислота |
| 4 | 20.8 | 298sh, 324 | 179 | 135 | C9H8O4 | 179.0342 | 0.8 | кофейная кислота |
| 5 | 23.2 | 250, 284, 308, 340 | 1041 | 879, 717, 681, 519, 501, 475, 339 | C48H50O26 | 1041.2515 | 0.3 | рабдозиин ди-О-гексозид |
| 6 | 24.5 | 250, 285, 308, 340 | 879 | 717, 699, 655, 537, 519, 475, 339 | C42H40O21 | 879.1985 | 0.4 | рабдозиин-О-гексозид I |
| 7 | 25.5 | 315 | 521 | 359, 223, 197, 179, 161 | C24H26O13 | 521.129 | 1.1 | розмариновой кислоты О-гексозид |
| 8 | 25.9 | 247, 285, 340 | 879 | 717, 699, 681, 637, 519, 501, 475, 365, 339 | C42H40O21 | 879.1994 | 0.5 | рабдозиин-О-гексозид II |
| 9 | 26.3 | 254, 283, 315sh, 346 | 717 | 537, 519, 475, 365, 339 | C36H30O16 | 717.1453 | 0.8 | рабдозиин |
| 10 | 27.5 | 267, 334 | 917* | 771, 609, 447, 285 | C40H52O24 | 915.2774 | 0.2 | акацетин-О-рамнозил-три-О-гексозид |
| 915 | 753, 283 | |||||||
| 11 | 27.7 | 295sh, 328 | 359 | 223, 197, 179, 161, 135 | C18H16O8 | 359.0779 | 0.7 | розмариновая кислота |
| 12 | 28.4 | 267, 335 | 959* | 813, 797, 651, 593, 447, 285 | C42H54O25 | 957.2885 | 0.4 | акацетин-О-рамнозил- три-О-гексозид ацетилированный I |
| 957 | 915, 897, 753 | |||||||
| 13 | 29.4 | 268, 333 | 959* | 813, 797, 651, 593, 447, 285 | C42H54O25 | 957.2891 | 1.0 | акацетин-О-рамнозил- три-О-гексозид ацетилированный II |
| 957 | 915, 897, 795, 753, 649, 445, 283 | |||||||
| 14 | 30.6 | 288sh, 330 | 717 | 519, 339 | C36H30O16 | 717.1452 | 0.9 | сальвианоловая кислота В |
| 15 | 32.1 | 290sh, 318 | 715 | 535, 517, 491, 355, 311 | C36H28O16 | 715.1296 | 0.9 | дегидрорабдозиин |
Соединения, соответствующие пикам 10, 12 и 13, были отнесены к флавоноидам, согласно типичному для них УФ профилю. МС данные для этих пиков, записанные в режиме регистрации отрицательных ионов, оказались недостаточными для проведения идентификации. Поэтому было решено провести тандемную масс-спектрометрию для положительных ионов. Исследуемые компоненты в МС/МС спектрах ионов-прекурсоров [M + H]+ обнаружили присутствие интенсивных сигналов фрагментов с m/z 285, что позволило допустить, что соединения 10, 12 и 13 являются производными акацетина, о наличии которых в различных видах Dracocephalum сообщалось ранее [19, 21]. Пик 10 ([M–H]– с m/z 915.2774, C18H16O8) продемонстрировал содержательную фрагментацию протонированных ионов ([M + H]+ с m/z 917) с образованием продуктов с m/z 771, 609, 447 и 285, что определяется последовательным элиминированием остатков дезоксигексозы (–146) и трех гексоз (–162), соответственно. Соединение 10 было идентифицировано как акацетин рамнозил-тригексозид, как было определено ранее [21]. Компоненты 12 и 13 показали сходные МС характеристики в положительном и отрицательном режимах и были определены как два изомера ацетилированного акацетин рамнозил-тригексозида, как было описано ранее [21].
Наши данные выявили неравномерный характер распределения биологически активных соединений в листьях и корнях растений D. сharkeviczii (рис. 2). В корнях природных растений в небольшом количестве содержалась кофейная кислота. Это соединение является предшественником большого количества полифенолов и встречается практически во всех видах растений. Розмариновая кислота, являющаяся эфиром кофейной кислоты и 3,4-дигидроксифенил-молочной кислоты, и ее производные – тетрамеры кофейной кислоты: сальвианоловая кислота В и рабдозиин, также присутствовали, но в большем количестве (рис. 1 и 2). При этом в корнях преобладали гликозилированные формы рабдозиина (суммарно для гликозидов 18.3 мкмоль/г сухого веса (1.7% сухого веса)), тогда как в листьях эфиры хинной и кофейной кислот – хлорогеновая кислота, 3-кофеилхинная и 4-кофеилхинная кислоты, которые, как известно, участвуют в процессах дыхания растений [с. 265, 23]. Кроме того, в больших количествах в листьях присутствовал акацетин в гликозилированной форме (для ацетилированного производного до 59 мкмоль/г сухого веса, 5.6%/г сухого веса, соответственно). Другое уникальное вещество – дегидрорабдозиин было идентифицировано только в листьях растений из природной популяции.
Рис. 2.
Диаграмма распределения полифенольных соединений в органах растений D. charkeviczii in vitro ( ) и in situ (
) и in situ (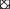 ).
).

Анализ состава метаболических профилей экстрактов показал, что в целом в микрорастениях in vitro идентифицированы те же вещества, что и в растениях из природной популяции (рис. 1). Профиль распределения веществ в органах микрорастений значительно не менялся по сравнению с органами дикорастущих растений (рис. 2). Однако в микрорастениях преобладали вещества в виде свободных агликонов, тогда как в растениях из природной популяции эти вещества находились в гликозилированной форме (рис. 2). Например, в листьях микрорастений содержание розмариновой кислоты составляло 63 мкмоль/г сухого веса (2.3% сухого веса), что в 5 раз превышало ее содержание в листьях природных растений. Аналогичный эффект наблюдался и в корнях для рабдозиина (в микрорастениях 8 мкмоль/г сухого веса (0.6% сухого веса), в природных растениях около 1.5 мкмоль/г сухого веса (0.1% сухого веса)). Можно предположить, что микрорастения in vitro более свободно осуществляют водно-солевой обмен между корневой системой и МС-средой. Это способствовало выходу веществ в среду культивирования и, вероятно, снижению цитотоксичности внутри микрорастений. Следует отметить, что в листьях микрорастений содержание хлорогеновой кислоты и ее изомеров было ниже в сравнении с природными растениями (рис. 2).
Содержание розмариновой кислоты в листьях микрорастений D. charkeviczii было выше (63.3 мкмоль/г или 22.8 мг/г сухого веса) (рис. 2), чем в культуре корней (19.97 мг/г сухого веса) и корнях однолетних растений D. forrestii (4.7 мг/г сухого веса), выращиваемых в поле [16]. Однако ее содержание было ниже, чем у клеточных культур, выращиваемых на средах с гормонами и различными элиситорами [24]. Особый интерес представляет исследование, в котором показано, что волосатые корни D. moldavica продуцировали розмариновую кислоту в концентрации до 78 мг/г сухого веса после оптимизации состава культуральной среды [6]. В работе Фатахи с соавт. [8] приводятся сведения о том, что содержание розмариновой кислоты в культуре корней D. kotsychyi, полученных после заражения штаммом Agrobacterium rhizogenes LBA 9402, варьировало от 10 до 1500 мкг/г сухого веса, что в 15 раз выше, чем в интактных корнях. При исследовании листьев 96 видов сем. Lamiaceae было обнаружено, что концентрация розмариновой кислоты варьировала от 0.01 до 9.30 мг/г сухого веса, а содержание кофейной кислоты от 0 до 0.62 мг/г сухого веса [25].
Спектр вторичных метаболитов является отражением физиологического и биохимического состояния организма, и процессы синтеза веществ могут быть связаны с онтогенетическим развитием растения. Недавние исследования показали, что фенологические стадии являются одними из наиболее влиятельных факторов в вариациях вторичных метаболитов [26]. В нашем случае, исследуемые микрорастения находились в виргинильном онтогенетическом состоянии, тогда как растения из природной популяции – в среднем генеративном. Кроме того, для получения гликозилированных форм веществ необходима стадия биосинтеза, отвечающая за реакцию присоединения сахаров к агликонам и работа дополнительных ферментных систем, обеспечивающих переход веществ в активную или неактивную форму [27]. Возможно, микрорастения не успевали преобразовать вещества в гликозилированные формы из-за недостатка времени, необходимого для достижения генеративного состояния. Этим может объясняться и обнаружение в них достаточно большого количества кофейной кислоты, важной в дальнейших стадиях синтеза изомеров и эфиров.
ЗАКЛЮЧЕНИЕ
Профили биологически активных веществ в микрорастениях D. charkeviczii сравнимы с таковыми в дикорастущих растениях, что открывает возможность их дальнейшего изучения с перспективой использования. Показано неравномерное распределение веществ в исследованных группах растений с преобладанием кофейной кислоты и рабдозиина в корнях, розмариновой кислоты и производных акацетина в листьях. В дикорастущих растениях преобладали гликозилированные формы веществ в отличие от микрорастений. Вероятно, это определено физиологическими процессами, связанными с фенологическими фазами развития микрорастений.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов.
Список литературы
Demain A.L., Fang A. The natural functions of secondary metabolites // History of modern biotechnology I (Advances in biochemical engineering/biotechnology) / Ed. A. Fiechter, Springer, Berlin, Heidelberg. 2000. V. 69. P. 1. https://doi.org/10.1007/3-540-44964-7_1
Bulgakov V.P., Inyushkina Y.V., Fedoreyev S. Rosmarinic acid and its derivatives: biotechnology and applications // Crit. Rev. Biotechnol. 2012. V. 32. P. 203. https://doi.org/10.3109/07388 551.2011.59680 4
Zeng Q., Jin H., Qin J., Fu J., Hu X., Liu J., Yan L., Zhang W. Chemical constituents of plants from the genus Dracocephalum // Chem. Biodivers. 2010. V. 7. P. 1911. https://doi.org/10.1002/cbdv.200900188
Swarup V., Ghosh J., Ghosh S., Saxena A., Basu A. Antiviral and anti-inflammatory effects of rosmarinic acid in an experimental murine model of Japanese encephalitis // Antimicrob. Agents Chemother. 2007. V. 51. P. 3367. https://doi.org/10.1128/AAC.00041-07
Anusuya C., Manoharan S. Antitumor initiating potential of rosmarinic acid in 7,12-dimethylbenz(a)anthracene-induced hamster buccal pouch car-cinogenesis // J. Environ. Pathol. Toxicol. Oncol. 2011. V. 30. P. 199. https://doi.org/10.1615/JEnvironPatholToxicolOncol.v30.i3.30
Weremczuk-Jeżyna I., Grzegorczyk-Karolak I., Frydrych B., Królicka A., Wysokińska H. Hairy roots of Dracocephalum moldavica: rosmarinic acid content and antioxidant potential // Acta Physiol. Plant. 2013. V. 35. P. 2095. https://doi.org/10.1007/s11738-013-1244-7
Trifan A., Wolfram E., Esslinger N., Grubelnik A., Skalicka-Woźniak K., Minceva M., Luca S.V. Globoidnan A, rabdosiin and globoidnan B as new phenolic markers in European – sourced comfrey (Symphytum officinale L.) root samples // Phytochem. Anal. 2020. P. 1. https://doi.org/10.1002/pca.2996
Fattahi M., Nazeri V., Torras-Claveria L., Sefidkon F., Cusido R.M., Zamani Z., Palazon J. A new biotechnological source of rosmarinic acid and surface flavonoids: hairy root cultures of Dracocephalum kotschyi Boiss // Ind. Crops Prod. 2013. V. 50. P. 256. https://doi.org/10.1016/j.indcrop.2013.07.029
Winkel-Shirley B. Biosynthesis of flavonoids and effects of stress // Curr. Opin. Plant Biol. 2002. V. 5. P. 218.
Voronkova N.M., Burkovskaya E.V., Bezdeleva T.A., Burundukova O.L. Morphological and biological features of plants related to their adaptation to coastal habitats // Russ. J. Ecol. 2008. V. 39. P. 1. https://doi.org/10.1134/S1067413608010013
Kozhevnikov A.E., Kozhevnikova Z.V., Kwak M., Lee B.Y. Illustrated flora of the Primorsky Territory [Russian Far East]. National Institute of Biological Resources, Incheon, 2019. 1124 p.
Пробатова Н.С., Баркалов В.Ю., Нечаев В.А. Хромосомные числа сосудистых растений в Приморском крае: дальнейшее изучение // Ученые записки ЗабГУ. Серия: Естественные науки. 2016. Т. 11. № 1. С. 27.
Бутенко Р.Г. Культура изолированных тканей и физиология морфогенеза растений. Москва: Наука, 1964. 272 с.
Безделев А.Б., Безделева Т.А. Жизненные формы семенных растений российского Дальнего Востока. Владивосток: Дальнаука, 2006. 296 с.
Murashige T., Skoog F. A revised medium for rapid growth and bio-assays with tobacco tissue cultures // Physiol. Plant. 1962. V. 15. P. 473.
Weremczuk-Jeżyna I., Skała E., Olszewska M.A., Kiss A.K., Balcerczak E., Wysokińska H., Kicel A. The identification and quantitative determination of rosmarinic acid and salvianolic acid B in hairy root cultures of Dracocephalum forrestii W.W. Smith // Ind. Crops Prod. 2016. V. 91. P. 125. https://doi.org/10.1016/j.indcrop.2016.07.002
Weremczuk-Jeżyna I., Kuźma Ł., Kiss A.K., Grzegorczyk-Karolak I. Effect of cytokinins on shoots proliferation and rosmarinic and salvianolic acid B production in shoot culture of Dracocephalum forrestii W.W. Smith // Acta Physiol. Plant. 2018. V. 40. P. 1. https://doi.org/10.1007/s11738-018-2763-z
Clifford M.N., Knight S., Kuhnert N. Discriminating between the six isomers of dicaffeoylquinic acid by LC-MSn // J. Agric. Food Chem. 2005. V. 53. P. 3821. https://doi.org/10.1021/jf050046h
Martínez-Vázquez M., Estrada-Reyes R., Martínez-Laurrabaquio A., López-Rubalcava C., Heinze G. Neuropharmacological study of Dracocephalum moldavica L. (Lamiaceae) in mice: sedative effect and chemical analysis of an aqueous extract // J. Ethnopharmacol. 2012. V. 141. P. 908. https://doi.org/10.1016/j.jep.2012.03.028
Zhang J.L., Yan R.J., Yu N., Zhang X., Chen D.J., Wu T., Xin J.G. A new caffeic acid tetramer from the Dracocephalum moldavica L. // Nat. Prod. Res. 2018. V. 32. P. 370. https://doi.org/10.1080/14786419.2017.1359168
Weremczuk-Jeżyna I., Skała E., Kuźma Ł., Kiss A.K., Grzegorczyk-Karolak I. The effect of purine-type cytokinin on the proliferation and production of phenolic compounds in transformed shoots of Dracocephalum forrestii // J. Biotechnol. 2019. V. 306. P. 125. https://doi.org/10.1016/j.jbiotec.2019.09.014
Fedoreyev S.A., Veselova M.V., Krivoschekova O.E., Mischenko N.P., Denisenko V.A., Dmitrenok P.S., Glazunov V.P., Bulgakov V.P., Tchernoded G.K., Zhuravlev Y.N. Caffeic acid metabolites from Eritrichium sericeum cell cultures // Planta medica. 2005. V. 71. P. 446. https://doi.org/10.1055/s-2005-864141
Гудвин Т., Мерсер Э. Введение в биохимию растений: в 2-х т. Т. 2. Пер. с англ. Москва: Мир, 1986. 312 с.
Bulgakov V.P., Vereshchagina Y.V., Veremeichik G.N. Anticancer polyphenols from cultured plant cells: production and new bioengineering strategies // Curr. Med. Chem. 2017. V. 24. P. 1. https://doi.org/10.2174/0929867324666170609080357
Janicsak G., Mathe I., Miklossy-Vari V., Blunden G. Comparative studies of the rosmarinic and caffeic acid contents of Lamiaceae species // Biochem. Syst. Ecol. 1999. V. 27. P. 733. https://doi.org/10.1016/S0305-1978(99)00007-1
Fattahi M., Bonfill M., Fattahi B., Torras-Claveria L., Sefidkon F., Cusido R.M., Palazon J. Secondary metabolites profiling of Dracocephalum kotschyi Boiss at three phenological stages using uni-and multivariate methods // Journal of Applied Research on Medicinal and Aromatic Plants. 2016. V. 3. P. 177. https://doi.org/10.1016/j.jarmap.2016.04.002
Nosov A.M. Functions of plant secondary metabolites in vivo and in vitro // Russ. J. Plant Physiol. 1994. V. 41. P. 767.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


