Физиология растений, 2022, T. 69, № 2, стр. 161-170
Содержание антоцианов в цветках сортов сирени обыкновенной (Syringa vulgaris L.)
А. М. Деева a, **, П. С. Шабуня b, С. А. Фатыхова b, А. В. Зубарев a, В. Н. Решетников a, Е. В. Спиридович a, *
a Центральный ботанический сад Национальной академии наук Беларуси
Минск, Республика Беларусь
b Институт биоорганической химии Национальной академии наук Беларуси
Минск, Республика Беларусь
** E-mail: alladzeeva@gmail.com
* E-mail: a.spirydovich@gmail.com
Поступила в редакцию 10.09.2021
После доработки 10.10.2021
Принята к публикации 11.10.2021
- EDN: BCAIUG
- DOI: 10.31857/S001533032202004X
Аннотация
Впервые методами высокоэффективной жидкостной хроматографии, совмещенной с масс-спектрометрией (HPLC-MS), и рH-дифференциальной спектрофотометрией проведено подробное изучение качественного и количественного состава антоцианового спектра цветков 14 сортов сирени обыкновенной (Syringa vulgaris L), относящихся к разным цветовым группам интродуцированных образцов коллекции in vitro Центрального ботанического сада НАН Беларуси. На основании результатов хроматографических, спектральных анализов и сравнения их с аутентичными образцами, а также по литературным данным, антоцианы цветков сирени идентифицированы как кумарил-гексозиды или рутинозиды дельфинидина и цианидина. Все сорта условно можно поделить на три группы по наличию и содержанию производных дельфинидина и цианидина: не содержат (светлые цвета: белые, голубоватые); содержат только производные цианидина (темные цвета); содержат производные дельфинидина и цианидина (сложные цвета: розовато-лиловые, фиолетово-синие, лилово-фиолетовые). Установлено, что содержание антоцианов в зависимости от окраски варьирует, согласно HPLC, цветки либо совсем не содержат антоцианов, либо содержат их в пределах 0.32–3.80 мг/100 г сухого веса; согласно рH-дифференциальной спектрофотометрии, содержат антоциановые пигменты в количестве 0.03–3.71 мг/100 г сухого веса. Полученные данные пополнят информацию о документировании сортов сирени, их описание размещено в сеть Internet на страницах информационно-поисковой системы HBC-Info (http://hbc.bas-net.by).
ВВЕДЕНИЕ
Представители рода сирень (Syringa L.) семейства Маслиновые (Oleaceae) широко распространены в различных регионах мира как декоративные растения [1]. Данные о количестве видов противоречивы: некоторые исследователи считают, что в Европе и в Азии распространено 40 видов сирени, по другим данным род Syringa L. включает 27 видов, 25 из которых происходят из Азии и только 2 (Syringa vulgaris L. и Syringa josikaea Jack.) − из юго-восточной Европы (Балкано-Карпатский регион) [2, 3].
В Европе и Северной Америке чаще всего выращивают листопадный кустарник сирень обыкновенная (Syringa vulgaris L.). Основная часть сортов (около трех тысяч по списку Международного общества сиреневодов) получена именно от этого вида. В коллекции Центрального ботанического сада НАН Беларуси (ЦБС НАН Беларуси, Минск) собрано более 250 сортов. Сорта сирени отличаются между собой, прежде всего цветом, строением и размером цветков, а также другими морфологическими признаками. Условно все сирени делят на семь цветовых групп, в которые входят как темные, так и светлые тона одного и того же цвета: белые, фиолетовые, голубоватые, лиловые или сиреневые, розоватые, мажентовые, пурпурные сирени [4, 5]. Практически все сорта сирени отнесены к той или иной цветовой группе. Есть двуцветный сорт – “Сенсация”: у него по краям пурпурных лепестков чисто-белая кайма. “Примроз” – настоящий желтый сорт.
Сирень широко используется в народной и традиционной медицине как противовоспалительное, адаптогенное и иммуномодулирующее средство, а также для лечения ревматоидного артрита, подагры, ревматизма и сахарного диабета [6–8]. Имеются данные, что цветки сирени используют в пищу [9]. В доступной литературе основное внимание уделяется фенольному профилю коры и листьев как источнику фармацевтического сырья [10–12], и, в то же время, в доступной литературе можно найти лишь несколько работ, описывающих химический состав цветков. Ученые из Венгрии и Румынии в своем исследовании впервые определили полифенольный состав цветков и плодов сирени. Было идентифицировано тридцать четыре фенольных соединения, включая восемнадцать секоиридоидов, семь фенилпропаноидов, четыре флавоноида и пять низкомолекулярных фенолов. В результате количественного анализа было подтверждено, что цветки содержат значительные количества фенилэтаноидов (актеозид, 2.48%; эхинакозид, 0.75%) и олеуропеин (0.95%), а в плодах секоиридоид олеуропеин (1.09%) и нуженид (0.42%) являются основными вторичными метаболитами [13]. Однако данное исследование не показало наличия антоциановых пигментов в цветках сирени, что было объяснено тем, что антоцианы накапливаются в цветках исключительно в клетках наружного эпидермального слоя лепестков, что приводит к очень низкому их содержанию в пересчете на массу цветка. Кроме того, антоцианы – это нестабильные соединения, которые могли деградировать при обработке образцов. В то же время авторами работы было высказано предположение, что антоцианы должны присутствовать в цветках из-за их характерного пурпурного цвета.
Целью нашей работы было исследование антоцианового спектра 14 сортов сирени обыкновенной (Syringa vulgaris L.), относящихся к разным цветовым группам, методами HPLC-MS и pH-дифференциальной спектрофотометрии.
В настоящее время исследование антоцианового комплекса хозяйственно-ценных растений приобретает важную значимость в свете значительного прогресса в селекции растений с использованием методов генной инженерии, что позволит прогнозировать и получать новые высокодекоративные сорта разной окраски [14, 15]. В связи со спросом на культуру сирени как декоративного и лекарственного растения, наряду с молекулярно-генетическими методами документирования коллекционного материала, необходима разработка надежных биохимических методов классификации сирени на основе исследований антоцианового спектра для установления чистосортности, обнаружения фальсификации и др.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы цветков 14 сортов сирени обыкновенной (Syringa vulgaris L.) коллекции in vitro ЦБС НАН Беларуси, относящихся к разным цветовым группам, были собраны в центральной агроклиматической зоне республики в июне 2020 г. (рис. 1). Собранные гербарные образцы приведенных в статье сортов сирени обыкновенной депонированы в гербарии Центрального ботанического сада НАН Беларуси (MSKH). Эксперименты выполняли в пяти аналитических повторностях.
Рис. 1.
Cорта сирени обыкновенной (Syringa vulgaris ) разных цветовых групп: а – “Флора”, б – “Радж Капур”, в – “Сумерки”.

Подготовка проб для HPLC-UV-ESI-MS анализа. Для проведения анализа было отобрано по 100 г свежих цветков сирени каждого сорта, из них для экстракции отбирались навески по 5 г, которые экстрагировали 50 мл экстрагента (этиловый спирт – вода в соотношении по объему 4 : 1). Экстракцию проводили в течение 30 минут ультразвуком (SONOPULS HD 2200). Затем пробы оставляли на 16 часов при температуре +4°С. Полученные экстракты центрифугировали при 5500 g в течение 10 минут (центрифуга Sigma 3−18k) и сохраняли при температуре +4°С до проведения измерений.
Аликвоты (5 мл) каждого экстракта перед анализом были упарены в токе азота досуха. Затем осадки были растворены в смеси (500 мкл метанола + 200 мкл воды деионизованной). Полученные растворы фильтровали в хроматографические виалы через шприцевой фильтр из регенерированной целлюлозы (Econofilter, Германия) с размером пор 0.45 мкм и использовали для анализа.
HPLC-UV-ESI-MS. Анализ проводили на хроматографе Agilent 1200 (Agilent, США), оснащенном тандемным масс-спектрометром Agilent 6410 Triple Quad (Agilent, США) и UV-детектором Agilent G1315C (Agilent, США). Пробу в объеме 5 мкл наносили на колонку Agilent Zorbax Eclipse Plus C18 (3.0 × 100 мм, 1.8 мкм; Agilent, США). Температура колонки составляла 25°С, объемная скорость потока подвижной фазы – 0.25 мл/мин. В качестве подвижной фазы использовали 5% (по объему) раствор муравьиной кислоты в воде (растворитель А) и 100% ацетонитрил (растворитель Б). В процессе анализа состав подвижной фазы менялся следующим образом (Б, % по объему): 0−20 мин. – 6 → 23.5%, 20−25 мин. – 23.5%, 25−30 мин. – 23.5 → 45%, 30−32 мин. – 45%, 32−35 мин. – 45 → 75%. Анализ осуществляли в режиме детектирования положительных и отрицательных ионов (диапазон m/z 100−2000). Параметры источника ионизации: температура осушающего газа +350°C; скорость потока осушающего газа 9 л/мин; давление на распылителе 30 psi; напряжение на капилляре 3000 вольт. В режиме сканирования общего ионного тока напряжение на фрагменторе составило 150 вольт (положительные ионы) и 220 вольт (отрицательные ионы). Для установления предполагаемой структуры антоцианов использовали режим получения дочерних ионов при напряжении на фрагменторе 150 вольт и энергии в ячейке соударений 20 вольт. Обработку полученных результатов производили с помощью программ Agilent Mass Hunter Workstation Software version B.01.03 и Agilent ChemStation (Agilent Technologies Inc., USA).
Для количественного анализа антоцианов использовали хроматограммы, зарегистрированные при длине волны 510 нм. Сток-растворы стандартов дельфинидин-3-галактозида (≥95% HPLC, Extrasynthese, Франция) и цианидин-3-О-глюкозид хлорида (≥ 96% HPLC, Extrasynthese, Франция) готовили в концентрациях 2 мг/мл в метаноле. Концентрации градуировочных растворов были в диапазоне от 5 до 20 мкг/мл. Полученные калибровочные прямые были линейны в указанном диапазоне концентраций (коэффициенты корреляции > 0.99). Производные дельфинидина обсчитывали по калибровке дельфинидин-3-галактозида, производные цианидина – цианидин-3-О-глюкозид хлорида [16].
Количественное определение суммарного содержания антоциановых пигментов было проведено методом рН-дифференциальной спектрофотометрии [17]. Готовили по два разбавления каждого экстракта с использованием буферных растворов № 1 и № 2. Раствор № 1: рН 1.0 (0.405 мг хлорида калия и 1.238 мл концентрированной соляной кислоты доводят до 100 мл дистиллированной водой). Раствор № 2: рН 4.5 (1.64 г натрия ацетата растворяют в 100 мл дистиллированной воды и доводят рН до 4.5 концентрированной соляной кислотой). Оптическую плотность полученных растворов измеряли при 510 и 700 нм на спектрофотометре Agilent 8453. Расчет суммы антоцианов (S) проводили по формуле:
где А510 рН1.0; А700 рН1.0 – оптические плотности разбавленных экстрактов в растворе 1; А510 рН4.5; А700 рН4.5 – оптические плотности разбавленных экстрактов в растворе 2; ММ – молекулярная масса цианидин-3-глюкозида (449.2); F – коэффициент разведения; Е – коэффициент молярной экстинкции для цианидин-3-глюкозида (26900); l – длина оптического пути, см; С – концентрация приготовленного раствора образца в пересчете на сухую массу цветков сирени (содержание влаги в цветках в среднем – 15.2%).РЕЗУЛЬТАТЫ
Разнообразие цветочной окраски обусловлено наличием различных пигментов. Цветочные пигменты варьируют у разных видов растений в зависимости от состава вторичных метаболитов, таких как флавоноиды, каротиноиды и хромоалкалоиды – беталаины, из которых флавоноиды являются доминирующими соединениями [16]. Антоцианидины (включая пеларгонидин, цианидин, дельфинидин, пеонидин, петунидин и мальвидин) в органах цветков растений являются основными флавоноидами, определяющими окраску цветка (рис. 2, табл. 1) [18].
Таблица 1.
Химические структуры и молекулярные массы антоцианидинов*
| Антоцианидин | *R1 | R2 | R3 | Молекулярная масса, г/моль |
|---|---|---|---|---|
| Цианидин | Н | ОН | Н | 287 |
| Пеонидин | ОСН3 | ОН | Н | 301 |
| Дельфинидин | ОН | ОН | ОН | 303 |
| Петунидин | ОСН3 | ОН | ОН | 317 |
| Мальвидин | ОСН3 | ОН | ОСН3 | 331 |
| Пеларгонидин | Н | ОН | Н | 271 |
Примечание: * R – функциональная группа (см. рис. 2).
Экстракт цветков каждого сорта был проанализирован методом HPLC с масс-спектрометрическим и диодно-матричным детекторами для обнаружения и идентификации антоцианов. Для поиска веществ антоциановой природы были записаны хроматограммы при длине волны 510 нм, которая входит в специфичную область поглощения антоцианов (510–530 нм). На хроматограммах различных сортов сирени было обнаружено два пика с UV-спектрами, где основной максимум поглощения находится в области 510 нм, что позволяет отнести эти вещества к группе антоцианов. При этом следует отметить, что различные сорта сирени обыкновенной (Syringa vulgaris L.) характеризовались либо наличием обоих компонентов в разных соотношениях, либо отсутствием одного или обоих компонентов (рис. 3).
Рис. 3.
HPLC-UV хроматограммы экстрактов цветков различных сортов Syringa vulgaris (λ = 510 нм): а – сорт “Флора”; б – сорт “Никитская”; в – сорт “Перлес Пинк”. 1 − производное цианидина (время удерживания около 16.4 мин), 2 − производное дельфинидина (время удерживания около 13.7 мин).

Для определения молекулярной массы найденных веществ экстракты были проанализированы с помощью HPLC-MS в режимах генерации положительных и отрицательных ионов. Анализ масс-спектров показал, что вещество с временем удерживания около 13.7 минут имеет молекулярную массу 610 Да: в масс-спектрах при положительной ионизации присутствует ион протонированная молекула [M + H]+ с m/z 611, в отрицательных – депротонированный молекулярный ион [M–H]– с m/z 609. Вещество с временем удерживания около 16.4 минут имеет молекулярную массу 594 Да: в масс-спектрах при ионизации в положительных ионах присутствует ион с m/z 595, в отрицательных – 593 (рис. 4).
Рис. 4.
Масс-спектры для веществ с молекулярной массой 610 (а, б) и 594 (в, г) Да на примере сорта “Перлес Пинк”. а, в – масс-спектры в режиме положительной ионизации (ионы с m/z 611 и 595 соответствуют [M + H]+); б, г – масс-спектры в режиме отрицательной ионизации (ионы с m/z 609 и 593 соответствуют [M–H]–).

Для идентификации обнаруженных антоцианов были записаны хроматограммы в режиме получения дочерних ионов из m/z 611 и 595 Да. При анализе полученных масс-спектров (рис. 5) отмечено появление ионов, обусловленных следующей фрагментацией исходных молекул: [M + H–146]+ и [M + H–146–162]+. Последний фрагмент по величине m/z соответствует остатку агликона: ион с массой 303 Да– остаток агликона дельфинидин, с массой 287 Да – агликона цианидин. Потеря фрагмента 162 Да характерна при отщеплении дегидратированной гексозы. Фрагмент молекулы с нейтральной потерей 146 Да может образовываться при отщеплении либо дегидратированной рамнозы, либо дегидратированного остатка кумаровой кислоты.
Рис. 5.
Масс-спектры в режиме получения дочерних ионов из m/z 611 (А) и 595 (Б) на примере сорта “Перлес Пинк”. Ионы с m/z 303.2 соответствуют фрагменту [M + H–146–162]+; с m/z 465.3 – [M + H–146]+; с m/z 287.2 – [M + H–146–162]+; с m/z 449.3 – [M + H–146]+.
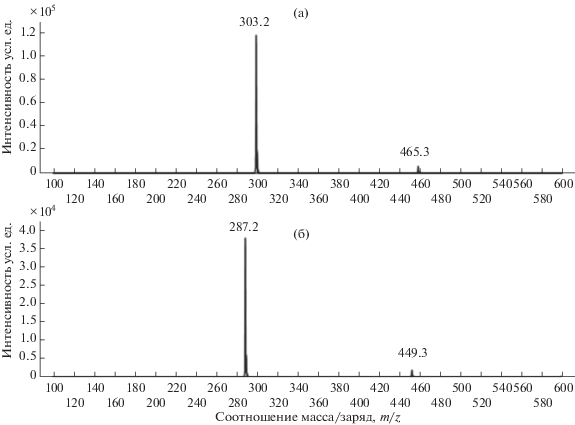
Для гликозидов антоцианов на колонках С18 характерен определенный порядок выхода в зависимости от количества и строения сахаров в углеводной части [19]. Тригликозиды выходят раньше, чем дигликозиды, а дигликозиды элюируются раньше, чем моногликозиды. Также отмечено, что рутинозиды (углеводная часть состоит из глюкозы и рамнозы) и ацилированные формы гликозидов имеют большее время удерживания, чем моноглюкозиды [20]. Анализируемые нами экстракты сравнивали со стандартами моногексозидов дельфинидина и цианидина. Обнаруженные в экстрактах антоцианы имели более позднее время удерживания по сравнению со стандартами. Принадлежность обнаруженных веществ к ацилированным формам можно установить по характерным особенностям спектров поглощения, но присутствие в экстракте большого количества других веществ и низкие концентрации антоцианов не позволили получить чистый спектр. Таким образом, обнаруженные антоцианы могут относиться либо к рутинозидам, либо к кумарил-гексозидам дельфинидина и цианидина.
Параллельно было рассчитано общее количество антоцианов путем суммирования концентраций отдельных веществ, вычисленных по методу внешней калибровки при HPLC-анализе в пересчете на цианидин-3-О-глюкозид хлорид и дельфинидин-3-галактозид (табл. 2). Установлено, что коэффициент корреляции между содержанием антоциановых пигментов, измеренных методом HPLC с UV-детектором и содержанием антоцианов, определенных методом рН-дифференциальной спектрофотометрии в пересчете на цианидин-3-глюкозид, составляет 0.99, что достоверно при данном количестве сравниваемых пар значений с уровнем значимости Р < 0.05. Была проведена статистическая обработка результатов – ошибка среднего для всех средних значений концентраций не превышала 5%. Полученные результаты свидетельствуют о возможности использования метода рН-дифференциальной спектрофотометрии в качестве достоверной оценки общего содержания антоцианов в цветках сирени.
Таблица 2.
Содержание антоцианов в экстрактах цветков сирени обыкновенной (Syringa vulgaris L.) исследуемых сортов, мг/100 г СВ
| Окраска цветков | Название сорта | Содержание в экстракте, определенное методом HPLC | Содеpжание в экстракте, определенное методом рH-дифференциальной спектрофотометрии | |||
|---|---|---|---|---|---|---|
| производное дельфинидина | производное цианидина | суммарное | ||||
| Светлые цвета: от зеленовато-белого до голубого |
“Флора” | – | – | – | 0.03–min | Группа 1 |
| “Ами Шотт” | – | – | – | 0.11 | ||
| от лилово-розового до розовато-белого | “Жемчужи-на” | – | – | – | 0.17 | |
| От нежно голубоватого тона с лиловыми тенями | “Андрюша Громов” | – | – | – | 0.22 | |
| до голубовато-лилового | “Абель Карьер” | – | – | – | 0.27 | |
| “Петр Кончаловский” | – | – | – | 0.29 | ||
| Темные цвета: От лилового |
“Никитская” | – | 0.31 | 0.31–min | 0.42 | Группа 2 |
| “Поль Арно” | – | 0.43 | 0.43 | 0.57 | ||
| До фиолетово- пурпурного | “Франк Петерсон” | – | 0.97 | 0.97 | 1.07 | |
| “Радж Капур” | – | 1.04 | 1.04 | 1.19 | ||
| Сложные цвета: от розовато-лилового до фиолетово-синего |
“Михаил Шолохов” | 0.67 | 0.41 | 1.09 | 1.31 | Группа 3 |
| “Сумерки” | 1.78 | 1.03 | 2.79 | 3.00 | ||
| “Перлес Пинк” | 2.66 | 0.56 | 3.22 | 3.41 | ||
| “Павлинка” | 2.29 | 1.50 | 3.79–max | 3.71–max | ||
ОБСУЖДЕНИЕ
Полученные данные позволяют все изученные сорта сирени обыкновенной (Syringa vulgaris L.) условно поделить на три группы по наличию и соотношению производных дельфинидина и цианидина (табл. 2). Сорта “Флора”, “Ами Шотт”, “Жемчужина”, “Андрюша Громов”, “Абель Карьер”, “Петр Кончаловский” можно выделить в 1 группу, характеризующуюся очень низким суммарным содержанием антоцианов от 0.03 (сорт “Флора”) до 0.29 (сорт “Петр Кончаловский”) мг/100 г СВ, определяемым методом рH-дифференциальной спектрофотомерии, которое коррелирует с интенсивностью окраски от белой до голубовато-лиловой. Сорта 2 группы: “Никитская”, “Поль Арно”, “Франк Петерсон”, “Радж Капур” отличаются наличием производных только цианидина с суммарным содержанием антоцианов в пределах от 0.42 (“Никитская”) до 1.19 (“Радж Капур”) мг/100 г СВ (по методу рH-дифференциальной спектрофотометрии), соответствующие окраске от лиловой до фиолетово-пурпурной. В экстрактах цветков сортов 3 группы (“Михаил Шолохов”, “Сумерки”, “Перлес Пинк”, “Павлинка”) были обнаружены производные как цианидина, так и дельфинидина, при этом суммарное содержание антоцианов в сортах с фиолетово-синей окраской цветков достигало значения 3.71 мг/100 г СВ (сорт “Павлинка”). Надо отметить, что в отличие от метода HPLC-MS метод дифференциальной рН-спектрофотометрии позволил определить даже незначительные количества антоцианов в экстрактах цветков первой группы. Это можно объяснить тем, что в данном случае определяется суммарное содержание всех антоциановых пигментов, а не индивидуальных веществ. Тогда как методом HPLC-MS рассчитывается отдельно содержание двух индивидуальных компонентов. При сопоставлении экспериментальных данных (табл. 2) обнаруживаются следующие тенденции: исследованные сорта были разделены условно на три группы по доле вклада обнаруженных антоцианов дельфинидинового или цианидинового ряда: группа 1 − низко антоциановая – незначительное количество антоцианов обнаружено методом рH-дифференциальной спектрофотометрии; группа 2 − полностью цианидиновая; группа 3 – высокоантоциановая, в цветках обнаружены антоцианы обоих рядов с преобладанием компонентов дельфинидинового ряда над компонентами цианидинового ряда. Подобное исследование проведено в работе по винограду, где на основе анализа схем биосинтеза антоцианов предложено несколько критериев для дифференциации сортов и видов винограда по набору антоцианов, накапливающихся в плодах растений. Первый критерий оценивает активность флаваноид-гидроксидаз (F3'H и/или F3'5'H), разделяя все антоцианы на два ряда – дельфинидиновый и цианидиновый; второй критерий оценивает активность метилтрансфераз, соответствуя степени метилирования антоцианов [21].
Таким образом, в настоящей работе впервые проведено подробное хромато-масс-спектрометрическое и спектрофотометрическое изучение антоцианов в цветках 14 сортов сирени обыкновенной (Syringa vulgaris L.), относящихся к разным цветовым группам и интродуцированых на территории Беларуси. Проведено сравнение результатов, полученных методами HPLC-MS и pH-дифференциальной спектрофотометрии. Антоцианы цветков сирени идентифицированы как рутинозиды, либо как кумарил-гексозиды дельфинидина и цианидина. Наличие антоцианов обуславливает интенсивность окраски. Обнаруженные соединения антоцианов достаточно широко распространены среди разных таксонов растительного биоразнообразия [22–24], однако сообщений об их присутствии у сортов сирени обыкновенной (Syringa vulgaris L.) в доступной литературе обнаружить не удалось. Изложенные результаты согласуются с известными в литературе данными об окраске цветков каллистефуса китайского или астры китайской (C. Chinensis (L.) Nees) – от красной до синей, что обусловлено биосинтезом антоцианов. Фиолетовая окраска цветков астр китайских обычно связана с биосинтезом производных дельфинидинового ряда и, действительно, в лепестках цветков сортов фиолетового цвета антоциановый состав определяется производными цианидина, к которым добавляются производные дельфинидина, либо производные дельфинидина становятся доминирующими антоцианами [21]. Исследование антоцианового комплекса современного растительного материала имеет большое значение в свете значительного прогресса в селекции растений, в т.ч. методами генной инженерии, что позволит прогнозировать и получать новые высокодекоративные сорта разной окраски. В связи с высокой актуальностью культуры сирени как декоративного растения, а также высокой востребованностью и эффективностью фармакологических субстанций из растительного сырья сирени, стоит задача строгой сертификации сортности коллекционного и посадочного материала и коллекций in vitro на основе современных генетических и биохимических методов. Создание паспорта сорта является стратегической необходимостью при оценке качества растительного материала: подтверждения сортности, стабильности генотипа при микроклональном размножении и количественное содержание антоцианов цветков сортов сирени может существенно дополнить этот раздел.
Работа выполнена при финансовой поддержке задания 06.02 ГПНИ “Природные ресурсы и окружающая среда”, подпрограмма “Биоразнообразие, биоресурсы, экология” на 2021−2025 годы.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Lendvay B., Pedryc A., Höhn M. Characterization of nuclear microsatellite markers for the narrow tndemic Syringa josikaea Jacq. fil. ex Rchb // Not Bot Horti Agrobot Cluj Napoca. 2013. V. 41. P. 301.
Kim K.J., Jansen R.K. A chloroplast DNA phylogeny of lilacs (Syringa, Oleaceae): plastome groups show a strong correlation with crossing groups // Am. J. Bot. 1998. V. 85. P. 1338.
Li J., Goldman-Huertas B., DeYoung J., Alexander J. Phylogenetics and diversification of Syringa inferred from nuclear and plastid DNA sequences // Castanea. 2012. V. 77. P. 82.
Шуваева К.Н. Принципы идентификации и классификации сортов Syringa vulgaris L. по признакам строения венчика. Дис. … канд. биол. наук. Москва: Гл. ботан. сад им. Н. В. Цицина РАН, 2012. 135 с.
Полякова Н.В. Оценка декоративности сирени (Syringa L.) / Н.В. Полякова, В.П. Путенихин // Аграрная Россия. 2013. С. 14.
Fedoseeva A., Lebedkova O., Kanibolotskaya L., Shendrik A., Dudzinskaya V., Tkachenko L., Shineva N. Composition and antiradical activity of lilac extracts // Pharm. Chem. J. 2011. V. 45. P. 91.
Berbecaru-Iovan A., Stanciulescu E.C., Berbecaru-Iovan S., Andrei A.M., Ceausu I., Pisoschi C.G. Study regarding the antioxidant and antidiabetic activity of Syringae vulgaris flos f. ViolÁcea tincture in experimental diabetes // Farmacia. 2014. V. 62. P. 1072.
Su G., Cao Y., Li C., Yu X., Gao X., Tu P., Chai X. Phytochemical and pharmacological progress on the genus Syringa // Chem. Cent. J. 2015. V. 9 (1). P. 2.
Mlcek J., Rop O. Fresh edible flowers of ornamental plants – a new source of nutraceutical foods // Trends Food Sci Technol. 2011. V. 22. P. 561.
Kurkin V., Grinenko N., Zapesochnaya G., Dubichev A., Vorontsov E. TLC and HPLC analysis of syringin in Syringa vulgaris // Chem Nat Compd. 1992. V. 28. P. 36.
Damtoft S., Franzyk H., Jensen S.R. Biosynthesis of iridoids in Syringa and Fraxinus: secoiridoid precursors // Phytochemistry. 1995. V. 40. P. 773.
Ahmad M., Rizwani G.H., Aftab K., Ahmad V.U., Gilani A.H., Ahmad S.P. Acteoside: a new antihypertensive drug // Phytother Res. 1995. V. 9. P. 525.
Toth G., Barabas C., Toth A., Kery A., Beni S., Boldizsar I., Varga E., Noszal B. Characterization of antioxidant phenolics in Syringa vulgaris L. flowers and fruits by HPLC-DAD-ESI-MS // Biomed. Chromatogr. 2016. V. 30. P. 923.
Ратькин А.В., Тарасов В.А. Генетический контроль биосинтеза антоцианов в цветках горошка душистого (Lathyrus odoratus L.) // Генетика. 2010. Т. 46. С. 488.
Passeri V., Koes R., Quattrocchio F.M. New challenges for the design of high value plant products: stabilization of anthocyanins in plant vacuoles // Front. Plant Sci. 2016. P. 1. https://doi.org/10.3389/fpls.2016.00153
Huang J.X., Wang L.S., Li X.M., Lu Y.Q. Advances in molecular basis and evolution of floral color variation // Chin Bull Bot. 2006. V. 23. P. 321.
Готтих М.Б., Ташлицкий В.Н. Определение качественного и количественного состава антоциановых пигментов в составе биологически активных добавок с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) // Рус. мед. жур. 2007. Т. 8. http://www.rmj.ru/articles_5604.htm
Martin C., Prescott A., Mackay S., Bartlett J., Vrijlandt E. Control of anthocyanin biosynthesis in flowers of Antirrhinum majus // Plant J. 1991. V. l. P. 37.
Zheng J., Hu Z., Guan X., Dou D., Bai G., Wang Y., Guo Y., Li W., Leng P. Transcriptome analysis of Syringa oblata Lindl. inflorescence identifies genes associated with pigment biosynthesis and scent metabolism // PLoS ONE. 2015. V. 10. P. 20.
Durst R.W., Wrolstad W.E. Separation and characterization of anthocyanins by HPLC // https://doi.org/10.1002/0471142913.faf0103s00
Дейнека Л.А., Литвин Ю.Ю., Дейнека В.И. Критерии для классификации винограда по антоциановому комплексу плодов // Региональные геосистемы. 2008. Т. 47: https://cyberleninka.ru/article/n/ kriterii-dlya-klassifikatsii-vinograda-po-antotsianovomu-kompleksu-plodov.
Кульченко Я.Ю., Дейнека В.И., Чулков А.Н., Сидоров А.Н., Дейнека Л.А., Селеменев В.Ф. Определение антоцианов лепестков астр китайских, Callistephus chinensis, методом обращенно-фазовой ВЭЖХ // Сорбционные и хроматографические процессы. 2018. Т. 18. С. 588.
Дейнека В.И., Кульченко Я.Ю., Олейниц Е.Ю., Дейнека Л.А., Варушкина С.М., Чулков А.Н., Селеменев В.Ф. Использование ВЭЖХ при определении антоцианов цветков растений семейства Malvaceae // Сорбционные и хроматографические процессы. 2020. Т. 20. С. 150. https://doi.org/10.17308/sorpchrom.2020.20/2769
Тыняная И.И. Разделение, концентрирование и анализ антоцианов и бетацианинов в экстрактах растительного сырья с применением оптических и хроматографических методов. Дис. … канд. хим. наук. Воронеж: Воронежский государственный университет, 2016. 135 с.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений



