Физиология растений, 2022, T. 69, № 2, стр. 189-197
Влияние 24-эпикастастерона и его моносалицилата на солеустойчивость Arabidopsis thaliana дикого типа и салицилатдефицитных трансформантов NahG
Р. П. Литвиновская a, М. А. Шкляревский b, Ю. Е. Колупаев b, *, А. И. Кокорев b, В. А. Хрипач a, А. П. Дмитриев c
a Институт биоорганической химии Национальной академии наук Беларуси
Минск, Беларусь
b Харьковский национальный аграрный университет им. В. В. Докучаева
Харьков, Украина
c Институт клеточной биологии и генетической инженерии Национальной академии наук Украины
Киев, Украина
* E-mail: plant.biology.knau@gmail.com
Поступила в редакцию 11.08.2021
После доработки 20.08.2021
Принята к публикации 20.08.2021
- EDN: ACKGLR
- DOI: 10.31857/S0015330322020105
Аннотация
Исследовано влияние 24-эпикастастерона (ЭК) и его конъюгата с остатком салициловой кислоты (2-моносалицилата ЭК – МСЭК) на устойчивость растений Arabidopsis thaliana L. дикого типа (Col-0) и трансформированных геном бактериальной салицилатгидроксилазы (NahG) к 24-часовому воздействию 175 мМ NaCl. Обработка ЭК в диапазоне концентраций от 0.01 до 1 мкМ оказывала положительное влияние на солеустойчивость растений дикого типа, что проявлялось в снижении под его влиянием интенсивности ПОЛ, стабилизации пула хлорофилла и повышении содержания каротиноидов после действия NaCl. Еще более выраженный защитный эффект на растения Col-0 оказывал МСЭК. Под влиянием ЭК в условиях солевого стресса у растений дикого типа повышалась активность антиоксидантных ферментов каталазы и гваяколпероксидазы, а при обработке МСЭК происходило значительное повышение активности супероксиддисмутазы и каталазы. В то же время обработка как ЭК, так и МСЭК не изменяла активность антиоксидантных ферментов у растений NahG, которые не способны накапливать салициловую кислоту. Также воздействие ЭК или МСЭК на салицилатдефицитные растения A. thaliana не изменяло интенсивности ПОЛ и содержания фотосинтетических пигментов при солевом стрессе. Сделано заключение об участии салициловой кислоты в реализации защитного действия брассиностероидов на растения в условиях интенсивного засоления и перспективности применения МСЭК для повышения солеустойчивости растений.
ВВЕДЕНИЕ
Брассиностероиды (БС) – класс растительных полигидроксистероидов, структурно родственных стероидным гормонам позвоночных животных и насекомых [1]. БC играют ключевую роль в поддержании нормального роста растений как в оптимальных условиях, так и при действии неблагоприятных факторов окружающей среды. Предполагается, что модификация сигнального пути БС может быть одним из стратегических направлений решения проблемы адаптации культурных растений [2]. Изученная в последние годы способность БС индуцировать устойчивость растений к “отсроченному” действию стресс-факторов [3, 4] создает дополнительные предпосылки для их использования в растениеводстве в качестве праймирующих агентов. БС оказывают протекторное влияние на растения, подвергающиеся действию абиотических стрессоров различной природы – гипо- и гипертермии, засухи, засоления, тяжелых металлов, гербицидов и т.д. [5–8]. Широкий спектр эффектов БС, вероятно, связан с их способностью регулировать экспрессию ключевых для обеспечения устойчивости растений генов, кодирующих транскрипционные факторы MYB/MYC и WRKY, белки семейства COR, дегидрины, белки теплового шока, белки цитоскелета, антиоксидантные ферменты [2, 8]. От экспрессии этих генов зависит выполнение программ адаптации к стрессорам различной природы. По крайней мере, часть таких эффектов БС реализуется за счет их функционального взаимодействия с другими фитогормонами, в частности, с гиббереллинами, ауксинами [9], цитокининами [10], АБК [11], этиленом и салициловой кислотой (СК) [12].
СК наряду с БС вовлекается в адаптацию растений к стресс-факторам различной природы [13]. Имеются данные, указывающие на участие компонентов салицилатного сигналинга в реализации стресс-протекторных эффектов БС [14]. Однако такие сведения неоднозначны. Так, при заражении корней риса Pythium graminicola БС действовали как факторы вирулентности, усиливая развитие болезни и подавляя защитное действие синтетического аналога СК бензотиадиазола [15]. Иной характер взаимодействия СК и БС обнаружен в экспериментах по повышению устойчивости растений к действию абиотических стрессоров. Например, показано, что экзогенный 24-эпибрассинолид значительно повышал теплоустойчивость растений A. thaliana дикого типа (Col-0), но слабо влиял на резистентность генотипа npr1-1 – мутантов по ключевому гену салицилатного сигналинга [12]. При действии засоления показатель выживаемости npr1-1 не отличался от такового у растений дикого типа, однако при обработке экзогенным 24-эпибрассинолидом повышение солеустойчивости наблюдалось только у растений Col-0 [12].
Комбинированная обработка 24-эпибрассинолидом и СК оказывала более существенные защитные эффекты на растения Brassica juncea при действии токсичных доз свинца, что проявлялось в усиленном накоплении антиоксидантов липидной фазы и хелаторов металлов [16]. Усиление защитного влияния обработки 28-гомобрассинолидом в сочетании с СК показано на растениях Brassica juncea в условиях засоления [17]. При одновременном действии двух фитогормонов в условиях засоления отмечались более высокие показатели устьичной проводимости, фиксации CO2 и активности нитратредуктазы по сравнению с растениями, обработанными каждым из фитогормонов по отдельности.
Показано, что конъюгаты БС с СК, специально синтезированные с помощью реакций 24-эпибрассинолида и 24-эпикастастерона (ЭК) с ангидридом 2-O-бензилсалициловой кислоты с последующим гидрогенолизом O-бензильных групп, оказывали более заметное влияние на выживание проростков проса после потенциально летального нагрева не только по сравнению с исходными БС, но и со смесью соответствующих БС с СК, взятых в оптимальных концентрациях [18].
Следует отметить, что, несмотря на сложившиеся представления о защитных функциях СК у растений в условиях действия абиотических стрессоров, в ряде исследований показано, что отсутствие эндогенного пула СК может не только не снижать устойчивость растений к действию отдельных неблагоприятных факторов, но и повышать ее. Например, установлено, что растения A. thaliana NahG, трансформированные бактериальной салицилатгидроксилазой и не накапливающие вследствие этого СК, проявляли более высокую устойчивость к действию ионов алюминия [19] и кадмия [20]. Неоднозначной оказалась реакция трансформантов NahG на действие засоления. При умеренном солевом стрессе растения NahG отличались повышенной по сравнению с растениями дикого типа устойчивостью, в то время как при действии высоких концентраций NaCl, их устойчивость оказалась ниже, чем у растений Col-0 [21]. Под влиянием экзогенного пероксида водорода отмечалось ингибирование роста растений дикого типа, но не трансформантов NahG, при этом обработка H2O2 повышала солеустойчивость растений обоих генотипов [22]. В связи с этим можно полагать, что повышение солеустойчивости растений экзогенным пероксидом водорода не связано с участием СК как возможного посредника.
Растения NahG могут служить модельным объектом для изучения роли эндогенной СК в проявлении эффектов различных соединений со стресс-протекторным действием. Однако влияние БС на адаптивные реакции таких растений до сих пор не изучено, несмотря на наличие сведений о функциональном взаимодействии БС и СК [12].
Для выяснения возможной роли СК в проявлении протекторного действия БС сравнивали влияние ЭК и его 2-моносалицилата (МСЭК) на солеустойчивость растений A. thaliana дикого типа и салицилатдефицитных трансформантов NahG и состояние их ферментативной антиоксидантной системы. Помимо получения доказательств участия СК в повышении солеустойчивости под действием БС, такие результаты могут быть полезными при оценке возможности практического применения новых синтетических производных БС, в частности МСЭК, для повышения устойчивости растений к засолению.
МАТЕРИАЛЫ И МЕТОДЫ
Для экспериментов использовали 5-недельные растения Arabidopsis thaliana дикого типа (Col-0) и трансформированные геном NahG, кодирующим салицилатгидроксилазу (КФ 1.14.13.1) бактерии Pseudomoms putida [23]. Содержание СК в клетках листьев трансформантов NahG на порядок ниже, чем у растений дикого типа [23]. Семена растений NahG были предоставлены проф. Ж. М. Нейгаузом (Университет Нашатель, Швейцария). Растения выращивали в водной культуре на среде Хогланда с модификациями при температуре 22/16°С (день/ночь) [24], освещении 6000 лк и фотопериоде 10 ч. В таких условиях растения накапливали достаточную биомассу розетки, но еще не переходили к цветению [25].
ЭК или МСЭК, синтезированные в лаборатории химии стероидов Института биоорганической химии НАН Беларуси, вносили в питательную среду и инкубировали на ней растения в течение 24 ч. После этого их переносили на питательную смесь без исследуемых БС, но с добавлением 175 мМ NaCl. После 24-часовой инкубации растений в присутствии хлорида натрия среду заменяли на обычную. Ранее было установлено, что такое воздействие соли не приводило к потере тургора, но вызывало увеличение водного дефицита, усиление ПОЛ и снижение содержания хлорофилла в листьях при дальнейшем росте растений на обычной среде [25].
В первой серии экспериментов с использованием ЭК и МСЭК в концентрациях 0.01, 0.1 и 1 мкМ изучали концентрационную зависимость влияния этих соединений на солеустойчивость растений A. thaliana дикого типа. В качестве критериев стресс-протекторного действия БС использовали изменения водного дефицита, интенсивности ПОЛ и содержания фотосинтетических пигментов в листьях после воздействия на растения 175 мМ NaCl в течение 24 ч.
Во второй серии опытов использовали оптимальные концентрации ЭК и МСЭБ для сравнения их влияния на солеустойчивость растений дикого типа и трансформантов NahG. В этой серии экспериментов определяли активность антиоксидантных ферментов, а также содержание продуктов ПОЛ и фотосинтетических пигментов в листьях. Для анализов использовали развитые розеточные листья 5–6 ярусов. Все показатели за исключением содержания фотосинтетических пигментов определяли сразу после окончания 24‑часового стрессового воздействия.
Водный дефицит оценивали по насыщению интактных листьев водой в течение 12–14 ч и выражали в процентах от общего содержания воды в состоянии полного насыщения [25].
Для определения продуктов ПОЛ, реагирующих с 2-тиобарбитуровой кислотой (преимущественно МДА), листья гомогенизировали в реакционной среде, содержащей 0.25% 2-тиобарбитуровую кислоту в 10% ТХУ, гомогенат помещали в кипящую водяную баню на 30 мин. Затем пробы охлаждали и центрифугировали 15 мин при 10 000 g на центрифуге MPW 350R (MedInstruments, Польша). Оптическую плотность надосадочной жидкости определяли при 532 нм (максимум светопоглощения МДА) и 600 нм (для поправки на неспецифическое светопоглощение) [26]. Содержание МДА выражали в мкмоль/г сухой массы. Сухую массу растений определяли путем высушивания при температуре (103 ± 1°С) до постоянной массы.
Содержание фотосинтетических пигментов анализировали через 2 суток после действия соли на растения. Как показано ранее [22, 25], именно через такое время после стрессового воздействия наблюдалось наиболее заметное снижение содержания хлорофилла в листьях. Пигменты экстрагировали из листьев этанолом и определяли их содержание спектрофотометрическим методом [27]. Их количество выражали в мг/г сухой массы.
Активность антиоксидантных ферментов – супероксиддисмутазы (СОД, КФ 1.15.1.1), каталазы (КАТ, КФ 1.11.1.6) и гваяколпероксидазы (ГПО, КФ 1.11.1.7) – определяли методами, подробно описанными ранее [22]. Свежесрезанные листья гомогенизировали на холоде в 0.15 М K, Na-фосфатном буфере, pH 7.6, содержавшем 0.1 мМ ЭДТА и 1 мМ дитиотрейтола. Гомогенат центрифугировали при 8000 g в течение 10 мин при температуре 2–4°С. Супернатант использовали для анализа. Активность СОД определяли при pH 7.6 по методу, основанному на способности фермента конкурировать с нитросиним тетразолием за супероксидные анионы, образующиеся вследствие аэробного взаимодействия НАДH и феназинметосульфата. Ее выражали в условных единицах/г сухой массы мин. Активность каталазы определяли по количеству пероксида водорода, разложившегося за единицу времени, и выражали в ммоль H2O2/г сухой массы мин. При определении активности ГПО в качестве донора водорода использовали гваякол, а в качестве субстрата – пероксид водорода. Активность фермента выражали в условных единицах/г сухой массы мин.
Эксперименты проводили в 3-кратной биологической повторности; каждый опыт независимо воспроизводили 3 раза. На рисунках и в таблице приведены средние величины и их стандартные ошибки. Достоверность различий определяли по t-критерию Стьюдента. Кроме специально оговоренных случаев, обсуждаются различия, достоверные при P ≤ 0.05.
РЕЗУЛЬТАТЫ
Концентрационная зависимость стресс-протекторного влияния ЭК и МСЭК на растения Arabidopsis thaliana дикого типа
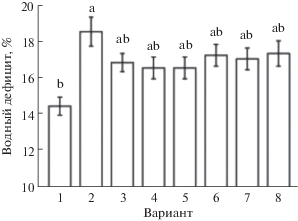
Воздействие NaCl вызывало увеличение водного дефицита листьев (рис. 1). Предварительная обработка как ЭК, так и МСЭК в разных концентрациях смягчала его проявление. Однако влияние изучаемых БС на этот показатель проявлялось на уровне тенденции и было значимым лишь при P ≤ 0.1. В связи с этим различий в эффектах ЭК и МСЭК зафиксировать не удалось.
Рис. 1.
Водный дефицит листьев A. thaliana дикого типа (Col-0) при обработке ЭК, МСЭК в условиях солевого стресса (175 мМ NaCl, 24 ч). 1 – контроль; 2 – NaCl (175 мМ); 3 – NaCl (175 мМ) + ЭК (0.01 мкМ); 4 – NaCl (175 мМ) + ЭК (0.10 мкМ); 5 – NaCl (175 мМ) + + ЭК (1.00 мкМ); 6 – NaCl (175 мМ) + МСЭК (0.01 мкМ); 7 – NaCl (175 мМ) + МСЭК (0.10 мкМ); 8 – NaCl (175 мМ) + МСЭК (1.00 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.
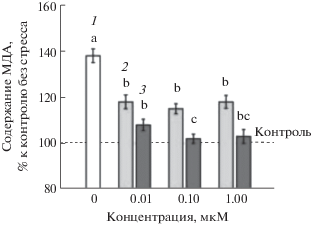
После 24 ч воздействия 175 мМ NaCl содержание продуктов ПОЛ в листьях увеличивалось почти на 40% (рис. 2). Обработка ЭК во всех трех исследуемых концентрациях частично снимала проявление окислительного стресса, вызываемое действием хлорида натрия. Протекторное действие МСЭК было более эффективным: это соединение в минимальной концентрации (0.01 мкМ) частично, а в более высоких (0.1 и 1 мкМ) почти полностью устраняло повышение содержания МДА в листьях, вызываемое солевым стрессом (рис. 2).
Рис. 2.
Влияние ЭК и МСЭК на содержание МДА (% к контролю без стресса) в листьях A. thaliana дикого типа после 24-часового воздействия 175 мМ NaCl. 1 – без обработки ЭК и МСЭК; 2 – ЭК; 3 – МСЭК. Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.
Инкубация растений на среде с добавлением хлорида натрия вызывала не только окислительный стресс в листьях, но и существенно (на 27%) уменьшала содержание хлорофиллов a и b (табл. 1). Обработка растений ЭК в концентрации 0.1 мкМ способствовала сохранению пула хлорофиллов. При действии ЭК в концентрациях 0.01 и 1 мкМ его защитные эффекты не были статистически значимыми при P ≤ 0.05. Стабилизирующее влияние МСЭК на пул хлорофиллов было более существенным и проявлялось во всем диапазоне исследуемых концентраций (табл. 1). Наибольший протекторный эффект обнаружили при использовании МСЭК в концентрации 0.1 мкМ.
Таблица 1.
Влияние различных концентраций ЭК и МСЭК на содержание фотосинтетических пигментов (мг/г сухой массы) в листьях A. thaliana (Col-0) после 24-часового воздействия NaCl
| Вариант | Хлорофилл a | Хлорофилл b | Хлорофиллы a + b | Каротиноиды |
|---|---|---|---|---|
| Контроль | 11.17 ± 0.19a* | 5.49 ± 0.07a | 16.66 ± 0.20a | 1.93 ± 0.06b |
| NaCl (175 мМ) | 8.16 ± 0.14c | 4.02 ± 0.06c | 12.18 ± 0.15d | 2.02 ± 0.06b |
| NaCl (175 мМ) + ЭК (0.01 мкМ) | 8.48 ± 0.16c | 4.29 ± 0.07c | 12.77 ± 0.17d | 2.26 ± 0.08ab |
| NaCl (175 мМ) + ЭК (0.10 мкМ) | 9.22 ± 0.16b | 4.65 ± 0.08bc | 13.87 ± 0.18c | 2.43 ± 0.07a |
| NaCl (175 мМ) + ЭК (1.00 мкМ) | 8.78 ± 0.14c | 4.08 ± 0.08c | 12.86 ± 0.16cd | 2.35 ± 0.10ab |
| NaCl (175 мМ) + МСЭК (0.01 мкМ) | 9.12 ± 0.18bc | 4.64 ± 0.10bc | 13.76 ± 0.21c | 2.17 ± 0.08ab |
| NaCl (175 мМ) + МСЭК (0.10 мкМ) | 10.06 ± 0.16b | 5.33 ± 0.07a | 15.39 ± 0.17b | 2.40 ± 0.08a |
| NaCl (175 мМ) + МСЭК (1.00 мкМ) | 9.37 ± 0.19bc | 4.88 ± 0.09b | 14.25 ± 0.21c | 2.35 ± 0.10ab |
Содержание каротиноидов в листьях после воздействия 175 мМ NaCl существенно не изменялось. Обработка ЭК и МСЭК в концентрации 0.1 мкМ вызывала значимое увеличение содержания каротиноидов в листьях в условиях солевого стресса, эффект других концентраций изучаемых БС проявлялся на уровне тенденции (табл. 1).
В целом можно констатировать, что наиболее заметный защитный эффект ЭК и его моносалицилата проявлялся в концентрации 0.1 мкМ. Эту концентрацию использовали в дальнейших экспериментах по сравнению влияния ЭК и МСЭК на солеустойчивость A. thaliana дикого типа и салицилатдефицитных трансформантов и функционирование антиоксидантной системы растений двух генотипов.
Влияние ЭК и МСЭК на солеустойчивость салицилатдефицитного трансформанта NahG растений Arabidopsis thaliana
Растения салицилатдефицитного трансформанта NahG проявляли более высокую базовую устойчивость к действию 175 мМ NaCl по сравнению с растениями дикого типа (рис. 3). Так, если у растений дикого типа под влиянием стрессора содержание МДА возрастало почти на 40%, то у растений NahG оно увеличивалось лишь на 18%. Суммарное содержание хлорофиллов у растений дикого типа после солевого воздействия снижалось почти на треть, в то время как у трансформанта такое снижение составило всего 12% (рис. 4). Содержание каротиноидов при солевом стрессе у растений обоих генотипов существенно не изменялось.
Рис. 3.
Содержание МДА в листьях A. thaliana дикого типа (Col-0) и салицилатдефицитных трансформантов (NahG) после 24-часового воздействия 175 мМ NaCl. 1 – контроль; 2 – NaCl (175 мМ); 3 – NaCl (175 мМ) + ЭК (0.10 мкМ); 4 – NaCl (175 мМ) + МСЭК (0.10 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.

Рис. 4.
Содержание хлорофиллов (а) и каротиноидов (б) в листьях A. thaliana дикого типа (Col-0) и салицилатдефицитных трансформантов (NahG) при действии NaCl и брассиностероидов. 1 – контроль; 2 – NaCl (175 мМ); 3 – NaCl (175 мМ) + ЭК (0.10 мкМ); 4 – NaCl (175 мМ) + МСЭК (0.10 мкМ). (а) светлая часть столбиков – хлорофилл a, темная – хлорофилл b. Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.

Обработка ЭК и МСЭК, препятствуя развитию окислительного стресса и способствуя сохранению пула хлорофиллов в условиях действия NaCl у растений дикого типа, почти не оказывала такого влияния на растения NahG (рис. 3, 4). Под влиянием ЭК и МСЭК приблизительно в одинаковой степени повышалось содержание каротиноидов в листьях растений A. thaliana Col-0. При этом обработка исследуемыми БС не влияла на содержание каротиноидов у салицилатдефицитных растений (рис. 4). Таким образом, можно констатировать отсутствие существенного влияния как ЭК, так и его моносалицилата на солеустойчивость трансформанта NahG.
Влияние ЭК и МСЭК на ферментативную антиоксидантную систему растений при солевом стрессе
После воздействия NaCl у растений A. thaliana дикого типа существенно снижалась активность СОД (рис. 5а). У салицилатдефицитного трансформанта активность фермента сохранялась на уровне контрольных значений. Обработка ЭК не влияла на активность СОД у растений дикого типа. В то же время воздействие МСЭК приводило к существенному повышению активности фермента у этих растений в условиях солевого стресса (рис. 5а). Обработка ЭК и МСЭК не вызывала изменений активности СОД в листьях трансформантов NahG.
Рис. 5.
Активность СОД (а), КАТ (б) и ГПО (в) в листьях A. thaliana дикого типа (Col-0) и салицилатдефицитных трансформантов (NahG) при действии N-aCl и брассиностероидов. 1 – контроль; 2 – NaCl (175 мМ); 3 – NaCl (175 мМ) + ЭК (0.10 мкМ); 4 – NaCl (175 мМ) + МСЭК (0.10 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.

Активность КАТ после стрессового воздействия NaCl у растений обоих исследуемых генотипов существенно не изменялась (рис. 5б). У растений дикого типа под влиянием ЭК активность КАТ не изменялась, в то же время обработка МСЭК вызывала ее повышение. Исследуемые БС не оказывали влияния на активность КАТ у салицилатдефицитных растений NahG.
Базовая активность ГПО у трансформантов NahG была значительно выше, чем у растений Col-0 (рис. 5в). В ответ на солевой стресс активность фермента повышалась у растений обоих генотипов. Предварительная обработка растений дикого типа ЭК и МСЭК приблизительно в одинаковой степени способствовала дополнительному повышению активности ГПО после воздействия NaCl (рис. 5в). В то же время у растений NahG при обработке ЭК перед солевым стрессом активность ГПО не отличалась от таковой в варианте с действием только NaCl, а обработка МСЭК вызывала даже тенденцию к снижению активности фермента, хотя этот эффект не был значимым при P ≤ 0.05.
ОБСУЖДЕНИЕ
В настоящей работе получены экспериментальные данные, указывающие на вовлечение СК в процесс повышения солеустойчивости растений A. thaliana одним из распространенных БС – ЭК. О значении СК для реализации стресс-протекторных эффектов БС, в частности, свидетельствует отсутствие заметного защитного действия ЭК и МСЭК на растения трансформанты NahG, экспрессирующие бактериальную салицилатгидроксилазу и не способные к накоплению СК. Так, если у растений A. thaliana дикого типа обработка ЭК, и особенно МСЭК, смягчала проявление процесса ПОЛ и деградации хлорофилла при солевом стрессе, то у трансформантов NahG защитные эффекты обоих БС не проявлялись (рис. 3, 4). Также, в отличие от растений дикого типа, у трансформантов NahG под влиянием обработки ЭК и МСЭК не обнаружено повышения ни одного из трех изученных антиоксидантных ферментов (рис. 5).
Как уже отмечалось, в литературе имеются данные о вовлечении ключевого белка салицилатного сигналинга NPR1 в проявление эффектов БС [12]. Этот белок в мономерной форме активирует транскрипционные факторы TGA, контролирующие экспрессию салицилат-чувствительных генов. У мутантов npr1-1 не происходило повышения солеустойчивости в ответ на обработку экзогенным 24-эпибрассинолидом [12]. Эти данные указывают на возможную роль белка NPR1 в передаче сигнала БС, однако они не являются доказательством непосредственного участия СК в реализации эффектов БС. Обнаруженное в нашей работе отсутствие выраженного стресс-протекторного влияния БС на салицилатдефицитные растения NahG можно рассматривать как аргумент в пользу вовлечения эндогенной СК в реализацию эффектов БС. Примечательно, что у трансформантов NahG не происходило изменений активности антиоксидантных ферментов, содержания МДА и хлорофиллов при обработке не только ЭК, но и МСЭК. Такой результат представляется нам достаточно закономерным, поскольку МСЭК использовался в довольно низкой концентрации (0.1 мкМ). В литературе имеются данные о том, что у растений A. thaliana NahG не происходило усиления экспрессии гена PR1, кодирующего ключевой белок, синтезирующийся под влиянием СК, даже при обработке 5 мМ СК, также СК в указанной концентрации не повышала устойчивость салицилатдефицитных трансформантов к заражению патогенным грибом Botrytic cinerea [28]. Отсутствие индукции синтеза белка PR1 при действии экзогенной СК отмечено и в более поздних исследованиях [29]. Высокая активность салицилатгидроксилазы исключает накопление СК растениями NahG даже при ее экзогенном введении в концентрациях, существенно превышающих физиологические.
Отдельного пояснения требует проявившаяся в наших экспериментах повышенная солеустойчивость салицилатдефицитных трансформантов NahG. Такие эффекты наблюдались и в работе, выполненной ранее с использованием более высокой концентрации NaCl – 200 мМ [22]. Также показана способность растений NahG к эффективной стабилизации содержания активных форм кислорода при действии не только солевого стресса, но и экзогенного пероксида водорода [22]. В работе Hao и соавт. [30] сообщается о повышенном соотношении между восстановленным и окисленным глутатионом у растений NahG в условиях умеренного солевого стресса. Одной из причин повышенной устойчивости растений NahG к окислительному стрессу может быть высокая активность ГПО. В свою очередь, условием для ее поддержания у этих растений может быть высокое содержание катехола [31], способного выступать в пероксидазных реакциях в роли восстановителя H2O2. В частности, показано положительное влияние экзогенного катехола на прорастание семян A. thaliana в условиях солевого стресса [32]. С другой стороны, показано, что растения NahG, не способные к накоплению СК, но аккумулирующие значительное количество катехола, отличались повышенной устойчивостью к токсическому действию алюминия [19] и кадмия [33]. Тем не менее, при определенных условиях, например, при воздействии высоких концентраций NaCl (400 мМ) устойчивость растений NahG может быть ниже резистентности растений дикого типа [21]. При этом известно, что экзогенная СК может эффективно усиливать адаптацию растений к засолению, хотя ее протекторные эффекты обычно проявляются в довольно узком концентрационном диапазоне. Например, показано, что обработка растений A. thaliana дикого типа 10 мкМ СК повышала их солеустойчивость, в то время как под действием 200 мкМ она снижалась [34].
Есть основания полагать, что наличие остатка СК в конъюгате ЭК (МСЭК) при его попадании в клетки растений за счет гидролиза эфирной связи создает эффект “мягкого” повышения содержания СК и условия для комбинированного синергического действия СК и ЭК. Естественно, это предположение требует специальной экспериментальной проверки. Однако сравнение влияния ЭК и МСЭК на солеустойчивость растений A. thaliana дикого типа показывает значительно более эффективное стресс-протекторное действие последнего (рис. 3, 4). Особенностью действия МСЭК оказалось повышение под его влиянием активности СОД в листьях A. thaliana дикого типа, в то время как ЭК подобного эффекта не проявлял (рис. 5а). Следует отметить, что выраженная способность повышать активность СОД при солевом стрессе на растениях разных видов показана для СК [35], остаток которой содержится в МСЭК. Как известно, СОД является единственным антиоксидантным ферментом, обезвреживающим супероксидный анион-радикал, в связи с чем этот фермент относят к “первому эшелону” антиоксидантной защиты [35]. Примечательно также, что обработка МСЭК, но не обычным ЭК, также повышала активность КАТ у растений Col-0 при солевом стрессе (рис. 5б). Вероятно, одновременное повышение СОД и КАТ способствовало сбалансированному обезвреживанию как супероксидного анион-радикала, так и пероксида водорода, образующегося в реакции с участием СОД. Также исследуемые БС способствовали повышению активности ГПО у растений дикого типа, хотя в этом случае действие ЭК и МСЭК значимо не отличалось (рис. 5в). Изменение активности антиоксидантных ферментов при солевом стрессе под влиянием БС зарегистрировано у растений различных видов [4, 36, 37]. На растениях рапса показано, что обработка ЭК, в отличие от действия 24-эпибрассинолида, вызывала повышение активности пероксидазы при воздействии 150 мМ NaCl, а активность СОД при этом повышалась только под влиянием 24-эпибрассинолида [4]. С другой стороны, обработка 24-эпибрассинолидом и 28-гомобрассинолидом не оказывала влияния на активность СОД и пероксидазы у растений картофеля, подвергнутых действию 100 мМ NaCl. При этом предстрессовое воздействие БС способствовало усилению накопления пролина в условиях засоления [3]. По-видимому, БС, в зависимости от химического строения, видовых особенностей растений и других факторов, могут индуцировать различные компоненты антиоксидантной защиты, находящиеся между собой в функциональном взаимодействии. Так, известно, что пролин является низкомолекулярным компонентом антиоксидантной системы и может находиться в реципрокных отношениях с ее ферментативными компонентами, в первую очередь, с СОД [38, 39].
Еще одним эффектом ЭК и МСЭК, обусловливающим предотвращение развития окислительного стресса, является усиление накопления каротиноидов в листьях растений дикого типа (рис. 4). Известно, что каротиноиды обеспечивают гашение синглетного кислорода и инактивируют пероксидные радикалы, которые генерируются при избыточном возбуждении хлорофилла [40].
Таким образом, в целом исследуемые БС – ЭК и МСЭК – способствовали поддержанию редокс-гомеостаза и сохранению пула фотосинтетических пигментов у растений A. thaliana в условиях солевого стресса. При этом действие МСЭК было более эффективным. Этот факт, а также отсутствие положительного влияния исследуемых БС на показатели редокс-гомеостаза и солеустойчивость трансформантов NahG, не способных накапливать СК, указывают на ее роль в реализации стресс-протекторного действия БС. При этом конъюгат ЭК, содержащий остаток СК (МСЭК) и превосходящий по интенсивности защитного действия ЭК, можно рассматривать в качестве физиологически активного вещества со стресс-протекторными эффектами, перспективного для практического применения.
Авторы благодарны к.б.н. Т. О. Ястреб за ценные методические консультации.
Настоящая статья не содержит каких-либо исследований с использованием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Bajguz A. Brassinosteroids – occurence and chemical structures in plants // Brassinosteroids: A Class of Plant Hormone / Eds. Hayat S., Ahmad A. Springer Science+Business Media B.V. 2011. P. 1. https://doi.org/10.1007/978-94-007-0189-2_1
Nolan T., Chen J., Yin Y. Cross-talk of brassinosteroid signaling in controlling growth and stress responses // Biochem. J. 2017. V. 474. P. 2641. https://doi.org/10.1042/BCJ20160633
Efimova M.V., Khripach V.A., Boyko E.V., Malofiy M.K., Kolomeychuk L.V., Murgan O.K., Vidershpan A.N., Mukhamatdinova E.A., Kuznetsov Vl.V. The priming of potato plants induced by brassinosteroids reduces oxidative stress and increases salt tolerance // Dokl. Biol. Sci. 2018. V. 478. P. 33. https://doi.org/10.1134/S0012496618010106
Kolomeichuk L.V., Danilova E.D., Khripach V.A., Zhabinskyi V.N., Kuznetsov Vl.V., Efimova M.V. Ability of lactone- and ketone-containing brassinosteroids to induce priming in rapeseed plants to salt stress // Russ. J. Plant Physiol. 2021. V. 68. P. 499. https://doi.org/10.1134/S1021443721020084
Efimova M.V., Hasan J.A.K., Kholodova V.P., Kuznetsov V.V., Savchuk A.L., Litvinovskaya R.P., Khripach V.A. Physiological mechanisms of enhancing salt tolerance of oilseed rape plants with brassinosteroids // Russ. J. Plant Physiol. 2014. V. 61. P. 733. https://doi.org/10.1134/S1021443714060053
Nawaz F., Naeem M., Zulfiqar B., Akram A., Ashraf M.Y., Raheel M., Shabbir R.N., Hussain R.A., Anwar I., Aurangzaib M. Understanding brassinosteroid-regulated mechanisms to improve stress tolerance in plants: a critical review // Environ. Sci. Pollut. Res. 2017. V. 24. P. 15959. https://doi.org/10.1007/s11356-017-9163-6
Karpets Yu.V., Kolupaev Yu.E. Participation of nitric oxide in 24-epibrassinolide-induced heat resistance of wheat coleoptiles: functional interactions of nitric oxide with reactive oxygen species and Ca ions // Russ. J. Plant Physiol. 2018. V. 65. P. 177. https://doi.org/10.1134/S1021443718010053
Ahammed G.J., Li X., Liu A., Chen S. Brassinosteroids in plant tolerance to abiotic stress // J. Plant Growth Regul. 2020. V. 39. P. 1451. https://doi.org/10.1007/s00344-020-10098-0
Bajguz A., Hayat S. Effects of brassinosteroids on the plant responses to environmental stresses // Plant Physiol. Biochem. 2009. V. 47. P. 1. https://doi.org/10.1016/j.plaphy.2008.10.002
Kudryakova N.V., Efimova M.V., Danilova M.N., Zubkova N.K., Khripach V.A., Kusnetsov V.V., Kulaeva O.N. Exogenous brassinosteroids activate the expression of the genes of cytokinin signaling pathway in transgenic Arabidopsis thaliana // Plant Growth Regul. 2013. V. 70. P. 61. https://doi.org/10.1007/s10725-012-9778-z
Allagulova C.R., Maslennikova D.R., Avalbaev A.M., Fedorova K.A., Yuldashev R.A., Shakirova F.M. Influence of 24-epibrassinolide on growth of wheat plants and the content of dehydrins under cadmium stress // Russ. J. Plant Physiol. 2015. V. 62. P. 465. https://doi.org/10.1134/S1021443715040020
Divi U.K., Rahman T., Krishna P. Brassinosteroid-mediated stress tolerance in Arabidopsis shows interactions with abscisic acid, ethylene and salicylic acid pathways // BMC Plant Biology. 2010. V. 10. P. 151. https://doi.org/10.1186/1471-2229-10-151
Vlot A.C., Dempsey D.A., Klessig D.F. Salicylic acid, a multifaceted hormone to combat disease // Ann. Rev. Phytopathol. 2009. V. 47. P. 177. https://doi.org/10.1146/annurev.phyto.050908.135202
Ahanger M.A., Ashraf M., Bajguz A., Ahmad P. Brassinosteroids regulate growth in plants under stressful environments and crosstalk with other potential phytohormones // J. Plant Growth Regul. 2018. V. 37. P. 1007. https://doi.org/10.1007/s00344-018-9855-2
De Vleesschauwer D., Van Buyten E., Satoh K., Balidion J., Mauleon R., Choi I.R., Vera-Cruz C., Kikuchi S., Höfte M. Brassinosteroids antagonize gibberellin- and salicylate-mediated root immunity in rice // Plant Physiol. 2012. V. 158. P. 1833. https://doi.org/10.1104/pp.112.193672
Kohli S.K., Handa N., Sharma A., Gautam V., Arora S., Bhardwaj R., Alyemeni M.N., Wijaya L., Ahmad P. Combined effect of 24-epibrassinolide and salicylic acid mitigates lead (Pb) toxicity by modulating various metabolites in Brassica juncea L. seedlings // Protoplasma. 2018. V. 255. P. 11. https://doi.org/10.1007/s00709-017-1124-x
Hayat S., Maheshwari P., Wani A.S., Irfan M., Alyemeni M.N., Ahmad A. Comparative effect of 28 homobrassinolide and salicylic acid in the amelioration of NaCl stress in Brassica juncea L. // Plant Physiol. Biochem. 2012. V. 53. P. 61. https://doi.org/10.1016/j.plaphy.2012.01.011
Litvinovskaya R.P., Vayner A.A., Zhylitskaya H.A., Kolupaev Yu.E., Savachka A.P., Khripach V.A. Synthesis and stress-protective action on plants of brassinosteroid conjugates with salicylic acid // Chem. Nat. Compd. 2016. V. 52. P. 452. https://doi.org/10.1007/s10600-016-1671-y
Guo D.Y., Zhao S.Y., Huang L.L., Ma C.Y., Hao L. Aluminum tolerance in Arabidopsis thaliana as affected by endogenous salicylic acid // Biol. Plant. 2014. V. 58. P. 725. https://doi.org/10.1007/s10535-014-0439-0
Guo B., Liu C., Liang Y., Li N., Fu Q. Salicylic acid signals plant defence against cadmium toxicity // Int. J. Mol. Sci. 2019. V. 20. P. 2960. https://doi.org/10.3390/ijms20122960
Cao Y., Zhan Z. W., Xue L. W., Du J. B., Shang J., Xu F., Yuan S., Lin H.H. Lack of salicylic acid in Arabidopsis protects plants against moderate salt stress // Z. Naturforsch. C. J. Biosci. 2009. V. 64. P. 231. https://doi.org/10.1515/znc-2009-3-414
Yastreb T.O., Kolupaev Yu.E., Lugovaya A.A., Dmitriev A.P. Hydrogen peroxide-induced salt tolerance in the Arabidopsis salicylate-deficient transformants NahG // Appl. Biochem. Microbiol. 2017. V. 53. P. 719. https://doi.org/10.1134/S000368381706014X
Gaffney T., Friedrich L., Vernooij B., Negrotto D., Nye G., Uknes S., Ward E., Kessmann H., Ryalsm J. Requirement of salicylic acid for the induction of systemic acquired resistance // Science. 1993. V. 261. P. 754. https://doi.org/10.1126/science.261.5122.754
Gibeaut D.M., Hulett J., Cramer G.R.J., Seemann R. Maximal biomass of Arabidopsis thaliana using a simple, low-maintenance hydroponic method and favorable environmental conditions // Plant Physiol. 1997. V. 115. P. 317. https://doi.org/10.1104/pp.115.2.317
Yastreb T.O., Kolupaev Yu.E., Shkliarevskyi M.A. Dmitriev A.P. Participation of jasmonate signaling components in the development of Arabidopsis thaliana’s salt resistance induced by H2S and NO donors // Russ. J. Plant Physiol. 2020. V. 67. P. 827. https://doi.org/10.1134/S1021443720050192
Fazlieva E.R., Kiseleva I.S., Zhuikova T.V. Antioxidant activity in the leaves of Melilotus albus and Trifolium medium from man-made disturbed habitats in the Middle Urals under the influence of copper // Russ. J. Plant Physiol. 2012. V. 59. P. 333. https://doi.org/10.1134/S1021443712030065
Шлык А.А. Определение хлорофиллов и каротиноидов в экстрактах зеленых листьев // Биохимические методы в физиологии растений / Под ред. О.А. Павлиновой. Москва: Наука, 1971. С. 154.
Ferrari S., Plotnikova J.M., De Lorenzo G., Ausubel F.M. Arabidopsis local resistance to Botrytis cinerea involves salicylic acid and camalexin and requires EDS4 and PAD2, but not SID2, EDS5 or PAD4 // Plant J. 2003. V. 35. P. 193. https://doi.org/10.1046/j.1365-313X.2003.01794.x
Nagashima Y., Iwata Y., Ashida M., Mishiba K., Koizumi N. Exogenous salicylic acid activates two signaling arms of the unfolded protein response in Arabidopsis // Plant Cell Physiol. 2014. V. 55. P. 1772. https://doi.org/10.1093/pcp/pcu108
Hao L., Zhao Y., Jin D., Zhang L., Bi X.H., Chen H.X., Xu Q., Ma C.Y., Li G.Z. Salicylic acid-altering Arabidopsis mutants response to salt stress // Plant Soil. 2012. V. 354. P. 81. https://doi.org/10.1007/s11104-011-1046-x
van Wees S.C.M., Glazebrook J. Loss of non-host resistance of Arabidopsis NahG to Pseudomonas syringae pv. phaseolicola is due to degradation products of salicylic acid // Plant J. 2003. V. 33. P. 733. https://doi.org/10.1046/j.1365-313x.2003.01665.x
Lee S., Kim S.-G., Park C.-M. Salicylic acid promotes seed germination under high salinity by modulating antioxidant activity in Arabidopsis // New Phytol. 2010. V. 188. P. 626. https://doi.org/10.1111/j.1469-8137.2010.03378.x
Tao S., Sun L., Ma C., Li L., Li G., Hao L. Reducing basal salicylic acid enhances Arabidopsis tolerance to lead or cadmium // Plant Soil. 2013. V. 372. P. 309. https://doi.org/10.1007/s11104-013-1749-2
Yu L.-L., Liu Y., Zhu F., Geng X.-X., Yang Y., He Z.-Q., Xu F. The enhancement of salt stress tolerance by salicylic acid pretreatment in Arabidopsis thaliana // Biol. Plant. 2020. V. 64. P. 150. https://doi.org/10.32615/bp.2019.151
Kolupaev Yu.E., Karpets Yu.V., Kabashnikova L.F. Antioxidative system of plants: cellular compartmentalization, protective and signaling functions, mechanisms of regulation (review) // Appl. Biochem. Microbiol. 2019. V. 55. P. 441. https://doi.org/10.1134/S0003683819050089
Talaat N.B., Shawky B.T. 24-Epibrassinolide alleviates salt-induced inhibition of productivity by increasing nutrients and compatible solutes accumulation and enhancing antioxidant in wheat (Triticum aestivum L.) // Acta Physiol. Plant. 2013. V. 35. P. 729. https://doi.org/10.1007/s11738-012-1113-9
Vázquez M.N., Guerrero Y.R., de la Noval W.T., González L.M., Zullo M.A. T. Advances on exogenous applications of brassinosteroids and their analogs to enhance plant tolerance to salinity: A review // Austr. J. Crop Sci. 2019. V. 13. P. 115. https://doi.org/10.21475/ajcs.19.13.01.p1404
Radyukina N.L., Kartashov A.V., Ivanov Y.V., Shevyakova N.I., Kuznetsov Vl.V. Functioning of defense systems in halophytes and glycophytes under progressing salinity // Russ J. Plant Physiol. 2007. V. 54. P. 806. https://doi.org/10.1134/S1021443707060131
Carvalho K., Campos M.K., Domingues D.S., Pereira L.F., Vieira L.G. The accumulation of endogenous proline induces changes in gene expression of several antioxidant enzymes in leaves of transgenic Swingle citrumelo // Mol. Biol. Rep. 2013. V. 40. P. 3269. https://doi.org/10.1007/s11033-012-2402-5
Demmig-Adams B., Adams W.W., III. The role of xanthophylls cycle carotenoids in the protection of photosynthesis // Trends Plant Sci. 1996. V. 1. P. 21. https://doi.org/10.1016/S1360-1385(96)80019-7
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


