Физиология растений, 2022, T. 69, № 2, стр. 198-206
Натрий μ2-дитиосульфато-тетранитрозилдиферрат тетрагидрат предотвращает обусловленную тепловым шоком дисфункцию митохондрий
И. В. Жигачева a, *, В. И. Бинюков a, И. П. Генерозова b, Е. М. Миль a, Н. И. Крикунова a, М. М. Расулов c, А. А. Албантова a
a Федеральное государственное бюджетное учреждение науки Институт биохимической физики
им. Н.М. Эмануэля Российской академии наук
Москва, Россия
b Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
c Государственный научно-исследовательский институт химии и технологии
элементоорганических соединений
Москва, Россия
* E-mail: zhigacheva@mail.ru
Поступила в редакцию 02.03.2021
После доработки 12.04.2021
Принята к публикации 13.04.2021
- EDN: GHAQMN
- DOI: 10.31857/S0015330322010225
Аннотация
Исследована возможность использования донора NO натрий μ2-дитиосульфато-тетранитрозилдиферрат тетрагидрата (ТНКЖ-тио) в качестве препарата, предупреждающего дисфункцию митохондрий при стрессовых воздействиях. Свойства ТНКЖ-тио изучали на митохондриях 5-дневных этиолированных проростков гороха. Определяли функциональное состояние митохондрий в условиях теплового шока (ТШ) и обработки проростков ТНКЖ-тио. Тепловой шок активировал перекисное окисление липидов, приводил к набуханию митохондрий и изменениям в содержании С18 жирных кислот (ЖК): индекс ненасыщенности С18 ЖК в мембранах митохондрий снижался с 1.42 ± 0.01 до 1.22 ± 0.01. Происходили изменения и в содержании С20 ЖК: содержание 20:3ω6 снизилось почти на 43.6%, а содержание 20:0 сократилось в 1.3 раза. Изменение пула ненасыщенных ЖК отразилось на биоэнергетических характеристиках митохондрий: наблюдалось почти 1.5-кратное падение скоростей окисления НАД-зависимых субстратов окисления. Обработка семян гороха 10–6 М ТНКЖ-тио сопровождалась предотвращением перекисного окисления липидов (ПОЛ), предупреждением изменений в составе ЖК мембран и морфологии митохондрий, а также восстановлением биоэнергетических характеристик этих органелл. Предотвращая ПОЛ, препарат мог способствовать поддержанию функционального состояния митохондрий при стрессе. Результатом этого, возможно, явилось сохранение эффективности энергетических процессов в клетке, что, вероятно, повысило устойчивость организма к изменяющимся условиям внешней среды.
ВВЕДЕНИЕ
Оксид азота (NO) представляет собой сигнальную молекулу, участвующую в прорастании, развитии, цветении и старении растений [1]. NO выполняет важные регуляторные функции на разных стадиях развития растительного организма, а также при взаимодействии растения с симбионтами [1]. Показано увеличение содержания NO в различных органах и тканях растений при адаптации к изменяющимся условиям внешней среды [2], что предполагает возможность использования доноров оксида азота в качестве препаратов, повышающих устойчивость растений к действию стрессовых факторов [3].
Действительно, обработка растений экзогенными донорами NO регулирует устойчивость растений к абиотическому стрессу, и это, возможно, способствует предупреждению снижения урожайности сельскохозяйственных культур в стрессовых условиях [4]. Особый интерес вызывает изучение влияния доноров оксида азота на устойчивость растений к температурным стрессам. Температура окружающей среды является одним из экологических факторов, оказывающих наиболее сильное влияние на жизнедеятельность растений и их продуктивность. Отметим, что при температурах, превышающих оптимальный уровень, физиологическая активность нарушается вследствие инактивации ферментов, что негативно влияет на рост и развитие растений, тем самым ограничивая продуктивность сельскохозяйственных культур [5].
В лабораторных условиях показано, что использование экзогенных доноров NO повышает устойчивость растений к высокотемпературному воздействию [6, 7].
Наиболее перспективными экзогенными донорами NO являются нитрозотиолы (RSNO) и нитрозильные комплексы железа с низкомолекулярными тиолсодержащими лигандами. Так же, как и динитрозильные комплексы негемового железа, S-нитрозотиолы являются одной из форм депонирования NO в клетках, в которых сохраняется его радикальный характер и сродство к атомам железа и серы [8]. Однако применение S-нитрозотиолов возможно лишь в лабораторных условиях, поскольку применение их в растениеводстве ограничено, так как они легко разлагаются уже при комнатной температуре с образованием дисульфидов и оксида азота. Другими перспективными экзогенными донорами оксида азота являются динитрозильные комплексы железа (ДНКЖ). Они являются структурными и спектроскопическими аналогами активных центров негеминовых [2Fe-2S]-белков, найденных во всех живых организмах от бактерий до млекопитающих [8].
Преимущество нитрозильных комплексов железа с тиолсодержащими лигандами перед другими донорами оксида азота может быть обусловлено тем, что они донируют монооксид азота при физиологических значениях рН без какой-либо (термо-, редокс- или фото-) активации, и при разложении этих комплексов не образуется токсических веществ [9].
В нашей работе в качестве донора оксида азота мы использовали натрий μ2-дитиосульфато-тетранитрозилдиферрат тетрагидрат (комплекс железа с тиосульфатом)-[Na2 [Fe(S2O3)2(NO)4]2 · 4H2O (кристаллический ТНКЖ-тио) [9]. Этот комплекс относительно стабилен при хранении на свету и отсутствии влаги. Генерация NO и образование мононитрозильного соединения [Fe(S2O3)2(NO)2] и частицы [Fe(S2O3)] ‒ начинается после растворения комплекса в воде. Целью нашей работы было исследование возможности использования ТНКЖ-тио в качестве донора NO в растениеводстве для повышения устойчивости растений к тепловому стрессу. Такая задача была поставлена в связи с тем, что в настоящее время доноры оксида азота, в частности, широко применяемые S-нитрозотиолы, из-за своей нестабильности при хранении используются лишь в лабораторных условиях. Поскольку для молекулы NO в клетке железо-серные кластеры [Fe-S] белков являются молекулярными мишенями, прежде всего, это белки и комплексы митохондрий и хлоропластов, мы изучали влияние теплового шока и ТНКЖ-тио на функциональное состояние митохондрий 5-дневных этиолированных проростов гороха.
МАТЕРИАЛЫ И МЕТОДЫ
Работу проводили на митохондриях 5-дневных этиолированных проростков гороха (Pisum sativum L.), сорт Флора 2. Семена гороха промывали мыльной водой (хозяйственное мыло) и 0.01% раствором КMnO4, а затем промывали дистиллированной водой в течение 2 мин. Контрольную группу семян в течение 1 часа замачивали в дистиллированной воде, а опытную группу в 10–6 М или 10–9 М водном растворе ТКНЖ-тио. Спустя 1 час, семена контрольной и опытной групп, не отмывая от ТНКЖ-тио, переносили на влажную фильтровальную бумагу, где их проращивали в течение 5 суток в темноте при температуре 24°С. Половина проростков контрольной группы находилась на влажной фильтровальной бумаге при 24°С. Вторую половину проростков контрольной группы (ТШ) и проростки, обработанные ТНКЖ-тио (ТШ+ТНКЖ-тио) на 2 часа помещали в термостат при температуре 47°С на влажной фильтровальной бумаге. Для поддержания влажности в термостате находились две чашки Петри с водой. Спустя 2 часа выделяли митохондрии из эпикотилей проростков всех исследуемых групп.
Тетранитрозильный комплекс железа с тиосульфатом
Кристаллический водорастворимый донор оксида азота натрий μ2-дитиосульфато-тетранитозилдиферрат тетрагидрат (комплекс железа с тиосульфатом) [Na2[Fe2(S2O3)2(NO)4]2 · 4H2O (ТНКЖ-тио) синтезирован в ФГБУН Институте проблем химической физики РАН (Черноголовка) [9].
В медицине ТНКЖ-тио является перспективным препаратом для лечения кардиологических и онкологических заболеваний [10, 11].
Выделение митохондрий из эпикотилей этиолированных проростков гороха проводили методом дифференциального центрифугирования [12]. Эпикотили гороха измельчали блендером “Braun” (Германия), а затем гомогенизировали на льду в стеклянном гомогенизаторе в среде, содержащей: 0.4 М сахарозу, 5 мМ ЭДТА, 20 мМ КН2РО4 (рН 8.0), 10 мМ KCl, 2 мМ дитиотреитол и 0.1% бычий сывороточный альбумин (БСА), свободный от жирных кислот (ЖК). Гомогенат центрифугировали при 25 000 g в течение 5 мин при 4°С. Полученный осадок ресуспендировали в 8 мл среды и центрифугировали при 3000 g в течение 3 мин. Осаждение митохондрий проводили в течение 10 мин при 1000 g. Осадок ресуспендировали в 2–3 мл среды, содержащей: 0.4 М сахарозу, 20 мМ КН2РО4 (рН 7.4), 0.1% БСА (свободный от жирных кислот) и вновь осаждали митохондрии при 11 000 g в течение 10 мин. Все процедуры выделения проводили при 4°С.
Регистрацию потребления кислорода митохондриями проводили полярографическим методом, используя полярограф LP-7 и кислородный электрод типа Кларка. Стандартная среда инкубации митохондрий проростков гороха содержала: 0.4 М сахарозу, 20 мМ HEPES-Tris буфер (рН 7.2), 5 мМ КН2РО4, 4 мМ MgCl2, и 0.1% БСА при температуре среды 22°С. В качестве субстратов окисления использовали малат (10 мМ) + глутамат (10 мМ).
“Старение” митохондрий проростков гороха. Выделенные митохондрии (2−3 мг белка) помещали в 0.5 мл среды, содержащей: 0.1 М сахарозу, 10 мМ HEPES, 1 мМ КН2РО4, pH 7.4. Митохондрии инкубировали 20‒25 мин при температуре 22°С.
Уровень перекисного окисления липидов (ПОЛ) оценивали флуоресцентным методом [13]. Липиды экстрагировали смесью хлороформ:метанол = = 2 : 1 (по объему), из митохондрий, содержащих 3−5 мг белка. Соотношение митохондрий: смесь хлороформ:метанол = 1:10. Регистрацию флуоресценции конечных продуктов ПОЛ − оснований Шиффа, которые образуются между аминогруппами белков и продуктами ПОЛ альдегидами (малоновым диальдегидом и 4-гидрокси-2,3-ноненалями) проводили в десятимиллиметровых кварцевых кюветах на спектрофлуориметре FluoroMax-HoribaYvonGmbH (Германия). В контрольную кювету добавляли 3 мл хлороформа, а затем 0.3 мл метанола. Длина волны возбуждения флуоресценции 360 нм, испускания − 420–470 нм. Результаты выражали в условных единицах флуоресценции, пересчитанных на мг белка.
Морфологию митохондрий исследовали методом атомно-силовой микроскопии (АСМ). Образцы митохондрий, находящиеся в среде выделения, фиксировали 2% глутаровым альдегидом в течение 1 часа с последующим осаждением методом центрифугирования в бидистиллированной воде в течение 3 мин (9000 g). Митохондрии наносили на поверхность кремниевой подложки и подсушивали на воздухе. Исследование проводили на приборе SOLVER P47 SMENA на частоте 150 кгц в полу-контактном режиме с использованием кантилевера 5 NSG11 с радиусом кривизны 10 нм. Некоторые геометрические параметры имиджа митохондрий определяли, используя “Image Analysis”. Сечение производили на высоте 30 нм. Объем имиджа митохондрий исследуемых препаратов митохондрий соответствовал произведению площади сечения имиджа митохондрии на среднюю высоту данного имиджа в области сечения.
Метиловые эфиры жирных кислот (МЭЖК). МЭЖК были получены путем кислотного метанолиза липидов мембран митохондрий [14, 15]. Суспензию митохондрий (200 мкл) помещали в герметично закрывающуюся стеклянную пробирку, добавляли 5 мл метанола и помещали образец в морозильную камеру на 1 ч. После этого добавляли 600 мкл ацетилхлорида, и образец помещали в кипящую водяную баню, где он находился в течение 1 часа при постоянном перемешивании. МЭЖК экстрагировали гексаном, а полученные растворы анализировали.
Определение количественного состава МЭЖК. Количественное определение МЭЖК проводили с использованием хроматографа Kristall 2000M (Россия) с пламенно-ионизационным детектором и кварцевой капиллярной колонкой DB-1 (60 м × × 0.32 мм, слой 0.25 мкм, фирма “J&W Scientific”, США). Анализ МЭЖК проводили при программировании температуры от 120 до 270°C со скоростью 4°C/мин. Температура инжектора и детектора ‒ 270°С; скорость потока газа-носителя гелия составляла 2.0 мл/мин, деление потока на входе в колонку ‒ 1:40. Каждый образец содержал 2 мкл гексанового экстракта. Содержание МЭЖК в образцах рассчитывали, как отношение площади пика соответствующей кислоты к сумме площадей пиков всех найденных МЭЖК [16]. Стандартное отклонение средних значений площадей пиков, полученных в трех измерениях, не превышало 5% (относительное значение). Математическая обработка результатов проводилась с использованием Microsoft Excel и Sigma Plot 10.
Идентификацию МЭЖК проводили на основе масс-спектров, полученных после разделения МЭЖК в условиях, аналогичных газохроматографическому анализу с использованием прибора Hewlett Packard-6890 (США). Масс-спектры были получены в режиме электронного удара при напряжении ионизации 70 эВ и скорости сканирования 1°С на декаду масс в области 40–400 а.е.м.
Определение NO в эпикотилях 5-дневных этиолированных проростков проводили по методу, описанному [17]. В основе данного метода лежит превращение содержащегося в растениях NO в нитрит, который можно определять спектрофотометрически. Определение его концентрации осуществляли на основе реакции Грисса. NO в образце окислялся до NO2- после чего следовала реакция с реагентом Грисса, которая дает окраску образца. Навеску 60 г эпикотилей гомогенизировали на льду в 50 мМ ацетатном буфере (рН 3.6), содержащем 4% ацетата цинка. Гомогенат центрифугировали при 8000 g в течение 15 мин. Собирали надосадочную жидкость. Осадок промывали 1 мл ацетатного буфера содержащий 4% ацетат цинка и центрифугировали также при 8000 g в течение 15 мин. Два супернатанта объединяли. Затем к 10 мл супернатанта добавляли 150 мг активированного древесного угля. Смесь фильтровали через бумажный фильтр марки ФМ (синяя лента), после чего смешивали 2 мл фильтрата с 1 мл 1% реактива Грисса в 12% уксусной кислоте и выдерживали при комнатной температуре 30 мин. Оптическую плотность измеряли при λ = 540 нм. В качестве стандарта использовали растворы нитрита натрия.
Статистическую обработку экспериментальных данных проводили определением средних арифметических и их стандартных ошибок. Достоверность различий между вариантами со значимостью P ≤ 0.05. Обработка результатов проводилась с использованием пакетов программ Microsoft Excel и Sigma Plot 10.
В эксперименте использовали реактивы следующих фирм: метанол, хлороформ (Merck, Германия), сахароза, Трис (Sigma, США), БСА (свободный от жирных кислот), FCCP (карбонилцианид-п-трифторметоксифенилгидразон), малат, глутамат, 1-нафтиламин, сульфаниловая кислота (Sigma, США), HEPES (МР Biomedicals, Германия), дитиотреитол (AppliChem), карбонат калия (Merck, Германия), гексан (Panreac, Испания), ацетилхлорид (Acros, Бельгия), Hepes (4-(2-Гидроксиэтил) пиперазин-1-этансульфоновая кислота) (MP Biomedicals, Германия).
РЕЗУЛЬТАТЫ
Известно, что при действии стрессовых факторов, в частности, при тепловом стрессе, происходит смещение антиоксидантно-прооксидантного равновесия в сторону увеличения содержания активных форм кислорода (АФК) в клетке. При этом митохондрии являются одним из основных источников генерации АФК [18‒20]. Поэтому для исследования антистрессовых свойств натрий μ2-дитиосульфато-тетранитрозилдиферрат тетрагидрата необходимо было разработать модель, имитирующую стресс, т.е. найти условия, при которых бы увеличивалась продукция АФК митохондриями, а, следовательно, активировалось ПОЛ. Эту задачу решили, разработав модель “старения” (инкубация митохондрий в гипотонической среде при 22°С).
“Старение” митохондрий приводило к активации ПОЛ в мембранах митохондрий, которое регистрировали по флуоресценции конечных продуктов перекисного окисления липидов (оснований Шиффа). При этом интенсивность флуоресценции продуктов ПОЛ возрастала в 3.5 раза (рис. 1). Введение в среду инкубации ТНКЖ-тио приводило к снижению интенсивности флуоресценции продуктов ПОЛ, и это снижение зависело от концентрации препарата в среде инкубирования. При этом наиболее эффективными концентрациями оказались 10–6‒10–9 М. Отметим, что при концентрации 10–3 М в среде инкубации препарат проявлял прооксидантный эффект, что указывает на необходимость четко придерживаться концентраций, в которых ТНКЖ-тио проявляет антиоксидантный эффект для защиты от оксидативного стресса (рис. 1).
Рис. 1.
Влияние “старения”, железо-сера-нитрозильного комплекса с тиосульфатом (ТНКЖ-тио) на интенсивность флуоресценции продуктов ПОЛ в мембранах митохондрий 5-дневных проростков гороха. По оси ординат интенсивность флуоресценции в условных единицах/мг белка, по оси абсцисс ‒ концентрация ТНКЖ-тио. 1 ‒ “старение” + ТНКЖ-тио; 2 ‒ контрольная группа проростков, которая находилась на влажной фильтровальной бумаге при 24°С в течение 5 суток.

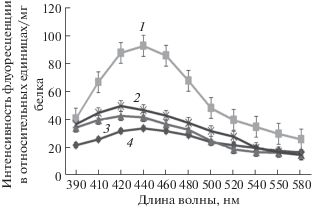
Способность препарата снижать интенсивность ПОЛ в мембранах митохондрий исследовали на модели теплового шока. В этом эксперименте ТНКЖ-тио использовали в концентрациях 10–6 и 10–9 М, так как в этих концентрациях препарат предотвращал активацию ПОЛ на модели “старения” митохондрий. В условиях теплового шока (47°С) в мембранах митохондрий происходила активация ПОЛ, что сопровождалось 2‑кратным увеличением флуоресценции конечных продуктов ПОЛ (оснований Шиффа). В результате замачивания семян в 10–6 и 10–9 М растворе ТНКЖ-тио происходило снижение интенсивности флуоресценции продуктов ПОЛ почти до контрольного уровня (рис. 2).
Рис. 2.
Спектры флуоресценции продуктов ПОЛ в мембранах митохондрий проростков гороха при тепловом шоке (ТШ) и обработке семян ТНКЖ-тио. По оси ординат _ интенсивность флуоресценции/мг белка, по оси абсцисс – длина волны в нм. 1 ‒ ТШ; 2 ‒ ТШ + 10–9 М ТНКЖ-тио; 3 ‒ ТШ + 10–6 М ТНКЖ-тио; 4 ‒ контрольная группа проростков. Данные 8 опытов (2 повтора в каждом опыте). Достоверность между 1 и 2, 3, 4 (Р ≤ 0.05), достоверность между 2 и 3, 4 (Р ≥ 0.05).
Можно было предположить, что в условиях теплового шока (47°С), происходит увеличение генерации активных форм кислорода, приводящее к активации ПОЛ с последующим набуханием митохондрий. Действительно, в следующей серии экспериментов выявлено, что гипертермия вызывала набухание митохондрий. Так, объем митохондрий группы проростков ТШ (V = 0.054 ± 0.003 мкм3) был в 2.35 раза больше объема митохондрий контрольной группы проростков (V = 0.023 ± 0.003 мкм3) (рис. 3, 4). Обработка семян гороха 10–6 М ТНКЖ-тио предотвращала набухание митохондрий. При этом 95% митохондрий имели объем даже несколько меньший, чем в контрольной группе проростков (V = 0.018 ± 0.003 мкм3).
Рис. 3.
Влияние теплового шока и ТНКЖ-тио на объем митохондрий. Ось абсцисс: группы растений. Ось ординат: объем митохондрий в мкм3. Условные обозначения: ТШ ‒ тепловой шок; ТШ+ТНКЖ-тио ‒ митохондрии проростков гороха, предварительно обработанных 10-6 М ТНКЖ-тио и подвергнутых тепловому шоку. Данные 8 опытов (20 повторов в каждом опыте).

Рис. 4.
В качестве примера приведено двухмерное изображение митохондрии (ось абсцисс (мкм), ось ординат (мкм), ось аппликата (нм)). АСМ ‒ имиджи митохондрий группы “ТШ + 10–6 М ТНКЖ-тио”.

Активация ПОЛ, вызывающая изменение физико-химических характеристик мембран митохондрий, приводила к изменению жирнокислотного состава мембран митохондрий. Так, содержание пальмитиновой кислоты увеличилось на 13%. Существенные изменения наблюдались и в содержании С18 ЖК. Содержание линоленовой кислоты в мембранах митохондрий снизилось на 21.5%, а линолевой – на 11%. При этом индекс ненасыщенности С18 ЖК сократился с 1.42 ± 0.01 до 1.22 ± 0.01. ∑ С18 ненасыщенных жирных кислот снизилась на 13%. Изменялось и содержание С20 ЖК: содержание 20:3ω6 снизилось почти на 43.6%, а пул 20:0 сократился в 1.3 раза (табл. 1).
Таблица 1.
Влияние теплового шока (ТШ) и ТНКЖ-тио на жирнокислотный состав мембран митохондрий 5‑дневных проростков гороха
| ЖК | Контроль | ТШ | ТС+ТНКЖ-тио |
|---|---|---|---|
| Относительные проценты | |||
| 12:0 | 0.36 ± 0.03 | 2.07 ± 0.28 | 0.37 ± 0.04 |
| 14:0 | 0.66 ± 0.13 | 2.08 ± 0.32 | 0.75 ± 0.11 |
| 16:1ω7 | 0.94 ± 0.18 | 2.15 ± 0.40 | 1.00 ± 0.10 |
| 16:0 | 18.0 ± 0.19 | 20.51 ± 0.24 | 18.28 ± 0.21 |
| 17:0 | 0.50 ± 0.04 | 0.98 ± 0.12 | 0.58 ± 0.05 |
| 18:2 ω6 | 50.0 ± 1.00 | 44.39 ± 1.20 | 47.26 ± 0.90 |
| 18:3 ω3 | 12.2 ± 0.14 | 9.79 ± 0.11 | 11.43 ± 0.08 |
| 18:1 ω9 | 4.78 ± 0.22 | 3.86 ± 0.03 | 5.92 ± 0.23 |
| 18:1 ω7 | 0.67 ± 0.12 | 0.31 ± 0.02 | 1.50 ± 0.08 |
| 18:0 | 4.16 ± 0.31 | 6.01 ± 022 | 4.10 ± 0.18 |
| 20:3 ω6 | 1.17 ± 0.05 | 0.66 ± 0.03 | 1.06 ± 0.05 |
| 20:2 ω6 | 0.82 ± 0.04 | 1.09 ± 0.03 | 0.69 ± 0.05 |
| 20:1 ω 9 | 2.29 ± 0.03 | 1.49 ± 0.10 | 2.50 ± 0.07 |
| 20:1 ω7 | 1.26 ± 0.01 | 1.11 ± 0.01 | 1.29 ± 0.03 |
| 20:0 | 1.36 ± 0.03 | 1.00 ± 0.01 | 1.38 ± 0.02 |
| 22:0 | 0.83 ± 0.12 | 2.50 ± 0.13 | 1.89 ± 0.14 |
| Индекс ненасыщенности С18 | 1.42 ± 0.01 | 1.22 ± 0.01 | 1.36 ± 0.01 |
| Индекс ненасыщенности С20 | 0.087 ± 0.002 | 0.067 ± 0.001 | 0.084 ± 0.001 |
Окисление ненасыщенных жирных кислот (18:2ω6 и 18:3ω3), вероятно, снижало функциональную активность митохондрий [21]. Действительно, максимальные скорости окисления НАД-зависимых субстратов (в присутствии FCCP) митохондриями проростков гороха снижалось с 70.0 ± 3.6 до 48.9 ± 3.2 нг. атом О2/мг белка (табл. 2). Обработка семян гороха ТНКЖ-тио восстанавливала эти скорости до 61.5 ± 2.4 нг. атом О2/мг белка. Однако эти показатели были несколько ниже, чем в контроле, вероятно, из-за конкурентных отношений между О2 и NO за сайты связывания с цитохромоксидазой [22].
Таблица 2.
Влияние теплового шока (ТШ) и ТНКЖ-тио на кинетику потребления кислорода митохондриями
| Группа | V2 | V3 | V4 | VFCCP | ДК |
|---|---|---|---|---|---|
| Контроль | 15.1 ± 2.8 | 62.4 ± 3.0 | 23.6 ± 2.0 | 70.0 ±3.6 | 2.50 ± 0.01 |
| ТШ | 11.2 ± 2.0 | 39.1 ± 5.0 | 26.3 ± 2.0 | 48.90 ± 3.2 | 1.49 ± 0.01 |
| ТШ + ТНКЖ-тио | 13.3 ± 2.24 | 44.0 ± 3.08 | 20.00 ± 1.50 | 61.50 ± 2.40 | 2.20 ± 0.03 |
Примечание: Среда инкубации: 0.4 М сахароза, 20 мМ HEPES-Tris буфер (pH 7.2), 5 мМ KH2PO4, 4 мМ MgCl2, 0.1% BSA. Дополнительные добавки: 10 мМ малат, 10 мМ глутамат, 125 мкМ АДФ, 0.5 мМ FCCP (карбонилцианид-п-трифторметоксифенилгидразон). V2 ‒ скорости окисления субстратов; V3 ‒ скорости окисления субстратов в присутствии АДФ; V4 ‒ скорости окисления в состоянии покоя (скорости окисления субстрата при исчерпании АДФ). Работа проведена на 5-дневных этиолированных проростках гороха (нг. атом О2/мин × мг белка) (данные 10 опытов).
Возможно, протекторные свойства препарата обусловлены тем, что ТНКЖ-тио является донором оксида азота. Действительно, в нашем эксперименте обработка семян гороха 10–6 М раствором ТНКЖ-тио увеличивала содержание NO в тканях проростков. При этом содержание NO в тканях эпикотилей 5-дневных проростков гороха, семена которых обрабатывали ТНКЖ-тио, было в 1.5 раза выше (57 нмоль/г. сырого веса), чем у не обработанных проростков (38 нмоль/г. сырого веса).
ОБСУЖДЕНИЕ
Реализация антистрессовых программ требует больших энергетических трат [23]. Поэтому энергетический обмен играет важную роль в адаптивных реакциях организма. Показано, что при температурном стрессе митохондрии являются основным источником генерации активных форм кислорода [18, 20], участвующих в передаче внутриклеточных сигналов, регуляции экспрессии стрессовых генов и активации защитных систем клетки [24]. Однако при длительном действии стрессового фактора или при сильном стрессе (высокотемпературный стресс) митохондрии становятся источниками избыточной генерации АФК, что может привести к окислительному стрессу, определяющему нарушения физиологических функций растительных организмов (снижения ростовых процессов, урожайности и т.д.). Можно предположить, что препараты, снижающие чрезмерную генерацию АФК митохондриями при действии высоких температур, могут повышать устойчивость растений к этому стрессовому фактору. Таким препаратом, по-видимому, является ТНКЖ-тио. Его антистрессовая активность, вероятно, определяется антирадикальными и антиоксидантными свойствами [25]. Препарат предотвращал окисление ненасыщенных жирных кислот с 18 атомами углерода, главным образом, линолевой и линоленовой кислот, основных жирных кислот, входящих в состав кардиолипина, обеспечивающего эффективное функционирование дыхательной цепи митохондрий [26]. Снижение суммарного процентного содержания полиненасыщенных жирных кислот (ПНЖК), в частности, в содержании С16 и С18 ЖК при повышенных температурах, наблюдали у мхов и у Arabidopsis thaliana [27]. Результатом сохранения пула ненасыщенных жирных кислот с 18 атомами углерода на исходном (контрольном) уровне, явилось предупреждение, вызванного тепловым шоком, снижения скоростей транспорта электронов в дыхательной цепи митохондрий. Благодаря сохранению функциональной активности митохондрий, вероятно, поддерживались энергетические процессы в клетке, что, возможно, повышало устойчивость проростков гороха к тепловому стрессу.
Большое значение в сохранении функциональной активности митохондрий в условиях теплового шока, вероятно, имело и сохранение пула ненасыщенных ЖК, содержащих 20 атомов углерода. Роль этих ЖК в устойчивости растений к стрессу еще мало изучена, но в некоторых случаях показано их участие в реакции растений на неблагоприятные воздействия. Так было обнаружено, что увеличение пула C20 ЖК имело значение при адаптации растений к осмотическому стрессу, вызванному засолением [28]. Биологическая активность натрий μ2-дитиосульфато-тетранитозилдиферрат тетрагидрата (ТНКЖ-тио), очевидно, обусловлена тем, что он является донором монооксида азота. Действительно, при взаимодействии ТНКЖ-тио с протонными растворителями выделяется NO [9]. Экспериментальное сравнение действия ТНКЖ-тио с эффективностью растворенного в воде NO в аналогичных условиях показало, что антиоксидантная активность комплекса определяется действием NO, высвобождающегося при гидролизе ТНКЖ-тио [25]. Способность NO сохранять функциональную активность митохондрий растений в условиях абиотического стресса, в частности при тепловом шоке, может быть обусловлена его способностью связывать свободные ионы железа в составе нитрозильных комплексов, что, по-видимому, приводит к ингибированию реакций свободно-радикального окисления, катализируемых редокс-активными ионами железа [8]. Кроме того, NO может взаимодействовать с алкилпероксильными и алкоксильными радикалами [29], а также влиять на активность антиоксидантных ферментов [5, 30]. Более того NO может влиять на накопление цитрата, регулируя экспрессию гена Aco и белка-фермента аконитазы и тем самым снижать генерацию АФК митохондриями [30]. Таким образом, NO проявляет антиоксидантные свойства, хотя возможен и синергизм в действии NO и H2O2 [6].
ТНКЖ-тио способствует сохранению функциональной активности митохондрий, обеспечивающих необходимой энергией метаболические процессы, что особенно важно для прорастающих семян, нуждающихся в энергетических ресурсах. Преимуществом ТНКЖ-тио перед другими донорами оксида азота является то, что этот комплекс относительно стабилен при хранении на свету при отсутствии влаги. Его синтез достаточно прост [9]. Кроме того, при разложении этих комплексов не образуется токсических и канцерогенных веществ [9, 10]. Результаты наших экспериментов свидетельствуют о необходимости продолжения исследований и о возможности использования нитрозильных комплексов железа для защиты растений от абиотических стрессов.
Авторы выражают глубокую благодарность сотруднику Федерального государственного бюджетного учреждения науки Института проблем химической физики Российской академии наук (Черноголовка) Саниной Н. А., за предоставление для исследований образцов натрия μ2-дитиосульфато – тетранитрозилдиферрат тетрагидрата.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (тема № 1201253310).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Список литературы
Мамаева А.А., Фоменков А.А., Носов А.В., Мошков И.Е., Мур Л.А.Ж., Холл М.А., Новикова Г.В. Регуляторная роль оксида азота в растениях // Физиология растений. 2015. Т. 62. С. 459 https://doi.org/10.1134/S1021443715040135
Nabi R.B.S., Tayade R., Hussain A., Kulkarni K.P., Imran Q.M., Bong-Gyu Mun. Nitric oxide regulates plant responses to drought, salinity, and heavy metal stress // Environ. Exp. Bot. 2019. V. 161. P. 120. https://doi.org/10.1016/j.envexpbot.2019.02.003
Marvasi M. Use and perspectives of nitric oxide donors in agriculture // J. Sci. Food Agric. 2017. V. 97 (4). P. 1065. http://doi:eprints.mdx.ac.uk/23147
Ahmad P., Ahanger M.A., Alyemeni M.N., Wijaya L., Alam P. Exogenous application of nitric oxide modulates osmolyte metabolism, antioxidants, enzymes of ascorbate-glutathione cycle and promotes growth under cadmium stress in tomato // Protoplasma. 2018. V. 255. P. 79. https://doi.org/10.1007/s00709-017-1132-x
Nahar K., Hasanuzzaman M., Ahamed K.U., Hakeem K.R., Ozturk M., Fujita M. Plant responses and tolerance to high temperature stress: role of exogenous phytoprotectants // Crop production and global environmental issues / Ed. Hakeem K.R. Switzerland: Springer International Publishing. 2015. P. 51. http://doi: https://doi.org/10.1007/978-3-319-23162-4_17
Hasanuzzaman M.K., Nahar K., Alam Md.M., Masayuki Fujita. Exogenous nitric oxide alleviates high temperature induced oxidative stress in wheat (Triticum aestivum L.) seedlings by modulating the antioxidant defense and glyoxalase // Australian J. Crop Science. 2012. V. 6 (8). P. 1314. http://doi: https://doi.org/10.1007/s10646-013-1050-4
Hasanuzzaman M., Nahar K., Alam M.M., Roychowdhury R., Fujita M. Physiological, biochemical, and molecular mechanisms of heat stress tolerance in plants // Int. J. Mol. Sci. 2013. V. 14. P. 9643. https://doi.org/10.3390/ijms14059643
Ванин А.Ф. Динитрозильные комплексы железа с тиол-содержащими лигандами: физико-химия, биология, медицина. Москва-Ижевск: Институт компьютерных исследований. 2015. 220 с.
Санина Н.А., Алдошин С.М. Строение и свойства нитрозильных комплексов железа с функциональными серосодержащими лигандами // Изв. РАН. Сер. Хим. 2011. Т. 7. С. 1199.
Санина Н.А., Руднева Т.Н., Сулименков И.В., Коновалова Н.П., Сашенкова Т.Е., Алдошин С.М. Противоопухолевая активность нитрозильных комплексов железа ‒ новых доноров монооксида азота // Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И. Менделеева). 2009. Т. 53 (1). С. 1.
Lakomkin V.L., Vanin A.F., Timoshin A.A., Kapelko V.I., Chazov E.I. Long-lasting hypotensive action of stable preparations of dinitrosyl-iron complexes with thiol-containing ligands in conscious normotensive and hypertensive rats // Nitric Oxide. 2007. V. 16 (4). P. 413. https://doi.org/10.1016/j.niox.2007.03.002
Попов В.Н., Руге Э.К., Старков А.А. Влияние ингибиторов электронного транспорта на образование активных форм кислорода при окислении сукцината митохондриями гороха // Биохимия. 2003. Т. 68 (7). С. 910. https://doi.org/10.1023/a:1025078815819
Fletcher B.I., Dillard C.D., Tappel A.L. Measurement of fluorescent lipid peroxidation products in biological systems and tissues // Anal. Biochem. 1973. V. 52. P. 1. https://doi.org/10.1016/0003-2697(73)90327-8
Wang J., Sunwoo H., Cherian G., Sim I.S. Fatty acid determination in chicken egg yolk. A comparison of different methods // Poult. Sci. J. 2000. V. 79. P. 71168. https://doi.org/10.1093/ps/79.8.1168
Carreau J.P., Dubacq J.P. Adaptation of macroscale method to the microscale for fatty acid methyl transesterification of biological lipid extracts // J. Chromatogr. Sci. 1979. V. 151. P. 384. https://doi.org/10.1016/S0021-9673(00)88356-9
Golovina R.V., Kuzmenko T.E. Thermodynamic evaluation interaction of fatty acid methyl esters with polar and nonpolar stationary phases, based on their retention indices // J. Chromatogr. Sci. 1977. V. 10 (9). P. 545. https://doi.org/10.1007/BF02262915
Zhou B., Guo Z., Xing J., Huang B. Nitric oxide is involved in abscisic acid-induced antioxidant activities in Stylosanthes guianensis // J. Exp. Bot. 2008. V. 56. P. 3223. https://doi.org/10.1093/jxb/eri319
Федяева А.В., Степанов А.В., Любушкина И.В., Побежимова Т.П., Рихванов Е.Г. Тепловой шок индуцирует продукцию активных форм кислорода и повышает потенциал на внутренней митохондриальной мембране в клетках озимой пшеницы // Биохимия. 2014. Т. 79. С. 1476. https://doi: 10.1134 / S0006297914110078
Зоров Д.Б., Исаев Н.К., Плотников Е.Ю., Зорова Л.Д., Стельмашук Е.В., Васильева А.К., Архангельская A.A., Хряпенкова Т.Г. Митохондрия как многоликий Янус // Биохимия. 2007. Т. 72 (10). С. 1371. https://doi.org/10.1134/S0006297907100094
Hasanuzzaman M., Bhuyan M.H.M.B., Zulfiqar F., Raza A., Mohsin S. M., Mahmud J.A., Fujita M., Fotopoulos V. Reactive oxygen species and antioxidant defense in plants under abiotic tress: Revisiting the crucial role of a universal defense regulator // Antioxidants. 2020. V. 9. P. 681. http://doi:https://doi.org/10.3390/antiox9080681
Zhigacheva I., Burlakova E., Misharina T., Terenina M., Krikunova N., Generozova I., Shugaev A., Fattakhov S. Fatty acid composition and activity of the mitochondrial respiratory chain complex I of pea seedlings under water deficit // Biologia. 2014. V. 59 (3). P. 241. https://doi.org/10.6001/biologija.v59i3.2786
Gupta K.J., Kumari A., Florez-Saras I., Fernie A.R., Igamberdiev A.U. Interaction of nitric oxide with the components of the plant mitochondrial electron transport chain // J. Exp. Bot. 2018. V. 69 (14). P. 3413. https://doi.org/10.1093/jxb/ery119
Шакирова Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Изд-во “Гилем”. 2001. 160 с.
Креславский В.Д., Лось Д.А., Аллахвердиев С.И., Кузнецов Вл.В. Сигнальная роль активных форм кислорода при стрессе у растений // Физиология растений. 2012. Т. 59. С. 163. https://doi.org/10.1134/S1021443712020057
Файнгольд И.И., Котельникова Р.А., Смолина А.В., Полетаева Д.А., Солдатова Ю.В., Покидова О.В., Садков А.П., Санина Н.А., Алдошин С.М. Антиоксидантная активность тетранитрозильного комплекса железа с тиосульфатными лигандами и его влияние на каталитическую активность митохондриальных ферментов в опытах in vitro // ДАН. 2019. Т. 488 (5). С. 571. https://doi.org/10.1134/S1607672919050120
Paradies G., Petrosillo G., Pistolese M., Venosa N., Federici A., Ruggiero F.M. Decrease in mitochondrial complex I activity in ischemic / Perfused rat heart. Involvement of reactive oxygen species and cardiolipin // Circ. Res. 2004. V. 94. P. 53. https://doi.org/10.1161/01.RES.0000109416.56608.64
Falcone D.L., Ogas J.P., Somerville Ch.R. Regulation of membrane fatty acid composition by temperature in mutants of Arabidopsis with alterations in membrane lipid composition // BMC Plant Biol. 2004. V. 4. P. 17. https://doi.org/10.1186/1471-2229-4-17
Цыдендамбаев В.Д., Иванова Т.В., Халилова Л.А., Куркова Е.Б., Мясоедов Н.А., Балнокин Ю.В. Жирнокислотный состав липидов вегетативных органов галофита Suaeda Altissima при разном уровне засоления // Физиология растений. 2013. Т. 60. С. 700. https://doi.org/10.1134/S1021443713050142
Parankusam S., Adimulam S. S., Bhatnagar-Mathur P., Sharma K. K. Nitric oxide (NO) in plant heat stress tolerance: current knowledge and perspectives // Front. Plant Sci. 2017. V. 8. P. 1582. https://doi.org/10.3389/fpls.2017.01582
Ludan Hou, Mengran Zhao, Chenyang Huang, Xiangli Wu, Jinxia Zhang. Nitric oxide improves the tolerance of Pleurotus ostreatus to heat stress by inhibiting mitochondrial aconitase. Appl. Environ. Microbiol. 2020. V. 86. e02303-19. https://doi.org/10.1128/AEM.02303-19
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений



