Физиология растений, 2022, T. 69, № 2, стр. 216-224
Влияние света на изменение морфофизиологических характеристик кокколитофориды Emiliania huxleyi
Н. Ю. Шоман a, *, Е. С. Соломонова a, А. И. Акимов a
a Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр
“Институт биологии южных морей им. А.О. Ковалевского Российской академии наук”
Севастополь, Россия
* E-mail: n-zaichencko@yandex.ru
Поступила в редакцию 23.07.2021
После доработки 08.10.2021
Принята к публикации 19.10.2021
- EDN: VBEJKE
- DOI: 10.31857/S0015330322020178
Аннотация
Исследовано влияние интенсивности света (в диапазоне от 20 до 850 мкЭ/(м2 с)) на изменение основных структурно-функциональных, цитометрических и флуоресцентных показателей кокколитофориды Emiliania huxleyi (Lohmann) Hay & Mohler 1967. Результаты микроскопического и цитометрического анализов показали, что E. huxleyi была представлена двумя клеточными формами, покрытыми слоем кальциевых образований – кокколит и клетками без кокколит, соотношение между которыми изменялось в зависимости от световых условий роста водорослей: повышение интенсивности света от 20 до 850 мкЭ/(м2 с) приводило к закономерному снижению количества покрытых кокколитами клеток от 90 до 35%. Предложена гипотеза, что уменьшение доли покрытых клеток в популяции с увеличением освещенности может рассматриваться как возможная причина раннего фотоингибирования роста E. huxleyi (от 400 мкЭ/(м2 с)). Применение метода проточной цитометрии позволило выявить ряд существенных различий в флуоресцентных, размерных и структурных показателях клеток E. huxleyi, соответствующих двум ее формам: покрытым и непокрытым кокколитами. Установлено, что по объему непокрытые клетки в 2.5–3.5 раза мельче покрытых и отличаются низкими светорассеивающими свойствами – показатель прямого светорассеяния (FS) в 2 раза, а бокового светорассеяния (SS) в 25 раз ниже, чем у клеток, покрытых кокколитами, что позволяет идентифицировать исследуемые группы клеток E.huxleyi на цитограммах проточного цитометра, используя автофлуоресценцию хлорофилла в красной области спектра (канал FL4) и канал SS. Отмеченное свечение в зеленой области спектра (канал FL1), закономерно увеличивающееся с ростом освещенности, также является отличительной чертой клеток, покрытых кокколитами, у непокрытых клеток зеленая автофлуоресценция отсутствует. Полученные в работе результаты позволяют значительно улучшить понимание физиологии E. huxleyi, как вида, вызывающего массовые цветения в Черном море, и значительно влияющего на круговорот биогенных и минеральных веществ в морской среде.
ВВЕДЕНИЕ
Кокколитофориды Emiliania huxleyi представляют собой планктонные одноклеточные водоросли с клетками сферической формы диаметром 5–8 мкм. Клетки E. huxleyi окружены слоем из 10−15 ажурных известковых (CaCO3) дисков – кокколит размером 1–2 мкм, в отдельных случаях на поверхности клетки может образовываться 2–3 слоя кокколит. Наличие кальциевых образований – кокколит обуславливает ряд индивидуальных физиологических особенностей E. huxleyi, в частности приводит к увеличению коэффициента светорассеяния клетками и снижению удельного коэффициента поглощения света пигментами [1, 2]. При благоприятных условиях роста E. huxleyi начинает “цвести”, образуя колонии численностью более 1 млн клеток/л. После окончания “цветений” кокколиты частично оседают на дно и являются основным компонентом известковых илов, которые покрывают до 35% дна океана. Таким образом, эти водоросли играют важную роль в транспорте неорганического углерода из атмосферы в донные осадки, что приобретает особую значимость в связи с проблемой углекислотного загрязнения атмосферы [1].
В Черном море регулярное “цветение” E. huxleyi наблюдается как в летний период при экстремально высоком уровне облученности в течение годового цикла [2], так и в зимние месяцы в условиях низкой освещенности [3, 4]. Крупномасштабные области цветения кокколитофорид могут быть выявлены с помощью спутниковых сенсоров по яркости восходящего излучения благодаря эффекту интенсивного обратного рассеяния света кокколитами в приповерхностном слое воды. На основе спутниковых данных могут быть определены примерные даты начала цветения и его пика, установлены продолжительность цветения и его пространственные характеристики [4, 5].
Эколого-физиологические характеристики Emiliania huxleyi интенсивно изучаются в контексте биогеохимии (особенно в связи с глобальным углеродным циклом), экологии планктона, биоминерализации, особое внимание уделяется вопросу образования кокколит и оценке взаимодействия “кальцификация – фотосинтез” [1, 5, 6]. При этом большинство работ посвящено исследованию “классической” формы клетки E. huxleyi, покрытой слоем кальциевых образований – кокколит (далее в тексте – покрытые клетки). Однако еще в 70-е годы было показано, что помимо такой формы E. huxleyi может быть представлена некальцифицированными клетками без кокколит (далее в тексте – непокрытые клетки), а также гаплоидными клетками с двумя длинными жгутиками и чешуйками на поверхности [6, 7]. Считается, что клетки, не покрытые слоем кокколит, проявляют те же морфологические особенности, что и покрытые клетки, но они не способны к кальцификации – синтезу кокколит. Образование таких клеток не является частью обычного жизненного цикла E. huxleyi, а является своего рода мутацией в ответ на неблагоприятное действие внешнего фактора [1]. Причины появления непокрытых клеток в популяции до настоящего времени не ясны. На примере лабораторной культуры E. huxleyi показано, что появление непокрытых клеток может быть обусловлено “старением” культуры и дефицитом минерального питания в среде [1]. При этом отмечается, что непокрытые клетки более устойчивы к неблагоприятному воздействию внешних факторов [1, 2, 6]. Важным и малоизученным остается вопрос, как изменяются эколого-физиологические характеристики клеток при переходе из покрытой в непокрытую форму, и как изменение соотношения между покрытыми и непокрытыми клетками в популяции приведет к изменению ее структурно-функциональных характеристик. Изучение данных вопросов при культивировании E. huxleyi при разной освещенности и послужило целью представленной работы.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования была использована альгологически чистая культура морской кокколитофориды Emiliania huxleyi (Lohmann) Hay & Mohler 1967 из коллекции культур микроводорослей и цианобактерий (IBSS) научно-образовательного центра коллективного пользования “Гидробионты мирового океана” (WDCM № 1201) Федерального исследовательского центра “Института биологии южных морей имени А.О. Ковалевского РАН”.
Условия проведения экспериментов. Водоросли в экспериментах культивировали на питательной среде F/2 [8] при интенсивности света 20, 85, 238, 340, 442, 680 и 850 мкЭ/(м2 с) (в двух повторностях для каждой освещенности) и температуре 20°С в течение 7 суток. Свето-темновой режим освещения в эксперименте поддерживался в цикле 14/10 ч. Освещение колб (объем 200 мл) осуществлялось светодиодами белого света, различные уровни которого достигались изменением расстояния до источника света и применением нейтральных фильтров. Уровень освещенности определяли внутри колб зондирующим 4П датчиком квантометра QSL 2101 (BiosphericalInstrumentsInc., США), ошибка измерения интенсивности света составляла ±1 мкЭ/(м2 с). Величина рН культуральной среды находилась в пределах 8.2–8.4.
На протяжении всего эксперимента концентрация клеток культуры поддерживалась примерно на одном уровне в экспоненциальной фазе роста путем периодического (1 раз в сутки или реже для слаборастущих культур) разбавления свежей питательной средой. Адаптацию водорослей к каждой исследуемой освещенности проводили в течение трех суток (1–3 сутки эксперимента). За указанный временной интервал водоросли осуществляли как минимум два клеточных деления, после чего считались адаптированными к новым условиям освещения. Измерение численности клеток, концентрации хлорофилла в пробах, относительной переменной флуоресценции хлорофилла а Fv/Fm, а также цитометрических показателей (прямое (FS) и боковое светорассеяние (SS), зеленая и красная автофлуоресценция клеток) проводили на 4 сутки эксперимента.
Для оценки адаптационных возможностей Emiliania huxleyi после окончания основного комплекса экспериментов исследовали динамику изменения структурно-функциональных характеристик водорослей при переносе с высокой интенсивности света 680 мкЭ/(м2 с) в оптимальные для роста световые условия 85 мкЭ/(м2 с). Продолжительность эксперимента составляла трое суток.
Методы измерений. Цитометрический анализ проб проводили на проточном цитометре CytomicsTMFC 500 (BeckmanCoulter, США), оборудованном 488 нм однофазным аргоновым лазером, для обработки данных использовано программное обеспечение CXP. Общую численность микроводорослей в культурах определяли в кластере на 2-х параметрических цитограммах по прямому светорассеянию (FS) и флуоресценции отдельных клеток в красной спектральной области (FL4, 675 нм) на безразмерных логарифмических шкалах. Концентрацию клеток рассчитывали по скорости протока пробы (60 мкл/мин), времени счета (33−100 с) и количеству клеток, зарегистрированных в этот промежуток времени. Контроль качества измерений численности производили с помощью калибровочных флуоросфер (Flow-CheckTM, Beckman Coulter) с известной концентрацией в пробе.
Скорость роста микроводорослей рассчитывали по формуле [9]:
где:µ – скорость роста водорослей, делений в сут.;
N0 и Nt – исходная концентрация клеток и их количество через время t, клеток л–1;
t – время между измерениями, сут.
Относительный размер клеток микроводорослей определяли на проточном цитометре в кластерах по прямому (FS) и боковому светорассеянию (SS) на линейных шкалах [10]. Идентификацию клеток с кокколитами и без них проводили на 2-х параметрических цитограммах по автофлуоресценции в красной области спектра (FL4, 675 нм) и боковому рассеянию (SS), характеризующему гранулярность клеток. Измерение бокового светорассеяния (SS) позволило достоверно разделить клетки E. huxleyi, покрытые и непокрытые кокколитами, на две отдельные группы. Расчет объема клеток проводили по калибровочным зависимостям, представленным в [11].
Зеленую автофлуоресценцию покрытых и непокрытых клеток E. huxleyi определяли на проточном цитометре по флуоресценции отдельных клеток в зеленой спектральной области (FL1, 525 нм) на безразмерных логарифмических шкалах.
Содержание хлорофиллов а и с в пробах определяли спектрофотометрически на СФ-2000. Расчет концентрации пигментов проводили по формулам [12]:
(2)
${\text{Хл }}а = {\text{(11}}{\text{.43O}}{{{\text{D}}}_{{{\text{663}}}}} - {\text{0}}{\text{.64O}}{{{\text{D}}}_{{{\text{630}}}}}{\text{)}}\frac{{{{V}_{{{\text{экс}}}}}}}{{{{V}_{{{\text{пр}}}}}{{L}_{k}}}},$(3)
${\text{Хл c2}} = {\text{(27}}{\text{.09O}}{{{\text{D}}}_{{{\text{630}}}}} - {\text{3}}{\text{.63O}}{{{\text{D}}}_{{{\text{663}}}}}{\text{)}}\frac{{{{V}_{{{\text{экс}}}}}}}{{{{V}_{{{\text{пр}}}}}{{L}_{k}}}},$Определение концентрации хлорофилла дискретно в покрытых и непокрытых кокколитами клетках проводили по их флуоресценции в красной спектральной области (FL4, 675 нм), измеренной на проточном цитофлуориметре. Предварительно для E. huxleyi была проведена калибровка значений FL4 и суммарного содержания хлорофилла (Хл) в суспензии, измеренного спектрофотометрически: Хл = 0.0004FL4 + 0.04, R 2 = 0.97.
Измерение относительной переменной флуоресценции хлорофилла а Fv/Fm (максимальная квантовая эффективность ФС II) проводили на флуориметре с импульсной модуляцией возбуждающего света на длине волны ~455 нм “Мега-25м”. Расчет проводили по формуле [13]:
(4)
${{{{F}_{{\text{v}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{v}}}}} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}} = \frac{{{{F}_{{\text{m}}}} - {{F}_{0}}}}{{{{F}_{{\text{m}}}}}},$Fv/Fm – относительная переменная флуоресценция хлорофилла а;
F0 – величина флуоресценции хлорофилла при открытых реакционных центрах;
Fm – максимальная флуоресценция при закрытых реакционных центрах.
Статистическая обработка данных выполнялась по стандартным программным пакетам “Microsoft Exel 7.0”, “Statistica-5”, “Grapher-9” для персонального компьютера. Точки, указанные на графиках, представляют собой среднее четырех измерений – две серии биологических повторностей проведенных экспериментов по две повторности определения исследуемых параметров в каждой. Барами на графиках обозначены среднеквадратичные отклонения описываемых величин.
РЕЗУЛЬТАТЫ
По результатам проведенного экспериментального исследования установлены закономерности изменения скорости роста кокколитофориды E. huxleyi в зависимости от условий освещения (рис. 1). Показано, что оптимальная для роста водорослей освещенность варьирует от 85 до 440 мкЭ/(м2 с). В пределах указанного диапазона водоросли поддерживают максимальную скорость роста порядка 0.8–1 дел./сут. При интенсивности света 20 мкЭ/(м2 с) E. huxleyi растет с низкой скоростью 0.3 дел./сут., что обусловлено световым лимитированием роста водорослей при данных условиях. При освещенности выше 440 мкЭ/(м2 с) наблюдается прогрессирующее снижение скорости роста клеток вплоть до полной остановки роста при освещенности 680 мкЭ/(м2 с). На низкую функциональную активность водорослей при высокой освещенности указывают также значения коэффициента квантовой эффективности работы реакционных центров ФС II (Fv/Fm). Так, в оптимальных условиях роста значения коэффициента Fv/Fm составляют 0.6–0.7, в то время как повышение освещенности до 440 и 680 мкЭ/(м2 с) приводит к снижению описываемого параметра до 0.4 и 0.2 соответственно. Внутриклеточная концентрация хлорофилла (а + с) у E. huxleyi линейно снижается от 0.3 пг/кл. при интенсивности света 20 мкЭ/(м2 с) до 0.08 пг/кл. при 680 мкЭ/(м2 с). Отметим, что соотношение между хлорофиллами а и с в клетках E. huxleyi не зависело от освещенности и оставалось относительно постоянным на протяжении всего эксперимента – содержание хлорофилла с составляло порядка 22–25% содержания хлорофилла а.
Рис. 1.
Изменение скорости роста (⚪), внутриклеточной концентрации хлорофилла а + с (⚫) и коэффициента переменной флуоресценции хлорофилла – Fv/Fm (◇) у Emiliania huxleyi в зависимости от интенсивности света, при которой выращивались водоросли.

Используя технические возможности проточного цитометра, удалось достоверно разделить клетки E. huxleyi, покрытые и не покрытые кокколитами (рис. 2а), проанализировать их структурно-функциональные и флуоресцентные показатели, а также рассчитать соотношение между данными группами клеток в зависимости от условий освещения. Результаты показали, что соотношение покрытых и непокрытых клеток в популяции сильно различается в зависимости от световых условий роста водорослей: при повышении интенсивности света наблюдается выраженная тенденция к снижению процента покрытых клеток в культуре (рис. 2б). Так, в световом диапазоне от 20 до 100 мкЭ/(м2 с) количество покрытых клеток составляло порядка 80–90%, при повышении облученности до 440 мкЭ/(м2 с) их процент снижался до значений 50–55%, а при экстремально высокой освещенности 850 мкЭ/(м2 с) – до 35%. Можно предположить, что фотоингибирование скорости роста E. huxleyi, наблюдаемое при интенсивности света свыше 400 мкЭ/(м2 с), связано со значительным увеличением числа непокрытых клеток в культуре, которые ввиду отсутствия кокколит на поверхности в большей степени подвержены воздействию высокой освещенности. Однако остановка роста E. huxleyi и значительное увеличение числа непокрытых кокколитами клеток в культуре при высокой интенсивности света (680–850 мкЭ/(м2 с)) не указывает на летальное действие света на рост водорослей. При переносе культуры с высокой освещенности 680 мкЭ/(м2 с) в оптимальные световые условия 85 мкЭ/(м2 с) в течение 2 суток скорость роста водорослей восстанавливается в полном объеме, внутриклеточная концентрация хлорофилла (а+с) изменяется соответственно новым световым условиям роста, а показатель относительной переменной флуоресценции хлорофилла Fv/Fm достигает значений 0.6–0.7 (рис. 3).
Рис. 2.
Визуализация метода разделения популяции Emiliania huxleyi на две клеточные формы – покрытые слоем кальциевых образований – кокколит (область А) и клетки без кокколит (область Б) по измерению бокового светорассеяния клеток (SS) и автофлуоресценции хлорофилла в красной области спектра (FL4) (а); изменение процента клеток Emiliania huxleyi, покрытых кокколитами в зависимости от интенсивности света, при которой выращивались водоросли (б).
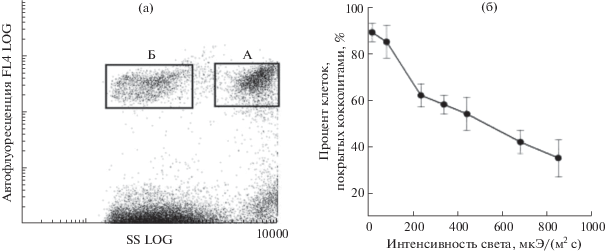
Рис. 3.
Динамика скорости роста (⚪), внутриклеточной концентрации хлорофилла а + с (⚫) и относительной переменной флуоресценции хлорофилла – Fv/Fm (◇) у Emiliania huxleyi при изменении световых условий выращивания. Вертикальной пунктирной линией отмечен момент изменения освещенности в эксперименте с 680 на 85 мкЭ/(м2 с).

В таблице 1 отражены основные цитометрические и структурные показатели покрытых и непокрытых клеток E. huxleyi в различных световых условиях роста водорослей. Из представленных данных видно, что исследуемые группы клеток E. huxleyi значительно различаются по величине прямого (FS) и бокового (гранулярность клетки) (SS) светорассеяния. Так, значения FS у покрытых клеток двукратно превышают таковые у непокрытых клеток, в то время как показатель SS у клеток, покрытых кокколитами, имеет значения в 25 раз выше, чем у клеток без кокколит при всех уровнях облученности. Полученные различия, очевидно, обусловлены светорассеивающими свойствами кокколит. Пересчет из относительных единиц (FS) в абсолютные (объем клеток, мкм3) показал, что объем клеток, покрытых кокколитами примерно в 2.5–3.5 раза превышает значение описываемого параметра у клеток без кокколит.
Таблица 1.
Цитометрические и структурные характеристики клеток Emiliania huxleyi, покрытых (“П”) и непокрытых (“Н”) кокколитами, в различных световых условиях роста водорослей
| I, мкЭ/(м2 с) |
FL4 | Хл. (а + с), пг/кл. | FL1 | SS | FS | V, мкм3 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| “П” | “Н” | “П” | “Н” | “П” | “Н” | “П” | “Н” | “П” | “Н” | “П” | “Н” | |
| 20 | 790 ± 11 | 780 ± 5 | 0.31 | 0.32 | 23 ± 2 | – | 3208 | 221 | 519 ± 7 | 320 ± 8 | 67 | 25 |
| 85 | 518 ± 9 | 420 ± 14 | 0.20 | 0.16 | 34 ± 5 | – | 4418 | 174 | 613 ± 10 | 358 ± 5 | 95 | 31 |
| 238 | 481 ± 21 | 400 ± 7 | 0.19 | 0.16 | 45 ± 4 | – | 4881 | 162 | 629 ± 16 | 377 ± 8 | 96 | 34 |
| 340 | 445 ± 13 | 382 ± 10 | 0.17 | 0.15 | 52 ± 7 | – | 4886 | 176 | 657 ± 5 | 380 ± 10 | 102 | 35 |
| 442 | 410 ± 13 | 337 ± 12 | 0.16 | 0.13 | 63 ± 5 | – | 4958 | 175 | 670 ± 8 | 362 ± 3 | 113 | 31 |
| 680 | 380 ± 10 | 330 ± 15 | 0.15 | 0.13 | 69 ± 4 | – | 4980 | 175 | 660 ± 7 | 358 ± 4 | 110 | 30 |
| 850 | 310 ± 12 | 240 ± 14 | 0.12 | 0.09 | 75 ± 11 | – | 4982 | 145 | 659 ± 8 | 357 ± 5 | 110 | 30 |
Примечание: I – интенсивность света, мкЭ/(м2 с); FL4 и FL1 – средняя автофлуоресценция, нормированная на клетку, в красной и зеленой области спектра соответственно, от. ед.; FS и SS – прямое и боковое (гранулярность клетки) светорассеяние; V – объем клетки, мкм3; Хл. (а + с) – содержание хлорофилла в клетке, пг/кл; “±” – среднеквадратическое отклонение
Клетки, покрытые и не покрытые кокколитами, отличаются по показателям автофлуоресценции в красной области спектра (675 нм, канал FL4), и, соответственно, по содержанию хлорофилла в них. Для обеих групп клеток E. huxleyi отмечены однотипные световые зависимости красной автофлуоресценции: снижение FL4 с увеличением освещенности. Однако для клеток, покрытых слоем кокколит, значения FL4 были достоверно выше, чем у не покрытых, во всем исследуемом световом диапазоне. Вероятно, наблюдаемая разница обусловлена различиями в количестве поглощенных клетками квантов света, так как наличие кальциевых образований – кокколит приводит к увеличению коэффициента рассеяния и снижению удельного коэффициента поглощения света пигментами. Поэтому количество квантов света, поглощенных непокрытыми клетками, будет превосходить таковое у покрытых, соответственно и содержание хлорофилла в них будет ниже.
Отмечено, что у клеток, покрытых слоем кокколит, в зеленой области спектра (525 нм) регистрируется неспецифическая автофлуоресценция, в то время как у клеток без кокколит данная флуоресценция отсутствует. Эмиссия покрытых клеток в данной области спектра, вероятно, связана с клеточными флуорофорами, входящими в состав самих кокколит, в частности полисахаридами [14–16], хитином [17] или другими органическими веществами [18]. Кроме того, автофлуоресценция в зеленой области спектра не только является исключительным свойством отдельных таксонов, но может проявляться в той или иной мере в клетках разной природы и происхождения в зависимости от их физиологического состояния [19]. Она является показателем интенсивности окислительных процессов в клетках бактерий и эукариот [20] и нарастает в клетках, находящихся в экстремальных условиях [21] и подверженных деструктивным изменениям – при деградации фотосинтетического аппарата, снижении ферментативной активности, увеличении проницаемости мембран, денатурации белков [19], а также при апоптозе [22, 23]. Возможно, это объясняет увеличение значений зеленой автофлуоресценции у покрытых кокколитами клеток E. huxleyi с повышением интенсивности света (см. табл. 1). Но конкретно ответить, связано ли увеличение зеленой автофлуоресценции с изменением функционального состояния E. huxleyi в ответ на действие света или обусловлено увеличением интенсивности свечения флуоресцентных молекул и соединений, входящих в состав кокколит, на сегодняшний момент не представляется возможным и требует дополнительных исследований.
ОБСУЖДЕНИЕ
На сегодняшний день одной из основных теорий, объясняющих массовое развитие кокколитофориды E. huxleyi в водах Мирового океана в условиях крайне высоких уровней освещенности, является снижение степени проникновения света в клетку за счет особых светорассеивающих свойств кокколит, покрывающих клеточную оболочку [1, 2, 17]. Тем самым клетка имеет конкурентные преимущества перед другими представителями фитопланктона в условиях высокой облученности. Тем не менее, результаты проведенного нами экспериментального исследования показали, что фотоингибирование роста E. huxleyi начинает проявляться при интенсивности света выше 400 мкЭ/(м2 с) вплоть до полной остановки роста водорослей при освещенности 680 мкЭ/(м2 с). Светозависимое уменьшение скорости роста происходит на фоне снижения удельного содержания хлорофилла в клетках и значений коэффициента квантовой эффективности реакционных центров ФС II. Следует отметить, что освещение клеток светом интенсивностью 400–850 мкЭ/(м2 с) не оказывает летального воздействия на микроводоросли, функциональные характеристики клеток быстро восстанавливаются при переносе в благоприятные условия роста (рис. 3). Мы полагаем, что наблюдаемое ингибирование роста E. huxleyi связано со значительным увеличением процента непокрытых клеток в культуре при высокой освещенности (порядка 65% при 850 мкЭ/(м2 с)), которые ввиду отсутствия кокколит на поверхности в большей степени подвержены воздействию высокой освещенности. Подтверждением тому является различие во внутриклеточной концентрации хлорофилла, величина которой была достоверно выше у клеток, покрытых кокколитами, во всем исследуемом световом диапазоне.
Вопросам, касающимся кальцификации E. huxleyi, посвящено огромное количество работ, данные которых получены с применением различного арсенала экспериментальных методов [1, 24, 25]. Благодаря отличительному признаку, связанному со способностью клеток, окруженных кокколитами, рассеивать свет, появляется возможность использовать современную методическую базу, в частности проточную цитометрию. Боковое светорассеяние (SS) проточных цитометров позволяет идентифицировать клетки E. huxleyi при различных их морфотипах [25, 26]. Нами отмечено, что значения SS в 25 раз выше у клеток, покрытых кокколитами, что, вероятно, связано с высокой гранулярностью поверхности внешних кокколит. Используя такой подход разделения клеток, нам удалось выявить ряд различий в флуоресцентных, размерных и структурных показателях клеток E. huxleyi, соответствующих двум ее формам: покрытым и непокрытым кокколитами.
Анализ размерной структуры E. huxleyi показал, что покрытые клетки по объему в 2.5–3.5 раза крупнее непокрытых. Аналогичный расчет объемов клеток E. huxleyi с кокколитами и без с использованием проточной цитометрии и калибровочных бусин проведен в исследовании [27]. Авторами показано, что объемы исследуемых групп клеток различаются в среднем в два раза: объем клеток с кокколитами варьирует от 115 до 155 мкм3, в то время как его величина у непокрытых клеток составляет порядка 57–77 мкм3 в зависимости от условий выращивания. Увеличение объема покрытых кокколитами клеток до значений 155 мкм3 в неблагоприятных условиях роста авторы объясняют увеличением размера коккосфер (протопластов и пластинок карбоната кальция) или количества кокколитов на поверхности клетки. Выдвинутая авторами гипотеза объясняет отмеченное нами закономерное повышение объемов клеток, покрытых кокколитами, с ростом освещенности. Так, при лимитирующей и оптимальной для роста интенсивности света различие в объеме покрытых и непокрытых кокколитами клеток E. huxleyi составляло 2.5–3 раза, тогда как при ингибирующем уровне света данный показатель различался почти в 4 раза. Отметим, что гипотеза о “сверхпродуцировании” кокколитов в неблагоприятных условиях роста и образовании нескольких слоев известковых дисков на поверхности клетки E. huxleyi отмечено еще в ряде работ [1, 28–30], посвященных исследованию данного вида водорослей. В работе [31] также отмечено увеличение объема клеток, как с кокколитами, так и без них, при повышении освещенности, но, не столь значительное, как в нашем исследовании. Однако авторы приводят другую трактовку полученным данным и связывают изменение объема клеток с повышением скорости фотосинтеза и сопутствующим ему накоплением углерода внутри клетки [32]. Следует отметить, что Мюллером с соавторами получено и существенно меньшее различие между объемами клеток с кокколитами и без них: в среднем клетки различались в 1.5 раза. Возможно, это связано с разными инструментальными подходами к расчету размеров или разными штаммами E. huxleyi, используемыми в исследованиях.
Особое внимание хочется уделить вопросу различия значений зеленой автофлуоресценции (FL1) у исследуемых групп клеток E. huxleyi. Нами получено, что клетки без кокколит характеризуются отсутствием свечения в данной области спектра, тогда как у покрытых клеток E. huxleyi зеленая автофлуоресценция регистрируется, и ее величина закономерно увеличивается с ростом освещенности. Наблюдаемое различие можно объяснить двумя причинами. Во-первых, эмиссия в зеленой области спектра может быть связана с флуорофорами, входящими в состав кокколитсодержащих клеток E. huxleyi, в частности полисахаридами [14–16], кальцитом [33] или с изменением содержания внутриклеточных пигментов [34]. Если рассматривать предположение, что зеленая автофлуоресценция клеток, покрытых коккосферой, связана с полисахаридами, то в работе [35] имеются данные, которые противоречат данной гипотезе. Авторами показано, что полисахариды имеются как у клеток, покрытых кокколитами, так и без них, и практически не отличаются составом входящих в них моносахаридов. Мы полагаем, что наблюдаемая зеленая автофлуоресценция обусловлена свечением фибриллярного материала или “клея”, посредством которого кокколиты прикрепляются к оболочкам клеток [36]. В других источниках данный “клей” описан как кислотный полисахарид или “полисахарид кокколита” [17, 37], который способен связываться с ионами кальция [38] и с поверхностью кристаллов CaCO3 [39]. Кислотный полисахарид продуцируется во внутриклеточных везикулах кокколитов, откладывается на поверхности клетки, интегрируется в кристаллы CaCO3 и затем транспортируется на поверхность клетки с кокколитами [40]. Предполагается, что при повышении интенсивности света скорость кальцификации покрытых клеток возрастает, что, вероятно, является причиной увеличения зеленой флуоресценции и объемов клеток с кокколитами при этих условиях.
ЗАКЛЮЧЕНИЕ
Результаты проведенного экспериментального исследования позволили выявить новые аспекты физиологии кокколитофориды E. huxleyi, как вида, вызывающего массовые “цветения” в Черном море, и значительно влияющего на круговорот биогенных и минеральных веществ в морской среде. Показано, что популяция E. huxleyi представлена двумя клеточными формами, покрытыми слоем кальциевых образований – кокколит и клетками без кокколит, соотношение между которыми зависит от световых условий роста водорослей. Повышение интенсивности света приводит к закономерному снижению количества покрытых кокколитами клеток в культуре, что, вероятно, является причиной фотоингибирования роста E. huxleyi при освещенности выше 400 мкЭ/(м2 с).
По результатам исследования выявлены существенные физиологические различия клеток E. huxleyi, покрытых и не покрытых кокколитами. Так, непокрытые клетки отличаются мелким размером, низкими значениями прямого и бокового светорассеяния, более низким удельным содержанием хлорофилла, а также отсутствием зеленой автофлуоресценции (FL1). Ввиду этого изменение соотношения между покрытыми и непокрытыми клетками в популяции будет приводить к изменению ее структурно-функциональных характеристик в целом. Так, в условиях низкой освещенности (в природных условиях характерной для зимнего сезона) в культуре преобладают клетки, покрытые кокколитами. В то время как при высоких значениях освещенности (600−800 мкЭ/(м2 с)) вклад покрытых клеток снижается до 30–40%. Исходя из этого, следует полагать, что оценка количества клеток E. huxleyi в море в летний период (при экстремально высоком уровне облученности), основанная на данных спутниковых измерений, дает заниженные результаты относительно реальных значений, так как регистрирует только клетки, покрытые кокколитами. Кроме того отсутствие твердых кальциевых образований (кокколит) у E. huxleyi и как следствие значительное уменьшение размеров непокрытых клеток делает микроводоросли более подверженными выеданию зоопланктоном, тем самым оказывая влияние на динамику пищевой цепи.
Авторы выражают глубокую признательность сотруднику отдела экологической физиологии водорослей Федерального исследовательского центра “Института биологии южных морей имени А.О. Ковалевского РАН” Алатарцевой О.С. за предоставленную культуру E. huxleyi.
Работа выполнена в рамках темы государственного задания Федерального исследовательского центра “Института биологии южных морей имени А.О. Ковалевского РАН” № 121041400077−1 “Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом”.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Paasche E. A review of the coccolithophorid Emiliania huxleyi (Prymnesiophyceae), with particular reference to growth, coccolith formation, and calcification-photosynthesis interactions // Phycologia. 2001. V. 40. P. 503. https://doi.org/10.2216/i0031-8884-40-6-503.1
Чурилова Т.Я., Суслин В.В. O причинах доминирования Emiliania huxleyi в фитопланктоне глубоководной части Черного моря в начале лета // Екологічна безпека прибережної та шельфової зон та комплекс невикористання ресурсів шельфу. 2012. Т. 26. С. 195.
Стельмах Л.В., Сеничева М.И., Бабич И.И. Эколого-физиологические основы “цветения” воды, вызываемого Emiliania huxleyi в Севастопольской бухте // Экология моря. 2009. Т. 77. С. 28.
Кубрякова Е.А., Кубряков А.А., Микаэлян А.С. Зимние цветения кокколитофорид в Черном море: межгодовая изменчивость и факторы ее вызывающие // Комплексные исследования Мирового океана. Материалы VI Всероссийской научной конференции молодых ученых. Москва: Институт океанологии им. П.П. Ширшова РАН. 2021. С. 507.
Cokacar T., Oguz T., Kubilay N. Satellite-detected early summer coccolithophore blooms and their interannual variability in the Black Sea // Deep Sea Res., Part I. 2004. V. 51. P. 1017. https://doi.org/10.1016/j.dsr.2004.03.007
Klaveness D., Paasche E. Two different Coccolithus huxleyi cell types incapable of coccolith formation // Arch. Mikrobiol. 1971. V. 75. P. 382. https://doi.org/10.1007/BF00407700
Klaveness D. Coccolithushuxleyi (Lohmann) Kamptner. I. Morphological investigations on the vegetative cell and the process of coccolith formation // Protistologica. 1972. V. 8. P. 335.
Guillard R., Ryther J. Studies of marine planktonic diatoms: I. Cyclotella Nana Hustedt, and Detonula Confervacea (CLEVE) Gran // J. Can. Microbiol. 1962. V. 8. P. 229. https://doi.org/10.1139/m62-029
Финенко З.З., Ланская Л.А. Рост и скорость деления водорослей в лимитированных объемах воды // Экологическая физиология морских планктонных водорослей (в условия культур) / Под ред. К.М. Хайлова. Киев: Наукова думка. 1971. С. 22.
Соломонова Е., Муханов В. Оценка доли физиологически активных клеток в накопительных культурах Phaeodactylum tricornutum и Nitzschia sp. с помощью проточной цитометрии // Мор. экол. журн. 2011. Т. 10. С. 67.
Соломонова Е., Акимов А. Соотношение мeртвой и живой компоненты взвеси в культурах микроводорослей в зависимости от стадии роста и освещенности // Мор. экол. журн. 2014. Т. 13. С.73.
Jeffrey S.W., Humphrey G.F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton // Biochem Physiol Pflanzen. 1975. V. 167. P. 191.
Маторин Д.Н., Осипов В.А., Яковлева О.В., Погосян С.И. Определение состояния растений и водорослей по флуоресценции хлорофилла: учеб.-метод. пособие. Москва: изд-во Макс Пресс. 2010. 116 с.
Fichtinger-Schepman A.M.J., Kamerling J.P., Versluis C., Vliegenthart J.F. Structural studies of the methylated, acidic polysaccharide associated with coccoliths of Emiliania huxleyi (Lohmann) Kamptner // Carbohydr. Rese. 1981. V. 93. P. 105. https://doi.org/10.1016/S0008-6215(00)80756-9
Borman A.H., de Jong E.W., Thierry R., Westbroek P., Bosch L., Gruter M., Kamerling J.P. Coccolith-associated polysaccharidesfrom cells of Emiliania huxleyi (Haptophyceae) // J. Phycol. 1987. V. 23. P. 118. https://doi.org/10.1111/j.1529-8817.1987.tb04433.x
Marsh M.E. Regulation of CaCO3 formation in coccolithophores // Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. 2003. V. 136. P. 743. https://doi.org/10.1016/S1096-4959(03)00180-5
Kayano K., Saruwatari K., Kogure T., Shiraiwa Y. Effect of coccolith polysaccharides isolated from the coccolithophorid, Emiliania huxleyi, on calcite crystal formation in in vitro CaCO 3 crystallization // Mar. Biotechnol. 2011. V. 13. P. 83. https://doi.org/10.1007/s10126-010-9272-4
Takahashi J., Fujiwara S., Kikyo M., Hirokawa Y., Tsuzuki M. Discrimination of the cell surface of the coccolithophorid Pleurochrysis haptonemofera from light scattering and fluorescence after fluorescein-isothiocyanate-labeled lectin staining measured by flow cytometry // Mar. Biotechnol. 2002. V. 4. P. 94. https://doi.org/10.1007/s10126-001-0083-5
Tang Y.Z., Dobbs F.C. Green autofluorescence in dinoflagellates, diatoms, and other microalgae and its implications for vital staining and morphological studies // Appl. Environ. Microbiol. 2007. V. 73. P. 2306. https://doi.org/10.1128/AEM.01741-06
Price P.B., Bay R.C. Marine bacteria in deep Arctic and Antarctic ice cores: a proxy for evolution in oceans over 300 million generations // Biogeosciences. 2012. V. 9. P. 3799. https://doi.org/10.5194/bg-9-3799-2012
Roldán M., Ascaso C., Wierzchos J. Fluorescent fingerprints of endolithic phototrophic cyanobacteria living within halite rocks in the Atacama Desert // Appl. Environ. Microbiol. 2014. V. 80. P. 2998. https://doi.org/10.1128/AEM.03428-13
Veldhuis M.J.W., Kraay G.W., Timmermans K.R. Cell death in phytoplankton: correlation between changes in membrane permeability, photosynthetic activity, pigmentation and growth // Eur. J. Phycol. 2001. V. 36. P. 167. https://doi.org/10.1017/S0967026201003110
Franklin D.J., Berges J.A. Mortality in cultures of the dinoflagellate Amphidinium carterae during culture senescence and darkness // Proc. R. Soc. London, Ser. B. 2004. V. 271. P. 2099. https://doi.org/10.1098/rspb.2004.2810
Paasche E., Brubak S., Skattebøl S., Young J.R., Green J.C. Growth and calcification in the coccolithophorid Emiliania huxleyi (Haptophyceae) at low salinities // Phycologia. 1996. V. 35. P. 394. https://doi.org/10.2216/i0031-8884-35-5-394.1
Fuertes M.Á., Flores J.A., Sierro F.J. The use of circularly polarized light for biometry, identification and estimation of mass of coccoliths // Marine Micropaleontology. 2014. V. 113. P. 44. https://doi.org/10.1016/j.marmicro.2014.08.007
Von Dassow P., van den Engh G., Iglesias-Rodriguez D., Gittins J.R. Calcification state of coccolithophores can be assessed by light scatter depolarization measurements with flow cytometry // J. Plankton Res. 2012. V. 34. P. 1011. https://doi.org/10.1093/plankt/fbs061
Iglesias-Rodriguez M.D., Halloran P.R., Rickaby R.E., HallI. R., Colmenero-Hidalgo E., Gittins J.R., Green D.R.H., Tyrrell T., Gibbs S.J., Dassow P. von, Rehm E., Armbrust E.V., Boessenkool K.P. Phytoplankton calcification in a high-CO2 world // Science. 2008. V. 320. P. 336. https://doi.org/10.1126/science.1154122
Garde K., Cailliau C. The impact of UV-B radiation and different PAR intensities on growth, uptake of 14C, excretion of DOC, cell volume, and pigmentation in the marine prymnesiophyte, Emiliania huxleyi // J. Exp. Mar. Biol. Ecol. 2000. V. 247. P. 99. https://doi.org/10.1016/S0022-0981(00)00145-3
Müller M.N., Antia A.N., LaRoche J. Influence of cell cycle phase on calcification in the coccolithophore Emiliania huxleyi // Limnol. and Oceanog. 2008. V. 53. P. 506. https://doi.org/10.4319/lo.2008.53.2.0506
Müller M.N., Trull T.W., Hallegraeff G.M. Independence of nutrient limitation and carbon dioxide impacts on the Southern Ocean coccolithophore Emiliania huxleyi // ISME J. 2017. V. 11. P. 1777. https://doi.org/10.1016/S0022-0981(00)00145-3
Müller M.N., Brandini F.P., Trull T.W., Hallegraeff G.M. Coccolith volume of the Southern Ocean coccolithophore Emiliania huxleyi as a possible indicator for palaeo-cell volume // Geobiology. 2021. V. 19. P. 63. https://doi.org/10.1111/gbi.12414
Aloisi G. Covariation of metabolic rates and cell size in coccolithophores // Biogeosciences. 2015. V. 12. P. 4665. https://doi.org/10.5194/bg-12-4665-2015, 2015
Fox E., Meyer E., Panasiak N., Taylor A.R. Calcein staining as a tool to investigate coccolithophore calcification // Frontiers in Marine Science. 2018. V. 5. P. 326.https://doi.org/10.3389/fmars.2018.00326
Sayanova O., Haslam R.P., Calerón M.V., López N.R., Worthy C., Rooks P., J. Allen Napier J. A. Identification and functional characterisation of genes encoding the omega-3 polyunsaturated fatty acid biosynthetic pathway from the coccolithophore Emiliania huxleyi // Phytochemistry. 2011. V. 72. P. 594.
Nanninga H.J., Ringenaldus P., Westbroek P. Immunological quantitation of a polysaccharide formed by Emiliania huxleyi // J Mar Syst. 1996. V. 9. P. 67. https://doi.org/10.1016/0924-7963(96)00017-6
Billard C., Inouye I. What is new in coccolithophore biology? // Coccolithophores. – Springer, Berlin, Heidelberg. 2004. P. 1.
Tsuji Y., Yamazaki M., Suzuki I., Shiraiwa Y. Quantitative analysis of carbon flow into photosynthetic products functioning as carbon storage in the marine coccolithophore, Emiliania huxleyi // Mar. Biotechnol. 2015. V. 17. P. 428. https://doi.org/10.1007/s10126-015-9632-1
De Jong E.W., Bosch L., Westbroek P. Isolation and characterization of a Cat 2+ binding polysaccharide associated with coccoliths of Emiliania huxleyi (Lohmann) Kamptner // Eur. J. Biochem. 1976. V. 70. P. 611. https://doi.org/10.1111/j.1432-1033.1976.tb11052.x
Henriksen K., Stipp S.L.S., Young J.R., Marsh M.E. Biological control on calcite crystallization: AFM investigation of coccolith polysaccharide function // Am. Mineral. 2004. V. 89. P. 1709. https://doi.org/10.2138/am-2004-11-1217
Van Emburg P.R., De Jong E.W., Daems W.T. Immunochemical localization of a polysaccharide from biomineral structures (coccoliths) of Emiliania huxleyi // J. Ultrastruct. Mol. Struct. Res. 1986. V. 94. P. 246. https://doi.org/10.1016/0889-1605(86)90071-6
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


