Физиология растений, 2022, T. 69, № 2, стр. 207-215
Влияние дефицита криптохромов 1 и 2 на фотосинтетическую активность и про-антиоксидантный баланс в листьях растений Arabidopsis thaliana при действии УФ-В
А. Ю. Худякова a, *, В. Д. Креславский a, А. Н. Шмарев a, Г. Н. Ширшикова a, В. Ю. Любимов a, А. А. Кособрюхов a
a Институт фундаментальных проблем биологии РАН, Федеральный исследовательский центр
“Пущинский научный центр биологических исследований Российской академии наук”
Пущино, Россия
* E-mail: s_t_i_m_a_@mail.ru
Поступила в редакцию 17.04.2020
После доработки 22.03.2021
Принята к публикации 07.05.2021
- EDN: PJFFVW
- DOI: 10.31857/S0015330322010080
Аннотация
Изучено влияние УФ-В-радиации (1 Вт/м2, 1 ч) на фотохимическую активность ФС II, скорость фотосинтеза Pn, содержание фотосинтетических и УФ-поглощающих пигментов (УФПП), активность антиоксидантных ферментов (каталаза и пероксидаза), а также на содержание H2O2 у 25‑дневных растений Arabidopsis thaliana дикого типа (ДТ) (экотип Landsberg erecta) и мутанта, дефицитного по криптохромам 1 и 2 (cry1cry2), выращенных на красном (КС), белом (БС) и синем свету (СС) при интенсивности света 130 мкмоль квантов/(м2 с). Также изучена экспрессия генов фактора транскрипции (HY5), биосинтеза флавоноидов (CHS, PAL) фитохромобилинсинтазы (HY2), протохлорофиллид-оксидоредуктазы (POR-A), стромальной (sAPX) и тилакоидной (tAPX) аскорбатпероксидаз. УФ-В-облучение приводило к снижению величины Pn и фотохимической активности ФС II (флуоресцентные параметры FV/FM, PIABS) растений ДТ и мутанта, выращенных на БС, КС и СС. При этом у растений cry1cry2, выращенных на СС, но не на КС и БС, наблюдали большее ингибирование активности ФС II и скорости фотосинтеза по сравнению с ДТ. Содержание УФПП у cry1cry2, выращенных на СС, было заметно ниже, чем у ДТ, тогда как на КС и БС разница не обнаружена. При действии УФ-В-радиации содержание УФПП во всех вариантах не менялось. У растений, выращенных на СС, активность каталазы и пероксидазы у ДТ была заметно выше, чем у мутанта, как до, так и после облучения УФ-В. У ДТ на БС после облучения активность пероксидазы возрастала, а у мутанта снижалась, но возрастало содержание Н2О2. У мутантных растений, выращенных на СС, уровни транскрипции генов tAPX, sAPX, PAL, HY5, HY2 и POR-A были снижены по сравнению с ДТ. Мы предполагаем, что сниженная устойчивость фотосинтетического аппарата к УФ-В у растений cry1cry2 связана с низким содержанием УФПП и с пониженной активностью пероксидазы и каталазы в листьях мутантных растений.
ВВЕДЕНИЕ
В ряде случаев УФ-излучение является одним из стрессовых факторов, влияющих на функционирование фотосинтетического аппарата (ФА). В процессе выращивания большинство растений испытывает воздействие УФ-радиации различной степени как в области УФ-А, так и УФ-В. ФС II, среди компонентов ФA, и система фиксации CO2 обычно наиболее чувствительны к действию стрессовых факторов [1, 2].
Система фоторецепторов – фитохромов и криптохромов – играет важную роль в световой регуляции активности ФА [3–5]. Известны три типа криптохромов, два из которых являются основными: криптохром 1 и криптохром 2 [5, 6]. Криптохром 1 – это рецептор УФ-А и синего света, и он участвует в реакции растений на УФ-В-радиацию [5], которая приводит к окислительному повреждению ФА [7]. Анализ экспрессии генов выявил регуляторную роль криптохрома 1 в ответе на действие УФ-В [7, 8]. Криптохром 2, напротив, деградирует даже при слабом освещении и участвует в фотопериодизме [6]. Криптохромы, поглощая специфические длины волн (УФ-А и синяя области спектра), составляют часть фоторегуляторной системы растений, ответственной за адаптацию ФА растений [9–11]. Показано, что криптохром 1 играет ключевую роль в ответной реакции растений Arabidopsis thaliana на свет высокой интенсивности [10] и устойчивости ФС II к УФ-В [12]. При этом криптохром 1 способствует индукции экспрессии многих светочувствительных генов, в частности, гена халконсинтазы (CHS), которая участвует в начальной стадии биосинтеза флавоноидов [9]. Опыты с мутантом растений A. thaliana, дефицитным по криптохрому 1, показали, что 77 чувствительных к свету генов регулируются с помощью криптохрома 1 [10]. Вследствие нарушения регуляции этих генов в cry1 A. thaliana этот мутант показал высокочувствительный к облучению фенотип со значительной фотоинактивацией ФС II, о чем свидетельствует снижение максимального квантового выхода флуоресценции. Однако имеется мало информации о совместном действии криптохромов 1 и 2 при действии УФ-радиации на растения.
УФ-излучение является одним из наиболее распространенных факторов окружающей среды, влияющих на растения и баланс оксидантов и антиоксидантов в них, но механизм адаптации к этому стрессу до конца не раскрыт. Обычно такое облучение вызывает образование повышенного количества АФК, которые, в дополнение к негативным эффектам, способны выполнять сигнальные функции [13, 14]. В ответ на усиление образования АФК синтезируются различные низкомолекулярные антиоксиданты, а также усиливается активность антиоксидантных ферментов. При этом содержание синтезированных антиоксидантов варьируется в зависимости от интенсивности стресса и его продолжительности. При кратковременном стрессе, вызванном ультрафиолетом, значительно изменяются активности антиоксидантных ферментов, нейтрализующих АФК [15]. При более длительном воздействии на растения происходит значительное изменение содержания низкомолекулярных антиоксидантов, таких как восстановленная аскорбиновая кислота и восстановленный глутатион (GSH).
Широкое использование мутантных растений A. thaliana в экспериментах связано с тем, что они имеют полностью расшифрованный геном, а также широкий набор фоторецепторных мутантов, в том числе мутант cry1cry2, дефицитный по криптохромам 1 и 2. Однако отсутствуют данные о роли дефицита этих криптохромов в фотосинтетических процессах при выращивании растений на свету разного спектрального состава.
В данном исследовании мы изучали возможную роль криптохромов 1 и 2 в реакции ФА на УФ-В. Мы предположили, что дефицит криптохромов влияет на функционирование ФА растений A. thaliana при кратковременном облучении УФ-В (1 ч), и что это влияние зависит от того, на каком свету выращены растения – на белом (БС), красном (КС) или синем (СС). При этом активность ключевых антиоксидантных ферментов, уровни экспрессии генов и содержание УФ-поглощающих пигментов (УФПП), таких как каротиноиды и флавоноиды, вероятно, являются основными факторами, определяющими устойчивость ФА к кратковременному действию УФ-В-радиации.
Цель работы – изучение влияния дефицита криптохромов 1 и 2 на фотосинтетическую активность и про-антиоксидантный баланс в листьях растений Arabidopsis thaliana при действии УФ-В.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Эксперименты проводили на растениях Arabidopsis thaliana дикого типа (ДТ) (экотип Landsberg erecta, Ler) и мутанта, дефицитного по криптохромам 1 и 2 (cry1cry2). В отдельных экспериментах использовали также ДТ A. thaliana экотипа Columbia-0 (Col-0), который сравнивали с мутантом hy4 (дефицит криптохрома 1). Семена всех растений были получены из Nottingham Arabidopsis Stock Centre (Великобритания). Растения выращивали в течение 25 дней с 12 ч фотопериодом при температуре 24 ± 1°C днем и 21 ± 1°C ночью под белыми люминесцентными лампами (БС) (130 ± 10 мкмоль квантов/(м2 с)), или красными светодиодами (КС) (λmax = 664 нм, полуширина 19 нм, 130 ± 15 мкмоль квантов/(м2 с)), или синими светодиодами (СС) (λmax = 463 нм, полуширина 20 нм, 130 ± 15 мкмоль квантов/(м2 с)).
После последнего темнового периода растения в сосудах для выращивания подвергали воздействию УФ-В в течение 1 ч. Для обработки УФ-В использовалась узкополосная УФ-лампа PL-S 9W/01/2P (“Philips Lighting”, Польша) (λmax = (311 ± 3) нм, 1 Вт/м2). После облучения верхние развитые почти горизонтальные листья отделяли и держали на влажной фильтровальной бумаге в течение 20 мин перед различными измерениями.
Измерение фотохимической активности. Фотохимическую активность ФС II оценивали путем измерения индукционных кривых флуоресценции Хл a (OJIP кривые) с использованием самодельного флуориметра. JIP-тест часто используют для оценки состояния ФС II [16]. Флуориметр оснащен синим светодиодом 5 Вт LXHL-PR02 Royal Blue 455 нм (“Luxeon”, США) и фотодиодным датчиком BPW24R, PIN (фотодиод 600…1050 нм, “Vishay”, Германия) для записи флуоресценции Хл. Для определения основной флуоресценции хлорофилла (F0) использовали слабый измерительный свет (0.25 мкмоль квантов/(м2 с)). Максимальную амплитуду флуоресценции (FМ) определяли с использованием насыщающего импульса синего света (455 нм; 5000 мкмоль квантов/(м2 с), длительность 1 с) от светоизлучающего диода. Сигнал регистрировался каждые 10 мкс – в течение 1 мс и каждые 1 мс, начиная с 1 мс до 1 с во время сбора данных. Сигнал передавался с кремниевого фотодиода на компьютер для последующей обработки. На основе полученных индукционных кривых рассчитывали флуоресцентные параметры: FV/FM – максимальный квантовый выход фотохимии ФС II, где FV – переменная флуоресценция, определяемая как разность между FM и F0; F0 и FM – минимальный и максимальный уровень флуоресценции, соответственно; DI0/RC – количество рассеянной, в основном, в тепло энергии, относящейся к реакционному центру; PIABS – индекс производительности ФС II.
Параметры были рассчитаны по формулам:
(1)
${{{\text{ABS}}} \mathord{\left/ {\vphantom {{{\text{ABS}}} {{\text{RC}}}}} \right. \kern-0em} {{\text{RC}}}} = {{\left( {{{{{M}_{0}}} \mathord{\left/ {\vphantom {{{{M}_{0}}} {{{V}_{{\text{J}}}}}}} \right. \kern-0em} {{{V}_{{\text{J}}}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{{{M}_{0}}} \mathord{\left/ {\vphantom {{{{M}_{0}}} {{{V}_{{\text{J}}}}}}} \right. \kern-0em} {{{V}_{{\text{J}}}}}}} \right)} {\left( {{{{{F}_{{\text{V}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{V}}}}} {{{F}_{{\text{M}}}}}}} \right. \kern-0em} {{{F}_{{\text{M}}}}}}} \right)}}} \right. \kern-0em} {\left( {{{{{F}_{{\text{V}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{V}}}}} {{{F}_{{\text{M}}}}}}} \right. \kern-0em} {{{F}_{{\text{M}}}}}}} \right)}},$(2)
${{{\text{D}}{{{\text{I}}}_{0}}} \mathord{\left/ {\vphantom {{{\text{D}}{{{\text{I}}}_{0}}} {{\text{RC}}}}} \right. \kern-0em} {{\text{RC}}}} = {{{\text{ABS}}} \mathord{\left/ {\vphantom {{{\text{ABS}}} {{\text{RC}}}}} \right. \kern-0em} {{\text{RC}}}} - {{{{M}_{0}}} \mathord{\left/ {\vphantom {{{{M}_{0}}} {{{V}_{{\text{J}}}}}}} \right. \kern-0em} {{{V}_{{\text{J}}}}}},$(3)
${\text{P}}{{{\text{I}}}_{{{\text{ABS}}}}} = {{\left( {{{{{F}_{{\text{V}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{V}}}}} {{{F}_{{\text{M}}}}}}} \right. \kern-0em} {{{F}_{{\text{M}}}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{{{F}_{{\text{V}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{V}}}}} {{{F}_{{\text{M}}}}}}} \right. \kern-0em} {{{F}_{{\text{M}}}}}}} \right)} {\left( {{{{{M}_{0}}} \mathord{\left/ {\vphantom {{{{M}_{0}}} {{{V}_{{\text{J}}}}}}} \right. \kern-0em} {{{V}_{{\text{J}}}}}}} \right)}}} \right. \kern-0em} {\left( {{{{{M}_{0}}} \mathord{\left/ {\vphantom {{{{M}_{0}}} {{{V}_{{\text{J}}}}}}} \right. \kern-0em} {{{V}_{{\text{J}}}}}}} \right)}}\left( {{{{{F}_{{\text{V}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{V}}}}} {{{F}_{0}}}}} \right. \kern-0em} {{{F}_{0}}}}} \right){{\left( {1 - {{V}_{{\text{J}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {1 - {{V}_{{\text{J}}}}} \right)} {{{V}_{{\text{J}}}}}}} \right. \kern-0em} {{{V}_{{\text{J}}}}}},$(4)
${{М}_{0}} = {{4\left( {{{F}_{{300\,\,{\text{мкс}}}}} - {{F}_{0}}} \right)} \mathord{\left/ {\vphantom {{4\left( {{{F}_{{300\,\,{\text{мкс}}}}} - {{F}_{0}}} \right)} {\left( {{{F}_{{\text{M}}}} - {{F}_{0}}} \right)}}} \right. \kern-0em} {\left( {{{F}_{{\text{M}}}} - {{F}_{0}}} \right)}},$(5)
${{V}_{{\text{J}}}} = {{\left( {{{F}_{{2\,\,{\text{мс}}}}} - {{F}_{0}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{F}_{{2\,\,{\text{мс}}}}} - {{F}_{0}}} \right)} {\left( {{{F}_{{\text{M}}}} - {{F}_{0}}} \right)}}} \right. \kern-0em} {\left( {{{F}_{{\text{M}}}} - {{F}_{0}}} \right)}},$Определение содержания УФПП и фотосинтетических пигментов в листьях растений. Содержание УФПП определяли по методике Mirecki и Teramura [17]. Высечки из листьев (6–10) выдерживали 24 ч в кислом метаноле (метанол : вода : HCl, 78 : 20 : 2) при +4°С. Оптическую плотность образцов определяли при 327 ± 2 нм на спектрофотометре Genesys 10 UV (“Thermo Fisher Scientific”, США). Количество УФПП рассчитывали в относительных единицах на 100 мг сырого веса и выражали в процентах к ДТ.
Содержание Хл (a + b) и каротиноидов измеряли в этанольных экстрактах, используя метод Lichtenthaler и Wellburn [18]. Поглощение в образцах измеряли с помощью спектрофотометра Genesys 10 UV (“Thermo Fisher Scientific”, США) при λМ – 470, 649 и 665 нм.
Определение активности общей пероксидазы (КФ 1.11.1.7) и каталазы (КФ 1.11.1.6) и содержания H2O2 в листьях растений. Активность общей пероксидазы в листьях исследуемых растений определяли спектрофотометрически [19] с помощью спектрофотометра Genesys 10UV. К 2 мл фосфатного буфера (pН 7.0) добавляли 100 мкл растительного экстракта и 1 мл раствора 1 мМ о-дианизидина. Реакцию инициировали добавлением 100 мкл 10 мМ H2O2 и измеряли оптическую плотность при 460 нм в течение 30 с. Активность пероксидазы рассчитывали, используя коэффициент экстинкции ο-дианизидина, и активность фермента выражали в процентах от контроля. Активность каталазы также определяли спектрофотометрически с использованием метода Chance и Maehly [20] с некоторыми модификациями [21]. Динамика изменения оптической плотности регистрировалась с помощью спектрофотометра Genesys 10 UV в течение 30 с при длине волны 240 нм.
Для определения содержания H2O2 листья арабидопсиса (30–50 мг) охлаждали в жидком азоте в течение 2–3 мин. Затем замороженные листья переносили в 400 мкл 2 М трихлоруксусной кислоты и гомогенизировали. Гомогенат трижды смывали в пробирку с 1000 мкл 0.05 М К-фосфатным буфером (рН 8.5). После этого 3400 мкл гомогената смешивали с 100 мг активированного угля для адсорбции феофитина и каротиноидов, а затем центрифугировали в течение 20 мин при 10 000 g [22]. Надосадочную жидкость декантировали и титровали 2 М КОН до рН 8.5. Содержание Н2О2 определяли в 100 мкл экстракта путем измерения биолюминесценции в смеси, содержащей 10–6 М пероксидазы и 10–4 М люминола (общий объем 1 мл) [23]. Для измерений использовали хемилюминометр Lum-100 (“ДИСофт” Россия).
Аппаратура и методы измерения СО2 газообмена. Газообмен CO2 листьев измеряли с помощью портативной системы LCPro+ (“ADC BioScientific Ltd.”, Великобритания). Зависимость скорости видимого фотосинтеза от интенсивности света определяли при насыщающей интенсивности света 800 мкмоль квантов/(м2 с) при концентрации CO2 в воздухе 420 мкмоль/моль [24].
Количественная ПЦР в реальном времени. Общая РНК была выделена с помощью TRI-Reagent (MRC, Inc., США) в соответствии с прилагаемой к реактиву инструкцией. Для синтеза первой цепи кДНК использовали набор для обратной транскрипции (“Синтол”, Россия) в соответствии с инструкцией производителя. Количественную ПЦР в реальном времени проводили с использованием iCycler IQ5 (“Bio-Rad”, США) и реакционной смеси из набора qPCRmix-HS SYBR (“Евроген”, Россия). Ген UBQ5 (AT3G62250) использовали в качестве внутреннего эталона [25]. Вырожденные праймеры были сконструированы для выявления генов PAL. Последовательности праймеров представлены в Дополнительных материалах (табл. S1 ).
Статистика. Статистическую обработку данных и построение графиков осуществляли с помощью SigmaPlot 11.0. Таблицы и графики показывают средние значения с их стандартными ошибками (SE). Для каждого эксперимента использовали три биологических и, по меньшей мере, 6–12 аналитических повторностей. Достоверность различий между любыми двумя вариантами (эксперимент и контроль) описывали t-критерием Стьюдента при уровне значимости 5%, если не указано иное. В многовариантных экспериментах использовали однофакторный дисперсионный анализ (ANOVA).
РЕЗУЛЬТАТЫ
Растения ДТ и cry1cry2, выращенные на БС и КС, практически не отличались по флуоресцентным параметрам (FV/FM, DI0/RC и PIABS) в физиологических условиях. Однако при выращивании растений на СС наблюдалась заметная разница (рис. 1). Так максимальный квантовый выход (FV/FM) и индекс производительности ФС II (PIABS) у мутанта cry1cry2 были меньше на 11% и в 3 раза, соответственно, а степень рассеивания поглощенной световой энергии (DI0/RC) была больше в 1.7 раза, по сравнению с ДТ. После облучения УФ-В наблюдалось снижение фотохимической активности ФС II (FV/FM, PIABS) у всех исследуемых растений. При этом у растений ДТ и cry1cry2, выращенных на КС и БС, параметры флуоресценции достоверно не отличались после облучения. У растений cry1cry2, выращенных на СС, уменьшение фотохимической активности было значительно выше по сравнению с ДТ. Так, после облучения УФ-В величина FV/FM снижалась в 2.5 раза у мутанта и на 21% у ДТ, индекс производительности PIABS снизился более чем в 100 раз у cry1cry2 и в 4.4 раза у ДТ (рис. 1а, б). После облучения параметр DI0/RC возрастал в 7.5 и 2.1 раза у мутанта cry1cry2 и ДТ, соответственно (рис. 1в). Такие же тенденции мы наблюдали при сравнении растений ДТ(Col-0) и hy4, выращенных на СС, а также при анализе индукционных кривых быстрой флуоресценции (нет разницы между растениями, выращенными на БС и КС, на СС заметная разница) (рис. 2).
Рис. 1.
Влияние УФ-В (1 ч) на максимальный квантовый выход ФС II FV/FM (а), индекс производительности ФС II PIABS (б), количество рассеянной в тепло энергии DI0/RC (в) и скорость фотосинтеза Pn (г) в листьях растений A. thaliana ДТ(Col-0) и мутанта hy4, выращенных на СС, и ДТ(Ler) и cry1cry2, выращенных на БС, КС и СС. 1* – ДТ(Col-0), 2* – ДТ(Col-0)-УФ, 3* – hy4, 4* – hy4-УФ. 1 – ДТ(Ler), 2 – ДТ(Ler)-УФ, 3 – cry1cry2, 4 – cry1cry2-УФ. СС(Col-0) – растения экотипа Columbia-0, выращенные на СС, n = 3.

Рис. 2.
Индукционные кривые флуоресценции Хл а листьев 25-дневных растений A. thaliana ДТ и мутанта cry1cry2 до и после облучения УФ-В в течение 1 ч. Растения выращивали на БС (а), СС (б) и КС (в). 1 ‒ ДТ, 2 – cry1cry2, 3 – ДТ-УФ, 4 – cry1cry2-УФ. Показаны типичные кривые, n = 7.

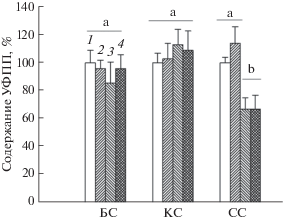
Показано, что количество УФПП существенно не отличается у растений ДТ и cry1cry2, выращенных на КС и БС, как до, так и после облучения УФ-В (рис. 3). При этом у мутанта cry1cry2 на СС содержание УФПП было ниже на 33% по сравнению с ДТ, и после облучения УФ-B эти тенденции сохранялись.
Рис. 3.
Влияние УФ-В (1 ч) на содержание УФПП в листьях растений A. thaliana ДТ и мутанта, дефицитного по криптохромам 1 и 2 (cry1cry2), выращенных на БС, КС и СС. 1 – ДТ, 2 – ДТ-УФ, 3 – cry1cry2, 4 – cry1cry2-УФ. Содержание УФПП у ДТ, выращенного на БС, до облучения принято за 100%, n = 3.
Проведено сравнение содержания фотосинтетических пигментов (Хл a + b, каротиноиды) у растений ДТ и cry1cry2, выращенных на БС, КС или СС. Их содержание было больше у растений ДТ-БC и cry1cry2-БC по сравнению с растениями ДТ-СC и cry1cry2-СC, а также ДТ-КC и cry1cry2-КC. Облучение УФ-В либо не изменяло содержание Хл (а + b) и каротиноидов, либо немного снижало (табл. 1).
Таблица 1.
Влияние облучения УФ-В (1 ч) на содержание Хл (а + b) и каротиноидов в листьях растений A. thaliana ДТ и мутанта, дефицитного по криптохромам 1 и 2 (cry1cry2), выращенных на БС, КС и СС. Показаны средние значения ± SE, n = 3
| Вариант | Хл (а + b), мкг/г (сырой вес) | Каротиноиды, мкг/г (сырой вес) |
|---|---|---|
| ДТ-БC | 1129 ± 54a | 191 ± 3a |
| ДТ-БC(УФ) | 1070 ± 62a | 182 ± 14ab |
| cry1cry2-БC | 1052 ± 9a | 196 ± 1a |
| cry1cry2-БC(УФ) | 1087 ± 40a | 199 ± 5a |
| ДТ-КC | 893 ± 26ab | 170 ± 4b |
| ДТ-КC(УФ) | 805 ± 49b | 133 ± 12c |
| cry1cry2-КC | 870 ± 20b | 176 ± 12ab |
| cry1cry2-КC(УФ) | 842 ± 29b | 167 ± 12ab |
| ДТ-СC | 901 ± 37ab | 142 ± 8bc |
| ДТ-СC(УФ) | 899 ± 43ab | 132 ± 5c |
| cry1cry2-СC | 869 ± 9b | 148 ± 1c |
| cry1cry2-СC(УФ) | 724 ± 43c | 126 ± 10c |
Обнаружена незначительная разница в скорости фотосинтеза (Pn) у растений ДТ и cry1cry2, выращенных на КС (рис. 1г). У растений ДТ и cry1cry2, выращенных на БС, скорость фотосинтеза равна 14.6(0.4) мкмоль CO2/(м2 с) и 17.8(0.3) мкмоль CO2/(м2 с), соответственно. При выращивании растений на СС значения Pn были заметно ниже – 8.2(0.2) мкмоль CO2/(м2 с) у ДТ и 2.8(0.2) мкмоль CO2/(м2 с) у мутанта. Облучение УФ-В приводило к снижению скорости фотосинтеза у растений, выращенных на БС и СС, тогда как на КС такой эффект не наблюдался. При этом снижение было значительно выше у cry1cry2 по сравнению с растениями ДТ. Так, на БС скорость фотосинтеза снижалась в 1.5 раза у ДТ и в 2.3 раза у мутанта, а на СС – в 1.6 раза у ДТ и в 2.5 раза у мутанта.
Активность общей пероксидазы и каталазы растений cry1cry2, выращенных на БС, была сходна с таковой у ДТ (рис. 4а, б). После облучения активность пероксидазы возрастала у ДТ, а у мутанта снижалась. Содержание Н2О2 у мутанта, выращенного на БС, было вдвое меньше, чем у ДТ. Однако после облучения у ДТ наблюдали снижение содержания Н2О2 почти вдвое, а у мутанта наоборот, повышение содержания более чем в два раза (рис. 4г). У растений, выращенных на СС, активность каталазы и пероксидазы была приблизительно в два раза выше у ДТ по сравнению с cry1cry2. После облучения эта тенденция сохранялась. У растений, выращенных на КС, содержание Н2О2 было заметно выше у мутанта по сравнению с ДТ. И наоборот, активность пероксидазы была выше в два раза у ДТ по сравнению с cry1cry2. По каталазе различий не наблюдали.
Рис. 4.
Влияние облучения УФ-В (1 ч) на активность каталазы (а) и пероксидазы (б) и содержание Н2О2 (в) в листьях растений A. thaliana ДТ и мутанта cry1cry2, выращенных на БС, КС и СС. 1 – ДТ, 2 – ДТ-УФ, 3 – cry1cry2, 4 – cry1cry2-УФ, n = 3.

У растений, выращенных на СС, у мутанта cry1cry2 по сравнению с уровнями экспрессии генов ДТ обнаружены пониженные уровни экспрессии генов стромальной (sAPX) и тилакоидной (tAPX) аскорбатпероксидаз, биосинтеза флавоноидов (PAL), протохлорофиллид-оксидоредуктазы (POR-A) и фактора транскрипции (HY5) (рис. 5). Также заметно (почти в три раза) снижен уровень транскрипции гена HY2, ответственного за биосинтез фитохромобилинсинтазы – ключевого фермента в цепи биосинтеза фитохромобилина. При выращивании растений на БС обнаружены более низкие уровни экспрессии генов sAPX и POR-A у мутанта cry1cry2 по сравнению с таковыми у ДТ.
ОБСУЖДЕНИЕ
УФ-компонента солнечного излучения в значительной степени влияет на систему фотоморфогенеза растений, и ее исключение приводит к усилению роста листьев и растения в целом, увеличению скорости фотосинтеза растений, но мало влияет на скорость фотосинтетического электронного транспорта и активность ФС I и ФС II [26, 27]. Однако на фоне действия нескольких стрессовых факторов, что, как правило, встречается в природе, воздействие УФ-радиации может в значительной степени влиять на первичные фотохимические процессы [27]. При этом наибольший эффект на активность ФА оказывает УФ-В-радиация, действие которой тесно сопряжено с работой фоторецепторов, таких как фитохромы и криптохромы [4, 12].
По-видимому, фоторецепторы оказывают защитное действие против УФ-В, регулируя содержание УФПП – каротиноиды и флавоноиды [4, 28]. Известно, что эпидермальный слой листьев, в котором в основном локализованы флавоноиды, может играть важную защитную роль против УФ-излучения [29]. Например, у мутантов A. thaliana, у которых наблюдали ингибирование фенилпропаноидного пути, а следовательно, пониженное содержание флавоноидов в эпидермальном слое, была обнаружена более высокая чувствительность ФА к УФ-В-излучению по сравнению с диким типом [30].
Как уже было сказано, криптохром 1 играет ключевую роль в ответных реакциях A. thaliana на УФ-В, который вызывает окислительное повреждение ФА [4, 28]. Также дефицит криптохрома 1 приводил к повышенной чувствительности ФС II к кратковременному облучению растений A. thaliana УФ-В [12]. Хотя криптохром 2 быстро деградирует на сильном свету, его дефицит может усилить снижение устойчивости ФА при дефиците криптохрома 1, как это следует из наших данных (рис. 1а, б). Действительно, флуоресцентные параметры ДТ Ler и Col-0 мало отличались друг от друга. Однако у УФ-облученных растений разница между флуоресцентными параметрами была значительна. Так, у ДТ(Ler) и cry1cry2 мутанта производительность ФС II (PIABS) и максимальный квантовый выход ФС II (FV/FM) заметно больше отличались друг от друга, чем у ДТ(Col-0) и мутанта с дефицитом криптохрома 1 (hy4).
Действие УФ-радиации приводит к развитию в хлоропластах окислительного стресса и генерации АФК. Это согласуется с нашими данными по заметному снижению активности ФС II как у мутанта, выращенного на СС, так и у ДТ (рис. 1). При этом у растений cry1cry2, выращенных на СС, наблюдали большее ингибирование активности ФС II, оцененное по всем флуоресцентным параметрам, включая максимальный квантовый выход ФС II (FV/FM), индекс производительности ФС II (PIABS) и степень рассеивания поглощенной световой энергии в тепло (DI0/RC). Аналогичные тенденции мы наблюдали, анализируя влияние УФ-В на скорость фотосинтеза (рис. 1г). По-видимому, дефицит криптохромов приводит к наиболее высокой чувствительности ФА растений cry1cry2, выращенных на СС, по сравнению с БС, где доля СС в спектре люминесцентных ламп меньше в несколько раз, чем в излучении синих светодиодов. Гораздо большее ингибирование cry1cry2 по сравнению с ДТ у растений СС, вероятно, связано со значительно меньшим содержанием УФПП у cry1cry2 по сравнению с ДТ (рис. 3). При этом у ДТ и cry1cry2 растений, выращенных на КС, разница по степени ингибирования активности ФС II отсутствовала, что, видимо, связано с отсутствием активности криптохромов.
У растений, выращенных на СС, активность каталазы и пероксидазы у ДТ была заметно выше, чем у cry1cry2 (рис. 4). Аналогичная тенденция сохранялась и после облучения УФ. Наряду с этим мы наблюдали значительно меньшее содержание УФПП у cry1cry2, которое сохранялось после облучения (рис. 3). Отмеченные факты могут объяснять пониженную устойчивость к УФ-В ФА у cry1cry2, выращенных на СС, по сравнению с ФА у ДТ.
На БС активность пероксидазы после облучения УФ-В у ДТ возрастала, а у мутанта снижалась. По-видимому, это является причиной увеличения содержания Н2О2 у cry1cry2 и уменьшения у ДТ (рис. 4).
Хотя мы не наблюдали разницы по содержанию пигментов (Хл и каротиноиды) у ДТ и cry1cry2, выращенных на СС, (табл. 1), тем не менее ФС II мутанта была более чувствительна к УФ-В-радиации. Вероятно, это объясняется повышенным содержанием УФПП и высокой активностью антиоксидантных ферментов у ДТ по сравнению с cry1cry2. С учетом всех полученных данных можно предположить, что у мутанта потенциал антиоксидантной системы ниже, чем у ДТ, что вносит вклад в пониженную устойчивость cry1cry2 к УФ-В.
Сниженный уровень экспрессии гена, кодирующего синтез флавоноидов PAL, может объяснять более низкое содержание УФПП у мутанта cry1cry2 по сравнению с ДТ, а пероксидаз sAPX, tAPX – более низкую исходную пероксидазную активность у мутанта по сравнению с ДТ (рис. 3–5). Все это может обуславливать сниженную активность ФС II у мутанта, выращенного на СС. При выращивании растений на БС не наблюдали такого снижения содержания УФПП и активности ферментов, как на СС, в результате чего не отмечено снижения активности ФС II при выращивании на БС.
Дефицит криптохромов 1 и 2 у растений, выращенных на БС, не приводит к снижению активности ФС II, однако дефицит криптохромов на СС сопровождается также сниженным уровнем экспрессии гена HY2, который отвечает за биосинтез фермента фитохромобилинсинтазы, ключевого для биосинтеза хромофора фитохрома – фитохромобилина. По-видимому, этим двойным дефицитом фоторецепторов объясняется пониженная фотосинтетическая активность у мутанта cry1cry2, выращенного на СС.
ЗАКЛЮЧЕНИЕ
Мы показали, что устойчивость ФА A. thaliana к кратковременному облучению УФ-В при выращивании на СС значительно выше у ДТ растений по сравнению с мутантом с дефицитом криптохромов 1 и 2, но не отличается у растений, выращенных на БС и КС. Этот результат соответствует активности криптохромов, которая максимальна на СС, но отсутствует на КС. Растения БС занимают промежуточное положение.
Новым результатом является обнаруженная нами гораздо большая разница по устойчивости к УФ-В у растений ДТ и мутанта cry1cry2, выращенных на СС, по сравнению с растениями на БС. Эта разница предполагает, что как криптохром 1, так и криптохром 2 важны для поддержания устойчивости к УФ-радиации при выращивании растений при высокой доле СС.
Более высокая стрессоустойчивость ФА к УФ-В у ДТ по сравнению с мутантом cry1cry2 объясняется, вероятно, более высоким содержанием пигментов, поглощающих УФ-В, и/или повышенной активностью ферментов, таких, как пероксидаза и каталаза.
Работа поддержана грантом Российского фонда фундаментальных исследований №18-34-00613 мол_а.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Berry J., Bjorkman O. Photosynthetic response and adaptation to temperature in higher plants // Annu. Rev. Plant Physiol. 1980. V. 31. P. 491. https://doi.org/10.1146/annurev.pp.31.060180.002423
Креславский В.Д., Карпентиер Р., Климов В.В., Мурата Н., Аллахвердиев С.И. Молекулярные механизмы устойчивости фотосинтетического аппарата к стрессу // Биологические мембраны. 2007. Т. 24 (3). С. 195.
Casal J.J. Phytochromes, cryptochromes, phototropin: photoreceptor interactions in plants // Photochem. Photobiol. 2000. V. 71. P. 1. https://doi.org/10.1562/0031-8655(2000)0710001PCPPII2.0.CO2
Kreslavski V.D., Los D.A., Schmitt F.J., Zharmukhamedov S.K., Kuznetsov V.V., Allakhverdiev S.I. The impact of the phytochromes on photosynthetic processes // BBA – Bioenergetics. 2018. V. 1859. P. 400. https://doi.org/10.1016/j.bbabio.2018.03.003
Voitsekhovskaja O.V. Phytochromes and other (photo) receptors of information in plants // Russ. J. Plant Physiol. 2019. V. 66. P. 351. https://doi.org/10.1134/S1021443719030154
D’Amico-Damião V., Carvalho R.F. Cryptochrome-related abiotic stress responses in plants // Front. Plant Sci. 2018. V. 9. P. 1897. https://doi.org/10.3389/fpls.2018.01897
Banerjee R., Batschauer A. Plant blue-light receptors // Planta. 2005. V. 220. P. 498. https://doi.org/10.1007/s00425-004-1418-z
Hoffmann A.M., Noga G., Hunsche M. High blue light improves acclimation and photosynthetic recovery of pepper plants exposed to UV stress // Environ. Exp. Bot. 2015. V. 109. P. 254. https://doi.org/10.1016/j.envexpbot.2014.06.017
Wade H.K., Bibikova T.N., William J.V., Jenkins G.I. Interactions within a network of phytochrome, cryptochrome and UV-B phototransduction pathways regulate chalcone synthase gene expression in Arabidopsis leaf tissue // Plant J. 2001. V. 25. P. 675. https://doi.org/10.1046/j.1365-313x.2001.01001.x
Kleine T., Kindgren P., Benedict C., Hendrickson L., Strand A. Genome-wide gene expression analysis reveals a critical role for cryptochrome1 in the response of Arabidopsis to high irradiance // Plant Physiol. 2007. V. 144. P. 1391. https://doi.org/10.1104/pp.107.098293
Lin C., Todo T. Cryptochromes // Genome Biol. 2005. V. 6. P. 220. https://doi.org/10.1186/gb-2005-6-5-220
Khudyakova A.Y., Kreslavski V.D., Shmarev A.N., Lyubimov V.Y., Shirshikova G.N., Allakhverdiev S.I., Pashkovskiy P.P., Kuznetsov V.V. Impact of UV-B radiation on the photosystem II activity, pro-/antioxidant balance and expression of light-activated genes in Arabidopsis thaliana hy4 mutants grown under light of different spectral composition // J. Photochem. Photobiol. B, Biol. 2019. V. 194. P. 14. https://doi.org/10.1016/j.jphotobiol.2019.02.003
Mubarakshina M.M., Ivanov B.N., Naidov I.A., Hillier W., Badger M.R., Krieger Liszkay A. Production and diffusion of chloroplastic H2O2 and its implication to signaling // J. Exp. Bot. 2010. V. 61. P. 3577. https://doi.org/10.1093/jxb/erq171
Schmitt F.-J., Renger G., Friedrich T., Kreslavski V.D., Zharmukhamedov S.K., Allakhverdiev S.I., Los D.A., Kuznetsov V.V. Reactive oxygen species: re-evaluation of generation, monitoring and role in stress-signaling in phototrophic organisms // BBA – Bioenergetics. 2014. V. 1837. P. 835. https://doi.org/10.1016/j.bbabio.2014.02.005
Szymanska R., Slesak I., Orzechowska A., Kruk J. Physiological and biochemical responses to high light and temperature stress in plants // Environ. Exp. Bot. 2017. V. 139. P. 65. https://doi.org/10.1016/j.envexpbot.2017.05.002
Гольцев В.Н., Каладжи Х.М., Паунов М., Баба В., Хорачек Т., Мойски Я., Коцел Х., Аллахвердиев С.И. Использование переменной флуоресценции хлорофилла для оценки физиологического состояния фотосинтетического аппарата растений // Физиология растений. 2016. Т. 63. С. 881. https://doi.org/10.7868/S0015330316050055
Mirecki R.M., Teramura A.H. Effect of ultraviolet B irradiance on Soybean. V. The dependence of plant sensitivity on photosynthesis flux density during and after leaf expansion // Plant Physiol. 1984. V. 74. P. 475. https://doi.org/10.1104/pp.74.3.475
Lichtenthaler H.K., Wellburn A.R. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes // Methods Enzymol. 1987. V. 148. P. 350. https://doi.org/10.1016/0076-6879(87)48036-1
Bania I., Mahanta R. Evaluation of peroxidases from various plant sources // IJSRP. 2012. V. 2. P. 1.
Chance B., Maehly A.C. Assay of catalases and peroxidases // Method Enzymol. 1955. V. 2. P. 764. https://doi.org/10.1002/9780470110171.ch14
Radyukina N.L., Mapelli S., Ivanov Y.V., Kartashov A.V., Brambilla I., Kuznetsov V.V. Homeostasis of polyamines and antioxidant systems in roots and leaves of Plantago major under salt stress // Russ. J. Plant Physiol. 2009. V. 56. P. 323. https://doi.org/10.1134/S1021443709030042
Любимов В.Ю., Застрижная О.М. Роль перекиси водорода в фотодыхании C4-растений // Физиология растений. 1992. Т. 39. С. 701.
Cormier M.J., Prichard P.M. An investigation of the mechanism of the luminescent peroxidation of luminol by stopped flow techniques // J. Biol. Chem. 1968. V. 243. P. 4706. https://doi.org/10.1016/S0021-9258(18)93176-5
Martirosyan Y.T., Polyakova M.N., Dilovarova T.A., Kosobryukhov A.A. Photosynthesis and productivity of potato plants in the conditions of different spectral irradiation // Agric Biol. 2013. V. 1. P. 107.
Gutierrez L., Mauriat M., Guénin S., Pelloux J., Lefebvre J.F., Louvet R., Rusterucci C., Moritz T., Guerineau F., Bellini C., Van Wuytswinkel O. The lack of a systematic validation of reference genes: a serious pitfall undervalued in reverse transcription-polymerase chain reaction (RT-PCR) analysis in plant // Plant Biotech. J. 2008. V. 6. P. 609. https://doi.org/10.1111/j.1467-7652.2008.00346.x
Kadur G., Swapan B., Kataria S., Sanjeev Y., Arjun T., Sanjay B., Abhinav R., Mohanty P. Growth enhancement of soybean (Glycine max) upon exclusion of UV-B and UV-B/A components of solar radiation: characterization of photosynthetic parameters in leaves // Photosynth. Res. 2007. V. 94. P. 299. https://doi.org/10.1007/s11120-007-9190-0
Kataria S., Jajoo A., Guruprasad K.N. Impact of increasing Ultraviolet-B (UV-B) radiation on photosynthetic processes // J. Photochem. Photobiol. B. 2014. V. 137. P. 55–66. https://doi.org/10.1007/978-3-319-13368-3_3
Kosobryukhov A.A., Lyubimov V.Yu., Kreslavski V.D. Adaptive mechanisms of photosynthetic apparatus to UV radiation // Stress responses in plants. Mechanisms of toxicity and tolerance / Eds. Tripathi B.N., Müller M. Switzerland: Springer International Publishing. 2015. Ch. 3. P. 59–78. https://doi.org/10.1016/j.jphotobiol.2014.02.004
Tevini M., Braun J., and Fieser G. The protective function of the epidermal layer of rye seedlings against ultraviolet-B radiation // Photochem. Photobiol. 1991. V. 53. P. 329. https://doi.org/10.1111/j.1751-1097.1991.tb03636.x
Bharti A.K., Khurana J.P. Mutants of Arabidopsis as tools to understand the regulation of phenylpropanoid pathway and UV-B protection mechanisms // Photochem. Photobiol. 1997. V. 65. P. 765. https://doi.org/10.1111/j.1751-1097.1997.tb01923.x
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений



