Физиология растений, 2022, T. 69, № 3, стр. 297-305
Влияние ауксинов и цитокининов на ростовые и биосинтетические характеристики суспензионной культуры клеток Tribulus terrestris L.
А. Г. Клюшин a, *, С. В. Томилова a, Д. В. Кочкин a, b, Б. А. Галишев c, А. М. Носов a, b, **
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К. А. Тимирязева Российской академии наук
Москва, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
c Федеральное государственное автономное образовательное учреждение высшего образования
“Уральский федеральный университет имени первого Президента России Б. Н. Ельцина”
Екатеринбург, Россия
* E-mail: andreyklyushin@list.ru
** E-mail: al_nosov@mail.ru
Поступила в редакцию 11.10.2021
После доработки 19.10.2021
Принята к публикации 19.10.2021
- EDN: FODMEX
- DOI: 10.31857/S0015330322020075
Аннотация
Продолжен цикл работ по изучению влияния синтетических фитогормонов на ростовые и биосинтетические параметры суспензионной культуры клеток якорцев стелющихся Tribulus terrestris L., и исследовано влияние цитокининов на эти характеристики. В дополнение к ранее полученным результатам об альтернативном действии двух аналогов ауксинов – 2,4-Д и α-НУК (первый из них активирует рост клеток in vitro, но тормозит образование стероидных гликозидов, второй – вызывает цитодифференцировку, приводящую к замедлению и остановке роста культуры, но активирует образование вторичных соединений), показано, что природа цитокинина и его концентрация может модулировать действие этих ауксинов. Установлено, что после перевода культуры с “ростовой” среды (содержащей 2,4-Д) на среду с α-НУК и различным составом цитокининов (БАП или кинетин в различных концентрациях) она сохраняет способность к активному росту в течение как минимум 3 циклов выращивания. Затем, при неоптимальной комбинации фитогормонов, культура клеток перестает расти и погибает. Однако при определенном составе регуляторов роста в питательной среде (1 или 2 мг/л α-НУК + 1 мг/л кинетина) после длительной лаг-фазы (12–18 суток) рост культуры возобновляется и впоследствии возможно ее длительное культивирование. На среде с 2 мг/л α-НУК и 1 мг/л кинетина суспензию T. terrestris поддерживали в течение 70 циклов выращивания без ухудшения ростовых характеристик (максимальный уровень накопления сухой биомассы Mmax – 12–16 г/л, индекс роста I – 13–18, удельная скорость роста μ – 0.18–0.28 сут–1). Содержание стероидных гликозидов в клетках при этом не опускалось ниже 0.2–0.3% к сухой биомассе. С использованием метода UPLC-ESI-MS показано наличие в клеточной биомассе как минимум 4 стероидных гликозидов фуростанолового ряда – производных гидрокси-диосгенина и тигогенина/неотигогенина. Полученные результаты подтверждают общие закономерности развития популяций клеток in vitro и важны для оптимизации ростовых и биосинтетических характеристик культур клеток высших растений.
ВВЕДЕНИЕ
В современном мире постоянно растет интерес к использованию биологически активных веществ растений как основных составляющих фармпрепаратов, пищевых добавок, косметических и парфюмерных средств. На данный момент из растений получают порядка трети всех лекарственных субстанций, используемых в медицинской практике [1].
Крайне часто ценные лекарственные растения относятся к редким и эндемичным видам, к тому же для интактных растений (дикорастущих и плантационных) характерен нестабильный химический состав и высокая вероятность естественного (связано с природными процессами) и антропогенного (техногенного) загрязнения, зависящие от условий произрастания [2]. Поэтому поиск альтернативных источников экологически чистого возобновляемого растительного сырья с высоким содержанием целевых веществ является весьма актуальной проблемой. Перспективным вариантом решения этой проблемы может быть использование культур клеток высших растений, но применение данного подхода ограничено из-за трудностей в получении штамма-продуцента с удовлетворительными ростовыми и биосинтетическими характеристиками [3].
Якорцы стелющиеся Tribulus terrestris L. (Zygophyllaceae R.Br.) синтезируют более сотни различных стероидных гликозидов как спиростанолового, так и фуростанолового ряда. Кроме того, растения T. terrestris также накапливают множество флавоноидов, протоалкалоидов, истинных алкалоидов и некоторые другие группы вторичных метаболитов. Благодаря своему богатому химическому составу, препараты и экстракты на основе T. terrestris обладают высокой биологической активностью и используются при лечении сердечно-сосудистых заболеваний, атеросклероза общих, церебральных и коронарных сосудов и для коррекции половой дисфункции у мужчин и женщин [4, 5].
Ранее нами были получены каллусная и суспензионная культуры клеток якорцев стелющихся, определены их ростовые параметры и показано наличие в клетках in vitro двух стероидных гликозидов фуростанолового ряда. В недавних исследованиях было изучено влияние ряда химических факторов – изменение состава синтетических регуляторов роста ауксиновой природы, а также стрессовое воздействие (повышенные концентрации ионов меди) на ростовые и биосинтетические характеристики суспензионной культуры клеток T. terrestris. Было показано, что на средах, содержащих в качестве регулятора роста с ауксиновой активностью 2,4-Д (2,4-дихлорфеноксиуксусную кислоту), наблюдается интенсивный рост культуры, но содержание вторичных метаболитов (стероидных гликозидов) снижается до весьма малых значений (не более 0.1–0.2% к сухой массе клеток). Замена в среде выращивания 2,4-Д на α-НУК (α-нафтилуксусную кислоту) приводит к существенному повышению уровня содержания стероидных гликозидов и расширяет их качественный состав. Однако на средах с α-НУК наблюдается изменение морфологии клеток, увеличение степени их агрегированности и постепенное снижение жизнеспособности культуры вплоть до ее гибели. Совместное присутствие в среде 2,4-Д и α-НУК приводило к увеличению содержания стероидных гликозидов, но в меньшей степени чем на средах только с α-НУК, − с сохранением удовлетворительных ростовых характеристик культуры и высокой жизнеспособности клеток. Стрессовое воздействие на суспензионную культуру T. terrestris (высокие концентрации ионов меди в среде) серьезно не ухудшало ростовые характеристики клеток in vitro, но увеличивало накопление стероидных гликозидов без изменения их качественного состава [6–8].
Целью настоящей работы явилось исследование влияния регуляторов роста с цитокининовой активностью на ростовые и биосинтетические характеристики суспензионной культуры клеток Tribulus terrestris.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования была использована суспензионная культура клеток якорцев стелющихся Tribulus terrestris L. (штамм Tter 8 коллекционный №81 во Всероссийской коллекции культур клеток высших растений (ВККК ВР)), которая была получена М.Т. Ханды с коллегами в Институте физиологии растений им. К.А. Тимирязева РАН в 2014 г. [6].
Для культивирования суспензионной культуры применяли питательную среду с минеральной основой по Мурасиге и Скугу (MS) [9], с добавлением гидролизата казеина (0.5 г/л), инозитола (0.1 г/л) и 3% сахарозы (“Merck”, Германия). Для экспериментов использовали среды с разными сочетаниями регуляторов роста: 2,4-Д, α-НУК, 6‑бензиламинопурин (БАП) и кинетин (“Merck”, Германия). Диапазон концентраций ауксинов и цитокининов в средах составил от 0 до 9.0 мг/л.
Выращивание проводили в конических стеклянных колбах объемом 250 мл (30 мл суспензии в колбе) или 100 мл (12 мл суспензии в колбе) в темноте, при скорости вращения качалки 100 об/мин, температура в камере 26 ± 0.1°C, влажность 60–70%. Пересадку осуществляли на 14 сутки выращивания, соотношение инокулюм/свежая среда – 1/10.
Для характеристики роста суспензионной культуры на разных средах использовали содержание сырой и сухой биомассы в 1 л среды. Для определения сырой и сухой биомассы пробу суспензии клеток (содержимое одной колбы, 12–30 мл) отфильтровывали на воронке Бюхнера через бумажный фильтр под вакуумом [10]. Высушивание биомассы проводили методом сублимационного обезвоживания.
На основании полученных результатов вычисляли параметры роста суспензионной культуры, такие как индекс роста (I) и удельная скорость роста (μ). Для расчетов использовали следующие формулы [10]:
I = Xmax/X0, где Xmax и X0 – максимальное и начальное значения критерия роста соответственно (сухая масса клеток).
µ = (lnХ2 – lnХ1)/(t2 – t1), где Х2 и Х1 – значения критерия роста (сухая масса клеток) в момент времени t2 и t1 соответственно (рассчитывали для экспоненциальной фазы роста).
Микрофотографии суспензионной культуры клеток сделаны на оптическом микроскопе PZO SK14 (Польша) с помощью цифровой камеры Toupcam UCMOS14000KPA 14.0 Мпикс (Китай).
Для качественного анализа стероидных гликозидов в исследуемых вариантах суспензионной культуры клеток использовали ультраэффективную жидкостную хроматографию с масс-спектрометрическим детектированием при ионизации электрораспылением (UPLC-ESI-MS). Методика UPLC-ESI-MS анализа опубликована ранее [8].
Общую экстракцию стероидной фракции проводили из лиофилизированной биомассы 70% этанолом (соотношение биомасса : растворитель – 1 : 40 (масса : объем)) на ультразвуке 3 раза по 30 мин при комнатной температуре (УЗ-ванна “Сапфир”, Россия). Объединенный экстракт упаривали досуха под вакуумом при 55°С и растворяли в воде. Полученный раствор наносили на патрон для твердофазной экстракции Supelclean ENVI-18 (“Supelco”, США). Затем патрон последовательно промывали водой и 70% этанолом. Полученный спиртовой экстракт упаривали досуха под вакуумом при 55°С и использовали для химического анализа.
Для количественного анализа стероидных гликозидов фуростанолового ряда применяли спектрофотометрический метод. 0.4 мл спиртового экстракта отбирали в пробирки Эппендорф и добавляли 1.0 мл реактива Эрлиха (1% раствор п-диметиламинобензальдегида в смеси концентрированная соляная кислота : этанол – 34 : 66, по объему). Пробирки закрывали и помещали в термостат при 60 ± 1°С на 1 ч. После охлаждения пробирок проводили измерение оптической плотности на спектрофотометре СФ-26 (ЛОМО, Россия) при 520 нм. Концентрацию фуростаноловых гликозидов вычисляли по калибровочному графику, построенному по препарату “Дельтостим” (смесь фуростаноловых гликозидов, выделенных из биомассы культуры клеток Dioscorea deltoidea Wall.).
Определение ростовых характеристик (содержание сырой и сухой биомассы) проводили в 2–3 биологических повторностях. Для спектрофотометрического метода анализа погрешность прибора при измерении оптической плотности была не более 0.5%. Анализ данных проводили с помощью программы Excel, входящей в состав офисного пакета приложений Microsoft Office 2010.
РЕЗУЛЬТАТЫ
Для выяснения роли регуляторов роста с цитокининовой активностью на физиолого-биохимические характеристики суспензионной культуры клеток Tribulus terrestris культуру, выращиваемую на стандартной среде (содержащей в качестве регуляторов роста 2 мг/л 2,4-Д и 1 мг/л БАП) перевели на среды с различными комбинациями синтетических ауксинов (2,4-Д, α-НУК) и цитокининов (БАП, кинетин) (табл. 1).
Таблица 1.
Характеристики роста (3 цикл культивирования после перевода культуры со стандартной среды) и содержание фуростаноловых гликозидов (ФГ) в суспензионной культуре клеток T. terrestris при выращивании на средах с различными комбинациями регуляторов роста
| Содержание регуляторов роста в среде | Ростовые параметры, 3 цикл после смены среды |
Содержание ФГ в сухой биомассе, % | ||||
|---|---|---|---|---|---|---|
| Ауксины | Цитокинины | I | μ, сут–1 | Mmax, г/л | 2 цикл | 3 цикл |
| 2 мг/л 2,4-Д | 1 мг/л БАП | 14.1 ± 0.7 | 0.28 ± 0.01 | 9.9 ± 0.5 | 0.20 ± 0.01 | 0.12 ± 0.01 |
| 2 мг/л α-НУК | 1 мг/л БАП | 13.3 ± 0.7 | 0.27 ± 0.01 | 13.3 ± 0.7 | 0.38 ± 0.02 | <0.02 |
| 1 мг/л α-НУК | 1 мг/л кинетина | 12.0 ± 0.6 | 0.21 ± 0.01 | 10.8 ± 0.5 | 0.48 ± 0.02 | 0.30 ± 0.02 |
| 1 мг/л α-НУК | 3 мг/л кинетина | 11.3 ± 0.6 | 0.19 ± 0.01 | 13.6 ± 0.7 | <0.02 | 0.22 ± 0.01 |
| 1 мг/л α-НУК | 6 мг/л кинетина | 12.0 ± 0.6 | 0.17 ± 0.01 | 14.4 ± 0.7 | <0.02 | 0.27 ± 0.01 |
| 1 мг/л α-НУК | 9 мг/л кинетина | 12.4 ± 0.6 | 0.26 ± 0.01 | 14.9 ± 0.7 | 0.24 ± 0.01 | 0.33 ± 0.02 |
| − | 1 мг/л кинетина | 4.6 ± 0.2 | 0.27 ± 0.01 | 4.4 ± 0.2 | 0.24 ± 0.01 | 0.17 ± 0.01 |
| 2 мг/л α-НУК | 1 мг/л кинетина | 6.4 ± 0.3 | 0.30 ± 0.02 | 6.3 ± 0.3 | 0.82 ± 0.04 | 0.24 ± 0.01 |
| 4 мг/л α-НУК | 1 мг/л кинетина | 7.2 ± 0.4 | 0.32 ± 0.02 | 6.0 ± 0.3 | 0.25 ± 0.01 | 0.27 ± 0.01 |
| 8 мг/л α-НУК | 1 мг/л кинетина | 4.8 ± 0.2 | 0.32 ± 0.02 | 5.7 ± 0.3 | <0.02 | <0.02 |
Установлено, что после перевода культуры на экспериментальные варианты сред, она во всех случаях сохраняет способность к активному росту в течение как минимум 3 циклов выращивания. На рис. 1 представлены кривые роста в полулогарифмической системе координат для пяти из исследованных вариантов. При этом на средах, содержащих кинетин и высокие концентрации α-НУК (2–8 мг/л) или при отсутствии ауксинов, к третьему циклу выращивания можно отметить существенное снижение ростовых параметров (индекса роста, максимального накопления биомассы – табл. 1).
Рис. 1.
Динамика роста (накопление сухой биомассы) в полулогарифмической системе координат суспензионной культуры клеток T. terrestris на средах с 2 мг/л 2,4-Д – 1 мг/л БАП (а), 2 мг/л α-НУК – 1 мг/л БАП (б), 1 мг/л α-НУК – 1 мг/л кинетина (в), 2 мг/л α-НУК – 1 мг/л кинетина (г) и 1 мг/л кинетина – без ауксинов (д). Чередующимся затемнением выделено начало и окончание каждого индивидуального цикла.
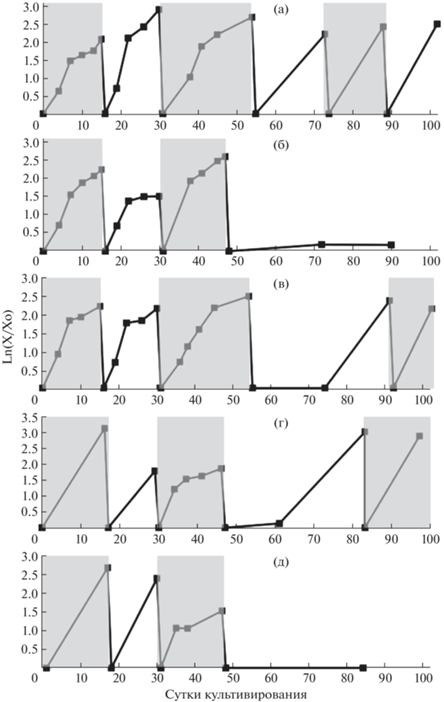
После трех циклов выращивания на большинстве экспериментальных вариантов сред (семи из девяти исследованных) культура клеток T. terrestris перестает расти и в результате погибает. Однако при определенном составе регуляторов роста в питательной среде (1 или 2 мг/л α-НУК + 1 мг/л кинетина) после длительной лаг-фазы (12–18 суток) рост культуры возобновляется (рис. 1в, 1г), после чего возможно ее длительное субкультивирование. На одном из этих вариантов сред (2 мг/л α-НУК и 1 мг/л кинетина) культуру клеток T. terrestris выращивали более двух лет, при этом она сохраняла высокие ростовые характеристики (максимальный уровень накопления сухой биомассы (Mmax) 12– 16 г/л, индекс роста (I) 13–18, удельная скорость роста (μ) 0.18–0.28 сут–1). Кривые роста культуры клеток T. terrestris на среде, содержащей 2 мг/л α-НУК и 1 мг/л кинетина после почти 3 лет субкультивировния на этой среде (68 цикл выращивания) представлены на рис. 2.
Рис. 2.
Кривая роста (накопление сухой биомассы) суспензионной культуры T. terrestris на среде с 2 мг/л α-НУК и 1 мг/л кинетина в стандартной (а) и полулогарифмической (б) системе координат (68-й цикл выращивания после перевода со стандартной среды культивирования, содержащей 2 мг/л 2,4-Д и 1 мг/л БАП).
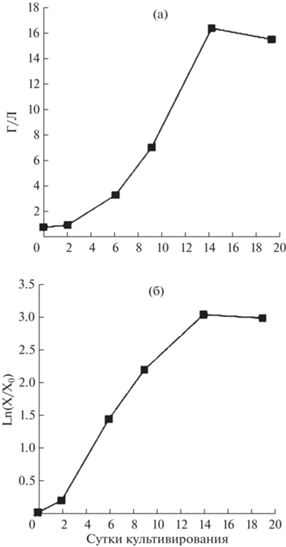
Анализируя полученные результаты, можно предположить, что после изменения состава среды культура клеток в течение нескольких (2–4) циклов выращивания поддерживает рост за счет использования “остаточных” количеств регуляторов роста исходной среды. В это время происходит изменение популяции за счет отбора клеток, способных пролиферировать в условиях измененной композиции регуляторов роста. После формирования жизнеспособной популяции возобновляется рост культуры, при невозможности отбора таких клеток – популяция погибает.
Для подтверждения изложенного варианта объяснения полученных результатов, был проведен цитологический анализ клеток T. terrestris при выращивании на разных средах. Показано, что при использовании стандартной среды выращивания с 2 мг/л 2,4-Д и 1 мг/л БАП клетки in vitro в популяции выявляются как небольшие агрегаты клеток, состоящие из мелких округлых меристемоподобных клеток, так и в виде гигантских цилиндровидных клеток. Длина этих клеток относится к ширине как 4 : 1 и их доля в клеточной популяции составляет не менее 65–70%. Также встречаются единичные паренхимоподобные овальные клетки размером 40–50 мкм. Центральную часть клеток занимает центральная вакуоль, которую пронизывают цитоплазматические тяжи. Вакуоль не содержит видимых включений. Ядро расположено либо в цитоплазматических тяжах, либо занимает пристенное положение (рис. 3а). При замене в среде ауксинов (с 2,4-Д на α-НУК; среда содержит 2 мг/л α-НУК и 1 мг/л БАП) наблюдаются значительные морфологические и структурные перестройки состава популяции клеточной культуры T. terrestris. При выращивании на этой среде культура представлена преимущественно агрегатами меристемоподобных и/или паренхимоподобных округлых клеток. Часто агрегаты имеют вид закрученных “улиток” и складывается впечатление, что они формируются из гигантских клеток, которые приступили к активной цитотомии. Цитоплазма в клетках более плотная, крупные вакуоли отсутствуют, ядра не просматриваются, однако выявляются многочисленные мелкие темноокрашенные кольцевидные включения, располагающиеся в цитоплазме хаотично (рис. 3б). При изменении в среде регуляторов роста как ауксиновой, так и цитокининовой природы (среда с 2 мг/л α-НУК и 1 мг/л кинетина) в суспензии преобладают одиночные крупные овальные паренхимоподобные клетки, которые по общему плану строения аналогичны выращенным на стандартной среде (рис. 3б). В популяции присутствует незначительное количество “гигантских” клеток. Учитывая, что в случае использования среды с 2 мг/л α-НУК и 1 мг/л БАП, культура клеток не способна расти более 3–4 циклов, то, вероятно, данные структурные перестройки в популяции клеток и морфологические изменения клеток оказывают существенное влияние на ростовые процессы суспензии. В пользу этого предположения свидетельствует также то, что в предыдущей работе при культивировании суспензионной культуры клеток T. terrestris на среде с 1 мг/л 2,4-Д, 1 мг/л α-НУК и 1 мг/л БАП было показано увеличение агрегированности клеток без формирования внутриклеточных включений и в этой ситуации наблюдался стабильный и хороший рост культуры на протяжении более 5 циклов выращивания [8]. Таким образом установлено, что изменения в составе регуляторов роста оказывают значительное влияние на цитофизиологические особенности культуры клеток.
Рис. 3.
Микрофотографии суспензионной культуры клеток T. terrestris на средах с разным составом регуляторов роста: (а) – 2 мг/л 2,4-Д и 1 мг/л БАП; (б) – 2 мг/л α-НУК и 1 мг/л БАП; (в) – 2 мг/л α-НУК и 1 мг/л кинетина.

Во время 2-го и 3-го цикла культивирования после перевода культуры на среды с разными концентрациями ауксинов и цитокининов был выполнен количественный анализ содержания фуростаноловых гликозидов (ФГ) в клеточной биомассе (табл. 1). Проведенный анализ показал, что практически для всех вариантов уровень содержания ФГ находился в пределах 0.2–0.8% к сухой биомассе. Фуростаноловые гликозиды не были обнаружены в варианте с максимальной концентрацией α-НУК в среде, а также во время второго цикла выращивания культуры клеток на средах с 3 и 6 мг/л кинетина. Максимальное содержание ФГ было отмечено для культур, выращиваемых на вариантах сред, способных поддерживать рост культуры клеток в течение длительного времени – 0.8% к сухой биомассе на среде с 2 мг/л α-НУК и 1 мг/л кинетина, и 0.5% − для среды с 1 мг/л α-НУК и 1 мг/л кинетина. Для культуры клеток, выращиваемой на контрольной среде (2 мг/л 2,4-Д и 1 мг/л БАП) содержание фуростаноловых гликозидов было в пределах 0.1 –0.2%. Уровень накопления стероидных гликозидов в биомассе клеток выращиваемой в течение трех лет (более 70 циклов субкультивирования) суспензионной культуре T. terrestris на среде с 2 мг/л α-НУК и 1 мг/л кинетина не опускался ниже 0.2–0.3% к сухой биомассе.
Для суспензионной культуры клеток T. terrestris длительно выращиваемой на среде с 2 мг/л α-НУК и 1 мг/л кинетина с целью структурной идентификации фуростаноловых гликозидов был проведен UPLC-ESI-MS анализ [7]. UPLC-ESI-MS хроматограмма (записана в режиме полного ионного тока при регистрации положительных ионов) очищенных экстрактов из биомассы клеток T. terrestris (68 цикл культивирования, 21 сутки выращивания) представлена на рис. 4. Идентификацию соединений проводили на основании расшифровки результатов масс-спектрометрии (фрагментации протонированных молекул гликозидов в источнике ионизации), анализа относительного хроматографического поведения соединений и сопоставления этих результатов с данными литературы [8, 11, 12].
Рис. 4.
UPLC-ESI-MS-хроматограмма (записана в режиме полного ионного тока при регистрации положительных ионов) экстракта из биомассы суспензионной культуры клеток T. terrestris на среде с 2 мг/л α-НУК и 1 мг/л кинетина (68 цикл, 21 сутки выращивания). Номера 1–4 – пики идентифицированных гликозидов (табл. 2).

В общей сложности в биомассе суспензионной культуры клеток якорцев стелющихся, выращенной на среде с 2 мг/л α-НУК и 1 мг/л кинетина было выявлено 4 стероидных гликозида фуростанолового типа (табл. 2). В соответствии с порядком увеличения гидрофобности (времени удерживания на обращенной фазе хроматографической колонки) обнаруженные гликозиды обозначены номерами 1 – 4.
Таблица 2.
Результаты UPLC-ESI-MS анализа (регистрация положительных ионов) экстракта из биомассы суспензионной культуры клеток T. terrestris, выращенной на среде с 2 мг/л α-НУК и 1 мг/л кинетина (68 цикл, 21 сутки выращивания) (номера хроматографических пиков соответствуют таковым на рис. 4)
| Номер пика | tR, мин* | Масс-спектры, m/z** | Результаты идентификации | ||
|---|---|---|---|---|---|
| [M–H2O + H]+ | [M + Na]+ | Осколочные ионы | |||
| 1 | 1.03 | 1241.6 | – | 1079.5, 917.5, 755.4, 593.4, 431.3 | Пентагексозил-гидрокси-диосгенин (фуростаноловая форма) |
| 2 | 6.35 | 1227.6 | – | 1065.6, 903.5, 741.4, 579.4, 417.3 | Гексозил-25(R)- террестрозин H |
| 3 | 8.42 | 1049.5 | 1089.5 | 903.5, 887.5, 741.4, 725.4, 579.4, 417.3 | 25(S)-прототеррестрозин B |
| 4 | 8.60 | 1049.5 | – | 903.5, 887.5, 741.4, 579.4, 417.3 | 25(R)-прототеррестрозин B |
В качестве агликонов обнаруженных гликозидов выступают фуростаноловые формы производных следующих стероидов [8, 11, 12]: гидрокси-диосгенин (характеристический ион – m/z 431; гликозид 1) и тигогенин/неотигогенин (характеристический ион – m/z 417; гликозиды 2−4).
ОБСУЖДЕНИЕ
На основании полученных в ходе исследования результатов можно заключить, что оптимизация химических (изменение состава и соотношения синтетических регуляторов роста) условий культивирования суспензионной культуры T. terrestris способна оказывать значительное влияние на ее ростовые и биосинтетические характеристики.
Как уже было отмечено, в наших предыдущих работах было исследовано влияние регуляторов роста с ауксиновой активностью на рост культуры клеток якорцев и биосинтез стероидных гликозидов. Было показано, что при выращивании культуры клеток T. terrestris на средах, содержащих 2,4-Д наблюдается интенсивный рост культуры, но весьма низкая концентрация фуростаноловых гликозидов (не более 0.1–0.2% к сухой биомассе клеток). Замена в среде выращивания 2,4-Д на α-НУК приводила к повышению в культивируемых клетках как уровня содержания стероидных гликозидов (до 6 раз – 0.7% по сухой биомассе), так и к увеличению их структурного разнообразия (девять идентифицированных олигофуростанозидов на среде с α-НУК по сравнению с пятью на среде с 2,4-Д). Однако данные изменения сопровождались образованием крупных клеточных агрегатов и постепенным снижением (в течение 3–4 циклов выращивания) жизнеспособности культуры, вплоть до ее гибели. В то же время, совместное присутствие двух синтетических аналогов ауксинов (α-НУК и 2,4-Д) в среде выращивания также стимулировало увеличение содержания в клетках T. terrestris стероидных гликозидов – но в меньшей степени (примерно в 3 раза – до 0.3% по сухой биомассе), однако в этом случае культура имела относительно стабильный рост и высокую жизнеспособность [8]. Выявленные закономерности оказались практически идентичны обнаруженному ранее эффекту при аналогичной замене 2,4-Д на α-НУК для культуры клеток женьшеня Panax ginseng C.A.Mey. При этой замене также были отмечены изменения степени агрегированности клеток, снижение ростовых характеристик культуры, но расширялся качественный состав и повышалось количественное содержание тритерпеновых гликозидов (гинзенозидов) [13]. Подобные изменения, зафиксированы для культур клеток разных видов растений, указывают на противоположное влияние двух аналогов ауксинов на процессы пролиферации и дифференцировки клеток in vitro, что вполне подтверждается данными литературы [14, 15].
Столь существенное воздействие на физиолого-биохимические свойства культур клеток регуляторов роста ауксиновой природы сделало закономерным вопрос о влиянии на эти характеристики цитокининовых регуляторов роста.
Цитокинины участвуют в различных важнейших процессах жизнедеятельности растений, а также в регуляции многих ключевых генов. Они взаимодействуют сложным образом, контролируя множество аспектов, связанных с ростом, развитием и дифференцировкой, в том числе на клеточном уровне [16, 17]. Регуляторы роста цитокининовой природы имеют противоположные функции в меристемах корней и побегов. Известно, что разные цитокинины способны оказывать различное влияние на регенерацию побегов in vitro, к примеру, БАП был эффективен при увеличении числа побегов, тогда как кинетин активно стимулировал удлинение побегов [18, 19]. Стоит также отметить, что есть сведения о положительном влиянии кинетина на формирование мелкоагрегированной суспензионной культуры клеток масличной пальмы, которая впоследствии содержала хорошо делящиеся изодиаметрические клетки [20]. Несмотря на имеющиеся данные о влиянии цитокининов на ростовые процессы культур клеток, их роль в регуляции вторичного метаболизма в клетках in vitro исследована недостаточно.
Проведенное в настоящей работе исследование влияния синтетических аналогов ауксинов (2,4-Д, α-НУК) и цитокининов (БАП, кинетин) на рост суспензионной культуры T. terrestris показало, что при определенной комбинации не поддерживающего ростовые процессы ауксинового регулятора роста α-НУК с кинетином (а именно 1 или 2 мг/л α-НУК + 1 мг/л кинетина) удается получить длительный (не менее 3 лет) и стабильный рост культуры клеток якорцев. При этом для поддержания роста культуры важна не только структура цитокинина (кинетин, но не БАП), но и его концентрация и/или соотношение ауксин/цитокинин. На основе результатов работы можно предположить, что получение длительно растущей культуры клеток на измененной среде происходит за счет формирования новой популяции клеток, адаптированной к новым условиям культивирования.
Важно, что при длительном культивировании клеток на среде с α-НУК и кинетином содержание стероидных гликозидов в клетках было достаточно высоким (не менее 0.2 – 0.3% к сухой биомассе), что практически совпадает с характеристиками длительно выращиваемой культуры на среде с двумя ауксинами – α-НУК и 2,4-Д. При этом качественный состав обнаруженных фуростаноловых гликозидов также достаточно близок – идентифицированы 4 и 5 соединений соответственно. При использовании среды, не поддерживающей длительный рост культуры (2 мг/л α-НУК и 1 мг/л БАП) спектр соединений существенно богаче – отмечено образование как минимум 9 фуростаноловых гликозидов [8].
В настоящее время трудно судить, определяются ли полученные совпадения и/или различия в ростовых характеристиках и в составе и содержании стероидных гликозидов только следствием различных комбинаций ауксиновых и цитокининовых регуляторов роста или это связано с более общими популяционными механизмами развития уникальной биологической системы – культуры клеток высших растений.
Полученные результаты позволяют предположить, что изменение состава и концентрации регуляторов роста цитокининовой природы, как и в случае с синтетическими аналогами ауксинов, имеет существенное значение для оптимизации ростовых и биосинтетических характеристик культур клеток высших растений, однако для выявления конкретных механизмов данного явления требуются дополнительные исследования.
Работы по выращиванию культур клеток проводили при финансовой поддержке гранта Российского научного фонда (договор № 19-14-00387); фитохимические анализы выполнены на базе “Научно-производственного биотехнологического комплекса для проведения работ по изучению, сохранению и практическому применению культивируемых клеток и органов высших растений и микроводорослей” при финансовой поддержке Мегагранта Правительства Российской Федерации (Соглашение № 075-15-2019-1882).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Куркин В.А., Авдеева Е.В., Куркина А.В., Правдивцева О.Е., Браславский В.Б. Современная фитотерапия как наука и учебная дисциплина в медицинском и фармацевтическом образовании // Медицинский вестник Башкортостана. 2016. Т. 11. С. 149.
Хотим Е.Н., Жигальцов А.М., Кумара А. Некоторые аспекты современной фитотерапии // Журнал Гродненского государственного медицинского университета. 2016. Т. 3. С. 136.
Nosov A.M. Application of cell technologies for production of plant-derived bioactive substances of plant origin // Applied Biochemistry and Microbiology. 2012. V. 48. P. 609. https://doi.org/10.1134/S000368381107009X
Kostova I., Dinchev D. Saponins in Tribulus terrestris – chemistry and bioactivity // Phytochemistry Reviews. 2005. V. 4. P. 111. https://doi.org/10.1007/s11101-005-2833-x
Wu T.S., Shi L.S., Kuo S.C. Alkaloids and other constituents from Tribulus terrestris // Phytochemistry. 1999. V. 50. P. 1411. https://doi.org/10.1016/S0031-9422(97)01086-8
Ханды М.Т., Кочкин Д.В., Томилова С.В., Галишев Б.А., Суханова Е.С., Клюшин А.Г., Иванов И.М., Носов А.М. Получение и характеристика каллусных и суспензионных культур клеток якорцев стелющихся Tribulus terrestris L. – продуцента стероидных гликозидов // Биотехнология. 2016. Т. 32. С. 21. https://doi.org/10.1016/0234-2758-2016-32-4-21
Томилова С.В., Кочкин Д.В., Галишев Б.А., Носов А.М. Влияние повышенных концентраций ионов меди на ростовые характеристики и синтез стероидных гликозидов в суспензионной культуре клеток Tribulus terrestris L. // Биотехнология. 2019. Т. 35. С. 42. https://doi.org/10.21519/0234-2758-2019-35-3-42-49
Томилова С.В., Ханды М.Т., Кочкин Д.В., Галишев Б.А., Клюшин А.Г., Носов А.М. Влияние синтетических аналогов ауксинов – 2,4-Д и α-НУК – на ростовые и биосинтетические характеристики суспензионной культуры клеток Tribulus terrestris L. // Физиология растений. 2020. Т. 67. С. 389. https://doi.org/10.31857/S001533032004017X
Murashige T., Skoog F. A revised medium for rapid growth and bio-assays with tobacco tissue cultures // Physiologia Plantarum. 1962. V. 15. P. 473. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x
Носов А.М. Методы оценки и характеристики роста культур клеток высших растений // Молекулярно-генетические и биохимические методы в современной биологии растений / Под ред. Вл.В. Кузнецова, В.В. Кузнецова, Г.А. Романова. Москва: БИНОМ. Лаборатория знаний. 2012. С. 386.
Zheng W., Wang F., Zhao Y., Sun X., Kang L., Fan Z., Qiao L., Yan R., Liu S., Ma B. Rapid haracterization of Constituents in Tribulus terrestris from Different Habitats by UHPLC/Q-TOF MS // J. Am. Soc. Mass Spectrom. 2017. V. 28. P. 2302. https://doi.org/10.1007/s13361-017-1761-5
Mulinacci N., Vignolini P., la Marca G., Pieraccini G., Innocenti M., Vincieri F. F. Food supplements of Tribulus terrestris L.: An HPLC-ESI-MS method for an estimation of the saponin content // Chromatographia. 2003. V. 57. P. 581. https://doi.org/10.1007/BF02491733
Смоленская И.Н., Решетняк О.В., Смирнова Ю.Н., Черняк Н.Д., Глоба Е.Б., Носов А.М., Носов А.В. Противоположное влияние синтетических ауксинов – 2,4-дихлорфеноксиуксусной и 1-нафтилуксусной кислот на рост культуры клеток женьшеня настоящего и синтез гинзенозидов // Физиология растений. 2007. Т. 54. С. 243.
Campanoni P., Nick P. Auxin-dependent cell division and cell elongation. 1-naphthaleneacetic acid and 2,4-dichlorophenoxyacetic acid activate different pathways // Plant Physiol. 2005. V. 137. P. 939. https://doi.org/10.1104/pp.104.053843
Rao S.R., Ravishankar G.A. Plant cell cultures: Chemical factories of secondary metabolites // Biotechnology Advances. 2002. V. 20. P. 101. https://doi.org/10.1016/s0734-9750(02)00007-1
Werner T., Motyka V., Laucou V., Smets R., Onckelen H.V., Schmulling T. Cytokinin-deficient transgenic Arabidopsis plants show multiple developmental alterations indicating opposite functions of cytokinins in the regulation of shoot and root meristem activity // The Plant Cell. 2003. V. 15. P. 2532. https://doi.org/10.1105/tpc.014928
Mazid M., Khan T.A., Mohammad F. Cytokinins, a classical multifaceted hormone in plant system // Journal of Stress Physiology & Biochemistry. 2011. V. 7. P. 347.
Ashraf M.F., Aziz M.A., Kemat N., Ismail I. Effect of cytokinin types, concentrations and their interactions on in vitro shoot regeneration of Chlorophytum borivilianum Sant. & Fernandez // Electronic Journal of Biotechnology. 2014. V. 17. P. 275. https://doi.org/10.1016/j.ejbt.2014.08.004
Hagos R., Gebremdhin H. Effects of cytokinin types and their concentration on in vitro shoot induction and multiplication of korarima // Int. J. Genet. Mol. Biol. 2015. V. 7. P. 8. https://doi.org/10.5897/IJGMB2015.0108
Te-chato S., Hilae A., In-peuy K. Effects of cytokinin types and concentrations on growth and development of cell suspension culture of oil palm // Journal of Agricultural Technology. 2008. V. 4. P. 157.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


