Физиология растений, 2022, T. 69, № 3, стр. 306-316
Физиологический (интеграционный) подход при использовании параметров флуоресценции хлорофилла листьев растений
Т. В. Нестеренко a, А. А. Тихомиров a, b, В. Н. Шихов a, *
a Институт биофизики Сибирского отделения Российской академии наук, Федеральный исследовательский центр “Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
b Сибирский государственный университет
Красноярск, Россия
* E-mail: v_shikhov@ibp.ru
Поступила в редакцию 22.03.2021
После доработки 19.11.2021
Принята к публикации 29.11.2021
- EDN: KVBASR
- DOI: 10.31857/S0015330322030113
Аннотация
На примере листьев пшеницы Triticum aestivum L. и растений редиса Raphanus sativus var. radicula Pers. сорта “Вировский белый” изучали возможность использования интегральных характеристик медленной стадии индукции флуоресценции хлорофилла (ИФX) для мониторинга физиологического состояния растений в ценозах в условиях светокультуры. Исследовали поведение Т0.5 (время полуспада интенсивности флуоресценции хлорофилла от максимума к стационарному уровню), Rfd (индекс спада флуоресценции, известный также как “индекс жизнеспособности”), параметра ${{{{\bar {V}}}_{{\max }}}}$ (максимально возможная средняя скорость индукционного перехода) и $\bar {\alpha }$ (средняя эффективность ФСА в индукционный период) в онтогенезе листа. Объектом исследования служили высечки разновозрастных равномерно освещенных листьев верхнего (шестого) яруса растений пшеницы и высечки вторых (по мере появления) настоящих листьев редиса в возрасте от 3 до 24 дней. Растения выращивали в контролируемых условиях вегетационных камер методом гидропоники на керамзите при облученности 100 Вт/м2 фотосинтетически активной радиации (ФАР). Регистрацию кривых ИФX проводили на однолучевой установке. Величина параметра Т0.5 незначительно изменялась на протяжении онтогенеза листьев и до момента их старения (26-суточный возраст). Показатель относительных изменений величин параметров ИФХ (Δ отн., %) в возрастном периоде с 2 до 24 сут составлял для $\bar {\alpha }$ 28% и Т0.5 – 30%. Для ${{{{\bar {V}}}_{{\max }}}}$ и Rfd значения соответствовали 67 и 70%. При дальнейшем старении и сравнении параметров 24- и 26-суточных листьев наблюдали в наибольшей степени изменения значений для Т0.5 (на 37.6%) и ${{{{\bar {V}}}_{{\max }}}}$ (на 36.0%) и в меньшей степени для $\bar {\alpha }$ (на 23.0%) и Rfd (на 13.0%). Таким образом, наблюдаемые нами особенности в поведении параметра Т0.5 в онтогенезе листьев пшеницы в сравнении с изменениями значений других флуоресцентных параметров медленной стадии ИФХ (Rfd, $\bar {\alpha }$ и ${{{{\bar {V}}}_{{\max }}}}$) подтверждают перспективность использования Т0.5 в качестве одного из наиболее простых интегральных показателей физиологического состояния и индикатора патофизиологических (необратимых) изменений листьев растений в широком возрастном диапазоне и при старении. Для однозначной интерпретации данных при использовании параметра Т0.5 в стрессовых условиях для оценки необратимости наблюдаемых изменений ФСА необходимы дальнейшие исследования.
ВВЕДЕНИЕ
В последнее время в экологических исследованиях и в области физиологии фотосинтеза и стресса растений широкое применение получил биофизический метод, основанный на явлении индукции флуоресценции хлорофилла (ИФХ) [1]. Как правило, параметры, используемые для характеристики состояния растений, в основном связаны с характеристикой фотосинтетического аппарата на разных уровнях его организации [1, 2]. К наиболее часто используемым параметрам ИФХ на уровне листа при изучении стрессов растений относится так называемый “индекс жизнеспособности” (Rfd), основанный на амплитудных параметрах флуоресценции хлорофилла [2–4]. Несмотря на то, что уровень флуоресценции хлорофилла определяется редокс-состоянием первичного акцептора ФС2, основную роль в регуляции активности ФС2 играет редокс-состояние пластохинонового пула [5]. В свою очередь, редокс-состояние пластохинонового пула определяется соотношением скоростей реакций фотосинтеза, темнового и светового дыхания и других метаболических процессов в растительной клетке [6]. Несмотря на то, что все стрессовые факторы, действующие на какую либо часть растения, в конечном итоге прямо или косвенно влияют на фотосинтез, устойчивость растений и их урожайность зависят не только от состояния ФСА [7]. Так, установлено, что при увеличении интенсивности фотосинтеза, в зависимости от условий (температуры, освещения, влажности) разброс урожайности меняется в процентах в диапазоне от –1 до 12 [8]. Субклеточное регулирование фотосинтетического процесса связано со структурно-функциональным единством хлоропластов и митохондрий и внутренней интеграцией энергообмена в растительной клетке [6, 9].
Наиболее объективно физиологическое состояние листового аппарата растения может быть оценено через соотношения, отражающие взаимосвязь основных физиологических процессов, например, долю суммарного дыхания от истинного фотосинтеза (гроссфотосинтеза) и т.д. [7, 10]. Показано, что при выращивании растений в оптимальных условиях внешней среды имеет место согласование дыхания и фотосинтеза, и количественные соотношения этих процессов у растений за сутки стремятся к минимальным значениям (примерно 38–40%). Эти значения близки у разных видов растений [10]. В стрессовых условиях соотношение суммарного дыхания к гроссфотосинтезу, как правило, увеличивается, причем более значительно у неустойчивых и неадаптированных к данному типу стресса видов [11]. Физиологические классические методы, как правило, не являются оперативными, что затрудняет экологический мониторинг, анализ и прогноз состояния растений при их использовании.
При выборе параметров для контроля за состоянием растений высокая чувствительность параметров к внешним воздействиям еще не может служить однозначным доказательством пригодности их использования в системе экологического мониторинга. По мнению Н.Г. Булгакова, помимо таких необходимых качеств, как достоверность информации, ее воспроизводимость, методическая простота и технологичность данных, выбранные параметры контроля должны иметь возможность однозначной физиологической интерпретации данных для ответа на вопрос об патофизиологических изменениях или обративных адаптивных реакциях растений на внешние воздействия [12, стр. 119].
Поскольку в последнее время при оценке стрессоустойчивости растений уделяется большое внимание роли регуляторных систем, в работе [13] в качестве удобного интегрального показателя состояния ФСА листьев растений был предложен временной параметр ИФХ Т0.5 (время полуспада интенсивности флуоресценции хлорофилла в течение медленной фазы ИФX). Т0.5 представляет собой интегральную характеристику скорости активации ряда фотоаccимиляционныx и фотозащитныx процессов в листе [2, 3]. Наблюдаемые в экспериментах особенности в поведении Т0.5 и сравнение его с другими показателями ИФХ дали основания предположить перспективность применения Т0.5 в ситуациях, когда необходим оперативный интегральный контроль за состоянием ФСА [13, 14]. Однако возникает вопрос, является ли возможным более широкое применение этого параметра для оценки физиологического состояния ФСА не только на молекулярном и клеточном, но и на листовом уровнях, по крайней мере, с учетом работы энерготрансформирующей подсистемы растительных клеток (хлоропластов и митохондрий).
Известно, что некоторые авторы рассматривают старение растений как один из видов стресса (имеются ряд эндогенных изменений, ухудшающих внутреннюю среду) [15–17]. Поэтому представляет интерес изучение поведения параметра Т0.5 по сравнению с другими флуоресцентными показателями в онтогенезе листьев растений в контролируемых оптимальных условиях, для которых показана стабильность отношения дыхания к гроссфотосинтезу для С3 растений на завершающем этапе вегетационной фазы роста [11].
Цель работы – сравнительное изучение интегральных характеристик медленной стадии ИФХ (Т0.5, Rfd и ранее введенных параметров – средней эффективности ФСА в индукционный период $\bar {\alpha }$ и максимально возможной средней скорости индукционного перехода ${{{{\overline V }}_{{{\text{max}}}}}}$ [18]) листьев растений пшеницы и редиса в условиях светокультуры для оценки перспективности их использования как наиболее простых интегральных показателей физиологического состояния листьев растений в их онтогенезе и как индикаторов на патофизиологические изменения при старении.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили высечки разновозрастных равномерно освещенных флаг-листьев (верхнего шестого яруса) растений пшеницы Triticum aestivum L. линии 232 селекции Г.М. Лисовского [19] и высечки разновозрастных листьев растений редиса Raphanus sativus var. radicula Pers. сорта “Вировский белый”. Для экспериментов по влиянию интенсивности возбуждающего флуоресценцию света на значения параметров ИФХ использовали высечки вторых (по мере появления) настоящих листьев редиса в возрасте от 3 до 24 дней, измерения были выполнены в 5–6 повторностях. Растения выращивали в вегетационных камерах методом гидропоники на керамзите при непрерывной облученности 100 Вт/м2 ФАР [19, 20]. Источником излучения служила ксеноновая лампа ДКстВ-6000 (НПП “Разряд”, Россия). Эксперименты проведены в 3-кpатной биологической повторности. Кривые ИФХ регистрировали на однолучевой установке, принципиальная схема которой описана в работе [21]. В качестве источника излучения использовалась лампа накаливания КГМ 250 Вт, 24 В (НИИИС им. А.Н. Лодыгина, Россия). Для выделения спектральной области 400–500 нм (возбуждающий флуоресценцию свет) применяли зеленый светофильтр СЗС-22 (“ЛОМО”, Россия) с максимумом пропускания около 450 нм. Флуоресценцию регистрировали при 685 ± 2 нм. Постоянная времени установки составляла 0.3 с. Для получения интенсивности возбуждающего света в диапазоне 20–80 Вт/м2 ФАР применяли комбинацию нейтральных светофильтров. Время регистрации одной кривой ИФХ составляло 1–3 мин. Темновая адаптация образцов длилась 15–20 мин. Определяли время полуспада (Т0.5) интенсивности флуоресценции хлорофилла от максимума Fp к стационарному уровню Fs [18] (рис. 1). Для сравнения в качестве интегрального показателя состояния ФСА на уровне листа был использован индекс спада флуоресценции Rfd [2–4], известный также как индекс жизнеспособности, часто применяемый в физиологии растений в качестве наиболее чувствительного показателя к стрессам растений:
(1)
${{R}_{{{\text{fd}}}}} = ({{{{F}_{{\text{p}}}} - {{F}_{{\text{s}}}})} \mathord{\left/ {\vphantom {{{{F}_{{\text{p}}}} - {{F}_{{\text{s}}}})} {{{F}_{{\text{s}}}}}}} \right. \kern-0em} {{{F}_{{\text{s}}}}}},$Рис. 1.
Типичная кривая медленной стадии индукции флуоресценции хлорофилла листа. Использованы следующие параметры: время полуспада Т0.5 интенсивности флуоресценции хлорофилла от максимума Fp к стационарному уровню Fs, где Fp – максимальная (в пределах фотоиндукционной кривой) флуоресценция хлорофилла в условиях ненасыщающего света, а Fs представляет интенсивность флуоресценции хлорофилла в условиях стационарного освещения. Энергетический интегральный показатель S1 – площадь, ограниченная сверху кривой F(t) и снизу прямой F(t) = Fs, S0 = S1 + S2 + S3, S2 – площадь над индукционной кривой; S0 – площадь прямоугольника со сторонами Т и Fp; S3 – площадь прямоугольника со сторонами Т и F0.
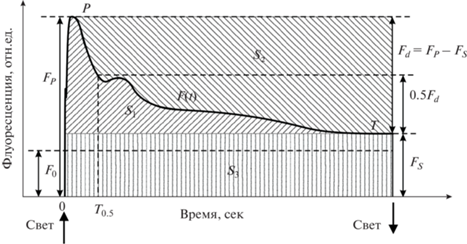
Для оценки интенсивности фотосинтеза на уровне листа использовали параметр $\overline {{{V}_{{\max }}}} $ (максимально возможная средняя скорость индукционного перехода), для которого была показана высокая степень корреляции с интенсивностью фотосинтеза по сравнению с другими параметрами медленной индукции флуоресценции (0.86–0.95) [18]. Для оценки эффективности ФСА в онтогенезе листьев пшеницы применяли параметр $\bar {\alpha }$, характеризующий среднюю эффективность ФСА в индукционный период. Подробнее введение и определение выше перечисленных параметров описано в работе [18].
Наиболее общей характеристикой кривых ИФХ разного типа в онтогенезе листьев растений является энергетический интегральный показатель S1, представляющий собой площадь, ограниченную сверху кривой F(t) и снизу прямой F(t) = Fs (рис. 1):
(2)
${{S}_{1}} = \int\limits_0^T {{{F}_{{\text{v}}}}(t)dt} = \int\limits_0^T {F(t)dt} - T{{F}_{{\text{s}}}},$Если вся энергия, высвеченная в индукционный период, пропорциональна площади S, где S = ${\int_{\text{0}}^T {F(t)dt} }$, то интеграл S1 пропорционален переменной части этой энергии.
Разделив выражение (2) на Fd = (Fp – Fs) (максимальная переменная флуоресценция в индукционный период P–S–M–T, рис. 1), получим некоторое время tmin, в течение которого высветилась бы вся переменная часть энергии квантов флуоресценции, если бы интенсивность F(t) = Fd. Очевидно, что реальное индукционное время T при меняющейся интенсивности процесса Fv(t) < Fd, но с той же суммарной энергией высвечивания, будет больше tmin. Поэтому показатель tmin, являясь минимальным временем индукции, отражает потенциальные возможности флуоресцирующей системы [18].
(4)
${{{{\bar {V}}}_{{\max }}} = \frac{{{{F}_{{\text{d}}}}}}{{{{F}_{{\text{p}}}}{{t}_{{{\text{min}}}}}}}}.$Параметр $\bar {\alpha }$, характеризующий среднюю эффективность ФСА в индукционный период Т, определяли по формуле:
(5)
$\bar {\alpha } = \frac{{\int\limits_{\text{0}}^T {[{{F}_{{\text{p}}}} - F(t)]dt} }}{{{{F}_{{\text{p}}}}T}} = \frac{{{{S}_{2}}}}{{{{S}_{0}}}},$Оценка величины реакции показателей ИФX (Rfd, $\bar {\alpha }$, ${{{{\overline V }}_{{{\text{max}}}}}}$ и Т0.5) листьев растений пшеницы в их онтогенезе проводилась с помощью интегрального логарифмического показателя I [23, стр. 383], коэффициента вариации (к.в.) и индекса относительных изменений значений параметров при старении Δ отн. с помощью следующих формул:
где Ni – значение соответствующего параметра ИФХ стареющих листьев (26-суточных); Ni0 – значение параметра ИФХ зрелых листьев (7-суточных); где δ – среднее квадратичное отклонение, ${\bar {x}}$ – среднее значение параметров листа после завершения роста и до резких изменений значений при старении (от 10- до 24-суточного возраста); где Ni – значение соответствующего параметра ИФХ стареющих листьев (26-суточных); Ni0 – значение параметра ИФХ зрелых листьев до резкого старения (24-суточных).РЕЗУЛЬТАТЫ
В работах [24, 25] была исследована зависимость значений параметров флуоресценции хлорофилла от интенсивности возбуждающего флуоресценцию света для разновозрастных листьев растений редиса и пшеницы. Результаты экспериментов подтвердили отсутствие видовой специфичности в поведении параметра Fp/Fs в широком диапазоне интенсивности света (до 220 Вт/м2 ФАР) [25]. Достоверный рост значений Fp/Fs при увеличении интенсивности возбуждающего флуоресценцию света имел место для самых молодых и наиболее старых листьев пшеницы (2-, 12- и 16‑суточных). Для 9-суточных листьев изменения показателя Fp/Fs для обоих случаев были недостоверны. Известно, что именно стадия зрелости характеризуется стабильностью многих показателей при внешних воздействиях в определенном диапазоне [4, 26].
Для выбора оптимальной интенсивности возбуждающего флуоресценцию света при дальнейших исследованиях было изучено поведение флуоресцентных параметров Т0.5, Rfd и ${{{{\overline V }}_{{{\text{max}}}}}}$ листьев редиса в четырех вариантах: 20, 40, 60 и 80 Вт/м2 ФАР (табл. 1).
Таблица 1.
Влияние интенсивности возбуждающего флуоресценцию света на значения флуоресцентных параметров для разновозрастных листьев редиса
| Варианты интенсивности света, Вт/м2 | Возраст листа, сут | |||
|---|---|---|---|---|
| 3 | 12 | 18 | 24 | |
| Т0.5, с | ||||
| 20 | 40.1 ± 2.0 | 12.5 ± 1.5 | 23.3 ± 1.6 | 18.0 ± 1.2 |
| 40 | 20.2 ± 1.3 | 13.5 ± 1.2 | 21.2 ± 1.7 | 10.0 ± 1.3 |
| 60 | 11.5 ± 1.3 | 9.5 ± 1.3 | 17.3 ± 1.6 | 8.6 ± 1.2 |
| 80 | 10.0 ± 1.1 | 8.3 ± 1.3 | 18.7 ± 1.4 | 8.7 ± 1.2 |
| Rfd, отн ед. | ||||
| 20 | 0.6 ± 0.1 | 0.9 ± 0.2 | 1.2 ± 0.1 | 0.2 ± 0.1 |
| 40 | 2.1 ± 0.1 | 1.9 ± 0.1 | 2.3 ± 0.2 | 0.9 ± 0.2 |
| 60 | 1.3 ± 0.2 | 1.7 ± 0.1 | 1.8 ± 0.1 | 1.4 ± 0.2 |
| 80 | 1.5 ± 0.2 | 1.7 ± 0.2 | 2.0 ± 0.2 | 1.7 ± 0.2 |
| ${{{{\overline V }}_{{{\text{max}}}}}}$ ×10–2, с–1 | ||||
| 20 | 1.0 ± 0.3 | 1.5 ± 0.2 | 2.2 ± 0.3 | 1.0 ± 0.3 |
| 40 | 2.8 ± 0.4 | 2.1 ± 0.3 | 3.1 ± 0.4 | 3.8 ± 0.5 |
| 60 | 3.5 ± 0.4 | 4.2 ± 0.4 | 3.1 ± 0.4 | 4.8 ± 0.5 |
| 80 | 4.0 ± 0.5 | 4.3 ± 0.5 | 3.0 ± 0.3 | 5.5 ± 0.6 |
Примечание. Использованы следующие параметры: время полуспада (Т0.5) интенсивности флуоресценции хлорофилла от максимума Fp к стационарному уровню Fs; индекс жизнеспособности Rfd; максимально возможная средняя скорость индукционного перехода $\overline {{{V}_{{\max }}}} $. Приведены средние значения из 5–6 измерений ± доверительный интервал с уровнем достоверности 0.95.
При рассмотрении влияния возраста на значения параметра Т0.5 при одной и той же интенсивности возбуждающего флуоресценцию света были отмечены колебания значений этого параметра в онтогенезе листа. При сравнении разновозрастных листьев по параметру Rfd, характеризующего активность ФСА листа, видно, что значения этого параметра во всем диапазоне исследования выше для зрелого листа по сравнению со значениями этого параметра для молодых и стареющих листьев редиса. Результаты эксперимента, представленные в таблице 1, показывают, что параметр Т0.5 имеет наименьший диапазон изменений для разновозрастных листьев, начиная с интенсивности 40 Вт/м2 и выше (табл. 1). Как для параметра Т0.5, так и для Rfd наименьшее влияние возраста листьев растений редиса имело место при интенсивности возбуждающего флуоресценцию света 60 Вт/м2 ФАР, что близко к значению ИРП – интенсивности радиации приспособления растений (таких значений ФАР, при которых кпд газообмена листьев по СО2 максимален, поскольку при этом оптимально соотношение процессов фотосинтеза к дыханию листа [28, 29]). Полученные данные согласуются с ранее высказанным нами мнением, что в случае стрессовых ситуаций для оценки устойчивости ФСА листьев растений имеет смысл использовать не насыщающий фотосинтез свет порядка 100 Вт/м2 и более (в некоторых работах с применением приборов для регистрации импульсно-модулированной ИФХ [1, 22]), а свет с интенсивностью, близкой к значению ИРП – интенсивности радиации приспособления растений [30].
Для изучения поведения флуоресцентных параметров в онтогенезе листьев пшеницы в дальнейшем использовали для регистрации кривых ИФХ интенсивность света 60 Вт/м2 ФАР (табл. 2). Значения параметра Т0.5 по мере роста и развития листа пшеницы постепенно уменьшались до достижения листом примерно 80% от максимальной площади и возраста 5–6 сут от 29.2 до 23.4 с (табл. 2). При дальнейшем онтогенезе листа наблюдали увеличение значений Т0.5 до 35.1 с в 12-суточном листовом возрасте с дальнейшим уменьшением значений параметра до примерно исходного уровня молодого листа – 31.6 с (при 24 сут). При старении листа (26 сут) величина Т0.5 резко возрастала, достигая 43.5 с (на 37.6%; табл. 2 и 3). Минимальные значения Т0.5 наблюдали в 5–6-суточном возрасте листа и второй небольшой минимум – в 16 сут. Первый минимум по возрастному времени совпадал с максимумами величин для параметров Rfd, ${{{{\overline V }}_{{{\text{max}}}}}}$. При этом в возрасте листьев 5–6 сут средняя эффективность ФСА $\bar {\alpha }$ также имела высокие значения (60 × 10–2, отн.ед.). Второй небольшой минимум Т0.5 совпадал с незначительными увеличениями значений Rfd, ${{{{\overline V }}_{{{\text{max}}}}}}$ и в меньшей степени связан с небольшими колебаниями величин $\bar {\alpha }$ на протяжении онтогенеза листа, начиная с 8- и вплоть до 24-суточного возраста (среднее значение 44.7, табл. 2). Таким образом, анализ экспериментальных данных показал, что изменения значений Т0.5 и параметров Rfd, ${{{{\overline V }}_{{{\text{max}}}}}}$ происходили в противофазе, т.е. максимумы для Т0.5 соответствовали приблизительно минимумам для других рассматриваемых характеристик. А.Т. Мокроносов характеризует этапы онтогенеза листа зрелости и старения соотношением синтеза и деструкции активных клеточных структур [7, стр. 31]. При этом отмечается, что этап зрелости характеризуется равновесием этих процессов и проявляется, как правило, в перегибе возрастных кривых физиологических показателей и не имеет длительного стационарного состояния.
Таблица 2.
Изменения флуоресцентных интегральных показателей листьев верхнего (шестого) яруса растений пшеницы в их онтогенезе
| Возраст листа, сут | Площадь листа, % | T0.5, с | Rfd, отн. ед. | $\bar {\alpha }$ × 10–2, отн. ед. | ${{{{\overline V }}_{{{\text{max}}}}}}$ × 10–2, c–1 |
|---|---|---|---|---|---|
| 2 | 20 | 29.2 ± 1.6 | 2.5 ± 0.3 | 60 ± 3 | 2.0 ± 0.3 |
| 3 | 44 | 28.1 ± 1.7 | 3.0 ± 0.2 | 60 ± 5 | 2.5 ± 0.4 |
| 4 | 66 | 27.3 ± 1.1 | 4.6 ± 0.1 | 60 ± 10 | 3.5 ± 0.9 |
| 5 | 76 | 26.2 ± 1.2 | 4.9 ± 0.2 | 4.0 ± 0.5 | |
| 6 | 84 | 25.3 ± 1.8 | 5.1 ± 0.3 | 60 ± 10 | 3.3 ± 0.9 |
| 7 | 90 | 23.4 ± 1.3 | 4.9 ± 0.4 | 48 ± 8 | 1.5 ± 0.7 |
| 8 | 96 | 31.2 ± 1.2 | 4.7 ± 0.2 | 46 ± 9 | 1.3 ± 0.6 |
| 10 | 99 | 34.2 ± 1.6 | 3.0 ± 0.2 | 45 ± 8 | 1.3 ± 0.5 |
| 12 | 100 | 35.1 ± 1.8 | 2.1 ± 0.5 | 43 ± 7 | 1.3 ± 0.3 |
| 14 | 100 | 30.3 ± 2.5 | 1.6 ± 0.5 | 44 ± 9 | 1.5 ± 0.5 |
| 16 | 100 | 27.3 ± 1.5 | 1.7 ± 0.2 | 45 ± 9 | 2.0 ± 0.9 |
| 20 | 100 | 30.4 ± 1.3 | 2.2 ± 0.1 | 46 ± 10 | 1.7 ± 0.7 |
| 24 | 100 | 31.6 ± 1.5 | 1.5 ± 0.1 | 43 ± 10 | 1.4 ± 1.0 |
| 26 | 100 | 43.5 ± 2.0 | 1.3 ± 0.2 | 33 ± 9 | 0.9 ± 0.5 |
Примечание. Использованы следующие параметры: время полуспада (Т0.5) интенсивности флуоресценции хлорофилла от максимума Fp к стационарному уровню Fs; индекс жизнеспособности Rfd; максимально возможная средняя скорость индукционного перехода $\overline {{{V}_{{\max }}}} $; средняя эффективность ФСА в индукционный период $\bar {\alpha }$. Приведены средние значения из 5–6 измерений ± доверительный интервал с уровнем достоверности 0.95.
Таблица 3.
Оценка реакции флуоресцентных характеристик листьев пшеницы на старение на основании коэффициента вариации (к.в.), интегрального логарифмического показателя (I) и индекса (Δ) относительных изменений значений параметров при старении
| Параметры | к.в., % | I, отн. ед. | Δ отн., % |
|---|---|---|---|
| T0.5 | 9.7 | 0.27 ± 0.02 | –37.6 |
| Rfd | 28.0 | –0.58 ± 0.04 | 13.0 |
| ${{{{\overline V }}_{{{\text{max}}}}}}$ | 19.0 | –0.16 ± 0.07 | 36.0 |
| $\bar {\alpha }$ | 3.5 | –0.14 ± 0.04 | 23.0 |
Примечание. Использованы следующие параметры: время полуспада (Т0.5) интенсивности флуоресценции хлорофилла от максимума Fp к стационарному уровню FS; индекс жизнеспособности Rfd; максимально возможная средняя скорость индукционного перехода $\overline {{{V}_{{\max }}}} $; средняя эффективность ФСА в индукционный период $\bar {\alpha }$. Приведены средние значения из 5–6 измерений ± доверительный интервал с уровнем достоверности 0.95.
При дальнейшем старении и сравнении значений параметров 24- и 26-суточных листьев наблюдали в наибольшей степени изменения параметров Т0.5 (на 37.6%) и ${{{{\overline V }}_{{{\text{max}}}}}}$ (на 36.0%), в меньшей степени $\bar {\alpha }$ (на 23.0%) и Rfd (на 13.0%) (табл. 3, значения Δ %).
ОБСУЖДЕНИЕ
Как показали эксперименты, значения параметра ИФХ Т0.5 незначительно изменялись на протяжении онтогенеза листьев растений после окончания их роста (с 10-суточного возраста листа) и до момента старения (примерно 26-суточный возраст) по сравнению со значениями параметра Rfd (табл. 1). Коэффициент вариации значений Т0.5 в этот относительно стабильный период составил 9.7%, и для средней эффективности ФСА $\bar {\alpha }$ 3.5%. В то же время для параметра Rfd – 28.0%. Если сравнить параметры по реакции их на постепенное старение листа в онтогенезе, то из таблицы 2 видно, что значение интегрального логарифмического показателя I(Т0.5) по абсолютному значению почти в 2 раза меньше по сравнению с I(Rfd) (0.27 и –0.58, соответственно) для пшеницы при данных условиях онтогенеза. При сравнении результатов с данными по другим видам растений [13] можно отметить близость значений I (Т0.5) для редиса и огурца (0.22 и 0.25, соответственно). В то же время значения I(Rfd) для тех же видов растений составляли –0.25 и –0.44.
При одной и той же интенсивности возбуждающего флуоресценцию хлорофилла света для разновозрастных листьев редиса и пшеницы для значений параметра Т0.5 можно отметить общую закономерность, которая проявляется в колебаниях значений этого параметра в онтогенезе листа (табл. 1 и 2). Этот факт согласуется с данными, полученными для листьев пшеницы и других видов высших растений, и связан с переключениями метаболизма углерода в процессе роста и старения листа, а также с регуляцией метаболизма на уровне целого растения [7, 27]. В работе [24] было показано, что для параметра Т0.5 наименьшее влияние возраста листьев растений редиса имело место при интенсивности возбуждающего флуоресценцию света 60 Вт/м2 ФАР, что близко к значению ИРП – интенсивности радиации приспособления растений (таких значений ФАР, при которых кпд газообмена листьев по СО2 максимален, поскольку при этом оптимально соотношение процессов фотосинтеза к дыханию листа [29]). В работе [29, стр. 164] сделан вывод, что при определенном режиме ФАР, соответствующем ИРП, существует определенная сопряженность между фотосинтезом, дыханием и газообменом, т. е. фотосинтетическая деятельность в растительном покрове происходит в соответствии с принципом максимальной продуктивности. При этом подчеркивается важное значение фотосинтеза и дыхания не только для высокого урожая ценоза, но и для формирования устойчивости отдельных растений в фитоценозах. Для получения высокого урожая, по мнению Х.Г. Тооминга [29, стр. 81], оптимальным является условие, при котором листья в посеве работают не с максимальной, а с оптимальной интенсивностью фотосинтеза, соответствующей зоне ИПР и максимальному кпд фотосинтеза. Известно, что для многих растений, применяемых в сельском хозяйстве, значение ИРП находится в диапазоне 28–84 Вт/м2 ФАР [30]. Другими причинами, служащими обоснованием для применения средних интенсивностей возбуждающих флуоресценцию хлорофилла на уровне листьев, являются следующие:
1) использование интенсивности возбуждающего флуоресценцию света в области 30–60 Вт/м2 позволяет получать кривые ИФХ, которые дают наиболее полную количественную и качественную информацию о возрастном состоянии листьев растений [20, 30], т.к. хорошо проявляются дополнительные максимумы на кривых ИФХ [18, 21, 26, 31];
2) при данном диапазоне интенсивности не происходит фотоингибирования фотосинтетического аппарата листа [30];
3) фотоиндуцированный спад переменной флуоресценции при освещении светом умеренной интенсивности обусловлен в основном реокислением восстановленного первичного акцептора ФС2 за счет световой активации ферментов углеродного цикла фотосинтеза. Была показана тесная взаимосвязь фотоиндуцированной переменной флуоресценции (ИФХ) с содержанием АТФ в листьях проростков ячменя [31].
Считается, что флуоресценция хлорофилла может быть удобным инструментом для определения индукции стресса и оценки степени разрушений, а также степени регенерации ФСА растений при удалении стресс-фактора [1, 13]. В работе [14] был поставлен вопрос, возможна ли интегральная экспресс-оценка состояния ФСА по минимальному набору флуоресцентных параметров и какими свойствами эти параметры или характеристики должны обладать? По-видимому, предлагаемые параметры должны быть чувствительными к изменению активности ФСА при стрессовых воздействиях и восстановлению состояния ФСА после прекращения воздействия [33, 34]. Однако величина их не должна слишком меняться в онтогенезе листа, по крайней мере, после формирования листа и до начала его старения.
В монографии А.Т. Мокроносова [7, стр. 118] состояние зрелости листа характеризуется как наиболее сбалансированное по соотношению анаболических и катаболических процессов, а в период старения отмечается преобладание процессов деструкции. При этом максимум фотосинтетической активности листа, как правило, наступает раньше завершения роста листовой пластинки. В нашем исследовании максимальные величины для параметров Rfd, ${{{{\overline V }}_{{{\text{max}}}}}}$ наблюдали при достижении листом пшеницы примерно 80% максимальной площади в возрасте 5–6 сут (табл. 2).
В процессе онтогенеза растений происходит комплекс структурно-функциональных изменений в его фотосинтетическом аппарате, в результате чего фотосинтетическая функция растений непрерывно перестраивается и корректируется: меняется соотношение фососистем, развитие ФС1 опережает развитие ФС2 [7, стр. 53]. Содержание хлорофилла также изменяется в онтогенезе листа: в начале несколько увеличивается, затем идет постепенное снижение содержания хлорофилла по мере роста и старения листа [7, 20]. В онтогенезе происходит изменение соотношения основного восстановительного и альтернативных путей фотосинтетического метаболизма [7, стр. 117; 28].
В работе Н.Г. Бухова [26] показано, что значение быстро релаксирующего компонента нефотохимического тушения qN, идентифицированного как “высокоэнергетическое” или “дельта рН-зависимое” тушение, в старых листьях выше, чем в молодых. Это связано с тем, что пропускная способность углеродного метаболизма при старении листа ингибируется более сильно, чем активность электронного транспорта. В результате возможности диссипации протонного градиента при превращении АДФ в АТФ в старых листьях оказывается ниже, чем в молодых [26].
Считается, что “скорость развертывания защитных механизмов при умеренных интенсивностях света имеет решающее значение для устойчивости фотосинтетического аппарата растения в первую очередь на начальном этапе адаптации к свету, происходящем преимущественно в течение первой минуты освещения” [3]. Прогноз устойчивости строится на предположении, что ФСА тех листьев, у которых имеется определенная исходная (до начала воздействия) недостаточность регуляторных систем, будет менее устойчивым к экстремальному воздействию. При этом у наиболее устойчивых образцов в отсутствии существенных нарушений регуляторных систем и их оптимальной функциональной активности значения логарифмического показателя I = lg (Ni/Ni0) будут приближаться к нулю [23, стр. 391]. В статье [24] при использовании тестового воздействия – света разной интенсивности (диапазон 20–80 Вт/м2 ФАР) при регистрации кривых ИФХ листьев редиса показано, что наименьшие значения логарифмического показателя для параметра Т0.5 наблюдали для зрелого 18-суточного листа (I = –0.11). Это может свидетельствовать о большей устойчивости его регуляторных систем к воздействию света высокой интенсивности по сравнению с устойчивостью молодого листа, для которого значение интегрального логарифмического показателя для параметра I(Т0.5) было равно –0.55, что связано, вероятно, с меньшей устойчивостью регуляторных систем его ФСА к световому воздействию или менее развитыми защитными механизмами от фотоингибирования.
Сбалансированность ассимиляции СО2 и флуоресценции хлорофилла наблюдается при благоприятных физиологических условиях, а соотношение между этими процессами нарушается при стрессах (в том числе и при старении). При этом данные указывают на относительно меньшую изменчивость при стрессе энергообмена по сравнению с газообменом [32].
Соотношение дыхания к гроссфотосинтезу для разных видов растений, выращенных в благоприятных условиях, находится в узком диапазоне значений 0.4–0.6 [11]. При выращивании растений сахарной свеклы, подсолнечника и кукурузы в герметических вегетационных камерах в стационарных оптимальных условиях было показано, что в стационарную фазу роста соотношение дыхания к гроссфотосинтезу составляло 0.38–0.40 [25]. Данные значения соответствуют минимальным дыхательным затратам и не могут быть снижены без нарушения нормального роста и развития растений [10, 11].
Показано, что при выращивании растений в оптимальных условиях внешней среды имеет место согласование дыхания и фотосинтеза, и количественное соотношение этих процессов у растений за сутки стремится к минимальным значениям (примерно 38–40%). Эти значения близки у разных видов растений [10]. В то же время, данное отношение вариабельно при стрессе и зависит от силы стрессового воздействия и устойчивости растений. Так, снижение ФАР в 2 раза при выращивании кукурузы вызывало уменьшение соотношения дыхания к фотосинтезу до 0.32–0.35 [11]. При измерении фотосинтеза и дыхания растений пшеницы в течение 24 ч при разных температурах (от 15 до 30°С) величина отношения суммарного дыхания к гроссфотосинезу изменялась в узком диапазоне 0.40–0.45 [11].
Интересно отметить близкие значения параметра Т0.5 для листьев различных растений в одной фазе развития листа. Так, в работе [13] в онтогенезе листьев пшеницы, огурца и редиса при достижении 90% площади листа значения параметра Т0.5 составляли близкие значения: 12.3; 14.4 и 14.4, соответственно.
В обзоре Н.Г. Булгакова [12, стр. 118] отмечается, что при выборе параметров для мониторинга состояния экосистем, необходимо четко разделять их на две неравнозначные группы – основные и коррелятивные. Основные – те, которые отвечают некоторым критериям, например, характеризуют устойчивость экосистемы в целом. К коррелятивным относятся опережающие индикаторы изменения основных. По-видимому, параметры Т0.5 и в меньшей степени ${{{{\overline V }}_{{{\text{max}}}}}}$ могут рассматриваться как основные, а параметр Rfd – как коррелятивный. В этом смысле параметр Rfd может быть и более чувствительным к старению листьев, но не дает адекватную оценку степени патофизиологических изменений.
При применении теории автоматического регулирования в исследованиях фотосинтеза выделяют три основных типа регулирования: стабилизирующее, программное и следящее [7, стр. 169]. Если перейти на язык теории автоматического регулирования, то основные параметры, по-видимому, в большей степени связаны со стабилизирующим типом регулирования, при котором наблюдается постоянство регулируемой величины. Такое регулирование связано с поддержанием гомеостаза системы и стабилизацией скорости процессов. Как отмечено в монографии А.Т. Мокроносова, при фотосинтезе наблюдается гомеостаз метаболизма углерода, который нарушается только при значительных экстремальных воздействиях [7, стр. 169]. Коррелятивные параметры более связаны с двумя другими типами регулирования: следящим и программным по классификации Мокроносова. Следящее регулирование характеризуется изменением регулируемой величины в соответствии с изменением внешней среды на уровне быстрых, кратковременных изменений длительностью секунды – десятки минут. Для программного регулирования характерно изменение регулируемой величины по заданной программе. Этот тип управления составляет основу развития фотосинтетического аппарата в онтогенезе. На ранних этапах онтогенеза листа преобладает механизм положительной обратной связи. На поздних этапах онтогенеза фотосинтетической системы доминируют механизмы обратной отрицательной связи, характерные для стареющих систем [7, стр. 170].
Если рассмотреть показатель относительных изменений величин параметров ИФХ (Δ отн., %), то в наименьшей степени в возрастном периоде с двух до 24 сут изменялись $\bar {\alpha }$ (на 28%) и Т0.5 (на 30%). Для параметров ${{{{\overline V }}_{{{\text{max}}}}}}$ и Rfd соответствующие значения составили 67 и 70% (табл. 2). Поскольку в стационарную фазу роста соотношение дыхания и гроссфотосинтеза было 0.38–0.40 [35], а диапазон изменения этого соотношения для разных видов растений, выращенных в благоприятных условиях, находится в узком диапазоне значений 0.4–0.6 [10, 11], что составляет 33–37%, можно сделать предположение о достаточной степени стабильности параметра Т0.5 в онтогенезе листа в благоприятных условиях роста.
Сравнение параметров флуоресценции хлорофилла двух сортов сахарной свеклы с разной устойчивостью их ФСА к засухе показало разную чувствительность параметров (F0, Fv/Fm, qP, qN) на данный стресс [33]. Наиболее чувствительным к водному стрессу среди параметров и характеристик ФСА оказался коэффициент нефотохимического тушения qN (изменения значений почти в 3 раза) [33].
В ранее проведенной нами работе было показано, что изменения этой характеристики (qN) в онтогенезе листьев растений пшеницы находятся в пределах 30% [17], что сопоставимо с изменениями значений параметра Т0.5 (табл. 3). Клеточная популяция в листе дифференцирована по темпам старения, и разные клетки в мезофилле сильно отличаются по продолжительности жизни. В процессе старения листа в нем увеличивается фонд отмирающих, и, возможно, лизирующих клеток. Асинхронно стареют и хлоропласты. По данным Ю.В. Гамалея [36], вариация продолжительности жизни хлоропластов достигает 30% от средней величины этого показателя для данной клетки.
По характеру изменений значений в онтогенезе и чувствительности к стрессовым воздействиям показатели ИФХ qN и Т0.5 сопоставимы, однако преимущество Т0.5 заключается в более простых условиях измерения по сравнению с qN [13, 14].
Согласно выводам, сделанным в работе [37], при оценке степени необратимости изменений активности ФСА в стрессовых условиях, следует отдать предпочтение изучению закономерностей патофизиологических изменений во временной организации систем регуляции растительных клеток. Если нарушения носят обратимый характер и обусловлены прежде всего действием климатических факторов или возрастными особенностями растений, то, несмотря на изменения в абсолютных величинах физиологических характеристик, постоянные времени в системах физиологической регуляции останутся неизменными. В случае необратимых изменений будет затронута эффективность процессов регуляции, что отразится в изменении величин временных характеристик систем регуляции [37]. По нашему мнению, в случае патофизиологичеких эффектов, вызванных как внешними стрессовыми условиями, так и вследствие эндогенных причин (процесса старения), изменения значений параметра Т0.5 будут существенно превышать такие изменения в онтогенезе листа в нормальных условиях, которые составляют примерно 30% [14].
Суммируя литературные и экспериментальные данные по изменению значений параметра Т0.5 в онтогенезе листьев растений и при слабых стрессовых воздействиях, можно сделать следующие выводы.
1. Изменения значений параметра Т0.5 в онтогенезе листьев растений по отношению к изменениям для других флуоресцентных параметров незначительны, так же как для ${{{{\overline V }}_{{{\text{max}}}}}}$ и $\bar {\alpha }$. Коэффициент вариации значений параметра Т0.5 в онтогенезе листа (табл. 3, к.в. %) не превышает коэффициента вариации продолжительности жизни хлоропластов, которая достигает 30% от средней величины этого показателя для отдельной клетки [36]. Хотя изменения величин Т0.5 и ${{{{\overline V }}_{{{\text{max}}}}}}$ практически одинаковы, определить последний параметр сложнее. Во-вторых, значения параметра Т0.5 наименее вариабельны в онтогенезе листа до заключительной стадии старения.
2. Поскольку Т0.5 представляет собой интегральную характеристику скорости активации ряда фотоаccимиляционныx и фотозащитныx процессов в листе [2, 3], т.е., фотоиндуцированный спад переменной флуоресценции при освещении светом умеренной интенсивности обусловлен в основном световой активацией ферментов углеродного цикла фотосинтеза, а также имеется тесная взаимосвязь фотоиндуцированной переменной флуоресценции с содержанием АТФ в листьях [31], можно говорить о связи параметра Т0.5 с работой энерготрансформирующей подсистемы растительных клеток (хлоропластов и митохондрий).
3. В течение первой минуты освещения скорость развертывания защитных механизмов при умеренных интенсивностях света имеет решающее значение для устойчивости фотосинтетического аппарата растения на начальном этапе адаптации к свету [3]. Поэтому, регистрируя кривые ИФХ и определяя Т0.5, можно, по-видимому, тестировать регуляторные системы, связанные с защитными механизмами листа.
4. Анализ литературных данных по влиянию слабой засухи на растения показал высокую чувствительность параметра Т0.5, сопоставимую с поведением наиболее чувствительного к стрессам флуоресцентного параметра нефотохимического тушения флуоресценции qN [33].
5. Относительная устойчивость значений параметра Т0.5, а также флуоресцентных параметров ${{{{\overline V }}_{{{\text{max}}}}}}$ и Rfd для зрелых листьев растений по сравнению с молодыми и стареющими листьями при вариации интенсивности возбуждающего флуоресценцию хлорофилла света в интервале 40–80 Вт/м2 (табл. 1) может служить критерием зрелости листа и устойчивости регуляторных систем.
Таким образом, наблюдаемые нами в данной работе особенности в поведении параметра Т0.5 в онтогенезе листьев пшеницы и сравнение изменений значений других флуоресцентных параметров медленной стадии ИФХ (Rfd, ${{{{\overline V }}_{{{\text{max}}}}}}$ и $\bar {\alpha }$) подтверждают обоснованность выбора параметра Т0.5 для оценки не только реактивности регуляторных систем ФСА, но и перспективность его использования как одного из наиболее простых интегральных показателей физиологического состояния листьев высших растений в широком возрастном диапазоне и индикатора на патофизиологические изменения при старении. Для однозначной интерпретации данных при использовании параметра Т0.5 и других флуоресцентных параметров с целью оценки наблюдаемых патофизиологических изменений в стрессовых для растений условиях необходимы дальнейшие исследования.
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов изучения. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Goltsev V.N., Kalaji H.M., Paunov M., Bąba W., Horaczek T., Mojski J., Kociel H., Allakhverdiev S.I. Variable chlorophyll fluorescence and its use for assessing physiological condition of plant photosynthetic apparatus // Russ. J. Plant Physiol. 2016. V. 63. P. 869. https://doi.org/10.1134/S1021443716050058
Roháček K. Chlorophyll fluorescence parameters: the definitions, photosynthetic meaning, and mutual relationships // Photosynthetica. 2002. V. 40. P. 13. https://doi.org/10.1023/A:1020125719386
Птушенко В.В., Cолнцев В.А., Тиxонов А.Н. Биофизические методы экологического мониторинга, фотосинтетические показатели листьев древесных растений в условиях города Москвы // Биофизика. 2013. Т. 58. С. 313.
Нестеренко Т.В., Тихомиров А.А., Шихов В.Н. Индукция флуоресценции хлорофилла и оценка устойчивости растений к неблагоприятным воздействиям // Журн. общ. биол. 2007. Т. 68. С. 455.
Сааков В.С. Концепция энергетических основ устойчивости зеленой клетки к действию экстремальных факторов внешней среды // ДАН. 2000. Т. 375. С. 278.
Семихатова О.А. Энергетические аспекты интеграции физиологических процессов в растении // Физиология растений. 1980. Т. 27. С. 1105.
Мокроносов А.Т. Онтогенетический аспект фотосинтеза. Москва: Наука, 1981. 196 с.
Wu A., Hammer G.L., Doherty A., von Cammerer S., Farquhar G.D. Quantifying impacts of enhancing photosynthesis on crop yield // Nature Plants. 2019. V. 5. P. 380. https://doi.org/10.1038/s41477-019-0398-8
Иванченко В.М., Маршакова М.И., Урбанович Т.А., Микульская С.А., Обуховская Л.В. Влияние хлоропластов и митохондрий на энерготрансформирующие функции друг друга // Докл. АН СССР. 1986. Т. 291. С. 505.
Рахманкулова З.Ф. Взаимосвязь фотосинтеза и дыхания целого растения в норме и при неблагоприятных внешних условиях // Журн. общ. биол. 2002. Т. 63. С. 44.
Rakhmankulova Z.F. Physiological Aspects of Photosynthesis–Respiration Interrelations // Russ. J. Plant Physiol. 2019. V. 66. P. 365. https://doi.org/10.1134/S1021443719030117
Булгаков Н.Г. Индикация состояния природных экосистем и нормирование факторов окружающей среды: обзор существующих подходов // Успехи соврем. биол. 2002. Т. 122. С. 115.
Nesterenko T.V., Shikhov V.N., Tikhomirov A.A. Estimation of changes in the activity of photosynthetic apparatus of plant leaves based on half-time of fluorescence intensity decrease // Photosynthetica. 2019. V. 57. P. 132. https://doi.org/10.32615/ps.2019.005
Нестеренко Т.В., Шихов В.Н., Тихомиров А.А. Флуоресцентный метод определения реактивности фотосинтетического аппарата растений // Журн. общ. биол. 2019. Т. 80. С. 187. https://doi.org/10.1134/S0044459619030060
Thomas H., Stoddart J.L. Leaf senescence // Annu. Rev. Plant Physiol. 1980. V. 31. P. 83.
Romanova A.K., Semenova G.A., Novichkova N.S., Ignat’ev A.R., Mudrik V.A., Ivanov B.N. Physiological, biochemical, and fluorescence parameters of senescing sugar beet leaves in the vegetative phase of growth // Russ. J. Plant Physiol. 2011. V 58. C. 271. https://doi.org/10.1134/S1021443711020178
Nesterenko T.V., Shikhov V.N., Tikhomirov A.A. Chlorophyll fluorescence as an indicator of age-dependent changes in photosynthetic apparatus of wheat leaves // Russ. J. Plant Physiol. 2015. V. 62. C. 307. https://doi.org/10.1134/S1021443715020144
Нестеренко Т.В., Сидько Ф.Я. О количественном описании медленной индукции флуоресценции хлорофилла в онтогенезе листьев высших растений // Физиология растений. 1993. Т. 40. С. 10.
Tikhomirov A.A., Sid’ko F.Ya. Photosynthesis and structure of radish and wheat canopies as affected by radiation of different energy and spectral composition // Photosynthetica. 1982. V. 16. P. 191.
Тихомиров А.А. Внутренний радиационный режим в фитоценозах и фотобиологическая эффективность излучения в условиях светокультуры // Светотехника. 2021. №1. С. 13.
Полякова И.Б., Каpаваев В.А., Cолнцев М.К., Чечулина А.А. Люминесцентные показатели в разных участках листа пшеницы в онтогенезе // Биофизика. 2003. Т. 48. С. 1108.
Lichtenthaler H., Buschmann C., Knapp M. Measurement of chlorophyll fluorescence kinetics (Kautsky effect) and the chlorophyll fluorescence decrease ratio (RFd-values) with the PAM-fluorometer // Analytical methods in plant stress biology / Eds. Filek M., Biesaga-Kocielniak J., Marciska I. Krakow, Poland: The Franciszek Gorski Inst. Plant Physiol., Polish Academy of Sciences, 2004. P. 93.
Ушаков И.Б., Штемберг А.С., Шафиркин А.В. Реактивность и резистентность организма млекопитающих. Москва: Наука, 2007. 493 с.
Nesterenko T.V., Tikhomirov A.A., Shikhov V.N. Influence of excitation light intensity and leaf age on the slow chlorophyll fluorescence transient in radish // Biophysics. 2012. V. 57. P. 464. https://doi.org/10.1134/S0006350912040136
Нестеренко Т.В., Тихомиров А.А., Шихов В.Н. Световая зависимость медленной индукции флуоресценции хлорофилла в онтогенезе листьев растений пшеницы // ДАН. 2014. Т. 454. С. 729. https://doi.org/10.7868/S0869565214060267
Бухов Н.Г. Старение листа. Выявление участков, лимитирующих фотосинтез, с помощью коэффициентов тушения флуоресценции хлорофилла и редокс-измерений Р700 в листьях // Физиология растений. 1997. Т. 44. С. 352.
Нестеренко Т.В., Сидько Ф.Я. Индукция флуоресценции хлорофилла А в онтогенезе флаг листа пшеницы // Биофизические методы исследования экосистем / Под ред. И.А. Терсков, Новосибирск: Наука. СО АН СССР. 1984. С. 83.
Tooming H. Mathematical model of plant photosynthesis considering adaptation // Photosynthetica. 1967. V. 1. P. 233.
Тооминг Х.Г. Экологические принципы максимальной продуктивности посевов. Ленинград: Гидрометеоиздат. 1984. 264 с.
Nesterenko T.V., Tikhomirov A.A., Shikhov V.N. Ontogenetic approach to the assessment of plant resistance to prolonged stress using chlorophyll fluorescence induction method // Photosynthetica. 2006. V. 44 P. 321. https://doi.org/10.1007/s11099-006-0031-8
Дроздова И.С., Бондар В.В., Бухов Н.Г. Влияние старения листьев на индукционные переходы переменной флуоресценции хлорофилла. Содержание АТФ и метаболитов цикла Кальвина // Физиология растений. 1992. Т. 39. С.635.
Климов С.В. Корреляция между ассимиляцией СО2 и замедленной флуоресценцией при их одновременной регистрации с поверхности листа // Физиология растений. 1988. Т. 35. С. 31.
Li G.L., Wu H.X., Sun Y.Q., Zhang S.Y. Response of chlorophyll fluorescence parameters to drought stress in sugar beet seedlings // Russ. J. Plant Physiol. 2013. V. 60. P. 337. https://doi.org/10.1134/S1021443713020155
Shikhov V.N., Nesterenko T.V., Tikhomirov A.A. Effect of light intensity on chlorophyll fluorescence in wheat leaves: application of PAM-fluorometry // Russ. J. Plant Physiol. 2016. V. 63. C. 417. https://doi.org/10.1134/S1021443716030134
Мурей И.А., Рахманкулова З.Ф. Соотношение фотосинтеза и составляющих дыхание у сахарной свеклы в вегетационную фазу роста // Физиология растений. 1990. Т. 37. С. 462.
Гамалей Ю.В. Продолжительность жизни хлоропластов в клетках мезофилла // Цитология. 1975. Т. 17. С. 1243.
Шабала С.Н., Войнов О.А. Динамика физиологических характеристик растений как элемент системы экологического мониторинга // Успехи совр. биол. 1994. Т. 114. С. 144.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


