Физиология растений, 2022, T. 69, № 3, стр. 272-285
Генетические аспекты засухоустойчивости полиплоидных растений на примере пшеницы Triticum aestivum L.
С. В. Осипова a, b, *, Р. М. Островская b, А. В. Третьякова b
a Федеральное государственное бюджетное учреждение науки Сибирский институт физиологии и биохимии растений Сибирского отделения Российской академии наук
Иркутск, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
Иркутский государственный университет
Иркутск, Россия
* E-mail: svetlanaosipova2@mail.ru
Поступила в редакцию 29.09.2021
После доработки 29.09.2021
Принята к публикации 30.09.2021
- EDN: FVVLYX
- DOI: 10.31857/S0015330322020142
Аннотация
Засухоустойчивость растений – сложный количественный признак, в формировании которого участвует множество генов. На примере аллогексаплоидной пшеницы (Triticum aestivum L.) описаны подходы к изучению механизмов засухоустойчивости полиплоидных растений и их генетической и геномной архитектуры от картирования локусов количественных признаков (QTL) на хромосомах до профилирования транскриптомов и выявления стабильных блоков гаплотипов, благоприятных для урожайности в разных условиях доступности воды. Анализ функций идентифицированных кандидатных генов позволил экстраполировать молекулярные события при адаптации к засухе и выявлять уникальные для сортов стратегии адаптации, а также указал на решающую роль перепрограммирования транскрипции в процессе адаптации. Для контроля экспрессии генов функционально важна их физическая ассоциация, однако влияние пространственной организации хроматина и ко-регуляторов транскрипции на экспрессию генов, контролирующих ключевые хозяйственно-ценные признаки сельскохозяйственных растений, все еще плохо изучено. Ограничено также наше понимание специфики экспрессии генов-гомеологов, участвующих в адаптации к дефициту воды.
ВВЕДЕНИЕ
Засуха является одним из самых жестких абиотических стрессоров, вызывающих серьезные, иногда катастрофические, потери урожая сельскохозяйственных культур. Актуальность проблемы возрастает в связи с высокими рисками потерь урожаев основных зерновых культур (пшеницы, кукурузы и риса) из-за засух различной интенсивности на протяжении XXI в. [1, 2]. Считается, что эффективно противостоять засухам можно путем создания и внедрения засухоустойчивых генотипов сельскохозяйственных растений, причем лучшие результаты может дать не прямой отбор только по урожайности в неблагоприятных условиях, а комплексная стратегия с учетом морфологических, физиологических и биохимических признаков засухоустойчивости [3].
Растения отвечают на стресс из-за дефицита воды изменениями на разных уровнях организации. На морфологическом уровне уменьшается их размер, снижается площадь и количество листьев, увеличивается соотношение корень/лист; на физиологическом уровне происходит закрытие устьиц и снижение фотосинтеза, скорости транспирации, устьичной проводимости, относительного содержания воды, изменение клеточной стенки, увеличение окислительного стресса и альтернативного пути транспорта электронов в митохондриях; на биохимическом уровне снижается эффективность Рубиско и фотохимическая эффективность, активизируются системы антиоксидантной защиты, накапливаются абсцизовая кислота, пролин, полиамины, углеводы, стрессовые белки [4]. Первым о необходимости принимать во внимание физиологические признаки в процессе селекции на засухоустойчивость заявил D. Passioura [5]. Он предлагал использовать такие признаки как высокое относительное содержание воды, ремобилизация углеводных резервов, феномен “stay green“, связанный с задержкой старения флаговых листьев. Позже в селекционных программах стали использовать интегральный физиологический показатель − дискриминацию изотопов углерода (Δ13С), который у С3-растений связан с фотосинтетическим газообменом и коррелирует с эффективностью использования воды на протяжении онтогенеза [6]. С развитием флуоресцентных методов все чаще стали проводить мониторинг физиологического состояния фотосинтетического аппарата путем анализа индукционных кривых переменной флуоресценции хлорофилла [7]. В настоящее время, кроме перечисленных выше, используют следующие признаки: антиоксидантную активность, общее содержание фенолов и пролина [8], температуру полога, чувствительность к эндогенным гиббереллинам, определяющую высоту растений, содержание хлорофиллов, состав кутикулярных восков [2]. Эти признаки, наряду с оценкой фенотипа с помощью различных инструментов высокопроизводительного фенотипирования, являются хорошими кандидатами для отбора устойчивых генотипов.
В последние два десятилетия наблюдается значительный прогресс в понимании многогранности и сложности молекулярных процессов, помогающих растению адаптироваться и выживать в условиях засухи. Показано, что дефицит воды вызывает натяжение плазматической мембраны и повышение внеклеточного осмотического потенциала, что запускает открытие Ca2+ проницаемых каналов и приток ионов кальция в течение нескольких секунд после восприятия изменившихся условий [9]. Далее кальциевый сигнал передается на кальциевые белки-сенсоры (кальмодулин, кальмодулин-подобные белки, кальцинейрин-В-подобные белки) и взаимодействующие с ними Ca2+-зависимые протеинкиназы, которые осуществляют декодирование и дальнейшую трансдукцию кальциевого сигнала на белки-мишени – транскрипционные факторы, ионные помпы, ферменты углеродного и азотного метаболизма и др. [10]. В дальнейшем в передаче информации об изменившихся условиях используются также активные формы кислорода, митоген-активируемые протеинкиназы, протеинфосфатазы, фитогормоны, микроРНК, различные факторы транскрипции, ферменты, участвующие в метаболизме фосфолипидов и другие молекулы [11–14]. В ответ на активацию сигналов засухи у растений индуцируется синтез многих функциональных белков, таких как дегидрины, осмотин, антифризные белки, мРНК-связывающие белки, ключевые ферменты биосинтеза осмолитов, транспортёры сахаров и пролина, ферменты детоксикации, среди которых антиоксиданты, обеспечивающие поддержание баланса АФК, различные протеазы и другие белки [11, 15, 16]. Таким образом, на молекулярном уровне засухоустойчивость растений формируется множеством генов и регуляторных путей, перекрестные взаимодействия которых создают сложные генные сети.
Для прогресса в создании устойчивых генотипов растений с полиплоидным геномом, таких как мягкая пшеница, необходимо понимание генетической и геномной архитектуры засухоустойчивости [17]. Мягкая (хлебная) пшеница (Triticum aestivum L.) представляет собой аллогексаплоид (BBААDD, 2n = 42), возникший в результате естественной межвидовой гибридизации различных диплоидных видов [18] (рис. 1). Из-за огромного размера (16 Гб), высокой степени сходства последовательностей между гомеологичными геномами А, B и D (95–99% в кодирующих последовательностях) и большой доли повторяющейся ДНК (>80%) геном пшеницы был секвенирован и аннотирован одним из последних среди геномов основных сельскохозяйственных культур. В 2018 г. Международный консорциум по секвенированию генома пшеницы представил аннотированный референсный геном с подробным анализом содержания генов в субгеномах и структурной организации всех хромосом [19]. Секвенированный геном мягкой пшеницы активно используют для идентификации генов в локусах количественных признаков, ассоциированных с физиологическими признаками устойчивости; для полногеномного анализа отдельных генных семейств, участвующих в регуляции ответа на засуху; для выявления тканеспецифичных сетей экспрессии и коэкспрессии генов во время развития мягкой пшеницы и адаптации к воздействию стрессовых факторов. Полигенный характер признака “засухоустойчивость” и полиплоидный геном мягкой пшеницы требуют интеграции физиологических, генетических и геномных подходов в исследованиях механизмов адаптации к засухе этой культуры и разработке путей улучшения сортов. Наряду с отбором по фенотипу развиваются маркер-ориентированная селекция и геномная селекция пшеницы.
Рис. 1.
Происхождение гексаплоидной пшеницы Triticum aestivum (BBААDD). Субгеномы A, B и D в геноме мягкой пшеницы называют гомеологичными геномами. 1A,1B,1D; 2A,2B,2D; 3A,3B,3D; 4A,4B,4D; 5A,5B,5D; 6A,6B,6D; 7A,7B,7D – группы гомеологичных хромосом. Триады гомеологов ABD – копии одного и того же гена в субгеномах А, В и D.

Цель обзора – анализ современного состояния исследований засухоустойчивости у гексаплоидной пшеницы Triticum aestivum.
КАРТИРОВАНИЕ ЛОКУСОВ КОЛИЧЕСТВЕННЫХ ПРИЗНАКОВ НА ХРОМОСОМАХ МЯГКОЙ ПШЕНИЦЫ
С 1990-х гг. базовым подходом для изучения генетического контроля полигенных признаков стало картирование геномных областей (локусов количественных признаков, QTL) с использованием специально созданных картирующих популяций пшеницы и молекулярных маркеров (рис. 2), среди которых наиболее популярными были микросаттелитные маркеры [20]. С развитием технологий секвенирования доминирующие позиции в геномных исследованиях пшеницы занял полногеномный поиск ассоциаций (GWAS) между однонуклеотидными полиморфизмами (SNP) и фенотипическими признаками [21]. За последние 30 лет появилось несколько тысяч исследований по идентификации QTL для множества признаков сельскохозяйственных растений, в т.ч. для агрономических, физиологических и метаболических признаков, ассоциированных с засухоустойчивостью, и предложены кандидатные гены для практического использования [22–24].
Рис. 2.
Идентификация кандидатных генов для засухоустойчивости пшеницы через картирование локусов количественных признаков (QTL).
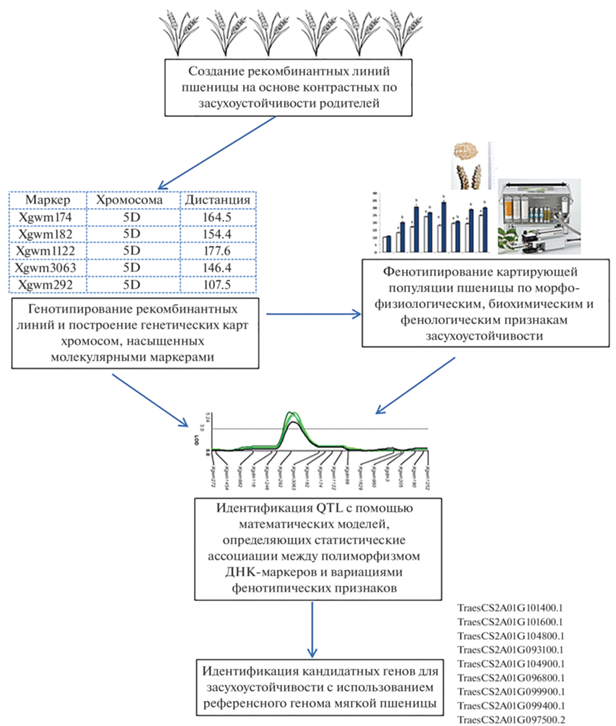
В 2015 г. был опубликован мета-анализ QTL, ассоциированных с физиологическими признаками и продуктивностью мягкой пшеницы в условиях засухи и температурного стресса [25]. Целью анализа была интеграция многочисленных данных по картированию QTL из разных экспериментов, проведенных на основе данных для 24 различных картирующих популяций пшеницы размером от 34 до 249 линий. Мета-анализ был сфокусирован на таких признаках как дискриминация изотопов углерода, температура полога, фотосинтез, содержание растворимых углеводов, водный статус, биомасса, компоненты урожая, скорость развития пшеницы в условиях стресса. Анализ показал, что QTL были неравномерно распределены между семью гомеологичными группами хромосом. Большее число QTL (163) было идентифицировано на хромосомах второй гомеологичной группы, меньшее число (92) – на хромосомах группы 6. QTL были также неравномерно распределены между хромосомами пшеницы: от 11 на хромосоме 3D до 72 на хромосоме 2B. В границах 23 идентифицированных мета-QTL были локализованы 50 SNP маркеров для генов ответа на засуху и тепловой стресс. Среди кандидатных генов (КГ) были гены, реагирующие на АБК и участвующие в контроле устьичных реакций на стресс, гены, вовлеченные в метаболизм углеводов и гены, функции которых в устойчивости пшеницы не были очевидны, т.к. не была изучена их экспрессия при стрессе [25]. Другой мета-анализ QTL, ассоциированных с засухоустойчивостью мягкой пшеницы, был сфокусирован на признаках архитектуры корневой системы. Он был проведен на основе 634 QTL, полученных из 30 предыдущих исследований [26]. В результате были идентифицированы 94 консенсусные области QTL, из которых 35 были связаны с архитектурой корня в контрастных условиях водообеспечения. Число QTL на хромосому варьировало от 7 на хромосоме 3D до 63 на хромосоме 2B, 8 мета-QTL на семи хромосомах (1А, 1В, 2А, 2В, 2В, 3В, 4В, 6А) были предложены для использования в селекции для улучшения засухоустойчивости пшеницы через архитектуру корня. Среди множества КГ, выявленных в анализе, наиболее часто встречались гены, кодирующие убиквитинлигазы E3, белки с доменом F-бокса, гликозилтрансферазы и богатый гидроксипролином гликопротеин позднего эмбриогенеза (LEA), реже – пероксидазы, белки, содержащие пентатрикопептидные повторы, белки с NAC доменами и доменами цинковых пальцев [26]. Следует отметить, что оба мета-анализа выявили наибольшее число QTL для фенотипических признаков засухоустойчивости на хромосоме 2В. Критическая роль хромосом второй гомеологичной группы в засухоустойчивости мягкой пшеницы была показана и в наших работах; замещение любой из хромосом гомеологичной группы 2 от влаголюбивого сорта пшеницы Янецкис Пробат значительно снижало засухоустойчивость адаптированного к водному дефициту сорта Саратовская 29 [27]. Используя две картирующие популяции мягкой пшеницы, мы идентифицировали хорошо воспроизводимые гомеологичные локусы на хромосомах 2D и 2А, ассоциированные с вариабельностью параметров газообмена, флуоресценции хлорофилла и биохимических индикаторов устойчивости к засухе [28, 29]. На хромосомах второй гомеологичной группы были идентифицированы позиции маркеров и значимые QTL, ассоциированные с относительным содержанием воды в листьях [30], содержанием фотосинтетических пигментов [31] и продуктивностью в условиях водного дефицита и высоких температур [32–34]. Из десяти выявленных в геноме пшеницы QTL, ассоциированных с поддержанием фертильности пыльцы в условиях осмотического стресса, локус с самым большим вкладом в изменчивость этого признака был идентифицирован на хромосоме 2А [35].
C появлением аннотированного генома мягкой пшеницы [19] QTL-анализ стал более точным, позволяющим выявить гены и генные сети в области QTL, идентифицируемого по признаку, и экстраполировать молекулярные механизмы, вовлеченные в ответные реакции на стресс и засухоустойчивость. Были разработаны методы для определения приоритетности генов-кандидатов на основе анализа их функций по генным онтологиям (ГO), что позволило значительно сократить их количество [36]. Примером может служить проведенное нами картирование локусов количественных признаков, ассоциированных с физиологическими признаками засухоустойчивости и урожайностью в контрастных условиях водообеспечения на хромосоме 2А. В этой работе было идентифицировано 56 QTL, из которых 51 были сгруппированы в пять кластеров, размер которых варьировал от двух до шести сантиморган [29]. Используя последнюю сборку генома пшеницы [19], были отобраны 39 генов, которые соответствуют терминам ГO, связанным с ответом на засуху со стороны фотосинтетического аппарата и на окислительный стресс и метаболизмом липидов. Почти половина (18) из этих КГ были факторами транскрипции (ТФ). Одиннадцать из них принадлежали к мультигенным семействам факторов транскрипции AP2/EREBR, bZIP, MYB/MYC, NAC и WRKY, роль которых в зависимых и независимых от АБК путях ответа на засуху хорошо изучена у арабидопсиса и основных сельскохозяйственных культур − пшеницы, риса, кукурузы [12]. Кроме того, выявлен ген фактора транскрипции семейства EIN3/EIL, играющего ключевую роль в сигнальном пути этилена, и ген семейства GRAS подсемейства DELLA, участвующий в гормональных сигнальных путях, опосредованных гибберелловой, жасмоновой, абсцизовой, салициловой кислотами и этиленом. Среди структурных генов, участвующих в работе фотосинтетического аппарата, в обнаруженных нами QTL были: ген, кодирующий малую субъединицу Рубиско, гены белка светособирающего комплекса ФС II Lhcb6, ген белка-переносчика электронов в ФС II PsbQ-like1 и ген криптохрома. В целом, функции большинства выявленных КГ были связаны с регуляцией путей гормональной сигнализации, большая часть – с регуляцией AБК-сигнализации, а также с сигнальными путями этилена, ауксина, жасмоновой, салициловой и гибберелловой кислот [29]. В границах значительного числа опубликованных QTL, ассоциированных с урожайностью и физиологическими признаками при дефиците воды, были локализованы гены-гомологи арабидопсиса, кодирующие факторы транскрипции и сигнальные молекулы. Отсюда появились идеи использовать эти гены для улучшения засухоустойчивости пшеницы [15, 37]. Однако факт локализации в пределах значимого QTL генов, хорошо изученных у модельных растений, таких как арабидопсис или рис, недостаточен для установления его функций у пшеницы, поскольку для полиплоидных геномов характерна гомеолог-специфичная экспрессия триад гомеологичных генов. Например, инфекция мучнистой росы индуцирует экспрессию TaCpk2-A1 (ген кальций-зависимой протеинкиназы TaCpk2), тогда как экспрессия TaCpk2-D1 в основном индуцируется низкими температурами [38]. Эту специфику можно выявить лишь анализом экспрессии транскриптома.
Благодаря поиску QTL постепенно прояснялась картина геномной архитектуры признаков, ассоциированных с устойчивостью, однако четкого понимания молекулярной основы большинства QTL, используемых селекционерами, в отношении пшеницы пока нет [39]. Несмотря на это, маркеры, ассоциированные с целевыми признаками и выявленные в работах по картированию QTL, могут быть вовлечены в процесс маркер-ориентированной селекции (MОС) [21, 40].
АНАЛИЗ ЭКСПРЕССИИ ГЕНОВ В ИССЛЕДОВАНИЯХ ЗАСУХОУСТОЙЧИВОСТИ МЯГКОЙ ПШЕНИЦЫ
Начиная с 2005 г. активно развиваются и удешевляются технологии секвенирования нового поколения, благодаря чему анализ транскриптома мягкой пшеницы в условиях стресса в сочетании с опубликованными данными по картированию QTL и референсным геномом становится важнейшим инструментом для понимания механизмов и геномной архитектуры засухоустойчивости. Такой комплексный подход использовался в работе Galvez с соавт. [17] при изучении реакций на водный стресс разной интенсивности мягкой пшеницы сорта Чайниз Спринг, выращенной в поле. Для оценки степени стресса растений в этой работе применяли спектральные характеристики, позволяющие проводить фенотипирование в полевых условиях.
Анализом коэкспрессии 30180 генов были выявлены геномные регионы, в которых размещены компактные кластеры генов, дифференциально экспрессирующихся в условиях засухи. Эти генные кластеры были расположены, главным образом, в дистальных областях хромосом и были названы кластерами зависимых от засухи генов (КЗЗГ). Условиями, при которых данный кластер генов считался КЗЗГ, были следующими: 1) не менее трех генов должно находиться в области 1 Mб, 2) каждый ген должен принадлежать к триаде гомеологов ABD и 3) кластер должен включать хотя бы один ген, дифференциально экспрессирующийся в условиях засухи. Примерно 65% всех экспрессируемых триад генов показали сбалансированную экспрессию между субгеномами A, B и D независимо от условий водообеспечения. В кластерах зависимых от засухи генов лишь 30% триад АВD показали сбалансированную экспрессию, а 70% триад имели более высокую или более низкую экспрессию одного гомеолога относительно двух других. Несбалансированность экспрессии гомеологов в кластерах зависимых от засухи генов была более выраженной по мере того, как увеличивался уровень стресса от засухи. Это указывает на то, что гомеолог-специфичная экспрессия КЗЗГ играет важную роль в ответах на стресс, вызванный засухой [17].
Понимание отношений между гомеологами имеет большое значение для улучшения засухоустойчивости полиплоидной пшеницы, т.к. изменчивость многих количественных признаков модулируется генетическими взаимодействиями между множеством наборов гомеологов в субгеномах A, B и D. Дополнительную сложность добавляет специфичность экспрессии гомеологов. Ramirez-Gonzalez с соавт. [41] показали, что паттерны экспрессии гомеологов в мягкой пшенице сформированы полиплоидией и связаны как с эпигенетическими модификациями, так и с вариациями в мобильных элементах в промоторах гомеологичных генов. Ramirez-Gonzalez и Borrill с соавт. [39, 41] считают, что понимание функций аллельных вариантов у гомеологов и управление ими может открыть широкий спектр фенотипических вариаций, которые ранее оставались за рамками селекции и естественного отбора, и раскрыть весь потенциал полиплоидной пшеницы.
Galvez с соавт. [17] выявили множество генных кластеров, семейств генов, микроРНК, репертуар которых различался в зависимости от интенсивности стресса, а также факторы транскрипции, координирующие ответы на засуху. Особое внимание авторы уделили семейству генов дегидринов, учитывая известную роль дегидринов в засухоустойчивости растений [42]. Из 50 генов дегидрина 37 были сгруппированы на хромосомах 5 и 6 групп. 13 генов дегидринов сверхэкспрессировались в ответ на засуху во флаговом листе, 11 из них были расположены на длинном плече хромосом группы 6, а остальные два – на длинном плече хромосомы 5B. Основной кластер дегидрина на хромосомах группы 6 соответствовал КЗЗГ, который находится в том же физическом положении, что и ранее известный мета-QTL для засухоустойчивости пшеницы на хромосомах 6В и 6D [25], что значительно повышает надежность их использования при создании засухоустойчивых сортов. Кроме того, на длинных плечах хромосом группы 5 была идентифицирована область размером примерно 50 Mб, содержащая несколько чувствительных к засухе дифференциально экспрессирующихся генов (в т.ч. кластер генов дегидрина) и ранее выявленные Quarrie с соавт. [43] гены, регулирующие индуцируемую засухой продукцию АБК. Этот интервал также содержал главный ген яровизации Vrn1, который влияет на архитектуру корневой системы пшеницы [44]. Таким образом, профилированием транскриптома в геноме пшеницы были верифицированы локусы, ранее выявленные путем QTL-картирования.
Сравнение экспрессии генов в условиях полевой засухи и в экспериментах с моделируемым стрессом с помощью полиэтиленгликоля (ПЭГ) показало, что почти половина (47%) идентифицированных дифференциально экспрессирующихся (ДЭ) в ответ на засуху генов были выявлены только в условиях полевой засухи [17]. Это свидетельствует о том, что исследования геномной архитектуры засухоустойчивости пшениц должны быть максимально приближены к естественным условиям их произрастания в регионах возделывания.
Аннотированный референсный геном пшеницы сорта Чайниз Спринг [19] не может полностью отразить внутривидовые геномные вариации, несмотря на то, что он является чрезвычайно ценным ресурсом. Сравнительный анализ геномного разнообразия среди 15 разных селекционных линий пшеницы из мировых генных банков выявил крупномасштабные рекомбинации в хромосомах и различия в содержании генов в результате сложных историй селекции, направленных на улучшение адаптации к различным условиям окружающей среды, урожайности и качества зерна [45]. Вероятно, этими различиями объясняется разнообразие стратегий адаптации разных сортов пшеницы. Секвенирование РНК демонстрирует существенные различия в транскриптомном ответе на стресс у сортов пшеницы из разных географических регионов. Так, в ответ на дефицит воды у пшеницы Саратовская 29, засухоустойчивого сорта степного волжского экотипа, повышалась экспрессия АТФаз семейства ААА, сигнальных и регуляторных белков с доменом F-бокса, белков суперсемейства α/β гидролаз, abc – транспортеров. А пшеница Янецкис Пробат, которая считается чувствительным к засухе сортом, характеризовалась снижением экспрессии трансмембранных переносчиков аминокислот [46]. Даже сорта, хорошо адаптированные к условиям одного и того же географического региона, такие как засухоустойчивые сорта озимой пшеницы ТАМ 111 и ТАМ 112, знаковые для южных районов США, могут реализовывать разные механизмы засухоустойчивости [47]. Более 50% ДЭ генов в разных условиях доступности воды были обнаружены у обоих сортов, что свидетельствует о наличии у них консервативной регуляторной сети. Однако экспрессия других генов существенно различалась. Это касалось генов, участвующих в процессах фосфорилирования белков, генов с функцией связывания аденил-рибонуклеотида или генов, кодирующих белки с функциями регуляции транскрипции и трансмембранного транспорта. В условиях засухи экспрессия этих генов у ТАМ 111 была снижена по сравнению с ТАМ 112, что говорит о том, что ТАМ 112 имел относительно более активную регуляцию экспрессии генов, чем ТАМ 111 [47]. На уровне фенотипа это проявлялось в более высокой эффективности использования воды и более высокой урожайности при продолжительной засухе. У ТАМ 111 при водном дефиците было больше стерильных колосков в колосе. Вероятно, сниженная экспрессия специфических ДЭ генов в условиях засухи помогала ТАМ 111 сэкономить больше энергии для транспортировки углеводов от стеблей и колосьев к зерновкам или даже приводила к корректировке экспрессии генов, чтобы вызвать прерывание развития семян в некоторых колосках для сохранения общего урожая [47].
Chaichi с соавт. [48] с помощью секвенирования РНК выявили стратегию адаптации староместного сорта пшеницы путем избегания засухи. В другом исследовании двух контрастных по устойчивости к засухе сортов пшеницы было показано, что среди ДЭ генов устойчивого генотипа было большое число генов, контролирующих сигнальную трансдукцию и активность митоген-активированной протеинкиназы. Кроме того, у засухоустойчивого и чувствительного генотипов в условиях засухи было выявлено, соответственно, 32 и 2 сайта редактирования РНК. Это свидетельствует о том, что редактирование РНК играет важную роль в засухоустойчивости у пшеницы [49].
Засуха в первую очередь воспринимается корнями растений. Анализом транскриптома тканей корней пшеницы, выращенной в поле, были выявлены механизмы контроля засухи от восприятия дефицита воды, внутриклеточной передачи сигнала, опосредованной серин/треонин-протеинкиназой SRK, передачи сигналов AБК вместе с активацией сигнального пути салициловой кислоты, ответа на окислительный стресс, до обезвреживания АФК, поддержания энергетического баланса, закрытия устьиц, регуляции клеточной стенки, защитного ответа и, наконец, старения [50]. Была обнаружена повышенная экспрессия генов вторичных метаболитов, которые необходимы для противостояния осмотическому и окислительному стрессам, а также генов, кодирующих факторы транскрипции bHLH, MYB, WRKY, NAC и FAR1. Роль последних в засухоустойчивости пшеницы может быть связана с уменьшением накопления активных форм кислорода и гибели клеток, вызванной окислительным стрессом [51]. Была обнаружена также повышенная экспрессия нескольких десятков микроРНК, участвующих в регуляции ответов на засуху. ПЭГ-индуцированный стресс в корнях проростков засухоустойчивой мягкой пшеницы также значительно влиял на экспрессию 37 микроРНК, мишени которых включали 6-фосфоглюконатдегидрогеназу, эпоксидгидролазу, сахарозосинтазу, фитохром и белок, регулирующий время цветения [52].
Факторы транскрипции пяти мультигенных семейств AP2/EREBP, bZIP, MYB/MYC, NAC и WRKY считаются основной группой регуляторов транскрипции, отвечающих за устойчивость растений к абиотическим стрессам [12]. Гены этих семейств были выявлены путем профилирования транскриптома [17, 50], а также обнаружены в границах QTL, ассоциированных с морфо-физиологическими признаками засухоустойчивости [29]. Среди них большое внимание привлекают ТФ DREB (AP2/EREBP) в связи с большим числом сообщений об их центральной роли в устойчивости и многочисленным попыткам применить гены DREB в генной инженерии для повышения устойчивости растений к абиотическим стрессам [15, 37]. Всего у мягкой пшеницы было выявлено 210 генов DREB, которые были неравномерно распределены в геноме [53]. Экспрессия трех гомеологичных генов TaDREB3 индуцировалась абиотическими стрессами. Трансгенный арабидопсис, сверхэкспрессирующий TaDREB3-AI, продемонстрировал повышенную устойчивость к засухе, солевому и тепловому стрессу. Shavrukov с соавт. [54] обнаружили существенную разницу в уровнях экспрессии генов TaDREB5 в листьях казахстанских пшениц с разной урожайностью в условиях засухи. В группе из шести сортов пшениц с высоким урожаем зерна была показана небольшая активация транскриптов TaDREB5 в обезвоженных листьях. Напротив, экспрессия TaDREB5 в растениях из группы сортов с низким урожаем зерна (6 сортов) была значительно подавлена. Однако использование в инженерии стрессоустойчивости пшеницы генов DREB часто отрицательно влияло на урожайность, что объяснялось перераспределением энергопотребления между ростом и развитием и стрессоустойчивостью, поэтому факторы транскрипции DREB чаще используют в случаях, когда основной целью является выживание растений в стрессовых условиях, а урожай не так важен [37].
Факторы транскрипции семейства NAC также рассматриваются как кандидаты для улучшения устойчивости сельскохозяйственных культур к неблагоприятным условиям окружающей среды. Guerin с соавт. [55], используя общедоступную базу данных IWGS RefSeq v1.0, идентифицировали 488 членов семейства NAC у мягкой пшеницы и выявили равномерное распределение генов TaNAC в трех субгеномах пшеницы. Паттерны экспрессии 23 генов TaNAC обнаружили функциональную диверсификацию членов этого семейства генов. Были выявлены пять специфичных для зерна генов TaNAC, функциональные характеристики которых позволяют предположить, что они участвуют в развитии зерна пшеницы и в ответах на абиотический стресс.
Хорошим примером использования фактора транскрипции семейства NAC для получения трансгенной пшеницы с улучшенными параметрами засухоустойчивости является работа Chen с соавт. [56], в которой на основе данных секвенирования транскриптомов de novo проростков пшеницы Triticum aestivum L. были идентифицированы 43 гена семейства факторов транскрипции NAC, индуцируемые засухой. Было показано, что транскрипт TaNAC48 активировался засухой, обработкой ПЭГ, H2O2 и АБК. Сверхэкспрессия TaNAC48 увеличивала чувствительность растений к АБК и значительно улучшала устойчивость трансгенных растений к засухе, но не солевому стрессу. При этом повышалось содержание пролина, снижалась скорость потери воды, накопление малонового диальдегида и H2O2. В то же время в этом исследовании трансгенные растения не показали различий с диким типом в архитектуре растений и урожайности зерна при оптимальном поливе. Длина корня, длина побегов и устьица трансгенных растений были более чувствительны к АБК. Было показано также, что ген TaAREB3 может связываться с цис-действующим AБК-чувствительным элементом (ABRE) на TaNAC48 промоторе и активировать экспрессию TaNAC48. На основании этих данных авторы полагают, что TaNAC48 может участвовать в регулировании засухоустойчивости посредством АБК-опосредованного сигнального пути.
Mao с соавт. [57] провели анализ ассоциаций с засухоустойчивостью чувствительных к стрессу генов-кандидатов семейства NAC в панели пшеницы, состоящей из 700 сортов, собранных по всему миру. Был идентифицирован ген TaSNAC8-6A, который тесно связан с засухоустойчивостью у проростков пшеницы. Трансгенная пшеница и линии арабидопсиса, сверхэкспрессирующие TaSNAC8-6A, показали повышенную засухоустойчивость за счет индукции сигнальных путей ауксина и стимуляции развития боковых корней, что впоследствии повысило эффективность использования воды. Был выявлен благоприятный аллель TaSNAC8-6AIn-313, который в значительной степени способствует устойчивости пшеницы к засухе и представляет собой ценный генетический ресурс.
Таким образом, анализ экспрессии генов в сочетании с данными картирования QTL и аннотированной референсной последовательностью мягкой пшеницы помогает выявить как универсальные, так и уникальные для сортов стратегии адаптации к засухе, а также новые кандидатные гены и благоприятные аллели, которые можно использовать для улучшения пшеницы биотехнологическими методами или с помощью маркер опосредованной селекции. Для отбора благоприятных аллелей используют аллель-специфичные маркеры, способствующие засухоустойчивости в определенных популяциях пшеницы. Так, Khalid с соавт. [58] идентифицировали благоприятные аллели пяти генов-кандидатов, связанных с адаптацией к засухе, в т.ч. гена инвертазы клеточной стенки (TaCwi-1A), которые можно использовать в МОС. Вероятно, маркеры к этим аллелям, к аллелю TaSNAC8-6AIn-313 или к генам TaNAC48 и TaDREB5, описанным выше, также могут быть хорошими кандидатами для МОС.
ИЗУЧЕНИЕ ЗАСУХОУСТОЙЧИВОСТИ МЯГКОЙ ПШЕНИЦЫ В ЭПОХУ ПОСГЕНОМНОГО СЕКВЕНИРОВАНИЯ
Достижения в области секвенирования и сборки геномов помогают идентифицировать широкий спектр генетической изменчивости и связать генетическое разнообразие (QTL, SNP-маркеры, блоки гаплотипов) с различными фенотипическими признаками. Недорогие платформы генотипирования теперь доступны для всех сельскохозяйственных культур, важных с точки зрения агрономии [59]. Вместе с развивающимися методами обработки больших данных и биоинформатики они обеспечивают эффективные средства для генетических исследований сельскохозяйственных культур и помогают понять молекулярные механизмы засухоустойчивости [17, 60, 61].
Чтобы вывести улучшенные сорта пшеницы, селекционеры манипулируют с аллельными вариантами генов, которые чаще всего наследуются не независимо, а как блоки гаплотипов, включающие в себя несколько генов, находящихся в генетическом сцеплении. Будучи мультиаллельными, гаплотипы более информативны, чем биаллельные SNP-маркеры, и позволяют идентифицировать генетические локусы, лежащие в основе признаков с относительно высоким разрешением [62]. Для пшеницы пока очень мало исследований, посвященных гаплотипам, хотя считается, что полиплоидные виды являются главными бенефициарами этой технологии, и разработка маркеров к полезным блокам гаплотипов поможет более эффективно интегрировать благоприятные гены в новые сорта пшеницы. Так, в коллекции из 102 сортов аргентинских гексаплоидных пшениц было выявлено 1268 блоков гаплотипов разного размера, распределенных по геному, включая высококонсервативные области. Ген Ppd-D1 на хромосоме 2D идентифицирован как главный детерминант жизненного цикла аргентинских сортов пшеницы в условиях адаптации [63]. Показательным является обширное исследование полногеномных ассоциаций (GWAS) с использованием гаплотипов и индивидуальных SNP, выполненное для зерновой урожайности и стабильности урожая в разных условиях водообеспечения учеными Международного центра улучшения кукурузы и пшеницы (CIMMYT) и Канзасского университета [64]. В течение семи вегетационных сезонов от 643 до 1086 перспективных линий пшеницы испытывались в нескольких контрастных условиях: оптимальный полив, умеренная засуха, суровая засуха и тепловой стресс. Линии были фенотипированы по зерновой урожайности, количеству дней до колошения и высоте растений и генотипированы с помощью маркеров GBS (genotyping by sequencing). Всего в геномах было установлено 519 блоков гаплотипов, количество аллелей в каждом блоке варьировало от 3 (4D) до 143 (7А). Блоки были распределены в соответствии с длиной каждой хромосомы, наибольшая плотность маркеров была в геномах A и B (231 и 239, соответственно), а наименьшая – в геноме D (49). Наибольшее число блоков гаплотипов было получено на хромосомах 7A (51), за ними следовали хромосомы 2B и 7B (по 46 каждая), тогда как наименьшее количество было получено на хромосоме 4D (1). Для каждого из условий среды были идентифицированы благоприятные блоки гаплотипов, ассоциированные со значительным повышением урожайности. Идентифицировано 30 стабильных гаплотипов, благоприятных в нескольких средах и в каждый из семи вегетационных периодов, включая семь “hotspot” на хромосомах 1A, 1B, 2B, 4A, 5B, 6B и 7B, где несколько блоков гаплотипов на одной хромосоме были связаны с высокой урожайностью. Из 30 стабильных блоков гаплотипов восемь блоков соответствовали пяти мета-QTL, идентифицированным Acuña-Galindo с соавт. [25]. Идентифицированы потенциальные гены-кандидаты, лежащие в основе стабильных блоков гаплотипов. В числе КГ были гены, экспрессия которых в пшенице в различных стрессовых условиях хорошо доказана, а также гены, роль которых в устойчивости к абиотическому стрессу доказана у модельных растений. Это гены, кодирующие ферменты с оксидоредуктазной, протеинкиназной, метилтрансферазной активностью, сигнальные пептиды, сериновые протеазы [64]. Среди КГ был ген, кодирующий белок c доменом DEK, который контролирует баланс между ростом и торможением роста у растений и животных посредством эволюционно консервативного механизма, связанного с ремоделированием хроматина. У Arabidopsis thaliana DEK3 специфически связывает гистоны H3 и H4, влияет на занятость нуклеосом и доступность хроматина и модулирует экспрессию генов-мишеней DEK3 [65]. Функциональные уровни DEK3 имеют решающее значение для устойчивости растений арабидопсиса к температурным стрессам [66].
Ген семейства F-бокса, отобранный в качестве КГ, принадлежит семейству генов, которые в большом количестве (1796) представлены в геноме пшеницы [67] и играют особую роль в регуляции деградации белков через убиквитин-протеасомный протеолитический механизм в ответ на различные сигналы в процессе роста и развития, сигналы гормонов и биотические/абиотические стрессовые реакции [68]. Несмотря на важную роль этих генов в регуляции развития растений и ответах на воздействие биотических и абиотических стрессоров, до последнего времени функциональный анализ генов F-бокса у пшеницы был проведен на уровне одного гена [69], поэтому необходимо дальнейшее исследование функций генов-кандидатов этого семейства. В списке КГ были также гены, кодирующие белки с JAZ (Jasmonate-zim) доменом, которые являются репрессорами транскрипции в сигнальном пути жасмоновой кислоты и играют важную роль в регуляции роста и развития растений. Для пшеницы показано, что эти гены очень чувствительны к воздействию высокой засоленности, засухи и низких температур и могут участвовать в сложных регуляторных сетях [70]. Факторы транскрипции семейства MYB, которые также вошли в список КГ, у пшеницы систематически идентифицированы и проанализированы, многие R2R3-MYB пшеницы участвуют в реакциях на абиотический и биотический стрессы [71]. Таким образом, в исследовании Sehgal с соавт. [64] была выявлена сложная генетическая архитектура урожайности зерна в условиях засухи разной интенсивности, стабильные блоки гаплотипов, идентифицированы маркеры к благоприятным блокам гаплотипов и кандидатные гены, лежащие в основе стабильных блоков-гаплотипов и позволяющие определить молекулярные механизмы устойчивости. Польза подобных исследований для практической селекции очевидна. Генотипирование всех линий, участвующих в испытаниях урожайности, становится рутинной процедурой для программ CIMMYT и других селекционных программ. Линии с большим количеством благоприятных гаплотипов можно повторно включать в процесс селекции в качестве элитных родителей. Вместе с тем, это исследование дает много информации для понимания молекулярных механизмов засухоустойчивости, в частности, подчеркивает роль механизмов ремоделирования хроматина в регуляции экспрессии генов при адаптации к засухе.
ЗАКЛЮЧЕНИЕ И ПЕРСПЕКТИВЫ
Идентификация кандидатных генов для засухоустойчивости мягкой пшеницы с помощью картирования локусов количественных признаков на хромосомах, профилирования транскриптома и использования аннотированного референсного генома помогает более полно экстраполировать картину молекулярных событий, имеющих место при адаптации к засухе. Значительная часть кандидатных генов, выявленных в описанных выше исследованиях, кодирует факторы и корегуляторы транскрипции, а также компоненты аппарата транскрипции, что указывает на решающую роль перепрограммирования транскрипции в процессе адаптации к засухе. После публикации референсного генома мягкой пшеницы появилось множество работ по полногеномному анализу факторов транскрипции. Однако данные о функциональной характеристике ТФ, вовлеченных в ответ на водный стресс, об их распределении в геноме и возможности использования в практической селекции или биотехнологии все еще ограничены.
Транскрипционная регуляция активно изучается на модельных растениях. Опубликовано значительное количество данных, подтверждающих важную роль в процессах адаптации к абиотическим и биотическим стрессам многосубъединичного комплекса МЕДИАТОР, который является коактиватором транскрипции за счет взаимодействия с РНК-полимеразой II и общими и специфическими факторами транскрипции [72]. Хорошо изучена субъединица MED25, которая, предположительно, является одной из самых многофункциональных субъединиц у растений и участвует в регуляции времени цветения, интеграции сигнальных путей гормонов, регуляции развития и устойчивости к стрессам [73]. У арабидопсиса определены стресс-специфические роли субъединиц MED9, MED16, MED18 и CDK8 в условиях жары, холода и солевого стресса [74]. Несмотря на очевидный прогресс в понимании роли МЕДИАТОРА в регуляции ответов растений на стрессовые условия, многое остается неизвестно, особенно ограничены знания о специфических функциях субъединиц комплекса МЕДИАТОР у сельскохозяйственных растений. У мягкой пшеницы была показана роль субъединицы TaMED25, локализованной на хромосомах 5A, 5B и 5D, в регуляции сигнального пути иммунного ответа на заражение мучнистой росой [75]. Hiebert с соавт. [76] установили, что ген SuSr-D1, известный как супрессор устойчивости к стеблевой ржавчине, кодирует субъединицу медиатора Med15b.D. Эта работа демонстрирует сложность взаимодействий между субгеномами пшеницы и определяет новый подход к повышению устойчивости к стеблевой ржавчине за счет удаления супрессоров. В целом же наше понимание того, в какой степени гены-гомеологи похожи или отличаются друг от друга по паттернам экспрессии и пространственно-временной динамике этих отношений, и как взаимодействия между гомеологами влияют на биологические признаки, на сегодняшний день ограничено.
В свете того, что конформация хроматина сильно влияет на экспрессию генов, активно развивается изучение пространственной организации хроматина. В недавнем исследовании Concia с соавт. [77] показано наличие в ядерном геноме мягкой пшеницы трех уровней крупномасштабной пространственной организации − расположение в территориях генома, разделение факультативного и конститутивного гетерохроматина и организация РНК-полимеразы II вокруг фабрик транскрипции. Авторы выявили в геноме пшеницы микрокомпартментализацию транскрипционно активных генов путем физических взаимодействий между генами со специфическими модификациями эухроматических гистонов. Как внутри-, так и межхромосомные контакты, ассоциированные с РНК-полимеразой, включают гены с одинаковыми уровнями экспрессии. Это предполагает, что физическая ассоциация функционально важна для контроля экспрессии генов [77], однако влияние организации хроматина и ко-регуляторов транскрипции на экспрессию генов, контролирующих ключевые хозяйственно-ценные признаки сельскохозяйственных растений, все еще плохо изучено. Для модельных растений показана также существенная роль АТФ-зависимых комплексов ремоделирования хроматина типа SWI/SNF в регуляции гормональных сигнальных путей [78], формировании “стрессовой памяти” [79] и регуляции взаимодействий между сигнальными путями АБК и шаперонов [80]. Исследования в этих направлениях необходимы для целостного понимания процессов адаптации мягкой пшеницы к неблагоприятным условиям и расширяют спектр потенциально благоприятных генов для практического использования. При создании улучшенных сортов для конкретных экологических условий необходимы также исследования сортоспецифичных стратегий адаптации пшеницы к разным сценариям засухи.
Полиплоидный геном мягкой пшеницы и полигенный характер признака “засухоустойчивость” определяют сложность выбора целевого гена, интрогрессия, трансформация или геномное редактирование которого приводили бы к повышению устойчивости без ущерба процессам роста и развития, хотя отдельные примеры удачного применения биотехнологических подходов имеются. Все же наиболее адекватными путями повышения засухоустойчивости гексаплоидной пшеницы считаются геномная и маркер-ориентированная селекция, выявление благоприятных и стабильных блоков гаплотипов и разработка надежных маркеров к ним. Секвенированная геномная последовательность мягкой пшеницы активно используется для этих целей.
Работа поддержана бюджетным проектом № 0277-2021-0002 Сибирского института физиологии и биохимии растений Сибирского отделения Российской академии наук.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Leng G., Hall J. Crop yield sensitivity of global major agricultural countries to droughts and the projected changes in the future // Sci. Total Environ. 2019. V. 654. P. 811. https://doi.org/10.1016/j.scitotenv.2018.10.434
Khadka K., Earl H.J., Raizada M.N., Navabi A. A physio-morphological trait-based approach for breeding drought tolerant wheat // Front. Plant Sci. 2020. V. 11. P. 715. https://doi.org/10.3389/fpls.2020.00715
Varshney R.K., Tuberosa R., Tardieu F. Progress in understanding drought tolerance: from alleles to cropping systems // J. Exp. Bot. 2018. V. 69. P. 3175. https://doi.org/10.1093/jxb/ery187
Nezhadahmadi A., Prodhan Z.H., Faruq G. Drought tolerance in wheat // Sci. World J. V. 2013. Article ID 610721. https://doi.org/10.1155/2013/610721
Passiora J.B. Grain-yield, harvest index and water-use of wheat // J. Aust. Inst. Agric. Sci. 1977. V. 43. P. 117.
Condon A.G., Farquhar G.D., Richards R.A. Genotypic variation in carbon isotope discrimination and transpiration efficiency in wheat. Leaf gas exchange and whole plant studies // Aust. J. Plant Physiol. 1990. V. 17. P. 9.
Goltsev V.N., Kalaji H.M., Paunov M. Bąba W., Horaczek T., Mojski J., Kociel H., Allakhverdiev S. Variable chlorophyll fluorescence and its use for assessing physiological condition of plant photosynthetic apparatus // Russ. J. Plant Physiol. 2016. V. 63. P. 869. https://doi.org/10.1134/S1021443716050058
Upadhyay D., Budhlakoti N., Singh A.K., Bansal R., Kumari J., Chaudhary N., Padaria J.C., Sareen S., Kumar S. Drought tolerance in Triticum aestivum L. genotypes associated with enhanced antioxidative protection and declined lipid peroxidation // 3 Biotech. 2020. V. 10. P. 281. https://doi.org/10.1007/s13205-020-02264-8
Liu X., Wang J., Sun L. Structure of the hyperosmolality-gated calcium-permeable channel OSCA1.2 // Nat. Commun. 2018. V. 9. Article ID 5060. https://doi.org/10.1038/s41467-018-07564-5
Medvedev S.S. Principles of calcium signal generation and transduction in plant cells // Russ. J. Plant Physiol. 2018. V. 65. P. 771. https://doi.org/10.1134/S1021443718060109
Shinozaki K., Yamaguchi-Shinozaki K. Gene networks involved in drought stress response and tolerance // J. Exp. Bot. 2007. V. 58. P. 221. https://doi.org/10.1093/jxb/erl164
Gahlaut V., Jaiswal V., Kumar A., Gupta P. Transcription factors involved in drought tolerance and their possible role in developing drought tolerance cultivars with emphasis on wheat (Triticum aestivum L.) // Theor. Appl. Genet. 2016. V. 129. P. 2019. https://doi.org/10.1007/s00122-016-2794-z
Abhinandan K., Skori L., Stanic M., Hickerson N.M.N., Jamshed M., Samuel M.A. Abiotic stress signaling in wheat – an inclusive overview of hormonal interactions during abiotic stress responses in wheat // Front. Plant Sci. 2018. V. 9. P. 734. https://doi.org/10.3389/fpls.2018.00734
Lamers J., van der Meer T., Testerink C. How plants sense and respond to stressful environments // Plant Physiol. 2020. V. 182. P. 1624. https://doi.org/10.1104/pp.19.01464
Budak H., Hussain B., Khan Z., Ozturk N.Z., Ullah N. From genetics to functional genomics: improvement in drought signaling and tolerance in wheat // Front. Plant Sci. 2015. V. 6. P. 1012. https://doi.org/10.3389/fpls.2015.01012
Samarah N.H. Understanding how plants respond to drought stress at the molecular and whole plant levels // Drought stress tolerance in plants / Eds. M.A. Hossain et al. Springer, Cham. 2016. 616 p. https://doi.org/10.1007/978-3-319-32423-4
Gálvez S., Mérida-García R., Camino C., Borrill P., Abrouk M., Ramírez-González R.H., Biyiklioglu S., Amil-Ruiz F., The IWGSC, Dorado G., Budak H., Gonzalez-Dugo V., Zarco-Tejada P.J., Appels R., Uauy C. et al. Hotspots in the genomic architecture of field drought responses in wheat as breeding targets // Funct. Integr. Genomics. 2019. V. 19. P. 295. https://doi.org/10.1007/s12374-012-0377-3
Loginova D.B., Silkova O.G. The genome of bread wheat Triticum aestivum L.: Unique structural and functional properties // Russ. J. Genet. 2018. V. 54. P. 403. https://doi.org/10.1134/S1022795418040105
International Wheat Genome Sequencing Consortium. Shifting the limits in wheat research and breeding using a fully annotated reference genome // Science. 2018. V. 361. https://doi.org/10.1126/science.aar7191
Kumar J., Gupta D.S., Gupta S., Dubey S., Gupta P., Kumar S. Quantitative trait loci from identification to exploitation for crop improvement // Plant Cell Rep. 2017. V. 36. P. 1187. https://doi.org/10.1007/s00299-017-2127-y
Салина Е.С. Технологии геномного моделирования и редактирования для решения задач селекции // Достижения науки и техники АПК. 2016. Т. 30. С. 9.
Kulkarni M., Soolanayakanahally R., Ogawa S., Uga Y., Selvaraj M.G., Kagale S. Drought response in wheat: key genes and regulatory mechanisms controlling root system architecture and transpiration efficiency // Front. Chem. 2017. V. 5. P. 106. https://doi.org/10.3389/fchem.2017.0010
Sallam A., Alqudah A.M., Dawood M.F.A., Baenziger P.S., Börner A. Drought stress tolerance in wheat and barley: advances in physiology, breeding and genetics research // Int. J. Mol. Sci. 2019. V. 20. P. 3137. https://doi.org/10.3390/ijms20133137
Khadka K., Raizada M.N., Navabi A. Recent progress in germplasm evaluation and gene mapping to enable breeding of drought-tolerant wheat // Front. Plant Sci. 2020. V. 11. P. 1149. https://doi.org/10.3389/fpls.2020.01149
Acuna-Galindo M.A., Mason E., Subramanian N.K., Hays D.B. Meta-analysis of wheat QTL regions associated with adaptation to drought and heat stress // Crop Sci. 2015. V. 55. P. 477. https://doi.org/10.2135/cropsci2013.11.0793
Soriano J.M., Alvaro F. Discovering consensus genomic regions in wheat for root-related traits by QTL meta-analysis // Sci. Rep. 2019. V. 9. P. 10537. https://doi.org/10.1038/s41598-019-47038-2
Osipova S.V., Permyakov A.V., Permyakova M.D., Pshenichnikova T.A., Genaev M.A. Börner A. The antioxidant enzymes activity in leaves of inter – varietal substitution lines of wheat (Triticum aestivum L.) with different tolerance to soil water deficit // Acta Physiol. Plant. 2013. V. 35. P. 2455. https://doi.org/10.1007/S11738-013-1280-3
Osipova S., Permyakov A., Permyakova M., Pshenichnikova T., Verkhoturov V., Rudikovsky A., Rudikovskaya E., Shishparenok A., Doroshkov A., Boerner A. Regions of the bread wheat D genome associated with variation in key photosynthesis traits and shoot biomass under both well watered and water deficient conditions // J. Appl. Gen. 2016. V. 57 P. 151. https://doi.org/10.1007/s13353-015-0315-4
Pshenichnikova T.A., Osipova S.V., Smirnova O.G., Leonova I.N., Permyakova M.D., Permyakov A.V., Rudikovskaya E.G., Konstantinov D.K., Verkhoturov V.V., Lohwasser U., Börner A. Regions of chromosome 2A of bread wheat (Triticum aestivum L.) associated with variation in physiological and agronomical traits under contrasting water regimes // Plants. 2021. V. 10. P. 1023. https://doi.org/10.3390/plants10051023
Ahmad M.A., Khan S.H., Khan A.S., Kazi A.M., Basra S.M.A. Identification of QTLs for drought tolerance traits on wheat chromosome 2A using association mapping // Int. J. Agric. Biol. 2014. V. 16. P. 862. http:// www.fspublishers.org/published_papers/86309_..pdf
Czyczylo-Mysza I., Tyrka M., Marcińska I., Skrzypek E., Karbarz M., Dziurka M., Hura T., Dziurka K., Quarrie S.A. Quantitative trait loci for leaf chlorophyll fluorescence parameters, chlorophyll and carotenoid contents in relation to biomass and yield in bread wheat and their chromosome deletion bin assignments // Mol. Breed. 2013. V. 32. P. 189. https://doi.org/10.1007/s11032-013-9862-8
Gao F., Wen W., Liu J., Rasheed A., Yin G., Xia X., Wu X., He Zh. Genome-wide linkage mapping of QTL for yield components, plant height and yield-related physiological traits in the Chinese wheat cross Zhou 8425B/Chinese Spring // Front. Plant Sci. 2015. V. 18. https://doi.org/10.3389/fpls.2015.01099
Parent B., Shahinnia F., Maphosa L. Berger B., Rabie H., Chalmers K., Kovalchuk A., Langridge P., Fleury D. Combining field performance with controlled environment plant imaging to identify the genetic control of growth and transpiration underlying yield response to water-deficit stress in wheat // J. Exp. Bot. 2015. V. 66. P. 5481. https://doi.org/10.1093/jxb/erv320
Saeed I., Chen X., Bachir D.G., Chen L., Hu Y.-G. Association mapping for photosynthesis and yield traits under two moisture conditions and their drought indices in winter bread wheat (Triticum aestivum L.) using SSR markers // Aust. J. Crop Sci. 2017. V. 11. P. 248. https://doi.org/10.21475/ajcs.17.11.03.pne252
Dolferus R., Thavamanikumar S., Sangma H., Kleven S., Wallace X., Forrest K., Rebetzke G., Hayden M., Borg L., Smith A., Cullis B. Determining the genetic architecture of reproductive stage drought tolerance in wheat using a correlated trait and correlated marker effect Model // G3: Genes, Genomes, Genet. 2019. V. 9. P. 473. https://doi.org/10.1534/g3.118.200835
Bargsten J.W., Nap J.P., Sanchez-Perez G.F., van Dijk A.D. Prioritization of candidate genes in QTL regions based on associations between traits and biological processes // BMC Plant Biol. 2014. V. 14. Article ID 330. https://doi.org/10.1186/s12870-014-0330-3
Agarwal P.K., Gupta K., Lopato S., Agarwal P. Dehydration responsive element binding transcription factors and their applications for the engineering of stress tolerance // J. Exp. Bot. 2017. V. 68. P. 2135. https://doi.org/10.1093/jxb/erx118
Geng S., Li A., Tang L., Yin L., Wu L., Lei C., Guo X., Zhang X., Jiang G., Zhai W., Wei Y., Zheng Y., Lan X., Mao L. TaCPK2-A, a calcium-dependent protein kinase gene that is required for wheat powdery mildew resistance enhances bacterial blight resistance in transgenic rice // J. Exp. Bot. 2013. V. 64. P. 3125. https://doi.org/10.1093/jxb/ert146
Borrill P., Adamski N., Uauy C. Genomics as the key to unlocking the polyploid potential of wheat // New Phytol. 2015. V. 208. P. 1008. https://doi.org/:10.1111/nph.13533
Хлесткина Е.К. Молекулярные маркеры в генетических исследованиях и в селекции // Вавиловский журнал генетики и селекции. 2013. Т. 17. С. 1044. https://vavilov.elpub.ru/jour/article/view/220/221
Ramirez-Gonzalez R.H., Borrill P., Lang D., Harrington S.A., Brinton J., Venturini L., Davey M., Jacobs J., van Ex F., Pasha A., Khedikar Y., Robinson S.J., Cory A.T., Florio T., Concia L. et al. The transcriptional landscape of hexaploid wheat across tissues and cultivars // Science. 2018. V. 361. https://doi.org/10.1126/science.aar6089
Close T.J. Dehydrins: emergence of a biochemical role of a family of plant dehydration proteins // Physiol. Plant. 1996. V. 97. P.759. https://doi.org/10.1111/j.1399-3054.1996.tb00546.x
Quarrie S.A., Gulli M., Calestani C., Steed A., Marmiroli N. Location of a gene regulating drought-induced abscisic acid production on the long arm of chromosome 5A of wheat // Theor. Appl. Genet. 1994. V. 89. P. 794. https://doi.org/10.1007/BF00223721
Voss-Fels K.P., Robinson H., Mudge S.R., Richard C., Newman S., Wittkop B., Stahl A., Friedt W., Frisch M., Gabur I., Miller-Cooper A., Campbell B.C., Kelly A., Fox G., Christopher J. et al. VERNALIZATION1 modulates root system architecture in wheat and barley // Mol. plant. 2018. V. 11. P. 226. https://doi.org/10.1016/j.molp.2017.10.005
Walkowiak S., Gao L., Monat C., Haberer G., Kassa M.T., Brinton J., Ramirez-Gonzalez R.H., Kolodziej M.C., Delorean E., Thambugala D., Klymiuk V., Byrns B., Gundlach H., Bandi V., Siri J.N. et al. Multiple wheat genomes reveal global variation in modern breeding // Nature. 2020. V. 588. P. 277. https://doi.org/10.1038/s41586-020-2961-x
Konstantinov D.K., Zubairova U.S., Ermakov A.A., Doroshkov A.V. Comparative transcriptome profiling of a resistant vs susceptible bread wheat (Triticum aestivum L.) cultivar in response to water deficit and cold stress // Peer J. 2021. V. 9. https://doi.org/10.7717/peerj.11428
Chu C., Wang S., Paetzold L., Wang Z., Hui K., Rudd J.C., Xue Q., Ibrahim A.M.H., Metz R., Johnson C.D., Rush C.M., Liu S. RNA‑seq analysis reveals different drought tolerance mechanisms in two broadly adapted wheat cultivars ‘TAM 111’ and ‘TAM 112’ // Sci. Rep. 2021. V. 11. P. 4301. https://doi.org/10.1038/s41598-021-83372-0
Chaichi M., Sanjarian F., Razavi K., Gonzalez-Hernandez J.L. Analysis of transcriptional responses in root tissue of bread wheat landrace (Triticum aestivum L.) reveals drought avoidance mechanisms under water scarcity // PLoS ONE. 2019. V. 14. P. e0212671. https://doi.org/10.1371/journal.pone.0212671
Lv S., Feng K., Peng S., Wang J., Zhang Y., Bian J., Nie X. Comparative analysis of the transcriptional response of tolerant and sensitive wheat genotypes to drought stress in field conditions // Agron. 2018. V. 8. P. 247. https://doi.org/10.3390/agronomy8110247
Iquebal M.A., Sharma P., Jasrotia R.S., Jaiswal S., Kaur A., Saroha M., Angadi U.B., Sheoran S., Singh R., Singh G.P., Rai A., Tiwari R., Kumar D. RnAseq analysis reveals drought responsive molecular pathways with candidate genes and putative molecular markers in root tissue of wheat // Sci. Rep. 2018. V. 9. Article ID 13917.
Ma L., Li G. FAR1-RELATED SEQUENCE (FRS) and FRS-RELATED FACTOR (FRF) family proteins in Arabidopsis growth and development // Front. Plant Sci. 2018. V. 9. Article ID 692. https://doi.org/10.3389/fpls.2018.00692
Hua Y., Zhang C., Shi W., Chen H. High-throughput sequencing reveals microRNAs and their targets in response to drought stress in wheat (Triticum aestivum L.) // Biotechnol. Biotechnol. Equip. 2017. V. 33. P. 465. https://doi.org/10.1080/13102818.2019.1586586
Niu X., Luo T., Zhao H., Su Y., Ji W., Li H. Identification of wheat dreb genes and functional characterization of tadreb3 in response to abiotic stresses // Gene. 2020. V. 740. Article ID 144514. https://doi.org/10.1016/j.gene.2020.144514
Shavrukov Y., Zhumalin A., Serikbay D., Botayeva M., Otemisova A., Absattarova A., Sereda G., Sereda S., Shvidchenko V., Turbekova A., Jatayev S., Lopato S., Soole K., Langridge P. Expression level of the DREB2-type gene, identified with amplifluor SNP markers, correlates with performance, and tolerance to dehydration in bread wheat cultivars from Northern Kazakhstan // Front. Plant Sci. 2016. V.7. Article ID 1736. https://doi.org/10.3389/fpls.2016.01736
Guerin C., Roche J., Allard V., Ravel C., Mouzeyar S., Bouzidi M.F. Genome-wide analysis, expansion and expression of the NAC family under drought and heat stresses in bread wheat (T. aestivum L.) // PLoS ONE. 2019. V. 14. Article ID e0213390. https://doi.org/10.1371/journal.pone.0213390
Chen J., Gong Y., Gao Y., Zhou Y., Chen M., Xu Z., Guo C. Ma Y. TaNAC48 positively regulates drought tolerance and ABA responses in wheat (Triticum aestivum L.) // Crop J. 2021. V. 9. P. 785. https://doi.org/10.1016/j.cj.2020.09.010
Mao H., Li S., Wang Z., Cheng X., Li F., Mei F., Chen N. Kang Z. Regulatory changes in TaSNAC8-6A are associated with drought tolerance in wheat seedlings // Plant Biotechnol. J. 2020. V.18. P. 1078. https://doi.org/10.1111/pbi.13277
Khalid M., Afzal F., Gul A., Amir R., Subhani A., Ahmed Z., Mahmood Z., Xia X., Rasheed A., He Z. Molecular characterization of 87 functional genes in wheat diversity panel and their association with phenotypes under well-watered and water-limited conditions // Front. Plant Sci. 2019. V.10. Article ID 7. https://doi.org/10.3389/fpls.2019.00717
Брагина М.К., Афонников Д.А., Салина Е.А. Прогресс в секвенировании геномов растений – направления исследований // Вавиловский журнал генетики и селекции. 2019. V. 23. P. 38. https://doi.org/10.18699/VJ19.459
Bevan M.W., Uauy C., Wulff B.B.H., Ji Zhou, Krasileva K., Clark M.D. Genomic innovation for crop improvement // Nature. 2017. V. 543. P. 346. https://doi.org/10.1038/nature22011
Leng P., Lübberstedt T., Xu M. Genomics-assisted breeding – A revolutionary strategy for crop improvement // J. Integr. Agr. 2017. V. 16. P. 2674. https://doi.org/10.1016/S2095-3119(17)61813-6
Sehgal D., Dreisigacker S. Haplotypes-based genetic analysis: benefits and challenges // Vavilov Journal of Genetics and Breeding. 2019. V. 23. P. 803. https://doi.org/10.18699/VJ19.37-o
Basile S.M.L., Ramírez I.A., Crescente J.M., Conde M.B., Demichelis M., Abbate P.,Rogers W.J., Pontaroli A.C., Helguera M., Vanzetti L.S. Haplotype block analysis of an Argentinean hexaploid wheat collection and GWAS for yield components and adaptation // BMC Plant Biol. 2019. V. 19. Article ID https://doi.org/10.1186/s12870-019-2015-4
Sehgal D., Mondal S., Crespo-Herrera L., Velu G., Juliana P., Huerta-Espino J., Shrestha S., Poland J., Singh R., Dreisigacker S. Haplotype-based, genome-wide association study reveals stable genomic regions for grain yield in CIMMYT spring bread wheat // Front. Genet. 2020. V. 11. Article ID 589490. https://doi.org/10.3389/fgene.2020.589490
Waidmann S., Kusenda B., Mayerhofer J., Mechtler K., Jonak C. A DEK domain-containing protein modulates chromatin structure and function in Arabidopsis // Plant Cell. 2014. V. 26. P. 4328. https://doi.org/10.1105/tpc.114.129254
Brestovitsky A., Ezer D.,Waidmann S.,Maslen S., Balcerowicz M., Cortijo S., Charoensawan V., Martinho C., Rhodes D., Jonak C., Wigge P.A. DEK influences the trade-off between growth and arrest via H2A.Z-nucleosomes in Arabidopsis. https://doi.org/ bioRxiv 2019https://doi.org/10.1101/829226
Hong M.J., Kim J.-B., Seo Y.W., Kim D.Y. F-Box genes in the wheat genome and expression profiling in wheat at different developmental stages genes // Genes. 2020. V. 11. 1154. https://doi.org/10.3390/genes11101154
Stefanowic K., Lannoo N., Van Damme E.J. Plant F-box proteins-judges between life and death // Crit. Rev. Plant Sci. 2015. V. 34. P. 523. https://doi.org/10.1080/07352689.2015.1024566
An J., Li Q., Yang J., Zhang G., Zhao Z., Wu Y., Wang Y., Wang W. Wheat F-box protein TaFBA1 positively regulates plant drought tolerance but negatively regulates stomatal closure // Front. Plant Sci. 2019. V. 10. Article ID 1242. https://doi.org/10.3389/fpls.2019.01242
Wang Y., Qiao L., Bai J., Wang P., Duan W., Yuan S., Yuan G., Zhang F., Zhang L., Zhao C. Genome-wide characterization of JASMONATE-ZIM DOMAIN transcription repressors in wheat (Triticum aestivum L.) // BMC Genomics. 2017. V. 18. Article ID 152. https://doi.org/10.1186/s12864-017-3582-0
Wei Q., Chen R., Wei X., Liu Y., Zhao S., Yin X., Xie T. Genome-wide identification of R2R3-MYB family in wheat and functional characteristics of the abiotic stress responsive gene TaMYB344 // BMC Genomics. 2020. V. 21. Article ID 792. https://doi.org/10.1186/s12864-020-07175-9
Kim Y.J., Bjorklund S., Li Y., Sayre M.H., Kornberg R.D. A multiprotein mediator of transcriptional activation and its interaction with the C-terminal repeat domain of RNA polymerase II // Cell. 1994. V.77. P. 599. https://doi.org/10.1016/0092-8674(94)90221-6
Kazan K. The multitalented MEDIATOR25 // Front. Plant Sci. 2017. V. 8. Article ID 999. https://doi.org/10.3389/fpls.2017.00999
Crawford T., Karamat F., Lehotai N., Rentoft M., Blomberg J., Strand A., Björklund S. Specifc functions for Mediator complex subunits from different modules in the transcriptional response of Arabidopsis thaliana to abiotic stress // Sci. Rep. 2020. V.10. Article ID 5073. https://doi.org/10.1104/pp.19.00124
Liu J., Zhang T., Jia J., Sun J. The wheat mediator subunit TaMED25 interacts with the transcription factor TaEIL1 to negatively regulate disease resistance against powdery mildew // Plant Physiol. 2016. V. 170. P. 1799. https://doi.org/10.1104/pp.15.01784
Hiebert C.W., Moscou M.J., Hewitt T. Steuernagel B., Hernández-Pinzón I., Green P., Pujol V., Zhang P., Rouse M.N., Jin Y., McIntosh R.A., Upadhyaya N., Zhang J., Bhavani S., Vrána J. et al. Stem rust resistance in wheat is suppressed by a subunit of the mediator complex // Nat. Commun. 2020. V. 11. Article ID 1123. https://doi.org/10.1038/s41467-020-14937-2
Concia L., Veluchamy A., Ramirez-Prado J.S., Martin-Ramirez A., Huang Y., Perez M., Domenichini S., Podriges Granados N.Y., Kim S., Blein T., Duncan S., Pochot C., Manza-Mianza D., Juery C., Paux E. et al. Wheat chromatin architecture is organized in genome territories and transcription factories // Genome Biol. 2020. V. 21. Article ID 104. https://doi.org/10.1016/j.gde.2012.03.003
Sarnowska E., Gratkowska D.M., Sacharowski S.P., Cwiek P., Tohge T., Fernie A.R., Siedlecki J. A., Koncz C., Sarnowski T.J. The role of SWI/SNF chromatin remodeling complexes in hormone crosstalk // Trends Plant Sci. 2016. V. 21. P. 594. https://doi.org/10.1016/j.tplants.2016.01.017
Lämke J., Bäurle I. Epigenetic and chromatin-based mechanisms in environmental stress adaptation and stress memory in plants // Genome Biol. 2017. V. 18. Article ID 124. https://doi.org/10.1186/s13059-017-1263-6
Bulgakov V.P., Wu H.C., Jinn T.L. Coordination of ABA and chaperone signaling in plant stress responses // Trends Plant Sci. 2019. V. 24. P. 636. https://doi.org/10.1016/j.tplants
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


