Физиология растений, 2022, T. 69, № 3, стр. 327-336
Изменение активности генов транскрипционных факторов TaNAC69, TaDREB1, TabZIP60 у растений мягкой пшеницы при водном дефиците и гипотермии
Е. А. Заикина a, *, Х. Г. Мусин a, А. Р. Кулуев a, В. И. Никонов b, А. М. Дмитриев c, Б. Р. Кулуев a
a Институт биохимии и генетики – обособленное структурное подразделение
Федерального государственного бюджетного научного учреждения Уфимского федерального исследовательского центра Российской академии наук
Уфа, Россия
b Башкирский институт сельского хозяйства ‒ обособленное структурное подразделение
Федерального государственного бюджетного научного учреждения Уфимского федерального исследовательского центра Российской академии наук
Уфа, Российская Федерация
c Федеральное государственное бюджетное образовательное учреждение высшего образования
“Башкирский государственный аграрный университет”
Уфа, Россия
* E-mail: evisheva@yandex.ru
Поступила в редакцию 24.09.2021
После доработки 25.11.2021
Принята к публикации 25.11.2021
- EDN: MOKJLQ
- DOI: 10.31857/S0015330322030186
Аннотация
Мягкая пшеница (Triticum aestivum L.) является важнейшей продовольственной культурой в мире. Отрицательное влияние на урожайность пшеницы оказывают стрессовые факторы, прежде всего, засуха и гипотермия. Транскрипционные факторы (ТФ) являются перспективной мишенью для повышения устойчивости растений к стрессу из-за их способности контролировать экспрессию большого числа защитных генов. Наиболее значимыми регуляторами реакций стрессоустойчивости являются следующие семейства ТФ: NAC, DREB и bZIP. Нами проведен анализ изменений относительного содержания транскриптов генов TaNAC69, TaDREB1, TabZIP60 у семи сортов и двух перспективных селекционных линий мягкой пшеницы при засухе и гипотермии. Изменения уровней экспрессии этих генов коррелировали с такими параметрами стрессоустойчивости, как относительное содержание воды, пролина и малонового диальдегида. Для гена TaNAC69 было характерно повышение относительного содержания транскриптов при засухе во всех изучаемых сортообразцах, гипотермия вызывала гораздо меньшие изменения в профиле экспрессии этого гена. При действии гипотермии и засухи наибольшее содержание транскриптов гена TaDREB1 было выявлено у линии Л43466, у гена TabZIP60 при засухе максимальные значения транскрипционной активности показала также линия Л43466. Наибольшее относительное содержание транскриптов при действии стрессовых факторов среди всех изучаемых генов показала линия Л43466, что может говорить о ее наибольшей перспективности для дальнейшей селекции.
ВВЕДЕНИЕ
Абиотические стрессовые факторы, такие как засуха и гипотермия, отрицательно влияют на рост, продуктивность и географическое распространение культурных растений. В связи с этим является актуальным увеличение стрессоустойчивости растений, что позволит повысить количество и качество урожая и будет способствовать более широкому распространению культурных растений, в том числе, на огромных территориях России с преимущественно неблагоприятными условиями среды. При воздействии засухи в растениях наблюдаются множественные негативные изменения, включая повреждение клеток в результате образования активных форм кислорода (АФК) [1]. В результате действия низких положительных температур в растениях происходит повышение жесткости мембран, нарушение активного транспорта ионов, водного обмена и впоследствии также развивается окислительный стресс [2]. Аминокислота пролин при стрессе действует как антиоксидант – защищает клетки от АФК, соответственно накопление пролина может коррелировать с устойчивостью растений к стрессу. Большое накопление молекул АФК, с которыми не справляются системы защиты, запускают процесс перекисного окисления липидов (ПОЛ), что выражается накоплением малонового диальдегида, что, в конечном счете, может привести к гибели клеток. Эти и ряд других биохимических параметров могут быть использованы в качестве маркеров стрессоустойчивости, однако более перспективным видится анализ генетических детерминант. В этой связи особый интерес представляет выяснение роли защитных генов в развитии устойчивости к стрессам [3]. Ввиду многочисленности таких генов перспективным может оказаться изучение транскрипционных факторов (ТФ), так как один ТФ контролирует экспрессию широкого спектра генов-мишеней путем связывания со специфическими цис-регуляторными элементами в промоторах [4]. Из всего разнообразия групп ТФ только несколько семейств признаны в качестве ключевых регуляторов устойчивости растений к абиотическим стрессовым факторам – NAC, DREB, bZIP [5].
Многочисленные сорта мягкой пшеницы (Triticum aestivum L.) характеризуются различной устойчивостью к засухе и гипотермии. В качестве одного из подходов отбора стрессоустойчивых линий могут быть использованы методы молекулярной генетики [6], однако полигенный контроль стрессоустойчивости сильно затрудняет разработку и внедрение технологий маркер-ориентированной селекции по данному признаку. Одними из таких универсальных ДНК-маркеров могли бы быть гены ТФ, однако ввиду их большой важности для развития растения, их нуклеотидные последовательности отличаются высокой консервативностью [7], что уменьшает их ценность для SNP-генотипирования. В то же время можно предположить, что стрессоустойчивые сорта будут характеризоваться естественным и своевременным изменением уровня экспрессии ряда генов ТФ, задействованных в ответе на стресс [5], что можно зафиксировать при помощи количественной ОТ-ПЦР. Поэтому целью работы было изучение влияния засухи и гипотермии на сорта и перспективные линии мягкой пшеницы районированных для Предуральской степной зоны на относительное содержание транскриптов генов TaNAC69, TaDREB1 и TabZIP60. Для оценки степени стрессовой нагрузки и стрессочувствительности изучаемых сортообразцов к засухе и гипотермии, была поставлена также задача провести анализ содержания пролина и малонового диальдегида, а также измерить относительное содержание воды в побегах (relative water content, RWC).
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования послужили сорта и перспективные линии яровой мягкой пшеницы T. aestivum из коллекций Чишминского селекционного центра Башкирского научно-исследовательского института (БНИИСХ) УФИЦ РАН и Башкирского государственного аграрного университета. Для экспериментов взяты следующие сорта мягкой пшеницы: Зауральская жемчужина, Архат, Тулайковская 108, Башкирская 28, Омская 35, Омская 36, Экада 113, а также две перспективные линии – Л43706 и Л43466.
Растения для всех опытов выращивали в вегетационных сосудах объемом 500 мл в теплице при +18°С при естественном освещении. Полив осуществлялся три раза в неделю, по 100 мл, водопроводной отстоянной водой. Через 30 сут выращивания опытные образцы подвергались стресс-обработке. Контрольные растения продолжали поливать трижды в неделю. В эксперименте с засухой опытные образцы фиксировали на 5 и 10 сут отсутствия полива (засуха). В эксперименте по гипотермии, опытные образцы с нормальным режимом полива помещали в климатостат с температурой +5°С на 20 ч, а другую группу растений на 4 ч при 0°С.
Относительное содержание воды (RWC) определяли у растений, растущих в норме (контроль) и подвергнутых засухе (опыт): побег растения отделяли от корня и взвешивали (сырая масса, FW), затем образцы побегов гидратировали в деионизированной воде 4 ч при 25°C. После гидратации образцы побегов вынимали из воды и после быстрого и легкого высушивания поверхностной влаги фильтровальной бумагой, взвешивали для получения полной массы (TW). Затем образцы сушили в сухожаровом шкафу (СКТБ СПУ, Россия) до сухого веса (DW) при 80°C в течение 24 ч. RWC вычисляли по формуле:
В экспериментах использовали метод определения пролина, основанный на работе Bates [8] c модификациями от Khedr с соавт. [9]. Экстрагировали пролин с помощью 3% сульфосалициловой кислоты (Химреактивснаб, Россия), центрифугировали при 8000 g 10 мин. Реакционная смесь состояла из супернатанта, ледяной уксусной кислоты (Химреактивснаб, Россия), нингидринового реактива (140 мМ нингидрин (Sigma-Aldrich, США), 5 M СН3COOH, 2.4 M H3PO4 (Химреактивснаб, Россия)), которые смешивали в объемном соотношении 1:1:1 и держали в твердотельном термостате ТТ-2 “Термит” (ДНК-Технология, Россия) при 95°C 1 ч. После охлаждения реакционную смесь анализировали с помощью спектрофотометра Enspire Multimode Plate Reader (Perkin Elmer, США) при длине волны 520 нм. Концентрацию пролина в пробе рассчитывали по калибровочной кривой, построенной по стандартной навеске пролина (Sigma-Aldrich, США).
Определение малонового диальдегида (МДА) производили в навеске листьев с помощью тиобарбитуровой кислоты (ТБК) (Sigma-Aldrich, США). Экстракцию МДА из листьев проводили в 80% этаноле, центрифугировали при 12 000 g 10 мин. После чего супернатант делили на 2 равные части, в одну часть добавляли равный объем 20% трихлоруксусной кислоты (ТХУ) (PanReac AppliChem, Испания) с 0.5% ТБК, в другую – 20% ТХУ. Смеси держали в твердотельном термостате при 95°C 20 мин. Оптическую плотность измеряли при 440, 532 и 600 нм [10] и вводили поправки на сахара и другие неспецифические вещества.
Тотальную РНК из листьев пшеницы выделяли с помощью реагента Лира (Биолабмикс, Россия). Для получения кДНК на основе мРНК исследуемых образцов проводили реакцию обратной транскрипции с использованием обратной транскриптазы M-MuLV (Евроген, Россия) согласно протоколу поставщика. Анализ накопления транскриптов генов TaNAC69, TaDREB1, TabZIP60 проводили методом количественной ОТ-ПЦР в режиме реального времени в присутствии интеркалирующего красителя SYBR Green I на термоциклере Rotor-GeneTM 6000 (Corbett Research, Австралия). Последовательности праймеров для ОТ-ПЦР были подобраны впервые в рамках данной работы, их последовательности и размеры ампликонов приведены в Дополнительных материалах (таблица S1 ). Для подбора праймеров использовали программу PrimerSelect пакета Lasergene (DNAStar, США), специфичность проверяли с помощью BLAST (ncbi.nlm.nih.gov). В качестве стандарта использовали мРНК гена RLI (RNase L Inhibitor-like protein), уровень экспрессии которого принимали за 100%. Выбор этого референсного гена объясняется тем, что он показывает наибольшую стабильность уровня экспрессии в различных тканях мягкой пшеницы при разных условиях произрастания [11].
Результаты всех исследований представлены в виде гистограмм со средними значениями выборки. Выборка во всех экспериментах составила 5 растений (n = 5). Барами обозначали стандартную ошибку среднего. Достоверность различий во всех экспериментах оценивали при помощи U-критерия Манна‒Уитни.
РЕЗУЛЬТАТЫ
Относительное содержание воды (RWC) является индикатором засухоустойчивости растений [12]. Так при измерении RWC на 5 сут засухи наибольшие изменения относительного содержания воды между контрольными и опытными растениями наблюдались у сортообразцов Экада 113, Башкирская 28 и Омская 36, а наименьшие – у Архат, Тулайковская 108 и Л43706 (рис. 1а). При более сильном стрессе на 10 сут разница в RWC между контрольными и опытными образцами была более ярко выражена, особенно в образцах Зауральская жемчужина, Омская 36, Башкирская 28, Омская 35. Наилучшей способностью сохранять воду обладали образцы Л43706, Тулайковская 108, Архат и Л43466 (рис. 1б).
Рис. 1.
Относительное содержание воды (RWC) при действии засухи: (a) 5 сут, (б) 10 сут. 1. Л43706, 2. Л43466, 3. Зауральская жемчужина, 4. Архат, 5. Тулайковская 108, 6. Омская 36, 7. Экада 113, 8. Башкирская 28, 9. Омская 35. 1 – контроль (нормальные условия), 2 – опыт (стрессовые условия). n = 5. * – P < 0.05.

Наиболее активными в накоплении пролина в период засухи продолжительностью в 5 сут оказались растения сортов Омская 36 и Экада 113 (рис. 2а), количество пролина в которых возросло в 12 и 22 раза, соответственно. При действии более длительной засухи, во всех образцах наблюдалось увеличение количества пролина, причем наиболее существенно у сортов Экада 113, Зауральская жемчужина и Башкирская 28 (рис. 2б).
Рис. 2.
Содержание пролина в листьях пшеницы при действии абиотических стрессовых факторов: (a) засуха 5 сут, (б) засуха 10 сут, (в) гипотермия. 1. Л43706, 2. Л43466, 3. Зауральская жемчужина, 4. Архат, 5. Тулайковская 108, 6. Омская 36, 7. Экада 113, 8. Башкирская 28, 9. Омская 35. 1 – контроль (нормальные условия), 2 – опыт (стрессовые условия). В опыте по гипотермии: a – контроль (нормальные условия), b – гипотермия +5°С, c – гипотермия 0°С. n = 5. * – P < 0.05.

При гипотермии количество пролина так же повышалось. Исключением были сорта Тулайковская 108 и Башкирская 28 (рис. 2в), где его содержание достоверно не отличалось от контрольных линий. Наибольшее увеличение содержания пролина при гипотермии было характерно для сортов Архат и Омская 35 (рис. 2в).
При засухе количество МДА в исследованных образцах почти всегда возрастало, исключением являлись лишь сорта Тулайковская 108 при засухе 5 сут (рис. 3а) и Архат при стрессе 10 сут (рис. 3б). Наибольшие увеличения содержания МДА по отношению к контролю были найдены для образцов Экада 113, Зауральская жемчужина и Л43706 на 5 сут отсутствия полива (рис. 3a), и в образцах Л43706, Экада 113 на 10 сут (рис. 3б). Максимальная степень роста содержания МДА при засухе 10 сут была показана для линии Л43706. Если при стрессовом фоне 5 сут содержание МДА у этой линии увеличилось на 57%, то при засухе 10 сут уже на 246%.
Рис. 3.
Содержание малонового диальдегида в листьях пшеницы при действии абиотических стрессовых факторов: (a) засуха 5 сут, (б) засуха 10 сут, (в) гипотермия. 1. Л43706, 2. Л43466, 3. Зауральская жемчужина, 4. Архат, 5. Тулайковская 108, 6. Омская 36, 7. Экада 113, 8. Башкирская 28, 9. Омская 35. 1 – контроль (нормальные условия), 2 – опыт (стрессовые условия). В опыте по гипотермии: a – контроль (нормальные условия), b – гипотермия +5°С, c – гипотермия 0°С. n = 5. * – P < 0.05.
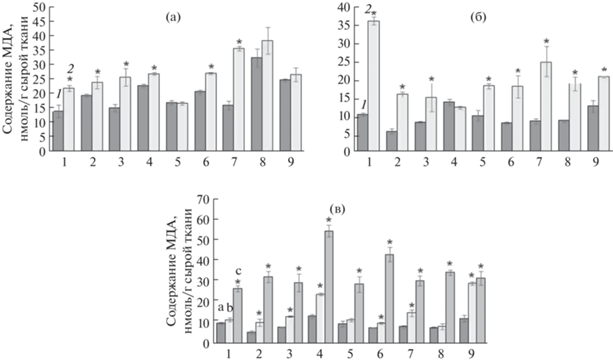
На фоне гипотермии накопление продуктов перекисного окисления практически во всех линиях возрастало. Причем, количество МДА при 0°С было выше, чем при +5°С. Так, например, в образце Л43706, количество МДА при +5°С повысилось на 15%, а при 0°С на 160%, по сравнению с контролем (рис. 3в). Самый заметный прирост концентрации МДА при гипотермии +5 и 0°С был отмечен в образце Л43466 (на 80% и 460%, соответственно), а наименьший в образце Тулайковская 108 (на 19% и 190%, соответственно).
Для дальнейшей работы нами был произведен поиск генов-мишеней, участвующих в абиотическом стрессе [4]. Были подобраны праймеры для ОТ-ПЦР генов транскрипционных факторов (табл. S1 ). Гены ТФ NAC регулируют развитие растений и реакции на биотический и абиотический стресс. Из множества генов NAC, нами был выбран ген TaNAC69, который позитивно влияет на устойчивость, как к засухе, так и к холоду [13]. Относительное содержание транскриптов гена TaNAC69 под воздействием засухи, больше всего повышалось у образца Л43466 (рис. 4a), уже на 5 сут действия стресса экспрессия данного гена возрастала и сохранялась на высоком уровне в течение всего опыта. Также при засухе наблюдалось значительное увеличение относительного содержания транскрипта гена TaNAC69 у сортов Архат, Экада 113 и Башкирская 28 (рис. 4a) при действии стрессового фактора 5 ч, и значительный рост активности гена наблюдался у всех сортов при более затяжной засухе (рис. 4б). Таким образом, при засухе уровень экспрессии гена TaNAC69 увеличивался у всех анализируемых сортообразцов.
Рис. 4.
Относительное содержание транскриптов гена TaNAC69 при действии абиотических стрессовых факторов: (a) засуха 5 сут, (б) засуха 10 сут, (в) гипотермия +5°С, (г) гипотермия 0°С. 1. Л43706, 2. Л43466, 3. Зауральская жемчужина, 4. Архат, 5. Тулайковская 108, 6. Омская 36, 7. Экада 113, 8. Башкирская 28, 9. Омская 35. 1 – контроль (нормальные условия), 2 – опыт (стрессовые условия). n = 5. * – P < 0.05.
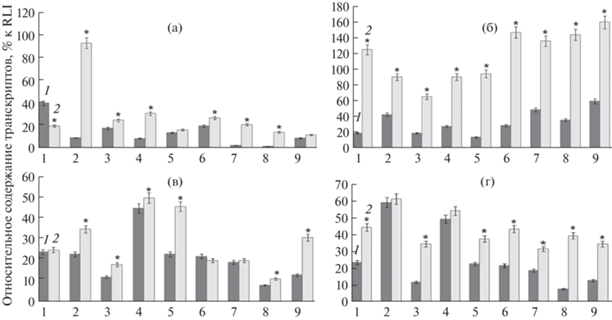
В ответ на гипотермию +5°С относительное содержание транскриптов гена TaNAC69 повышалось у сортообразцов Л43466, Зауральская жемчужина, Архат, Тулайковская 108, Башкирская 28, Омская 35 (рис. 4в). В образцах Л43706, Омская 36, Экада 113 (рис. 4в) достоверных отличий от контроля по содержанию транскриптов исследуемого гена не выявлялось. Сорт пшеницы Тулайковская 108 (рис. 4в) давал наибольший позитивный ответ при воздействии +5°С возрастанием относительного содержания транскриптов гена TaNAC69. При понижении температуры до 0°С наблюдалось еще более существенное увеличение уровня экспрессии этого гена по сравнению с действием температуры +5°С. При 0°С в образцах Л43706, Зауральская жемчужина, Омская 36, Башкирская 28, Омская 35 (рис. 4г) относительное содержание транскриптов гена TaNAC69 увеличивалось более чем в 2 раза по сравнению с контролем.
Для дальнейших исследований был выбран ген TaDREB1, который индуцируется абиотическим стрессом [14]. В результате проведенных экспериментов во многих опытных образцах обнаружено увеличение относительного содержания транскриптов гена TaDREB1 при действии стрессовых факторов и сохранение его на высоком уровне в течение всего эксперимента. При засухе 5 сут наибольший рост относительного содержания транскриптов гена TaDREB1 наблюдался у сортообразцов Л43706, Л43466 и Башкирская 28 (рис. 5a). В сортообразцах Архат, Тулайковская 108 и Омская 35 достоверных отличий при засухе между контролем и опытом не выявлялось (рис. 5a). В образцах Омская 36 и Экада 113 (рис. 5a) наблюдалось снижение активности гена TaDREB1 в условиях засухи. Под воздействием длительной засухи повышение уровня экспрессии гена TaDREB1 показывали образцы Л43706, Л43466, Зауральская жемчужина, Омская 36 и наибольшее повышение было характерно для Тулайковской 108 (рис. 5б). При этом у сортов Экада 113, Башкирская 28 и Омская 35 (рис. 5б) достоверных отличий от контроля в относительном содержании транскриптов этого гена не выявлено.
Рис. 5.
Относительное содержание транскриптов гена TaDREB1 при действии абиотических стрессовых факторов: (a) засуха 5 сут, (б) засуха 10 сут, (в) гипотермия +5°С, (г) гипотермия 0°С. 1. Л43706, 2. Л43466, 3. Зауральская жемчужина, 4. Архат, 5. Тулайковская 108, 6. Омская 36, 7. Экада 113, 8. Башкирская 28, 9. Омская 35. 1 – контроль (нормальные условия), 2 – опыт (стрессовые условия). n = 5. * – P < 0.05.
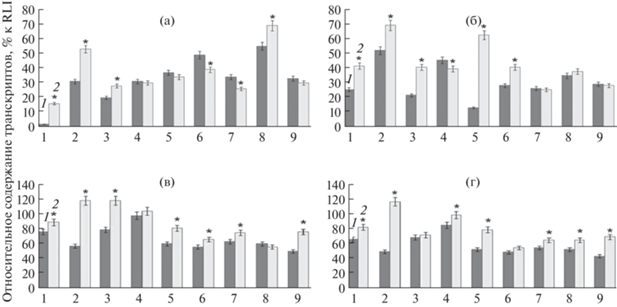
В опыте по гипотермии происходило большее увеличение относительного содержания транскрипта гена TaDREB1 по сравнению с экспериментами по засухе, причем различия в уровне экспрессии становились более существенными при действии 0°С. При действии +5°С наибольшее увеличение активности наблюдалось в образцах Л43466, Зауральская жемчужина, а при 0°С у Л43466 (рис. 5в, г).
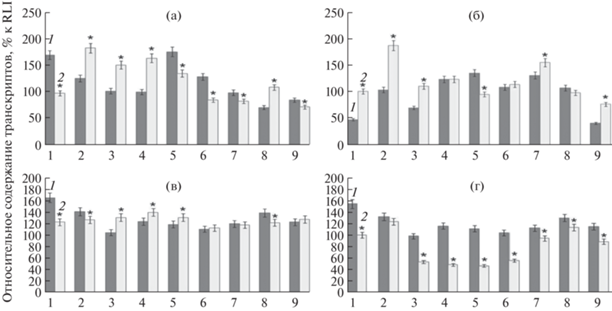
Следующим был изучен ген TabZIP60. При выборе этого гена мы полагались на результаты исследования Zhang с соавт. [15], которые показали, что трансгенные растения Arabidopsis thaliana со сверхэкспрессией гена TabZIP60 характеризуются значительно улучшенной устойчивостью, как к засухе, так и к низким температурам. Линия Л43466 (рис. 6a, б, в, г) показала высокий уровень относительного содержания транскрипта гена TabZIP60 при воздействии засухи, но при низких положительных температурах его экспрессия у этой линии, наоборот, снижалась по отношению к контролю. В сортообразцах Л43706, Тулайковская 108, Экада 113 и Башкирская 28 (рис. 6) в опытах с засухой и гипотермией +5°С наблюдалось снижение относительного содержания транскриптов гена TabZIP60 в стрессовых условиях по сравнению с контролем. При снижении температуры до 0°С уровень экспрессии гена TabZIP60 в опытных образцах вопреки ожиданиям, не повышался, а наоборот снижался во всех изучаемых образцах (рис. 6г).
Рис. 6.
Относительное содержание транскриптов гена TabZIP60 при действии абиотических стрессовых факторов: (a) засуха 5 сут, (б) засуха 10 сут, (в) гипотермия +5°С, (г) гипотермия 0°С. 1. Л43706, 2. Л43466, 3. Зауральская жемчужина, 4. Архат, 5. Тулайковская 108, 6. Омская 36, 7. Экада 113, 8. Башкирская 28, 9. Омская 35. 1 – контроль (нормальные условия), 2 – опыт (стрессовые условия). n = 5. * – P < 0.05.
ОБСУЖДЕНИЕ
При действии засухи снижение относительного содержания воды (RWC) наблюдалось у всех опытных образцов. Сортообразцы Л43466, Архат, Л43706, Тулайковская 108, поддерживающие более высокий RWC при засухе, вероятнее всего, являются наиболее устойчивыми к низкому водному потенциалу и, таким образом, способны сохранять свой рост и продуктивность в стрессовых условиях [17].
Пролин является важной молекулой, накапливающейся при стрессах, таких как засуха, гипотермия и другие. При стрессе пролин защищает от денатурации макромолекулы в клетках и регулирует осмотическое давление клеточного сока при снижении водного потенциала. Во время засухи пролин наиболее активно накапливался в образцах Экада 113, Омская 36, Зауральская жемчужина, а при гипотермии – у образцов Архат, Л43466 и Л43706. Накопление пролина в растениях может коррелировать с устойчивостью к стрессу. К тому же показано, что сверхэкспрессия пролинсинтазы в трансгенных растениях увеличивала стрессоустойчивость пшеницы [18], картофеля (Solanum tuberosum L.) [19] и табака (Nicotiana tabacum) [20]. В наших опытах чаще всего наблюдался подъем содержания пролина в стрессированных растениях, причем засуха оказывала больший эффект по сравнению с гипотермией.
МДА является основным продуктом перекисного окисления липидов, а значит, может указывать на степень повреждения мембран в клетке [21]. Однако стоит учесть тот факт, что МДА накапливается и при идеальных условиях роста организма, и количество его сильно различается не только от вида к виду, но и от сорта к сорту. При засухе наименьшее количество МДА накапливалось у сортов Тулайковская 108 и Архат, что может говорить о большей засухоустойчивости последних.
Предполагалось на основе RWC и содержания МДА и пролина сделать выводы о стрессоустойчивости исследуемых сортообразцов T. aestivum. Например, исходя из данных RWC и содержания МДА можно предположить, что самыми засухоустойчивыми сортами из нашего списка являются Тулайковская 108 и Архат. Судя по всему, обе линии Л43706 и Л43466 также являются весьма засухоустойчивыми, по крайней мере, для них было характерно существенное повышение уровня экспрессии всех трех генов ТФ под влиянием засухи. Повышение уровня экспрессии генов TaNAC69, TaDREB1, TabZIP60 в ответ на засуху это ожидаемая реакция растений, что должно способствовать увеличению устойчивости к этому стресс-фактору. Необходимо отметить, что сорта Тулайковская 108, Архат, Зауральская жемчужина, Экада 113, Омская 36 чаще всего реагировали на засуху существенным увеличением уровня экспрессии всех исследуемых генов ТФ. Причем Л43706, Л43466, Тулайковская 108 и Архат поддерживали, по всей видимости, устойчивость к засухе за счет более эффективной задержки воды в побегах (рис. 1), тогда как сорта Зауральская жемчужина, Экада 113 и Омская 36, в основном, за счет увеличения концентрации пролина (рис. 2). Хорошо известно, что в засухоустойчивости мягкой пшеницы, как и у других растений кроме пролина задействованы множество механизмов, поэтому у наиболее устойчивых сортов при засухе содержание пролина может и не повышаться [22]. Полученные нами данные показывают, что разные сорта мягкой пшеницы приспосабливаются к одним и тем же стрессовым условиям, подключая разные молекулярные системы, имеющиеся на вооружении у растений.
Увеличение содержания пролина при гипотермии может свидетельствовать о большей холодоустойчивости обеих перспективных линий и сортов Архат и Омская 35. Наименьшее содержание МДА при действии холода демонстрировали линии Л43706 и Л43466, а также сорта Зауральская жемчужина и Тулайковская 108 (рис. 3в). Наиболее существенное увеличение уровня экспрессии генов исследуемых ТФ при действии гипотермии было характерно для сортов Зауральская жемчужина, Тулайковская 108, Омская 35 и Архат. Для линий Л43706 и Л43466 также было показано увеличение уровня экспрессии генов ТФ при действии холода. Таким образом, можно сделать вывод, что по физиолого-биохимическим параметрам перспективные линии мягкой пшеницы Л43706 и Л43466 характеризуются относительно высоким уровнем устойчивости к засухе и гипотермии. Наиболее холодоустойчивыми сортами, вероятнее всего, являются Зауральская жемчужина, Тулайковская 108, Омская 35 и Архат. К засухе наиболее устойчивы сорта Тулайковская 108, Архат, Зауральская жемчужина, Экада 113 и Омская 36. Однако как покажут себя эти сорта и линии в полевых условиях при изменяющемся климате на территории нашей страны, является предметом дальнейших исследований селекционеров.
Исследования относительного содержания транскриптов гена TaNAC69 по мере развития засухи показали, что в нестрессированных образцах пшеницы уровень экспрессии этого гена низок, в то же время, при действии засухи происходит повышение содержания его транскриптов во всех изучаемых образцах. При более затяжной засухе наблюдается еще более значительное повышение относительного содержания транскрипта гена TaNAC69. Полученные данные по экспрессии гена TaNAC69, показали, что происходит увеличение его уровня экспрессии, как при засухе, так и при гипотермии у большинства изученных сортообразцов мягкой пшеницы. Из литературных данных известно об увеличении устойчивости к дегидратации у трансгенных линий A. thaliana и риса, сверхэкспрессирующих ген TaNAC69 [23]. Необходимо отметить, что гипотермия вызывала меньшие изменения экспрессии гена TaNAC69 у изучаемых образцов, чем засуха, что может быть связанно с тем, что ген TaNAC69 больше задействован как регулятор засухоустойчивости [13].
Гены DREB1 индуцируются низкой температурой и, могут сами активировать экспрессию многих чувствительных к низкой температуре генов [24]. Так в нашем опыте уровень экспрессии гена TaDREB1 при гипотермии повышался больше всего в образце Л43466 (рис. 5в, г). Наши данные соотносятся с результатами Dubouzet с соавт. [25], которые показали, что гены DREB1 регулируют устойчивость к низкотемпературному стрессу.
В наших исследованиях ген TabZIP60 показал более существенные увеличения уровня экспрессии, как при засухе, так и при гипотермии по сравнению с генами TaNAC69 и TaDREB1. Интересно отметить, что, экспрессия гомологичного гена OsbZIP60 в рисе также активируется под воздействием засухи [26]. Так и в нашем опыте под воздействием засухи 5 и 10 сут наблюдались увеличения уровня экспрессии гена TabZIP60, особенно в опытных образцах Л43466 и Зауральская жемчужина. А при действии низких температур относительное содержание транскриптов этого гена в опытных образцах было меньше, чем в контроле. Можно предположить, что экспрессия гена TabZIP60 падает из-за того, что в нашем эксперименте взяты только яровые сорта и линии мягкой пшеницы, для которых снижение температуры в период вегетации до 0°С не является нормой.
Засуха и гипотермия являются одними из наиболее актуальных стрессовых факторов при выращивании яровых сортов мягкой пшеницы, как на юге России, так и в более северных территориях России, к примеру, в Предуральской степной зоне. Нами проведены исследования особенностей изменения уровня относительного содержания транскриптов генов TaNAC69, TaDREB1 и TabZIP60 у ряда российских сортов и перспективных линий мягкой пшеницы башкирской селекции.
Наибольшее количество позитивных изменений транскрипционной активности в стрессовых условиях по всем изучаемым генам ТФ показал сортообразец Л43466. Также эта линия демонстрировала более высокую засухоустойчивость по таким физиологическим параметрам, как RWC и содержание МДА. Полученные результаты могут свидетельствовать о большей перспективности использования линии Л43466 мягкой пшеницы в дальнейшей селекционной работе, по сравнению с линией Л43706. Из всех изученных генов транскрипционных факторов – ген TaNAC69 наиболее существенно реагировал на засуху, показав самое большое изменение относительного содержания транскриптов. При воздействии низких положительных температур наиболее активно экспрессировался ген TaDREB1.
Работа выполнена в рамках государственного задания AAAA-A19-119021190011-0 при поддержке грантов Президента Российской Федерации МД-2304.2020.4 и Минобрнауки Российской Федерации (соглашения № 075-15-2021-549 от 31 мая 2021 г. и №075-15-2021-1066 от 28 сентября 2021 г).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Fathi A., Tari D.B. Effect of drought stress and its mechanisms in plants // Int J Life Sci. 2016. V. 10. P. 1. https://doi.org/10.3126/ijls.v10i1.14509
Нарайкина Н.В., Попов В.Н., Миронов К.С., Пчёлкин В.П., Трунова Т.И., Мошков И.Е. Транскрипция генов десатураз жирных кислот хлоропластов при низкотемпературном закаливании Solanum tuberosum L. // Вестн. Том. гос. ун-та. Биология. 2019. № 47. С. 174. https://doi.org/10.17223/19988591/47/9
Hussain H.A., Hussain S., Khaliq A., Ashraf U., Anjum S.A., Men S., Wang L. Chilling and drought stresses in crop plants: implications, cross talk, and potential management opportunities // Front. in plant sci. 2018. V. 9. P. 393. https://doi.org/10.3389/fpls.2018.00393
Zaikina E.A., Rumyantsev S.D., Sarvarova E.R., Kuluev B.R. Transcription factor genes involved in plant response to abiotic stress factors. Ecological genetics. 2019. V. 17. P. 47. https://doi.org/10.17816/ecogen17347-58
Baillo E.H., Kimotho R.N., Zhang Z., Xu P. Transcription factors associated with abiotic and biotic stress tolerance and their potential for crops improvement // Genes (Basel). 2019. V. 10. P. 771. https://doi.org/10.3390/genes10100771
Khan S., Anwar S., Yu S., Sun M., Yang Z., Gao Z.Q. Development of drought-tolerant transgenic wheat: achievements and limitations // Int. J. Mol. Sci. 2019. V. 20. P. 3350. https://doi.org/10.3390/ijms20133350
Gahlaut V., Jaiswal V., Kumar A., Gupta P.K. Transcription factors involved in drought tolerance and their possible role in developing drought tolerant cultivars with emphasis on wheat (Triticum aestivum L.) // Theor. App-l. Genet. 2016. V. 129. P. 2019. https://doi.org/10.1007/s00122-016-2794-z
Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water-stress studies // Plant Soil. 1973. V. 39. P. 205. https://doi.org/10.1007/BF00018060
Khedr A.H.A., Abbas M.A., Abdel W.A.A., Quick W.P., Abogadallah G.M. Proline induces the expression of salt-stress-responsive proteins and may improve the adaptation of Pancratium maritimum L. to salt stress // J. Exp. Bot. 2003. V. 54. P. 2553. https://doi.org/10.1093/jxb/erg277
Taylor N.L., Millar A.H. Oxidative stress and plant mitochondria // Methods Mol. Biol. 2007. V. 372. P. 389. https://doi: 10.1007 / 978-1-59745-365-3_28
Веселова С.В., Бурханова Г.Ф., Нужная Т.В., Максимов И.В. Роль этилена и цитокининов в развитии защитных реакций в растениях Triticum aestivum, инфицированных Septoria nodorum // Физиология растений. 2016. Т 63. С. 649. https://doi.org/10.7868/S0015330316050158
Aref I.M., Khan P.R., Khan S., El-Atta H., Ahmed A.I., Iqbal M. Modulation of antioxidant enzymes in Juniperus procera needles in relation to habitat environment and dieback incidence. Trees. 2016. V. 30. P. 1669. https://doi.org/10.1007/s00468-016-1399-0
Xue G.P., Way H.M., Richardson T., Drenth J., Joyce P.A., McIntyre C.L. Overexpression of TaNAC69 leads to enhanced transcript levels of stress up-regulated genes and dehydration tolerance in bread wheat // Mol. Plant. 2011. V. 4. P. 697. https://doi.org/10.1093/mp/ssr013
Liu M., Wang Z., Xiao H.M., Yang Y. Characterization of TaDREB1in wheat genotypes with different seed germination under osmotic stress // Hereditas. 2018. V. 155. P. 26. https://doi.org/10.1186/s41065-018-0064-6
Zhang L., Zhang L., Xia C., Zhao G., Liu J., Jia J. A novel wheat bZIP transcription factor, TabZIP60, confers multiple abiotic stress tolerances in transgenic Arabidopsis // Physiol. Plant. 2015. V. 153. P. 538. https://doi.org/10.1111/ppl.12261
Niu C., Wei W., Zhou Q., Tian A.G., Hao Y.J., Zhang W.K., Ma B., Lin Q., Zhang Z.B., Zhang J.S., Chen S.Y. Wheat WRKY genes TaWRKY2 and TaWRKY19 regulate abiotic stress tolerance in transgenic Arabidopsis plants // Plant Cell Environ. 2012. V. 35. P. 1156. https://doi.org/10.1111/j.1365-3040.2012.02480.x
Joshi R., Karan R. Physiological, biochemical and molecular mechanisms of drought tolerance in plants. In molecular approaches in plant abiotic stress, Eds. Gaur R.K., Sharma P. (Boca Raton, FL: CRC Press). 2013. P. 209.
Sawahel W.W., Hassan A.H. Generation of transgenic wheat plants producing high levels of the osmoprotectant proline // Biotechnol. Lett. 2002. V. 24. P. 721. https://doi.org/10.1023/A:1015294319114
Hmida-Sayari A., Gargouri-Bouzid R., Bidani A., Jaoua L., Savouré A., Jaoua S. Overexpression of Δ1-pyrroline-5-carboxylate synthetase increases proline production and confers salt tolerance in transgenic potato plants // Plant Sci. 2005. V. 169. P. 746. https://doi.org/10.1016/j.plantsci.2005.05.025
Kishor P.B.K., Hong Z., Miao G.G., Hu C.A.A., Verma D.P.S. Overexpression of ∆1-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants // Plant Physiol. 1995. V. 108. P. 1387. https://doi.org/10.1104/pp.108.4.1387
Gaweł S., Wardas M., Niedworok E., Wardas P. Dialdehyd malonowy (MDA) jako wskaźnik procesów peroksydacji lipidów w organizmie [Malondialdehyde (MDA) as a lipid peroxidation marker]. Wiad Lek. 2004. V. 57. P. 453.
Marček T., Hamow K.Á., Végh B., Janda T., Darko E. Metabolic response to drought in six winter wheat genotypes // PloS ONE. 2019. V. 14 P. 2. https://doi.org/10.1371/journal.pone.0212411
Yokotani N., Ichikawa T., Kondou Y., Matsui M., Hirochika H., Iwabuchi M., Oda K. Tolerance to various environmental stresses conferred by the salt-responsive rice gene ONAC063 in transgenic Arabidopsis // Planta. 2009. V. 229. P. 1065. https://doi.org/10.1007/s00425-009-0895-5
Seki M., Narusaka M., Abe H., Kasuga M., Yamaguchi-Shinozaki K., Carninci P., Hayashizaki Y. and Shinozaki K. Monitoring the expression pattern of 1300 Arabidopsis genes under drought and cold stresses by using a full-length cDNA microarray // Plant Cell. 2001. V. 13. P. 61. https://doi.org/10.1105/tpc.13.1.61
Dubouzet J.G., Sakuma Y., Ito Y., Kasuga M., Dubouzet E.G., Miura S., Seki M., Shinozaki K., Yamaguchi-Shinozaki K. OsDREB genes in rice, Oryza sativa L., encode transcription activators that function in drought-, high-salt- and cold-responsive gene expression // Plant J. 2003. V. 33. P. 751. https://doi.org/10.1046/j.1365-313x.2003.01661.x
Agarwal P., Baranwal V.K., Khurana P. Genome-wide analysis of bZIP transcription factors in wheat and functional characterization of a TabZIP under abiotic stress // Sci. Rep. 2019. V. 9. P. 4608. https://doi.org/10.1038/s41598-019-40659-7
Дополнительные материалы
- скачать ESM.docx
- Таблица 1. Исследованные гены, последовательности праймеров для ОТ-ПЦР и размеры ампликонов
Инструменты
Физиология растений


