Физиология растений, 2022, T. 69, № 3, стр. 317-326
Cтресс-протекторное действие фуростаноловых гликозидов на культивируемые клетки люцерны в условиях гипотермии и гиперосмотического стресса
Л. А. Волкова a, В. В. Урманцева a, А. Б. Бургутин a, А. М. Носов a, b, *
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
* E-mail: al_nosov@mail.ru
Поступила в редакцию 16.10.2021
После доработки 23.11.2021
Принята к публикации 24.11.2021
- EDN: COVCPK
- DOI: 10.31857/S0015330322030174
Аннотация
Проведено изучение механизмов адаптогенного действия фуростаноловых гликозидов (ФГ) на клетки растений in vitro и осуществлено сопоставление воздействия гипотермии и гиперосмотического стресса на суспензионную культуру клеток люцерны (Medicago sativa L.). Показано, что популяция клеток люцерны in vitro обладает функциональными особенностями, определяющими разную чувствительность к действию указанных абиотических стрессоров, что выражалось в разном уровне жизнеспособности клеток: высокой (85%) в условиях гипотермии и низкой (25%) при гиперосмотическом воздействии. Гипотермия стимулировала скорость генерации супероксид-аниона (${\text{O}}_{2}^{{\centerdot - }}$), ей сопутствовала высокая конститутивная активность антиоксидантных ферментов (гваякол-зависимой пероксидазы, аскорбатпероксидазы и глутатионпероксидазы), уровень которых отражает компенсаторный потенциал клеток. Сохранение высокого уровня жизнеспособности клеток при действии гипотермии, несмотря на 40% повышение скорости генерации ${\text{O}}_{2}^{{\centerdot - }}$, свидетельствует о том, что образовавшиеся активные формы кислорода не вызывали повреждения липидных структур и макромолекул в клетках. Экзогенная обработка ФГ при этом виде стрессового воздействия способствовала повышению активности антиоксидантных ферментов, однако не оказывала заметного влияния на изначально высокий уровень жизнеспособности клеток. В условиях гиперосмотического стресса предварительное воздействие ФГ приводило к 3-кратному увеличению выживаемости клеток (с 25 до 73%) и повышению на 30% активности растворимой пероксидазы по сравнению с ее уровнем при влиянии только стрессора. Воздействие ФГ также вызывало повышение активности антиоксидантных ферментов, снижение уровня перекисного окисления липидов и повышение активности ферментов малатдегидрогеназного (МДГ) комплекса. Однако, в отличие от гипотермии, наблюдаемые изменения вызывали существенное повышение жизнеспособности клеток люцерны in vitro. На увеличение образования осмолитов в реакциях НАД/НАД·Н-МДГ указывала повышенная в сравнении с контролем концентрация осмотика (маннита), вызывающего начальную степень плазмолиза клеток. Обсуждаются особенности культуры клеток люцерны, влияющие на специфику ее стресс-устойчивости, возможные механизмы защиты клеток in vitro при гипотермии и гиперосмотическом стрессе и роль ФГ в этих процессах.
ВВЕДЕНИЕ
Фуростаноловые гликозиды (ФГ) являются высокоактивными соединениями, способными усиливать адаптивные реакции растительных клеток при воздействии абиотических стрессовых факторов. В предыдущих работах нами было показано, что предварительная обработка клеток in vitro ФГ, выделенными из культуры клеток Dioscorea deltoidea Wall., приводила к изменению ряда их физиолого-биохимических характеристик, имеющих адаптогенную направленность в условиях абиотического стресса [1–5]. В частности, экзогенное действие ФГ способствовало образованию АФК, генератором которых являлась НАДФ·Н-оксидаза плазмалеммы, и индукции ферментов антиоксидантной защиты. Активация НАДФ·Н-оксидазы приводила к изменению соотношения НАДФ+/НАДФ·Н, что может выполнять роль редокс-сигнала, который регулирует активность ключевых ферментов пентозофосфатного пути и ферментов метаболизма глутатиона.
Механизмы, лежащие в основе защиты клеток при действии разных видов стрессоров, могут иметь специфичные особенности. Известно, что при действии гипотермии основными негативными последствиями являются снижение текучести мембран и окислительный стресс, связанный в первую очередь с нарушением транспорта электронов в электрон-транспортных цепях. Воздействие низкой температуры может приводить к быстрому повышению содержания Са2+ в цитозоле, связанном с активацией НАДФ·Н-оксидазы [6]. В результате происходит формирование внутриклеточных АФК, при этом их продукция и активация антиоксидантных ферментов является результатом быстрых сигнальных реакций [7]. Активация антиоксидантной системы, наряду с повышением ненасыщенности ЖК в составе липидов мембран играет ключевую роль в формировании устойчивости к гипотермии [8]. В защиту от токсичного действия АФК вовлечены такие ключевые ферменты, как аскорбатпероксидазы (АПО) и супероксиддисмутазы (СОД), а также глутатионпероксидазы (ГПО) и фенол-зависимые пероксидазы. Поскольку пероксидаза (ПО) имеет различные функции (оксидазную и пероксидазную), она может выступать как фактор, участвующий в элиминировании Н2О2, а в других ситуациях – как источник кислородных радикалов. Учитывая такую двойственность, пероксидазная ферментная система представляется одним из наиболее вероятных участников клеточного сигналинга. Уровень активности фенол-зависимой ПО в клетках растений часто используют для характеристики их функционального состояния в ответ на действие экстремальных факторов среды [9]. Эффективность антиоксидантных ферментов, которые защищают разные компартменты клетки в условиях абиотического стресса, может зависеть не только от их индуцированной, но и конститутивной активности.
При другом виде стресса – гиперосмотическом, при котором существенную роль играют механические свойства мембран [10], компенсаторные изменения, противостоящие повреждающим эффектам, включают в себя осмопротекторные механизмы, связанные с повышением уровня осмолитов, предупреждающих пороговое обезвоживание. Кроме того, регуляция активности антиоксидантных ферментов, замедляющих интенсивность липопероксидации, а также активация альдегидутилизирующих ферментов, защитное действие которых проявляется как за счет метаболизма токсичных альдегидов, так и в результате образования осмолитов [5], способствуют сопротивлению клеток гиперосмотическому стрессу.
Для выяснения механизмов адаптогенного действия ФГ на растительные клетки in vitro эффективным подходом является использование объектов со специфичными свойствами. Суспензионная культура клеток люцерны (Medicago sativa L.), восстановленная после 27 лет криогенного хранения в жидком азоте, обладает рядом функциональных особенностей – в частности, активность гваякол-ПО в ней на несколько порядков выше, чем в других исследуемых растительных объектах in vitro [4]. После длительного криогенного хранения популяция клеток люцерны возобновила рост, несмотря на низкий уровень выживаемости, что свидетельствует о высоком адаптивном потенциале клеток возобновленной культуры. Основным повреждающим фактором в результате процедуры замораживания-оттаивания является гиперосмотический стресс, к которому клетки люцерны были довольно чувствительны (погибало около 80% преимущественно полиплоидных клеток) [11]. Наряду с действием гиперосмотического стресса в процессе замораживания-оттаивания клетки подвергались также действию низкой положительной температуры.
В связи с этим цель настоящей работы заключалась в изучении механизмов, лежащих в основе защитного действия ФГ на клетки возобновленной после криогенного хранения суспензионной культуры Medicago sativa, при действии гипотермии и гиперосмотического стресса.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проведены на восстановленной после 27 лет хранения в жидком азоте суспензионной культуре клеток люцерны (Medicago sativa L.) в условиях выращивания, описанных в работе Волковой с соавт. [11]. Для определения оптимальной интенсивности стрессовых факторов была также использована хорошо охарактеризованная нами ранее суспензионная культура клеток Dioscorea deltoidea Wall, штамм ИФР ДМ-0.5 [3].
Для изучения влияния ФГ на клетки люцерны использовали препарат фуростаноловых гликозидов, выделенный из водного экстракта лиофильно высушенной культуры клеток Dioscorea deltoidea Wall, штамм ИФР ДМ-0.5 [3]. Препарат представляет собой смесь двух гликозидов – дельтозида и протодиосцина, в соотношении 2 : 3 с чистотой 85%. Для изучения действия ФГ клетки отбирали в течение цикла роста в определенные сутки культивирования (на 2, 7, 14 сут; либо на 7 и 14 сут), которые соответствовали разным фазам ростового цикла (2 сут – лаг фаза, 7 сут – фаза экспоненциального роста, 14 сут – фаза замедления роста) и проводили 60-минутную экспозицию с ФГ в концентрации 10–5 М. Контролем служили клетки без воздействия. Подробная методика изложена ранее [5].
Жизнеспособность суспензионных культур определяли с помощью окрашивания клеток 0.1% раствором феносафранина, как описано в работах [3]. При микроскопировании (световой микроскоп PZO, Польша) учитывали процент неокрашенных (живых) клеток не менее чем в 200 клеточных агрегатах.
Условия гиперосмотического стресса создавали, воздействуя на клетки через каждые 5 мин раствором маннита с постепенно повышающейся концентрацией (0.3; 0.6; 0.8 и 1.1 М). При концентрации 1.1 М клетки выдерживали в течение 1 ч. Затем клетки в течение 20 мин ступенчато деплазмолизировали, после чего определяли их жизнеспособность (выживаемость).
Гипотермическое воздействие состояло в том, что колбы с культурами клеток люцерны и диоскореи помещали в холодильную камеру на 60 мин при периодическом помешивании. При этом экспозицию клеток люцерны осуществляли при 4°С, а диоскореи – при 7°С.
Определение активности редокс-ферментов. После гомогенизации осажденных клеток суспензии (150−200 мг) в 0.1 М Трис-HCI буфере (рН 7.5) и последующего центрифугирования гомогената при 10 000 g в течение 10 мин (центрифуга Eppendorf 5414) в супернатантах определяли активность ферментов.
Активность гваякол-зависимой формы пероксидазы (КФ 1.11.1.7) определяли по изменению оптической плотности реакционной смеси в 0.1 М калий-фосфатном буфере (рН 5.5) при 470 нм [12]. Снижение активности гваякол-зависимой ПО, вызванное присутствием в реакционной среде второго субстрата – НАД·Н, определяли по методу, описанному в работе [4]. Определение пероксидазной активности производили, как описано выше [12]. Для сравнения разных вариантов величину снижения активности гваякол-зависимой ПО (А, %) вычисляли по формуле: А (%) = = 100 × (1 – А1/А2), где А1 – активность фермента (ммоль/(мг белка мин)) после внесения НАД·Н, А2 – исходная активность фермента, без НАД·Н.
Общую активность супероксиддисмутазы (СОД, КФ 1.15.1.11) определяли с использованием нитросинего тетразолия, конкурирующего с СОД за супероксид-анионы, образующиеся в результате взаимодействия метионина и рибофлавина при освещении в течение 30 мин, по методу Beauchamp и Fridovich [13]. Оптическую плотность реакционной смеси измеряли при 560 нм. Полученные данные по активности фермента выражали в относительных единицах на мг белка. За единицу активности СОД принимали 50% ингибирование образования формазана, образуемого при восстановлении нитросинего тетразолия.
Активность глутатионпероксидазы (ГПО, КФ 1.11.1.9) определяли по скорости уменьшения оптической плотности реакционной смеси при 340 нм в результате окисления НАДФ·Н с помощью двух сопряженных ферментативных реакций: генерации окисленного глутатиона (GSSG) под действием глутатионредуктазы и его последующего восстановления ГПО с использованием НАДФ·Н в качестве кофермента [14]. Снятие показаний осуществляли ежеминутно в течение 5 мин. Реакционная среда имела следующий состав: 50 мМ Трис-НСl буфер (рН 7.4), содержавший 1 мМ ЭДТА, 0.12 мМ НАДФ·Н, 0.85 мМ восстановленного глутатиона (GSН), 0.37 мМ Н2О2, 1 ед/мл глутатионредуктазы. В контрольной пробе отсутствовал GSН. Активность ГПО рассчитывали c учетом коэффициента экстинкции (ε = 6.22 мМ–1 см–1) и выражали в мкмоль/(мг белка мин).
Активность аскорбатпероксидазы (АПО, КФ 1.11.1.11) определяли по уменьшению оптической плотности при 298 нм в результате окисления аскорбиновой кислоты перекисью водорода (ε = 0.80 М–1 см–1) [15]. Для каждого определения проводили также контрольное измерение неспецифического окисления аскорбата. Активность АПО выражали в ммоль окисленного аскорбата/(мг белка мин).
Активность НАД-малатдегидрогеназы (НАД-МДГ, КФ 1.1.1.37) определяли по скорости восстановления НАД в среде следующего состава: 80 мМ Трис-НС1 буфер (рН 8.0), 2 мМ малат, 5 мМ MgSO4, 0.2 мМ НАД. Активность НАД-МДГ рассчитывали, используя среднюю скорость светопоглощения при 340 нм за первые 3 мин после начала реакции.
Активность НАД·Н-малатдегидрогеназы (НАД·Н-МДГ, КФ 1.1.1.37) определяли по скорости расходования НАД·Н в среде следующего состава: 80 мМ Трис-НС1 буфер (рН 8.0), 2 мМ оксалоацетат, 5 мМ MgSO4, 0.2 мМ НАД·Н. Активность НАД·Н-МДГ рассчитывали, используя среднюю скорость светопоглощения при 340 нм за первые 3 мин после начала реакции.
Скорость генерации супероксид-аниона (${\text{O}}_{2}^{{\centerdot - }}$) регистрировали по методу, основанному на способности ${\text{O}}_{2}^{{\centerdot - }}$ восстанавливать нитросиний тетразолий до нерастворимого формазана [16]. Количественное определение формазана проводили по методу, описанному нами ранее [3]. Контрольные и обработанные ФГ клетки инкубировали 60 мин в 0.3% растворе нитросинего тетразолия в фосфатном буфере (рН 7.0), при этом восстановление нитросинего тетразолия в клетках было спонтанным, без использования источника ${\text{O}}_{2}^{{\centerdot - }}$. После центрифугирования при 10 000 g в течение 10 мин клетки дважды экстрагировали 96% этанолом для извлечения формазана. В объединенном экстракте определяли количество формазана при длине волны 510 нм (ε = 3.0 мМ–1 см–1) и выражали в мкмоль/мг белка.
Содержание вторичных продуктов перекисного окисления липидов (ПОЛ) оценивали по ТБК-тесту [17], основанному на взаимодействии этих продуктов (преимущественно МДА) с тиобарбитуровой кислотой и образовании окрашенных комплексов, при наличии высокой температуры и кислой среды. Содержание ТБК-АП рассчитывали с использованием коэффициента экстинкции МДА, равного 155 мМ–1 см–1 и выражали в нмоль/мг белка.
Определение общего количества белка проводили по методу Lowry с соавт. [18].
Статистическую обработку данных проводили по общепринятым методикам с использованием программы Microsoft Excel 2007. Все эксперименты проводили в трехкратной повторности. Бары на диаграммах означают стандартную ошибку. Достоверность различий оценивали по критерию Стьюдента при уровне значимости P ≤ 0.05.
РЕЗУЛЬТАТЫ
Жизнеспособность клеток люцерны при действии ФГ в условиях гипотермии и гиперосмотического стресса
Для определения оптимальной интенсивности стрессовых факторов была использована хорошо охарактеризованная суспензионная культура клеток D. deltoidea Wall. Гиперосмотический стресс (выдерживание клеток в 1.1 М растворе маннита в течение 1 ч, см. Материалы и методы) и гипотермический стресс (1 ч при 4°С) вызывали практически одинаковое снижение жизнеспособности клеток – с 90% в контроле до 41% при гиперосмотическом стрессе и до 46% при гипотермии (рис. 1а), что может свидетельствовать об оптимальном уровне выбранных режимов воздействий и их “эквивалентности” для клеток диоскореи in vitro.
Рис. 1.
Жизнеспособность клеток диоскореи (а) и люцерны (б) в условиях гипотермии и гиперосмотического стресса: 1 – контроль; 2 – стресс; 3 – ФГ. Звездочками (*) обозначены статистически достоверные различия относительно контроля при Р ≤ 0.05.
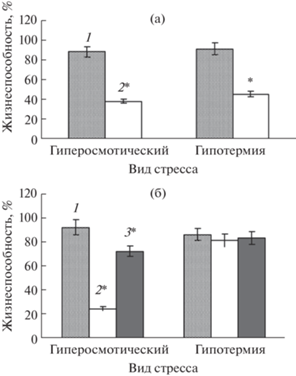
В отличие от клеток диоскореи, воздействие на суспензионные культуры клеток люцерны абиотических стрессоров разной природы привело к различному эффекту (рис. 1б). Гипотермия практически не оказала влияние на жизнеспособность клеток люцерны in vitro, тогда как гиперосмотический стресс вызвал более существенное по сравнению с клетками диоскореи (почти 4-кратное) снижение жизнеспособности – с 93% (контроль) до 25%.
В условиях гиперосмотического стресса предобработка клеток люцерны ФГ повышала выживаемость с 25% (в варианте без ФГ) до 73%. В условиях действия низкой температуры жизнеспособность клеток люцерны in vitro во всех вариантах (контроль, гипотермия, гипотермия + ФГ) практически не изменялась и находилась на уровне 85 ± 3%.
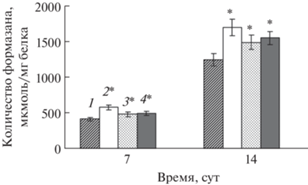
Скорость генерации супероксид-аниона при действии ФГ в условиях гипотермии
Гипотермия и обработка клеток люцерны ФГ на 7 или 14 сут культивирования стимулировали образование ${\text{O}}_{2}^{{\centerdot - }}$ (рис. 2). Превышение контроля при действии только гипотермии составило 39% на 7 сут выращивания и 36% – на 14 сут, а воздействие ФГ в контрольных условиях (при нормальной температуре) – 20 и 24%, соответственно. Воздействие на клетки ФГ в условиях холодового стресса также приводило к повышению уровня образования в них ${\text{O}}_{2}^{{\centerdot - }}$, но в меньшей степени, чем воздействие только стрессового фактора. По сравнению с контролем степень превышения скорости образования ${\text{O}}_{2}^{{\centerdot - }}$ при воздействии ФГ на 7 сут составляла 17%, на 14 сут – 19%, что в среднем на 20% ниже уровня его генерации при действии только гипотермии.
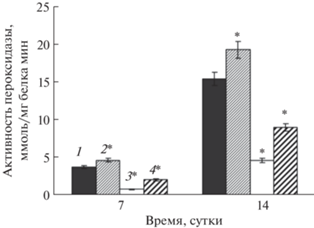
Пероксидазно-оксидазная активность пероксидазы (ПО) при действии ФГ в условиях гипотермии
Активность ПО в клетках люцерны измеряли как в окислительном цикле (с использованием НАД·Н в качестве субстрата), так и пероксидазном (с использованием фенолов в качестве субстрата). Присутствие в реакционной среде наряду с гваяколом сильного восстановителя НАДФ·Н приводило к снижению пероксидазной активности в контрольном варианте (в результате переключения на оксидазную активность) на 7 сут цикла выращивания на 37%, а на 14 сут – на 29% (рис. 3). При действии гипотермии пероксидазная активность увеличивалась на 24 и 29% (на 7 и 14 сут, соответственно), а оксидазная активность ПО либо не изменялась (7 сут), либо незначительно (недостоверно) снижалась (14 сут). Предкультивирование клеток люцерны с ФГ способствовало увеличению пероксидазной активности (на 7 сут на 17%, на 14 сут – на 19%), однако в условиях гипотермии эффект ФГ не наблюдался.
Рис. 3.
Пероксидазно-оксидазная активность пероксидазы в клетках люцерны при действии фуростаноловых гликозидов (ФГ) в условиях гипотермии: 1 – контроль; 2 – НАД‧Н; 3 – гипотермия; 4 – НАД‧Н + + гипотермия; 5 – ФГ; 6 – ФГ + гипотермия. Звездочками (*) обозначены статистически достоверные различия относительно контроля при Р ≤ 0.05.

Активность антиоксидантных ферментов при действии ФГ
Исследование функционирования антиоксидантных ферментов в клетках люцерны показало высокий уровень их конститутивной активности, имеющий циклический характер. При этом в начале цикла выращивания (2 сут) их активность была максимальной, в период интенсивного роста клеток (7 сут) она снижалась, но к завершению цикла (14 сут) опять возрастала. Активность СОД на 2 сут культивирования составляла 7.0, на 7 сут – 0.9 и на 14 сут – 2.9 отн. ед/мг белка. Активность аскорбат ПО – соответственно 2.0, 0.65 и 1.9 ммоль окисленного аскорбата/мг белка в мин; активность глютатион ПО – 800, 280 и 470 мкмоль GSSG/мг белка в мин. Зафиксированное повышение активности антиоксидантных ферментов в лаг-фазе цикла (2 сут) выращивания культур клеток фиксируется достаточно часто и может быть обусловлено активацией митохондриального дыхания после пересадки клеток на свежую питательную среду.
Изучение динамики активности антиоксидантных ферментов при воздействии ФГ показало (рис. 4), что предварительная инкубация клеток люцерны с ФГ приводила к повышению активности СОД на 21–36% по сравнению с контролем в зависимости от фазы ростового цикла культуры, что свидетельствует об увеличении образования ${\text{O}}_{2}^{{\centerdot - }}$. Аналогичное повышение активности было зафиксировано и для АПО: на 21–43% от уровня активности в контроле, тогда как изменений активности ГПО при действии ФГ в цикле выращивания клеток обнаружено не было – ее активность оставалась на уровне конститутивных значений контрольного варианта.
Уровень перекисного окисления липидов (ПОЛ) при действии ФГ
Динамика интенсивности ПОЛ в цикле выращивания клеток люцерны оказалась схожей с динамикой активности антиоксидантных ферментов – более высокие значения были отмечены в начале и конце цикла культивирования (рис. 5). Воздействие ФГ на клетки приводило к уменьшению количества в них ТБК-АП на 19–22% по сравнению с контрольным вариантом независимо от фазы ростового цикла, в котором происходила обработка ФГ.
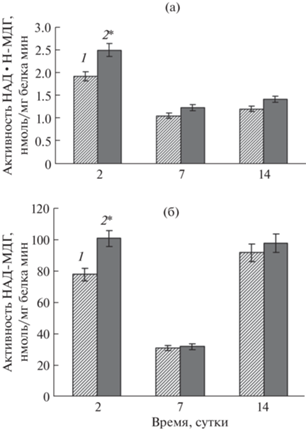
Активность ферментов малатдегидрогеназного комплекса
Анализ динамики активности НАД·Н-МДГ (рис. 6а), катализирующей восстановление оксалоацетата в малат, показал, что действие ФГ способствовало увеличению ее активности по сравнению с контролем на 18–30% в зависимости от фазы ростового цикла. В отличие от НАД·Н-МДГ, обработка клеток люцерны ФГ приводила к существенному (на 23%) повышению активности НАД-МДГ, катализирующей окисление малата в оксалоацетат лишь в начале выращивания (на 2 сут) (рис. 6б). Влияние ФГ на активность этого фермента в остальные фазы ростового цикла либо отсутствовало (обработка на 7 сут), либо было незначительным (обработка на 14 сут).
Уровень пероксидазной активности при действии ФГ в условиях гиперосмотического стресса
Обработка ФГ клеток люцерны в нормальных условиях культивирования приводила к достоверному (на 20–25%) повышению уровня пероксидазной активности по сравнению с контролем (рис. 7). Условия гиперосмотического стресса вызывали существенное (в зависимости от фазы ростового цикла – в 3–4 раза по сравнению с контролем) снижение уровня этой активности. Воздействие ФГ в условиях гиперосмотического стресса приводило к “нормализации” пероксидазной активности в клетках: она оказывалась в 1.7–1.8 раза ниже по сравнению с контрольным уровнем, но в 1.8–2.4 раза выше, чем в стрессовых условиях без воздействия ФГ.
Образование начального плазмолиза при действии ФГ в условиях гиперосмотического стресса
При использовании маннита в концентрации 0.3 М начальный плазмолиз в контрольном варианте наблюдался во всех клетках люцерны. При воздействии ФГ начальный плазмолиз в паренхимоподобных клетках с крупной вакуолью был зафиксирован при концентрации 0.4 М осмотика, а в более мелких изодиаметрических меристемоподобных клетках (их доля в популяции клеток составляла около 30%) – при 0.6 М маннита. При концентрации маннита 1.1 М сильный плазмолиз клеток (уменьшение объема цитоплазмы на 50% и более) был зафиксирован для всех клеток во всех вариантах эксперимента.
ОБСУЖДЕНИЕ
Чтобы противостоять гипотермии и гиперосмотическому воздействию в растительных клетках имеются механизмы, позволяющие посредством сложного пути передачи сигнала включать соответствующие адаптивные физиологические реакции. Известно, что холодовой стресс характеризуется активацией окислительных процессов в клетке [19]. Ограничение процессов ПОЛ и поддержание структурно-функционального состояния мембранных липидов осуществляется за счет работы антиоксидантной системы защиты, ключевую роль в которой играют специализированные ферменты [19], среди которых ПО одной из первых реагирует на любые внешние воздействия [20]. В нашем исследовании, в отличие от культивируемых клеток диоскореи (рис. 1а), холодовое воздействие (4°С, 60 мин) не влияло на жизнеспособность клеток люцерны (рис. 1б), оставаясь на уровне контроля (86%), но наблюдались изменения на биохимическом уровне. Так, определение активности ПО при действии гипотермии показало ее увеличение в цикле роста на 24–29%, при этом, не было зарегистрировано достоверного влияния на уровень оксидазной (прооксидантной) активности (рис. 3). Увеличение активности ПО при совместном действии гипотермии и ФГ может быть связано с повышением уровня Н2О2 вследствие усиления образования ${\text{O}}_{2}^{{\centerdot - }}$ (рис. 2) и активности СОД (рис. 4), которая дисмутирует ${\text{O}}_{2}^{{\centerdot - }}$ в Н2О2 и молекулярный кислород. Известно, что СОД (в частности, Cu/Zn-СОД) может быть основным источником Н2О2 в апопластном компартменте [21]. Стоит заметить, что при гипотермии уровень ${\text{O}}_{2}^{{\centerdot - }}$ в контрольном варианте был выше на 12−19%, по сравнению с действием ФГ в обычных условиях, что свидетельствует о нестрессовом характере проявления эффекта ФГ (рис. 2). Высокий уровень жизнеспособности клеток люцерны при действии гипотермии (рис. 1б) свидетельствует о том, что образовавшиеся АФК не вызывали повреждений липидных структур и макромолекул (ДНК, РНК, белки) в клетках, поэтому не приводили к развитию окислительного стресса, следствием которого могло быть образование существенных повреждений, нарушающих барьерные свойства мембран. Наряду с СОД предкультивирование клеток люцерны с ФГ вызывало также увеличение активности АПО (рис. 4), являющейся составной частью аскорбат-глутатионового цикла, механизм которого заключается в восстановлении H2O2 до воды с участием аскорбата и АПО. Участвуя в аскорбат-глутатионовом цикле, АПО снижает содержание H2O2, поддерживает окислительно-восстановительный баланс клетки, а также уровень глутатиона и аскорбиновой кислоты [22]. В отношении ГПО заметного изменения активности фермента при действии ФГ (рис. 4) не выявлено, что может быть связано с более низкой чувствительностью ГПО к увеличению концентрации Н2О2. Следует обратить внимание на высокие конститутивные значения активностей исследуемых ферментов, особенно ПО – более 15 ммоль/(мг белка мин) на 14 сут культивирования (рис. 3), которая выявляется как доминирующий фермент в цикле роста. Пероксидазная (антиоксидантная) активность ПО, наряду с другими антиоксидантными ферментами, контролирует уровень АФК, тем самым осуществляя редокс-регуляцию в растительной клетке.
При действии низких температур выявляется множество зависимых эффектов, среди которых значительно выделяются видовые особенности, соответствующие генотипу растений. Например, культура клеток диоскореи, полученная из корневища D. deltoidea Wall., была чувствительна к гипотермии уже при 7°С (рис. 1б), их жизнеспособность снижалась на 50%. Виды рода Dioscorea L. произрастают преимущественно в тропиках, реже в субтропиках и в умеренном климате и являются теплолюбивыми растениями, в отличие от люцерны, которая относится к холодостойким видам. В связи с этим устойчивость к гипотермии культуры клеток люцерны может быть генетически детерминирована и связана, в том числе, с высокой конститутивной активностью антиоксидантных ферментов, по уровню активности которых можно судить о компенсаторном потенциале клеток [23]. На этом фоне, несмотря на повышение исходного уровня активности антиоксидантных ферментов при действии ФГ, эффект последних в условиях гипотермии не наблюдался (рис. 4).
Исследуемые антиоксидантные ферменты различались чувствительностью к концентрации Н2О2. Известно, что АПО обладает высоким сродством к Н2О2 и нейтрализует ее даже в очень низких концентрациях [24], тогда как ГПО не обладает высоким сродством к Н2О2 [25], а гваяколпероксидаза, вероятно, занимает промежуточное положение. Опосредованная способность ФГ повышать активность антиоксидантных ферментов, обладающих высоким сродством к Н2О2 (в частности АПО), может свидетельствовать об участии ФГ в сигнальных механизмах АФК-индуцируемых защитных реакций в качестве фактора, обеспечивающего необходимый уровень АФК [5, 26].
Изменение проницаемости плазмалеммы тесно связано с состоянием барьера ионной проницаемости, что является важнейшим показателем, от которого зависит нормальное функционирование клетки. Полярные липиды являются структурными компонентами клеточных мембран, участвующими в формировании барьера ионной проницаемости клеток, который может нарушаться при активации ПОЛ [27]. В результате формируются сквозные полярные каналы, вследствие чего увеличивается пассивная проницаемость мембран для ионов и снижается их электрическая стабильность. Уровень ПОЛ является одним из важных повреждающих факторов, вызывающих пробой в липидной части мембраны, приводящий к ее разрыву и, в конечном итоге, к гибели клетки [28]. Нами показано, что воздействие ФГ приводило к уменьшению количества ТБК-АП в течение цикла роста на 19–22% (рис. 5), что в условиях гиперосмотического стресса отразилось на жизнеспособности клеток люцерны, которая возросла с 25% (в контроле) до 73%.
При гиперосмотическом воздействии протопласт теряет воду, уменьшается в размерах и отделяется от клеточной стенки. Сохранению водного гомеостаза при стрессе могут способствовать органические кислоты, образуемые в реакциях ферментов МДГ комплекса. Органические кислоты имеют свойства осмолитов, благодаря чему увеличивают количество связанной воды, тем самым предотвращают критическое обезвоживание клетки. Образуемые в реакциях НАД/НАД·Н-МДГ малат и оксалоацетат могут запасаться в вакуолях, выполняющих важную буферную роль [29]. Кроме того, эти молекулы участвуют в реакциях переаминирования с образованием аспарагина и аланина. Аминокислоты, образуемые в результате этих реакций, также играют значительную роль в осморегуляции клеток. Анализ динамики активности оксидоредуктазных НАД·Н-МДГ (рис. 6а) и НАД-МДГ (рис. 6б) показал, что ФГ способствовали увеличению активности ферментов МДГ комплекса. Ранее в клетках люцерны нами было показано усиление активности альдегидутилизирующих ферментов при действии ФГ [5]. Продуктами реакций этих ферментов являются карбоновые кислоты, которые могут выступать в качестве осмолитов.
На увеличение образования осмолитов при воздействии ФГ может указывать разная концентрация маннита, вызывающая начальную степень плазмолиза. Следует заметить, что клетки диоскореи по сравнению с люцерной были более устойчивые к действию осмотика − только у 50% клеток был отмечен начальный плазмолиз при концентрации маннита 0.3 М [30].
При действии гиперосмотического стресса происходит повреждение белков мембран клетки как в липидной фазе, так и проявляющих свою активность в водных растворах [27]. Уровень ПОЛ влияет на степень нарушения липидного бислоя мембран, ослабляя липид-белковые взаимодействия интегральных белков. Последние выходят из мембраны во внеклеточное пространство, тем самым усиливая неселективную проницаемость мембран [29, 31]. При гиперосмотическом стрессе уменьшается растворимость гидрофильных белков, изменяются форма и размеры их молекул, теряется ферментативная активность. Изменения происходят вследствие разрыва водородных и ионных связей, стабилизирующих пространственные структуры [32]. На примере ПО нами показано, что в результате действия гиперосмотического стресса активность фермента была ингибирована почти на 80% (рис. 7). Предварительная экспозиция клеток с ФГ способствовала бóльшему сохранению (на 30%) функциональной активности ПО по сравнению с вариантом без ФГ. Видимо, это связано с повышением активности ферментов МДГ комплекса, продукты которых имеют свойства осмолитов, а также вследствие снижения уровня ПОЛ. Таким образом, наблюдаемый эффект ФГ в условиях гиперосмотического стресса свидетельствует о запуске цитопротекторных механизмов и связанных с ними регуляторных путей, показанных нами ранее [5, 26].
Работа выполнена при поддержке гранта Российского научного фонда № 19-14-00387.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Volkova L.A., Maevskaya S.N., Burgutin A.B., Nosov A.M. Effect of exogenous steroid glycosides on cultured cells of potato under oxidative stress // Russ. J. Plant Physiol. 2007. V. 54. P. 639. https://doi.org/10.1134/S1021443707050111
Volkova L.A. Urmantseva V.V., Burgutin A.B., Maevskaya S.N., Nosov A.M. Stimulation of defense responses of in vitro potato plants by treatment with steroid glycosides under abiotic stresses // Russ. J. Plant Physiol. 2011. V. 58. P. 928. https://doi.org/10.1134/S1021443711040236
Volkova L.A., Urmantseva V.V., Burgutin A.B., Nosov A.M. Characteristics of eliciting effects of furostanol glycosides on cultured yam cells // Russ. J. Plant Physiol. 2018. V. 65. P. 427 https://doi.org/10.1134/S1021443718020085
Volkova L.A., Urmantseva V.V., Burgutin A.B., Nosov A.M. Sensitivity of antioxidant status of plant cells to furostanol glycosides // Russ. J. Plant Physiol. 2016. V. 63. P. 784. https://doi.org/10.7868/S0015330316060154
Volkova L.A., Urmantseva V.V., Burgutin A.B., Nosov A.M. Effect of furostanol glycosides from Dioscorea deltoidea on redox state of alfalfa cells in vitro // Russ. J. Plant Physiol. 2021. V. 68. P. 1098. https://doi.org/10.1134/S102144372105023X
Ogasawara Y., Kaya H., Hiraoka G., Yumoto F., Kimura S., Kadota Y., Hishinuma H., Senzaki E., Yamagoe S., Nagata K., Nara M. Synergistic activation of the Arabidopsis NADPH oxidase AtrbohD by Ca2+ and phosphorylation // J. Biol. Chem. 2008. V. 283. P. 8885. https://doi.org/10.1074/jbc.M708106200
Scandalios J.G. Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses // Braz. J. Med. Biol. Res. 2005. V. 38. P. 995. https://doi.org/10.1590/s0100-879x2005000700003
Theocharis A., Clement C., Barka E.A. Physiological and molecular changes in plants grown at low temperatures // Planta. 2012. V. 235. P. 1091. https://doi.org/10.1007/s00425-012-1641-y
Passardi F., Cosio C., Penel C., Dunand C. Peroxidases have more functions than a Swiss army knife // Plant Cell Rep. 2005. V. 24. P. 255. https://doi.org/10.1007/s00299-005-0972-6
Ackermann F., Stanislas T. The plasma membrane − an integrating compartment for mechano-signaling // Plants. 2020. V. 9. P. 505. https://doi.org/10.3390/plants9040505
Volkova L.A., Urmantseva V.V., Popova E.V., Nosov A.M. Physiological, cytological and biochemical stability of Medicago sativa L. cell culture after 27 years of cryogenic storage // CryoLetters. 2015. V. 36(4). P. 252.
Lin C.C., Kao C.H. NaCl induced changes in ionically bound peroxidase activity in roots of rice seedlings // Plant Soil. 1999. V. 216. P. 147. https://doi.org/10.1023/A:1004714506156
Beauchamp C., Fridovich J. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels // Anal. Biochem. 1971. V. 44. P. 276.
Шульгин К.К., Попов С.С., Рахманова Т.И., Попова Т.Н., Сафонова О.А., Веревкин А.Н., Семенихина А.В., Гончарова Е.И. Активность глутатионпероксидазы при нарушении функции печени и выделение фермента с использованием хроматографических методов для исследования регуляторных свойств // Сорбционные и хроматографические процессы. 2016. Т. 16. № 6. С. 916.
Gerbling K.-P., Kelly G.J., Fischer K.-H., Latzko E. Partial purification and properties of soluble ascorbate peroxidases from Pea leaves // J. Plant Physiol. 1984. V. 115. P. 59.
Liszkay A., van der Zalm E., Schopfer P. Production of reactive oxygen intermediates (${\text{O}}_{2}^{{\centerdot - }}$, H2O2, and •OH) by maize roots and their role in wall loosening and elongation growth // Plant Physiol. 2004. V. 136. P. 3114. https://doi.org/10.1104/pp.104.04478410.1104/pp.104.044784
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts. 1. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125. P. 189.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with Folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265.
Chinnusamy V., Zhu J., Zhu J.-K. Cold stress regulation of gene expression in plants // Trends Plant Sci. 2007. V. 12. P. 444. https://doi.org/10.1016/j.tplants.2007.07.002
Kawano T. Roles of the reactive oxygen species generating peroxidase reactions in plant defense and growth induction // Plant Cell Rep. 2003. V. 21. P. 829. https://doi.org/10.1007/s00299-003-0591-z
Tanaka K., Takio S., Yamamoto I., Satoh T. Purification of the cytosolic CuZn-superoxide dismutase (CuZn-SOD) of Marchantia paleacea var. diptera and its resemblance to CuZn-SOD from chloroplasts // Plant Cell Physiol. 1996. V. 37(4). P. 523.
Foyer C.H., Noctor G. Defining robust redox signalling within the context of the plant cell // Plant Cell Environ. 2015. V. 38. P. 239. https://doi.org/10.1111/pce.13659
Mehla N., Sindhi V., Josula D., Bisht P., Wani S.H. An introduction to antioxidants and their roles in plant stress tolerance // Reactive Oxygen Species and Antioxidant Systems in Plants: Role and Regulation under Abiotic Stress / Eds. M.I.R. Khan, N.A. Khan. Springer Nature Singapore Pte Ltd. 2017. P. 1. https://doi.org/10. 1007/978-981-10-5254-5
Полесская О.Г. Растительная клетка и активные формы кислорода. Москва: КДУ, 2007. 140 с.
Колупаев Ю.Е. Антиоксиданты растительной клетки, их роль в АФК-сигналинге и устойчивости растений // Успехи современной биологии. 2016. Т. 136. С. 181.
Volkova L.A., Urmantseva V.V., Klyushin A.G., Burgutin A.B., Nosov A.M. Activity of respiratory pathways in cultured yam cells under the influence of furostanol glycosides // Russ. J. Plant Physiol. 2020. V. 67. P. 344. https://doi.org/10.1134/S1021443715040172
Volinsky R., Kinnunen P.K.J. Oxidized phosphatidylcholines in membrane-level cellular signaling: from biophysics to physiology and molecular pathology // FEBS J. 2013. V. 280. P. 2806. https://doi.org/10.1111/febs.12247
Евстигнеев М.П., Завьялова О.С., Савченко Е.В. Биофизика мембран: учеб. пособие // Севастополь: СевГУ. 2019. 59 с.
Lokhande V.H., Suprasanna P. Prospects of halophytes in understanding and managing abiotic stress tolerance // Environmental adaptations and Stress Tolerance of Plants in the Era of Climate Change / Eds. P. Ahmad, M.N.V. Prasad. Springer Science + Business Media, LLC. 2012. P. 29. https://doi.org/10.1007/978-1-4614-0815-4_2
Урманцева В.В., Волкова Л.А., Ульянова К.А., Куличенко И.Е., Носов А.М. Использование перекиси водорода и дикарбоновых кислот для повышения осмоустойчивости культуры клеток Dioscorea deltoidea W. // Биотехнология. 2009. С. 14.
Fruhwirth G.O., Loidl A., Hermetter A. Oxidized phospholipids: from molecular properties to disease // Biochim. Biophys. Acta Mol. Basis Dis. 2007. V. 1772. № 7. P. 718. https://doi.org/10.1016/j.bbadis.2007.04.009
Степовая Е.А., Шахристова Е.В., Рязанцева Н.В., Носарева О.Л., Якушина В.Д., Носова А.И., Гулая В.С., Степанова Е.А., Чильчигашев Р.И., Новицкий В.В. Окислительная модификация белков и система глутатиона при модуляции редокс-статуса клеток эпителия молочной железы // Биомедицинская химия. 2016. Т.62. С. 64. https://doi.org/10.18097/PBMC20166201064
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений