Физиология растений, 2022, T. 69, № 4, стр. 339-351
Современные представления о механизмах образования оксида азота в растениях
Ч. Р. Аллагулова a, *, А. М. Авальбаев a, А. Р. Лубянова a, О. В. Ласточкина a, Ф. М. Шакирова a
a Институт биохимии и генетики – обособленное структурное подразделение
Уфимского федерального исследовательского центра Российской академии наук
Уфа, Россия
* E-mail: allagulova-chulpan@rambler.ru
Поступила в редакцию 23.11.2021
После доработки 03.12.2021
Принята к публикации 04.12.2021
- EDN: GYLNIF
- DOI: 10.31857/S0015330322030034
Аннотация
Оксид азота (NO) является универсальной сигнальной молекулой, функционирующей во всех живых организмах. В растениях он вовлекается в регуляцию роста и развития в нормальных условиях произрастания и в формирование устойчивости к широкому спектру стрессовых воздействий. Несмотря на то, что за последние три десятилетия был совершен колоссальный прогресс в понимании роли и механизмов регуляторного действия NO, пути его биосинтеза в растительных организмах раскрыты далеко не полностью и остаются предметом жарких дискуссий. Анализ современных литературных данных позволяет выделить два принципиально различающихся механизма образования NO в высших растениях: окислительный или аргинин-зависимый путь, и восстановительный или нитрат/нитрит-зависимый путь. В первом случае продукция оксида азота происходит при взаимодействии аргинина с кислородом, протекающем с образованием цитруллина и высвобождением молекулы NO. Однако ферменты, отвечающие за окислительное образование NO в высших растениях, пока не идентифицированы. Наиболее хорошо изученным у растений является нитрит-зависимое образование NO, в котором особая роль принадлежит молибденосодержащим ферментам, в частности нитратредуктазе NR (Nitrate Reductase) и амидоксимредуктазе mARC (mitochondrial Amidoxime Reducing Component). Свой вклад в продукцию NO могут вносить ксантиноксидоредуктаза XOR (xanthine oxidoreductase), альдегидоксидаза AO (aldehyde oxidase) и сульфитоксидаза SO (sulfite oxidase). Настоящий обзор посвящен детальному анализу основных механизмов образования NO в высших растениях.
ВВЕДЕНИЕ
Оксид азота (NO) принадлежит к числу универсальных сигнальных молекул, функционирующих во всех живых организмах [1]. В растениях он вовлекается в регуляцию метаболических процессов на всех этапах онтогенеза от прорастания и вегетативного роста до цветения, плодоношения и старения. NO принимает участие в регуляции клеточного цикла, дифференциации и росте пыльцевых трубок, морфогенеза, взаимодействия растений с симбионтами [2–7]. Особый интерес к NO вызван его участием в формировании устойчивости растений к разным по природе стрессовым факторам [8, 9]. О сигнальных функциях NO в растениях заговорили в конце 1990-х г.г., когда была выявлена его роль в развитии защитных реакций растений при инфицировании патогенами [10–12]. Кроме того, получен большой массив данных об участии NO в развитии устойчивости растений к стрессовым факторам абиотического происхождения, таким как, засуха, засоление, осмотический стресс, нарушение температурного режима, УФ-облучение, воздействие ионов тяжелых металлов [4, 7, 13, 14].
Выполнение оксидом азота множественных функций связано с особенностями его физико-химического строения. NO является липофильной молекулой, характеризующейся наличием непарного электрона на π-орбитали, что превращает его в радикальную молекулу с высокой реакционной способностью, свободно проникающей через клеточные мембраны и быстро взаимодействующей с другими соединениями [4, 8, 15–17]. Взаимодействие NO с активными формами кислорода (АФК) индуцирует продукцию активных форм азота (АФА). Среди них особого внимания заслуживает пероксинитрит (ONOO–), образуемый при взаимодействии NO с супероксидом, который выступает в качестве одного из нитрирующих агентов в каскаде NO сигнальных реакций в растениях. Кроме того, при взаимодействии оксида азота с глутатионом образуется S-нитрозоглутатион (GSNO), который выступает в качестве главной запасной и транспортной формы NO, способной осуществлять передачу нитрогруппы на другие биомолекулы, такие как белки, жирные кислоты, нуклеиновые кислоты. В частности, нитрование белков по остаткам тирозина и серина, а также по ионам Cu или Fe в составе металлопротеинов, вызывает их конформационные перестройки, что лежит в основе одного из основных механизмов реализации NO-зависимого сигналинга [6, 18–20].
Об образовании оксида азота растениями стало известно еще в 1970-х г.г., когда с помощью газовой хроматографии была выявлена его эмиссия бобовыми культурами, подвергнутыми обработке гербицидами [6, 21]. Однако пути его биосинтеза в растениях изучены далеко не полностью и до настоящего времени остаются объектом пристального внимания и жарких дискуссий [1, 22, 23]. Согласно современным представлениям в высших растениях функционируют два главных механизма биосинтеза NO: (1) окислительный или аргинин-зависимый путь и (2) восстановительный или нитрат/нитрит-зависимый путь [2, 5, 13, 16]. При этом оба пути носят сложный комплексный характер. Поэтому данная работа посвящена детальному анализу современных литературных данных о механизмах образования оксида азота в растениях, которые реализуются в ходе множественных окислительно-восстановительных превращений различных субстратов с участием разнообразных ферментных систем.
1. ОКИСЛИТЕЛЬНЫЕ МЕХАНИЗМЫ ОБРАЗОВАНИЯ NO
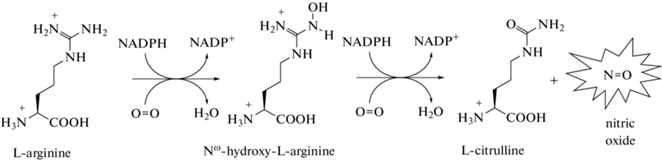
Окислительные пути биосинтеза оксида азота связаны с процессом окисления L-аргинина в присутствии кислорода, при котором происходит образование цитруллина и высвобождение NO (рис. 1). Реакция протекает в два этапа: изначально L-аргинин преобразуется в N-гидрокси-L-аргинин, который затем превращается в цитруллин с высвобождением NO. При этом атом азота образующейся молекулы NO происходит из гуанидиновой группы L-аргинина, а атом кислорода – из участвующей в реакции молекулы кислорода [5, 6, 8, 12, 20, 24].
Реакция хорошо изучена на примере животных, у которых она катализируется специфическими ферментами NO-синтазами (NOSs, КФ 1.14.13.39) [6, 12, 24]. У млекопитающих и человека описаны три изоформы NO-синтаз: NOS1 – нейронная (nNOS, neuronal NOS); NOS2 – индуцибельная или макрофагальная (iNOS, inducible NOS); NOS3 – эндотелиальная (eNOS, endothelial NOS), кодируемые тремя разными генами. При этом NOS1 и NOS3 характеризуются конститутивной экспрессией, тогда как NOS2 отличается индуцируемой активностью, на что указывает само название данной изоформы фермента. iNOS образуется при инфицировании организма, и его основные функции связаны с участием в защитных иммунных реакциях. Все изоформы NOS обладают сходным строением, проявляя функциональную активность в гомодимерной форме. В каждой мономерной субъединице присутствуют два домена: (1) – редуктазный или NAD(P)H-FAD-FMN-домен, расположенный в С-терминальной области; (2) – оксигеназный или Fe-Heme-домен, расположенный в N-терминальной области молекулы, содержащий сайты связывания гема тетрагидробиоптерина (THB4) и L-аргинина. Между редуктазным и оксигеназным доменами расположен кальмодулин (CaM)-связывающий участок, выполняющий важную роль в регуляции активности фермента. В ходе NOS-катализируемых реакций NO синтезируется при окислении атома азота гуанидинового радикала в составе L-аргинина с использованием электронов, предоставляемых универсальным клеточным восстановителем NAD(P)H и транспортируемых из редуктазного в оксигеназный домен [6, 12, 24, 25].
Многочисленные экспериментальные данные, в которых образование NO анализировалось по продукции цитруллина, а также угнетение его синтеза в растениях при использовании ингибиторов NOS-активности млекопитающих, позволяют предполагать возможность реализации аргинин-зависимого пути генерации NO в растениях [13, 15, 20, 22]. Однако ферменты, гомологичные NOS млекопитающих в высших растениях пока не идентифицированы, о чем свидетельствуют данные крупномасштабного скрининга более тысячи просеквенированных растительных геномов [12, 26]. Среди фотосинтезирующих организмов NOS-подобные последовательности выявлены у 15 одноклеточных водорослей, включая Ostreococcus tauri, для которой ранее было продемонстрировано наличие функционально активного NOS фермента, обладающего 45% гомологией с NOS-последовательностями млекопитающих [13, 25–27]. Одноклеточные зеленые водоросли рода Ostreococcus являются мельчайшими ныне живущими эукариотическими организмами, отделившимися от общего с высшими растениями предка в самостоятельную филогенетическую группу на ранних этапах развития. Существует мнение, что в ходе эволюции с выходом на сушу у зеленых растений произошла утрата генов, подобных NOS генам млекопитающих [12, 27]. Вместе с тем в многочисленных экспериментальных работах было четко продемонстрировано, что использование ингибиторов NO-синтаз животных для обработки разных видов высших растений приводило к угнетению в них продукции NO и связанных с ним биологических эффектов [4, 15, 22]. На основании этих данных была выдвинута гипотеза о существовании неких растительных полипептидов, обладающих окислительно-восстановительными доменами, способными объединяться в единый ферментативный комплекс, катализирующий аргинин-зависимые реакции образования NO в высших растениях [20, 27]. Таким образом, на сегодняшний день перед исследователями стоит задача идентифицировать в наземных растениях специфические ферменты, катализирующие окисление аргинина с образованием L-цитруллина и высвобождением NO [23, 26, 28, 29].
Полиамины (PAs, polyamines). Известно, что аргинин является субстратом для биосинтеза спермина и спермидина, принадлежащих к веществам класса полиаминов [2, 20]. Использование двух мутантных по аргиназе линий Arabidopsis thaliana с повышенной экспрессией или, напротив, с выключенным геном аргиназы показало, что продукция NO в этих растениях зависит от доступности аргинина. При этом дефицитные по аргинину растения характеризовались пониженным уровнем продукции NO, которая восстанавливалась после обработки спермином [30]. Экзогенная обработка растений A. thaliana спермином или спермидином приводила к повышенной продукции NO в кончиках корней и в сосудистых тканях листьев обработанных полиаминами проростков [2, 31]. Однако последовательность реакций, при которых происходит биосинтез NO из полиаминов, пока не установлена. Предполагается, что данный процесс протекает с участием Cu-аминооксидазы, поскольку мутанты A. thaliana CuAO1 характеризовались нарушением синтеза NO в ответ на обработку PAs [13, 27, 32].
Гидроксиламин (HA, hydroxylamine). Тот факт, что в бактериальных и животных клетках происходит энзиматическая продукция NO из гидроксиламина (HA), наводит на мысль, что это соединение может служить одним из источников биосинтеза оксида азота в растениях [2, 33, 34]. Например, в нитрифицирующих бактериях HA-зависимое образование NO может протекать с участием гидроксиламиноредуктазы [35]. Показано также, что NO может высвобождаться из HA при их взаимодействии с супероксидом [36]. Более того, одним из производных гидроксиламина является L-гидроксиаргинин, выступающий в качестве интермедиата в реакции превращения L-аргинина до цитрулина, протекающей с высвобождением NO [2, 37]. В пользу участия HA в образовании NO в растительных организмах служат данные, полученные в опытах с мутантными линиями табака nia30, дефицитных по нитратредуктазе и не способных к нитрит-зависимому восстановительному образованию NO. Внесение HA в суспензионную культуру клеток линии nia30 индуцировало эмиссию оксида азота дефицитными по нитратредуктазе клетками, о чем судили по данным газо-фазовой хемилюминесценции [33, 34]. Физиологическое значение продукции NO из HA не совсем понятно, поскольку пока не получены неопровержимые доказательства функционирования HA в растениях. Установлено, что NH2OH является первым продуктом окисления аммония. Кроме того, образование HA может происходить с участием фермента S-нитрозоглутатион редуктазы (GSNOR), играющей исключительную роль в поддержании гомеостаза S-нитрозоглутатиона (GSNO), функционирующего в качестве основного резервуара NO в живых организмах, включая растения [1, 2].
2. ВОССТАНОВИТЕЛЬНЫЕ ПУТИ ОБРАЗОВАНИЯ NO
Восстановительные пути биосинтеза NO (нитрат/нитрит-зависимые пути) связаны с реакциями нитрат/нитритредукции, которые могут протекать спонтанно без участия специфических ферментов, либо осуществляться с участием ферментов, проявляющих нитритредуктазную активность, катализирующих восстановление нитрита до NO [2, 5, 22].
Неферментативное нитрит-зависимое образование NO было выявлено в апопласте алейронового слоя ячменя, которое осуществлялось в условиях низких значений pH среды и высоких концентрациях нитрата [22, 38, 39]. Эта реакция была описана с помощью уравнения:
Присутствие редуцирующих агентов, таких как аскорбиновая кислота или некоторых фенольных соединений способствует усилению неферментативной продукции NO. Было выдвинуто предположение, что продуцируемый в апопласте NO вовлекается в регуляцию процесса прорастания семян [39].
Ферментативные процессы восстановительного образования NO могут протекать в митохондриях с участием компонентов митохондриальной электрон-транспортной цепи (мЭТЦ), а также в хлоропластах, пероксисомах и в цитоплазме растительной клетки [23, 40]. При этом важную роль в нитрит-зависимой продукции оксида азота играют молибденсодержащие ферменты, к числу которых, в частности, принадлежит нитратредуктаза [41, 42]. Ее основные функции связаны с процессом восстановления нитрата до нитрита в ходе реакций ассимиляции азота. Кроме того, она способна проявлять нитритредуктазную активность в условиях гипоксии и пониженных значений pH среды [2, 5, 13, 22].
2.1. Роль молибденсодержащих энзимов в восстановительном образовании NO
Многочисленные экспериментальные данные указывают на то, что доминирующими в растениях являются восстановительные пути образования оксида азота с участием молибдоэнзимов, для которых основным субстратом для продукции NO становится нитрит. Аккумуляция нитрита в растениях может происходить в результате его поглощения из почвы. Однако его преобладающее количество образуется в ходе реакции восстановления нитрата с участием ассимиляторной нитратредуктазы NR (Nitrate Reductase; КФ 1.7.1.1), принадлежащей к классу растительных молибдоэнзимов, объединяющего всего пять ферментов [41–43]. Наряду с нитратредуктазой в состав класса молибдоэнзимов входят амидоксимредуктаза или митохондриальный амидоксим редуцирующий компонент mARC (mitochondrial Amidoxime Reducing Component), ксантиноксидоредуктаза XOR (xanthine oxidoreductase, КФ 1.17.3.2), альдегидоксидаза AO (aldehyde oxidase, КФ 1.2.3.1) и сульфитоксидаза SO (sulfite oxidase, КФ 1.8.3.1). Молибдоэнзимы выполняют в растениях свои специфические функции и вместе с тем обладают потенциальной способностью катализировать реакцию одноэлектронного восстановления нитрита до NO, в связи с чем эти ферменты предложено объединить в самостоятельное семейство, для обозначения которого в литературе предлагается термин “неспецифические NO-формирующие нитритредуктазы” [41, 44].
Молибденовый кофактор. Отличительным структурным признаком, обуславливающим нитрит-восстанавливающую NO-образующую активность эукариотических молибдоэнзимов, является наличие в их составе специфического молибденового кофактора Moco. Он характеризуется уникальной 4-гранной пирамидальной структурой, образование которой обусловлено связыванием атома молибдена с гетероциклом пираноптерином (рис. 2). А в зависимости от того, каким образом Moco связывается с белковой частью, было предложено классифицировать молибдоэнзимы на 2 группы: (1) семейство SO, включающее три фермента: NR, SO, ARC и (2) семейство XO, объединяющее два других молибдоэнзима: XOR и AO. У членов семейства SO присоединение Moco к белковой части фермента осуществляется посредством ковалентной связи через тиоловую группу остатка цистеина, тогда как в составе XOR и AO связывание Moco с белком происходит с участием неорганического атома серы (рис. 2) [41, 42, 45].
Рис. 2.
Структура активных сайтов растительных молибдоэнзимов: (а) – строение гетероцикла пираноптерина (молибдоптерина); (б) – структура молибденовых центров двух семейств растительных молибдоэнзимов.
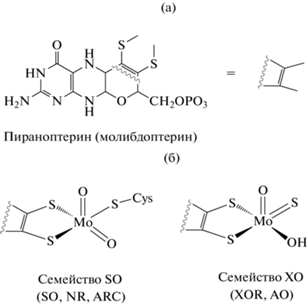
В 4-гранной пирамидальной структуре всех Moco атом молибдена образует пять координационных связей: (1) с одной апикальной оксогруппой; (2‒3) двумя атомами серы гетероцикла пираноптерина; (4) с атомом кислорода лабильной OH/H–группы; (5) с атомом серы, кислорода или селена в зависимости от типа фермента (рис. 2). Так, в активном центре ферментов семейства XO атом молибдена координируется одной апикальной оксогруппой, двумя атомами серы пираноптерина, одной лабильной OH/H–группой и одной терминальной оксо-, сульфо- или селено-группой. Активный сайт трех других молибдоэнзимов NR, ARC, SO, принадлежащих к семейству SO, имеет аналогичное строение с единственным различием по месту терминальной группы, где атом молибдена в составе Moco этих ферментов образует тиоловую связь с консервативным остатком цистеина, связывающую кофактор с пептидной частью энзима [41, 42].
Одним из типов катализируемых Moco реакций является отнятие атома кислорода от субстрата с образованием воды и продукта реакции с использованием электронов восстановленного атома Mo (+IV). При этом степень его окисления циклично меняется от +IV до +VI [41]. Данный процесс хорошо изучен для реакции восстановления нитрата до нитрита, катализируемого NR (Уравнение 1).
Аналогичный тип реакции лежит в основе процесса нитрит-зависимой продукции NO (Уравнение 2) [41, 42, 46].
2.1.1. Роль нитратредуктазы в биосинтезе NO
Ассимиляторная нитратредуктаза (NR – Nitrate reductase; EC 1.7.1.1) является NAD(P)H-активируемым Moco-содержащим ферментом, широко распространенным среди растений, грибов и водорослей [2, 22, 46]. У растений фермент обнаруживается как в цитозольной, так и в связанной с цитоплазматической мембраной форме [28]. Основная функция NR связана с процессом ассимиляции азота, в котором она катализирует первую стадию – реакцию двухэлектронного восстановления нитрата (${\text{NO}}_{3}^{ - }$) до нитрита (${\text{NO}}_{2}^{ - }$). Далее нитрит с участием другого ключевого фермента азотного обмена ассимиляторной нитритредуктазы (NiR) восстанавливается до аммония, необходимого для последующего синтеза аминокислот. Вместе с тем показано, что нитрит с участием NR может быть восстановлен до NO при одноэлектронном транспорте электронов (рис. 3). Реакцию восстановления нитрита до NO с участием NR можно представить в следующем виде:
Способность растительной NR восстанавливать нитрит до NO принято обозначать термином “нитрит : NO-редуктазная активность” или Ni‒NR [2, 22, 46]. В настоящее время NR-зависимый путь рассматривается в качестве одного из главных механизмов образования оксида азота в растениях. Однако роль NR в продукции NO растительными клетками связана не только с прямым ее участием в процессе одноэлектронного восстановления нитрита до NO, а также с продукцией самого нитрита, выступающего в качестве субстрата для других ферментов, катализирующих реакцию нитритредукции до NO. Кроме того, NR может осуществлять передачу электронов от NAD(P)H на молибдоэнзим mARC, который катализирует восстановление нитрита с образованием NO, как это было продемонстрировано на модельной водоросли Chlamydomonas reinhardtii [22, 47, 48]. Важно подчеркнуть, что нитратредуктаза вовлекается также в процесс утилизации оксида азота и поддержание его гомеостаза в растениях, поскольку она способна передавать электроны от NAD(P)H на гемоглобин THB1, катализирующего реакцию двухэлектронного превращения NO до нитрата [27, 47].
Трехмерная модель нитратредуктазы, характеризующаяся мультидоменным строением, была предложена еще в конце 1990-х г.г. [49]. Вместе с тем за последние два десятилетия были выявлены новые детали строения и функционирования NR [44, 46]. Фермент проявляет каталитическую активность, будучи в гомодимерной форме, образованной из мономерных субъединиц с молекулярной массой около 100‒110 кДа, построенных приблизительно из 900 остатков. В каждой из субъединиц присутствует 3 простетические группы: (1) молибденовый кофактор или Moсo (molybdenum cofactor), входящий в состав Moco-домена; (2) цитохром b5 типа, содержащий гемовое железо (Heme-домен) и (3) FAD-кофактор, который при взаимодействии с универсальным клеточным восстановителем NAD(P)H формирует FAD-домен (рис. 4). Домены соединены между собой с помощью гибких шарнирных участков, обозначенных как Hing1 и Hing2. Первый шарнирный участок Hing1 расположен между Moco- и Heme- доменами и представляет собой неконсервативный аминокислотный фрагмент, играющий важную роль в регуляции каталитической активности NR, обусловленную фосфорилированием по остатку серина. Второй шарнирный участок Hing2 соединяет Heme- и FAD- домены. Сборка гомодимерной формы NR осуществляется с помощью сайта димеризации мономеров, входящего в состав Moco-домена (рис. 3) [46, 49].
Рис. 4.
Схематическое изображение доменной структуры мономерной субъединицы нитратредуктазы (NR). Фигурными скобками сверху обозначены три домена (Moco-; Heme- и FAD-домены). Стрелками отмечено направление потока электронов от FAD-домена на Moco-домен.

Известно, что между кофакторами ферментных молекул, обладающих разными значениями окислительно-восстановительных потенциалов (ОВП), формируется электрон транспортная цепь, при этом передача электронов происходит от переносчика с меньшим значением ОВП к переносчику с большим его значением [50]. Основываясь на значениях ОВП для кофакторов в составе NR, было сделано заключение, что внутри каждой из субъединиц осуществляется нисходящий ток электронов от FAD- (~ –280 мВ), к Heme- домену (~ –160 мВ), и затем на Moсo (~ 0 мВ). Таким образом, NR функционирует как миниатюрная электрон-транспортная цепь, осуществляющая перенос электронов от NAD(P)H, которые последовательно передаются через FAD- и Heme- на атом молибдена в составе Moсo, при этом степень окисления Mo меняется с (+VI) до (+IV). Далее электроны используются для восстановления нитрата, а в реакции образования оксида азота происходит восстановление нитрита [43, 46, 48, 49].
Впервые участие NR в реакции нитритредукции с образованием NO было успешно продемонстрировано у представителей семейства бобовых [51]. В последующем ее роль в NO-продукции была выявлена и у других видов растений, включая пшеницу [52], A. thaliana [53–55], томат [56], кукурузу [57]. NO-образующая способность нитратредуктазы весьма невысока и составляет не более 1% суммарной активности фермента в нормальных условиях произрастания и зависит от ряда факторов, в частности от соотношения концентраций нитрат- и нитрит-ионов, присутствием кислорода и значением pH среды, пост-трансляционными модификациями фермента. Сродство NR к нитрату (${\text{NO}}_{3}^{ - }$) существенно выше, чем к нитриту (${\text{NO}}_{2}^{ - }$) и определяется значением KM, которое составляет 10 и 100 мкМ для нитрат- и нитрит-ионов, соответственно. Кроме того, сродство NR к нитриту (KMnitrite = 100 мкМ) превышает величину константы ингибирования нитрата (Kinitrate = = 50 мкМ) и, следовательно, образование NO зависит от накопления нитрита [2]. Приведенные кинетические параметры объясняют тот факт, что Ni-NR активность повышается при уменьшении концентрации ${\text{NO}}_{3}^{ - }$ и увеличении концентрации ${\text{NO}}_{2}^{ - }$ [2, 22]. Важным условием для проявления Ni-NR активности является значение pH среды, по мере снижения которого происходит повышение NO-образующей способности NR.
Примечательно, что продукция NO при кислых значениях pH возрастает, вследствие подавления активности пластидной ассимиляторной нитритредуктазы (NiR), сопровождающейся повышением уровня нитрита в клетке [2]. Имеются данные о влиянии пост-трансляционных модификаций белковой молекулы NR на NO-образующую способность фермента. Фосфорилирование консервативного остатка серина в одном из гибких линкерных участков NR обуславливает ее взаимодействие с белками класса 14‒3‒3, что приводит к инактивации фермента с его последующей протеолитической деградацией [2]. Замена консервативного остатка серина Ser-521 на аспартат в структуре NR табака Nicotiana plumbaginifolia индуцировала конститутивную активность фермента, сопровождавшуюся повышением концентрации нитрита в клетках и увеличением уровня эмиссии NO в окружающую среду трансгенными линиями этого вида растений [58].
У представителей разных видов растений выявлено наличие двух или более изоформ нитратредуктаз, характеризующиеся своей спецификой в проявлении функциональной активности, например, преимущественным взаимодействием с NADH или NADPH, конститутивной или индуцируемой экспрессией. В модельном объекте Arabidopsis thaliana идентифицировано две изоформы фермента NR1 и NR2, кодируемые генами Nia1 и Nia2. Тот факт, что NR1 проявляет более высокую Ni‑NR активность, а NR2 характеризуется более высокой нитратредуктазной активностью, свидетельствует о том, что разные изоформы фермента выполняют свои специфические функции в растительных организмах [27]. Трансгенные линии A. thaliana с оверэкспрессией Nia1 и Nia2 генов и накоплением соответствующих белков характеризовались значительным повышением уровня NO продукции [46]. Использование мутантных линий, дефицитных по NR: nia1 и nia2, а также двойных мутантов nia1/nia2 продемонстрировало важную роль фермента в биосинтезе NO, необходимого для поддержания жизнедеятельности растений в норме и при стрессе. Показано, что в нормальных условиях произрастания оксид азота, продуцируемый с участием NR, вовлекается в контролирование процессов морфогенеза корней [59], инициацию цветения [60], гормональную чувствительность, регуляцию устьичных движений [54, 61]. Кроме того, NR-зависимый NO выполняет важную роль в развитии защитных реакций растений при инфицировании патогенами, и при воздействии стрессовых факторов абиотического происхождения, таких как засуха, засоление, осмотический и температурный стресс, действие ионов тяжелых металлов [46, 62–65].
2.1.2. Образование оксида азота с участием mARC. Cистема NR:NOFNiR
До недавнего времени NR рассматривалась в качестве главного ферментативного источника нитрит-зависимой продукции NO в растительных организмах [47]. Вместе с тем участие NR в процессе образования NO может обуславливаться ее диафоразной активностью, то есть способностью осуществлять транспорт электронов от клеточных восстановителей NADH или NADPH на редуктазный (FAD)- и затем цитохромный (Heme)- домены. Далее электроны в процессе нитрит-зависимой генерации NO передаются на другой молибдоэнзим mARC, катализирующий реакцию восстановления нитрита до NO, обусловленную функционированием Moco в составе mARC [66].
Белки семейства mARC были охарактеризованы у прокариотических и эукариотических организмов и впервые идентифицированы благодаря своей способности in vitro катализировать превращение амидоксимов в активные аминоформы [67, 68]. У человека идентифицированы две изоформы mARC, локализованные на внешней митохондриальной мембране, с чем связано наименование этих белков. В геноме A. thaliana также присутствует два гена амидоксимредуктаз ARC1 и ARC2, тогда как у одноклеточной зеленой водоросли Chlamydomonas reinhardtii выявлено наличие одного ARC-гена, а сам белок имеет цитоплазматическую локализацию [47, 69]. Амидоксимредуктазы животных и растений имеют идентичное строение и представляют собой белки с молекулярной массой около 35 кДа. В отличие от других молибдоэнзимов, функционирующих в виде гомодимеров, животные и растительные mARC проявляют свою активность, будучи в форме мономеров. В структуре mARC имеется только одна простетическая группа, представленная Mосо и на примере животных, было показано, что для осуществления каталитической активности mARC требуется участие митохондриальных белковых партнеров: цитохром b5-редуктазы (Cyt b5-R) и цитохрома b5 (Cyt b5), при этом активный центр mARC граничит с цитоплазмой [66]. Таким образом, совместно со своими партнерами mARC формирует митохондриальный электрон-транспортный комплекс ARCO (Amidoxime Reducing Complex), по которому электроны последовательно передаются от NADH или NADPH через Cyt b5-R и Cyt b5 на Мосо-сайт mARC, в котором происходит редуцирование субстрата [47, 67, 68].
Субстратная специфичность mARC окончательно не установлена. Выявлен широкий спектр веществ, принадлежащих к производным гидроксиламина, которые могут подвергаться ARC-зависимой редукции [67]. Среди них идентифицированы N-гидроксилированные формы азотистых оснований, в частности N-гидроксиаминопурин и N-гидроксицитозин, что может указывать на вовлечение mARC в процессы нейтрализации их мутагенного и повреждающего действия [47, 68]. Кроме того, субстратом для mARC может выступать N-ω-гидрокси-L-аргинин, который является признанным промежуточным продуктом NOS-зависимой генерации оксида азота. Таким образом, mARC может выступать в качестве негативного регулятора NOS-активности [67].
C использованием амидоксимредуктаз человека hmARC1 и hmARC2, было показано участие этих белков в продукции NO на наружной стороне митохондриальной мембраны [66]. Следует обратить внимание, что пространственная организация простетических групп митохондриального комплекса ARCO имеет близкое сходство с внутримолекулярной электрон-транспортной цепью нитратредуктазы, в которой также присутствуют NAD(P)H-связывающий редуктазный-FAD-домен и цитохромный Cyt b5- или Heme-домен [67]. С использованием NR-мутантных линий водоросли Chlamydomonas reinhardtii, характеризующихся делецией по Moсo-домену и функционально активными редуктазным и цитохромным доменами в структуре NR, была наглядно продемонстрирована ее роль в транспорте электронов на Moсo-домен в составе ARC при синтезе NO. Оба фермента в клетках водоросли локализованы в цитоплазме, где выявлялась продукция NO [47]. Важно подчеркнуть, что ARC проявлял высокую специфичность к нитриту в присутствии нитрата в концентрациях, достигающих 1 мM, то есть в тех условиях, когда NR не способна катализировать реакцию восстановления нитрита до NO. Учитывая его незаменимую роль в жизнедеятельности растительных организмов, был сделан вывод, что образование NO является главной функцией растительных ARC. В связи с этим ARC белки растений предложено назвать как NO-формирующие нитритредуктазы NOFNiR (NO Forming Nitrite Reductase), а двухкомпонентную NO-продуцирующую систему, образуемую NR в партнерстве с ARC, было предложено обозначать с использованием аббревиатуры NR:NOFNiR [22, 47, 48].
2.1.3. Участие других молибденосодержащих ферментов в реакциях восстановления нитрита с образованием NO
Потенциальной способностью восстанавливать нитрит до NO обладают молибдоэнзимы ксантиноксидоредуктаза (XOR), альдегидоксидаза (AO) и сульфитоксидаза (SO), что стало основанием для их объединения совместно с NR и mARC в группу нитрит-восстанавливающих NO-образующих ферментов “неспецифических нитритредуктаз” [41].
Ксантиноксидоредуктаза и альдегидоксидаза. Белковые молекулы XOR и AO обладают сходным доменным строением и на основании структурного сходства Moco-доменов эти ферменты объединены в семейство XO. Они являются гомодимерными флавиносодержащими белками с молекулярной массой около 290 кДа. В каждой мономерной единице содержится по два железо-серных центра [2Fe-2S], одному Moco и одному FAD-кофактору [44].
Фермент XOR широко распространен среди животных и растительных организмов и характеризуется преимущественно пероксисомной локализацией, хотя в тканях животных он также выявляется в цитоплазме и на внешней мембране некоторых клеток [2, 20, 41]. XOR может функционировать в виде ксантиндегидрогеназы (XDH) – основной формы фермента, или ксантиноксидазы (XO), которая образуется вследствие преобразования XDH, обусловленного обратимым окислением остатков цистеина в полипептидной цепи, например Cys535 или Cys992 у XOR коровьего молока, или необратимым окислением других аминокислотных остатков, например Lys551 или Lys569 в составе того же фермента [41]. Обе формы фермента в аэробных условиях катализируют окисление гипоксантина до ксантина с последующим образованием мочевой кислоты. При этом в сопряженной реакции XDH восстанавливает NADP до NADPH, тогда как в случае XO происходит восстановление молекулы кислорода с образованием супероксида, спонтанно дисмутирующим до перекиси водорода [2]. В разных независимых опытах с помощью методов электронно-парамагнитной спектроскопии, хемилюминесценции и с использованием NO-селективных электродов было показано, что в анаэробных условиях in vitro XOR, изолированная из тканей животных способна в присутствии НАДН осуществлять восстановление нитрита до NO [41, 70]. У растительных организмов вовлечение XOR в продукцию NO было продемонстрировано с помощью ингибитора активности XOR аллопуринола. Его использование для обработки растений белого люпина приводило к угнетению в корнях синтеза NO, указывая на высокую вероятность участия XOR в образовании оксида азота в растительных организмах [22, 71].
Альдегидоксидазы подобно XOR обнаруживаются как в животных, так и в растительных клетках и характеризуются цитоплазматической локализацией. Их специфические функции заключаются в катализировании реакций окисления различных ароматических и неароматических альдегидов с образованием соответствующих им карбоновых кислот [68, 72]. В геноме Arabidopsis thaliana идентифицировано четыре гена альдегидоксидаз: AO1-AO4, продукты экспрессионной активности которых образуют гомо- и гетеродимеры с различной субстратной специфичностью. В частности, гомодимер AO1 способен окислять индолил-3-ацетальдегид до индолил-3-уксусной кислоты, принадлежащей к семейству ауксинов. Другая альдегидоксидаза резуховидки Таля, функционирующая в виде AO2/AO3-гетеродимера, известная как AOδ проявляет высокую специфичность к абсцизовому альдегиду, являющегося предшественником гормона абсцизовой кислоты. Данные об участии растительных AO в биосинтезе фитогормонов могут указывать на их вовлечение в различные аспекты роста и развития растений, включая прорастание семян, вегетативный рост, а также в адаптацию к стрессовым факторам окружающей среды [72]. В экспериментах in vitro было показано, что изолированные из тканей животных АО способны катализировать реакцию нитритредукции до NO в присутствии нитрита и таких восстанавливающих субстратов, как альдегид N/-метилникотинамид и NADH [41]. Учитывая близкое структурное сходство AO и XOR можно предположить, что эти молибдоэнзимы могут играть роль дополнительного ферментативного источника NO в растительных организмах.
Сульфитоксидаза. Свой вклад в продукцию NO в растительных организмах может вносить фермент сульфитоксидаза, поскольку на примере млекопитающих была продемонстрирована ее нитритредуктазная NO-синтезирующая активность [41, 43, 73]. Основные функции SO заключаются в детоксификации сульфита в ходе его окисления до сульфата.
Реакция является финальным этапом окислительной деградации серосодержащих аминокислот цистеина и метионина. По структуре SO млекопитающих или птиц является гомодимером с молекулярной массой около 100 кДа, характеризующимся присутствием в каждой субъединице двух простетических групп: N-терминального гем-домена и C-терминального молибденового кофактора. В клетках животных фермент локализован в межмембранном пространстве митохондрий, где электроны, высвобождающиеся в ходе окисления сульфита, передаются через гем-домен на универсальный акцептор электронов цитохром с. Гем-домен SO может гидролизироваться в результате частичного протеолиза, что приводит к образованию модифицированной формы энзима, обладающей только одним редокс-центром – молибденовым доменом. Эта редуцированная форма SO уже не способна передавать электроны на цитохром с, но сохраняет способность к окислению сульфита, которое может осуществляться в присутствии искусственных акцепторов электронов [41]. Структура растительных SO была расшифрована после идентификации соответствующего фрагмента кДНК у A. thaliana и проведения сравнительного анализа последовательностей SO растений и животных [74]. При этом наиболее близкое сходство, составлявшее 46% гомологию на уровне аминокислотных последовательностей, было выявлено между SO растений и цыпленка. Кроме того, их Moco-содержащие домены характеризовались аналогичным с NR строением [74, 75]. Было установлено, что SO растений также имеет гомодимерную организацию и подобно модифицированному ферменту животных не содержит гем-домена, осуществляя передачу высвободившихся при окислении сульфита электронов на молекулярный кислород с образованием супероксида и его последующей дисмутацией до перекиси водорода. Поэтому не удивительно, что в растительных клетках SO локализована в пероксисомном матриксе, в котором протекают процессы утилизации перекиси [19, 44, 68].
Примечательно, что SO млекопитающих в присутствии сульфита способна катализировать одноэлектронное восстановление нитрита до NO [41, 73]. SO-катализируемая продукция NO протекает на молибденовом центре, при этом сульфит выступает в качестве восстановителя [41]. Скорость реакции зависит от значения pH среды и возрастает приблизительно вдвое при понижении pH от 7.4 до 6.5. Однако при тех же значениях pH нитрит-восстанавливающая активность SO существенно ниже, чем у XO и AO [41]. Кроме того, SO-катализируемая продукция NO зависит от присутствия кислорода в среде и усиливается по мере снижения его содержания [41, 73]. В условиях гипоксии ингибируется внутримолекулярный поток электронов от молибденового центра в составе SO и их поступление на цитохром с, вследствие чего происходит усиление передачи электронов на нитрит, что сопровождается активацией реакции нитритредукции с образованием NO [41]. Данные опытов о проявлении NO-синтезирующей активности SO млекопитающих позволяет предположить вовлечение этого молибдоэнзима в NO продукцию в растительных организмах, которое еще только предстоит подтвердить экспериментально [2, 22, 43].
2.1.4. Образование NO с участием электрон-транспортной цепи митохондрий
В ряде работ было показано, что реакции восстановления нитрита, протекающие с образованием NO, могут быть сопряжены с функционированием митохондриальной электрон-транспортной цепи (мЭТЦ) [2, 22, 76]. В условиях гипоксии митохондрии проявляют нитритредуктазную активность и становятся важным источником NO в клетках микроорганизмов, животных и растительных тканей. Имеются сведения, что в клетках некоторых грибов использование нитрита в качестве терминального акцептора электронов лежит в основе образования АТФ при отсутствии кислорода [2, 77, 78]. Более того, образование АТФ в условиях аноксии, опосредуемое восстановлением нитрита до NO, была выявлена в растительных тканях, в частности в корнях растений ячменя и риса [79]. С помощью ингибиторного анализа было установлено, что процесс нитритредукции с образованием NO в растительных митохондриях протекает с участием ферментов мЭТЦ комплексов III и IV. В частности использование миксотиазола и цианида (KCN), которые являются ингибиторами цитохром с редуктазы (комплекса III) и цитохром с оксидазы (комплекса IV), соответственно, приводило к угнетению нитрит-зависимой генерации АТФ и сопряженной с ней продукции NO в корнях растений ячменя и риса [2, 79]. Считается, что присутствие нитрита в митохондриях оказывает защитное действие на их структурную организацию при аноксии, а протекающий в них процесс нитритредукции до NO способствует поддержанию митохондриальной активности и в целом повышению жизнеспособности растительных организмов в неблагоприятных условиях [40].
ЗАКЛЮЧЕНИЕ
Таким образом, оксид азота в растительных организмах продуцируется в ходе множественных биохимических реакций, протекающих спонтанно или с участием разных ферментных систем, катализирующих окислительные или восстановительные пути биосинтеза NO. При этом ферменты, отвечающие за окислительное аргинин-зависимое образование NO в высших растениях пока не идентифицированы и являются объектом активного поиска исследователей. Наиболее хорошо изученными в высших растениях являются нитрит-зависимые или восстановительные механизмы образования NO, в которых особую роль играет ключевой фермент азотного обмена ассимиляторная нитратредуктаза. Она служит энзиматическим источником нитрита, выступающим в качестве основного субстрата при восстановительной продукции NO. В определенных условиях NR может сама катализировать реакцию нитритредукции с образованием NO. И, кроме того, в партнерстве с другим молибденосодержащим ферментом амидоксимредуктазой (mARC), нитратредуктаза участвует в образовании двухкомпонентной NO-продуцирующей системы NR:NOFNiR. Свой вклад в нитрит-зависимую продукцию NO могут вносить такие молибдоэнзимы, как XOR, AO и SO, в связи, с чем их, наряду с NR и mARC, было предложено объединить в класс неспецифических NO-образующих нитритредуктаз. Молекула NO является нестабильной и характеризуется коротким временем жизни, период полураспада которой исчисляется секундами. Вместе с тем учитывая чрезвычайно широкий спектр регуляторного действия NO, становится очевидной необходимость поддержания его выработки на базовом уровне, обеспечивающим нормальное протекание разных звеньев растительного метаболизма на всех этапах их жизненного цикла в норме и при стрессе, с чем связано существование такого множества путей биосинтеза NO в растениях. Вместе с тем актуальным является вопрос о функциональном взаимодействии разных механизмов образования NO, поскольку активация определенных путей продукции этой сигнальной молекулы, весьма вероятно, сопровождается угнетением интенсивности других механизмов, что может определяться внешними условиями и фазой развития растительного организма.
Работа выполнена в рамках государственного задания АААА-А21-121011990120-7 при поддержке грантов Российского фонда фундаментальных исследований № 20-04-00904.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Hancock J.T. Nitric oxide signaling in plants // Plants. 2020. V. 9. 1550. https://doi.org/10.3390/plants9111550
Gupta K.J., Fernie A.R., Kaiser W.M., van Dongen J.T. On the origins of nitric oxide // Trends Plant Sci. 2011. V. 16. P. 160.
Гильванова И. Р., Еникеев А.Р., Федяев В.В., Усманов И.Ю., Рахманкулова З.Ф. Влияние оксида азота на его эндогенное содержание, рост, активность дыхательных путей и антиоксидантный баланс растений пшеницы // Вестник БашГУ. 2014. Т. 19. № 1. С. 54.
Карпец Ю.В., Колупаев Ю.Е. Функциональное взаимодействие оксида азота с активными формами кислорода и ионами кальция при формировании адаптивных реакций растений // Вісник Харківського національного аграрного університету. Серія: Біологія. 2017. Вип. 2. С. 6. https://doi.org/10.35550/vbio2017.02.006
Глянько А.К., Ищенко А.А. Активные формы кислорода и азота – возможные медиаторы системной устойчивости у бобовых при действии ризобиальной инфекции // Вісник Харківського національного аграрного університету. Серія: Біологія. 2017. Вип. 1. С. 9. https://doi.org/10.35550/vbio2017.01.009
Kolbert Z., Barroso J.B., Brouquisse R., Corpas F.J., Gupta K.J., Lindermayr C., Loake G.J., Palma J.M., Petřivalský M., Wendehenne D., Hancock J.T. A forty year journey: The generation and roles of NO in plants // Nitric Oxide. 2019. V. 93. P. 53.
Corpas F., González-Gordo S., Palma J. Nitric oxide: A radical molecule with potential biotechnological applications in fruit ripening // J. Biotechnol. 2020. V. 324. P. 211.
Misra A.N., Misra M., Singh R. Nitric oxide ameliorates stress responses in plants // Plant Soil Environ. 2011. V. 57. P. 95.
Asgher M., Per T.S., Masood A., Fatma M., Freschi L., Corpas F.J., Khan N.A. Nitric oxide signaling and its crosstalk with other plant growth regulators in plant responses to abiotic stress // Environ. Sci. Pollut. Res. 2017. V. 24. P. 2273.
Delledonne M., Xia Y., Dixon R., Lamb C. Nitric oxide functions as a signal in plant disease resistance // Nature. 1998. V. 394. P. 585.
Durner J., Wendehenne D., Klessig D. Defense gene induction in tobacco by nitric oxide, cyclic GMP, and cyclic ADP-ribose // Proc. Natl. Acad. Sci. U.S.A. 1998. V. 95. P. 10328.
Del Castello F., Nejamkin A., Cassia R., Correa-Aragunde N., Fernández B., Foresi N., Lombardo C., Ramirez L., Lamattina L. The era of nitric oxide in plant biology: Twenty years tying up loose ends // Nitric Oxide. 2019. V. 85. P. 17.
Mamaeva A.S., Fomenkov A.A., Nosov A.V., Moshkov I.E., Novikova G.V., Mur L.A.J., Hall M.A. Regulatory role of nitric oxide in plants // Russ. J. Plant Physiol. 2015. V. 62. P. 427.
Lau S.E., Hamdan M.F., Pua T.L., Saidi N.B., Tan B.C. Plant nitric oxide signaling under drought stress // Plants. 2021. V. 10. 360. https://doi.org/10.3390/plants10020360
Karpets Y.V., Kolupaev Y.E., Lugovaya A.A., Shvidenko N.V., Yastreb T.O. Effects of nitrate and l-arginine on content of nitric oxide and activities of antioxidant enzymes in roots of wheat seedlings and their heat resistance // Russ. J. Plant Physiol. 2018. V. 65. P. 908.
Verma N., Tiwari S., Singh V.P., Prasad S.M. Nitric oxide in plants: an ancient molecule with new tasks // Plant Growth Regul. 2020. V. 90. P. 1.
Гончаров Н.П. Оксид азота (NO): физиология и метаболизм (лекция) // Андрология и генитальная хирургия. 2020. Т. 21. С. 75.
Begara-Morales J.C., Chaki M., Valderrama R., Sanchez-Calvo B., Mata-Perez C., Padilla M.N., Corpas F.J., Barroso J.B. Nitric oxide buffering and conditional nitric oxide release in stress response // J. Exp. Bot. 2018. V. 69. P. 3425.
Битюцкий Н.П. Микроэлементы высших растений. Санкт-Петербург: изд-во Санкт-Петербургского ун-та, 2020. 368 с.
Corpas F.J., González-Gordo S., Palma J.M. Nitric oxide (NO) scaffolds the peroxisomal protein–protein interaction network in higher plants // Int. J. Mol. Sci. 2021. V. 22. 2444. https://doi.org/10.3390/ijms22052444
Klepper L. Nitric oxide (NO) and nitrogen dioxide (NO2) emissions from herbicide-treated soybean plants // Atmos. Environ. 1979. V. 13. P. 537.
Astier J., Gross I., Durner J. Nitric oxide production in plants: an update // J. Exp. Bot. 2018. V. 69. P. 3401.
Corpas F.J., Del Río L.A., Palma J.M. Impact of nitric oxide (NO) on the ROS metabolism of peroxisomes // Plants. 2019. V. 8. 37. https://doi.org/10.3390/plants8020037
Фомина М.А., Абаленихина Ю.В. Окислительная модификация белков тканей при изменении синтеза оксида азота. Москва: ГЭОТАР-Медиа, 2018. 192 с.
Correa-Aragunde N., Foresi N., Lamattina L. Structure diversity of nitric oxide synthases (NOS): the emergence of new forms in photosynthetic organisms // Front. Plant Sci. 2013. V. 4. 232. https://doi.org/10.3389/fpls.2013.00232
Jeandroz S., Wipf D., Stuehr D.J., Lamattina L., Melkonian M., Tian Z., Zhu Y., Carpenter E.J., Wong G.K., Wendehenne D. Occurrence, structure, and evolution of nitric oxide synthase-like proteins in the plant kingdom // Sci. Signaling. 2016. V. 9. re2. https://doi.org/10.1126/scisignal.aad4403
Recalde L., Gómez Mansur N.M., Cabrera A.V., Matayoshi C.L., Gallego S.M., Groppa M.D., Benavides M.P. Unravelling ties in the nitrogen network: Polyamines and nitric oxide emerging as essential players in signalling roadway // Ann. Appl. Biol. 2021. V. 178. P. 192.
Prochazkova D., Haisel D., Pavlikova D. Nitric oxide biosynthesis in plants – the short overview // Plant Soil Environ. 2014. V. 60. P. 129.
Kolbert Z., Lindermayr C., Loake G.J. The role of nitric oxide in plant biology: current insights and future perspectives // J. Exp. Bot. 2021. V. 72. P. 777.
Flores T., Todd C.D., Tovar-Mendez A., Dhanoa P.K., Correa-Aragunde N., Hoyos M.E., Brownfield D.M., Mullen R.T., Lamattina L., Polacco J.C. Arginase-negative mutants of Arabidopsis exhibit increased nitric oxide signaling in root development // Plant Physiol. 2008. V. 147. P. 1936.
Tun N.N., Santa-Catarina C., Begum T., Silveira V., Handro W., Floh E.I., Scherer G.F. Polyamines induce rapid biosynthesis of nitric oxide (NO) in Arabidopsis thaliana seedlings // Plant Cell Physiol. 2006. V. 47. P. 346.
Wimalasekera R., Villar C., Begum T., Scherer G.F. COPPER AMINE OXIDASE1 (CuAO1) of Arabidopsis thaliana contributes to abscisic acid-and polyamine-induced nitric oxide biosynthesis and abscisic acid signal transduction // Mol. Plant. 2011. V. 4. P. 663.
Rümer S., Gupta K.J., Kaiser W.M. Plant cells oxidize hydroxylamines to NO // J. Exp. Bot. 2009. V. 60. P. 2065.
Rümer S., Gupta K.J., Kaiser W.M. Oxidation of hydroxylamines to NO by plant cells // Plant Signal. Behav. 2009. V. 4. P. 853.
Caranto J.D., Lancaster K.M. Nitric oxide is an obligate bacterial nitrification intermediate produced by hydroxylamine oxidoreductase // Proc. Natl. Acad. Sci. U.S.A. 2017. V. 114. P. 8217.
Hooper A.B., Terry K.R. Hydroxylamine oxidoreductase of Nitrosomonas: production of nitric oxide from hydroxylamine // Biochim. Biophys. Acta, Enzymol. 1979. V. 571. P. 12.
DeMaster E.G., Raij L., Archer S.L., Weir E.K. Hydroxylamine is a vasorelaxant and a possible intermediate in the oxidative conversion of L-arginine to nitric oxide // Biochem. Biophys. Res. Commun. 1989. V. 163. P. 527.
Yamasaki H. Nitrite-dependent nitric oxide production pathway: implications for involvement of active nitrogen species in photoinhibition in vivo // Philos. Trans. R. Soc., Ser. B: Biol. Sci. 2000. V. 355. P. 1477.
Bethke P.C., Badger M.R., Jones R.L. Apoplastic synthesis of nitric oxide by plant tissues // Plant Cell. 2004. V. 16. P. 332.
Gupta K.J., Kumari A., Florez-Sarasa I., Fernie A.R., Igamberdie-v A.U. Interaction of nitric oxide with the components of the plant mitochondrial electron transport chain // J. Exp. Bot. 2018. V. 69. P. 3413.
Maia L.B., Moura J.J.G. Nitrite reduction by molybdoenzymes: a new class of nitric oxide-forming nitrite reductases // J. Biol. Inorg. Chem. 2015. V. 20. P. 403.
Bender D., Schwarz G. Nitrite-dependent nitric oxide synthesis by molybdenum enzymes // FEBS Lett. 2018. V. 592. P. 2126.
Chamizo-Ampudia A., Sanz-Luque E., Llamas A., Galvan A., Fernandez E. Nitrate reductase regulates plant nitric oxide homeostasis // Trends Plant Sci. 2017. V. 22. P. 163.
Wang J., Keceli G., Cao R., Su J., Mi Z. Molybdenum-containing nitrite reductases: Spectroscopic characterization and redox mechanism // Redox Rep. 2017. V. 22. P. 17.
Schwarz G., Mendel R.R., Ribbe M.W. Molybdenum cofactors, enzymes and pathways // Nature. 2009. V. 460. P. 839.
Mohn M.A., Thaqi B., Fischer-Schrader K. Isoform-specific NO synthesis by Arabidopsis thaliana nitrate reductase // Plants. 2019. V. 8. 67. https://doi.org/10.3390/plants8030067
Chamizo-Ampudia A., Sanz-Luque E., Llamas Á., Ocaña-Calahorro F., Mariscal V., Carreras A., Barroso J.B., Galván A., Fernández E. A dual system formed by the ARC and NR molybdoenzymes mediates nitrite-dependent NO production in Chlamydomonas // Plant Cell Environ. 2016. V. 39. P. 2097.
Tejada-Jimenez M., Llamas A., Galván A., Fernández E. Role of nitrate reductase in NO production in photosynthetic eukaryotes // Plants. 2019. V. 8. 56. https://doi.org/10.3390/plants8030056
Campbell W.H. Nitrate reductase structure, function and regulation: bridging the gap between biochemistry and physiology // Annu. Rev. Plant Biol. 1999. V. 50. P. 277.
Pradedova E.V., Nimaeva O.D., Salyaev R.K. Redox processes in biological systems // Russ. J. Plant Physiol. 2017. V. 64. P. 822.
Dean J.V., Harper J.E. The conversion of nitrite to nitrogen oxide(s) by the constitutive NAD(P)H-nitrate reductase enzyme from soybean // Plant Physiol. 1988. V. 88. P. 389.
Rosales E.P., Iannone M.F., Groppa M.D., Benavides M.P. Nitric oxide inhibits nitrate reductase activity in wheat leaves // Plant Physiol. Biochem. 2011. V. 49. P. 124.
Chen Z.H., Wang Y., Wang J.W., Babla M., Zhao C., García-Mata C., Sani E., Differ C., Mak M., Hills A., Amtmann A., Blatt M.R. Nitrate reductase mutation alters potassium nutrition as well as nitric oxide-mediated control of guard cell ion channels in Arabidopsis // New Phytol. 2016. V. 209. P. 1456.
Hao F., Zhao S., Dong H., Zhang H., Sun L., Miao C. Nia1 and Nia2 are involved in exogenous salicylic acid-induced nitric oxide generation and stomatal closure in Arabidopsis // J. Integr. Plant Biol. 2010. V. 52. P. 298.
Zhao C., Cai S., Wang Y., Chen Z. Loss of nitrate reductases NIA1 and NIA2 impairs stomatal closure by altering genes of core ABA signaling components in Arabidopsis // Plant Signal. Behav. 2016. V. 11. e1183088. https://doi.org/10.1080/15592324.2016.1183088
Jin C.W., Du S.T., Zhang Y.S., Lin X.Y., Tang C.X. Differential regulatory role of nitric oxide in mediating nitrate reductase activity in roots of tomato (Solanum lycocarpum) // Ann. Bot. 2009. V. 104. P. 9.
Manoli A., Begheldo M., Genre A., Lanfranco L., Trevisan S., Quaggiotti S. NO homeostasis is a key regulator of early nitrate perception and root elongation in maize // J. Exp. Bot. 2014. V. 65. P. 185.
Lea U.S., Ten Hoopen F., Provan F., Kaiser W.M., Meyer C., Lillo C. Mutation of the regulatory phosphorylation site of tobacco nitrate reductase results in high nitrite excretion and NO emission from leaf and root tissue // Planta. 2004. V. 219. P. 59.
Lombardo M.C., Lamattina L. Nitric oxide is essential for vesicle formation and trafficking in Arabidopsis root hair growth // J. Exp. Bot. 2012. V. 63. P. 4875.
Seligman K., Saviani E.E., Oliveira H.C., Pinto-Maglio C.A.F., Salgado I. Floral transition and nitric oxide emission during flower development in Arabidopsis thaliana is affected in nitrate reductase-deficient plants // Plant Cell Physiol. 2008. V. 49. P. 1112.
García-Mata C., Lamattina L. Nitric oxide and abscisic acid cross talk in guard cells // Plant Physiol. 2002. V. 128. P. 790.
Freschi L. Nitric oxide and phytohormone interactions: current status and perspectives // Front. Plant Sci. 2013. V. 4. 398. https://doi.org/10.3389/fpls.2013.00398
Hu Y., You J., Liang X. Nitrate reductase-mediated nitric oxide production is involved in copper tolerance in shoots of hulless barley // Plant Cell Rep. 2015. V. 34. P. 367.
Fu Y.F., Zhang Z.W., Yuan S. Putative connections between nitrate reductase S-nitrosylation and NO synthesis under pathogen attacks and abiotic stresses // Front. Plant Sci. 2018. V. 9. 474. https://doi.org/10.3389/fpls.2018.00474
Zhao G., Zhao Y., Lou W., Su J., Wei S., Yang X., Wang R., Guan R., Pu H., Shen W. Nitrate reductase-dependent nitric oxide is crucial for multi-walled carbon nanotube-induced plant tolerance against salinity // Nanoscale. 2019. V. 11. P. 10511.
Sparacino-Watkins C.E., Tejero J., Sun B., Gauthier M.C., Thomas J., Ragireddy V., Merchant B.A., Wang J., Azarov I., Basu P., Gladwin M.T. Nitrite reductase and nitric-oxide synthase activity of the mitochondrial molybdopterin enzymes mARC1 and mARC2 // J. Biol. Chem. 2014. V. 289. P. 10345.
Bender D., Schwarz G. Nitrite-dependent nitric oxide synthesis by molybdenum enzymes // FEBS Lett. 2018. V. 592. P. 2126.
Rana M.S., Bhantana P., Sun X.-C., Imran M., Shaaban M., Moussa M.G, Saleem M.H., Elyamine A.M., Binyamin R., Alam M., et al. Molybdenum as an essential element for crops: an overview // Biomed. J. Sci. Tech. Res. 2020. V. 24. P. 18535.
Tejada-Jiménez M., Chamizo-Ampudia A., Galván A., Fernández E., Llamas Á. Molybdenum metabolism in plants // Metallomics. 2013. V. 5. P. 1191.
Godber B.L., Doel J.J., Sapkota G.P., Blake D.R., Stevens C.R., Eisenthal R., Harrison R. Reduction of nitrite to nitric oxide catalyzed by xanthine oxidoreductase // J. Biol. Chem. 2000. V. 275. P. 7757.
Wang B.L., Tang X.Y., Cheng L.Y., Zhang A.Z., Zhang W.H., Zhang F.S., Liu J.Q., Cao Y., Allan D.L., Vance C.P., Shen J.B. Nitric oxide is involved in phosphorus deficiency-induced cluster-root development and citrate exudation in white lupin // New Phytol. 2010. V. 187. P. 1112.
Кравченко А.П., Токсобаева Г.А., Каусбекова А., Берсимбаев Р.И. Влияние TOR комплекса 1 на активность и экспрессию генов альдегидоксидазы у Arabidopsis thaliana // Известия НАН РК. Серия биол. медиц. 2017. № 5. С. 57.
Wang J., Krizowski S., Fischer-Schrader K., Niks D., Tejero J., Sparacino-Watkins C., Wang L., Ragireddy V., Frizzell S., Kelley E.E., et al. Sulfite oxidase catalyzes single-electron transfer at molybdenum domain to reduce nitrite to nitric oxide // Antioxid. Redox Signal. 2015. V. 23. P. 283.
Eilers T., Schwarz G., Brinkmann H., Witt C., Richter T., Nieder J., Koch B., Hille R., Hänsch R., Mendel R.R. Identification and biochemical characterization of Arabidopsis thaliana sulfite oxidase. A new player in plant sulfur metabolism // J. Biol. Chem. 2001. V. 276. P. 46989.
Schrader N., Fischer K., Theis K., Mendel R.R., Schwarz G., Kisker C. The crystal structure of plant sulfite oxidase provides insights into sulfite oxidation in plants and animals // Structure. 2003. V. 11. P. 1251.
Igamberdiev A.U., Ratcliffe R.G., Gupta K.J. Plant mitochondria: source and target for nitric oxide // Mitochondrion. 2014. V. 19. P. 329.
Tielens A.G., Rotte C., van Hellemond J.J., Martin W. Mitochondria as we don’t know them // Trends Biochem. Sci. 2002. V. 27. P. 564.
Gupta K.J., Igamberdiev A.U. The anoxic plant mitochondrion as a nitrite: NO reductase // Mitochondrion. 2011. V. 11. P. 537.
Stoimenova M., Igamberdiev A.U., Gupta K.J., Hill R.D. Nitrite-driven anaerobic ATP synthesis in barley and rice root mitochondria // Planta. 2007. V. 226. P. 465.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений