Физиология растений, 2022, T. 69, № 4, стр. 352-362
Влияние содержания каротиноидов и активности гена каротиноид-цис-транс-изомеразы CRTISO на окраску плода томата
Г. И. Ефремов a, *, Е. А. Джос a, b, А. А. Ашихмин c, Е. З. Кочиева a, А. В. Щенникова a
a Институт биоинженерии Федерального исследовательского центра
“Фундаментальные основы биотехнологии” Российской академии наук
Москва, Россия
b Федеральный научный центр овощеводства
поселок ВНИИССОК, Россия
c Институт фундаментальных проблем биологии Российской академии наук –
обособленное подразделение ФИЦ ПНЦБИ РАН
Пущино, Россия
* E-mail: gleb_efremov@mail.ru
Поступила в редакцию 27.12.2021
После доработки 27.01.2022
Принята к публикации 27.01.2022
- EDN: PXWLXA
- DOI: 10.31857/S0015330322040042
Аннотация
Томат Solanum lycopersicum L. является удобной моделью для изучения метаболизма каротиноидов, благодаря большому разнообразию каротиноид-опосредованной окраски спелого плода. Каротиноид-цис-транс-изомераза CRTISO катализирует реакцию цис-транс-изомеризации двойных связей, приводящую к образованию полностью-транс-ликопина – сильнейшего антиоксиданта среди каротиноидов и субстрата для последующего синтеза α-, β-каротинов и ксантофиллов. В работе было проанализировано 18 образцов сортов и линий томата, различающихся окраской спелого плода. Полученные биохимические данные продемонстрировали зависимость окраски плода от содержания и состава каротиноидов и наличия/отсутствия хлорофиллов. Проведенный in silico анализ экспрессии трех генов-гомологов CRTISO показал, что наибольший уровень экспрессии в плоде характерен только для гена CRTISO, который максимально транскрибируется на стадиях смены окраски (с зеленой на красную) и биологической спелости плода. Методом ПЦР-РВ показано отсутствие четкой корреляции между уровнем экспрессии гена CRTISO и суммой каротиноидов, что может объясняться различным количеством метаболитов, предшествующих проликопину.
ВВЕДЕНИЕ
Большой класс вторичных метаболитов – каротиноиды, синтезируются растениями, бактериями и грибами, в то время как животные (включая человека) получают их только с пищей [1]. Каротиноиды являются важными компонентами защиты фотосинтетического аппарата растений от фотоокислительного повреждения, вызванного чрезмерным освещением. Помимо этого, окислительное расщепление каротиноидов может производить сигнальные соединения, такие как β-циклоцитраль, для регулирования экспрессии ядерных генов в ответ на фотоокислительный стресс, тогда как их ферментативное расщепление приводит к образованию гормонов (абсцизовой кислоты и стриголактонов) [2]. В центре молекулы каротиноида находится хромофор – система сопряженных двойных связей, каждая из которых может существовать в цис- или транс-конфигурации, определяя длину волны и интенсивность поглощаемого света [3].
У плодовых и овощных культур каротиноиды выполняют также функцию пигментов, накапливаясь в хромопластах и обеспечивая красную, оранжевую и желтую окраску цветков и плодов [2, 4]. Одним из основных источников каротиноидов среди овощных культур является томат Solanum lycopersicum L., плоды которого имеют в большинстве красную окраску за счет накопления полностью-транс-ликопина. Данное соединение синтезируется из предшественника всех каротиноидов (бесцветного 15-цис-фитоина) в несколько этапов, включая две десатурации и две цис-транс-изомеризации [3]. Изомеризация каротиноидов во время десатурации является существенным различием между биосинтезом каротиноидов у растений и бактерий; у бактерий молекулы от фитоина до ликопина являются полностью-транс-изомерами. Данные реакции осуществляются двумя десатуразами (фитоин-десатураза PDS и ζ-каротин-десатураза ZDS) и двумя изомеразами (ζ-каротин-изомераза Z-ISO и каротиноид-цис-транс-изомераза CRTISO) (рис. 1а) [3]. Ортологи изомераз присутствуют только у цианобактерий и растений, тогда как у пурпурных фотосинтезирующих бактерий и нефотосинтезирующих организмов функции десатурации и изомеризации объединены в одном ферменте типа каротин-десатуразы CRTI [3]. CRTISO считается эволюционным производным CRTI и катализирует реакцию цис-транс-изомеризации двойных связей, приводящую к образованию полностью-транс-ликопина – субстрата для последующей циклизации с образованием полностью-транс-α-β-каротинов под действием соответствующих ликопин-циклаз [5].
Рис. 1.
Схема биосинтеза каротиноидов в плодах томата (а) и фотографии спелого плода образцов томата, анализируемых в данной работе: Л-Несозревающий (б); Л-Черри лимонно-желтые (в); сорт Викинг (г); Л-Золотой лотос (д); сорт Грот (е); сорт Благодатный (ж); сорт Лотос (з); сорт Подарок к юбилею (и); сорт Малиновый силач (к); сорт Гаяна (л); сорт Гармошка (м); сорт Русский размер (н); сорт Дубок (о); Л-411 (п); Л-Черри розовые (р); Л-Черри арбуз (с); Л-176 (т); Л-Черри коричнево-фиолетовые (у). GGPP – geranylgeranylpyrophosphate (геранилгеранил пирофосфат); PSY1 – фитоин-синтаза 1; PDS – фитоин-десатураза; Z-ISO – ζ-каротин-изомераза; ZDS – ζ-каротин-десатураза; CRTISO – каротиноид-цис-транс-изомераза.

Ген изомеразы CRTISO был впервые клонирован у Arabidopsis thaliana в результате анализа мутации ccr2, которая приводила к накоплению ациклических изомеров каротина в этиопласте и снижению лютеина в хлоропласте листа [6]. Одновременно, ген CRTISO был обнаружен у томата S. lycopersicum при анализе мутанта tangerine, плоды и цветки которого имели оранжевую окраску в отличие от красной (плод) и желтой (цветок) у томата дикого типа [7]. Различия в окраске плода объяснялись разным составом накапливаемых каротиноидов: проликопина – у мутанта tangerine, и полностью-транс-ликопина – у томата дикого типа [7]. Ген, определяющий фенотип tangerine, назван CRTISO, расположен на хромосоме 10 и является одним из трех генов в геноме томата (два других гена – CRTISO-L1 и CRTISO-L2), кодирующих каротиноид-изомеразы – ферменты окислительно-восстановительного типа, структурно сходные с фитоин-десатуразой CRTI бактерий [8]. Исследованы два мутантных аллеля tangerine, потеря функции, которых связана с делецией 282 п.н. (24 п.н. в экзоне I и 258 п.н. в интроне I) в последовательности гена CRTISO (1) и нарушением экспрессии гена за счет делеции 348 п.н. в промоторе (2). В случае экзон-интронной делеции удаляется сайт сплайсинга, и образующаяся последовательность мРНК содержит ранний стоп-кодон, который прерывает синтез функционального белка CRTISO [7].
Показано, что в растениях томата дикого типа ген CRTISO экспрессируется во всех тканях, и его экспрессия значительно возрастает в процессе созревания плодов (максимум в спелом плоде) и в цветках [7]. Интересно, что в зеленых тканях строгих требований к наличию активности CRTISO нет. Так, развивающиеся листья мутанта tangerine склонны к обесцвечиванию, однако зрелые листья фенотипически не затронуты и на свету накапливают практически те же каротиноиды, что и томат дикого типа, тогда как в темноте дальше проликопина биосинтез каротиноидов не идет [7]. Это позволило предположить, что активность CRTISO необходима для цис-транс-изомеризации в условиях отсутствия освещения, а на свету успешно заменяется фотоизомеризацией [5, 7]. Также было показано, что CRTISO томата изомеризует соседние цис-двойные связи в C7 и C9 попарно в транс-конфигурацию, но не способен изомеризовать одинарные цис-двойные связи в C9 и C9' [9].
В дальнейшем каротиноид-изомераза CRTISO была изучена у других видов, как правило, сельскохозяйственных растений. Так, на примере мутантных растений Oryza sativa была показана роль CRTISO в поддержании фотосинтетического выделения кислорода у растений [10]. Для Brassica rapa на основе полиморфизмов последовательности гомологов CRTISO (Bra031539; BrCRTISO1) были разработаны молекулярные маркеры, ассоциированные с оранжевой окраской кочна [11, 12]. Было продемонстрировано, что связанные с окраской кочна китайской капусты концентрации хлорофилла и каротиноидов можно изменить с помощью целевого CRISPR/Cas9-редактирования гена каротиноид-изомеразы BoaCRTISO [13]. Были идентифицированы и функционально охарактеризованы 4 гомологичных CRTISO гена у апельсина Citrus sinensis, и показано восстановление биосинтеза каротиноидов в растениях мутанта томата tangerine при сверхэкспрессии гена CsCRTISO [14]. Данные по гену CRTISO были использованы для прояснения истории доместикации моркови [15]. Кроме прочего, было показано участие CRTISO в реакции на стрессы, например, у растений моркови в ответ на заражение корней облигатным паразитом Phelipanche aegyptiaca [16]. Сверхэкспрессия CRTISO значительно повышает солеустойчивость и уровень накопления каротиноидов в трансгенных растениях табака [17].
Цель настоящей работы – поиск возможной корреляции профиля экспрессии гена CRTISO в спелых плодах образцов сортов томата S. lycopersicum, различающихся окраской, с содержанием и составом каротиноидов.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали образцы десяти сортов и восьми селекционных линий томата овощного (S. lycopersicum), различающихся окраской спелого плода (рис. 1б-у, табл. S1 ). Растения выращивали до плодоношения в 2021 г. в условиях пленочной теплицы ФГБНУ “Федеральный научный центр овощеводства” (ФНЦО, Московская обл., РФ) и далее содержали в условиях экспериментальной установки искусственного климата (ЭУИК, ФИЦ Биотехнологии РАН).
В сентябре 2021 г. спелые плоды (финальная стадия созревания; Red Ripe, RR) каждого сорта (по одному плоду от двух растений), собирали, растирали (кожица и мякоть вместе) в жидком азоте и использовали для экспрессионного и биохимического исследования.
Для анализа генной экспрессии, из 50‒100 мг ткани спелого плода выделяли суммарную РНК (RNeasy Plant Mini Kit (Qiagen, Германия), которую очищали от примесей ДНК (RNase free DNasy set; Qiagen, Германия) и использовали для синтеза кДНК (GoScriptтм Reverse Transcription System; Promega, США) по прилагаемым производителями протоколам. Концентрацию РНК и кДНК определяли на флуориметре Qubit 4 (Thermo Fisher Scientific, США) с помощью соответствующих реактивов (Qubit RNA HS Assay Kit и Qubit DS DNA HS Assay Kit, Invitrogen, США). Качество РНК оценивали методом электрофореза в 1.5% агарозном геле.
Ген-специфичные праймеры (forward 5'-ATGAAGCGAAGAAAGAGGTTGT-3'; reverse 5'-GCAAGGTATCGTCTGTGGGTCT-3') для анализа экспрессии разработаны на основе последовательности CRTISO томата, доступной в GenBank NCBI (хромосома 10, Solyc10g081650, https://www.solgenomics.net/; Gene ID: 101267857; https://www.ncbi. nlm.nih.gov/) [18]. Согласно результатам сравнительного анализа данные праймеры не отжигаются на последовательностях двух других, гомологичных CRTISO, генов – CRTISO-L1 (хромосома 5, Solyc05g010180.2; Gene ID: 101247017) и CRTISO-L2 (хромосома 2, Gene ID: 101259799; или хромосома 7, Solyc07g021640). Синтез праймеров осуществляли в ЗАО Евроген (Москва, Россия). Количественную ПЦР в реальном времени (ПЦР-РВ; RT-qPCR) проводили на термоциклере CFX96 Real-Time PCR Detection System (“Bio-Rad Laboratories”, США) в двух биологических и трех технических повторах (“Реакционная смесь для проведения ПЦР-РВ в присутствии SYBR Green I и ROX”, ЗАО “Синтол”, Москва, Россия). Для реакции использовали 100 нг кДНК-матрицы и следующие условия: 95°C – 5 мин.; 40 циклов (95°C – 15 с, 60°C – 40 с). Для нормализации экспрессии использовали референсные гены томата Expressed и ACTIN2 [19]. Полученные результаты статистически обрабатывали (Graph Pad Prism v. 8; GraphPad Software Inc., San Diego, CA, USA; https:// www.graphpad.com/scientific-software/prism/). Данные выражали как среднее значение ± стандартное отклонение (SE) на основе двух биологических и трех технических повторов для каждого варианта кДНК. Для оценки различий в экспрессии генов применяли T-критерий Велча (unequal variance (Welch’s) t-test) (P < 0.05 указывает на статистическую значимость различия). Линейные регрессии экспрессии гена CRTISO и содержания каротиноидов, а также множественные коэффициенты корреляции (R2) рассчитывали в программе GraphPad Prism v. 8.
Анализ экспрессии генов-гомологов CRTISO проводили in silico, используя данные TomExpress (http://tomexpress.toulouse.inra.fr/).
Биохимический анализ содержания (мг/г сырого веса) хлорофиллов (а и б), ликопина, β-каротина и общего количества каротиноидов (x + c; каротины + ксантофиллы, а также проликопин и ликопин) в спелом плоде всех анализируемых образцов томата проводили с использованием модифицированного протокола метода Фолча [19, 20] в двух биологических и трех технических повторах. Спектры поглощения регистрировали на спектрофотометрах Eppendorf BioSpectrometer® basic (Eppendorf, Германия) и Cary 50 (“Agilent Technology”, США).
Дополнительный детальный анализ содержания каротиноидов в спелом плоде образцов томата проводили c помощью ВЭЖХ (высокоэффективная жидкостная хроматография) системы Shimadzu (Shimadzu, Киото, Япония) при 22°C, как было описано ранее [21, 22]. Установка для ВЭЖХ состояла из насоса LC-10ADVP с модулем FCV-10ALVP, детектора с диодной матрицей SPD-M20A и термостата CTO-20AC. Разделение проводили на колонке с обращенной фазой Agilent Zorbax SB-C18 (5 мкм 4.6 × 250 мм) (Agilent, Санта Клара, США). Скорость подачи растворителей была 1 мл/мин. Каротиноиды идентифицировали по их времени удержания и спектрам поглощения. Количественное определение каждого каротиноида выполняли путем сравнения площади его пика в области 270‒800 нм с суммой всех пиков каротиноидов, взятых за 100%, и рассчитывали с помощью программы LC-solution (“Shimadzu”, Kyoto, Japan) с использованием молярных коэффициентов экстинкции [23]. В данных четырех образцах томата дополнительно промеряли концентрацию суммы каротиноидов (x + c) в 100% петролейном эфире, согласно [24]. Концентрацию каждого каротиноида (мкг/г сырого веса) рассчитывали, сопоставляя данные по сумме каротиноидов и процентному (моль %) соотношению отдельных типов каротиноидов.
РЕЗУЛЬТАТЫ
Окраска спелого плода томата определяется содержанием и составом каротиноидов
Образцы сортов и селекционных линий томата были выбраны, руководствуясь различиями в окраске спелого плода (рис. 1б-у). Так, спелые плоды у линии Л-Несозревающий характеризовались бледно-зеленой окраской. У сорта Викинг и двух линий (Л-Черри лимонно-желтые и Л-Золотой лотос) – оттенками желтого и оранжевого. У девяти сортов (Грот, Благодатный, Лотос, Подарок к юбилею, Малиновый силач, Гаяна, Гармошка, Русский размер и Дубок) и двух линий (Л-Черри розовые и Л-411) – от розового и малинового до красного. У трех линий (Л-Черри арбуз, Л-Черри коричнево-фиолетовые и Л-176) – красно-коричневой с фиолетовым оттенком или вкраплениями.
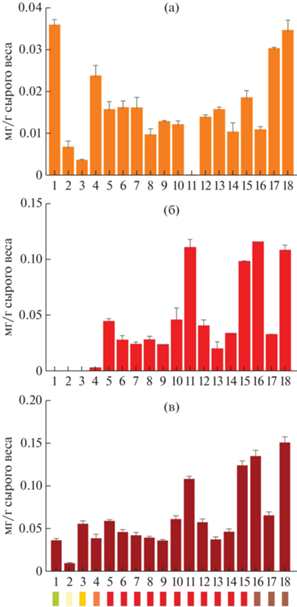
Для оценки зависимости окраски плода томата от содержания каротиноидов был проведен анализ содержания ликопина, β-каротина, суммы каротиноидов (x + c) и хлорофиллов (а + б) в спелых плодах (вместе кожица и мякоть) всех 18 образцов (табл. S1 ). Согласно полученным данным, наибольшее количество суммы каротиноидов (0.1518 мг/г сырого веса) детектировалось у линии Л-Черри коричнево-фиолетовые, наименьшее (0.0102 мг/г сырого веса) – у желтоплодной линии Л-Черри лимонно-желтые (табл. S1 , рис. 2в). При этом содержание ликопина или β‑каротина строго не коррелировало с окраской плода. Плоды с бледно-зеленой и желто-оранжевой окраской характеризовались следовыми количествами ликопина (Л-Золотой лотос) или совсем не содержали его, тогда как плоды красной и коричнево-фиолетовой окраски характеризовались относительно высоким содержанием ликопина – от 0.0196 мг/г сырого веса (сорт Дубок) до 0.1153 мг/г сырого веса (Л-Черри арбуз) (табл. S1 , рис. 2б). Концентрация β-каротина имела следовые значения у трех сортов (Викинг, Гармошка и Подарок к юбилею) и трех линий (Л-411, Л-Черри лимонно-желтые и Л-Черри арбуз). Наибольшее содержание β-каротина было обнаружено в спелых плодах линий Л-Несозревающий (0.0358 мг/г сырого веса), Л-Черри коричнево-фиолетовые (0.0345 мг/г сырого веса) и Л-Золотой лотос (0.0237 мг/г сырого веса); остальные образцы характеризовались сходным количеством β-каротина (0.0121–0.0185 мг/г сырого веса) (табл. S1 , рис. 2а).
Рис. 2.
Содержание β-каротина (а), ликопина (б) и суммы каротиноидов (в) в спелых плодах анализируемых образцов томата: Л-Несозревающий (1), Л-Черри лимонно-желтые (2), сорт Викинг (3), Л-Золотой лотос (4), сорт Грот (5), сорт Благодатный (6), сорт Лотос (7), сорт Подарок к юбилею (8), сорт Малиновый силач (9), сорт Гаяна (10), сорт Гармошка (11), сорт Русский размер (12), сорт Дубок (13), Л-411 (14), Л-Черри розовые (15), Л-Черри арбуз (16), Л-176 (17), Л-Черри коричнево-фиолетовые (18). Цветными прямоугольниками условно обозначена окраска спелого плода. Значения концентрации (мг/г сырого веса) представлены в виде среднего арифметического ± ± стандартная ошибка среднего двух биологических и трех технических повторов.
Хлорофиллы (а + б) были обнаружены только в плодах линии Л-Несозревающий в количествах, сопоставимых с концентрацией β-каротина (табл. 1).
Таблица 1.
Состав каротиноидов в спелых плодах у использованных в работе образцов томата
| RT (время выхода), мин | Тип каротиноида | Викинг | Л-Несозревающий | Малиновый силач | Л-176 |
|---|---|---|---|---|---|
| Концентрация, мкг/г сырого веса | |||||
| Сумма каротиноидов* | 3.8 | 33.1 | 36.3 | 68.4 | |
| Хлорофиллы (а + б) |
0.0 | 35.4 (15.4 + 19.9) |
0.0 | 0.0 | |
| Концентрация, моль % (мкг/г сырого веса) | |||||
| 30.12 | Полностью-транс-ликопин | 0.0 | 0.0 | 40.3 (21.0366) | 36.5 (32.339) |
| 34.4 | β-каротин | 63.4 (2.4789) | 100.0 (33.1) | 25.1 (13.1022) | 33.0 (29.238) |
| 24.5 | Проликопин | 0.0 | 0.0 | 0.0 | 0.0 |
| 7.69 | Лютеин эпоксид | 15.0 (0.5865) | 0.0 | 0.0 | 0.0 |
| 8.16 | (all-E)-Лютеин | 18.7 (0.7312) | 0.0 | 2.1 (1.0962) | 7.0 (6.202) |
| 30.85 | β-криптоксантин | 2.9 (0.1134) | 0.0 | 0.1 (0.0522) | 0.2 (0.1772) |
| 33.61 | γ-каротин | 0.0 | 0.7 (0.3654) | 0.0 | |
| 33.53 | ζ-каротин | 0.0 | 0.0 | 0.2 (0.1044) | 0.2 (0.1772) |
| 34.18 | α-каротин | 0.0 | 0.0 | 0.1 (0.0522) | 0.3 (0.2658) |
| 34.7 | Фитофлуин | 0.0 | 0.0 | 3.2 (1.6704) | 2.6 (2.3036) |
| 35.5 | Фитоин | 0.0 | 0.0 | 28.2 (14.7204) | 20.2 (17.8972) |
Примечание: * измерено согласно [23]. В таблице указаны только типы каротиноидов, найденные в анализируемых образцах; группы производных α-, β-, ζ- и γ-каротинов объединены каждая под одним названием.
Для уточнения возможных корреляций между окраской спелого плода и составом каротиноидов, а также степени преобразования предшественников в полностью-транс-ликопин и последующие каротиноиды, был проведен дополнительный анализ. Спектр каротиноидов был детализирован методом ВЭЖХ у четырех образцов томата, контрастных по окраске спелого плода: зеленоплодной линии Л-Несозревающий, желтоплодного сорта Викинг, красноплодного сорта Малиновый силач и коричнево-красноплодной линии Л-176. Проликопин отсутствовал у всех образцов. У обоих красноплодных образцов были обнаружены бесцветные предшественники каротиноидов (фитоин и фитофлуин; 0.0164–0.0202 мг/г сырого веса, ~23–31% от общего содержания каротиноидов) и производные ζ-каротина (следовые количества) (табл. 1). В желто-оранжевых плодах сорта Викинг в состав каротиноидов входили значительные количества производных лютеина. За исключением Л-Несозревающий, плоды анализируемых образцов содержали β-криптоксантин и (all-E)-лютеин (табл. 1). Красный пигмент ликопин отсутствовал в плодах сорта Викинг и Л-Несозревающий и был преобладающим каротиноидом в плодах сорта Малиновый силач (40%) и линии Л-176 (37%). Оранжевый β-каротин преобладал в плодах линии Л-Несозревающий (100%) и сорта Викинг (63%), однако и у красноплодных образцов составлял 25% (сорт Малиновый силач) и 33% (Л-176).
Экспрессия CRTISO не коррелирует с суммой каротиноидов в спелом плоде томата
Как упоминалось, в геноме томата известны три гена, кодирующие каротеноид-изомеразы (CRTISO, CRTISO-L1 и CRTISO-L2). Для того чтобы определить, какой из них активен в плоде томата, был проведен предварительный in silico анализ (TomExpress) экспрессии этих генов (рис. 3). В результате было обнаружено, что ген CRTISO экспрессируется во всех анализируемых тканях и органах растения с максимумом в плоде, а также в листе и цветке. При этом в плоде наибольший уровень транскрипции CRTISO наблюдается на стадии смены окраски с зеленой на красную (breaker, BR) и при биологической спелости (red ripe, RR) (рис. 3). Транскрипция другого гена CRTISO-L1 наиболее активна в цветке томата, причем экспрессия значительно ниже, чем у гена CRTISO, а в плоде близка к нулевому значению. мРНК третьего гена CRTISO-L2 в анализируемых тканях томата не обнаружена (рис. 3). С учетом полученных данных в дальнейшем анализе был использован ген CRTISO.
Рис. 3.
Относительный уровень транскрипции генов CRTISO (Solyc10g081650), CRTISO-L1 (Solyc05g010180.2) и CRTISO-L2 (Solyc07g021640) в различных органах растений томата Solanum lycopersicum. По данным TomExpress (http://tomexpress.toulouse.inra.fr/login). DPA – дней после антезиса (открытый цветок); DPG – дней после прорастания; BR и ORG – стадия смены окраски плода; RED – биологическая спелость плода; MG – зрелый зеленый плод финального размера; IG – незрелый зеленый плод.

Для проверки предположения о корреляции между количеством полностью-транс-ликопина или же суммы каротиноидов с активностью гена CRTISO был проведен анализ экспрессии CRTISO в спелых плодах 18 анализируемых образцов томата. Наибольшим уровнем транскрипции характеризовался сорт Викинг, наименьшим – Л-Несозревающий (рис. 4а). У большинства красноплодных сортов экспрессия гена статистически достоверно не различалась, за исключением сорта Гаяна и Л-Черри розовые (наименьший среди красноплодных образцов уровень транскрипции), а также сортов Малиновый силач и Гармошка (наибольший среди красноплодных образцов уровень транскрипции) (рис. 4а).
Рис. 4.
Относительный уровень транскрипции гена CRTISO в спелых плодах анализируемых образцов томата (а): Л-Несозревающий (1), Л-Черри лимонно-желтые (2), сорт Викинг (3), Л-Золотой лотос (4), сорт Грот (5), сорт Благодатный (6), сорт Лотос (7), сорт Подарок к юбилею (8), сорт Малиновый силач (9), сорт Гаяна (10), сорт Гармошка (11), сорт Русский размер (12), сорт Дубок (13), Л-411 (14), Л-Черри розовые (15), Л-Черри арбуз (16), Л-176 (17), Л-Черри коричнево-фиолетовые (18). Цветными прямоугольниками условно обозначена окраска спелого плода. Буквами указаны статистически достоверные отличия (P < 0.05) (а). Оценка корреляции между уровнем экспрессии CRTISO и содержанием суммы каротиноидов [нумерация образцов: сорт Викинг (1), сорт Грот (2), сорт Благодатный (3), сорт Лотос (4), сорт Малиновый силач (5), сорт Гармошка (6), сорт Русский размер (7) сорт Гаяна (8), сорт Подарок к юбилею (9), сорт Дубок (10), Л-Несозревающий (11), Л-Черри лимонно-желтые (12), Л-Золотой лотос (13), Л-Черри розовые (14), Л-Черри арбуз (15), Л-Черри коричнево-фиолетовые (16), Л-411 (17), Л-Черри арбуз (16), Л-176 (18)]. Учтены все образцы; коэффициент R2 = 0.03248 (б); из анализа исключены пять образцов (Л-Несозревающий, Л-Черри лимонно-желтые, сорта Викинг, Гаяна и Гармошка); R2 = 0.3383 (в).

Проведенная оценка зависимости содержания суммы каротиноидов от уровня экспрессии гена CRTISO показала отсутствие корреляции. Так, коэффициент детерминации R2 между содержанием суммы каротиноидов и уровнем экспрессии CRTISO для всех анализируемых образцов составил 0.03248 (рис. 4б), а без учета пяти выпадающих на предыдущем графике образцов (Л-Несозревающий, Л-Черри лимонно-желтые, сорта Викинг, Гаяна и Гармошка) – 0.3383 (рис. 4в). Оба результата не соответствуют критерию наличия корреляции (R2 ≥ 0.7).
ОБСУЖДЕНИЕ
Плоды томата (S. lycopersicum) являются важнейшим диетическим источником ликопина и других каротиноидов, потребление которых связано с пониженным риском онкологии, сердечно-сосудистых заболеваний и смертностью [25]. В процессе созревания в тканях плода изменяется идентичность клеточных пластид: хлоропласты, содержащие хлорофилл, превращаются в хромопласты, отдельные структуры которых способны накапливать каротиноиды. В результате, в зависимости от содержания и соотношения типов каротиноидов и остаточного хлорофилла, зеленый плод приобретает желтую, оранжевую или красную (самые разные оттенки, обусловленные характерными спектрами поглощения) окраску [25, 27]. Большое разнообразие окраски плода у сортов томата делает S. lycopersicum удачной моделью для изучения биосинтеза и накопления каротиноидов в сочных плодах.
Наше исследование было сфокусировано на оценке содержания и состава каротиноидов в спелом плоде образцов томата и их предполагаемой зависимости от экспрессии гена каротиноид-изомеразы CRTISO. Роль данного фермента в цис-транс изомеризации проликопина делает его фактором, определяющим общее количество каротиноидов – полностью-транс-ликопина (красный пигмент) и последующих желтых и оранжевых каротиноидов (α-, β-каротинов, ксантофиллов). В работе были использованы образцы томата с различной окраской спелого плода, а также образец томата Л-Несозревающий, спелый плод которого практически не меняет цвет при созревании.
Полученные нами данные биохимического анализа (табл. S1, 1 , рис. 2) подтвердили зависимость окраски плода (рис. 1) от содержания и состава пигментов. Так, желто-оранжевая окраска плодов сорта Викинг может объясняться отсутствием ликопина и присутствием β-каротина и лютеинов. Окраска плодов сорта Малиновый силач и Л-176 – присутствием больших количеств ликопина и β-каротина. При этом глубокий малиново-красный цвет в случае сорта Малиновый силач может быть обусловлен преобладанием (почти в 2 раза) ликопина (красный) над β-каротином (оранжевый), а коричнево-красный оттенок в случае Л-176 – почти равными количествами ликопина и β-каротина, а также присутствием существенного количества (all-E)-лютеина (желтый). И, наконец, светло-зеленая с желтым оттенком окраска плодов Л-Несозревающий является следствием равных количеств β-каротина и хлорофиллов.
Линия Л-Несозревающий была получена ранее в результате скрещивания сорта Земба (ВИР, Санкт-Петербург, Россия) с линией LA1795, гомозиготной по мутации rin (сортовой фон неизвестен; TGRC, Дэвис, Калифорния, США) [28]. Линия LA1795 формирует спелые плоды с признаками незрелости (зеленая окраска, отсутствие накопления влаги по мере созревания, твердая текстура в течение более длительного времени, чем у сортов). Это объясняется подавлением клеточного дыхания и высвобождения этилена, которое препятствует биосинтезу и накоплению каротиноидов и ароматических соединений, а также размягчению плодов [29]. Мутация rin вызвана протяженной делецией в последовательности хромосомы 5, приводящей к слиянию соседних усеченных генов RIPENING INHIBITOR (RIN) и MACROCALYX (MC) (локус RIN-MC) [29, 30]. Транскрипционный фактор RIN считается главным регулятором созревания плода томата и осуществляет контроль транскрипции множества генов всех стадий созревания плода, включая структурные гены биосинтеза каротиноидов, в том числе и CRTISO [18, 30‒33].
Поскольку CRTISO является мишенью RIN, ожидалось, что его экспрессия в спелом плоде Л‑Несозревающий будет существенно снижена. Результаты проведенного экспрессионного анализа подтвердили ожидания – уровень транскрипции CRTISO у данной линии (генотип rin/RIN) оказался наименьшим в сравнении с другими анализируемыми образцами (генотип RIN/RIN) (рис. 4а).
Заметим, что в плодах всех четырех проанализированных образцов (сорта Викинг и Малиновый силач, линия Л-176) полностью отсутствовал проликопин (7,9,9',7'-тетра-цис-ликопин; предшественник полностью-транс-ликопина), что говорит о его полной изомеризации в полностью-транс-ликопин с помощью CRTISO (табл. 2 ). Ранее показано, что при выключенной экспрессии гена CRTISO в плодах одной линии томата наблюдается накопление проликопина и дефицит полностью-транс-ликопина [34]. Таким образом, предполагалась корреляция между уровнем экспрессии гена CRTISO и суммой каротиноидов (ликопин + нижеследующие каротиноиды; исключая производные ζ-каротина). Однако в данном исследовании на большой выборке красноплодных сортов четкой зависимости не наблюдалось (рис. 4б, в). Также, в корреляцию не укладывались данные, полученные для желтоплодного сорта Викинг и линии Л-Несозревающий (наибольший и наименьший уровень экспрессии CRTISO; минимальное и сравнимое с другими образцами содержание суммы каротиноидов) (табл. 1, рис. 4а). Это может объясняться полным отсутствием в плодах этих двух образцов каких-либо предшественников каротиноидов в сравнении с сортом Малиновый силач и линией Л-176, где таких предшественников 32% и 23%, соответственно (табл. 1). Можно предположить, что в плодах сорта Викинг каротиноид-изомераза CRTISO при имеющемся уровне экспрессии успешно модифицировала бы и значительно большее количество проликопина. В то же время, в плодах линии Л-Несозревающий небольшой экспрессии гена CRTISO оказалось достаточно для изомеризации всего субстрата.
Таким образом, полученные данные демонстрируют зависимость окраски плода томата от содержания и состава каротиноидов и наличия хлорофиллов. Отсутствие выраженной корреляции между уровнем экспрессии гена CRTISO и суммой каротиноидов может объясняться различным количеством метаболитов, предшествующих проликопину, что определяется активностью, в первую очередь, фитоин-синтазы PSY1 и, затем, десатураз (PDS и ZDS) и ζ-каротин-изомеразы Z-ISO. Поэтому оценка корреляции между уровнем транскрипции CRTISO и суммой каротиноидов возможна при наличии остатков проликопина. Кроме того, нужно учитывать образование конечных метаболитов пути биосинтеза каротиноидов – гормонов, а также вероятную деградацию каротиноидов. Также, следует принять во внимание то, что на количество различных каротиноидов оказывает влияние не столько транскрипционная активность генов, сколько активность кодируемых ими ферментов.
Работа выполнена при финансовой поддержке гранта Российского научного фонда № 19-16-00016 и Министерства науки и высшего образования Российской Федерации.
Авторы заявляют об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Langi P., Kiokias S., Varzakas T., Proestos C. Carotenoids: from plants to food and feed industries // Methods Mol. Biol. 2018. V. 1852. P. 57. https://doi.org/10.1007/978-1-4939-8742-9_3
Llorente B., Martinez-Garcia J.F., Stange C., Rodriguez-Concepcion M. Illuminating colors: regulation of carotenoid biosynthesis and accumulation by light // Curr. Opin. Plant Biol. 2017. V. 37. P. 49. https://doi.org/10.1016/j.pbi.2017.03.011
Giuliano G., Giliberto L., Rosati C. Carotenoid isomerase: a tale of light and isomers // Trends Plant Sci. 2002. V. 7. P. 427. https://doi.org/10.1016/s1360-1385(02)02329-4
Lado J., Zacarías L., Rodrigo M.J. Regulation of carotenoid biosynthesis during fruit development // Subcell. Biochem. 2016. V. 79. P. 161. https://doi.org/10.1007/978-3-319-39126-7_6
Yu Q., Ghisla S., Hirschberg J., Mann V., Beyer P. Plant carotene cis-trans isomerase CRTISO: a new member of the FAD(RED)-dependent flavoproteins catalyzing non-redox reactions // J. Biol. Chem. 2011. V. 286. P. 8666. https://doi.org/10.1074/jbc.M110.208017
Park H., Kreunen S.S., Cuttriss A.J., DellaPenna D., Pogson B.J. Identification of the carotenoid isomerase provides insight into carotenoid biosynthesis, prolamellar body formation, and photomorphogenesis // Plant Cell. 2002. V. 14. P. 321. https://doi.org/10.1105/tpc.010302
Isaacson T., Ronen G., Zamir D., Hirschberg J. Cloning of tangerine from tomato reveals a carotenoid isomerase essential for the production of beta-carotene and xanthophylls in plants // Plant Cell. 2002. V. 14. P. 333. https://doi.org/10.1105/tpc.010303
Tomato Genome Consortium. The tomato genome sequence provides insights into fleshy fruit evolution // Nature. 2012. V. 485. P. 635. https://doi.org/10.1038/nature11119
Isaacson T., Ohad I., Beyer P., Hirschberg J. Analysis in vitro of the enzyme CRTISO establishes a poly-cis-carotenoid biosynthesis pathway in plants // Plant Physiol. 2004. V. 136. P. 4246. https://doi.org/10.1104/pp.104.052092
Wei J., Xu M., Zhang D., Mi H. The role of carotenoid isomerase in maintenance of photosynthetic oxygen evolution in rice plant // Acta Biochim Biophys Sin (Shanghai). 2010. V. 42. P. 457. https://doi.org/10.1093/abbs/gmq044
Zou C.L., Zheng Y., Wang P., Zhang X., Wang Y.H., Liu Z.Y., Feng H. Fine mapping and characterization of the or gene in Chinese cabbage (Brassica rapa L. ssp pekinensis) // Genet. Mol. Res. 2016. V. 15. gmr8370. https://doi.org/10.4238/gmr.15028370
Lee S., Lee S.C., Byun D.H., Lee D.Y., Park J.Y., Lee J.H., Lee H.O., Sung S.H., Yang T.J. Association of molecular markers derived from the BrCRTISO1 gene with prolycopene-enriched orange-colored leaves in Brassica rapa [corrected] // Theor. Appl. Genet. 2014. V. 127. P. 179. https://doi.org/10.1007/s00122-013-2209-3
Sun B., Jiang M., Zheng H., Jian Y., Huang W.L., Yuan Q., Zheng A.H., Chen Q., Zhang Y.T., Lin Y.X., Wang Y., Wang X.R., Wang Q.M., Zhang F., Tang H.R. Color-related chlorophyll and carotenoid concentrations of Chinese kale can be altered through CRISPR/Cas9 ta-rgeted editing of the carotenoid isomerase gene Bo-aCRTISO // Hortic. Res. 2020. V. 7. P. 161. https://doi.org/10.1038/s41438-020-00379-w
Pinheiro T.T., Peres L.E.P., Purgatto E., Latado R.R., Maniero R.A., Martins M.M., Figueira A. Citrus carotenoid isomerase gene characterization by complementation of the “Micro-Tom” tangerine mutant // Plant Cell Rep. 2019. V. 38. P. 623. https://doi.org/10.1007/s00299-019-02393-2
Soufflet-Freslon V., Jourdan M., Clotault J., Huet S., Briard M., Peltier D., Geoffriau E. Functional gene polymorphism to reveal species history: the case of the CRTISO gene in cultivated carrots // PLoS One. 2013. V. 8. e70801. https://doi.org/10.1371/journal.pone.0070801
Emran S., Nawade B., Yahyaa M., Abu Nassar J., Tholl D., Eizenberg H., Ibdah M. Broomrape infestation in carrot (Daucus carota): Changes in carotenoid gene expression and carotenoid accumulation in the parasitic weed Phelipanche aegyptiaca and its host // Sci. Rep. 2020. V. 10. P. 324. https://doi.org/10.1038/s41598-019-57298-7
Li C., Ji J., Wang G., Li Z., Wang Y., Fan Y. Over-expression of LcPDS, LcZDS, and LcCRTISO, genes from wolfberry for carotenoid biosynthesis, enhanced carotenoid accumulation, and salt tolerance in tobacco // Front. Plant Sci. 2020. V. 11. P. 119. https://doi.org/10.3389/fpls.2020.00119
Li S., Xu H., Ju Z., Cao D., Zhu H., Fu D., Grierson D., Qin G., Luo Y., Zhu B. The RIN-MC fusion of MADS-box transcription factors has transcriptional activity and modulates expression of many ripening genes // Plant Physiol. 2018. V. 176. P. 891. https://doi.org/10.1104/pp.17.01449
Efremov G.I., Slugina M.A., Shchennikova A.V. and Kochieva E.Z. Dierential regulation of phytoene synthase PSY1 during fruit carotenogenesis in cultivated and wild tomato species (Solanum section Lycopersicon) // Plants. 2020. V. 9. P. 1169. https://doi.org/10.3390/plants9091169
Филюшин М.А., Джос Е.А., Щенникова А.В., Кочиева Е.З. Зависимость окраски плодов перца от соотношения основных пигментов и профиля экспрессии генов биосинтеза каротиноидов и антоцианов // Физиология растений. 2020. Т. 67. С. 644. https://doi.org/10.31857/S0015330320050048
Ashikhmin A., Makhneva Z., Bolshakov M., Moskalenko A. Incorporation of spheroidene and spheroidenone into light-harvesting complexes from purple sulfur bacteria // J. Photochem. Photobiol. B Biol. 2017. V. 170. P. 99. https://doi.org/10.1016/j.jphotobiol.2017.03.020
Pashkovskiy P., Kreslavski V., Khudyakova A., Ashikhmin A., Bolshakov M., Kozhevnikova A., Kosobryukhov A., Kuznetsov V.V., Allakhverdiev S.I. Effect of high-intensity light on the photosynthetic activity, pigment content and expression of light-dependent genes of photomorphogenetic Solanum lycopersicum hp mutants // Plant Physiol. Biochem. 2021. V. 167. P. 91. https://doi.org/10.1016/j.plaphy.2021.07.033
Britton G. UV/visible spectroscopy // in: Britton G., Liaaen-Jensen S., Pfander H. (ed.). Carotenoids: Spectroscopy. V. 1B. – Birkhäuser Verlag. Basel. 1995.
Rodriguez-Amaya D.B. A guide to carotenoid analysis in foods // ILSI PRESS, International Life Sciences Institute. Washington. 2001. P. 45. https://pdf.usaid.gov/pdf_docs/pnacq929.pdf
Aune D., Keum N., Giovannucci E., Fadnes L.T., Boffetta P., Greenwood D.C., Tonstad S., Vatten L.J., Riboli E., Norat T. Dietary intake and blood concentrations of antioxidants and the risk of cardiovascular disease, total cancer, and all-cause mortality: a systematic review and dose-response meta-analysis of prospective studies // Am. J. Clin. Nutr. 2018. V. 108. P. 1069. https://doi.org/10.1093/ajcn/nqy097
Yoo H.J., Park W.J., Lee G.M., Oh C.S., Yeam I., Won D.C., Kim C.K., Lee J.M. Inferring the genetic determinants of fruit colors in tomato by carotenoid profiling // Molecules. 2017. V. 22. P. 764. https://doi.org/10.3390/molecules22050764
D'Andrea L., Rodriguez-Concepcion M. Manipulation of plastidial protein quality control components as a new strategy to improve carotenoid contents in tomato fruit // Front. Plant Sci. 2019. V. 10. P. 1071. https://doi.org/10.3389/fpls.2019.01071
Slugina M.A., Efremov G.I., Shchennikova A.V., Kochieva E.Z. Characterization of RIN isoforms and their expression in tomato fruit ripening // Cells. 2021. V. 10. P. 1739. https://doi.org/10.3390/cells10071739
Karlova R., Chapman N., David K., Angenent G.C., Seymour G.B., de Maagd R.A. Transcriptional control of fleshy fruit development and ripening // J. Exp. Bot. 2014. V. 65. P. 4527. https://doi.org/10.1093/jxb/eru316
Fujisawa M., Shima Y., Higuchi N., Nakano T., Koyama Y., Kasumi T., Ito Y. Direct targets of the tomato-ripening regulator RIN identified by transcriptome and chromatin immunoprecipitation analyses // Planta. 2012. V. 235. P. 1107. https://doi.org/10.1007/s00425-011-1561-2
Fujisawa M., Nakano T., Shima Y., Ito Y. A large-scale identification of direct targets of the tomato MADS box transcription factor RIPENING INHIBITOR reveals the regulation of fruit ripening // Plant Cell. 2013. V. 25. P. 371. https://doi.org/10.1105/tpc.112.108118
Qin G., Wang Y., Cao B., Wang W., Tian S. Unraveling the regulatory network of the MADS box transcription factor RIN in fruit ripening // Plant J. 2012. V. 70. P. 243. https://doi.org/10.1111/j.1365-313X.2011.04861.x
Fujisawa M., Ito Y. The regulatory mechanism of fruit ripening revealed by analyses of direct targets of the tomato MADS-box transcription factor RIPENING INHIBITOR // Plant Signal. Behav. 2013. V. 8: e24357. https://doi.org/10.4161/psb.24357
Fantini E., Falcone G., Frusciante S., Giliberto L., Giuliano G. Dissection of tomato lycopene biosynthesis through virus-induced gene silencing // Plant Physiol. 2013. V. 163. P. 986. https://doi.org/10.1104/pp.113.224733
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. Образцы сортов и линий томата, использованные в работе: содержание каротиноидов и окраска спелого плода.
Инструменты
Физиология растений


