Физиология растений, 2022, T. 69, № 4, стр. 427-437
Развитие проростков бурой водоросли Fucus distichus subsp. evanescens (Fucales, Phaeophyceae) в условиях избыточного содержания свинца и кадмия
А. В. Климова a, *, Р. Г. Болотова a, Т. А. Клочкова a
a Камчатский государственный технический университет
Петропавловск-Камчатский, Россия
* E-mail: annaklimovae@mail.ru
Поступила в редакцию 16.07.2021
После доработки 01.12.2021
Принята к публикации 03.12.2021
- EDN: QPERRJ
- DOI: 10.31857/S001533032203006X
Аннотация
Исследовано воздействие повышенного содержания свинца и кадмия в искусственной среде на рост и морфогенез проростков бурой водоросли Fucus distichus subsp. evanescens. В работе было установлено, что при содержании свинца в среде свыше 100 мкг/л и кадмия – 60 мкг/л у проростков фукуса отмечалось существенное подавление ростовых процессов. При этом скорость роста водорослей не восстанавливалась после их длительной экспозиции в среде без добавления металлов. Высокое содержание свинца и кадмия приводило к тератологическим изменениям в эмбриогенезе фукуса: нарушению формирования оси роста, аномальному развитию ризоидальной зоны и образованию вне- и внутриклеточных отложений металлов. Полученные результаты могут быть использованы в санитарной марикультуре при очистке прибрежных акваторий с использованием F. distichus, поскольку даже для ранних стадий развития этого вида характерна устойчивость к длительному воздействию высоких концентраций солей Pb и Cd в водной среде.
ВВЕДЕНИЕ
Загрязнение морских прибрежных экосистем тяжелыми металлами (ТМ) является одной из наиболее серьезных проблем во всем мире. Как правило, оно связано с антропогенной деятельностью, в частности с добычей природных ископаемых, работой металлургических заводов, предприятий теплоэнергетики, автотранспорта и другими источниками [1–4]. Реже постоянное и значительное поступление ТМ в среду обусловлено природными источниками – вулканизмом, выветриванием горных пород, апвеллингом [5].
Металлы присутствуют в водной среде и в незначительных количествах необходимы организмам для существования [6–8]. Однако высокие концентрации ТМ могут вызывать ухудшение качества окружающей среды, обусловленное, главным образом, кислородным голоданием и нарушением биогеохимических циклов [9, 10]. Изменение физико-химических характеристик морской воды влияет на механизмы поглощения питательных веществ у продуцентов прибрежных районов, морских трав и водорослей, что, в конечном счете, приводит к снижению продуктивности всей экосистемы [4, 11, 12]. Токсичность ТМ в сочетании с другими стрессовыми воздействиями приводит к изменениям в структуре сообществ из-за гибели видов-эдификаторов, что в дальнейшем вызывает ограничение доступности среды обитания, снижение биоразнообразия и нарушение функционирования всей экосистемы [13, 14].
Морские бентосные водоросли способны выдерживать длительное воздействие ТМ. Их сопротивляемость неблагоприятным условиям среды, в частности неорганическим поллютантам, обусловлена способностью изолировать и деактивировать ТМ в клеточных структурах – вакуолях и клеточных стенках [4]. В результате этих защитных механизмов водоросли могут накапливать металлы в значительных количествах, существенно превышающих их содержание в окружающей среде. Благодаря этим свойствам они используются и как биоиндикаторы качества морских акваторий, и как биомониторы изменений условий среды [4, 15].
Для биомониторинга состояния прибрежных районов очень часто используют представителей ламинариевых и фукусовых водорослей [16]. Однако устойчивость видов-мониторов зачастую ограничена выживаемостью микроскопических и ювенильных стадий их развития, поскольку именно эффективное развитие репродуктивных клеток и молодых проростков определяет успех воспроизводства этих видов. Как правило, диапазоны толерантности водорослей на ранних стадиях развития гораздо уже, чем у взрослых особей. Кроме того, несмотря на то что механизмы проникновения и дальнейшее воздействие ТМ на функционирование клеток водорослей хорошо изучены [4], ответные реакции и диапазоны устойчивости у отдельных видов, в том числе и близкородственных, могут сильно отличаться. Выявление летальных концентраций для разных стадий развития видов-мониторов позволит прогнозировать изменения в прибрежных экосистемах и разработать основу для их использования в санитарной марикультуре.
Для изучения воздействия тяжелых металлов на раннее развитие водорослей в качестве модельного объекта использовали литоральную бурую водоросль Fucus distichus subsp. evanescens. Этот вид среди многолетних водорослей Авачинской губы, несмотря на существенную трансформацию здесь сообщества макрофитобентоса за пятидесятилетний период, остался массовым представителем литоральной альгофлоры, не утратившим свое структурообразующее значение [17, 18].
Целью настоящей работы являлось исследование воздействия свинца и кадмия на ранние стадии развития Fucus distichus subsp. evanescens в условиях температуры и продолжительности светового дня, близких к таковым в естественной среде при массовом размножении вида. Для этого необходимо было решить несколько задач: оценить воздействие металлов на скорость роста фукуса, установить возможность нормального развития после длительной экспозиции проростков в среде с высоким содержанием металлов, выявить наиболее часто встречающиеся аномалии в развитии эмбрионов водоросли.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор водорослей и постановка экспериментов. Исходным материалом для проведения лабораторных экспериментов послужили образцы водоросли F. distichus subsp. evanescens со зрелыми концептакулами, собранные в мае в литоральной зоне бухты Сероглазка (Авачинская губа, юго-восточная Камчатка). Для получения зигот фукуса использовали метод, предложенный Т. Мотомуро [19] с изменениями, детально описанными нами ранее [20]. Культуры фукуса выращивали в чашках Петри (35 × 10 мм, Eppendorf), в каждой из которых насчитывалось от 600 до 800 проростков. Все водоросли в культурах находились в прикрепленном состоянии, субстратом для их развития являлось дно чашек Петри.
Питательную среду для культивирования осевших зигот готовили на основе морской воды с соленостью 28‰, отобранной в месте сбора водорослей. Содержание Pb и Cd в природной морской воде, использованной для приготовления культуральной среды, измеренное на атомно-эмиссионном спектрометре (4100 MP-AES Agilent, Agilent Technologies, США), не превышало 2.1 и 3 мкг/л соответственно. В условиях лаборатории морскую воду предварительно стерилизовали (автоклавирование, Yamato SQ510) и обогащали необходимыми витаминами, микро- и макроэлементами согласно протоколу для приготовления IMR-среды [21]. В 1 л культуральной среды содержалось 50 мг NaNO3, 6.8 мг KH2PO4, 1 мл раствора микроэлементов (1 г FeCl3, 0.62 г MnSO4, 0.25 г ZnSO4, 0.13 г Na2MoO4 · · 2H2O, 4 мг CoCl2·6H2O, 4 мг CuSO4·5H2O, 6 г EDTA и 1 л ddH2O) и 0.1 мл раствора витаминов (10 мг тиамина, 0.1 мг цианокабаламина, 0.1 мг биотина и 100 мл ddH2O). Для приготовления растворов, содержащих свинец и кадмий, использовали соли Pb(NO3)2 и CdCl2 соответственно. Рабочие растворы металлов в IMR-среде содержали номинальные концентрации Pb и Cd: 10, 20, 40, 60, 100, 200 мкг/л. Каждый раствор ТМ тестировался отдельно в трех повторностях.
Культивирование водорослей проводили при двух разных режимах инкубирования, отличающихся условиями температуры среды и продолжительностью освещения и соответствующих двум пикам полового размножения фукуса у юго-восточной Камчатки. Первый режим использовали для тестирования диапазона концентрации металла от 10 до 60 мкг/л, при этом развивающиеся зиготы выращивали при температуре 10°С и фотопериоде 12 : 12 ч. В естественной среде подобные условия близки к таковым для первых летних месяцев (июнь и июль) – периоду развития проростков фукуса после короткого пика весеннего размножения. Во втором режиме развитие эмбрионов фукуса при более высоких концентрациях свинца и кадмия проходило при температуре 7°С и условиях короткого дня (8 ч света и 16 ч темноты). При близких значениях температуры и продолжительности дня у юго-восточной Камчатки происходит массовое осеннее размножение F. distichus и, соответственно, в прибрежной зоне начинают активно развиваться проростки фукуса. Воздействие концентраций Pb и Cd до 60 мкг/л в условиях короткого дня и низкой температуры на культуры фукуса было изучено нами ранее, так, исследованные концентрации металлов не приводили к элиминации проростков [22].
Интенсивность освещения во всех экспериментах составляла 30 мкмоль фотонов/(м2 с). Параллельно в экспериментах для каждого диапазона концентраций металлов культуры фукуса выращивали в среде без добавления металлов, контрольные группы инкубировали при тех же условиях освещения и продолжительности дня, что и испытуемые группы.
Определение скорости роста культур. Наблюдения за развитием эмбрионов и проростков F. distichus вели с помощью стереомикроскопа Olympus SZX10 и инвертированного микроскопа Olympus IX73, снабженных цветными фотокамерами DP27 и DP73 (Olympus, Japan). Для определения их линейных размеров использовали программное обеспечение CellSens Entry (Olympus, Japan). За общую длину проростков принимали сумму значений длины их ризоидальной и талломической частей. Измерения проростков фукуса проводили через каждые 3–4 сут., особи отбирали случайным образом. Количество измеренных водорослей превышало 30 и обычно составляло 50 для каждой испытуемой и контрольной групп. Полученные значения длины усредняли и высчитывали стандартное отклонение. Абсолютную скорость роста (AGR, мкм/сут.) рассчитывали по формуле (1) [23]:
(1)
${\text{AGR}} = ({{{{{{\text{(}}{{L}_{{{\text{общ}}}}})}}_{2}} - {{{{\text{(}}{{L}_{{{\text{общ}}}}}{\text{)}}}}_{1}})} \mathord{\left/ {\vphantom {{{{{{\text{(}}{{L}_{{{\text{общ}}}}})}}_{2}} - {{{{\text{(}}{{L}_{{{\text{общ}}}}}{\text{)}}}}_{1}})} {({{t}_{2}} - {{t}_{1}})}}} \right. \kern-0em} {({{t}_{2}} - {{t}_{1}})}},$Общая продолжительность эксперимента при диапазоне концентраций металла 10–60 мкг/л составила 40 сут., при диапазоне 60–200 мкг/л – 64 сут. При этом для последнего случая первые 32 дня культуры выращивали в средах, содержавших тяжелые металлы, остальное время – в IMR-среде без добавления Pb и Cd.
При наблюдении за развитием проростков фукуса их дифференцировали на группы согласно выделенным нами ранее стадиям морфогенеза [24]: (0) эмбрионы, состоящие из 2–5 клеток; (I) одно- и двухслойные эмбрионы с развитым ризоидом, длина которого превышает таковую талломической части; (II) проростки с многослойной талломической частью; (III) проростки, имеющие гиалиновые волоски.
Статистический анализ. Статистическую обработку и построение графиков выполняли в программе GraphPad Prism version 8.4.2. Нормальность распределения полученных данных проверяли с помощью теста Д’Агостино-Пирсона (D’Agostino-Pearson test), гомогенность дисперсии – теста Браун-Форсайта (Brown-Forsythe test). Для оценки статистических различий между контрольными и испытуемыми группами применяли однофакторный дисперсионный анализ (one-way ANOVA), при выявлении различий между контрольной и испытуемыми группами использовали апостериорное сравнение с помощью критерия Даннетта (Dunnett post hoc test). Различия между средними значениями считали достоверными при P ≤ 0.05.
РЕЗУЛЬТАТЫ
Рост проростков F. distichus в среде с номинальными концентрациями металлов 10, 20, 40 и 60 мкг/л в нормальных условиях (фотопериод 12 : 12 ч, 10°С). В течение первых 15 сут. эксперимента рост проростков F. distichus в средах с добавлением свинца в номинальных концентрациях 10, 20, 40, 60 мкг/л не отличался от такового в контрольной группе (P > 0.05, Dunnett test) (рис. 1а). При этом в отдельные периоды линейные размеры водорослей в среде с добавлением металла были больше, чем в IMR-среде. Так, на 12-е сут. культивирования средние значения длины проростков в контрольной группе достигали 343.8 мкм, в то время как в средах с концентрацией 20 мкг/л и более они превышали 350 мкм (рис. 1а). В течение последующих 3 сут. эта разница лишь увеличивалась.
Рис. 1.
Изменение длины (мкм) проростков Fucus distichus subsp. evanescens в среде с разным содержанием свинца (а) и кадмия (б) в течение 40 сут.: (1) контрольная группа; (2) Pb 10 мкг/л; (3) Pb 20 мкг/л; (4) Pb 40 мкг/л; (5) Pb 60 мкг/л; (6) Cd 10 мкг/л; (7) Cd 20 мкг/л; (8) Cd 40 мкг/л; (9) Cd 60 мкг/л. Для каждой группы приведены среднее значение и стандартное отклонение (n = 50 для контрольной группы и n = 30 для испытуемых групп).

На 19-е сут. эксперимента в группах, выращиваемых в среде с содержанием свинца 10 и 40 мкг/л, были выявлены различия в росте относительно контрольной группы (P < 0.05, Dunnett test). Следует отметить, что в этих случаях добавление металла оказывало стимулирующий эффект на развитие проростков (рис. 1a). Через неделю, на 26-е сут. эксперимента, этот эффект отмечался уже во всех испытуемых группах (P < < 0.05, Dunnett test). Исключение составили проростки, выращенные в среде с максимальной концентрацией свинца (60 мкг/л), их линейные размеры не отличались от таковых в контрольной группе (P = 0.24, Dunnett test) (рис. 1a). Превышение длины проростков F. distichus, культивируемых в среде с 40 мкг/л Pb, относительно контрольной группы составило 33.9%.
После 33 сут. культивирования испытуемых групп в среде с добавлением свинца средние значения линейных размеров проростков превышали значения в контрольной группе. Однако статистически значимые различия выявлены только у водорослей, развивавшихся в средах с содержанием металла 10 и 40 мкг/л (P = 0.0001 и P = 0.004 соответственно, Dunnett test) (рис. 1a). К концу эксперимента, на 40-е сут., средние значения линейных размеров проростков из всех групп превышали 900 мкм. Только у водорослей, выращенных в среде с 60 мкг/л Pb, оно было ниже. В контрольной группе средняя длина проростков составила 946.7 мкм, максимальная длина была обнаружена у проростков в среде с содержанием металла 40 мкг/л (рис. 1a). Различий в росте испытуемых групп относительно контрольной к концу эксперимента не выявлено (P > 0.05, Dunnett test).
Изменение линейных размеров проростков F. distichus, культивируемых в средах с номинальными концентрациями кадмия 10, 20, 40, 60 мкг/л представлены на рисунке (рис. 1б). В течение первых 6 сут. длина водорослей в испытуемых группах не отличалась от контрольной (P > 0.05, Dunnett test) и изменялась незначительно, от 128.0 до 153.7 мкм. Через два дня во всех культурах с добавлением металла у проростков было отмечено заметное отставание в росте (P < 0.05, Dunnett test). В течение последующей недели различия в ростовых процессах обнаружены не были (рис. 1б). Только в группе, развивающейся в среде с концентрацией кадмия 60 мкг/л, выявлены наиболее низкие показатели линейных размеров относительно контрольной группы (P < 0.05, Dunnett test), их отставание в росте составило 28.8%.
С 19 по 40 сут. эксперимента для проростков, культивируемых в средах с номинальной концентрацией кадмия 10 и 20 мкг/л, выявлены различия в линейных размерах водорослей по отношению к контрольной группе (P < 0.05, Dunnett test). Здесь во всех случаях отмечено стимулирующее воздействие кадмия на рост F. distichus (рис. 1б). К концу эксперимента длина проростков в контрольной группе составляла 946.7 мкм, в культурах с концентрацией кадмия 10 мкг/л – 1306.2 мкм, и в культурах с концентрацией кадмия 20 мкг/л – 1209.9 мкм, что соответственно на 38.0 и 27.9% больше, чем длина проростков в среде без добавления металла.
У проростков фукуса, выращенных в среде с концентрацией кадмия 40 мкг/л, различий в ростовых процессах относительно контрольной группы не обнаружено (P > 0.05, Dunnett test). В течение всего периода, начиная с 12 по 20 сут., линейные размеры в этой группе были сопоставимы с таковыми в контрольной группе (рис. 1б).
С 15 сут. эксперимента развитие проростков в среде с концентрацией кадмия 60 мкг/л существенно отставало от контрольной группы (P < 0.05, Dunnett test). На 40-е сут. их длина достигала 715.7 мкм, что составляло только 75.6% от таковой в контрольной группе. Концентрация кадмия в среде выше 60 мкг/л оказывала явное отрицательное воздействие на ростовые процессы ранних стадий развития F. distichus.
Во всех испытуемых группах показатели абсолютной скорости роста водорослей достигали максимальных значений на 19-е сут. эксперимента (рис. 2). В это время прирост F. distichus в испытуемых культурах с Pb варьировал в среднем от 29.75 до 34.75 мкм/сут., с Cd – 14.93–33.38 мкм/сут. при значении AGR в контрольной группе – 19.70 мкм/сут. Во всех группах с Pb скорость роста была выше, чем в контрольной (P < 0.05, Dunnett test). Подобный положительный эффект отмечен и для культур фукуса с концентрациями Cd 10 и 20 мкг/л. Явное подавление скорости роста проростков отмечено только в среде с концентрацией кадмия 60 мкг/л (P = 0.01, Dunnett test). К концу эксперимента, на 40-е сут., различия в скорости роста фукуса в средах с содержанием металлов выявлены только для концентрации Cd 10 мкг/л (положительный эффект, AGR = 31.42 мкм/сут., P = 0.03, Dunnett test) и Cd 60 мкг/л (отрицательный эффект, AGR = 31.42 мкм/сут., P < 0.0001, Dunnett test).
Рис. 2.
Абсолютная скорость роста (AGR, мкм/сут.) проростков Fucus distichus subsp. evanescens в среде с разным содержанием тяжелых металлов (Pb и Cd): (а) – на 19-е сут.; (б) – на 40-е сут. Для каждого металла указана номинальная концентрация (10, 20, 40, 60 мкг/л). * отмечены статистические значимые различия между контрольной и тестируемыми группами (P ≤ 0.05, Dunnett test).

В условиях культивирования при температуре 10°С и фотопериоде 12 : 12 ч на 8-е сут. проростки имели сформированную объемную талломическую часть, их рост замедлялся. Дальнейшее развитие водорослей приводило к появлению и росту гиалиновых волосков, длина которых не учитывалась нами при измерении общих линейных размеров. В целом рост F. distichus в среде с номинальной концентрацией кадмия 10 и 20 мкг/л происходил более активно, чем в среде с аналогичными концентрациями свинца. Максимальные из испытуемых концентраций металлов вызывали угнетение ростовых процессов (рис. 1, 2).
Развитие проростков F. distichus в среде с номинальными концентрациями металлов 60, 100 и 200 мкг/л в условиях короткого дня и при 7°C. Развитие проростков F. distichus в средах с концентраций металлов от 60 до 200 мкг/л в условиях низкой температуры и короткого дня (7°С и фотопериоде 8 : 16 ч) происходило иначе, чем при более низком содержании свинца и кадмия (рис. 3). Во всех испытуемых группах, как в среде с Pb, так и в среде с Cd, отмечалось отрицательное воздействие металлов на ростовые процессы водорослей относительно проростков из контрольной группы (P < 0.05, Dunnett test). В течение первых двух недель эксперимента отставание в росте в группах, культивируемых в содержащих свинец средах (60, 100 и 200 мкг/л), варьировало от 37.2 до 46.3%, в группах, выращиваемых в средах с добавлением кадмия (60, 100 и 200 мкг/л) – от 44.4 до 54.1%.
Рис. 3.
Изменение длины (мкм) проростков Fucus distichus subsp. evanescens в среде с разным содержанием свинца (а) и кадмия (б) в течение 64 сут.: (1) контрольная группа; (2) Pb 60 мкг/л; (3) Pb 100 мкг/л; (4) Pb 200 мкг/л; (5) Cd 60 мкг/л; (6) Cd 100 мкг/л; (7) Cd 200 мкг/л. После 32 сут. все культуры выращивали в IMR среде без добавления тяжелых металлов. Для каждой группы приведены среднее значение и стандартное отклонение (n = 50).

После 32 сут. выращивания проростков F. distichus в средах с содержанием Pb и Cd (60, 100 и 200 мкг/л) ростовые процессы значительно замедлялись (рис. 3). Линейные размеры водорослей в группах, выращенных в средах с добавлением свинца, были ниже, чем у контрольных на 45.9–73.1%, в группах, культивируемых в средах с кадмием, – на 70.1–80.2%. Минимальные значения общей длины проростков отмечены при номинальных концентрациях свинца и меди 200 мкг/л. Так, через месяц культивирования в контрольной группе средняя длина водорослей составляла 1150.2 мкм против 309.5 мкм при максимальном содержании Pb в среде (рис. 3а) и 227.3 мкм при максимальном содержании Cd в среде (рис. 3б).
Последующее выращивание испытуемых групп F. distichus в течение еще 32 сут. проводили в IMR-среде без добавления металлов. Существенного увеличения линейных размеров проростков за весь период отмечено не было. В большинстве групп наблюдалось ингибирование ростовых процессов. Только у проростков в среде с концентрацией свинца 60 мкг/л была зарегистрирована положительная динамика роста. Их длина к концу эксперимента составляла 1109.3 мкм, в то время как в контрольной группе она превышала 1400 мкм (рис. 3а). В остальных группах (Pb_100 и Pb_200) среднее значение длины не превышало 600 мкм. Линейные размеры проростков в средах с концентрациями кадмия 60, 100 и 200 мкг/л характеризовались еще более низкими значениями, которые варьировали в зависимости от группы в пределах 249.0–350.6 мкм (рис. 3б).
Максимальные значения абсолютной скорости роста проростков F. distichus, культивируемых в среде с концентрациями металлов 60, 100 и 200 мкг/л, были отмечены в первые две недели эксперимента. К 29 сут. эксперимента прирост водорослей в контрольной группе в среднем достигал 34.57 мкм/сут., в испытуемых группах не превышал 17.5 мкм/сут. в среде с добавлением свинца и 10.5 мкм/сут. в среде с добавлением кадмия (рис. 4а). Во всех группах воздействие металлов на скорость роста водорослей характеризовалось выраженным отрицательным эффектом (P < 0.05, Dunnett test). К концу эксперимента негативное воздействие металлов на ростовые процессы фукуса сохранилось (рис. 4б).
Рис. 4.
Абсолютная скорость роста (AGR, мкм/сут.) проростков Fucus distichus subsp. evanescens в среде с разным содержанием тяжелых металлов (Pb и Cd): (а) – на 29-е сут.; (б) – на 64-е сут. Для каждого металла указана номинальная концентрация (60, 100, 200 мкг/л). * отмечены статистические значимые различия между контрольной и тестируемыми группами (P ≤ 0.05, Dunnett test).

Развитие проростков фукуса при концентрации металлов выше 60 мкг/л сопровождалось тератологическими отклонениями. Наиболее явные аномалии были обнаружены в формировании ризоидальной части водорослей. Многообразие вариантов развития ризоидов у проростков было разделено на 4 типа: сформированный главный ризоид с боковыми выростами или без них (тип I, рис. 5а–б); наличие нескольких равнозначных ризоидов (тип II, рис. 5в–е); нарушение оси роста, развитие двух главных ризоидов на противоположных зонах талломической части (тип III, рис. 5ж–з); отсутствие ризоидов при сформированной многослойной пластинчатой части с развитыми гиалиновыми волосками (IV тип, рис. 5и).
Рис. 5.
Развитие ризоидов у проростков Fucus distichus subsp. evanescens в средах с высоким содержанием Pb и Cd: (a‒б) – сформированный главный ризоид (тип I); (в–е) – наличие нескольких равнозначных ризоидов (тип II); (ж‒з) – нарушение оси роста, развитие двух главных ризоидов (тип III); (и) – отсутствие ризоидов (IV тип); (к) – соотношение различных типов развития ризоидов (I–IV) в культурах с номинальными концентрациями каждого металла 60, 100 и 200 мкг/л. Масштабная линейка: 100 мкм. Условные обозначения: r – ризоид, h – гиалиновый волосок.

В контрольной группе у большинства проростков (70.3%) ризоидальная часть развивалась по типу II (рис. 5к). Выраженный главный ризоид имели только 28.9% ювенильных водорослей. При этом во всех случаях длина ризоидов превышала таковую талломической части (рис. 5в–г). Кроме того, ризоидальные выросты были сильно вакуолизированы и слабо пигментированы. Нарушение оси роста было выявлено у менее 1% исследованных проростков.
Развитие органов прикрепления у проростков, культивировавшихся в средах с добавлением свинца (номинальные концентрации 60, 100 и 200 мкг/л), отличалось от контрольной группы (рис. 5к). При концентрации металла 60 мкг/л практически все водоросли имели развитые равнозначные ризоиды (91.7%). Главный ризоид сформировался лишь у 5.5% особей. Отклонения в развитии органов прикрепления были выявлены у 2.8% водорослей. Только в этой испытуемой группе зарегистрировано развитие проростков без ризоидальной части, их доля составила 1.9% (рис. 5и). В то же время они имели от 1 до 3 гиалиновых волосков, как правило, наличие таких волосков характеризует проростки как физиологически зрелые. Их появление является последней стадией морфогенеза ювенильных водорослей, после которой они развиваются во взрослых особей.
При концентрациях свинца в среде выше 60 мкг/л в испытуемых группах преобладала доля проростков с главным ризоидом (рис. 5к). В среде с концентрацией Pb 100 мкг/л она составила 76.9%, в среде с концентрацией Pb 200 мкг/л – 53.4%. Для этих групп выявлено самая высокая частота встречаемости аномального развития ризоидальной части фукуса. Нарушение в формировании оси роста проростков отмечено в 16.9% случаев для группы, выращенной в среде с содержанием свинца 100 мкг/л, и 8.4% – для группы, развивавшейся в среде с содержанием свинца 200 мкг/л (рис. 5ж–з). Как правило, их ризоидальные выросты были слабо вакуолизированы и сильно пигментированы.
Во всех группах, культивируемых в средах с добавлением кадмия, подавляющая часть проростков имела выраженный главный ризоид (95.2–97.1%). При этом, у него отсутствовали боковые выросты как в апикальной части, так и в переходной зоне ризоид-пластина. Нарушение в формировании оси роста были выявлены во всех группах, выращенных в средах с добавлением кадмия, их доля варьировала от 1.9 до 2.9%. В целом, частота встречаемости аномалий в развитии ризоидальной части проростков в испытуемых группах было выше, чем в контрольной (рис. 5к).
Наиболее типичные проростки F. distichus в среде с добавлением свинца представлены на рисунке (рис. 6). Водоросли, имевшие главный ризоид (тип I), внешне не отличались от таковых в контрольной группе (рис. 6а). Однако при формировании пучка ризоидов (тип II) их некоторые сегменты были сильно вздуты и вакуолизированы (рис. 6б). В некоторых случаях при развитии водорослей с повышенным содержанием металла отмечалось аномальное формирование ризоидальных выростов на талломической части. Такие аномалии были отмечены при концентрации свинца в среде 200 мкг/л и сопровождались множественными отложениями металла как в ризоидах, так и в пластине (рис. 6в). Нарушения связанные с развитием оси роста проростков выражались не только в формировании двух ризоидальных полюсов (рис. 6г), но и в образовании двух талломических зон без ризоидов (рис. 6д). Как правило, такие аномалии приводили к гибели водорослей.
Рис. 6.
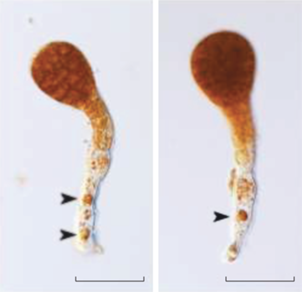
Развитие Fucus distichus subsp. evanescens в среде с разным содержанием свинца: (а) – проросток с сформированным главным ризоидом в среде с концентрацией свинца 200 мкг/л (17-й день эксперимента), отложения металла отмечены стрелками; (б) – проросток с пучком ризоидов в среде с содержанием Pb 100 мкг/л (40-й день эксперимента); (в) – проросток с аномальным развитием ризоидальных выростов на талломической части и многочисленным отложением металла (Pb 200 мкг/л, 64-й день эксперимента); (г) – нарушение оси роста и образование двух главных ризоидов в среде с концентрацией металла 100 мкг/л (17-й день эксперимента); (д) – нарушение оси роста и формирование двух талломических зон (среда Pb 100 мкг/л, 9-й день эксперимента); (е–ж) – внутриклеточное отложение свинца (отмечены стрелками) в ризоидальной части проростков (е – среда 100 мкг/л, ж – среда 60 мкг/л); (з) – отложение свинца в клеточных стенках талломической части проростков (среда Pb 200 мкг/л, 17-й день эксперимента). Масштабная линейка: (а–г) – 100 мкм, (д–з) – 50 мкм.

Отложения свинца в проростках фукуса выявлены при всех испытуемых вариантах концентраций (60, 100 и 200 мкг/л). В ризоидальной зоне они, как правило, были обособлены от внутриклеточного содержимого и имели темно-красный цвет. Их размеры варьировали в широких пределах от едва заметных гранул до занимающих большую часть сегмента ризоида везикул – 20 мкм (рис. 6а, е–ж). В талломической части проростков отложения формировались в клеточной стенке и были отмечены только при самой максимальной концентрации свинца в среде, 200 мкг/л (рис. 6з). Их размеры всегда были меньше (не превышали 5 мкм), чем аналогичные образования в ризоидах.
Отложения кадмия в проростках фукуса, также как и свинца, были выявлены в их ризоидальной и талломической частях (рис. 7). Везикулы с металлом формировались практически в каждом сегменте ризоида при концентрации выше 100 мкг/л. Наиболее крупные из них достигали 15 мкм в поперечнике. В пластине гранулы кадмия формировались внутри клеток. Дополнительно отметим, что при всех концентрациях кадмия в среде выше 60 мкг/л развитие гиалиновых волосков у проростков не происходило. К концу эксперимента у водорослей в группе, культивируемой в среде с Cd 200 мкг/л, были заметны некротические процессы (разрушение пигментного аппарата, появление крупных вакуолей в талломической части, нарушение целостности клеток).
ОБСУЖДЕНИЕ
Исследования воздействия ТМ на морские бурые водоросли в условиях лабораторного эксперимента начали проводить еще во второй половине прошлого века на представителях родов Ascophyllum, Fucus, Pelvetia, Padina, Sargassum [25–28]. Позже в исследованиях стали использовать виды ламинариевых водорослей Saccharina, Macrocystis и Undaria [29, 30].
Механизм воздействия ТМ на бурые водоросли в целом достаточно изучен. Известно, что их аккумуляция водорослями может происходить двумя путями. Первый из них связан с адсорбцией металлов на поверхности клеток за счет их электростатических взаимодействий с отрицательно заряженными компонентами клеточной оболочки [31–33]. Считается, что это один из важнейших механизмов устойчивости живых организмов к токсичному воздействию металлов, поскольку их ионы не проникают внутрь клеток [31]. В то же время этот механизм зависит от условий окружающей среды.
Второй механизм связан с транспортом ионов металлов через плазматическую мембрану в цитоплазму клеток водорослей, биоаккумуляционная способность которых зависит от их метаболической активности [34]. После проникновения ионов металлов внутрь клетки они могут негативно влиять на функционирование всего организма. Это связано, во-первых, с замещением эссенциальных металлов в ферментативных системах; во-вторых, с блокированием функциональных групп в молекулах и, в-третьих, с изменением их структуры, что, в конечном счете, приводит к резкому снижению скорости роста и нередко гибели клеток [35, 36]. Детоксикация ТМ внутри клеток направлена на их трансформацию в нейтральные формы (связывание с пептидами или другими соединениями) и дальнейшее обособление в везикулах или активный транспорт во внешнюю среду [31].
Однако, несмотря на общий механизм воздействия ТМ на клетки водорослей, разные виды имеют различные диапазоны устойчивости. Так, в лабораторных экспериментах добавление солей меди в культуральную среду приводило к видоспецифичным реакциям у пельвеции и трех видов фукуса [26]. Существенное отставание в росте было выявлено у Pelvetia canaliculata и Fucus spiralis уже при концентрации меди 12 мкг/л, в то время как у F. vesiculosus замедление в развитии отмечалось только при 50 мкг/л [26].
В проведенных нами экспериментах концентрации Pb выше 100 мкг/л и Cd выше 60 мкг/л в среде в условиях низкой температуры (7°С) и короткого светового дня (фотопериод 8 : 16 ч) были близки к летальным для ранних стадий развития F. distichus. Однако минимальные концентрации этих металлов (10 и 20 мкг/л) в культуре оказывали стимулирующий или нейтральный эффект на рост проростков (рис. 1). Подобные результаты были отмечены при выращивании Hizikia fusiformis и Porphyra haitensis в средах с добавлением меди и кадмия в концентрациях до 0.025 и 2 мкг/л соответственно [37, 38].
В наших экспериментах концентрации свинца и кадмия выше 60 мкг/л отрицательно влияли на ранний морфогенез проростков F. distichus. При высоком содержании металлов в культивируемой среде у водорослей наблюдалось аномальное развитие ризоидальной зоны, нарушение формирования оси роста эмбрионов и образование вне- и внутриклеточных отложений свинца и кадмия в ювенильных талломах. После длительной экспозиции проростков фукуса в средах с содержанием Pb и Cd в диапазоне 60–200 мкг/л восстановление скорости роста и морфогенеза не происходило. Вероятно, это связано с необратимыми физиологическими и морфологическими изменениями в водорослях, обусловленными воздействием ТМ на формирование клеточной стенки [39].
Полученные данные о росте и морфогенезе ранних стадий развития бурой водоросли F. distichus в искусственной среде с повышенным содержанием Pb и Cd позволили оценить диапазон ее толерантности к этим загрязнителям. Выявленные особенности в накоплении металлов в разных частях проростков и одновременно высокая устойчивость к длительному воздействию солей Pb и Cd позволяет рекомендовать этот вид в качестве биофильтра для связывания и удержания токсичных элементов сточных вод. В дальнейшем полученные результаты можно применять при организации санитарной марикультуры в районах с хроническим загрязнением среды ТМ. Дополнительно отметим, учитывая, что в результате урбанизации и индустриализации береговой зоны концентрация токсичных металлов в морской среде повышается, то контролю их содержания в промысловых водорослях и других гидробионтах должно уделяться все большее внимание.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Duce R.A., Liss P.S., Merrill J.T., Atlas E.L., Buat-Menard P., Hicks B.B., Miller J.M., Prospero J.M., Arimoto R., Church T.M., Ellis W., Galloway J.N., Hansen L., Jickells T.D., Knap A.H. et al. The atmospheric input of trace species to the world ocean // Global Biogeochem. Cycles. 1991. V. 5. P. 193.
Walker C.H., Sibly R.M., Hopkins S.P., Peakall D.B. Principles of ecotoxicology. Portland: CRC Press (Taylor and Francis), 2012. 386 p.
Wang S.-L., Xu X.-R., Sun Y.-X., Liu J.-L., Li H.-B. Heavy metal pollution in coastal areas of South China: a review // Mar. Pollut. Bull. 2013. V. 76. P. 7.
Contreras-Porcia L., Meynard A., Lopez-Cristoffanini C., Latorre N., Kumar M. Marine metal pollution and effects on seaweed species // Systems Biology of Marine Ecosystems / Eds. M. Krumar, P. Ralph. Switzerland: Springer International Publishing, 2017. P. 35.
Nor Y.M. Ecotoxicity of copper to aquatic organisms: a review // Environ. Res. 1987. V. 43. P. 274.
Nagajyoti P.C., Lee K.D., Sreekanth T.V.M. Heavy metals, occurrence and toxicity for plants: a review // Environ. Chem. Lett. 2010. V. 8. P. 199.
Blaby-Haas C.E., Merchant S.S. Regulating cellular trace metal economy in algae // Curr. Opin. Plant Biol. 2017. V. 39. P. 88.
Iluz D., Fermani S., Ramot M., Reggi M., Caroselli E., Prada F., Dubinsky Z., Goffredo S., Falini G. Calcifying response and recovery potential of the brown alga Padina pavonica under ocean acidification // ACS Earth Space Chem. 2017. V. 1. P. 316.
Nikinmaa M. Climate change and ocean acidification-interactions with aquatic toxicology // Aquat Toxicol. 2013 V. 126. P. 365.
Gao G., Liu Y., Li X., Feng Z., Xu Z., Wu H., Xu J. Expected CO2-induced ocean acidification modulates copper toxicity in the green tide alga Ulva prolifera // Environ. Exp. Bot. V. 135. P. 63.
Wang W.-X., Dei R.C.H. Metal uptake in a coastal diatom influenced by major nutrients (N, P, and Si) // Water Res. 2001. V. 35. P. 315.
Lambers H., Chapin F.S., Pons T.L. Plant Physiological Ecology. New York: Springer, 2008. 605 p.
Sales M., Cebrian E., Tomas F., Ballesteros E. Pollution impacts and recovery potential in three species of the genus Cystoseira (Fucales, Heterokontophyta) // Estuarine, Coastal Shelf Sci. 2011. V. 92. P. 347. https://doi.org/10.1016/j.ecss.2011.01.008
Sanchez-Quiles D., Marbà N., Tovar-Sanchez A. Trace metal accumulation in marine macrophytes: Hotspots of coastal contamination worldwide // Sci. Total Environ. 2017. V. 576. P. 520.
Chakraborty S., Bhattacharya T., Singh G., Maity J.P. Benthic macroalgae as biological indicators of heavy metal pollution in the marine environments: a biomonitoring approach for pollution assessment // Ecotoxicol. Environ. Saf. 2014. V. 100. P. 61.
Garcia-Seoane R., Fernandez J.A., Villares R., Aboal J.R. Use of macroalgae to biomonitor pollutants in coastal waters: Optimization of the methodology // Ecol. Indic. 2018. V. 84. P. 710.
Клочкова Н.Г., Березовская В.А. Макрофитобентос Авачинской губы и его антропогенная деструкция. Владивосток: Дальнаука, 2001. 205 с.
Kashutin A.N., Klimova A.V., Klochkova N.G. The seasonal growth dynamics of Fucus distichus subsp. evanescens (C. Agardh) H.T. Powell, 1957 (Phaeophyceae: Fucales) in the Avacha bay (southeastern Kamchatka) // Russ. J. Mar. Biol. 2019. V. 45. P. 275.
Motomura T. Electron and immunofluorescence microscopy on the fertilization of Fucus distichus (Fucales, Phaeophyceae) // Protoplasma. 1994. V. 178. P. 97.
Klimova A.V., Kashutin A.N. Early development of the brown alga Fucus evanescens (Phaeophyceae, Fucales) from southeast Kamchatka under laboratory-controlled conditions // Vestn. Kamchatskogo Gos. Tekh. Univ. 2016. V. 37. P. 50.
Klochkova T.A., Kang S.-H., Cho G.Y., Pueschel C.M., West J.A., Kim G.H. Biology of a terrestrial green alga, Chlorococcum sp. (Chlorococcales, Chlorophyta), collected from the Miruksazi stupa in Korea // Phycologia. V. 45. P. 349.
Яниславский В.В., Климова А.В., Клочкова Н.Г. Влияние солей свинца и кадмия на морфогенез проростков Fucus distichus subsp. evanescens на стадии формирования кладомного таллома // Материалы X Национальной всероссийской научно-практической конференции “Природные ресурсы, их современное состояние, охрана, промысловое и техническое использование”. Петропавловск-Камчатский, 2019. С. 144.
Hunt R. Basic Growth Analysis. Dordrecht: Springer, 1990. 112 p. https://doi.org/10.1007/978-94-010-9117-6_2
Klimova A.V., Kashutin A.N., Klochkova T.A. Development of germlings of Fucus distichus subsp. evanescens (Phaeophyceae, Fucales) under changing conditions of salinity, temperature and photoperiod // Vestn. Kamchatskogo Gos. Tekh. Univ. 2019. V. 49. P. 65.
Stromgren T. The effect of zinc on the increase length of five species of intertidal fucales // J. Exp. Mar. Biol. Ecol. 1979. V. 40. P. 95.
Stromgren T. The effects of dissolved copper on the increase in length of four species of intetidal fucoid algae // Mar. Envrion. Res. 1980. V. 3. P. 5.
Amado Filho G. M., Karez C. S., Andrade L. R., Yoneshigue-Valentin Y., Pfeiffer W. C. Effects on growth and accumulation of zinc in six seaweed species // Ecotoxicol. Environ. Saf. 1997. V. 3. P. 223.
Gledhill M., Nimmo M., Hill S.J. The release of copper-complexing ligands by the brown alga Fucus vesiculosus (Phaeophyceae) in response to increasing total copper levels // J. Phycol. 1999. V. 35. P. 501.
Chung I.K., Brinkhuis B.H. Copper effects in early stages of the kelp, Laminaria saccharina // Mar. Pollut. Bull. 1986. V. 17. P. 213.
Leal P.P., Hurd C.L., Sander S.G., Kortner B., Roleda M.Y. Exposure to chronic and high dissolved copper concentrations impedes meiospore development of the kelps Macrocystis pyrifera and Undaria pinnatifida (Ochrophyta) // Phycologia. 2015. V. 55. P. 12.
Priyadarshini E., Priyadarshini S.S., Pradhan N. Heavy metal resistance in algae and its application for metal nanoparticle synthesis // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 3297. https://doi.org/10.1007/s00253-019-09685-3
Remacle J. The cell wall and metal binding // Biosorption of heavy metals / Eds. B. Volesky. Boca Ranton: CRC Press, 1990. P. 83.
Volesky B., Holan Z. Biosorption of heavy metals // Biotechnol. Progr. 1995. V. 11. P. 235
Ahalya N., Ramachandra T., Kanamadi R. Biosorption of heavy metals // Res. J. Chem. Environ. 2003. V. 7. P. 71.
Bong C.W., Alfatti F.M., Zam F.A., Obayashi Y., Suzuki S. The effect of zinc exposure on the bacteria abundance and proteolytic activity in seawater // Interdisciplinary Studies on Environmental Chemistry – Biological Responses to Contaminants / Eds. N. Hamamura et al. Tokyo: TERRAPUB, 2010. P. 57.
Fourest E., Volesky B. Alginate Properties and Heavy Metal Biosorption by Marine Algae // Appl. Biochem. Biotechnol., Part A. 1997. V. 67. P. 215.
Zhu X., Zou D., Du H. Physiological responses of Hizikia fusiformis to copper and cadmium exposure // Bot. Mar. 2011. V. 54. P. 431. https://doi.org/10.1515/BOT.2011.054
Zhu X., Zou D., Huang Y., Cao J., Sun Y., Chen B., Chen X. Physiological responses of Porphyra haitanensis (Rhodophyta) to copper and cadmium exposure // Bot. Mar. 2017. V. 60. P.27. https://doi.org/10.1515/bot-2016-0117
Bond P.R., Brown M.T., Moate R.M., Gledhill M., Hill S.J., Nimmo M. Arrested development in Fucus spiralis (Phaeophyceae) // Eur. J. Phycol. 1999. V. 34. P. 513.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений