Физиология растений, 2022, T. 69, № 4, стр. 417-426
Характеристика вакуолярных включений в клетках зеленой микроводоросли Coelastrella rubescens NAMSU R1 на свету низкой и высокой интенсивности
А. А. Зайцева a, *, П. А. Зайцев a, b, О. А. Горелова a, Д. А. Бахарева a, Е. С. Лобакова a, c
a Биологический факультет Московского государственного университета имени М.В. Ломоносова
Москва, Россия
b Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр
химической физики им. Н. Н. Семенова Российской академии наук
Москва, Россия
c Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К. А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: annakublanovskaya@gmail.com
Поступила в редакцию 09.12.2021
После доработки 15.12.2021
Принята к публикации 16.12.2021
- EDN: OKCUCK
- DOI: 10.31857/S0015330322040224
Аннотация
Coelastrella rubescens Kaufnerová & Eliás (Chlorophyceae) – зеленая одноклеточная водоросль, обитающая в наземно-воздушной среде. В условиях стресса ее клетки переходят в состояние, характеризующееся низкой фотосинтетической активностью, высоким содержанием резервных липидов и вторичных каротиноидов. Впервые проведен сравнительный морфологический, ультраструктурный и элементный анализ вакуолярных включений у штамма C. rubescens NAMSU R1 при культивировании на минеральной среде в условиях низкой и высокой (вызывающей стресс) интенсивности освещения. Клетки микроводоросли, окрашенные флуоресцентным красителем DAPI, обнаруживали признаки присутствия полифосфатов. Методом поляризационной микроскопии в клетках C. rubescens выявлены структуры, способные преломлять поляризованный свет, что характерно для кристаллов. Анализ клеток C. rubescens методом просвечивающей электронной микроскопии (ПЭМ) выявил наличие разнообразных вакуолей с гетерогенным содержимым (аутофагические тела, кристаллоиды и округлые глобулы неоднородной электронной плотности). За исключением аутофагических тел, отмеченных в клетках только на ярком свету, данные включения были характерны для клеток микроводоросли независимо от интенсивности освещения. Методом ПЭМ в сочетании с энергодисперсионной рентгеновской спектроскопией охарактеризован элементный состав вакуолярных включений: установлено преобладающее содержание в них азота, фосфора или обоих элементов одновременно. Обсуждается потенциальная физиологическая роль вакуолярных включений C. rubescens.
ВВЕДЕНИЕ
Одноклеточные зеленые водоросли рода Coelastrella (Chlorophyceae, Sphaeropleales) являются типичными обитателями наземно-воздушной среды. Они встречаются как компонент обрастаний камней, зданий и коры деревьев; широко распространены в умеренных и полярных широтах, в высокогорных районах [1–5]. Наземно-воздушная среда характеризуется сочетанием целого ряда экологических факторов, которые являются стрессовыми для фотосинтезирующих микроорганизмов, таких как высокий уровень инсоляции, резкие колебания влажности и температуры, дефицит минерального питания [6]. Поэтому они имеют обширный арсенал адаптаций к неблагоприятным условиям. Среди них можно выделить накопление соединений-светофильтров, экранирующих излучение в видимом и УФ-диапазоне (каротиноиды, микоспорин-подобные аминокислоты и т.д.) [7–10], системы репарации ДНК [7], ферменты элиминации активных форм кислорода [7], эффективное нефотохимическое тушение возбужденных состояний хлорофилла [10, 11], обратимую редукцию фотосинтетического аппарата [11, 12].
Coelastrella rubescens является типичным представителем рода Coelastrella [1]. В ряде работ она рассматривается как продуцент астаксантина [13, 14] – каротиноида, имеющего большое практическое значение. Он является компонентом различных косметических средств, функционального питания, кормов для рыб и ракообразных в аквакультуре [15]. Астаксантин накапливается в клетках микроводоросли в качестве вторичного каротиноида, т.е. структурно и функционально не связанного с фотосинтетическим аппаратом. Для штамма NAMSU R1, исследуемого в данной работе, показано накопление смеси каротиноидов – астаксантина и β-каротина при стрессе [9]. Это обстоятельство делает исследования C. rubescens, в частности штамма NAMSU R1, актуальными.
Вакуоль – специфический компартмент растительных клеток, характеризующийся разнообразием как по составу находящихся в нем компонентов, так и выполняемым функциям. В них может происходить запасание биогенных элементов и (или) депонирование конечных продуктов метаболизма. Вакуоли могут содержать включения разной природы, такие как оксалаты, полифосфаты [16–19], производные пуриновых нуклеотидов [17, 20, 21].
Особое место в функционировании клетки водоросли занимают вакуоли, вовлеченные в процесс аутофагии, селективной изоляции и деградации поврежденных или аномально фолдированных молекул и органелл, а также компонентов последних [11, 22]. Аутофагия играет важную роль в акклимации фотоавтотрофов к неблагоприятным условиям [11, 23, 24]. Ранее в клетках C. rubescens были описаны вакуоли, содержащие фрагменты хлоропласта, и сливающиеся с ними аутофагосомы [9]. Кроме того, в вакуолях C. rubescens обнаруживали включения различной структуры и электронной плотности, предположительно различной химической природы.
Цель работы – исследование локализации, структуры и элементного состава вакуолярных включений зеленой микроводоросли C. rubescens штамма NAMSU R1.
МАТЕРИАЛЫ И МЕТОДЫ
Штамм и условия культивирования
Штамм NAMSU R1 зеленой микроводоросли Сoelastrella rubescens Kaufnerová & Eliás был выделен и описан ранее [9]. Выращивание культуры проводили в периодическом режиме на среде BG-11 [25] и при постоянном освещении люминесцентными лампами с холодным белым светом 40 мкмоль фотонов/(м2 с) ФАР (далее обозначали как “низкая интенсивность света”), температуре 24°C и постоянном перемешивании 85 об./мин в шейкере-инкубаторе New Brunswick Innova 44 (“Eppendorf”, Германия) в течение 15 сут. На протяжении этого периода каждые 1–2 дня проводили отбор проб для регистрации кривой роста. Измерение сухой массы проводили гравиметрически согласно [26]. По достижении культуры стационарной фазы роста суспензию делили на две равные части, из которых одну продолжали инкубировать в тех же условиях без перемешивания. Другую часть суспензии инкубировали при высокой интенсивности света, вызывающей стресс (150 мкмоль фотонов/(м2 с) ФАР). Общий срок инкубации составил 36 сут.
Световая микроскопия
Наличие включений в клетках детектировали методами оптической микроскопии. Окрашивание полифосфатов в клетках проводили с помощью раствора флуоресцентного красителя 4',6-диамидино-2-фенилиндола (4′,6-diamidino-2-phenylindole, DAPI) в диметилсульфоксиде, концентрация 1 мг/мл. 10 мкл исходного раствора DAPI добавляли к 90 мкл суспензии клеток и инкубировали 20 мин в темноте. Визуализацию флуоресценции полифосфатов осуществляли на микроскопе Leica DM2500 (“Leica Microsystems”, Германия) с фотокамерой Leica DFC700T. Флуоресценцию возбуждали излучением УФ-лампы HXP 120 (“Leica Microsystems”, Германия), оснащенной фильтром D того же производителя, в диапазоне 355–425 нм. Эмиссию флуоресценции детектировали в диапазоне 455–700 нм. Визуализацию кристаллических включений в клетках проводили на микроскопе Leica DM2500 с фотокамерой Leica DFC495 в поляризованном свете при скрещивании поляризатора и анализатора под углом 90°.
Просвечивающая электронная микроскопия (ПЭМ)
Ультраструктуру клеток и элементный состав клеточных включений изучали методами традиционной просвечивающей электронной микроскопии (ПЭМ) и аналитической ПЭМ, соответственно. Фиксация и обезвоживание клеток были выполнены согласно протоколу, описанному в статье Gorelova с соавт. [27]. Клетки сначала были зафиксированы в 2% (по объему) растворе глутарового альдегида, приготовленного на 0.1 мМ буфере какодилата натрия (pH 7.4), при комнатной температуре в течение получаса. Далее была проведена пост-фиксация клеток в 1% (по массе) растворе тетраокисида осмия, приготовленного на том же буфере, в течение 4 ч. Образцы были заключены в эпоксидную смесь Araldite (“Sigma-Aldrich”, США). Для изучения ультраструктуры клеток и элементного состава клеточных включений были приготовлены ультратонкие срезы и полутонкие срезы, соответственно. Приготовление срезов проводили с помощью ультратома Leica EM UC7 (“Leica Microsystems”, Германия) и алмазного ножа Ultra 45° (“DiATOME”, Швейцария). Срезы были смонтированы на медные сеточки для электронной микроскопии с ультратонкой подложкой из формвара (“Ted Pella”, США).
Для изучения ультраструктуры методом ПЭМ срезы дополнительно были контрастированы раствором цитрата свинца [28]. Изображения были получены на электронных микроскопах JEM-1011 и JEM-1400 (“JEOL”, Япония). Измерение размеров клеточных структур проводилось по изображениям ПЭМ, полученным на ультратонких срезах, в программе Fiji (ImageJ) v. 20200708-1553 (“NIH”, США).
Элементный анализ включений методом аналитической ПЭМ проводили с помощью энергодисперсионной рентгеновской спектроскопии (ЭДРС), как описано ранее [16], на электронном микроскопе JEOL-2100 (“JEOL”, Япония), оснащенном светлопольным детектором для работы в режиме сканирующей ПЭМ (СПЭМ) (“JEOL”, Япония) и рентгеновским детектором X-Max (“Oxford Instruments”, Великобритания). Для каждого образца были получены спектры из точечных участков минимум десяти клеток. Спектры были обработаны в программе INKA (“Oxford instruments”, Великобритания) и представлены в диапазоне 0.1–4 кэВ.
РЕЗУЛЬТАТЫ
Морфологические особенности штамма
При низкой интенсивности света культура микроводоросли С. rubescens NAMSU R1 представлена одиночными коккоидными клетками и аутоспорангиями диаметром 10–15 мкм, окрашенными в ярко-зеленый цвет (рис. 1а; 2а). На свету высокой интенсивности клетки приобретали оранжевую окраску, что свидетельствует о накоплении в клетках вторичных каротиноидов (рис. 1в; 2в). Как в стандартных, так и в стрессовых условиях были отмечены аутоспорангии с аутоспорами (рис. 1). На 12-е сутки роста культура достигала стационарной фазы (рис. 2).
Рис. 1.
Визуализация включений полифосфатов после окрашивания DAPI в клетках C. rubescens NAMSU R1 при освещении светом низкой (а, б) и высокой (в, г) интенсивности; а, в – светлопольная микроскопия, б, г – флуоресцентная микроскопия. Свечение хлорофилла имеет красный оттенок, окрашенных полифосфатов – желто-зеленый. Стрелками указаны полифосфатные включения. Длина масштабного отрезка соответствует 2 мкм.

Визуализация клеточных включений с помощью световой микроскопии
В клетках штамма С. rubescens NAMSU R1, культивируемых при обоих вариантах интенсивности потока ФАР, с помощью световой микроскопии (рис. 1) были обнаружены различные включения. В клетках, культивируемых на свету низкой интенсивности, отмечены немногочисленные округлые структуры диаметром 0.1–1.3 мкм (рис. 1а, б). В клетках, культивируемых на свету высокой интенсивности, наблюдали аналогичные включения (рис. 1в, г). Для установления потенциальной химической природы включений клетки окрашивали DAPI – красителем, имеющим сродство к ряду клеточных компонентов, в частности, к полифосфатам. В обоих вариантах эксперимента в цитоплазме клеток наблюдали характерную для гранул полифосфатов флуоресценцию в желто-зеленой области спектра. Полученные данные свидетельствовали о накоплении клетками С. rubescens резервов неорганического фосфора в виде полифосфатов на свету как низкой, так и высокой интенсивности.
Помимо этого, в клетках микроводоросли были обнаружены включения, не обладавшие характерной для полифосфатов флуоресценцией после окрашивания DAPI (рис. 1). Применение поляризационной микроскопии позволило визуализировать данные клеточные структуры, дающие яркий сигнал поляризованного света (рис. 3). По визуальной оценке, в культивируемых на свету низкой интенсивности клетках встречаемость и обилие кристаллов были выше, чем в клетках, культивируемых на свету высокой интенсивности.
Рис. 3.
Визуализация кристаллических структур с помощью поляризационной микроскопии в клетках C. rubescens NAMSU R1 при освещении светом низкой (а, б) и высокой (в, г) интенсивности; а, в – светлопольная микроскопия, б, г – поляризационная микроскопия. Кристаллы в клетках видны как включения голубовато-зеленого цвета. Длина масштабного отрезка соответствует 10 мкм.

Ультраструктурные особенности вакуолярных включений
Клетки C. rubescens NAMSU R1, культивируемые на свету низкой интенсивности, имели сравнительно хорошо развитый фотосинтетический аппарат, представленный хлоропластом (рис. 4а), содержавшим один (реже два) пиреноид и крахмальные зерна. В клетках также присутствовало одно ядро и вакуоли с различным содержимым. У клеток, культивируемых на свету высокой интенсивности, фотосинтетический аппарат был развит слабее (рис. 5а). Существенную долю площади на срезах таких клеток занимали липидные включения низкой электронной плотности (олеосомы).
Рис. 4.
Разнообразие вакуолярных включений в клетках C. rubescens NAMSU R1, выращенных на свету низкой интенсивности: а – общий вид клеток, б–е – изображения вакуолей с включениями разной структуры; а, г–е – ультратонкие срезы, б, в – полутонкие срезы. В – вакуоли, Ос – олеосомы, П – пиреноид, Хл – хлоропласт, Я – ядро. Масштабные отрезки: 100 нм – д, 200 нм – б, в, е, 500 нм – а.

Рис. 5.
Разнообразие вакуолярных включений в клетках C. rubescens NAMSU R1, выращенных на свету высокой интенсивности: а – общий вид клеток, б–е – изображения вакуолей с включениями разной структуры; а, б, г–е – ультратонкие срезы, в – полутонкий срез. В – вакуоли, Ос – олеосомы, Хл – хлоропласт, Я – ядро. Масштабные отрезки: 100 нм – г, е, 200 нм – б, в, д, 500 – а.

У клеток и аутоспор в спорангиях в случае культивирования на свету как низкой (рис. 4), так и высокой (рис. 4) интенсивности были выявлены вакуоли с разнообразными по ультраструктуре, упаковке и электронной плотности включениями. В первом случае отмечены занимающие основную часть площади вакуоли округлые глобулы размером 0.1–1.3 мкм с материалом равномерно высокой электронной плотности или аналогичные глобулы с погруженными в них угловатыми менее электронно-плотными пластинчатыми структурами, морфологически сходными с кристаллами (рис. 4а). В некоторых вакуолях такие включения доминировали, имея мелкие (рис. 4б) или более крупные размеры (рис. 4в). Были отмечены также включения, сочетавшие в разных пропорциях участки пластинчатых структур и упорядоченные области с чередованием электронно-плотных и электронно-прозрачных полос равной ширины 4.1 ± 0.2 нм, а также хаотично распределенными гранулами (рис. 4г, д). Также встречали вакуоли с электронно-плотными гранулами разных размеров, где отсутствовали кристаллоподобные структуры (рис. 4е).
Исследование клеток C. rubescens NAMSU R1, культивировавшихся на свету высокой интенсивности (рис. 4а), показало наличие вакуолей с включениями, сходными с теми, что были обнаружены в клетках, которые культивировали на свету низкой интенсивности. В частности, отмечены вакуоли, содержавшие пластинчатые кристаллоподобные структуры (рис. 5а, б, в), вакуоли, в которых, кроме таких включений, были образования, характеризовавшиеся чередованиями полос низкой и высокой электронной плотности (рис. 5г, д), а в ряде случаев еще и глобулы небольшого размера (от 15 до 50 нм) с повышенной электронной плотностью (рис. 5д, е). Отличительной особенностью неоднородного содержимого вакуолей в клетках, выращенных на свету высокой интенсивности, было обнаружение аутофагических тел (рис. 5а, б, г).
Анализ элементного состава обнаруженных вакуолярных включений
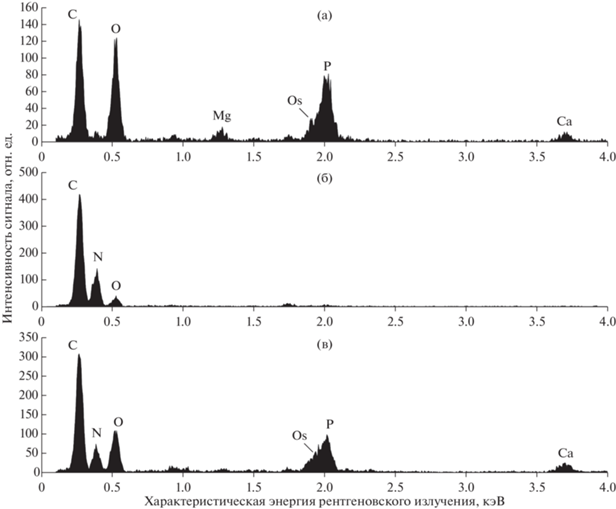
Исследование клеток C. rubescens NAMSU R1, культивировавшихся на свету разной интенсивности, выявило наличие вакуолярных включений разного типа. На рисунке 6 приведены репрезентативные спектры для вакуолярных структур, характеризовавшихся содержанием преимущественно фосфора (P) (характеристическая энергия рентгеновского излучения — 2.013 кэВ) (рис. 6а), азота (N) (0.392 кэВ) (рис. 6б), а также совместным присутствием данных химических элементов (рис. 6в). Спектры фосфор-содержащих включений также включали пики магния (Mg) (1.253 кэВ) и кальция (Ca) (основной сигнал при 3.690 кэВ) (рис. 6а), тогда как в спектрах включений смешанного типа присутствовал только пик Ca (рис. 6в). На спектрах как фосфор-содержащих включений, так и включений смешанного типа пик P частично перекрывался с пиком осмия (Os). Тетраоксид осмия использовали при фиксации образцов (см. МАТЕРИАЛЫ И МЕТОДЫ). Спектры с преимущественным содержанием P (рис. 6а) соответствовали включениям высокой электронной плотности, а именно крупным вакуолярным глобулам в клетках на свету низкой интенсивности (рис. 4а); глобулам меньших размеров в смешанных включениях (рис. 4е; 5е), а также участкам включений с чередованием полос высокой и низкой электронной плотности (рис. 4г, д; 5д, е) на свету обоих уровней освещения. Спектры, соответствующие высокому содержанию N (рис. 6б), были характерны для включений кристаллического вида, отмеченных для обоих условий культивирования (рис. 4а–д; 5). При этом точечные спектры рентгеновского излучения, содержащие пики N и P (рис. 6в), были получены от клеточных включений смешанного типа в области границ более электронно-плотных P-содержащих структур и менее электронно-плотных (в случае ультратонких срезов) N-содержащих кристаллов (рис. 4б, г, д; 5б, д, е).
ОБСУЖДЕНИЕ
В целом, особенности морфологии и ультраструктуры клеток C. rubescens NAMSU R1 в описанных условиях культивирования были сходны с таковыми для представителей рода Coelastrella [1, 3, 9, 13, 14]. В случае культивирования на свету низкой интенсивности клетки демонстрировали особенности, характерные для культуры с активным метаболизмом: развитый фотосинтетический аппарат и наличие большого числа делящихся клеток. Ранее было показано, что повышение интенсивности света до 150 мкмоль фотонов/(м2 с) (обозначен в настоящей работе как свет высокой интенсивности) приводило к снижению максимальной фотохимической эффективности ФСII, редукции фотосинтетического аппарата и появлению в спектрах поглощения деталей вторичных каротиноидов [9]. Это является типичным ответом микроводорослей наземно-воздушной среды обитания на стрессовое воздействие [6, 29]. Косвенным указанием на то, что клетки C. rubescens NAMSU R1, культивируемые на свету высокой интенсивности, находились в состоянии стресса, является то, что они имели характерную оранжевую окраску, свидетельствующую о накоплении вторичных каротиноидов.
Независимо от интенсивности света, исследование культуры C. rubescens NAMSU R1 с использованием совокупности методов микроскопии выявило наличие вакуолярных включений разной структуры и химического состава. В частности, были отмечены вакуолярные включения, аккумулировавшие преимущественно один из элементов – P или N – так и включения, обогащенные обоими этими элементами.
Согласно результатам стандартной и аналитической ПЭМ, в клетках, культивируемых на свету высокой интенсивности, не было отмечено крупных включений, содержащих преимущественно P. При этом точечные спектры в области электронно-плотных участков гетерогенных включений имели вид, типичный для обогащенных фосфором структур, идентифицированных как полифосфаты [16]. Вакуолярные структуры, представленные чередующимися полосами с высокой и низкой электронной плотностью, и характеризующиеся пиком P на ЭДРС-спектрах, по-видимому, организованы по ранее описанному типу “многожильного кабеля”, предложенного для полифосфатных включений [16, 17]. Накопление резерва P в такой форме известно для многих микроводорослей [16, 17, 30, 31]. Формирование полифосфатов может происходить в разных условиях доступности данного элемента в среде как при его недостатке, так и при избытке (в результате избыточного поглощения P) [30–33].
В клетках, инкубированных на свету низкой и высокой интенсивности, были отмечены вакуолярные включения, содержавшие преимущественно N и имевшие кристаллическую структуру (рис. 2). Известно, что резерв данного биогенного элемента в клетках микроводорослей может быть представлен различными производными пуриновых оснований, такими как микрокристаллические включения мочевой кислоты [34] или гуанина [20, 21]. В последние годы растет интерес к депонированию N в клетках эукариотических микроводорослей в форме кристаллов пуриновых оснований. При этом такая форма запасания N обнаруживается у разных таксономических групп микроводорослей [20, 21]. В данной работе кристаллы с высоким содержанием N в составе вакуолярных включений впервые обнаружены у Coelastrella. Среди представителей семейства Scenedesmaceae, к которому принадлежит данный род, отмечено формирование N-содержащих кристаллов в клетках микроводорослей родов Desmodesmus, Tetradesmus [16, 18–21]. При этом показано, что формирование данных вакуолярных включений происходит в условиях достаточного или избыточного содержания N в среде для последующего использования в условиях недостатка данного элемента [16, 19, 21]. В настоящей работе отмечено формирование N-содержащих кристаллов в условиях поздней стационарной фазы роста культуры C. rubescens при разной интенсивности света. Поскольку во время периода культивирования, предшествовавшего переносу биомассы клеток в условия разного уровня освещенности, зафиксирован прирост биомассы менее чем в 2 раза, то можно предположить наличие избыточного содержания нутриентов в среде ввиду низкой плотности клеток. Избыточное поглощение из среды нитратов и фосфатов могло бы быть токсичным для клеток без превращения их в слаборастворимые соединения, депонированные в изолирующем их компартменте (вакуоли). Кроме того, предполагается, что гуаниновые кристаллы обладают более широким спектром функций, чем депо N, в частности, модуляцией интенсивности и спектрального состава света, доступного для фотосинтеза [21].
Среди представителей рода Coelastrella известны каротиногенные микроводоросли [3, 13, 14], способные накапливать высокие количества вторичных каротиноидов [15]. Ранее для другой каротиногенной водоросли, Haematococcus lacustris (Gir.-Chantr.) Rostaf. (Volvocales, Chlorophyceae), было показано присутствие в вакуолях клеток округлых электронно-плотных включений [35]. Авторы цитируемой публикации предположили, что они соответствовали включениям астаксантина (англ. astaxanthin granules) и были вовлечены в метаболизм вторичных каротиноидов. Аналогичные по локализации, структуре и электронной плотности включения были обнаружены и у C. rubescens в настоящей работе. Однако на основании проведенного ПЭМ-ЭДРС анализа элементного состава можно заключить, что они являются скорее полифосфатами, чем каротиноидными включениями. Таким образом, можно сделать вывод о необходимости применения аналитической ПЭМ для характеристики вакуолярных включений и уточнения имеющихся представлений о природе отдельных типов внутриклеточных включений каротиногенных микроводорослей.
В данной работе охарактеризованы вакуоли, формирующиеся в клетках C. rubescens NAMSU R1, культивируемые в норме и при стрессе, вызванном светом высокой интенсивности. Показана полифункциональность этих органелл в связи с накоплением в них разных по структуре, функциям и элементному составу включений. Вероятно, вакуоли у данного вида микроводорослей участвуют в акклимации к неблагоприятным условиям внешней среды, т.е. играют роль “адаптивных органелл”. Такие органеллы обеспечивают внутриклеточный гомеостаз за счет формирования и расходования внутриклеточных резервов биогенных элементов, а также реализуют экстренные перестройки в клетке по механизму стресс-индуцированной аутофагии.
Авторы выражают благодарность сотрудникам биологического факультета МГУ имени М.В. Ломоносова: научному сотруднику, к.б.н. Д.А. Чудаеву за помощь в проведении поляризационной микроскопии, профессору, д.б.н. А. Е. Соловченко и ведущему научному сотруднику, к.б.н. К.А. Чеканову за критическое обсуждение полученных результатов и ценные замечания. Электронно-микроскопические исследования были проведены с использованием оборудования Центра коллективного пользования МГУ имени М.В. Ломоносова.
Работы по выращиванию культур микроводорослей и их физиолого-биохимической характеристике проводили при финансовой поддержке Мегагранта Правительства Российской Федерации (Соглашение № 075-15-2019-1882), работы по исследованию клеток с использованием сканирующей, трансмиссионной аналитической электронной микроскопии и энергодисперсионной рентгеновской спектроскопии были выполнены при поддержке гранта Президента Российской Федерации (№ МК-1952.2021.1.4).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Kaufnerová V., Eliáš M. The demise of the genus Scotiellopsis Vinatzer (Chlorophyta) // Nova Hedwigia. 2013. V. 97. P. 415. https://doi.org/10.1127/0029-5035/2013/0116
Скребовська С.В., Костіков І.Ю. Scotielleopsis levicostata (Chlorophyta) в системі Sсenedesmaceae // Чорноморський ботанічний журнал. 2012. Т. 8(4). С. 401.
Chekanov K., Fedorenko T., Kublanovskaya A., Litvinov D., Lobakova E. Diversity of carotenogenic microalgae in the White Sea polar region // FEMS Microbiol. Ecol. 2020. V. 96. P. 183. https://doi.org/10.1093/femsec/fiz183/5632105
Goecke F., Noda J., Paliocha M., Gislerød H. R. Revision of Coelastrella (Scenedesmaceae, Chlorophyta) and first register of this green coccoid microalga for continental Norway // World J. Microbiol. Biotechnol. 2020. V. 36. P. 1. https://doi.org/10.1007/s11274-020-02897-0
Stewart A., Rioux D., Boyer F., Gielly L., Pompanon F., Saillard A., Thuiller W., Valay J., Maréchal E., Coissac E. Altitudinal zonation of green algae biodiversity in the French Alps // Front. Recent Dev. Plant Sci. 2021. V. 12. P. 1066. https://doi.org/10.3389/fpls.2021.679428
Holzinger A., Karsten U. Desiccation stress and tolerance in green algae: consequences for ultrastructure, physiological and molecular mechanisms // Front. Plant Sci. 2013. V. 4. P. 327. https://doi.org/10.3389/fpls.2013.00327
Ugya A., Imam T., Li A., Ma J., Hua X. Antioxidant response mechanism of freshwater microalgae species to reactive oxygen species production: a mini review // Chem. Ecol. 2020. V. 36. P. 174. https://doi.org/10.1080/02757540.2019.1688308
Rastogi R.P., Sonani R.R., Incharoensakdi A., Madamwar D. Sun-screening biomolecules in microalgae: role in UV-photoprotection // UV-B radiation: from environmental stressor to regulator of plant growth / Eds. V.P. Singh, S. Singh, S.M. Prasad, P. Parihar. John Wiley & Sons Ltd. 2017. P. 197. https://doi.org/10.1002/9781119143611.ch11
Zaytseva A., Chekanov K., Zaytsev P., Bakhareva D., Gorelova O., Kochkin D., Lobakova E. Sunscreen effect exerted by secondary carotenoids and mycosporine-like amino acids in the aeroterrestrial Chlorophyte Coelastrella rubescens under high light and UV-A irradiation // Plants. 2021. V. 10. P. 2601. https://doi.org/10.3390/plants10122601
Chekanov K., Schastnaya E., Neverov K., Leu S., Boussiba S., Zarka A., Solovchenko A. Non-photochemical quenching in the cells of the carotenogenic chlorophyte Haematococcus lacustris under favorable conditions and under stress // BBA-General Subjects. 2019. V. 1863. P. 1429. https://doi.org/10.1016/j.bbagen.2019.05.002
Solovchenko A., Baulina O., Ptushenko O., Gorelova O. Ultrastructural patterns of photoacclimation and photodamage to photosynthetic algae cell under environmental stress // Physiol. Plant. 2019. V. 166. P. 251. https://doi.org/10.1111/ppl.12912
Chekanov K., Vasilieva S., Solovchenko A., Lobakova E. Reduction of photosynthetic apparatus plays a key role in survival of the microalga Haematococcus pluvialis (Chlorophyceae) at freezing temperatures // Photosynthetica. 2018. V. 56. P. 1268. https://doi.org/10.1007/s11099-018-0841-5
Minyuk G., Chelebieva E., Chubchikova I., Dantsyuk N., Drobetskaya I., Sakhon E., Chivkunova O., Chekanov K., Lobakova E., Sidorov R., Solovchenko A. pH and CO2 effects on Coelastrella (Scotiellopsis) rubescens growth and metabolism // Russ. J. Plant Physiol. 2016. V. 63. P. 566. https://doi.org/10.1134/S1021443716040105
Minyuk G., Chelebieva E., Chubchikova I., Dantsyuk N., Drobetskaya I., Sakhon E., Chekanov K., Solovchenko A. Stress-induced secondary carotenogenesis in Coelastrella rubescens (Scenedesmaceae, Chlorophyta), a producer of value-added keto-carotenoids // Algae. 2017. V. 32. P. 245. https://doi.org/10.4490/algae.2017.32.8.6
Liu C., Hu B., Cheng Y., Guo Y., Yao W., Qian H. Carotenoids from fungi and microalgae: A review on their recent production, extraction, and developments // Bioresour. Technol. 2021. V. 125398. https://doi.org/10.1016/j.biortech.2021.125398
Shebanova A., Ismagulova T., Solovchenko A., Baulina O., Lobakova E., Ivanova A., Moiseenko A., Shaitan K., Polshakov V., Nedbal L., Gorelova O. Versatility of the green microalga cell vacuole function as revealed by analytical transmission electron microscopy // Protoplasma. 2017. V. 254. P. 1323. https://doi.org/10.1007/s00709-016-1024-5
Пугачева Т.Т. Мониторинг формирования, субклеточного распределения и расходования резервов фосфора и азота в фототрофных микроорганизмах методами аналитической просвечивающей электронной микроскопии. Дисс. … канд. биол. наук. Москва: МГУ имени М.В. Ломоносова, 2019. 209 с.
Ismagulova T., Chekanov K., Gorelova O., Baulina O., Semenova L., Selyakh I., Chivkunova O., Lobakova E., Karpova O., Solovchenko A. A new subarctic strain of Tetradesmus obliquus – part I: identification and fatty acid profiling // J. Appl. Phycol. 2018. V. 30. P. 2737. https://doi.org/10.1007/s10811-017-1313-1
Ismagulova T., Shebanova A., Gorelova O., Baulina O., Solovchenko A. A new simple method for quantification and locating P and N reserves in microalgal cells based on energy-filtered transmission electron microscopy (EFTEM) elemental maps // PLoS One. 2018. V. 13. P. E0208830. https://doi.org/10.1371/journal.pone.0208830
Moudříková Š., Mojzeš P., Zachleder V., Pfaff C., Behrendt D., Nedbal L. Raman and fluorescence microscopy sensing energy-transducing and energy-storing structures in microalgae // Algal Res. 2016. V. 16. P. 224. https://doi.org/10.1016/j.algal.2016.03.016
Mojzeš P., Gao L., Ismagulova T., Pilátová J., Moudříková Š., Gorelova O., Solovchenko A., Nedbal L., Salih A. Guanine, a high-capacity and rapid-turnover nitrogen reserve in microalgal cells // Proc. Natl. Acad. Sci. 2020. V. 117. P. 32722. https://doi.org/10.1073/pnas.2005460117
Zhang Z., Sun D., Cheng K.W., Chen F. Inhibition of autophagy modulates astaxanthin and total fatty acid biosynthesis in Chlorella zofingiensis under nitrogen starvation // Bioresour. Technol. 2018. V. 247. P. 610. https://doi.org/10.1016/j.biortech.2017.09.133
Wang X., Song Y., Liu B., Hang W., Li R., Cui H., Li R., Jia X. Enhancement of astaxanthin biosynthesis in Haematococcus pluvialis via inhibition of autophagy by 3-methyladenine under high light // Algal Res. 2020. V. 50. P. 101991. https://doi.org/10.1016/j.algal.2020.101991
Gorelova O., Baulina O., Ismagulova T., Kokabi K., Lobakova E., Selyakh I., Semenova L., Chivkunova O., Karpova O., Scherbakov P., Khozin-Goldberg I., Solovchenko A. Stress-induced changes in the ultrastructure of the photosynthetic apparatus of green microalgae // Protoplasma. 2019. V. 256. P. 261. https://doi.org/10.1007/s00709-018-1294-1
Stanier R., Kunisawa R., Mandel M., Cohen-Bazire G. Purification and properties of unicellular blue-green algae (order Chroococcales) // Bacteriol. Rev. 1971. V. 35. P. 171. https://doi.org/10.1128/br.35.2.171-205.1971
Pal D., Khozin-Goldberg I., Cohen Z., Boussiba S. The effect of light, salinity, and nitrogen availability on lipid production by Nannochloropsis sp. // Appl. Microbiol. Biotechnol. 2011. V. 90. P. 1429. https://doi.org/10.1007/s00253-011-3170-1
Gorelova O., Baulina O., Solovchenko A., Selyakh I., Chivkunova O., Semenova L., Scherbakov P., Burakova O., Lobakova E. Coordinated rearrangements of assimilatory and storage cell compartments in a nitrogen-starving symbiotic chlorophyte cultivated under high light // Arch. Microbiol. 2015. V. 197. P. 181. https://doi.org/10.1007/s00203-014-1036-5
Reynolds E. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy // J. Cell Biol. 1963. V. 17. P. 208. https://doi.org/10.1083/jcb.17.1.208
Solovchenko A., Neverov K. Carotenogenic response in photosynthetic organisms: a colorful story // Photosynth. Res. 2018. V. 133. P. 31. https://doi.org/10.1007/s11120-017-0358-y
Kokabi K., Gorelova O., Ismagulova T., Itkin M., Malitsky S., Boussiba S., Solovchenko A., Khozin-Goldberg I. Metabolomic foundation for differential responses of lipid metabolism to nitrogen and phosphorus deprivation in an arachidonic acid-producing green microalga // Plant Science. 2019. V. 283. P. 95. https://doi.org/10.1016/j.plantsci.2019.02.008
Kokabi K., Gorelova O., Zorin B., Didi-Cohen S., Itkin M., Malitsky S., Solovchenko A., Boussiba S., Khozin-Goldberg I. Lipidome remodeling and autophagic response in the arachidonic-acid-rich microalga Lobosphaera incisa under nitrogen and phosphorous deprivation // Front. Plant Sci. 2020. V. 11. https://doi.org/10.3389/fpls.2020.614846
Powell N., Shilton A., Chisti Y., Pratt S. Towards a luxury uptake process via microalgae–defining the polyphosphate dynamics // Water research. 2009. V. 43. P. 4207. https://doi.org/10.1016/j.watres.2009.06.011
Solovchenko A., Khozin-Goldberg I., Selyakh I., Semenova L., Ismagulova T., Lukyanov A., Mamedov I., Vinogradova E., Karpova O., Konyukhov I., Vasilieva S., Mojzeš P., Dijkema C., Vecherskaya M., Zvyagin I. et al Phosphorus starvation and luxury uptake in green microalgae revisited // Algal Res. 2019. V. 43. P. 101651. https://doi.org/10.1016/j.algal.2019.101651
Clode P.L., Saunders M., Maker G., Ludwig M., Atkins C.A. Uric acid deposits in symbiotic marine algae // Plant Cell Environ. 2009. V. 32. P. 170. https://doi.org/10.1111/j.1365-3040.2008.01909.x
He B., Hou L., Zhang F., Cong X., Wang Z., Guo Y., Shi J., Jiang M., Zhang X., Zang X. Ultrastructural changes of Haematococcus pluvialis (Chlorophyta) in process of astaxanthin accumulation and cell damage under condition of high light with acetate. Algae. 2020. V. 35. P. 253. https://doi.org/10.4490/algae.2020.35.5.22
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений