Физиология растений, 2022, T. 69, № 4, стр. 386-397
Устойчивость и способность к накоплению никеля у растений различных популяций гипераккумуляторa Noccaea caerulescens
И. В. Серегин a, *, А. Д. Кожевникова a, Х. Схат b, c
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К. А. Тимирязева Российской академии наук
Москва, Россия
b Свободный Университет
Амстердам, Нидерланды
c Университет Вагенингена
Вагенинген, Нидерланды
* E-mail: ilya_seregin@mail.ru
Поступила в редакцию 18.01.2022
После доработки 20.01.2022
Принята к публикации 20.01.2022
- EDN: WUIUWB
- DOI: 10.31857/S0015330322040145
Аннотация
В работе проведен сравнительный анализ способности к накоплению никеля (Ni) гипераккумулятором Noccaea japonica (H. Boissieu) F.K. Mey с ультраосновной (серпентиновой) почвы и растениями 16 популяций гипераккумулятора Noccaea сaerulescens F.K. Mey, произрастающих в природе на ультраосновных (серпентиновых), каламиновых и неметаллоносных почвах. Растения выращивали в течение 2 недель на 0.5 N растворе Хогланда без добавления Ni с последующей инкубацией в течение 6 недель в присутствии NiSO4 в нетоксичной концентрации (1 мкМ). Содержание Ni в корнях и побегах определяли методом атомно-абсорбционной спектрофотометрии. У N. japonica содержание Ni в побегах было существенно ниже, чем в корнях, и ниже, чем в побегах у растений N. сaerulescens из популяций с серпентиновых почв. Способность растений разных популяций N. сaerulescens накапливать Ni в корнях в расчете на единицу массы уменьшалась в ряду: Puente Basadre ≈ Le Coulet > > St-Baudille ≈ Cira ≈ Prémanon > Viviez ≈ Monte Prinzera > Les Avignières > Moravskoslezké > Le Bleymard ≈ Krušné Hory ≈ Wilwerwiltz ≈ La Calamine ≈ St-Félix-de-Palliéres ≈ Kuopio > Prayon. Значение фактора транслокации у N. japonica практически не отличалось от представителей популяции N. сaerulescens с серпентиновой почвы Puente Basadre, а у растений разных популяций N. сaerulescens колебалось в широких пределах. Наибольшее среднее значение фактора транслокации было получено для растений популяций Monte Prinzera серпентиновой группы и Krušné Hory и Kuopio из группы с неметаллоносных почв, а наименьшее значение – у растений популяций La Calamine и Prayon каламиновой группы. Корреляции между содержанием Ni в корнях и побегах у N. сaerulescens не было найдено, тогда как между способностью накапливать Ni в корнях и устойчивостью растений была обнаружена значительная положительная корреляция. Высокая устойчивость к Ni растений популяций с серпентиновых почв, по-видимому, объясняется высокой эффективностью детоксикации Ni в корнях и напрямую не связана с эффективностью его транслокации из корней в побеги.
ВВЕДЕНИЕ
Металлофиты часто характеризуются высокой устойчивостью к металлам, содержащимся в почве в местах их произрастания, и некоторые из них обладают способностью к накоплению (гипераккумуляции) этих металлов в побегах [1, 2]. В настоящее время известно около 720 видов гипераккумуляторов более чем из 70 семейств покрытосеменных растений, способных накапливать значительные количества металлов в надземных органах без видимого нарушения метаболизма и ростовых процессов, причем содержание металлов в побегах этих растений может превышать их содержание в почве [3]. Около 75% из известных видов гипераккумуляторов относятся к гипераккумуляторам никеля (Ni), содержание металла в побегах которых превышает 1000 мкг/г сухой массы в естественных условиях произрастания, что намного выше, чем у неаккумуляторов [3]. Облигатные гипераккумуляторы Ni ограничены в своем распространении металлоносными, обычно ультраосновными (серпентиновыми), почвами [4], в то время как факультативные гипераккумуляторы Ni имеют как популяции, произрастающие на ультраосновных почвах, так и популяции, произрастающие на неметаллоносных почвах [5].
Noccaea caerulescens является широко распространенным факультативным гипераккумулятором и рассматривается в качестве подходящего модельного вида для изучения механизмов и генетических аспектов гипераккумуляции в связи с существующими выраженными внутривидовыми отличиями по устойчивости и способности накапливать Ni, кадмий (Cd) и цинк (Zn) при выращивании как в гидропонике [6–14], так и в почве [15]. Несмотря на существующие различия между популяциями, способность накапливать Zn у N. caerulescens характерна для вида в целом, тогда как способность накапливать Cd и Ni зависит от популяции, как в природе, так и в экспериментальных условиях, и у растений некоторых популяций не выявлена [6, 7, 13, 15]. Выделяют три контрастные экологические группы N. caerulescens, которые иногда рассматриваются в качестве экотипов (эдафотипов): каламиновая группа, включающая популяции, произрастающие на каламиновых почвах, богатых Zn, Cd и Pb; серпентиновая группа, к которой принадлежат популяции, произрастающие на ультраосновных (серпентиновых) почвах, богатых Ni, Со, Mg, Mn, Fe и Cr, а также популяции, произрастающие на неметаллоносных почвах [13–15]. Для близкородственного гипераккумулятора Ni Noccaea japonica также существуют популяции, растения которых произрастают на разных типах почв и различаются по устойчивости и способности к накоплению металлов [13, 16].
В природе высокое содержание Cd и Zn в листьях часто наблюдается у представителей каламиновых популяций N. caerulescens, а Ni – у произрастающих на серпентиновой почве, что отчасти подтверждает гипотезу, согласно которой количество накопленного металла зависит от его доступности в среде [13, 14, 17]. Однако при анализе большого числа популяций закономерности могут быть более сложными. При сравнении 22 популяций N. caerulescens, растения которых выращивались в гидропонике, было показано, что растения неметаллоносных популяций часто накапливали больше Zn и меньше Cd, чем растения каламиновых популяций, а растения неметаллоносных популяций часто накапливали больше Ni, чем растения каламиновых и серпентиновых популяций [9]. При сравнении преимущественно иных, чем в работе [9], 28 популяций N. caerulescens при других концентрациях металлов в растворе вариация по содержанию Zn и Ni в побегах между популяциями N. caerulescens внутри каламиновой группы была значительно выше, чем между популяциями внутри групп с других типов почв. Группы популяций N. сaerulescens с разных типов почв в целом незначительно отличались по способности накапливать Ni в побегах. Наибольшая способность накапливать Ni, Zn и Cd была характерна для растений популяции Col du Mas de l’Ayre (СМА, Франция) с каламиновых почв [13]. Полученные данные свидетельствуют, что способность к гипераккумуляции Zn у N. сaerulescens не всегда напрямую зависит от типа почв, на которых произрастают растения данных популяций, и в ряде случаев, по-видимому, могла эволюционировать на неметаллоносных почвах [13, 14, 18, 19]. Повышение устойчивости растений к Zn при заселении каламиновых почв [13, 14, 18, 19] может быть связано с уменьшением способности накапливать Zn как у N. сaerulescens [9, 20], так и у другого гипераккумулятора Zn и Cd, Arabidopsis halleri [19]. Однако именно повышенная способность к связыванию и детоксикации Zn, по-видимому, преимущественно определяет более высокую устойчивость к Zn растений большинства каламиновых популяций N. caerulescens по сравнению с популяциями с неметаллоносных почв [13, 14]. Были обнаружены значительные положительные корреляции между способностью растений N. caerulescens накапливать Zn и Cd, Zn и Ni, а также Cd и Ni, что свидетельствует о существовании общих путей поглощения этих металлов и/или их транспорта по растению [13].
При выращивании растений в гидропонике существенные отличия по способности накапливать Ni между растениями разных популяций N. сaerulescens проявляются уже в первые дни инкубации в присутствии Ni и в значительной степени не зависят ни от времени инкубации, ни от концентрации металла в растворе. Полученные данные свидетельствуют в пользу предположения о наличии генетически обусловленных различий в способности растений разных популяций N. сaerulescens накапливать Ni [12].
Внутривидовые различия были выявлены не только в накоплении Ni, Zn и Cd, но и в устойчивости растений N. сaerulescens к ним [10–15]. Растения группы популяций с каламиновых почв были значительно более устойчивы к Zn, чем растения групп популяций с неметаллоносных и серпентиновых почв, а растения группы популяций с неметаллоносных почв были немного более устойчивы к Zn, чем растения из серпентиновой группы [13, 15]. Как показали данные корневого теста с использованием серий линейно увеличивающихся концентраций Ni на фоне питательного раствора до полной остановки роста корня, устойчивость к Ni у N. caerulescens была характерна для вида в целом, и существенных различий между группами популяций с разных типов почв выявлено не было. Однако устойчивость растений разных популяций с одного типа почв варьировала, и различия в устойчивости растений к Ni были минимальными между популяциями из серпентиновой группы по сравнению с популяциями из групп с каламиновых и неметаллоносных почв. Однако именно растения популяций Puente Basadre (PB, Испания) и Cira (Ci, Испания), эволюция которых проходила на серпентиновых почвах, обладали самой высокой устойчивостью к Ni [13]. Так как растения популяций с каламиновых почв более устойчивы к Zn и Сd, чем растения с неметаллоносных и серпентиновых почв, в то время как последние более устойчивы к Ni, есть основания полагать, что устойчивость растений к металлам, как и способность к их накоплению генетически предопределена [13, 15], причем устойчивость и способность к накоплению металлов – два независимых явления, которые обусловлены разными генетическими и физиологическими механизмами, по крайней мере, отчасти [21–24].
Несмотря на значительный прогресс в изучении устойчивости и способности растений различных популяций N. caerulescens накапливать металлы, большинство исследований проведено на побегах [13, 15]. Данные по накоплению Ni в корнях ограничены очень небольшим числом популяций [8, 10, 12] или же другим их набором [14], что не позволяет ответить на вопрос, существует ли связь между устойчивостью растений и способностью растений накапливать Ni в корнях, а также насколько велики различия между популяциями в способности растений транспортировать металлы из корней в побеги. Учитывая, что через корневую систему растений поступает основное количество металлов, именно в корнях должны действовать механизмы, определяющие поступление металлов в надземные органы. Поэтому целью настоящей работы является сравнительный анализ способности растений 16 популяций N. caerulescens, произрастающих в естественных условиях на разных типах почв Европы, и близкородственного вида гипераккумулятора Ni Noccaea japonica (популяция Yūbari Mountain с ультраосновных (серпентиновых) почв, Япония) накапливать Ni в корневой системе и транспортировать его в побеги. Важно, что отбор популяций для анализа проводили из числа изученных ранее, на которых проводилась оценка устойчивости к Ni и Zn и способности растений накапливать эти металлы в побегах, а растения выращивали в идентичных условиях [13, 14]. Это позволяет также сравнить полученные для Ni данные с результатами, полученными ранее для Zn [14].
МАТЕРИАЛЫ И МЕТОДЫ
Выращивание растений. Семена гипераккумулятора Noccaea japonica (H.Boissieu) F.K.Mey (ранее Thlaspi japonicum H.Boissieu) (популяция Yūbari Mountain с ультраосновных (серпентиновых) почв, Япония, 43°06′ N, 142°14′ E), а также 16 популяций гипераккумулятора Noccaea сaerulescens F.K. Mey (ранее Thlaspi caerulescens J. & C. Presl), произрастающих в естественных условиях на разных типах почв Европы (Monte Prinzera (MP, Италия, 44°38′ N, 10°05′ E), Puente Basadre (PB, Испания, 42°50′ N, 07°59′ W), Cira (Ci, Испания, 42°46′ N, 08°21′ W) c ультраосновных (серпентиновых) почв; La Calamine (LC, Бельгия, 50°42′ N, 06°00′ E), Prayon (Pr, Бельгия, 50°34′ N, 05°40′ E), Les Avignières (LA, Франция, 43°56′ N, 03°40′ E), Viviez (Vi, Франция, 44°33′ N, 02°13′ E), St-Félix-de-Pallières (SF, Франция, 44°02′ N, 03°56′ E), Le Bleymard (LB, Франция, 44°28′ N, 03°43′ E) c каламиновых почв; Prémanon (Prem, Франция, 46°27′ N, 06°02′ E), St-Baudille (SB, Франция, 43°44′ N, 03°29′ E), Le Coulet (Co, Франция, 43°49′ N, 03°32′ E), Kuopio (Ku, Финляндия, 62°53′ N, 27°38′ E), Krušné Hory (КН, Чехия, 50°42′ N, 13°38′ E), Wilwerwiltz (Wi, Люксембург, 49°59′ N, 05°59′ E), Moravskoslezské (MS, Чехия, 49°26′ N, 18°13′ E) с неметаллоносных почв) получены с растений из природных популяций или растений, выращенных в лабораторных условиях. Семена проращивали на торфяной смеси (Jongkind BV, No. 1, Aлсмер, Нидерланды). Эксперименты проводили в климатической камере (20°C/15°C день/ночь, 14-часовой световой день, освещенность 250 мкмоль/(м2 с) ФАР, влажность 75%). Двухнедельные проростки пересаживали в вегетационные сосуды объемом 1 л (по 2 проростка на сосуд) на 0.5 N раствор Хогланда следующего состава: KNO3 (3 мМ), Ca(NO3)2 (2 мМ), NH4H2PO4 (1 мМ), MgSO4 (0.5 мМ), KCl (1 мкМ), H3BO3 (25 мкМ), ZnSO4 (2 мкМ), MnSO4 (2 мкМ), CuSO4 (0.1 мкМ), (NH4)6Mo7O24 (0.1 мкМ), FeEDDHA (20 мкМ) в деминерализованной воде. Среду доводили до рН 5.5 с помощью MES (2 мМ)/КОН [13, 14]. Затем растения выращивали на 0.5 N растворе Хогланда в присутствии 1 мкМ NiSO4 в течение 6 недель. Питательную среду сменяли дважды в неделю. Выращивали по 6 растений каждой популяции (3 вегетационных сосуда по 2 растения в каждом).
Определение содержания никеля. После 6 недель инкубации в присутствии 1 мкМ NiSO4 собирали корни и побеги изучаемых растений. Корни последовательно отмывали 20 мМ Na2ЭДТА в течение 10 мин при комнатной температуре, а затем дистиллированной водой. Растительный материал высушивали в сушильном шкафу до постоянного веса при 80°С в течение 48 ч и затем взвешивали. Высушенные до постоянного веса образцы растирали в порошок и 50−100 мг образца подвергали мокрому озолению при 140°С в течение 7 ч в тефлоновых бомбах, добавив к образцам 2 мл смеси 65% HNO3 и 37% HCl в соотношении 4 : 1. После соответствующего разведения деминерализованной водой проводили количественный анализ содержания Ni по стандартной методике на атомно-абсорбционном спектрофотометре (AAnalist 100, Perkin Elmer, Нидерланды). Анализ проведен в трех независимых аналитических повторностях. На основании полученных данных был вычислен фактор транслокации – отношение содержания Ni в побегах к его содержанию в корнях.
Статистическая обработка данных. Количественные данные по содержанию металла в корнях и побегах были log-трансформированы и проанализированы с помощью однофакторного дисперсионного анализа с последующим тестом MSR. Данные представлены как средние значения и их стандартные ошибки. Корреляции были проанализированы с помощью коэффициента корреляции Пирсона после log-трансформации данных.
РЕЗУЛЬТАТЫ
К концу эксперимента все проанализированные растения имели развитую розетку листьев. Признаков хлороза и некроза не наблюдалось, так как используемая концентрация NiSO4 (1 мкМ) не является токсичной для N. japonica и N. сaerulescens.
Наибольшее содержание Ni в корнях наблюдалось у N. japonica. Содержание Ni в побегах N. japonica было существенно ниже, чем в корнях (рис. 1a).
Рис. 1.
Содержание Ni в корнях (1) и побегах (2) (а) и значения фактора транслокации (отношение содержания Ni в побегах к его содержанию в корнях) (б) у гипераккумулятора Noccaea japonica (N.j.) и растений 16 популяций гипераккумулятора Noccaea сaerulescens (N.c.) после 2 недель инкубации на 0.5 N растворе Хогланда с последующей инкубацией в течение 6 недель в присутствии 1 мкМ NiSO4. Представлены средние значения и их стандартные ошибки. Статистический анализ проведен отдельно для корней и побегов (а), а также для значений фактора транслокации (б). Достоверно различающиеся между собой величины (при Р < 0.05) обозначены разными буквами. Статистически достоверные различия между содержанием Ni в корнях и побегах показаны звездочками: * при Р < 0.05; ** при Р < 0.01; *** при Р < 0.001 (однофакторный дисперсионный анализ).

Содержание Ni в корнях и побегах у растений разных популяций гипераккумулятора N. сaerulescens значительно варьировало (рис. 1а). У растений популяций PB и Сi серпентиновой (ультраосновной) группы, LC, Pr, Vi каламиновой группы, а также Prem, Wi, MS, SB и Co из группы с неметаллоностных почв содержание Ni в корнях было значительно выше, чем в побегах. Противоположная закономерность наблюдалась только у растений популяций МP серпентиновой группы и Ku с неметаллоносной почвы. У растений других популяций с каламиновых почв, а также у растений популяции KH c неметаллоносной почвы достоверных различий в содержании Ni в корнях и побегах найдено не было. Наибольшее содержание Ni в корнях наблюдалось у представителей популяций PB серпентиновой группы и Сo c неметаллоносной почвы, а в побегах – у растений популяции MP серпентиновой группы. Наибольшие различия между популяциями по способности растений накапливать Ni в корнях и побегах наблюдались в каламиновой группе, наименьшие – в серпентиновой группе, хотя необходимо учитывать, что число изученных популяций с серпентиновых почв было меньше (3 популяции из географически удаленных мест), чем число популяций с каламиновых и неметаллоносных почв (6 и 7 популяций, соответственно) (рис. 1а).
Способность растений разных популяций накапливать Ni в корнях в расчете на единицу массы уменьшалась в ряду: PB ≈ Co > SB ≈ Ci ≈ Prem > Vi ≈ ≈ MP > LA > MS > LB ≈ KH ≈ Wi ≈ LC ≈ SF ≈ Ku > Pr, а в побегах – в ряду: MP > Ku > KH > LA > SF > > LB > Vi ≈ Ci > PB ≈ Prem ≈ Wi > Co > SB > MS > > Pr ≈ LC (рис. 1а). Корреляции между содержанием Ni в корнях и побегах у представителей различных популяций N. сaerulescens не было найдено (рис. 2а).
Рис. 2.
Диаграммы корреляций между содержанием Ni в корнях и побегах (а), содержанием Ni в корнях и значением фактора транслокации (б), содержанием Ni и Zn в корнях (в), значениями фактора транслокации Ni и Zn (г), содержанием Ni в корнях и устойчивостью (д), а также значением фактора транслокации и устойчивостью (е) растений Noccaea сaerulescens. Показаны линии регрессии и коэффициент корреляции Пирсона (r) (* при Р < 0.05; ** при Р < 0.01). Данные по устойчивости растений, оцененной по значению концентрации Ni, при которой рост корней полностью ингибировался (EC100), а также по накоплению и транслокации Zn взяты из статей [13, 14].
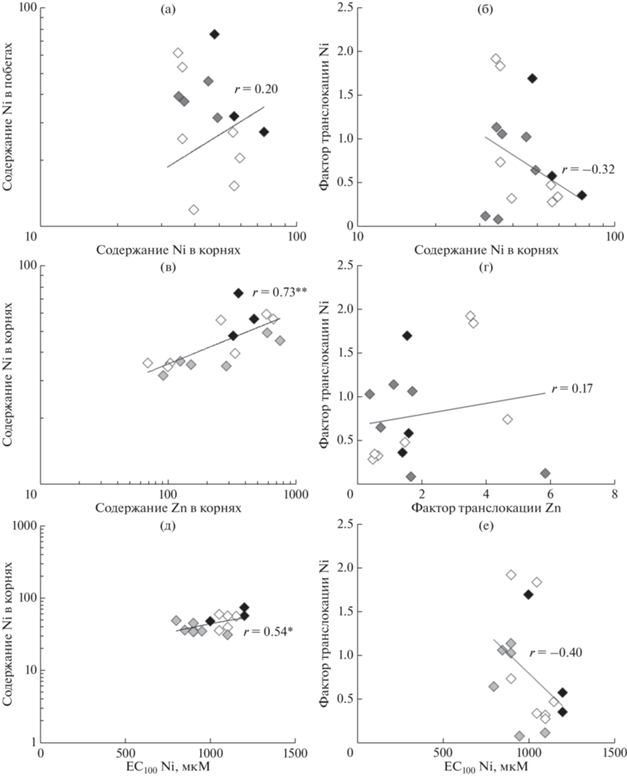
Значение фактора транслокации, то есть отношение содержания Ni в побегах к его содержанию в корнях, у N. japonica существенно не отличалось от представителей двух популяций N. сaerulescens с серпентиновых почв, Сi и PB, но было существенно ниже, чем у растений другой серпентиновой популяции, MP (рис. 1б). У растений разных популяций N. сaerulescens средние значения фактора транслокации колебались в широких пределах. Наибольшие средние значения были получены для растений популяции МР cерпентиновой группы, а также для популяций KH и Ku c неметаллоносных почв. Наименьшие средние значения фактора транслокации наблюдались у растений популяций Pr и LC каламиновой группы. Значения фактора транслокации меньше 1 наблюдались также у растений популяций PB и Ci c серпентиновых почв, Prem, Wi, MS, SB, Co c неметаллоносных почв, а также Vi с каламиновой почвы. В целом значения фактора транслокации уменьшались в ряду: Ku > KH ≈ MP > SF > LB ≈ ≈ LA > Wi > Vi > Ci > Prem > PB > Co ≈ MS > SB > > Pr ≈ LC. Во всех группах растений наблюдался значительный разброс значений фактора транслокации и присутствовали популяции со значением фактора транслокации как больше, так и меньше 1 (рис. 1б). Корреляции между содержанием Ni в корнях и значением фактора транслокации у представителей различных популяций N. сaerulescens найдено не было (рис. 2б).
ОБСУЖДЕНИЕ
Наибольшей способностью накапливать Ni в побегах из изученных нами популяций отличались растения популяции MP N. caerulescens, произрастающие в естественных условиях на ультраосновной (серпентиновой) почве Италии (рис. 1а). На первый взгляд, полученные данные подтверждают гипотезы, согласно которым развитие способности накапливать металл зависит от его доступности в среде [17], так как серпентиновые почвы богаты Ni, а различия в способности к специфическому накоплению металлов среди популяций N. caerulescens предопределены генетически [15]. Однако примечательно, что растения популяций Ku и КН с неметаллоносных почв Финляндии и Чехии, соответственно, и популяции LA c каламиновой почвы во Франции также имели относительно высокую способность аккумулировать Ni в побегах (рис. 1а), несмотря на его низкое содержание в почве в естественной среде их произрастания. Более того, как показали наши более ранние исследования, проведенные в идентичных условиях, способность накапливать Ni в побегах у растений популяции CMA с каламиновой почвы была более чем в два раза выше, чем у растений популяции MP с серпентиновой почвы [13]. Принято считать, что способность к гипераккумуляции Ni возникла, по-видимому, на серпентиновых почвах, а способность к гипераккумуляции Cd и Zn могла эволюционировать либо на каламиновых почвах, либо, что более вероятно, на неметаллоносных почвах с последующим заселением металлоносных почв и повышением устойчивости растений. Популяции факультативных металлофитов-гипераккумуляторов с металлоносных почв, по крайней мере, гипераккумуляторов Zn/Cd, обычно более устойчивы к Zn и Cd, чем популяции того же вида с неметаллоносных почв [18, 19]. Однако полученные данные свидетельствуют в пользу того, что способность растений накапливать металлы, в отличие от устойчивости к ним, не всегда коррелирует с содержанием соответствующих металлов в почве в среде их обитания [25].
Существует несколько гипотез относительно того, в чем селективное преимущество способности растений накапливать металлы в природе. Согласно гипотезе “защиты”, повышенный уровень содержания металлов в тканях побега способствует защите от растительноядных животных и патогенов, благодаря чему снижается необходимость тратить большие количества энергии, азота и углерода на биосинтез защитных органических соединений [обобщено в обзорах 26, 27]. Например, развитие патогенного штамма Xanthomonas campestris pv. сampestris не происходило в растениях гипераккумулятора Ni Streptanthus polygaloides, а рост паразитического гриба Erysiphe polygoni и некротрофного гриба Alternaria brassicola ингибировался [28].
Растения серпентиновой популяции N. japonica, а также популяций серпентиновой группы N. caerulescens (MP, PB, Ci) накапливали не только большое количество Ni (рис. 1а), но и отличались высокой способностью накапливать Zn [13, 14], а растения популяции CМА помимо Ni и Zn накапливали также наибольшее количество Cd в побегах [13]. В естественных условиях произрастания способность растений одновременно накапливать несколько металлов может давать определенные преимущества в защите от поедания. Например, у гипераккумулятора Cd и Zn A. halleri способность к накоплению Cd могла возникнуть в ответ на развитие устойчивости травоядных животных к Zn, тем более что Сd токсичнее Zn [29]. Кроме того, даже небольшие количества металлов могут вносить значительный вклад в токсичность смеси, даже когда металлы находятся в концентрациях ниже их пороговых значений токсичности при их раздельном действии [30]. Можно предположить, что высокая способность к накоплению Zn у растений в популяциях N. caerulescens с серпентиновых почв и Ni у растений ряда популяций (LA, SF, LB) с каламиновых почв (рис. 1а) могла развиться в ответ на устойчивость к Ni и Zn, соответственно, у местных видов травоядных или паразитов. Можно утверждать, что в природе концентрации Zn в листьях растений популяций серпентиновой группы и Ni в листьях растений каламиновой группы часто остаются намного ниже пороговой величины, характерной для гипераккумуляторов в природе [6] из-за относительно низкого содержания Zn в серпентиновых почвах и Ni в каламиновых почвах, соответственно. Однако возможно, что даже это относительно низкое содержание Zn и Ni в листьях у растений серпентиновой и каламиновой групп, растущих в естественных условиях, соответственно, в сочетании с накоплением преобладающих элементов, присутствующих в почве, вносит существенный вклад в защиту растений от травоядных или паразитов [13, 14]. Конечно, эти способности также могут быть просто унаследованными от предков, эволюционировавших на других типах почв.
Можно предположить, что способность к одновременному накоплению нескольких элементов растениями является результатом общих путей поступления металлов в растения или их транспорта в побеги [обобщено в обзоре 31]. Высокая положительная корреляция между содержанием Ni и Zn, Zn и Cd, а также Ni и Cd в побегах N. caerulescens [13] также подтверждает существование слабо специфических механизмов транспорта этих металлов. Было также показано, что поглощение Ni в присутствии эквимолярных концентраций Zn в питательном растворе существенно снижалось у растений N. caerulescens популяций MP и PB c cерпентиновых почв, а также SF и Durfort (Du, Франция) c каламиновых почв, тогда как Ni не влиял на поглощение Zn, что предполагает поглощение Ni в основном посредством транспортеров Zn у растений этих популяций [32]. Предпочтительное поглощение Zn перед Ni у N. caerulescens согласуется с результатами полевых исследований [9]. Учитывая эти данные, можно предположить, что способность к накоплению Ni у N. caerulescens является всего лишь побочным продуктом характерного для вида в целом механизма гипераккумуляции Zn, по крайней мере, в той мере, в какой это касается поглощения корнями.
Разные популяции N. caerulescens существенно различались по способности накапливать металлы в корнях и побегах. В то время как способность накапливать Zn характерна у N. caerulescens для вида в целом [13, 14], способность накапливать Ni в побегах у растений бельгийских популяций LC и Pr (рис. 1а), а также Plombières (Pl, Бельгия) и Lanеstosa (La, Испания) с каламиновых почв не выявлена [13]. Одним из неспецифических транспортеров, участвующих в поглощении металлов является IRT1, который участвует в транспорте через плазмалемму в цитоплазму не только двухвалентных ионов Fe, Zn, Сo, Mn, Cd [33–35], но и Ni [36, 37]. При действии Ni наблюдалась индукция экспрессии гена IRT1 в корнях Arabidopsis thaliana [36, 37] и N. caerulescens [38]. У растений двух бельгийских каламиновых популяций LC и Pr, лишенных способности к гипераккумуляции не только Ni (рис. 1а), но и Cd [13] и обладающих относительно низкой способностью к накоплению Zn, наблюдается синтез нефункциональной, вероятно, укороченной формы белка IRT1 [обобщено в обзоре 31; 35, 39]. В этой связи необходимо заметить, что у растений популяции LC, в отличие от MP, PB, SF и Du, Zn не оказывал заметного влияния на поглощение Ni [32]. Однако у популяции La (Испания) c каламиновой почвы, также не обладающей способностью к гипераккумуляции Cd и Ni, наблюдалась относительно высокая способность к накоплению Zn, из чего можно предположить, что у растений этой популяции существует по крайней мере еще один транспортер, участвующий в поглощении Zn и обладающий более низким сродством к Ni [13, 14]. О существовании общих путей поступления Ni и Zn в корневые системы растений свидетельствует достоверная корреляция между способностью накапливать Ni и Zn в корнях (рис. 2в).
Так как накопление Ni не изменялось в присутствии Zn и Cd у LC, но подавлялось этими металлами у растений популяций Lellingen (Le), St-Laurent-le-Minier (SLM, ранее Ganges) и MP, стало возможным предположить, что накопление Ni определяется менее специфичной системой поглощения, которая участвует в поглощении Zn и Cd у Lе, MP и SLM [7]. Участие в поглощении Ni транспортеров с низким сродством к Zn было подтверждено у N. caerulescens в более поздних исследованиях, а также продемонстрировано у гипераккумулятора Ni Odontarrhena muralis (Alyssum murale) и у неаккумуляторов Thlaspi arvense [40] и Triticum aestivum [41]. Одним из кандидатов, который может участвовать в транспорте Ni, является транспортер с низким сродством ZIP10 [38], однако различия между популяциями на уровне экспрессии генов транспортеров металлов, участвующих в их поглощении, изучены еще крайне недостаточно.
Значения фактора транслокации существенно различались между растениями разных популяций во всех трех группах N. caerulescens (рис. 1б). Принимая во внимание, что корреляции между содержанием Ni в корнях и побегах у представителей различных популяций N. сaerulescens не найдено (рис. 2а), становится очевидным, что должны существовать внутривидовые различия в транспорте Ni из корней в побеги. Примечательно, что у растений популяций N. caerulescens серпентиновой группы, за исключением MP, а также у серпентиновой популяции N. japonica содержание Ni в корнях было выше, чем в побегах. Они обладали средней эффективностью транслокации Ni в побеги, в то время как наибольшие значения фактора транслокации были обнаружены не только у растений серпентиновой популяции MP, но и у растений популяций KH и Ku с неметаллоносных почв (рис. 1б). Наименьшей способностью транспортировать Ni из корней в побеги обладали растения бельгийских каламиновых популяций LC и Рr (рис. 1б), а следовательно, очень низкая способность растений этих популяций к накоплению Ni в побегах определяется не только низкой интенсивностью поглощения металла, но и низкой эффективностью его транспорта из корней в побеги. Фактически, растения этих популяций проявляли себя скорее как исключатели с коэффициентом транслокации Ni около 0.1 (рис. 1б). Отсутствие корреляции между содержанием Ni в корнях и фактором транслокации Ni (рис. 2б) свидетельствует о том, что количество транспортируемого металла напрямую не зависит от его содержания в корневой системе. Таким образом, можно предположить, что у растений из популяций LC и Pr отсутствует именно способность к гипертранслокации Ni, тогда как способность к транслокации Cd и Zn поддерживается на уровне, свойственном для гипераккумуляторов [11, 14, 42].
Высокая способность растений гипераккумуляторов транспортировать Ni и Zn из корней в побеги может определяться высоким уровнем низкомолекулярных цитоплазматических хелаторов, таких как гистидин и никотианамин, в корнях этих видов [обобщено в обзоре 31]. При инкубации выделенных из корней везикул тонопласта в среде, содержащей Ni или Zn в сочетании с гистидином, поступление в них металлов значительно ингибировалось у N. caerulescens, но не у близкородственного неаккумулятора Thlaspi arvense [8, 43]. Учитывая конститутивно высокий эндогенный уровень гистидина в корнях N. caerulescens [8] и низкое содержание Ni и Zn в протопластах клеток коры корня [8, 43], можно предположить, что связывание металлов с гистидином в цитозоле ограничивает их поступление в вакуоли клеток коры корня, облегчая их радиальный транспорт по направлению к ксилеме [обобщено в обзоре 31]. Однако следует отметить, что, несмотря на существенные различия в способности накапливать Ni (рис. 1а) и Zn [9, 10, 13–15, 43], растения разных популяций N. caerulescens (Lе, LC, SF, MP) достоверно не различались по эндогенному содержанию гистидина в корнях и побегах [8]. Это свидетельствует о том, что межпопуляционные различия по способности растений накапливать Ni и Zn, по всей видимости, не определяются различным содержанием свободного гистидина в корнях. В этом отношении нельзя исключать потенциальную роль никотианамина, хотя данные по межпопуляционным различиям эндогенного содержания никотианамина в корнях нам неизвестны.
Существенный вклад в механизмы гипераккумуляции вносит эффективность загрузки металлов в сосуды ксилемы. Показано, что АТФазы P1B-типа HMA4 и HMA2 участвуют в загрузке Zn и Cd в сосуды ксилемы из клеток перицикла и ксилемной паренхимы [обобщено в обзоре 31]. Можно предположить, что причинами разной эффективности загрузки металлов в ксилему у растений разных популяций могут быть либо различия в локализации транспортеров на мембране, либо разный уровень экспрессии генов, кодирующих эти белки, что показано в случае НМА4 [42]. Уровень экспрессии NcHMA4 у растений PB N. caerulescens, был ниже по сравнению с Pr, SF и SLM, что связано с наличием четырех копий NcHMA4 у SLM и SF, трех копий у Pr и только двух копий у PB [42]. Однако уровень экспрессии NcHMA4 не полностью согласуется со способностью растений накапливать Zn [14], что позволяет рассматривать этот механизм только в качестве одной из возможных причин внутривидовых различий у N. caerulescens в накоплении Zn и, возможно, Cd. Механизм загрузки Ni в ксилему нам пока не известен. Но очевидно, что транспорт Ni и Zn в побеги происходит различными путями, о чем косвенно свидетельствует отсутствие корреляции между значениями факторов транслокации Ni и Zn (рис. 2г).
Очевидно, что гипераккумуляторы должны быть устойчивы к действию металлов, которые они накапливают. При этом механизмы, определяющие устойчивость к металлам, должны были возникнуть в процессе эволюции раньше или параллельно со способностью к аккумуляции [44]. Данные корневого теста, в котором растения последовательно инкубировали на растворах с возрастающими концентрациями Ni и отмечали минимальную концентрацию, при которой рост останавливался (EC100), показали, что устойчивость к Ni у N. caerulescens в целом видоспецифична и намного выше, чем у неметаллофитов, хотя растения разных популяций гипеаккумулятора могут отличаться по устойчивости [13]. Межпопуляционные различия в устойчивости растений к Ni были минимальными внутри группы растений с серпентиновых почв по сравнению группами популяций с каламиновых и неметаллоносных почв. Наибольшая устойчивость к Ni была характерная для растений популяций PB и Ci, эволюция которых проходила на серпентиновых почвах [13].
Корреляции между накоплением Ni в побегах и устойчивостью растений к Ni не было обнаружено [13]. Отсутствие корреляции между устойчивостью и способностью растений накапливать Ni, по крайней мере, частично может служить косвенным подтверждением существующей точки зрения о независимом генетическом контроле устойчивости и способности к накоплению металлов [21–24]. Так как для анализа устойчивости использовался корневой тест [13], то в настоящей работе нами был проведен анализ взаимосвязи между устойчивостью растений разных популяций N. caerulescens к Ni и их способностью накапливать Ni в корнях (рис. 2д) и транспортировать Ni в побеги, выраженной через фактор транслокации (рис. 2е). Анализ показал наличие значительной положительной корреляции только между способностью накапливать Ni в корнях и устойчивостью растений к Ni (рис. 2д), что свидетельствует о том, что между устойчивостью растений Ni, оцененной по корневому тесту, и накоплением Ni в корнях может существовать определенная связь. В этой связи важно заметить, что у наиболее устойчивых к Ni растений популяций PB и Ci N. caerulescens, а также у несколько менее устойчивых растений N. japonica [13], наблюдалось наибольшее накопление металла в корнях (рис. 1а), что может быть связано с высокой эффективностью механизмов детоксикации Ni в корнях. У растений популяции MP, устойчивость которых была немного ниже по сравнению PB и Ci [13], наблюдалось не только высокое содержание Ni в корнях, но и очень интенсивная его транслокация в побеги, где у гипераккумуляторов происходит детоксикация Ni путем его накопления в вакуолях клеток, преимущественно покровной ткани [обобщено в обзоре 45]. Однако очевидно, что существующие различия в устойчивости к Ni между популяциями не связаны непосредственно с различиями в эффективности транслокации Ni, поскольку не было найдено корреляции между значениями фактора транслокации и устойчивостью растений к Ni (рис. 2е), из чего следует, что различия в устойчивости должны в значительной степени определяться различной способностью связывать Ni в корнях. Примечательно, что в отличие от Ni, в случае Zn обнаружена отрицательная корреляция между способностью накапливать Zn в корнях и устойчивостью растений к Zn [14], что может свидетельствовать о том, что устойчивость в данном случае определяется скорее не эффективными механизмами детоксикации Zn в корнях, а способностью устойчивых к Zn растений поддерживать относительно низкое содержание металла в корнях благодаря ограниченному поглощению Zn или эффективному его транспорту в побеги. Причины различий в стратегии устойчивости растений к Ni и Zn пока не ясны. В любом случае, по-видимому, растения N. caerulescens не способны эффективно связывать Zn в корнях, что подтверждается полной потерей устойчивости к Zn при подавлении экспрессии гена HMA4 у A. halleri [23].
Таким образом, накопление Ni в корнях варьирует у разных популяций и не коррелирует с накоплением Ni в побегах. Однако накопление Ni в корнях положительно коррелирует с устойчивостью растений к Ni, оцененной по ингибированию роста корня. Высокая устойчивость к Ni растений популяций с серпентиновых почв, по-видимому, объясняется высокой эффективностью детоксикации Ni в корнях, но напрямую не связана с эффективностью его транслокации из корней в побеги.
Авторы выражают благодарность Mark Aarts, Mathilde Mousset, Thibault Sterckeman, Celestino Quintela-Sabarís, Petra Kidd, Oihana Barrutía и Sylvain Merlot за предоставление семян N. caerulescens, Takafumi Mizuno за предоставление семян N. japonica, and Rudo Verweij, Rob Broekman, Richard van Logtestijn, Riet Vooijs, и Sandy Goette за техническую помощь.
Исследования, проведенные на растениях Noccaea caerulescens, выполнены за счет средств Российского научного фонда (проект № 21-14-00028, https://rscf.ru/project/21-14-00028/). Исследования, проведенные на растениях Noccaea japonica, выполнены в рамках государственного задания Министерства науки и высшего образования Российской Федерации (тема № 121040800153-1).
Авторы заявляют об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Авторы И. В. Серегин и А. Д. Кожевникова внесли одинаковый вклад в эту работу.
Список литературы
Jaffré T., Pillon Y., Thomine S., Merlot S. The metal hyperaccumulators from New Caledonia can broaden our understanding of nickel accumulation in plants // Front. Plant Sci. 2013. V. 4: article 279. https://doi.org/10.3389/fpls.2013.00279
van Der Ent A., Vinya R., Erskine P. D., Malaisse F., Przybyłowicz W. J., Barnabas A. D., Harris H.H., Mesjasz-Przybyłowicz J. Elemental distribution and chemical speciation of copper and cobalt in three metallophytes from the copper–cobalt belt in Northern Zambia // Metallomics. 2020. V. 12. P. 682. https://doi.org/10.1039/c9mt00263d
Reeves R.D., Baker A.J., Jaffré T., Erskine P.D., Echevarria G., van der Ent A. A global database for plants that hyperaccumulate metal and metalloid trace elements // New Phytol. 2018. V. 218. P. 407. https://doi.org/10.1111/nph.14907
Pollard A.J., Powell K.D., Harper F.A., Smith J.A.C. The genetic basis of metal hyperaccumulation in plants // Crit. Rev. Plant. Sci. 2002. V. 21. P. 539. https://doi.org/10.1080/0735-260291044359
Pollard A.J., Reeves R.D., Baker A.J.M. Facultative hyperaccumulation of heavy metals and metalloids // Plant Sci. 2014. V. 217. P. 8. https://doi.org/10.1016/j.plantsci.2013.11.011
Assunção A.G., Bookum W.M., Nelissen H.J., Vooijs R., Schat H., Ernst W.H. Differential metal-specific tolerance and accumulation patterns among Thlaspi caerulescens populations originating from different soil types // New Phytol. 2003. V. 159. P. 411. https://doi.org/10.1046/j.1469-8137.2003.00819.x
Assunção A.G.L., Bleeker P., Ten Bookum W.M., Vooijs R., Schat H. Intraspecific variation of metal preference patterns for hyperaccumulation in Thlaspi caerulescens: evidence from binary exposures // Plant Soil. 2008. V. 303. P. 289. https://doi.org/10.1007/s11104-007-9508-x
Richau K.H., Kozhevnikova A.D., Seregin I.V., Vooijs R., Koevoets P.L., Smith J.A., Ivanov V.B., Schat H. Chelation by histidine inhibits the vacuolar sequestration of nickel in roots of the hyperaccumulator Thlaspi caerulescens // New Phytol. 2009. V. 183. P. 106. https://doi.org/10.1111/j.1469-8137.2009.02826.x
Gonneau C., Genevois N., Frérot H., Sirguey C., Sterckeman T. Variation of trace metal accumulation, major nutrient uptake and growth parameters and their correlations in 22 populations of Noccaea caerulescens // Plant Soil. 2014. V. 384. P. 271. https://doi.org/10.1007/s11104-014-2208-4
Seregin I.V., Erlikh N.T., Kozhevnikova A.D. Nickel and zinc accumulation capacities and tolerance to these metals in the excluder Thlaspi arvense and the hyperaccumulator Noccaea caerulescens // Russ. J. Plant Physiol. 2014. V. 61. P. 204. https://doi.org/10.1134/S1021443714020137
Seregin I.V., Kozhevnikova A.D., Zhukovskaya N.V., Schat H. Cadmium tolerance and accumulation in excluder Thlaspi arvense and various accessions of hyperaccumulator Noccaea caerulescens // Russ. J. Plant Physiol. 2015. V. 62. P. 837. https://doi.org/10.1134/S1021443715050131
Kozhevnikova A.D., Seregin I.V., Schat H. Accumulation of nickel by excluder Thlaspi arvense and hyperaccumulator Noccaea caerulescens upon short-term and long-term exposure // Russ. J. Plant Physiol. 2020. V. 67. P. 303. https://doi.org/10.1134/S1021443720020089
Kozhevnikova A.D., Seregin I.V., Aarts M.G., Schat H. Intra-specific variation in zinc, cadmium and nickel hypertolerance and hyperaccumulation capacities in Noccaea caerulescens // Plant Soil. 2020. V. 452. P. 479. https://doi.org/10.1007/s11104-020-04572-7
Seregin I.V., Kozhevnikova A.D., Schat H. Correlated variation of the Zn accumulation and tolerance capacities among populations and ecotypes of the Zn hyperaccumulator, Noccaea caerulescens // Russ. J. Plant Physiol. 2021. V. 68. P. S26. https://doi.org/10.1134/S1021443721070128
Sterckeman T., Cazes Y., Gonneau C., Sirguey C. Phenotyping 60 populations of Noccaea caerulescens provides a broader knowledge of variation in traits of interest for phytoextraction // Plant Soil. 2017. V. 418. P. 523. https://doi.org/10.1007/s11104-017-3311-0
Mizuno T., Usui K., Horie K., Nosaka S., Mizuno N., Obata H. Cloning of three ZIP/Nramp transporter genes from a Ni hyperaccumulator plant Thlaspi japonicum and their Ni(II)-transport abilities // Plant Physiol. Biochem. 2005. V. 43. P. 793. https://doi.org/10.1016/j.plaphy.2005.07.006
Reeves R.D., Schwartz C., Morel J.L., Edmondson J. Distribution and metal-accumulating behavior of Thlaspi caerulescens and associated metallophytes in France // Int. J. Phytorem. 2001. V. 3. P. 145. https://doi.org/10.1080/15226510108500054
Hanikenne M., Nouet C. Metal hyperaccumulation and hypertolerance: a model for plant evolutionary genomics // Curr. Opin. Plant Biol. 2011. V. 14. P. 252. https://doi.org/10.1016/j.pbi.2011.04.003
Stein R.J., Höreth S., de Melo J.R., Syllwasschy L., Lee G., Garbin M.L., Clemens S., Krämer U. Relationships between soil and leaf mineral composition are element-specific, environment-dependent and geographically structured in the emerging model Arabidopsis halleri // New Phytol. 2017. V. 213. P. 1274. https://doi.org/10.1111/nph.14219
Frérot H., Lefèbvre C., Petit C., Collin C., Dos Santos A., Escarré J. Zinc tolerance and hyperaccumulation in F1 and F2 offspring from intra and interecotype crosses of Thlaspi caerulescens // New Phytol. 2005. V. 165. P. 111. https://doi.org/10.1111/j.1469-8137.2004.01227.x
Macnair M.R., Bert V., Huitson S.B., Saumitou-Laprade P., Petit D. Zinc tolerance and hyperaccumulation are genetically independent characters // Proc. R. Soc. Lond. B: Biol. Sci. 1999. V. 266. P. 2175. https://doi.org/10.1098/rspb.1999.0905
Bert V., Meerts P., Saumitou-Laprade P., Salis P., Gruber W., Verbruggen N. Genetic basis of Cd tolerance and hyperaccumulation in Arabidopsis halleri // Plant Soil. 2003. V. 249. P. 9. https://doi.org/10.1023/A:1022580325301
Hanikenne M., Talke I.N., Haydon M.J., Lanz C., Nolte A., Motte P., Kroymann J., Weigel D., Krämer U. Evolution of metal hyperaccumulation required cis-regulatory changes and triplication of HMA4 // Nature. 2008. V. 453. P. 391. https://doi.org/10.1038/nature06877
Verbruggen N., Hermans C., Schat H. Molecular mechanisms of metal hyperaccumulation in plants // New Phytol. 2009. V. 181. P. 759. https://doi.org/10.1111/j.1469-8137.2008.02748.x
Escarré J., Lefèbvre C., Gruber W., Leblanc M., Lepart J., Rivière Y., Delay B. Zinc and cadmium hyperaccumulation by Thlaspi caerulescens from metalliferous and nonmetalliferous sites in the Mediterranean area: implications for phytoremediation // New Phytol. 2000. V. 145. P. 429. https://doi.org/10.1046/j.1469-8137.2000.00599.x
Seregin I.V., Kozhevnikova A.D. Physiological role of nickel and its toxic effects on higher plant // Russ. J. Plant Physiol. 2006. V. 53. P. 257. https://doi.org/10.1134/S1021443706020178
Boyd R.S. The defense hypothesis of elemental hyperaccumulation: status, challenges and new directions // Plant Soil. 2007. V. 293. P. 153. https://doi.org/10.1007/s11104-007-9240-6
Boyd R.S., Shaw J.J., Martens S.N. Nickel hyperaccumulation defends Streptanthus polygaloides (Brassicaceae) against pathogens // Amer. J. Bot. 1994. V. 81. P. 294. https://doi.org/10.1002/j.1537-2197.1994.tb15446.x
Kazemi-Dinan A., Thomaschky S., Stein R.J., Krämer U., Müller C. Zinc and cadmium hyperaccumulation act as deterrents towards specialist herbivores and impede the performance of a generalist herbivore // New Phytol. 2014. V. 202. P. 628. https://doi.org/10.1111/nph.12663
Sharma S.S., Schat H., Vooijs R., Van Heerwaarden L.M. Combination toxicology of copper, zinc and cadmium in binary mixtures: Concentration-dependent antagonistic, nonadditive, and synergistic effects on root growth in Silene vulgaris // Environ. Toxicol. Chem. 1999. V. 18. P. 348. https://doi.org/10.1002/etc.5620180235
Seregin I.V., Kozhevnikova A.D. Low-molecular-weight ligands in plants: role in metal homeostasis and hyperaccumulation // Photosynth. Res. 2021. V. 150. P. 51. https://doi.org/10.1007/s11120-020-00768-1
Kozhevnikova A.D., Seregin I.V., Schat H. Translocation of Ni and Zn in Odontarrhena corsica and Noccaea caerulescens: the effects of exogenous histidine and Ni/Zn interactions // Plant Soil. 2021. V. 468. P. 295. https://doi.org/10.1007/s11104-021-05080-y
Korshunova Y.O., Eide D., Clark W.G., Guerinot M.L., Pakrasi H.B. The IRT1 protein from Arabidopsis thaliana is a metal transporter with a broad substrate range // Plant Mol. Biol. 1999. V. 40. P. 37. https://doi.org/10.1023/A:1026438615520
Rogers E.E., Eide D.J., Guerinot M.L. Altered selectivity in an Arabidopsis metal transporter // Proc. Natl. Acad. Sci. 2000. V. 97. P. 12356. https://doi.org/10.1073/pnas.210214197
Halimaa P., Blande D., Baltzi E., Aarts M.G.M., Granlund L., Keinänen M., Kärenlampi S.O., Kozhevnikova A.D., Peräniemi S., Schat H., Seregin I.V., Tuomainen M., Tervahauta A.L. Transcriptional effects of cadmium on iron homeostasis differ in calamine accessions of Noccaea caerulescens // Plant J. 2019. V. 97. P. 306. https://doi.org/10.1111/tpj.14121
Nishida S., Tsuzuki C., Kato A., Aisu A., Yoshida J., Mizuno T. AtIRT1, the primary iron uptake transporter in the root, mediates excess nickel accumulation in Arabidopsis thaliana // Plant Cell Physiol. 2011. V. 52. P. 1433. https://doi.org/10.1093/pcp/pcr089
Nishida S., Aisu A., Mizuno T. Induction of IRT1 by the nickel-induced iron-deficient response in Arabidopsis // Plant Signal. Behav. 2012. V. 7. P. 329. https://doi.org/10.4161/psb.19263
Deng T.H.B., Tang Y.T., Sterckeman T., Echevarria G., Morel J.L., Qiu R.L. Effects of the interactions between nickel and other trace metals on their accumulation in the hyperaccumulator Noccaea caerulescens // Environ. Exp. Bot. 2019. V. 158. P. 73. https://doi.org/10.1016/j.envexpbot.2018.11.015
Plaza S., Tearall K.L., Zhao F.J., Buchner P., McGrath S.P., Hawkesford M.J. Expression and functional analysis of metal transporter genes in two contrasting ecotypes of the hyperaccumulator Thlaspi caerulescens // J. Exp. Bot. 2007. V. 58. P. 1717. https://doi.org/10.1093/jxb/erm025
Deng T.H.B., Cloquet C., Tang Y.T., Sterckeman T., Echevarria G., Estrade N., Morel J.-L., Qiu R.L. Nickel and zinc isotope fractionation in hyperaccumulating and nonaccumulating plants // Environ. Sci. Technol. 2014. V. 48. P. 11926. https://doi.org/10.1021/es5020955
Dalir N., Tandy S., Gramlich A., Khoshgoftarmanesh A., Schulin R. Effects of nickel on zinc uptake and translocation in two wheat cultivars differing in zinc efficiency // Environ. Exp. Bot. 2017. V. 134. P. 96. https://doi.org/10.1016/j.envexpbot.2016.11.009
Craciun A.R., Meyer C.L., Chen J., Roosens N., De Groodt R., Hilson P., Verbruggen N. Variation in HMA4 gene copy number and expression among Noccaea caerulescens populations presenting different levels of Cd tolerance and accumulation // J. Exp. Bot. 2012. V. 63. P. 4179. https://doi.org/10.1093/jxb/ers104
Kozhevnikova A.D., Seregin I.V., Erlikh N.T., Shevyreva T.A., Andreev I.M., Verweij R., Schat H. Histidine-mediated xylem loading of zinc is a species-wide character in Noccaea caerulescens // New Phytol. 2014. V. 203. P. 508. https://doi.org/10.1111/nph.12816
Krämer U. Metal hyperaccumulation in plants // Ann. Rev. Plant Biol. 2010. V. 61. P. 517. https://doi.org/10.1146/annurev-arplant-042809-112156
Seregin I.V., Kozhevnikova A.D. Roles of root and shoot tissues in transport and accumulation of cadmium, lead, nickel, and strontium // Russ. J. Plant Physiol. 2008. V. 55. P. 1. https://doi.org/10.1134/S1021443708010019
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


