Физиология растений, 2022, T. 69, № 4, стр. 373-385
Влияние повышенной температуры на окисление над-зависимых субстратов и активность альтернативной оксидазы в митохондриях семядолей люпина
А. Г. Шугаев a, *, П. А. Буцанец a, Н. А. Шугаева a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К. А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: ag-shugaev@ifr.moscow
Поступила в редакцию 10.12.2021
После доработки 18.01.2022
Принята к публикации 18.01.2022
- EDN: MNPYQO
- DOI: 10.31857/S0015330322040157
Аннотация
Исследовали влияние температуры в диапазоне 20–40°С на окисление малата и других НАД-зависимых дыхательных субстратов, а также на активность альтернативной CN-резистентной оксидазы в митохондриях, изолированных из семядолей проростков люпина (Lupinus angustifolius L.). Анализировали реакцию митохондрий на повышение температуры среды инкубации в условиях in vitro, а также изменения метаболической активности органелл, выделенных из проростков, подвергнутых действию повышенной температуры в условиях in vivo. Обнаружено, что с увеличением температуры среды инкубации (20–30°С) происходило увеличение скорости поглощения кислорода митохондриями при окислении малата в присутствии глутамата в активном фосфорилирующем состоянии (состояние 3) и, в меньшей степени, в состоянии 4 (в отсутствие АДФ). При этом интенсификация дыхания митохондрий с увеличением температуры происходила исключительно за счет активации цитохромного пути переноса электронов в ЭТЦ. Заметное торможение альтернативного пути дыхания обнаружено при температуре 35–40°С. Показано, что в условиях гипертермии (35–40°С) при окислении малата наблюдался эффект “улучшения” (conditioning) параметров процесса окислительного фосфорилирования в ходе нескольких добавок АДФ. После второй добавки 100–200 мкМ АДФ существенно увеличивалась скорость окисления субстрата в состоянии 3 и повышался коэффициент дыхательного контроля (ДК). Аналогичные изменения дыхания митохондрий в условиях гипертермии были обнаружены при окислении других НАД-зависимых субстратов, но они не проявлялись при окислении сукцината, катализируемого комплексом II ЭТЦ. Окисление малата при 25 или 35°С в митохондриях семядолей проростков люпина, подвергнутых действию высокой температуры (35°С в течение 12 ч) в условиях in vivo, также характеризовалось резким снижением скорости состояния 3 и величины ДК после добавки АДФ, которые восстанавливались в ходе нескольких циклов фосфорилирования. Окисление малата и других НАД-зависимых субстратов, катализируемое комплексом I, после прогревания митохондрий при 40°C в присутствии 10 мМ MgCl2 существенно ингибировалось и осуществлялось с участием ротенон-нечувствительных НАД·Н-дегидрогеназ. Полученные результаты позволяют предположить, что наиболее вероятной причиной торможения окисления НАД-зависимых субстратов в митохондриях семядолей люпина при высокой температуре является обратимый переход комплекса I из активной в неактивную форму (А/D трансформация). Обсуждается возможное физиологическое значение подобного механизма регуляции дыхания растений в ответ на неблагоприятные условия окружающей среды.
ВВЕДЕНИЕ
Изучение влияния экстремальных температур на дыхание и другие ключевые физиологические процессы, протекающие в растениях, представляет интерес не только для фундаментальной науки, но и имеет очевидную практическую значимость. Известно, что именно эти стрессовые факторы, наряду с засухой и засолением, оказывают наиболее сильное негативное действие на величину урожая важнейших сельскохозяйственных культур. Изучение влияния температуры на дыхание растений имеет более чем столетнюю историю, начиная с опытов Ф. Фукомпре и И. П. Бородина [1, стр. 172], проведенных во второй половине XIX в. Следует также отметить, что в выяснение этого вопроса большой вклад внесли работы других отечественных ученых: А. Н. Волкова, В. Н. Палладина, О.А. Семихатовой, В.Н. Жолкевича, В.К. Войникова и др. Благодаря постоянному интересу исследователей к этой проблеме было установлено, что действие экстремальных температур на растения сопровождалось глубокими изменениями дыхательного метаболизма, центральным звеном которого является функционирование митохондрий. Показано, что экстремальные температуры в той или иной мере ингибируют дыхательный метаболизм митохондрий и/или понижают его энергетическую эффективность за счет разобщения процесса окислительного фосфорилирования, что немедленно отрицательно сказывается на скорости роста проростков [2, 3]. Для успешного выживания в этих условиях растения используют разнообразные защитные механизмы, модифицируя реакции метаболизма, в том числе дыхательного, что позволяет им приспособиться к неблагоприятным условиям среды обитания.
Известно, что действие различных абиотических стресс-факторов, включая экстремальные температуры, из которых лучше изучено действие гипотермии, вызывает достаточно однотипную ответную реакцию митохондрий растений, направленную на преодоление возникающего окислительного стресса: активацию АФК-гасящих ферментов, индукцию процессов свободного окисления (альтернативной CN-резистентной оксидазы (АО) и ротенон-нечувствительных НАД(Ф)·Н-дегидрогеназ) и разобщения в ЭТЦ (разобщающих белков) [4, 5]. Показано, что основная функция АО и других несопряженных альтернативных путей электронного транспорта заключается в предотвращении избыточной генерации АФК митохондриями и поддержании окислительной активности органелл в стрессовых условиях [6–8]. В последнее время накапливается все больше доказательств того, что подобная структурно-функциональная изменчивость митохондрий играет важную роль в приспособлении растений к неблагоприятным факторам окружающей среды [5–8].
В отличие от гипотермии, влияние на функционирование митохондрий растений повышенных температур остается малоизученным, а имеющиеся литературные данные достаточно противоречивы, возможно, вследствие того, что в ранних исследованиях использовались органеллы недостаточно высокого качества [3]. Однако и в современных работах можно найти данные, свидетельствующие о том, что условия гипертермии (35°С и выше) активируют, ингибируют или не оказывают влияния на окисление сукцината, малата, α-кетоглутарата и других дыхательных субстратов интактными митохондриями растений [9–11]. Крайне противоречивая информация имеется относительно активности в условиях гипертермии АО митохондрий, которая, как уже отмечалось, играет важную роль в устойчивости растений к действию стресс-факторов различной природы, включая гипотермию [4, 8]. Например, при окислении сукцината митохондриями проростков фасоли, при повышении температуры среды инкубации с 25 до 42°С вклад АО в дыхание снижался с 38 до 0% при почти двукратном увеличении скорости поглощения кислорода органеллами [11]. С другой стороны, при окислении сукцината митохондриями семядолей сои не было обнаружено существенных различий в чувствительности к температуре цитохромного и альтернативного пути окисления [10]. Очевидно, многие аспекты ответной реакции дыхания растений и метаболической активности изолированных митохондрий на действие как гипо-, так и гипертермии могут быть ткане- и видоспецифичными, а также зависеть от уровня базовой или приобретенной термотолерантности у растений, относящихся даже к одному виду [12]. Кроме того, эта реакция, очевидно, будет зависеть от схемы проведения опытов с растениями и методов изучения дыхания митохондрий при действии высокой температуры.
Показано, что функционирование комплекса I в митохондриях растений наименее устойчиво к условиям гипертермии по сравнению с другими комплексами ЭТЦ. Например, инкубация митохондрий побегов кукурузы при 27°С в течение 30 мин приводила к практически полной инактивации окисления малата в состоянии 3. При этом окисление НАД-зависимых субстратов было возможным с участием “матриксных” ротенон-нечувствительных НАД(Ф)·Н дегидрогеназ ЭТЦ в присутствии экзогенного НАД+ [13]. Причины низкой температурной устойчивости комплекса I в митохондриях растений остаются малоизученными, однако известно, что гипертермия действительно стимулировала выход кофермента НАД+ из матрикса митохондрий листьев ячменя с участием специального переносчика, ингибируя НАД-зависимое окисление глицина [14]. Кроме того, по аналогии с митохондриями животных можно предположить, что в условиях гипертермии происходит обратимый переход (или трансформация работы) комплекса I из активного состояния (А – active) в неактивное (D – de-active) [15]. Характеристики такой А/D трансформации работы комплекса I в стрессовых условиях достаточно хорошо изучены и, помимо животных, она была обнаружена в митохондриях грибов и бактерий [16]. Возможность аналогичной трансформации работы комплекса I у высших растений при действии высокой температуры или других стрессовых факторов внешней среды ранее не исследовалась, хотя она признается весьма вероятной, учитывая сходную структуру этого комплекса в митохондриях животных и растений [17].
Целью данной работы являлось изучение влияния высокой температуры на окисление НАД-зависимых субстратов с участием различных дыхательных путей и функциональное состояние комплекса I в митохондриях семядолей проростков люпина.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Объектом исследований служили митохондрии, выделенные из семядолей этиолированных проростков люпина узколистного (Lupinus angustifolius L., сорт Дикаф-14). Проростки люпина выращивали в течение 5 дней на воде в термостате при 24°С в темноте. В экспериментах по изучению влияния повышенной температуры на дыхание 5-суточные проростки люпина прогревали в термостате при температуре 37°С в течение 12 ч.
Выделение митохондрий из контрольных и подвергнутых действию гипертермии семядолей проростков люпина осуществляли, используя единую методику дифференциального центрифугирования, описанную ранее [18], в небольшой модификации. Семядоли люпина 12 г промывали дистиллированной водой, высушивали, охлаждали и измельчали в ступке со средой гомогенизации (в соотношении 1 : 4), содержащей 0.5 М сахарозу, 50 мМ MOPS-буфер (рН 8.0), 10 мМ ЭДТА, 5 мМ дитиотрейтол (ДТТ) и 0.1% БСА, свободный от ЖК. Гомогенат отфильтровывали через 4 слоя мираклоса и центрифугировали при 4000 g в течение 5 мин. Полученный супернатант центрифугировали при 15 000 g в течение 5 мин, осадок митохондрий ресуспендировали в среде отмывания, содержащей 0.4 М сахарозу, 20 мМ HEPES-буфер (рН 7.2), 5 мМ ЭДТА, 0.1% БСА, и центрифугировали при 4000 g в течение 5 мин. Для осаждения митохондрий супернатант центрифугировали при 13 000 g в течение 10 мин. Выделенные митохондрии ресуспендировали в малом объеме среды, содержащей 0.3 М сахарозу, 20 мМ HEPES-буфер (рН 7.2) и 0.1% БСА. Суспензию митохондрий (10–15 мг/мл) хранили на льду. Все операции проводили в холодной комнате при 2–4°С. Особое внимание уделяли длительности процедуры выделения митохондрий, которая не превышала 40 мин.
Митохондрии с инактивированным комплексом I получали прогреванием в термостате суспензии изолированных вышеописанным способом органелл (содержание белка 0.6–0.7 мг/мл) в течение 10 мин при 40°С в среде, состав которой указан в подписи к рисунку 6. После охлаждения среды до комнатной температуры вносили дыхательные субстраты, кофакторы, ингибиторы и регистрировали скорость поглощения кислорода.
Поглощение кислорода митохондриями при различных температурах среды инкубации измеряли полярографическим (или амперометрическим) методом с использованием кислородного электрода типа Кларка на приборе Oxytherm Electrode Control Unit (“Hansatech Instruments”, Англия). Инкубационная среда (1.2 мл) содержала 0.3 М сахарозу, 20 мМ HEPES-буфер (рН 7.4), 5 мМ MgCl2, 5 мМ КН2РО4 (рН 7.4) и 0.1% БСА. Перед измерением скорости дыхания митохондрии (0.6–0.7 мг/мл белка) прединкубировались в среде при заданной температуре в течение различного интервала времени (от 1 до 3 мин), после чего в инкубационную среду вносился дыхательный субстрат. Если другое не указано в таблицах или на рисунках, в качестве субстрата окисления использовали 5 мМ малат в присутствии 5 мМ глутамата, необходимого для удаления оксалоацетата. Остальные добавки и условия экспериментов приведены в подписях к таблицам и рисункам. Содержание кислорода в насыщенной воздухом среде инкубации при различной температуре принималось эквивалентным концентрации О2 в чистой воде при 760 мм рт. ст. и составляло 250 мкМ при 25°С, 233 мкМ (30°С), 219 мкМ (35°С) и 205 мкМ (40°С) [19]. Скорость поглощения кислорода при окислении дыхательного субстрата митохондриями в различных метаболических состояниях, величину коэффициента дыхательного контроля (ДК) и отношения АДФ/О рассчитывали по методу Chance и Williams [20]. Количество митохондриального белка определяли по методу Lowry с соавт. [21], используя БСА в качестве стандарта.
Ингибиторный анализ. Для ингибирования цитохромного пути (ЦП) дыхания использовали 1.0 мМ цианид калия (KCN), альтернативного (АП) – 3 мМ салицилгидроксамовую кислоту (СГК). Максимальную активность АП дыхания определяли по разнице поглощения кислорода митохондриями при окислении субстрата в состоянии 3 (после второй добавки АДФ) в отсутствие или в присутствии СГК на фоне добавленного KCN [22]. Ротенон-чувствительную составляющую дыхания митохондрий при окислении НАД-зависимых субстратов определяли по степени ингибирования поглощения кислорода в присутствии 20 мкМ ротенона. Оптимальные концентрации ингибиторов подбирались в предварительных опытах.
В работе использованы следующие реактивы: MgCl2, КН2РО4 и другие соли отечественного производства марки о.с.ч. или х.ч. Дыхательные субстраты, нуклеотиды, БСА, MOPS, HEPES, ротенон, СГК и др. – фирмы “Sigma” (США).
Во всех экспериментах биологическая повторность была минимум 3-кратной, аналитическая – 3–4-кратной. Каждую серию опытов повторяли не менее трех раз. На рисунках представлены данные характерных опытов, в таблицах и графиках представлены средние значения и их стандартные отклонения.
РЕЗУЛЬТАТЫ
В данной работе с целью изучения влияния повышенной температуры на окисление НАД-зависимых субстратов в митохондриях семядолей этиолированных проростков люпина было использовано несколько экспериментальных подходов. Во-первых, анализировали оперативную реакцию дыхания изолированных митохондрий на повышение температуры в ходе кратковременных (10–15 мин) опытов в условиях in vitro. Во-вторых, изучали изменения метаболической активности органелл, выделенных из семядолей, после достаточно длительного (12 ч) воздействия повышенной температуры на проростки в условиях in vivo. Наконец, было изучено последействие инкубации суспензии митохондрий люпина при повышенной температуре на окисление НАД-зависимых субстратов.
Влияние температуры на окисление митохондриями НАД-зависимых субстратов в условиях in vitro
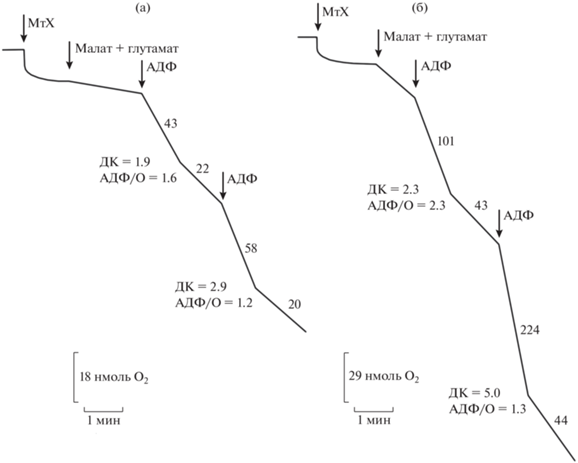
На рисунке 1 приведены типичные полярографические кривые поглощения кислорода при окислении малата в присутствии глутамата митохондриями семядолей проростков люпина в контроле (25°С) и при высокой температуре (40°С). Показано, что окисление митохондриями этого НАД-зависимого субстрата при температуре 25°С существенно, и примерно в равной степени стимулировалось первой и последующими добавками АДФ (состояние 3), а затем тормозилось после его исчерпания в процессе синтеза АТФ (состояние 4). При этом величина дыхательного контроля (ДК) по Чансу (состояние 3/состояние 4) составляла около 3, что свидетельствовало о прочном сопряжении процесса окислительного фосфорилирования, а близкая к теоретической величина отношения АДФ/О (2.4–2.5) указывала на его высокую эффективность (рис. 1а).
Рис. 1.
Полярографические кривые поглощения кислорода при окислении малата митохондриями (МтХ) семядолей люпина при температуре 25°С (а) и 40°С (б). Состав среды инкубации: 0.3 М сахароза, 20 мМ HEPES-буфер (рН 7.4), 5 мМ MgCl2, 5 мМ КН2РО4 (рН 7.4) и 0.1% БСА; дополнительно вносили 5 мМ малат, 5 мМ глутамат, 200 мкМ АДФ. Цифры около кривых – скорость поглощения кислорода митохондриями (нмоль О2/(мин · мг белка)).

Повышение температуры среды инкубации до 40°С сопровождалось увеличением скорости окисления малата в состоянии 3. Однако обнаруживались ярко выраженные изменения в ответной реакции митохондрий на первую и последующие добавки АДФ. Вторая добавка АДФ заметно ускоряла окисление малата в состоянии 3 и снижала его в состоянии 4. В результате после второй добавки АДФ возрастала величина ДК (рис. 1б), которая сохранялась в ходе последующих циклов фосфорилирования (не показано). Подобный феномен “улучшения” состояния (conditioning) изолированных митохондрий растений и животных после нескольких последующих добавок АДФ хорошо известен [23]. Он может иметь разные причины, которые будут рассмотрены ниже.
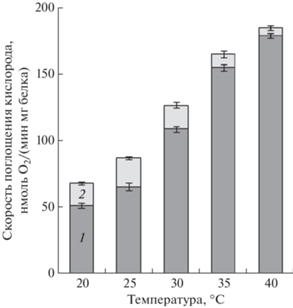
На рисунке 2 и в таблице 1 также приведены данные, демонстрирующие влияние температуры среды инкубации в диапазоне 20–40°С на окисление малата митохондриями люпина в состоянии 3 и 4, а также на величину коэффициента ДК и отношения АДФ/О, рассчитанные на основании результатов опытов, аналогичных показанным на рисунке 1. Увеличение температуры между 20 и 30°С сопровождалось практически линейным увеличением скорости окисления субстрата в состоянии 3, чего не наблюдалось в состоянии 4, скорость которого с увеличением температуры возрастала неравномерно. При этом не обнаружено существенных различий в скорости окисления малата в ответ на первую и вторую добавку АДФ (рис. 2). Как уже отмечалось, окисление малата митохондриями при температуре 35–40°С сопровождалось значительными различиями в скорости состояния 3, состояния 4, а также в величине коэффициента ДК (увеличивалось) и отношения АДФ/О (снижалось) после двух добавок АДФ (рис. 2, табл. 1). Следует отметить, что величина первой добавки АДФ в определенных пределах (75, 100, 150 или 200 мкМ) не имела большого значения, поскольку повторное внесение АДФ в среду инкубации митохондрий всегда сопровождалось существенным увеличением скорости окисления субстрата в состоянии 3, а также величины ДК. Таким образом, при температуре 35–40°С начальная скорость окисления малата в состоянии 3 была существенно снижена, но возрастала после нескольких циклов фосфорилирования.
Рис. 2.
Влияние температуры на скорость окисления малата митохондриями семядолей люпина в состоянии 3 (кривые 1, 2) и состоянии 4 (кривые 4, 3) в ответ на первую и вторую добавки АДФ, соответственно. Состав среды инкубации: 0.3 М сахароза, 20 мМ HEPES-буфер (рН 7.4), 5 мМ MgCl2, 5 мМ КН2РО4 (рН 7.4) и 0.1% БСА; дополнительно вносили 5 мМ малат, 5 мМ глутамат, 200 мкМ АДФ.

Таблица 1.
Влияние температуры на величину коэффициента дыхательного контроля (ДК) и отношения АДФ/О при окислении малата в митохондриях семядолей люпина, рассчитанных после первой (1) и второй (2) добавки АДФ
| Температура, °С | ДК (1) | ДК (2) | АДФ/О (1) | АДФ/О (2) |
|---|---|---|---|---|
| 20 | 4.4 ± 0.3 | 4.6 ± 0.4 | 2.2 ± 0.2 | 2.4 ± 0.1 |
| 25 | 3.3 ± 0.3 | 3.4 ± 0.4 | 2.4 ± 0.2 | 2.5 ± 0.2 |
| 30 | 3.6 ± 0.4 | 3.7 ± 0.5 | 2.3 ± 0.3 | 2.4 ± 0.2 |
| 35 | 3.9 ± 1.5 | 4.4 ± 1.3 | 2.2 ± 0.3 | 2.0 ± 0.2 |
| 40 | 2.2 ± 0.4 | 4.2 ± 0.9 | 2.4 ± 0.4 | 1.6 ± 0.3 |
Аналогичная активация дыхания митохондрий люпина в состоянии 3 после повторной добавки АДФ наблюдалась в условиях гипертермии при окислении других НАД-зависимых субстратов, в частности, цитрата (табл. 2) и пирувата (не показано). Важно, что подобный эффект не обнаруживался при окислении в митохондриях сукцината, которое катализируется ФАД-зависимой сукцинатдегидрогеназой (комплексом II) (табл. 2). Следует отметить, что при высокой температуре для достижения максимальной скорости окисления сукцината в состоянии 3 после первой добавки АДФ было необходимо присутствие в среде инкубации глутамата и/или АТФ для снятия ингибирования сукцинатдегидрогеназы оксалоацетатом.
Таблица 2.
Влияние повышенной температуры среды инкубации на скорости окисления цитрата и сукцината в митохондриях люпина в состоянии 3 (V3) после первой (1) и второй (2) добавки АДФ
| Температура, °С | Цитрат | Сукцинат + Глутамат | ||
|---|---|---|---|---|
| V3 (1) | V3 (2) | V3 (1) | V3 (2) | |
| 25 | 60 ± 7 | 64 ± 8 | 146 ± 18 | 153 ± 16 |
| 40 | 28 ± 9 | 69 ± 17 | 197 ± 32 | 213 ± 25 |
С использованием ингибиторов дыхания была определена активность альтернативных путей митохондриального окисления. Показано, что окисление малата в митохондриях семядолей люпина при нормальной температуре в достаточно высокой степени (65–70%) тормозилось ротеноном (ингибитор комплекса I) и цианидом – 80–85% (ингибитор цитохромоксидазы) (рис. 3). В присутствии ротенона добавка в среду инкубации экзогенного НАД+, способного транспортироваться в интактные митохондрии растений, не стимулировала поглощение кислорода, следовательно, активность ротенон-нечувствительных НАД·Н-дегидрогеназ, субстрат-связывающие центры которых локализованы на внутренней (матриксной) стороне внутренней мембраны митохондрий, не лимитировалась уровнем этого кофермента (рис. 3а). Кроме того, нам не удавалось существенно повысить активность АО путем внесения в реакционную среду пирувата и ДТТ (рис. 3б), т.е. тех эффекторов, которые могут стимулировать работу данного фермента в митохондриях растений [4]. Таким образом, в митохондриях люпина активность альтернативных “матриксных,” ротенон-нечувствительных НАД·Н-дегидроназ составляла 35%, а максимальная активность CN-резистентной АО не превышала 20% от скорости дыхания в состоянии 3.
Рис. 3.
Влияние ингибиторов на окисление малата митохондриями (МтХ) семядолей люпина при 25°С. Состав среды инкубации: 0.3 М сахароза, 20 мМ HEPES-буфер (рН 7.4), 5 мМ MgCl2, 5 мМ КН2РО4 (рН 7.4) и 0.1% БСА; дополнительно вносили 5 мМ малат, 5 мМ глутамат, 0.3 мМ пируват, 200 мкМ АДФ, 0.3 мМ НАД+, 1 мМ ДТТ, 1 мМ KCN, 3 мМ СГК, 20 мкМ ротенон. Цифры около кривых – скорость поглощения кислорода митохондриями (нмоль О2/(мин·мг белка)).

Далее было показано, что активация окисления малата (в состоянии 3 после второй добавки АДФ) митохондриями люпина при повышении температуры происходила преимущественно, а в интервале температур 35–40°С – исключительно за счет увеличения активности ЦП окисления в ЭТЦ. Активность АО в условиях гипертермии, хотя существенно снижалась, но не инактивировалась полностью (рис. 4).
Окисление малата митохондриями, выделенными из семядолей проростков люпина, подвергнутых действию повышенной температуры в условиях in vivo
На рисунке 5 показано, что выдерживание проростков люпина в условиях гипертермии (при 35°С в течение 12 ч) вызывало отчетливое ингибирование окисления малата митохондриями, которое сохранялось после выделения органелл. В ходе окисления малата митохондриями при 25°С наблюдалось торможение фосфорилирующего (в состоянии 3) окисления субстрата и снижение величины ДК после первой добавки АДФ. Повторная добавка АДФ существенно повышала или “улучшала” окислительную и фосфорилирующую активность митохондрий, в частности, увеличивала скорость состояния 3 и величину ДК (рис. 5а). В то же время, отношение АДФ/О, характеризующее эффективность окислительного фосфорилирования, оставалось существенно ниже теоретически возможного. Интересно, что наиболее отчетливо обратимое торможение окисления митохондриями малата проявлялось при температуре среды инкубации 35°С, при которой органеллы функционировали in vivo в клетках семядолей проростков. При этом также наблюдалось снижение скорости окисления субстрата в состоянии 3 и величины ДК после первой добавки АДФ, однако отношение АДФ/О оставалось достаточно высоким и резко снижалось после второй добавки АДФ на фоне увеличения скорости окисления малата в состояния 3 и величины ДК (рис. 5б). Таким образом, обнаруженная аналогичная ответная реакция на добавки АДФ в опытах in vitro и in vivo (рис. 1б, рис. 5) указывает, по-видимому, на одинаковый механизм, регулирующий окисление малата в митохондриях семядолей люпина при действии высокой температуры.
Рис. 5.
Окисление малата при температуре 25°С (а) и 35°С (б) митохондриями (МтХ), выделенными из семядолей люпина после прогревания проростков при 35°С. Состав среды инкубации: 0.3 М сахароза, 20 мМ HEPES-буфер (рН 7.4), 5 мМ MgCl2, 5 мМ КН2РО4 (рН 7.4) и 0.1% БСА; дополнительно вносили 5 мМ малат, 5 мМ глутамат, 200 мкМ АДФ. Цифры около кривых – скорость поглощения кислорода митохондриями (нмоль О2/(мин · мг белка)).
Влияние повышенной температуры и ионов Mg2+ на окисление НАД-зависимых субстратов митохондриями семядолей люпина
Известно, что комплекс I играет ключевую роль в работе ЭТЦ митохондрий животных, поэтому изучение его структуры и функциональной активности постоянно находится в центре внимания исследователей. Используя пермеабилизированные аламецитином митохондрии сердца крысы и субмитохондриальные частицы (СМЧ) сердца быка было показано, что комплекс I существует в них в виде смеси двух форм или состояний – активной (А) и деактивированной (D). Было обнаружено, что обратимая A/D трансформация комплекса I чувствительна к некоторым факторам среды, в частности, высокой температуре [24, 25]. Для СМЧ и митохондрий животных был предложен ряд диагностических тестов для обнаружения функционирования комплекса I в инактивированном состоянии. Среди таких тестов – использование двухвалентных катионов (Mg2+, Ca2+), в присутствии высокой концентрации которых происходит существенное замедление D/A трансформации комплекса I, и которое может дать простой способ определения уровня его инактивации в условиях гипертермии. Например, после прогревания при 38°С в течение 20 мин митохондрий сердца крысы в присутствии 10 мМ MgCl2 каталитическая активность комплекса I ингибировалась на 40–80% в зависимости от рН среды инкубации [25].
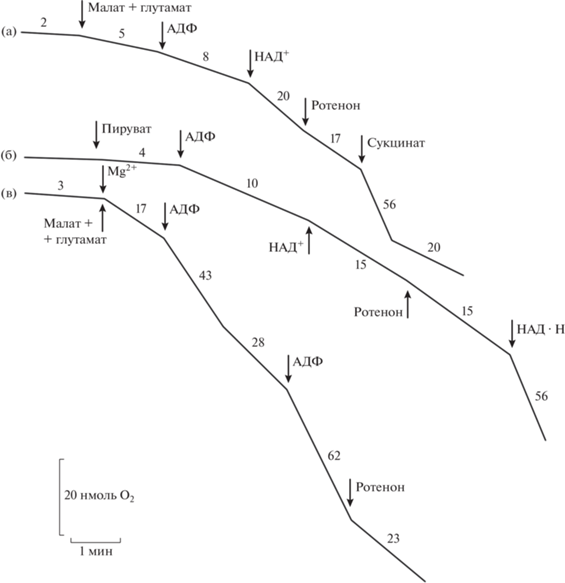
Мы применили аналогичный тест для выявления температурной инактивации ротенон-чувствительного окисления НАД-зависимых субстратов в интактных митохондриях семядолей. В этих опытах мы изучали влияние предварительного прогревания суспензии митохондрий люпина при 40°С в течение 10 мин в реакционной среде, содержащей или не содержащей 10 мМ MgCl2, на окисление малата или пирувата. На рисунке 6а показано, что после прогревания митохондрий в присутствии ионов Mg2+ окисление малата при 25°С было сильно заторможено (хотя и не полностью) и не реагировало на добавку АДФ. При этом в течение времени проведения полярографического опыта (7–10 мин) не наблюдалось спонтанной реактивации дыхания. Добавка экзогенного НАД+ частично стимулировала поглощение кислорода, которое было нечувствительно к ротенону (рис. 6а). В отличие от малата, окисление митохондриями сукцината, катализируемого комплексом II ЭТЦ, в указанных условиях происходило с высокой скоростью и сопровождалось фосфорилированием, о чем можно было судить по наличию ДК (рис. 6а). Аналогичное торможение ротенон-чувствительного поглощения кислорода после прогревания митохондрий в присутствии 10 мМ МgCl2 наблюдалось при окислении митохондриями пирувата (рис. 6б). Если МgCl2 был добавлен в среду инкубации предварительно прогретых митохондрий одновременно или после внесения дыхательного субстрата, скорость окисления малата в состоянии 3 достаточно быстро восстанавливалась (хотя и не полностью) в ходе нескольких циклов фосфорилирования. При этом окисление малата ингибировалось ротеноном (рис. 6в) и слабо стимулировалось экзогенным НАД+ (не показано). Таким образом, последействие прогревания митохондрий люпина в присутствии высокой концентрации ионов Mg2+ характеризовалось, во-первых, почти полным торможением чувствительного к ротенону окисления малата (т.е. активности комплекса I), которое не восстанавливалось в течение длительного лаг-периода после добавки субстрата. Кроме того, оно сопровождалось потерей митохондриями некоторой части пула матриксного НАД+, что ограничивало скорость окисления этого субстрата с участием альтернативных “матриксных” ротенон-нечувствительных НАД·Н-дегидрогеназ.
Рис. 6.
Влияние ионов Мg2+ и предварительного прогревания митохондрий (МтХ) на окисление НАД-зависимых субстратов. Митохондрии прогревали при 40°С в течение 10 мин в стандартной среде инкубации в присутствии (а), (б), или в отсутствие (в) 10 мМ MgCl2. Состав среды инкубации: 0.3 М сахароза, 20 мМ HEPES-буфер (рН 7.4), 5 мМ КН2РО4 (рН 7.4) и 0.1% БСА; дополнительно вносили: 5 мМ малат, 5 мМ глутамат, 5 мМ пируват (в присутствии 0.6 мМ ТПФ), 5 мМ сукцинат, 1 мМ НАД·Н, 10 мМ MgCl2, 100 мкМ АДФ, 0.35 мМ НАД+, 20 мкМ ротенон. Цифры около кривых – скорость поглощения кислорода митохондриями (нмоль О2/(мин·мг белка)).
ОБСУЖДЕНИЕ
В литературе существует большой разброс данных относительно влияния повышенной температуры как на рост растений, так и на метаболическую активность митохондрий [11, 26, 27]. Возможно, что влияние гипертермии на дыхание митохондрий зависит от объекта исследования, продолжительности температурного воздействия, а также качества выделенных препаратов органелл [3].
В наших экспериментах in vitro повышение температуры среды инкубации в диапазоне 20–30°С активировало окисление малата митохондриями семядолей люпина в состоянии 3 и 4. При этом скорость окисления субстрата в активном состоянии (V3) возрастала примерно в 1.7 раз на 10°С повышения температуры (коэффициент Q10). Для достижения аналогичной величины коэффициента Q10 при окислении малата в состоянии 3 в диапазоне температур 30–40°С требовалось внесение в среду инкубации нескольких добавок АДФ для снятия исходного ингибирования окисления НАД-зависимого субстрата в условиях гипертермии (35–40°С) (рис. 1). Эти результаты согласуются с данными о влиянии на окисление малата повышенной температуры в условиях in vivo. Прогревание проростков люпина при 35°С в течение 12 ч также сопровождалось обратимым ингибированием окисления НАД-зависимого субстрата в состоянии 3, которое наиболее сильно проявлялось при увеличении температуры среды инкубации органелл (рис. 5). Таким образом, митохондрии семядолей люпина, обладая достаточно высокой термоустойчивостью, способны выдерживать (переживать) воздействие гипертермии in vivo и in vitro и, главное, сохранять потенциальную способность восстанавливать свою окислительную и фосфорилирующую активность после окончания ее действия, что в целом согласуется с данными литературы [3, 13].
Следует также отметить, что окисление малата в условиях гипертермии происходило преимущественно с участием ЦП дыхания, при крайне низкой активности АО (рис. 4). Эти данные указывают, по-видимому, на более высокую чувствительность АП в митохондриях семядолей к гипертермии по сравнению с ЦП, что отмечали и другие авторы [11, 27]. Например, в митохондриях, выделенных из проростков кукурузы, температурный оптимум активности АО составлял 15–20°С, после которого при увеличении температуры активность АО постепенно снижалась и практически полностью ингибировалась при 41°С [27]. Природа теплового ингибирования активности АП в условиях in vitro остается неизвестной. Важно, что оно может быть обратимо. В частности, снижение температуры среды инкубации с 42 до 25°С восстанавливало максимальную активность АО в митохондриях гипокотилей бобов [11]. Противоречивость литературных данных по влиянию гипертермии на участие АП в дыхании может объясняться тем, что активность АО в митохондриях зависит не только от температуры, но и от восстановленности пула убихинона, жесткости контроля дыхания со стороны аденилатной системы и уровня активации АО под влиянием кетокислот и других эффекторов [10].
Более подробно хотелось бы остановиться на рассмотрении возможной причины обнаруженного в данной работе ингибирования в условиях гипертермии окисления НАД-зависимых субстратов, катализируемого чувствительным к ротенону комплексом I ЭТЦ. Несмотря на то, что торможение активности комплекса I при повышенной температуре в митохондриях растений было описано уже довольно давно [13, 14], вопросы относительно его механизма и функциональной роли продолжают оставаться актуальными и в настоящее время, поскольку ингибирование может быть весьма лабильным и, по-видимому, иметь различные причины. Например, в экспериментах in vitro было показано быстрое снижение скорости НАД-зависимого окисления глицина в митохондриях листьев гороха при 40°С, которое предотвращалось внесением кофермента НАД+ в среду инкубации. Это объяснялось практически полным истощением (потерей) пула НАД+ в матриксе уже после 5-минутной инкубации органелл в условиях гипертермии [14]. Авторы приходят к выводу, что высокая температура индуцирует быстрый и массированный выход кофермента НАД+ из матрикса митохондрий с участием специального переносчика [14]. Пока неизвестно, насколько широко распространен подобный феномен среди митохондрий, выделенных из других растительных объектов. В ходе наших экспериментов in vitro было показано, что воздействие высокой температуры, по-видимому, сопровождалось потерей органеллами части пула НАД+, поскольку экзогенный НАД+ оказывал некоторое стимулирующее действие на дыхание. Однако эта потеря незначительно сказывалась на скорости окисления малата с участием альтернативных ротенон-нечувствительных НАД·Н-дегидрогеназ, имеющих, как известно, более низкое по сравнению с комплексом I сродство к субстрату (рис. 6). Кроме того, выдерживание этиолированных проростков люпина в течение нескольких часов при температуре 35°С не сопровождалось потерей у выделенных из них митохондрий способности к окислению малата в состоянии 3 с высокой скоростью после нескольких добавок АДФ (рис. 5). Таким образом, помимо возможного изменения уровня кофермента НАД+ в матриксе, в митохондриях люпина, по-видимому, функционирует и другой механизм, регулирующий окисление НАД-зависимых субстратов не только в условиях гипертермии, но и после окончания ее действия.
Процесс постепенного восстановления функций изолированных митохондрий растений, связанных с выработкой энергии (скорости состояния 3 и величины ДК) после добавки дыхательных субстратов, в том числе НАД-зависимых, не является новым феноменом. Например, в ранних работах были описаны и проанализированы эффекты быстрого, в течение нескольких минут, полярографического опыта увеличения скорости окисления субстратов в состоянии 3 и величины ДК после нескольких добавок АДФ, наблюдаемых у митохондрий растений после “состаривания” (aging) суспензии при 0°С (называемого “кондиционированием”, или conditioning), или восстановления функциональной активности органелл после длительного, в течение нескольких часов, выдерживания митохондрий при 25°С в отсутствие субстрата дыхания (названного “самовосстановлением”, или self-restoration) [22, 28]. В работе Hung и Romani [28], проанализировав все возможные причины обратимого ингибирования скорости окисления α-кетоглутарата в митохондриях плодов авокадо после длительного выдерживания суспензии органелл в условиях деэнергизации, а именно, ингибирование проницаемости дыхательных субстратов, существенную потерю пула НАД+, снижение активности транслоказы адениновых нуклеотидов или АТФ-синтетазы, или торможение НАД·Н-дегидрогеназы, авторы посчитали наиболее вероятным последнее предположение.
В качестве такого механизма, обеспечивающего торможение окисления НАД-зависимых субстратов в различных стрессовых условиях, в том числе, в условиях гипертермии, может рассматриваться обнаруженная у животных, некоторых дрожжей и бактерий обратимая спонтанная трансформация комплекса I из активного (А) в неактивное (D) состояние [16]. Условием подобной деактивации комплекса I в митохондриях животных является невозможность протекания реакции, катализируемой ротенон-чувствительной НАД·Н-убихинон оксидоредуктазой при отсутствии субстрата или в присутствии НАД·Н, но при полной восстановленности пула убихинона. Кроме того, на СМЧ митохондрий, выделенных из различных объектов, было показано, что скорость А/D трансформации комплекса I увеличивалась с ростом температуры и в условиях гипертермии (37–38°С) происходила очень быстро (менее чем за минуту) [16]. Также быстро протекает и обратный переход комплекса I из неактивного в активное состояние (D/A) при нормальной температуре после добавки субстрата и восстановления транспорта электронов в дыхательной цепи. Однако скорость D/A трансформации комплекса I может быть существенно замедлена в присутствии двухвалентных катионов (Mg2+ или Са2+) [15, 16].
Анализ результатов, полученных в данной работе, позволяет говорить о существовании аналогичного механизма, регулирующего активность комплекса I, при действии повышенной температуры в митохондриях растений, в частности, в митохондриях семядолей люпина. Так в экспериментах in vitro было показано, что кратковременная (в течение нескольких минут) прединкубация при высокой температуре (40°С) митохондрий существенно снижала максимальную скорость окисления малата в состоянии 3, что проявлялось после первой добавки АДФ (рис. 1). При этом следует отметить, что торможение окисления НАД-зависимого субстрата не было полным, во-первых, благодаря присутствию в митохондриях растений “матриксных” ротенон-нечувствительных НАД·Н-дегидрогеназ, активность которых не ингибировалась в условиях гипертермии [13]. Кроме того, активация функционирования комплекса I после появления в матриксе НАД·Н в результате окисления малата, очевидно, должна была сопровождаться его быстрым переходом из неактивного в активное состояние (D/A трансформация) и увеличением скорости поглощения кислорода. Также можно предположить, что добавки АДФ дополнительно стимулировали такой переход комплекса I благодаря активации работы дыхательной цепи и снижению уровня восстановленности ее переносчиков электронов, включая пул убихинона.
Доказательства, свидетельствующие о переходе комплекса I в неактивное состояние в условиях гипертермии в митохондриях семядолей люпина, были получены нами при изучении влияния на этот процесс двухвалентных катионов. Было показано, что после кратковременного прогревания суспензии (в течение 10 мин при 40°С) в присутствии 10 мМ MgCl2, не оказывающего негативного действия на дыхание нестрессированных митохондрий, наблюдалось практически полное ингибирование окисления малата, катализируемого комплексом I, которое в этих условиях осуществлялось только с участием ротенон-нечувствительных НАД·Н-дегидрогеназ (рис. 6а). При этом последействие повышенной температуры слабо сказывалось на окислении сукцината (в присутствии глутамата) и экзогенного НАД·Н (рис. 6а, б). Аналогичные результаты были получены при действии гипертермии на окисление митохондриями люпина других НАД-зависимых субстратов, в частности, пирувата (рис. 6б). Наиболее вероятной причиной инактивации комплекса I при прогревании митохондрий в присутствии высокой концентрации MgCl2 является транспорт и накопление в матриксе ионов Mg2+ либо вследствие пассивной диффузии по градиенту концентрации, или в результате активного транспорта при наличии остаточного мембранного потенциала на внутренней мембране вследствие неполного отмывания дыхательных субстратов при выделении органелл. Следует подчеркнуть, что спонтанная реактивация окисления малата у предварительно прогретых в присутствии магния митохондрий не наблюдалась в течение полярографического опыта (рис. 6а, б). В то же время, процесс восстановления чувствительного к ротенону окисления малата предварительно прогретыми митохондриями был довольно быстрым, если НАД-зависимый субстрат добавляли одновременно или раньше магния (рис. 6в) и гораздо более длительным, либо вообще не наблюдался, если Mg2+ добавляли в среду инкубации за несколько минут до малата (данные не приведены). Такие существенные изменения в скорости восстановления активности комплекса I в зависимости от последовательности добавок в среду инкубации магния и НАД-зависимого субстрата, возможно, объяснялись разной скоростью транспорта и накопления в матриксе двух эффекторов, оказывающих на этот процесс противоположное действие.
Не исключено, что переход в неактивное состояние комплекса I в изолированных митохондриях растений возможен и при более низкой температуре (30–35°С), но при ее более длительном воздействии, как это было показано на митохондриях животных [16]. Нами были получены косвенные доказательства подобной трансформации комплекса I в условиях in vivo, причем при относительно низкой температуре (35°С). Это важно выяснить, поскольку большинство исследований по влиянию гипертермии на А/D переход комплекса I были выполнены в условиях in vitro – на изолированных митохондриях, СМЧ или выделенном ферменте. Несомненно, необходимы дополнительные исследования, чтобы внести большую ясность в обсуждаемые вопросы. Вместе с тем, в данной работе впервые получены результаты, свидетельствующие о возможности A/D трансформации комплекса I в интактных митохондриях растений под влиянием высокой температуры.
Что касается возможной физиологической роли обсуждаемых изменений активности комплекса I, то этот вопрос остается открытым даже для митохондрий животных, у которых они были обнаружены около 30 лет назад [15]. При этом объяснение функциональной роли торможения комплекса I в условиях гипертермии в митохондриях животных представляется достаточно сложным, поскольку нормальная температура многих животных организмов превышает 36°С. Вместе с тем, высказывается предположение, согласно которому временная инактивация комплекса I может способствовать предотвращению избыточной генерации супероксида и перекиси водорода митохондриями в стрессовых условиях [29]. Если подобное “антиоксидантное” свойство D формы комплекса I получит экспериментальное подтверждение, оно будет иметь важное значение для митохондрий растений, причем именно в условиях повышенной температуры. Поскольку, во-первых, в отличие от животных изменение температуры растительных организмов колеблется в широком диапазоне, а быстрое ее повышение (до 35°С и выше), сопровождаемое резкой активацией дыхания, очевидно, приводило бы к быстрому исчерпанию дыхательных субстратов и снижению содержания кислорода в тканях и клетках. Кроме того, в условиях гипертермии, на фоне активации окисления субстратов с участием основной цитохромной ЭТЦ и увеличения скорости образования АФК в митохондриях растений, в том числе, в митохондриях семядолей люпина, нередко обнаруживается ингибирование АО, которая играет ключевую роль в поддержании редокс-гомеостаза митохондрий и клетки, препятствуя возникновению окислительного стресса [8]. Поэтому временное торможение начальной НАД·Н-дегидрогеназы (комплекса I), являющейся основным поставщиком восстановительных эквивалентов в ЭТЦ и одним из главных источников АФК [17, 30], могло бы рассматриваться в качестве важного защитного механизма, предотвращающего избыточную генерацию супероксида и перекиси водорода в митохондриях растений в условиях гипертермии.
Работа выполнена в рамках государственного задания Министерства образования и науки Российской Федерации (номер темы 121040800153-1 “Механизмы адаптации растений к факторам аридизации глобального климата и антропогенному загрязнению окружающей среды”).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Семихатова О.А., Чиркова Т.В. Физиология дыхания растений. СПб.: СПГУ. 2003. 224 с.
Войников В.К. Митохондрии растений при температурном стрессе. Новосибирск. Изд-во: “ГЕО”. 2011. 163 с.
Семихатова О.А. Энергетика дыхания растений при повышенной температуре. Л.: Наука. 1974. 112 с.
Грабельных О.И., Боровик О.А., Таусон Е.Л., Побежимова Т.П., Катышев А.И. Павловская Н.С., Королева Н.А., Любушкина И.В., Башмаков В.Ю., Попов В.Н., Боровский Г.Б., Войников В.К. Митохондриальные энергорассеивающие системы (альтернативная оксидаза, разобщающие белки и “внешняя” NADH-дегидрогенеза) вовлечены в развитие морозоустойчивости проростков озимой пшеницы // Биохимия. 2014. Т. 79. С. 645.
Atkin O.K., Macherel D. The crucial role of plant mitochondria in orchestrating drought tolerance // Ann. Bot. 2009. V. 103. P. 581. https://doi.org/10.1093/aob/mcn094
Liberatore K. L., Dukowic-Schulze S., Miller M.E., Chen C., Kianian S.F. The role of mitochondria in plant development and stress tolerance // Free Rad. Biol. Med. 2016. V. 100. P. 238. https://doi.org/10.1016/j.freeradbiomed.2016.03.033
Jacoby R.P., Li L., Huang S.B., Lee C., Millar A.H., Taylor N.L. Mitochondrial composition, function and stress response in plants // J. Integr. Plant Biol. 2012. V. 54. P. 887. https://doi.org/10.101111/j.1744-7909.2012.01177.x
Vanlerberghe G.C. Alternative oxidase: a mitochondrial respiratory pathway to maintain metabolic and signaling homeostasis during abiotic and biotic stress in plants // Int. J. Mol. Sci. 2013. V. 14. P. 6805. https://doi.org/10.3390/ijmc14046805
Варакина Н.Н., Побежимова Т.П., Войников В.К. Действие гипертермии на энергетическую активность митохондрий и рост проростков кукурузы // Физиология растений. 1991. Т. 38. С. 304.
Atkin O.K., Zhang Q., Wiskich J.T. Effect of temperature on rates of alternative and cytochrome pathway respiration and their relationship with the redox poise of quinone pool // Plant Physiol. 2002. V. 128. P. 212. www.plantphysiol.org/cgi/doi:10.1104/pp.010326
Lin T.-Y., Markhart A.H. Temperature effects on mitochondria respiration in Phaseolus acutifolius A. Gray and Phaseolus vulgaris L. // Plant Physiol. 1990. V. 94. P. 54. https://doi.org/10.1104/pp.94.1.54
Hu W.H., Xiao Y.A., Zeng J.J., Hu X.N. Photosynthesis, respiration and antioxidant enzymes in pepper leaves under drought and heat stresses // Biol. Plant. 2010. V. 54. P. 761.
Побежимова Т.П., Войников И.К., Варакина Н.Н. Термоустойчивость и функциональная стабильность отдельных комплексов дыхательной цепи митохондрий кукурузы, инкубируемых in vitro // Физиология растений 1997. Т. 44. С. 873.
Lenne C., Neuburger M., Douce R. Effect of high physiological temperature on NAD+ content of green leaf mitochondria // Plant Physiol. 1993. V. 102. P. 1157. https://doi.org/10.1104/pp.1024.1157
Grivennikova V.G., Gladyshev G.V., Vinogradov A.D. Deactivation of mitochondrial NADH:ubiquinone oxidoreductase (respiratory complex I): Extrinsically affecting factors // Biochim. Biophys. Acta. 2020. V. 1861. P. 1. https://doi.org/10.1016/j.bbabio.2020.148207
Maklashina E., Kotlyar A.B., Cecchini G. Activ/de-active transition of respiratory complex I in bacteria, fungi, and animals // Biochim. Biophys. Acta. 2003. V. 1606. P. 95. https://doi.org/10.1016/S0005-2728(03)00087-2
Braun H.-P., Binder S., Brennike A., Eubel H., Fernie A.R., Finkemeier I., Klodman J., Konig A.-C., Kuhn K., Meyer E., Obata T., Schwarzlnder M., Takenaka M., Zehrmann A. The life of plant mitochondrial complex I // Mitochondrion. 2014. V. 19. P. 295. https://doi.org/10.1016/j.mito.2014.02.006
Shugaev A.G., Butsanets P.A., Andreev I.M., Shugaeva N.A. Effect of salicylic acid on the metabolic activity of plant mitochondria // Russ. J. Plant Physiol. 2014. V. 61. P. 520. https://doi.org/10.1134/S1021443714040189
Руководство по изучению биологического окисления полярографическим методом / Под ред. Г.М. Франка, М.Н. Кондрашовой, Е.Н. Моховой). М.: Наука. 1973. 222 с.
Chance B. Williams G.R. The respiratory chain and oxidative phosphorylation // Adv. Enzymol. 1956. V. 17. P. 65.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265.
Moller I.M., Berzi A., van der Plas L.H., Lambers H. Measurement of the activity and capacity of the alternative pathway in intact plant tissues. Identification of problems and possible solutions // Physiol. Plant. 1988. V. 72. P. 642. https://doi.org/10.1111/J.1399-3054.1988.TB09176.X
Romani R., Ozelkok S. “Survival” of mitochondria in vitro // Plant Physiol. 1973. V. 57. P. 702. https://doi.org/10.1104/pp.51.4.702
Kotlyar A.B., Vinogradov A.D. Slow active/inactive transition of the mitochondrial NADH-ubiquinone reductase // Biochim. Biophys. Acta. 1990. V. 1019. P. 151. https://doi.org/10.1016/0005-2728(90)90137-s
Grivennikova V.G., Kapustin A.N., Vinogradov A.D. Catalytic activity of NADH-ubiquinone oxidoreductase (complex I) in intact mitochondria // J. Biol. Chem. 2001. V. 276. P. 9038. https://doi.org/10.1074/jbc.M009661200
Hemrika-Vagner A.M., Kreuk K.C.M., van der Plas L.H.W. Influence of growth temperature on respiratory characteristics of mitochondria from callus-forming potato tuber discs // Plant Physiol. 1982. V. 70. P. 602. https://doi.org/10.1104/pp.70.2.602
Stewart C.R., Martin B.A., Reding L., Cerwick S. Seedling growth, mitochondrial characteristics, and alternative respiratory capacity of corn genotypes differing in cold tolerance // Plant Physiol. 1990. V. 92. P. 761. https://doi.org/10.1104/pp.92.3.761
Hung L.-S., Romani R.J. Metabolically driven self-restoration of energy-linked functions by avocado mitochondria // Plant Physiol. 1991. V. 95. P. 1096. https://doi.org/10.1104/pp.95.4.1096
Drose S., Stepanova A., Galkin A. Ischemic A/D transition of mitochondrial complex I and its role in ROS generation // Biochim. Biophys. Acta. 2016. V. 1857. P. 946. https://doi.org/10.1016/j.bbabio.2015.12.013
Murphy M.P. How mitochondria produce reactive oxygen species // Biochem J. 2009. V. 417. P. 1. https://doi.org/10.1042/BJ20081386
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений