Физиология растений, 2022, T. 69, № 6, стр. 675-690
Активность каталазы и пероксидазы в растениях пшеницы и риса в условиях аноксии и постаноксической аэрации
В. В. Емельянов a, b, *, В. В. Ласточкин b, Е. Г. Приказюк b, c, Т. В. Чиркова b
a Кафедра генетики и биотехнологии Санкт-Петербургского
государственного университета
Санкт-Петербург, Россия
b Кафедра физиологии и биохимии растений Санкт-Петербургского
государственного университета
Санкт-Петербург, Россия
c Кафедра водных ресурсов, факультет геоинформатики и наблюдения за Землей,
университет Твенте
Энсхеде, Нидерланды
* E-mail: bootika@mail.ru
Поступила в редакцию 20.02.2022
После доработки 06.03.2022
Принята к публикации 08.03.2022
- EDN: FYHHQT
- DOI: 10.31857/S0015330322060033
Аннотация
Влияние аноксии и последующей реаэрации на образование пероксида водорода, активность каталазы (КФ 1.11.1.6) и гваяколпероксидазы (КФ 1.11.1.7) были изучены у растений пшеницы и риса, контрастных по устойчивости к гипоксии. Показано, что у неустойчивой к гипоксии пшеницы действие аноксии и реаэрации приводило к значительному усилению продукции Н2О2, особенно при продолжительных сроках воздействия. У риса, устойчивого к кислородной недостаточности, существенной продукции Н2О2 выявлено не было. Под влиянием аноксии и последующего окислительного стресса наблюдалось быстрое повышение активности каталазы, а также внутри- и внеклеточной гваяколпероксидазы у устойчивого растения. У пшеницы стимуляции каталазы не происходило, а пероксидаза активировалась только в побегах после краткосрочной аноксии и продолжительной реаэрации. Повышение или поддержание активности каталазы и пероксидазы в проростках риса в условиях аноксии и реоксигенации снималось в результате действия циклогексимида и, в меньшей степени, актиномицина D. Стимуляция каталазы у риса сопровождалась усилением экспрессии генов, особенно OsCatB и OsCatС. Активность апопластных пероксидаз подавлялась брефельдином А. Электрофоретическое исследование не выявило появления новых изоформ гваяколпероксидазы в условиях аноксии и постаноксической аэрации. Однако была показана значительная стимуляция как большинства уже имеющихся изоформ у риса, так и отдельных изоформ у пшеницы. Предполагается, что у устойчивого растения активация пероксидаз в апопласте в условиях аноксии и постаноксической аэрации является адаптивным механизмом, необходимым для разрушения пероксида водорода в клеточной стенке, что препятствует проникновению его в цитозоль. Детоксикации АФК в цитоплазме клеток риса может способствовать повышение активности каталазы и внутриклеточной пероксидазы при продолжительной реаэрации. В отличие от риса, у пшеницы отсутствие активации ферментов антиоксидантной защиты в клеточной стенке, по-видимому, открывает доступ АФК внутрь клеток, где в их обезвреживании участвуют цитоплазматические формы гваяколпероксидаз. Эффективная работа антиоксидантных ферментов при аноксии и постаноксической аэрации у устойчивого растения предотвращает накопление АФК и является важным адаптивным механизмом как к недостатку кислорода, так и последующему окислительному стрессу.
ВВЕДЕНИЕ
Кислородная недостаточность – один из широко распространенных неблагоприятных факторов, с которым сталкиваются представители культурной и дикорастущей флоры при затоплении, особенно стоячей водой, создании асфальтовых покрытий в городах, образовании ледяной корки на поверхности почвы, прорастании семян и даже при неправильном хранении плодов и овощей. Способность произрастать в обедненной кислородом среде связана с наличием у растений определенных морфолого-анатомических и физиолого-биохимических приспособлений, подробно рассмотренных в ряде обзоров [1–9]. Кратко, у приспособленных растений существуют две стратегии адаптации: активное избегание кислородной недостаточности (low oxygen escape syndrome, LOES) и пассивная стратегия покоя (low oxygen quiescence syndrome, LOQS) [7–11]. Первая стратегия включает в себя (1) быстрый рост побегов, гипонастический изгиб листьев, образование аэренхимы, закладку придаточных корней, преобразование анатомии листьев и формирование газовой пленки на их гидрофобной поверхности для улучшения диффузии газов и т.п. В результате этих преимущественно морфолого-анатомических приспособлений надземная часть растения транспортирует кислород в затопленные корни, что позволяет им поддерживать обмен веществ. Вторая стратегия (LOQS) характеризуется торможением роста и реализуется, в первую очередь, как метаболическая адаптация, заключающаяся в (2) эффективном обеспечении растительного организма энергией за счет создания запасов углеводов, интенсификации гликолиза и брожений и использования альтернативных дыхательных субстратов; (3) обезвреживании токсичных метаболитов анаэробного обмена за счет их удаления или использования альтернативных метаболических путей реокисления восстановленных коферментов; (4) поддержании стабильности тканей (особенно меристем), клеток и клеточных мембранных компонентов (митохондрий, пластид) [1–5, 9]. Эти адаптации позволяют приспособленным растениям получать достаточное для жизнедеятельности количество энергии, поддерживать водно-минеральный баланс и расти даже в условиях полного отсутствия кислорода.
Однако выход растений из дефицитной по кислороду среды таит в себе еще больше опасностей. С гипоксическим (недостаток кислорода) или аноксическим (отсутствие кислорода) воздействиями тесно связано влияние окислительного стресса, который возникает еще в анаэробной среде и особенно усиливается сразу после действия дефицита кислорода, когда растения снова оказываются в условиях нормальной аэрации. Накопившиеся во время кислородного голодания восстановленные субстраты начинают окисляться кислородом воздуха, что приводит к генерации активных форм кислорода (АФК) и развитию постаноксических повреждений, которые также могут привести растение к гибели [2, 10, 11]. В природе окислительный стресс – прямое следствие гипоксии и аноксии. Постаноксические повреждения были выявлены у ириса германского (Iris germanica) [2, 12], риса (Oryza sativa) [13], пшеницы (Triticum aestivum) и овса (Avena sativa) [12, 13], сои (Glycine max) [14], желтого люпина (Lupinus luteus) [15] и других растений, однако сравнение степени повреждения у объектов с разной устойчивостью к кислородному дефициту проводится исследователями крайне редко. Ранее мы показали большие окислительные повреждения липидов и белков в растениях пшеницы по сравнению с растениями риса [13, 16]. Во время постаноксической реаэрации у растений возрастает уровень АФК [14, 15, 17–20] и свободных радикалов [21].
Для предотвращения действия окислительного стресса растения располагают многоуровневой системой защиты от повреждающего действия АФК. Важнейшей частью антиоксидантной системы являются ферменты, предотвращающие образование АФК или разрушающие их. Главную роль среди этих ферментов выполняют различные пероксидазы.
Каталаза (КФ 1.11.1.6) осуществляет распад двух молекул H2O2 с образованием воды и свободного кислорода. Этот фермент не нуждается в дополнительных субстратах и проводит окисление молекулы пероксида водорода за счет кислорода другой молекулы H2O2. Локализован фермент преимущественно в пероксисомах, где он отвечает за антиоксидантную защиту, в том числе и при фотодыхании. Особенно его роль возрастает при действии неблагоприятных факторов. Стимуляция каталазы показана под действием реаэрации для растений желтого люпина [15, 21], лотоса (Nelumbo nucifera) [22], резуховидки (Arabidopsis thaliana) [19] и риса [23]. Данные о сравнении действия постаноксического окислительного стресса на растения с контрастной устойчивостью к гипоксии приводятся в работе Monk с соавт. [24]. Показано, что в корневищах менее устойчивых растений реаэрация вызывала существенное возрастание каталазной активности. Сравнительного анализа изменений активности этого фермента в зеленых побегах и корнях растений пшеницы и риса не проводилось.
Гваяколпероксидаза (секреторная пероксидаза III класса, КФ 1.11.1.7) катализирует окисление разнообразных химических соединений за счет кислорода перекиси водорода [25]. Она вовлечена в фенольный обмен и лигнификацию клеточной стенки. Велика адаптивная роль пероксидаз при неблагоприятных воздействиях, особенно при патогенезе. Кроме того, многие ее изоформы участвуют в окислении ауксина, поэтому ее активность связана с регуляцией ростовых процессов. Антиоксидантная функция гваяколпероксидазы состоит в детоксикации пероксида водорода как одной из АФК. Фермент локализован в вакуолях, системе везикулярного транспорта и клеточной стенке [26].
Известно, что под влиянием гипо- и аноксии активность пероксидазы возрастает, появляются ее новые изоформы [20, 27–29]. Увеличение активности фермента связывают с необходимостью разрушения накапливающихся продуктов анаэробного обмена, в том числе и фенольных соединений. При постаноксической аэрации было обнаружено участие гваяколпероксидазы в процессе разложения пероксида водорода в культуре клеток сои [14] и резуховидки [19]. С другой стороны, в корнях люпина пероксидаза не играла существенной роли в детоксикации АФК при реоксигенации [21]. Имеются сведения и об отсутствии стимуляции этого фермента у коровьего гороха (Vigna unguiculata) при гипоксии [30]. Наряду с этим, известны данные и о снижении активности гваяколпероксидазы в условиях гипоксии в колеоптилях проростков риса, что связывали с ускорением роста этих органов [31].
Таким образом, в литературе имеются немногочисленные и неоднозначные данные о влиянии недостатка кислорода на активность каталазы и гваяколпероксидазы. В наших работах с растениями, контрастными по устойчивости к дефициту кислорода, была показана активация пероксидазы в результате действия аноксии [1, 29], причем в большей степени в апопласте клеток корней устойчивых растений [32]. Однако в этих работах не рассматривали роль гваяколпероксидазы как антиоксидантного фермента в постаноксический период и не сопоставляли его активность с накоплением пероксида водорода.
Цель работы – изучение действия аноксии и постаноксического окислительного стресса на продукцию перекиси водорода и активность каталазы и гваяколпероксидазы у растений пшеницы и риса, контрастных по устойчивости к недостатку кислорода.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал и условия выращивания. Эксперименты проводили на 7-дневных проростках пшеницы (Triticum aestivum L.) сорта Ленинградка и 10-дневных проростках риса (Oryza sativa L.) сорта Лиман. Пшеницу использовали в качестве неустойчивого, а рис – устойчивого к гипоксии растения. Семена поверхностно стерилизовали 5% раствором гипохлорита натрия и выращивали в гидропонных условиях, как было описано нами ранее [33]. Анаэробные условия создавали пропусканием газообразного азота (содержание кислорода < 0.01%) через камеры с растениями, которые затем герметично закрывали и помещали в темноту для предотвращения образования кислорода на свету. Анаэробные условия проверяли с помощью индикатора Anaerotest (“Merck”, Германия). Экспозиция в атмосфере азота составляла 12, 24 и 72 ч. Контрольные растения помещали в темноту в условиях аэрации.
Для создания условий реаэрации опытные растения вынимали из камер и оставляли на воздухе в темноте на 1, 12 и 24 ч после каждого из трех сроков пребывания в бескислородной среде. Для определения продукции перекиси водорода использовали более короткие сроки реаэрации: 5, 15, 30 мин и 1 ч. Относительный уровень транскриптов генов каталазы у риса детектировали после 1 и 24 ч реаэрации.
Определение продукции перекиси водорода проводили спектрофотометрическим методом при помощи ксиленового оранжевого [34]. Об уровне продукции судили на основании изменения оптической плотности раствора при 560 нм на спектрофотометре СФ-26 (“ЛОМО”, Россия). Стандартные растворы пероксида водорода были использованы для построения калибровочной кривой. Специфичность была подтверждена ингибированием продукции Н2О2 добавлением 500 ед. каталазы на 1 мл среды инкубации.
Получение апопластной жидкости (для анализа активности гваяколпероксидазы клеточной стенки). Растительный материал (1 г) ополаскивали дистиллированной водой, обсушивали на фильтровальной бумаге, нарезали отрезками по 30 мм длиной и в течение 20 мин подвергали вакуум-инфильтрации (–70 кПа) 0.05 М MES-буфером (рН 6.0), содержавшем 1 М NaCl [35]. Соотношение ткань : буфер составляло 1 : 10 (w/v). После инфильтрации растительный материал обсушивали и центрифугировали над сеточкой при 1000 g в течение 15 мин. В результате описанной выше процедуры получали 180–250 мкл апопластной жидкости, в которой определяли активность и изоферментный состав гваяколпероксидазы. Возможность загрязнения выделяемой апопластной фракции цитоплазматическими белками проверяли, анализируя активность маркерного фермента цитоплазмы – глюкозо-6-фосфатдегидрогеназы. Во всех случаях в исследуемой фракции активность этого фермента не была обнаружена.
Экстракция симпластной гваяколпероксидазы и каталазы. Все операции по выделению ферментов проводили при температуре 0…+4°С. Оставшуюся после центрифугирования инфильтрата растительную ткань (для гваяколпероксидазы) или навеску растительного материала (1 г, для каталазы) гомогенизировали и экстрагировали охлажденным 0.02 М K, Na-фосфатным буфером 30 мин (рН 6.5, соотношение 1 : 10, w/v). После центрифугирования (15 мин, 5500 g) супернатант собирали, а осадок ресуспендировали с 1/2 первоначального объема буфера, снова экстрагировали 20 мин, после чего вновь центрифугировали. Промывку повторяли. Объединенную фракцию использовали для определения активности ферментов в цитоплазме, а также для определения изоферментного спектра гваяколпероксидазы.
Определение содержания белка в ферментной вытяжке проводили методом Брэдфорда [36].
Определение активности каталазы. Реакционная среда для определения активности каталазы содержала 0.02 М K, Na-фосфатный буфер (pH 6.5) и 40 мкл ферментной вытяжки (7–25 мкг белка). Реакцию начинали введением перекиси водорода (10 мМ), в контрольном варианте добавляли дистиллированную воду. Конечный объем среды – 3 мл. Измерение оптической плотности производили при 240 нм на спектрофотометре СФ-46 (“ЛОМО”, Россия) в течение 2 мин с 20-секундным интервалом. Активность фермента рассчитывали в микромолях разрушаемой перекиси водорода на 1 г сырой массы в минуту, используя коэффициент экстинкции H2O2 39.4 мМ–1 см–1 [37].
Определение активности гваяколпероксидазы проводили на спектрофотометре СФ-26 (“ЛОМО”, Россия) при помощи гваякола, который в пероксидазной реакции превращается в тетрагваякол. Состав реакционной среды: 0.5 мл 0.05 М гваякола (“Sigma”, США), 0.5 мл 0.03% Н2О2 и 25 мкл ферментной вытяжки, содержащей 7–25 мкг белка, в 0.02 М фосфо-цитратном (рН 5.0, для апопластной фракции) или 0.02 М K, Na-фосфатном буфере (рН 6.5, для внутриклеточной фракции). Конечный объем среды – 3 мл. Реакцию запускали добавлением перекиси водорода. Оптическую плотность измеряли при 470 нм в течение 2 мин с момента начала реакции с 20-секундным интервалом. Активность фермента рассчитывали в микромолях окисляемого гваякола на 1 г сырой массы в минуту, используя коэффициент экстинкции тетрагваякола 26.6 мМ–1 см–1.
Определение изоферментного спектра пероксидаз проводили методом нативного электрофореза в пластинах полиакриламидного геля в кислой буферной системе [38]. Разделение проводили в камерах Mini-PROTEAN® с источником тока PowerPacTM Universal (“Bio-Rad Laboratories”, США) при напряжении 300 мВ в течение 40 мин. После разделения гели промывали 3 раза по 10 минут в 0.2 М ацетатном буфере (рН 5.0). Проявку пероксидаз проводили в среде, содержавшей 35 мМ гваякол, 3.3 мМ H2O2, и 0.1 М ацетатный буфер (рН 5.0). После проявления гели сканировали на сканере НР ScanJet 2000C (“Hewlett-Packard”, США). Полученные изображения анализировали с помощью ImageJ 1.53k. Оцифровывали денситограммы дорожек электрофореза и рассчитывали интенсивность окраски пятен. На графиках Дополнительных материалов (рис. 1, 2) приведены средние из трех повторностей.
Рис. 1.
Продукция перекиси водорода в побегах (а, б) и корнях (в, г) проростков пшеницы (а,
в) и риса (б, г) в условиях аноксии и последующей реаэрации. Значения с разными буквами
(a–g) достоверно различаются (LSD тест, P < 0.05). Условные обозначения:  – аэрация,
– аэрация,  – аноксия,
– аноксия,  – 5 мин реаэрация,
– 5 мин реаэрация,  – 15 мин реаэрация,
– 15 мин реаэрация,  – 30 мин реаэрация,
– 30 мин реаэрация,  – 1 ч реаэрация.
– 1 ч реаэрация.
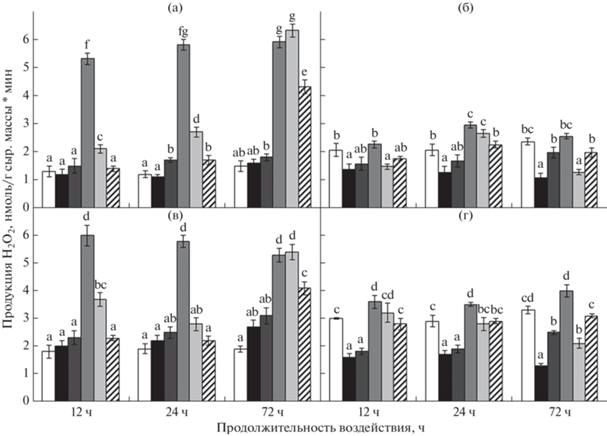
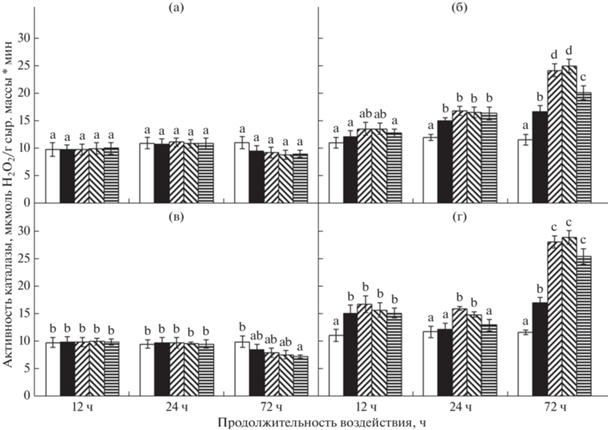
Рис. 2.
Активность каталазы в побегах (а, б) и корнях (в, г) проростков пшеницы (а, в) и риса
(б, г) в условиях аноксии и реаэрации. Значения с разными буквами (a–d) достоверно
различаются (LSD тест, P < 0.05). Условные обозначения:  – аэрация,
– аэрация,  – аноксия,
– аноксия,  – 1 ч реаэрация,
– 1 ч реаэрация,  – 12 ч реаэрация,
– 12 ч реаэрация,  – 24 ч реаэрация.
– 24 ч реаэрация.
Ингибиторный анализ. Для выявления возможных механизмов регуляции активности изучаемых ферментов растения обрабатывали ингибиторами транскрипции (актиномицин D, 6 × 10–5 М, “Reanal”, Венгрия), трансляции (циклогексимид, 3 × × 10–5 М, “Sigma”, США) и везикулярного транспорта (брефельдин А, 7 × 10–5 М, “Sigma”, США). Перед постановкой в экспериментальные условия растения помещали в стаканы, содержавшие 20 мл 20% раствора Кнопа с растворенным ингибитором на 3 ч.
Подбор праймеров для генов каталазы. Экспрессию генов каталазы изучали в проростках риса, поскольку только в них возрастала активность этого фермента. Пероксидазы III класса, т.е. гваяколпероксидазы, кодируются у риса 125–160 ORF, и изучение их экспрессии требует отдельного транскриптомного исследования. Для подбора праймеров были проанализированы электронные базы данных аннотированного генома риса (“Rice Genome Annotation Project”, http://rice.plantbiology. msu.edu/ и “The rice annotation project database”, http://rapdb.dna.affrc.go.jp/tools/search/), а также референсный геном риса IRGSP-1.0 Oryza sativa var. japonica сорта Nipponbare, доступный на сайте http://www.ncbi.nlm.nih.gov/. Были найдены последовательности нуклеотидов трех генов, кодирующих каталазу. Исследованы кодирующие последовательности ДНК (CDS), определяющие варианты альтернативного сплайсинга (изоформы) ферментов одного типа (Cat A и B). С помощью программы MegAlign 5.05 из набора программ DNAStar было проведено выравнивание всех CDS соответствующих изоформ по алгоритму ClustalW. К консенсусным участкам были подобраны праймеры в программе Beacon Designer 8 (табл. 1), т.е. разработанные нами праймеры позволяют оценить экспрессию любых вариантов альтернативного сплайсинга по изучаемым генам. В качестве гена сравнения (референсного) был использован OsTUB4 (Os01g0805900), кодирующий бета-4-тубулин и продемонстрировавший наиболее стабильную экспрессию в предварительных экспериментах. Специфичность праймеров проверяли с помощью поиска гомологии с геномом и транскриптомом риса по алгоритму BLASTn на сайте базы данных NCBI http://blast.ncbi.nlm.nih.gov/. Праймеры заказывали в компании Бигль (Россия, http://www.biobeagle.com/). Качество работы праймеров проверяли по результатам ПЦР.
Таблица 1.
Праймеры к генам риса, кодирующим каталазы и бета-2-тубулин
| Ген | RAP-DB | NCBI | Праймеры (5'–3') | Длина продукта, п.н. | Локализация белка |
|---|---|---|---|---|---|
| OsCatA | Os02g0115700 | LOC4328073 | GGAGGCAGAAGGCGACGATACA AACGACTCATCACACTGGGAGAGG |
187 | Пероксисомы глиоксисомы митохондрии |
| OsCatB | Os06g0727200 | LOC4342124 | CAAGGAGAACAATTTCCAACAGGC CACTGCGACCAGTAGGAGATCCAG |
153 | Пероксисомы |
| OsCatC | Os03g0131200 | LOC4331509 | GTGATTGCCAAGGAGAACAACTTCA GCCAGTTTCTGACCCAGAGACCTG |
188 | Пероксисомы |
| OsTUB4 | Os01g0805900 | LOC4327550 | GAACCATTTGATTTCTGCCACCA CGGTACTGCTGGGAGCCACG |
171 | Тубулин-бета 4 ген сравнения |
Выделение РНК и синтез кДНК проводили из тканей проростков риса. Для этого взвешивали по 150 мг побегов и 200 мг корней. Образцы замораживали в жидком азоте и гомогенизировали с помощью шаровой мельницы Tissue Lyser LT (“Qiagen”, Германия) три раза по 1 мин, 50 уд./с. К образцу добавляли 1 мл изолирующего РНК реагента PureZOL™ (“Bio-Rad Laboratories”, США) и проводили дальнейшее выделение по методике производителя. Очистку выделенной РНК от примеси ДНК осуществляли ДНКазой I (“Thermo Fisher Scientific”, США). Качество ДНКазной обработки проверяли с помощью ПЦР, где в качестве матрицы использовали РНК, и последующего электрофоретического разделения продуктов в 1% агарозном геле (ТАЕ-буфер, 120 В, 40 мин) с окрашиванием бромистым этидием (0.5 мкг/мл). Для всех пар использованных праймеров продуктов полимеризации с РНК не было обнаружено. Определение концентрации РНК проводили на спектрофотометре NanoDrop 1000 (“Thermo Fisher Scientific”, США). После измерения было проведено выравнивание проб по концентрации РНК до 2.5 мкг/мкл, необходимое для количественного анализа экспрессии. Комплементарную ДНК (кДНК) синтезировали c помощью набора RevertAid Reverse Transcriptase (“Thermo Fisher Scientific”, США) с применением ингибитора РНКаз RiboLock (“Thermo Fisher Scientific”, США). Все манипуляции осуществляли в соответствии с протоколом производителя. Синтез кДНК проводили с использованием Oligo(dT) праймеров (“Бигль”, Россия). Образцы кДНК осаждали 0.1 М раствором ацетата натрия в этаноле, растворяли стерильной деионизированной водой, разделяли на аликвоты и хранили при –80°C до анализа.
Количественную ПЦР в реальном времени (ОТ-ПЦР-РВ) проводили в реакционной смеси объемом 12.5 мкл следующего состава: 50 нг кДНК, по 10 пмоль прямого и обратного праймеров (F и R), 0.75 мкл MgCl2, 5 мкл 2.5× реакционной смеси SYBRGreen (“Синтол”, Россия, http://www.syntol.ru), до необходимого объема смесь доводили бидистиллированной водой из набора. Каждую реакцию проводили в трех аналитических повторностях. Контролем к каждому праймеру служила проба без кДНК. ОТ-ПЦР-РВ проводили на термоциклере C1000 с оптическим модулем CFX96 (“Bio-Rad Laboratories”, США). Использовали оборудование ресурсного центра СПбГУ “Развитие молекулярных и клеточных технологий”. Программа амплификации включала 45 циклов следующего состава: плавление 15 с при 95°С, отжиг 15 с при 60°С, элонгация 30 с при 72°С. Началу амплификации предшествовала 7-минутная инкубация при 95°С, а завершению – замер кривых плавления продуктов с постепенным нагреванием от 65 до 95°С. Для получения относительного количества транскриптов из пороговых циклов амплификации (Ct) использовали метод 2–ΔCt, а для получения степени изменения относительного количества транскриптов каждого гена – метод 2–ΔΔCt [39]. Изменение уровня экспрессии рассчитывали относительно контрольных (нормоксических) значений, принимая их за единицу.
Все опыты проводили в 4–8-кратной биологической повторности. Статистическую обработку данных осуществляли с помощью GraphPad Prism 5 для Windows. На графиках (рис. 1–5) приведены средние значения величин и их стандартные ошибки. Значения с разными буквами достоверно различаются при P < 0.05 (метод группирования выборок с наименее значимой разницей, Least Significant Difference test). В таблицах 2–4 данные ингибиторного анализа выражены в процентах от соответствующего значения без ингибитора и приведены их средние значения и стандартные ошибки. Звездочками обозначены статистически значимые различия от контроля (множественный парный тест Вилкоксона; P ≤ 0.05).
Рис. 3.
Относительный уровень транскрипции генов каталазы OsCatA (а, г), OsCatB (б, д) и OsCatC (в, е) в побегах (а–в) и корнях (г–е) проростков риса в условиях аноксии и реаэрации.
За единицу принят уровень экспрессии в контроле (аэрация). Значения с разными буквами
(a–h) достоверно различаются (LSD тест, P < 0.05). Условные обозначения:  – аэрация,
– аэрация,  – аноксия,
– аноксия,  – 1 ч реаэрация,
– 1 ч реаэрация,  – 24 ч реаэрация.
– 24 ч реаэрация.

Рис. 4.
Активность апопластной пероксидазы в побегах (а, б) и корнях (в, г) проростков пшеницы
(а, в) и риса (б, г) в условиях аноксии и реаэрации. Значения с разными буквами (a–e)
достоверно различаются (LSD тест, P < 0.05). Условные обозначения:  – аэрация,
– аэрация,  – аноксия,
– аноксия,  – 1 ч реаэрация,
– 1 ч реаэрация,  – 12 ч реаэрация,
– 12 ч реаэрация,  – 24 ч реаэрация.
– 24 ч реаэрация.

Рис. 5.
Активность внутриклеточной пероксидазы в побегах (а, б) и корнях (в, г) проростков
пшеницы (а, в) и риса (б, г) в условиях аноксии и реаэрации. Значения с разными буквами
(a–e) достоверно различаются (LSD тест, P < 0.05). Условные обозначения:  – аэрация,
– аэрация,  – аноксия,
– аноксия,  – 1 ч реаэрация,
– 1 ч реаэрация, 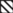 – 12 ч реаэрация,
– 12 ч реаэрация,  – 24 ч реаэрация.
– 24 ч реаэрация.

Таблица 2.
Действие ингибиторов транскрипции и трансляции на активность каталазы проростков пшеницы и риса в условиях 72 ч аноксии и последующей реаэрации, % от активности без ингибитора
| Пшеница | ||||
|---|---|---|---|---|
| побег | корень | |||
| актиномицин | циклогексимид | актиномицин | циклогексимид | |
| Аноксия | 99.5 ± 7.3 | 92.1 ± 10.1 | 98.4 ± 11.3 | 91.9 ± 11.2 |
| 1 ч реаэрация | 98.9 ± 7.0 | 92.2 ± 9.1 | 96.8 ± 10.5 | 83.4 ± 9.1 |
| 12 ч реаэрация | 96.8 ± 6.0 | 81.6 ± 7.2* | 98.0 ± 9.9 | 83.1 ± 8.4 |
| 24 ч реаэрация | 97.7 ± 7.1 | 68.4 ± 7.6* | 98.0 ± 3.9 | 71.3 ± 13.1* |
| Рис | ||||
| побег | корень | |||
| актиномицин | циклогексимид | актиномицин | циклогексимид | |
| Аноксия | 97.0 ± 7.4 | 73.6 ± 6.7* | 95.9 ± 6.4 | 72.6 ± 7.7* |
| 1 ч реаэрация | 87.7 ± 4.0* | 62.1 ± 4.8* | 75.1 ± 2.5* | 58.9 ± 4.1* |
| 12 ч реаэрация | 83.6 ± 2.4* | 59.6 ± 3.9* | 72.4 ± 2.7* | 55.2 ± 4.0* |
| 24 ч реаэрация | 91.5 ± 5.6 | 72.7 ± 3.4* | 79.0 ± 6.4* | 62.4 ± 6.0* |
Таблица 3.
Действие ингибиторов транскрипции, трансляции и везикулярной секреции на активность пероксидазы апопласта проростков пшеницы и риса под влиянием 12 ч аноксии и реаэрации, % от активности без ингибитора
| Пшеница | ||||||
|---|---|---|---|---|---|---|
| побег | корень | |||||
| актиномицин | циклогексимид | брефельдин | актиномицин | циклогексимид | брефельдин | |
| Аноксия | 95.0 ± 5.4 | 79.3 ± 9.6 | 100.0 ± 8.1 | 96.8 ± 4.0 | 133.8 ± 18.5 | 96.0 ± 6.2 |
| 1 ч реаэрация | 107.6 ± 9.0 | 119.4 ± 12.9 | 71.6 ± 6.2* | 99.5 ± 9.8 | 104.2 ± 3.2 | 90.2 ± 2.2* |
| 12 ч реаэрация | 98.6 ± 2.3 | 96.1 ± 0.2* | 47.1 ± 4.2* | 94.9 ± 7.1 | 106.0 ± 2.4 | 78.5 ± 4.2* |
| 24 ч реаэрация | 96.0 ± 7.0 | 102.8 ± 6.8 | 51.4 ± 4.2* | 103.3 ± 9.0 | 91.0 ± 7.5 | 97.2 ± 6.2 |
| Рис | ||||||
| побег | корень | |||||
| актиномицин | циклогексимид | брефельдин | актиномицин | циклогексимид | брефельдин | |
| Аноксия | 99.2 ± 8.3 | 96.8 ± 9.5 | 94.7 ± 6.2 | 94.1 ± 4.3 | 76.9 ± 10.2* | 76.5 ± 7.4* |
| 1 ч реаэрация | 98.7 ± 3.9 | 91.6 ± 2.4* | 72.0 ± 3.9* | 94.4 ± 7.0 | 66.3 ± 6.4* | 64.9 ± 7.8* |
| 12 ч реаэрация | 95.6 ± 5.0 | 77.2 ± 5.3* | 62.9 ± 4.3* | 69.7 ± 0.7* | 48.1 ± 4.6* | 47.6 ± 2.7* |
| 24 ч реаэрация | 93.0 ± 5.4 | 73.0 ± 7.7* | 57.9 ± 4.5* | 98.4 ± 1.6 | 68.9 ± 5.6* | 67.7 ± 5.6* |
Таблица 4.
Действие ингибиторов транскрипции и трансляции на активность пероксидазы симпласта проростков пшеницы и риса под влиянием 12 ч аноксии и реаэрации, % от активности без ингибитора
| Пшеница | ||||
|---|---|---|---|---|
| побег | корень | |||
| актиномицин | циклогексимид | актиномицин | циклогексимид | |
| Аноксия | 112.8 ± 5.0 | 136.5 ± 19.1 | 96.8 ± 2.1 | 104.9 ± 14.7 |
| 1 ч реаэрация | 92.2 ± 6.1 | 116.2 ± 11.5 | 98.8 ± 4.0 | 117.4 ± 3.4 |
| 12 ч реаэрация | 98.2 ± 2.3 | 92.5 ± 2.4 * | 97.4 ± 3.3 | 102.2 ± 3.8 |
| 24 ч реаэрация | 95.4 ± 9.3 | 88.4 ± 5.7 | 96.6 ± 9.7 | 108.6 ± 7.1 |
| Рис | ||||
| побег | корень | |||
| актиномицин | циклогексимид | актиномицин | циклогексимид | |
| Аноксия | 99.0 ± 13.8 | 69.4 ± 8.0 * | 92.6 ± 5.2 | 106.3 ± 6.3 |
| 1 ч реаэрация | 92.7 ± 11.9 | 89.3 ± 7.3 | 104.6 ± 7.5 | 96.0 ± 4.5 |
| 12 ч реаэрация | 95.0 ± 7.8 | 91.5 ± 8.2 | 99.9 ± 3.2 | 90.9 ± 3.5* |
| 24 ч реаэрация | 67.4 ± 8.9* | 51.9 ± 5.2 * | 57.0 ± 3.5 * | 90.4 ± 7.3 |
РЕЗУЛЬТАТЫ
Исходный уровень продукции перекиси водорода у риса был выше, чем у пшеницы, особенно в корнях (рис. 1). У проростков пшеницы аноксия не приводила к существенному изменению в количестве анализируемого пероксида водорода. У риса, в отличие от пшеницы, аноксическое воздействие снижало уровень продукции перекиси тканями. Во время реоксигенации у обоих растений уровень продукции пероксида водорода повышался. У пшеницы, как в побегах, так и в корнях, после 12 и 24 ч аноксии происходило увеличение продукции Н2О2 через 15 мин пребывания на воздухе почти в 5 раз, после чего она снижалась до контрольного уровня (рис. 1а, б). После 72 ч аноксии уровень пероксида сохранялся высоким не только после 15, но и после 30 мин реаэрации, и не достигал исходной величины даже через 1 ч. Продукция перекиси водорода в побегах и корнях риса при реаэрации превышала контрольные значения не столь значительно, как у пшеницы. В корнях риса она возрастала в большей степени, чем в побегах (рис. 1г). У обоих исследованных растений максимум продукции перекиси тканями приходился на 15 мин реаэрации после всех сроков аноксии.
Каталаза – один из основных ферментов, осуществляющих детоксикацию перекиси водорода. Исходный уровень ее активности у пшеницы и риса почти не различался (рис. 2). Аноксия и последующая реаэрация не приводили к изменениям активности фермента в проростках пшеницы, но при длительной (24 ч) реоксигенации после 72 ч аноксии его активность понижалась (рис. 2а, б). У риса, напротив, происходила активация каталазы при 12 ч аноксии в корнях и 24 ч аноксии в побегах. Отсутствие кислорода в течение 72 ч стимулировало активность в обоих органах (рис. 2в, г). Во время реаэрации каталазная активность в проростках риса была выше контрольной после всех сроков аноксического воздействия. Максимальная активация каталазы (в 2–3 раза) в проростках риса была обнаружена во время реаэрации после 72 ч аноксии. Поэтому было рассмотрено действие ингибиторов на активность каталазы у риса именно в этом варианте. Для сравнения было проанализировано влияние ингибиторов и у пшеницы, активность каталазы у которой, наоборот, падала. Растения обрабатывали ингибиторами транскрипции (актиномицин D) и трансляции (циклогексимид). Предобработка проростков актиномицином D не приводила к каким-либо заметным изменениям в активности каталазы у пшеницы, тогда как циклогексимид вызывал ингибирование при 12–24 ч реаэрации (табл. 2). У риса ингибиторы в большей степени подавляли активность каталазы, причем циклогексимид также был более эффективен. Наиболее сильное подавление активности было при 12 ч реаэрации (табл. 2). В связи с этим у риса исследовали экспрессию генов, кодирующих каталазы. Исходно, до начала эксперимента, в побеге 10-дневных проростков преимущественно экспрессировался ген OsCatA (80% суммарной экспрессии генов каталаз оценивалось относительно гена сравнения OsTUB4), а в корне с таким же преимуществом – OsCatB. Экспрессия OsCatC в побеге не превышала 5%, а в корне – 1%. В побеге проростков риса короткие сроки аноксии (12 ч) почти не сказывались на экспрессии генов каталаз, а реаэрация стимулировала накопление транскриптов всех трех генов, причем у OsCatB и OsCatС через 1 ч, тогда как у OsCatA – после 24 ч (рис. 3а–в). При длительных сроках аноксии (24 и 72 ч) экспрессия OsCatA в побеге риса подавлялась в бескислородных условиях и восстанавливалась только после 24 ч, тогда как OsCatB и OsCatC, наоборот, стимулировались именно в условиях аноксии и оставались активными при реаэрации. В корнях проростков риса краткосрочная аноксия (12 ч) стимулировала накопление транскриптов всех генов каталаз, которое оставались на высоком уровне и во время реаэрации, причем, так же как и в побегах, максимум аккумуляции мРНК OsCatB и OsCatC приходился на 1 ч, а OsCatA – на 24 ч постаноксии (рис. 3г–д). Как и в побегах, при длительном анаэробном воздействии OsCatA в корнях инактивировался, а OsCatB и OsCatC – стимулировались, причем изменения экспрессии в корне на протяжении всего времени действия стрессора почти на 100% были связаны с геном OsCatB. При реаэрации уровень транскриптов у OsCatA в корнях стремился к контрольным значениям, а у OsCatB и OsCatC оставался выше контроля. Таким образом, все гены каталаз являлись чувствительными к аноксии и постаноксическому окислительному стрессу.
Гваяколпероксидаза представляет собой один из самых распространенных ферментов в симпласте и апопласте растительных клеток, осуществляющий окисление фенольных соединений при помощи пероксида водорода. Каталитическая активность гваяколпероксидазы проявляется при одновременном связывании в активном центре фермента двух молекул фенольных соединений и молекулы H2O2. Апопластная форма пероксидазы первой сталкивается с АФК, проникающими в клетку извне, в связи с чем в нашей работе ей уделено особое внимание. Активность пероксидазы клеточной стенки в исходных контрольных вариантах обоих растений была приблизительно одинаковой (рис. 4). В результате действия анаэробиоза у пшеницы в течение первых 12 ч происходило снижение активности фермента как в побегах, так и в корнях. При 24 ч экспозиции в ее побегах активность оставалась низкой, а в корнях – почти не изменялась, как и в обоих органах при 72 ч аноксии (рис. 4а, в). У риса в побегах подавление активности фермента было обнаружено только при более коротких экспозициях (12 ч), в корнях же под влиянием анаэробиоза активность гваяколпероксидазы даже вырастала, что особенно четко проявлялось после 24 и 72 ч экспозиции (рис. 4б, г). В период постаноксической аэрации, особенно после 12 ч реоксигенирования, у пшеницы происходила некоторая активация гваяколпероксидазы апопласта и в побегах, и в корнях (рис. 4а, в). Однако она была значительно слабее, чем у риса (рис. 4б, г), у которого активация гваяколпероксидазы апопласта наблюдалась уже в первые часы реоксигенации и была наиболее значительной в побегах после длительных сроков аноксии (рис. 4г).
Активность симпластной формы гваяколпероксидазы была значительно выше, чем апопластной, у обоих растений, что было наиболее показательным для корней (рис. 5). В результате действия анаэробиоза активность фермента снижалась в проростках обоих растений, причем особенно сильно в побегах. Восстановление условий аэрации стимулировало фермент у пшеницы в значительно большей степени, чем у риса (рис. 5а). Наибольшая активация внутриклеточной пероксидазы у пшеницы была обнаружена в побегах при 12–24 ч реаэрации и после самого короткого срока пребывания в бескислородной среде (12 ч). У риса максимум активации симпластной формы этого фермента во всех рассмотренных вариантах приходился на 24 ч после восстановления нормальной аэрации (рис. 5б, г).
Поскольку результаты проведенной работы показали активацию фермента в апопласте у риса и в симпласте у обоих растений в условиях постаноксической аэрации, то представляло интерес определить, связано ли это активирование с процессами биосинтеза мРНК и белка. Кроме того, было рассмотрено влияние ингибитора везикулярного транспорта (брефельдин А) на интенсивность функционирования гваяколпероксидазы в апопласте клеток растений.
Выбрать наиболее оптимальный срок аноксии для изучения влияния ингибиторов на активность гваяколпероксидазы оказалось довольно трудно. Анализ результатов показал, что существенных различий в активации фермента при разных сроках аноксии не было. Тем не менее, в условиях аноксии гваяколпероксидаза активировалась только в апопласте корней риса после 24 и 72 ч аноксии. 12-часовая аноксия практически не изменяла активности апопластной пероксидазы у риса. Однако в условиях реаэрации гваяколпероксидазы риса как апопластные, так и внутриклеточные активировались именно после 12 ч аноксии. В побегах пшеницы активация внутриклеточной гваяколпероксидазы при реаэрации происходила только после 12 ч аноксии, снижаясь после 24 и 72 ч экспозиции. Поэтому в настоящей работе было исследовано влияние ингибиторов на активность гваяколпероксидазы и у пшеницы, и у риса после 12 ч аноксии и последующей аэрации. Показано, что актиномицин D почти не изменял активности гваяколпероксидазы после аноксии у обоих растений ни в апопласте, ни внутри клеток, за исключением проростков риса, у которых в условиях 12 ч реаэрации наблюдалось достоверное снижение активности фермента клеточной стенки в корне (табл. 3), а после 24 ч реаэрации – симпластной формы и в побеге, и в корне (табл. 4). Воздействие циклогексимида приводило к снижению активности обеих форм пероксидаз у устойчивого растения, особенно заметному в апопласте (табл. 3, 4). Применение брефельдина А вызвало уменьшение активации фермента в апопласте у обоих растений (табл. 3).
Поскольку пероксидазы III класса, т.е. гваяколпероксидазы, кодируются у риса около 150 ORF, то изучение их экспрессии требует отдельного транскриптомного исследования. В настоящем исследовании был проведен нативный электрофорез пероксидаз, который у риса выявил в побеге шесть и в корне пять апопластных изоформ. Внутриклеточных изоферментов у риса обнаружено пять в побеге и три – в корне. У пшеницы было определено пять изоформ клеточной стенки в побеге и три – в корне, а также пять локализованных внутри клеток побега и две – корней (рис. 6). В целом для риса было характерно большее количество изоформ и они отличались более интенсивной окраской, особенно ферменты клеточной стенки. В апопласте обоих растений изоформ пероксидазы было больше, чем внутри клеток, за исключением побегов пшеницы, где изопероксидаз было равное количество.
Рис. 6.
Изоферментный спектр апопластных (а, в) и внутриклеточных (б, г) пероксидаз в побегах (а, б) и корнях (в, г) проростков пшеницы и риса в условиях 12 ч аноксии и реаэрации; к – контроль, аэрация, а – аноксия, р1 – 1 ч реаэрация, р24 – 24 ч реаэрация.

У неустойчивого растения при действии аноксии и последующей реаэрации не наблюдалось изменений в количестве изоформ. У большинства апопластных и внутриклеточных изопероксидаз интенсивность окраски уменьшалась в условиях кислородной недостаточности и восстанавливалась или становилась выше контроля при постаноксии (рис. 6; Дополнительные материалы, рис. 1, 2). Однако изоформа 2 апопласта клеток корня (Rf 0.09, рис. 6в; Дополнительные материалы, рис. 1г) в наибольшей степени стимулировалась аноксией, а симпластная изоформа 5 побега (Rf 0.42, рис. 6б; Дополнительные материалы, рис. 2б) – реаэрацией. В проростках риса интенсивность окраски изоформ клеточных стенок возрастала как в побегах, так и в корнях (рис. 6а, в; Дополнительные материалы, рис. 1а, в). У симпластных изоформ в побегах риса динамика изменений была близка к таковой у пшеницы (рис. 6б; Дополнительные материалы, рис. 2а), а в корнях значительных изменений выявлено не было (рис. 6г; Дополнительные материалы, рис. 2в). Появления новых или исчезновения имеющихся изоформ также не детектировано.
ОБСУЖДЕНИЕ
Результаты проведенной работы показали, что в условиях нормальной аэрации устойчивое к гипоксии растение (рис) продуцирует большее количество пероксида водорода, чем неустойчивое – пшеница (рис. 1). Однако в условиях аноксии у риса накопление АФК отсутствовало, а при постаноксической аэрации оно было не столь интенсивным и достигало максимума на более поздних сроках, чем у пшеницы (рис. 1). В то же время в проростках пшеницы и в побегах, и в корнях наблюдалась значительная аккумуляция Н2О2, особенно хорошо заметная после 15–30-минутной реаэрации.
Из литературы известны примеры накопления пероксида в период аноксии и постаноксической аэрации. Так, аккумуляция H2O2 при гипоксических и аноксических условиях показана как в корнях, так и в листьях различных растений [14, 17]. Накопление H2O2 в апопласте и в области плазматической мембраны устойчивых и неустойчивых к недостатку кислорода растений при аноксии, и особенно в период постаноксической аэрации, показано при помощи трансмиссионной электронной микроскопии. Blokhina с соавт. продемонстрировали, что в корнях и корневищах у устойчивых к гипоксии растений (рис, болотный ирис – I. pseudacorus) во время аноксии, и особенно, постаноксической реоксигенации, аккумуляция H2O2 происходила в основном в апопласте, а у неустойчивых (пшеница и ирис германский – I. germanica) – в цитоплазме клеток [18].
При взаимодействии АФК с компонентами мембранных липидов, а также белков и ДНК образуются различные гидропероксиды, что свидетельствует о возникновении процессов перекисного окисления липидов (ПОЛ), которые ведут к нарушению целостности мембран клеток. В литературе приведены доказательства того, что у приспособленных к гипоксии объектов уровень ПОЛ ниже, чем у неприспособленных, как при аноксии, так и, главным образом, при аэрации в постаноксический период. Об этом судили по меньшему накоплению диеновых и триеновых конъюгатов – интермедиатов ПОЛ, так и его конечного продукта – малонового диальдегида [12, 13, 16]. Данные об ограничении ПОЛ у устойчивых растений свидетельствуют о большей стабильности их мембран. Это хорошо согласуется с нашими данными о меньшем накоплении перекиси водорода при аноксии и реоксигенации у риса, что может указывать на более эффективную регуляцию поставки и использования АФК у устойчивого растения.
Меньшее накопление H2O2 рисом, показанное в нашей работе, может быть связано с большей эффективностью работы антиоксидантных ферментов именно у устойчивых к гипоксии растений. В пользу последнего предположения говорит и тот факт, что исходный уровень АФК в тканях риса был выше, чем у пшеницы. По-видимому, антиоксидантная система клеток риса находится в большей готовности к разрушению АФК. Снижение уровня пероксида водорода у риса может быть результатом более интенсивной переработки его в реакциях, катализируемых каталазами и пероксидазами – ферментами, отвечающими за разрушение H2O2 или использующими ее в качестве одного из субстратов для получения фенольных полимеров.
В детоксикации пероксида, образующегося в цитоплазме или поступающего туда из апопласта, у риса принимает участие каталаза. В проростках неустойчивой пшеницы в нашей работе не показано существенных изменений активности каталазы. Более того, в корнях пшеницы фермент инактивировался после длительной (72 ч) аноксии и 24 ч реаэрации (рис. 2в). Исследуя причины повышенной активности каталазы риса при реаэрации после 72 ч аноксии удалось показать, что ее стимуляция происходит на транскрипционном и трансляционном уровнях (рис. 2, 3; табл. 2). У пшеницы действия ингибиторов на синтез мРНК каталазы выявлено не было (табл. 2). В работах Garnczarska с соавт. показана стимуляция каталазы в корнях желтого люпина под действием реаэрации, но только после краткосрочной (не более суток) гипоксии [15, 21]. В клеточной культуре резуховидки наложение условий аноксии приводило к снижению активности каталазы, а восстановление нормальной аэрации – к ее повышению в 1.4 раза выше контроля [19]. В проростках выращенного под водой риса активность каталазы была в 10 раз ниже, чем у аэробно-выращенного, а во время постгипоксической реаэрации она многократно возрастала и становилась в 1.5 раза выше аэробного контроля [23]. Сходный эффект был продемонстрирован и для проростков лотоса (Nelumbo nucifera) [22]. Дефицит кислорода вызывал существенную активацию каталазы в листьях рдеста (Potamogeton anguillanus), причем аноксия была более эффективна, чем гипоксия [20]. Увеличение активности каталазы в корневищах у рогоза (Typha domingensis) при затоплении связывают с продукцией кислорода в результате распада перекиси водорода [40]. В наших экспериментах активность каталазы в проростках аэробно выращенного риса, подвергнутого действию аноксии, либо не отличалась от контроля, либо несколько возрастала, и повышалась далее при действии постаноксии, особенно после долгосрочного анаэробного воздействия (72 ч, в 2–3 раза, рис. 2б, г), что сопровождалось усилением экспрессии генов, особенно OsCatB и OsCatС (рис. 3). Ранее в корневищах ряда неустойчивых к гипоксии растений (Glyceria maxima, Juncus effusus и I. germanica) было показано, что постаноксия вызывала существенное возрастание каталазной активности [24]. В значительной степени эта активация стимулировалась этанолом, который накапливался при дефиците кислорода. Весьма любопытно, что в данном случае каталаза участвовала не только в антиоксидантной защите, но и в превращении этанола в ацетальдегид, токсическое действие которого вносит существенный вклад в постаноксические повреждения, вызывающие быструю гибель корневищ у неустойчивых видов [11, 24]. У более устойчивых растений (Schoenoplectus lacustris, Acorus calamus и I. pseudacorus) активность каталазы в корневищах при реаэрации не изменялась или возрастала несущественно. Таким образом, каталаза в условиях постаноксии, по-видимому, является важным компонентом системы антиоксидантной защиты, обеспечивающим деградацию пероксида водорода. Однако степень ее активации у адаптированных к дефициту кислорода растений зависит от видовой и органной принадлежности, а также стадии развития.
В нашей работе показано участие апопластной гваяколпероксидазы в защите растений от окислительного постаноксического воздействия. Этот фермент до последнего времени не рассматривался как компонент антиоксидантной защиты. Основными его функциями считают участие в синтезе лигнина, регуляции ростовых процессов, а также в фенольном обмене растений. Тем не менее, в наших опытах для гваяколпероксидазы была показана активация в условиях реаэрации. Стимуляция активности этого фермента у устойчивого растения происходила уже через 1 ч реаэрации и была более интенсивной в побеге, который первым сталкивается с развитием окислительных процессов при возвращении в нормоксические условия. В результате этого в апопласте клеток осуществляется детоксикация перекиси водорода, образование которой при аноксии и после нее именно в клеточной стенке было показано в работе Blokhina с соавт. [18]. Это должно препятствовать проникновению H2O2 в цитоплазму и нарушению метаболизма клетки. У неустойчивого растения подобной стимуляции не показано.
Что касается симпластной формы фермента у растений пшеницы и риса, то полученные в нашей работе данные показали, что активность пероксидазы несколько снижалась под влиянием аноксии как у устойчивого, так и у неустойчивого растения (рис. 3, 4) что противоречит данным некоторых авторов [27, 29]. Однако они регистрировали суммарный уровень гваяколпероксидазы, не разделяя ее на внутриклеточную и апопластную формы, и, кроме того, они помещали растения в гипоксическую среду, в то время как в нашей работе растения находились в режиме более жесткой аноксии (содержание кислорода < 0.01%). В условиях, близких к нашим, активность внутриклеточной пероксидазы в колеоптилях и корнях риса не изменялась [31]. Вероятно, это связано с удалением молекулярного кислорода из окружающей среды и, как следствие этого, уменьшением содержания АФК, в том числе и Н2О2 как субстрата (рис. 1). Восстановление же нормальной аэрации приводило к накоплению этих радикалов и соединений, что стимулировало активацию внутриклеточных пероксидаз (рис. 3, 4). Повышение активности симпластных пероксидаз может рассматриваться как второй (после апопластного) этап антиоксидантной защиты, связанный с детоксикацией в цитоплазме клеток пероксида водорода, который либо проник из апопласта, несмотря на активацию апопластных пероксидаз, либо был синтезирован в цитоплазме. У неустойчивого растения пероксидаза активировалась только к 12 часам реаэрации и только внутри клеток, что, по-видимому, связано с отсутствием внеклеточного апопластного барьера, разрушающего пероксид еще в клеточной стенке. Более того, после длительных воздействий анаэробиоза способность к активации симпластной гваяколпероксидазы постепенно снижалась (рис. 3), тогда как у риса она сохранялась примерно на одном уровне после всех сроков аноксии (рис. 4).
Результаты настоящей работы не выявили влияния ингибитора транскрипции (актиномицин D) на активность гваяколпероксидаз апопласта и симпласта, однако возможность биосинтеза ферментов по готовым мРНК, находящимся в клетке, была показана (табл. 3, 4). Синтезированный таким образом фермент транспортировался в апопласт везикулярно, поскольку брефельдин А был эффективен в подавлении его активности у обоих растений (табл. 3).
В результате проведенного электрофоретического исследования пероксидаз не было выявлено появления новых изоформ в условиях аноксии и постаноксической аэрации (рис. 6; Дополнительные материалы, рис. 1, 2). Однако показана значительная стимуляция как большинства уже имеющихся изоформ у риса (при аноксии и постаноксии), так и отдельных изоформ у пшеницы. Сходные данные были получены и ранее. Так, при анализе изоферментного состава пероксидаз апопласта клеток сои [14] показано увеличение имеющихся изоформ без появления новых.
Таким образом, обнаруженная нами активация пероксидазы в клеточной стенке у риса может свидетельствовать о том, что этот фермент является одним из компонентов антиоксидантной системы устойчивых к гипоксии растений. Ее роль состоит в предотвращении поступления активных форм кислорода в цитоплазму из клеточных стенок. Исходя из вышеизложенного, можно заключить, что у устойчивого растения не наблюдалось значительной продукции перекиси водорода, что, по-видимому, связано с быстрым и интенсивным возрастанием активности апопластных форм гваяколпероксидазы, обеспечивающих детоксикацию пероксида еще в клеточной стенке, препятствуя, тем самым, его проникновению в цитоплазму клеток. Образующийся же в цитоплазме пероксид, а также проникающий туда из апопласта, разрушается внутриклеточными ферментами, которые у риса, в отличие от пшеницы, сохраняют длительное время высокий уровень активности во всех вариантах опыта. Подобная схема работает как при коротких, так и при длительных сроках анаэробного и постаноксического воздействия.
В отличие от риса, пшеница, по-видимому, не обладает столь четко выраженной системой координации работы антиоксидантных ферментов при недостатке кислорода и последующей аэрации. В ответ на усиление продукции пероксида не наблюдалось быстрой активации ни каталазы, ни апопластной гваяколпероксидазы. Последняя активировалась только после длительных сроков реаэрации. В результате создавались предпосылки для проникновения Н2О2 в цитоплазму клетки, где ее детоксикацию осуществляли внутриклеточные формы гваяколпероксидазы. Однако, вероятно, этого оказывалось недостаточно, поскольку все они довольно быстро инактивировались, и АФК способствовали дестабилизации мембран и разрушению клеток пшеницы.
Таким образом, у устойчивого растения имеется эффективно регулируемая антиоксидантная система, включающая в себя каталазу и гваяколпероксидазу, которая при аноксии и постаноксической аэрации предотвращает накопление АФК и является важным адаптивным механизмом как к недостатку кислорода, так и последующему окислительному воздействию. У неустойчивого растения эти ферменты работают не столь эффективно, поэтому детоксикация АФК происходит менее интенсивно, что приводит к их аккумуляции, развитию повреждений и быстрой гибели растения не только от кислородной недостаточности, но и от окислительного стресса.
В экспериментах использована приборная база Ресурсного центра СПбГУ “Развитие молекулярных и клеточных технологий”. Работа выполнена при финансовой поддержке гранта Российского научного фонда №22-24-00484.
Авторы заявляют об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо экспериментов с участием людей и животных в качестве объектов исследования.
Авторы В.В. Емельянов и Т.В. Чиркова придумали и разработали эксперимент, В.В. Ласточкин и Е.Г. Приказюк выращивали растительный материал. Эксперименты по изучению продукции перекиси водорода и активности ферментов проводил В.В. Ласточкин, по определению изоферментного спектра пероксидаз – В.В. Ласточкин и В.В. Емельянов, по исследованию экспрессии генов каталазы – Е.Г. Приказюк и В.В. Емельянов. Авторы В.В. Ласточкин, Е.Г. Приказюк и В.В. Емельянов участвовали в обработке данных. Авторы В.В. Емельянов и Т.В. Чиркова участвовали в написании текста статьи. Все авторы участвовали в обсуждении результатов.
Список литературы
Чиркова Т.В. Пути адаптации растений к гипоксии и аноксии. Л.: Изд-во Ленинградского ун-та. 1988. 244 с.
Crawford R.M.M. Studies in Plant Survival. Ecological Case Histories of Plant Adaptation to Adversity. Oxford: Blackwell Scientific Publications, 1989. 296 p.
Kennedy R.A., Rumpho M.E., Fox T.C. Anaerobic metabolism in plants // Plant Physiol. 1992. V. 100. P. 1. https://doi.org/10.1104/pp.100.1.1
Vartapetian B.B., Jackson B.M. Plant adaptations to anaerobic stress // Ann. Bot. 1997. V. 79 (Sup. A). P. 3. https://doi.org/10.1093/oxfordjournals.aob.a010303
Чиркова Т.В. Растение и анаэробиоз // Вестник С.‑Петербургского ун-та. Сер. 3. 1998. Вып. 2. С. 41.
Kende H., van der Knaap E., Cho H.T. Deepwater rice: A model plant to study stem elongation // Plant Physiol. 1998. V. 118. P. 1105. https://doi.org/10.1104/pp.118.4.1105
Bailey-Serres J., Voesenek L.A.C.J. Flooding stress: Acclimations and genetic diversity // Annu. Rev. Plant Biol. 2008. V. 59. P. 313. https://doi.org/10.1146/annurev.arplant.59.032607.092752
Voesenek L.A.C.J., Bailey-Serres J. Flood adaptive traits and processes: An overview // New Phytol. 2015. V. 206. P. 57. https://doi.org/10.1111/nph.13209
Chirkova T., Yemelyanov V. The Study of plant adaptation to oxygen deficiency in Saint Petersburg university // Biol. Commun. 2018. V. 63. P. 17. https://doi.org/10.21638/spbu03.2018.104
amang B.G., Fukao T. Plant adaptation to multiple stresses during submergence and following desubmergence // Int. J. Mol. Sci. 2015. V. 16. P. 30164. 10.3390/ijms16122622
Shikov A.E., Chirkova T.V., Yemelyanov V.V. Post-anoxia in plants: reasons, consequences, and possible mechanisms // Russ. J. Plant Physiol. 2020. V. 67. P. 45. https://doi.org/10.1134/S1021443720010203
Blokhina O.B., Fagerstedt K.V., Chirkova T.V. Relationships between lipid peroxidations and anoxia tolerance in a range of species during post-anoxic reaeration // Physiol. Plant. 1999. V. 105. P. 625. https://doi.org/10.1034/j.1399-3054.1999.105405.x
Chirkova T.V., Novitskaya L.O., Blokhina O.B. Lipid peroxidation and antioxidant systems under anoxia in plants differing in their tolerance to oxygen deficiency // Russ. J. Plant Physiol. 1998. V. 45. P. 55.
Amor Y., Chevion M., Levine A. Anoxia pretreatment protects soybean cells against H2O2-induced cell death: Possible involvement of peroxidases and of alternative oxidase // FEBS Lett. 2000. V. 477. P. 175. https://doi.org/10.1016/s0014-5793(00)01797-x
Garnczarska M., Bednarski W., Morkunas I. Re-aeration-induced oxidative stress and antioxidative defenses in hypoxically pretreated lupine roots // J. Plant Physiol. 2004. V. 161. P. 415. https://doi.org/10.1078/0176-1617-01073
Емельянов В.В., Шиков А.Е., Ласточкин В.В., Чиркова Т.В. Окислительный стресс под действием реаэрации и генераторов АФК в проростках пшеницы и риса // Экобиотех. 2020. Т. 3. С. 229. https://doi.org/10.31163/2618-964X-2020-3-2-229-238
Калашников Ю.Е., Балахнина Т.И., Закржевский Д.А. Эффект почвенной гипоксии на активацию кислорода и систему защиты от окислительной деструкции в корнях и листьях Hordeum vulgare // Физиология растений. 1994. Т. 41. С. 583.
Blokhina O.B., Chirkova T.V., Fagerstedt K.V. Anoxic stress leads to hydrogen peroxide formation in plant cells // J. Exp. Bot. 2001. V. 52. P. 1179. https://doi.org/10.1093/jexbot/52.359.1179
Paradiso A., Caretto S., Leone A., Bove A., Nisi R., De Gara L. ROS Production and scavenging under anoxia and re-oxygenation in Arabidopsis cells: A balance between redox signaling and impairment // Front. Plant Sci. 2016. V. 7. 1803. https://doi.org/10.3389/fpls.2016.01803
Parveen M., Miyagi A., Kawai-Yamada M., Rashid M.H., Asaeda T. Metabolic and biochemical responses of Potamogeton anguillanus Koidz. (Potamogetonaceae) to low oxygen conditions // J. Plant Physiol. 2019. V. 232. P. 171. https://doi.org/10.1016/j.jplph.2018.11.023
Garnczarska M., Bednarski W. Effect of a short-term hypoxic treatment followed by re-aeration on free radicals level and antioxidative enzymes in lupine roots // Plant Physiol. Biochem. 2004. V. 42. P. 233. https://doi.org/10.1016/j.plaphy.2004.01.005
Ushimaru T., Kanematsu S., Katayama M., Tsujid H. Antioxidative enzymes in seedlings of Nelumbo nucifera germinated under water // Physiol. Plant. 2001. V. 112. P. 39. https://doi.org/10.1034/j.1399-3054.2001.1120106.x
Ushimaru T., Shibasaka M., Tsuji H. Development of ${\text{O}}_{2}^{ - }$-detoxification system during air adaptation of submerged rice seedlings // Plant Cell Physiol. 1992. 33: 1065. https://doi.org/10.1093/oxfordjournals.pcp.a07835710.1093/oxfordjournals.pcp.a078357
Monk L.S., Braendle R., Crawford R.M.M. Catalase activity and post-anoxic injury in monocotyledonous species // J. Exp. Bot. 1987. V. 38. P. 233. https://doi.org/10.1093/jxb/38.2.233
Андреева В.А. Фермент пероксидаза: Участие в защитном механизме растений. М.: Наука, 1988. 128 с.
Cosio C., Dunand C. Specific functions of individual class III peroxidase genes // J. Exp. Bot. 2009. V. 60. P. 391. https://doi.org/10.1093/jxb/ern318
Рубин Б.А., Логинова Л.Н. Завершающие этапы окисления в листьях полупогруженных растений // Биохимия. 1965. Т. 30. С. 681.
Будилова Е.В., Рубин Б.А., Иванова М.А., Семенова Н.А. Изоферменты пероксидазы в листьях кубышки // Доклады АН СССР. 1971. Т. 200. С. 980.
Чиркова Т.В., Соколовская Е.А., Хазова И.В. Активность и изоферментный состав пероксидазы корней растений в зависимости от условий временного анаэробиоза // Физиология растений. 1973. Т. 20. С. 1236.
Jayawardhane J., Goyali J.C., Zafari S., Igamberdiev A.U. The response of cowpea (Vigna unguiculata) plants to three abiotic stresses applied with increasing intensity: Hypoxia, salinity, and water deficit // Metabolites. 2022. V. 12. 38. https://doi.org/10.3390/metabo12010038
Lee T.M., Lin Y. Changes in soluble and cell wall-bound peroxidase activities with growth in anoxia-treated rice (Oryza sativa L.) coleoptiles and roots // Plant Sci. 1995. V. 1. P. 1. https://doi.org/10.1016/0168-9452(94)04053-j
Ласточкин В.В., Емельянов В.В., Чиркова Т.В. Активность пероксидазы в проростках пшеницы и риса в связи с воздействием аноксии. // Вестник С.-Петербургского ун-та. Сер. 3. 2000. Вып. 3. С. 59.
Yemelyanov V.V., Lastochkin V.V., Chirkova T.V., Lindberg S.M., Shishova M.F. Indoleacetic acid levels in wheat and rice seedlings under oxygen deficiency and subsequent reoxygenation // Biomolecules. 2020. V. 10. 276. https://doi.org/10.3390/biom10020276
Gay C., Gebicki J.M. A Critical evaluation of the effect of sorbitol on the ferric xylenol orange hydroperoxide assay // Anal. Biochem. 2000. V. 284. P. 217. https://doi.org/10.1006/abio.2000.4696
Otter T., Polle A. Characterisation of acidic and basic apoplastic peroxidases from needles of norway spruce (Picea abies L., Karsten) with respect to lignifying substrates // Plant Cell Physiol. 1997. V. 38. P. 595. https://doi.org/10.1093/oxfordjournals.pcp.a029209
Bradford M. A Rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248. https://doi.org/10.1006/abio.1976.9999
Aebi H. Catalase in vitro // Methods Enzymol. 1984. V. 105. P. 121. https://doi.org/10.1016/S0076-6879(84)05016-3
Davis B. Disc electrophoresis. II. Method and application for human serum proteins // Ann. N. Y. Acad. Sci. 1964. V. 121. P. 404. https://doi.org/10.1111/j.1749-6632.1964.tb14213.x
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method // Methods. 2001. V. 25. P. 402. https://doi.org/10.1006/meth.2001.1262
Duarte V.P., Pereira M.P., Corrêa F.F., de Castro E.M., Pereira F.J. Aerenchyma, gas diffusion, and catalase activity in Typha domingensis: A complementary model for radial oxygen loss // Protoplasma. 2021. V. 258. P. 765. https://doi.org/10.1007/s00709-020-01597-8
Дополнительные материалы
- скачать ESM.docx
- Рисунок 1. Интенсивность окраски пятен апопластных изопероксидаз побегов (а, б) и корней (в, г) проростков риса (а, в) и пшеницы (б, г) после 12 ч аноксии и реаэрации в гелях после электрофореза (см. рис. 6 статьи).
Рисунок 2. Интенсивность окраски пятен внутриклеточных изопероксидаз побегов (а, б) и корней (в, г) проростков риса (а, в) и пшеницы (б, г) после 12 ч аноксии и реаэрации в гелях после электрофореза (см. рис. 6 статьи).
Инструменты
Физиология растений


