Физиология растений, 2022, T. 69, № 6, стр. 665-674
Дыхание, запасание энергии и про-/антиоксидантный метаболизм в верхушке подземного побега Achillea millefolium в процессе фотоморфогенеза
С. П. Маслова a, *, М. А. Шелякин a, Е. В. Силина a, Р. В. Малышев a
a Институт биологии Коми научного центра Уральского отделения Российской академии наук
Сыктывкар, Россия
* E-mail: maslova@ib.komisc.ru
Поступила в редакцию 07.02.2022
После доработки 10.03.2022
Принята к публикации 10.03.2022
- EDN: AVAOFW
- DOI: 10.31857/S0015330322060203
Аннотация
Получены данные об энергетическом статусе и активности про-/антиоксидантного метаболизма в процессе фотоморфогенеза верхушки корневища тысячелистника обыкновенного Achillea millefolium L. На фотофобном этапе развития этиолированные верхушки корневищ характеризовались повышенной интенсивностью дыхания и скоростью запасания энергии: доля энергетически эффективного цитохромного дыхания составляла 60%, вклад альтернативного пути (АП) не превышал 25% общего дыхания. Этиолированные верхушки накапливали значительные количества прооксидантов и характеризовались относительно высокой активностью гваяколпероксидазы и супероксиддисмутазы, что может быть связано с вовлечением компонентов про-/антиоксидантного метаболизма в регуляцию процессов роста и дифференцировки клеток и тканей в конусе нарастания во время подземного роста. На фотофильном этапе в верхушке зеленеющего сармента выявлено значительное снижение скорости запасания энергии, повышение способности энергетически низкоэффективного АП, доля которого составляла 50% общей дыхательной активности. При фотоморфогенетическом переходе в верхушках зеленеющих сарментов показано усиление про-/антиоксидантного метаболизма: концентрация продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-РП) и H2O2, возрастала на 25−30%, уровень активности антиоксидантных ферментов повышался на 24−86%. Фотоморфогенетический переход не приводил к возникновению новых изоформ антиоксидантных ферментов, однако выявлены изменения их активности в зависимости от фазы развития побега. В молодых листьях сарментов повышалась активность медь/цинк-содержащей изоформы супероксиддисмутазы (Cu/Zn-SOD-2), локализованной в хлоропластах. В листьях отмечали снижение содержания прооксидантов и усиление способности цитохромного пути дыхания, что отражает успешную адаптацию подземных побегов A. millefolium к росту на свету.
Корневища многолетних трав способны расти продолжительное время в горизонтальном положении под поверхностью почвы, не проявляя фото- или гравитропических реакций. Конус нарастания подземных побегов длиннокорневищных травянистых многолетников периодически формирует почки, которые затем переходят в надземный побег − сармент. Апикальная часть сармента в процессе подземного горизонтального роста дифференцируется, образуя зачатки ассимилирующих листьев [1, 2]. Мы называем этот процесс фотоморфогенетическим переходом, когда верхушка делает ростовой изгиб и переходит от подземного (диатропного) роста к ортотропному (надземному) развитию. Фотоморфогенетический переход − это совокупность процессов роста и развития клеток и тканей при переходе верхушки подземного побега от фотофобного к фотофильному развитию. Во время фотофобного (подземного) роста осуществляется ветвление корневища и формирование подземных меристем. В период перехода к ортотропному росту (фотофильный этап) верхушка формирует надземные побеги, выполняя функцию ассимиляции.
Ранее нами были исследованы ультраструктурные изменения пластид и содержание фотосинтетических пигментов в процессе фотоморфогенеза верхушки подземного побега у растений Achillea millefolium [3]. В этиолированных верхушках обнаружены слаборазвитая мембранная система пластид с одиночными тилакоидами и присутствие зеленых и желтых пигментов. В зеленеющих верхушках подземного побега выявлено формирование гранальной системы хлоропластов и накопление фотосинтетических пигментов, в том числе лютеина и виолоксантина, участвующих в защите слаборазвитой мембранной системы хлоропластов от фотоокисления.
В настоящее время довольно полно изучены механизмы формирования фотосинтетического аппарата, регуляция митохондриального дыхания и функционирование систем антиоксидантной защиты в процессе деэтиоляции у проростков растений [4–7]. Исследований по изучению энергетического статуса и состояния про-/антиоксидантного метаболизма при переходе от фотофобного к фотофильному этапу развития верхушечной почки корневища многолетних трав мы не обнаружили. В отличие от тканей проростков, фотофобный этап развития корневища связан с формированием подземных диаспор, размножением и расселением многолетних растений в процессе подземного роста. На этом этапе подземные побеги характеризуются активным формированием новых меристематических зон, интенсивным дыханием, повышенной активностью фитогормонов ИУК, цитокининов и АБК [8].
Роль энергетического баланса растения, вклад альтернативного пути дыхания (АП) при адаптации растения к различным факторам внешней и внутренней природы обсуждались в классических работах О.А. Семихатовой [9] и исследованиях современных авторов [7, 10, 11]. Однако сведений о соотношении дыхательных путей, функционировании АП в почках корневищ многолетних трав мы не обнаружили.
Мы предположили, что физиолого-биохимические изменения в тканях верхушки корневища при переходе от фотофобного к фотофильному этапу развития модулируют морфогенетические (рост и дифференцировка клеток и тканей) и энергопластические (скорость дыхания, тепловыделение, запасание энергии и соотношение дыхательных путей) процессы в конусе нарастания подземного побега. Компоненты про-/антиоксидантного метаболизма могут действовать как сигнальные молекулы, запуская адаптивные реакции на разных этапах мофогенеза подземного побега корневищного многолетника.
Цель работы − изучение дыхания, запасания энергии и характеристика про-/антиоксидантного метаболизма в верхушке подземных побегов Achillea millefolium L. в процессе фотоморфогенеза верхушечной почки.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования и условия выращивания растений. В качестве модельного растения использовали тысячелистник обыкновенный (Achillea millefolium L.) – многолетний летнезеленый травянистый тонко-длиннокорневищный симподиально нарастающий поликарпик с удлиненным прямостоячим побегом [12]. Растение формирует два типа подземных побегов − корневища и сарменты. Сарменты отличаются от корневищ наличием в апикальной части листовых примордиев [1]. В фазу цветения растение образует до 30 подземных побегов, из которых 25% составляют сарменты [8].
Растения выращивали из корневищ в вегетационном опыте, в условиях открытого грунта при площади питания 0.4 × 0.7 м2. Почва участка типичная подзолистая, сформированная на покровных суглинках, средней степени окультуренности. В июле, в полдень, при безоблачном небе освещенность могла превышать 500 Вт/м2 ФАР, при низкой плотной облачности – уменьшалась более чем в 10 раз. В зоне расположения основной массы корневищ A. millefolium (на глубине 5−7 см) освещенность составляла 1−2 Вт/м2. Температура почвы на глубине залегания корневищ в июле и августе была в среднем 20 и 15°С, соответственно. Освещенность и температуру воздуха измеряли с помощью регистрирующего устройства LI-1400 (“LI-COR”, США) с набором метеорологических датчиков.
Опыты закладывали летом в 2017−2019 гг. Для изучения физиологических и биохимических показателей растительные образцы отбирали на второй год после посадки корневищами в период генеративного развития (июль−август).
Верхушки подземных побегов (0.3−1 см) исследовали на разных этапах органогенеза апикальной почки: на фотофобном − этиолированные верхушки корневищ, на фотофильном − зеленеющие верхушки сарментов и молодые листья сарментов.
Калореспирометрические показатели. Скорость метаболического тепловыделения побегов измеряли методом прямого калориметрирования при 20°С. В каждую ячейку помещали по 2−3 верхушки корневищ с 3−5 растений (сырая масса 150−200 мг). Интенсивность дыхания определяли по тепловому эффекту реакции выделяемого объектом CO2 с 0.4 М раствором NaOH [13]. Измерения тепловыделения и дыхания проводили на микрокалориметре Биотест-2 (Институт биологического приборостроения РАН, г. Пущино, Россия).
Скорость тепловыделения (q) и дыхания (${{R}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$) рассчитывали по формулам (1) и (2), соответственно:
(1)
$q = 0.022([{{({{q}_{2}} + {{q}_{4}})} \mathord{\left/ {\vphantom {{({{q}_{2}} + {{q}_{4}})} 2}} \right. \kern-0em} 2}] - [{{({{Q}_{1}} + {{Q}_{5}})} \mathord{\left/ {\vphantom {{({{Q}_{1}} + {{Q}_{5}})} 2}} \right. \kern-0em} 2}]),$(2)
${{R}_{{{\text{C}}{{{\text{O}}}_{2}}}}} = {{[(0.022{{q}_{3}}) - q]} \mathord{\left/ {\vphantom {{[(0.022{{q}_{3}}) - q]} {108.5}}} \right. \kern-0em} {108.5}},$Полученные значения q и ${{R}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ относили к сухой массе исследуемого объекта и выражали в мкВт/мг и нмоль/(мг с), соответственно. На основании термодинамической модели рассчитывали скорость запасания энергии на рост (ΔHBRSG), согласно [13]:
(3)
$\Delta {{H}_{{\text{B}}}}{{R}_{{{\text{SG}}}}} = 455{{R}_{{{\text{С}}{{{\text{О}}}_{2}}}}} - q,$Скорость дыхания и дыхательных путей. Скорость дыхания верхушек корневищ определяли по поглощению О2 при 20°С полярографически на Oxytherm system (“Hansatech Inst.”, Великобритания). Для измерения острым лезвием срезали верхушки подземных побегов длинной 3–5 мм. Высечки верхушек свежесобранных подземных побегов массой 15–20 мг помещали в реакционный сосуд, содержащий буферный раствор HEPES (“Компания Хеликон”, Россия) (50 mM, pH 7.2). В процессе измерения образцы находились при постоянном перемешивании. Интенсивность поглощения О2 отдельными дыхательными путями определяли с добавлением специфических ингибиторов. Оптимальные концентрации ингибиторов дыхательных путей были подобраны в предварительных экспериментах с применением метода прямого титрования с повышением концентрации ингибиторов до насыщения поглощения О2 тканями высечек верхушек корневищ [10]. В качестве ингибитора альтернативной оксидазы (АОХ) использовали 8 мМ раствор салицилгидроксамовой кислоты (СГК) (“Lancaster”, Англия). Активность цитохромоксидазы подавляли 2 мМ раствором KCN (“Sigma”, США). Скорость поглощения кислорода выражали как сумму отдельных компонент для расчета способностей отдельных путей дыхания:
где Vt – общее дыхание; Valt – способность альтернативного пути дыхания, подавляемая ингибитором альтернативной оксидазы СГК, Vcyt – способность цианидчувствительного (цитохромного) пути дыхания (ЦП); Vres – остаточное дыхание, регистрируемое в присутствии ингибиторов альтернативного и цитохромного дыхательных путей.Интенсивность общего дыхания определяли по скорости поглощения О2 тканями без добавления ингибиторов. Способность альтернативного дыхательного пути определяли как дыхание, чувствительное к СГК после вычитания остаточного дыхания. Способность цитохромного дыхания определяли как дыхание, чувствительное к KCN в присутствии СГК после вычитания остаточного дыхания. Остаточное дыхание измеряли по скорости поглощения О2, после добавления СГК и KCN. Ингибиторы дыхательных путей к пробе добавляли последовательно после измерения интенсивности общего поглощения О2. Определения проводили в 9–12-кратной биологической повторности.
Измерение показателей про-/антиоксидантного статуса верхушек корневищ. Уровень перекисного окисления липидов (ПОЛ) оценивали по накоплению в тканях корневищ продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-РП) [14]. Концентрацию ТБК-РП рассчитывали с использованием коэффициента молярной экстинкции ε = 156 мМ–1 см–1 после вычитания неспецифического поглощения при 600 нм и выражали в нмоль ТБК-РП/г сухой массы.
Содержание пероксида водорода (Н2О2) определяли с использованием ксиленолового оранжевого (“Fisher Chemical”, Великобритания) [15] по графику градуировочной зависимости. Проверку на специфичность проводили по ингибированию образования Н2О2 при добавлении каталазы (активность 500 ед/мг белка, “Sigma”, США).
Активность супероксиддисмутазы (SOD) определяли по ее способности подавлять фотохимическое восстановление нитросинего тетразолия (“DDL”, США) [16]. Активность пероксидаз III класса (далее гваяколпероксидаза – GPX) определяли по методу, основанному на реакции окисления гваякола (“Sigma”, США) до окрашенного соединения тетрагваякола и рассчитывали, используя коэффициент экстинкции тетрагваякола ε = 26.6 мМ–1 см–1 [17]. Активность каталазы (CAT) измеряли по количеству разложившегося Н2О2 (“Sigma”, США) за единицу времени [18] и рассчитывали, используя коэффициент экстинкции Н2О2 ε = 0.036 мМ–1 см–1. Содержание растворимого белка анализировали по методу Бредфорда [19], используя в качестве стандарта бычий сывороточный альбумин (“Sigma”, США). Процедуры выделения белка проводили при температуре 4°С.
Электрофоретическое разделение антиоксидантных ферментов. Для определения изоферментного состава SOD, GPX и САТ применяли метод нативного электрофореза в полиакриламидном геле (12.5% для SOD, 10% для GPX и САТ). Нативный форез проводили при температуре 4°С и при стабильном токе 180 В [20] без добавления SDS (додецилсульфат натрия). В карман геля вносили от 10 до 20 мкг белка.
Визуализацию изоформ SOD проводили по методу [16]. Для идентификации изоформ SOD использовали ингибиторный анализ [20]. Для каждого ингибиторного анализа получали новый гель с разделенными белками. Для ингибирования Cu/Zn-SOD и Fe-SOD в окрашивающий буфер добавляли 5 мМ Н2О2. Селективное ингибирование Cu/Zn-SOD происходило при инкубации гелей в буфере, содержащем 3 мМ KCN.
Визуализацию изоформ GPX проводили по методу [21]. Для этого гели инкубировали в Na-ацетатном буфере (рН 5.5), содержащем 20 мМ гваякола и 0.05% (об./об.) Н2О2. Активность изоформ CAT определяли с использованием метода [22]. Гели помещали в 4 мМ раствор Н2О2 на 10 мин, дважды промывали дистиллированной водой и инкубировали 5 мин в 1% (мас./об.) растворе FeCl3 (“Fisher Chemical”, Великобритания) и 1% (мас./об.) K3[Fe(CN)6] (“Лабтех”, Россия).
Все биохимические анализы проводили в 2–3‑кратной аналитической повторности на 3–4 независимых образцах.
Статистическая обработка данных. Статистическую обработку данных осуществляли с использованием программы Statistica 10 (“StatSoft Inc.”, США). Значимость различий между средними величинами измеряемых показателей оценивали с применением однофакторного дисперсионного анализа ANOVA (критерий Дункана). Нормальность распределения данных оценивали с помощью критерия Шапиро-Уилкса. Расчеты осуществляли при заданном уровне значимости P ≤ 0.05. В таблицах и на рисунках приведены средние арифметические значения со стандартной ошибкой.
РЕЗУЛЬТАТЫ
Калориметрические показатели и энергетический статус верхушек корневищ
Калориметрические определения показали, что энергетический статус верхушек подземных побегов Achillea millefolium зависел от фазы морфогенеза верхушечной почки. На фотофобном этапе развития этиолированные верхушки корневищ характеризовались повышенной скоростью тепловыделения и дыхания. Величина q этиолированных верхушек составляла около 25 мкВт/мг сухой массы и имела тенденцию к снижению в период зеленения верхушек и формирования молодых листьев сарментов (рис. 1а). Скорость выделения СО2 на фотофобном этапе развития почки также была повышенной в сравнении с фотофильным периодом, когда формируются ассимилирующие листья (рис. 1б).
Рис. 1.
Интенсивность метаболического тепловыделения (а), дыхания (б) и скорость запасания энергии (в) в верхушках подземных побегов Achillea millefolium на разных этапах морфогенеза. Разные буквенные символы над столбцами обозначают статистическую значимость различий между показателями на разных стадиях развития верхушек корневищ (ANOVA, критерий Дункана, n = 10, P ≤ 0.05).

Расчеты показали, что этиолированные верхушки корневищ запасали значительное количество энергии – около 20 мкВт/мг сухой массы (рис. 1в). С переходом от фотофобного к фотофильному этапу морфогенеза в зеленеющей верхушке сармента (зачатки листьев) отмечено снижение в три раза скорости запасания энергии по сравнению с этиолированными верхушками корневищ.
Дыхание и способность дыхательных путей в корневищах и сарментах
В тканях верхушек этиолированных корневищ скорость поглощения О2 была максимальной и составляла около 7000 нмоль О2/(г сухой массы мин) (табл. 1). В зеленеющих верхушках сарментов отмечали тенденцию к снижению скорости общего дыхания, а интенсивность дыхания формирующихся листьев сарментов была в среднем на 20% ниже по сравнению с этиолированными верхушками.
Таблица 1.
Интенсивность общего дыхания (Vt), способность цитохромного (Vcyt), альтернативного (Valt) дыхательных путей и остаточного дыхания (Vres) в верхушках подземных побегов Achillea millefolium на разных этапах морфогенеза, нмоль О2/(г сухой массы мин)
| Этап морфогенеза | Vt | Vcyt | Valt | Vres |
|---|---|---|---|---|
| Верхушки корневищ | 7217 ± 232b | 4381 ± 219c | 1797 ± 143a | 1039 ± 74a |
| Верхушки зеленеющих сарментов | 6344 ± 142ab | 2112 ± 88a | 3191 ± 91b | 1040 ± 91a |
| Молодые листья сарментов | 5558 ± 442a | 2957 ± 306b | 1719 ± 163a | 883 ± 67a |
В дыхании этиолированных верхушек способность энергетически эффективного цитохромного пути (Vcyt) была почти в три раза выше по сравнению со способностью дыхания по альтернативному пути (Valt). Вклад ЦП в общее поглощение О2 корневищами на фотофобном этапе развития составлял более 60%, доля АП не превышала 25% общего дыхания (рис. 2).
Рис. 2.
Относительный вклад цитохромного (1), альтернативного (2) и остаточного (3) дыхания в общее поглощение О2 верхушек подземных побегов Achillea millefolium на разных этапах морфогенеза. Разные буквенные символы на столбцах обозначают статистическую значимость различий между показателями на разных стадиях развития верхушек корневищ (ANOVA, критерий Дункана, n = 9−12, P ≤ 0.05).
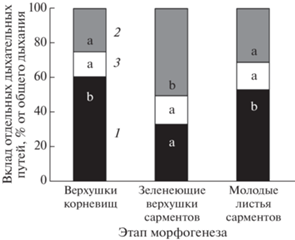
При переходе к фотофильному этапу развития на фоне сохранения высокой интенсивности дыхания верхушек сарментов выявлены значимые изменения способности и соотношения дыхательных путей (табл. 1, рис. 2). В зеленеющих верхушках сарментов отмечали почти двукратное усиление способности энергетически мало эффективного Valt и снижение способности основного Vcyt по сравнению с этиолированными корневищами. В результате, способность Valt в тканях зеленеющих верхушек была в 1.5 раза выше дыхания по основному дыхательному пути. При этом вовлечение АП в общее дыхание зеленеющих верхушек увеличилось до 50%, тогда как вклад ЦП снизился в среднем до 30%. В молодых листьях сарментов способность Vcyt повышалась в среднем на 40% по сравнению с зеленеющими верхушками. Способность Valt снижалась, и соотношение дыхательных путей восстанавливалось до значений, отмеченных в этиолированных верхушках корневищ.
Независимо от фазы развития верхушки подземного побега на долю остаточного дыхания (Vres) приходилось в среднем 14–16% общего поглощения О2.
Про-/антиоксидантный статус корневищ и сарментов
На фотофобном этапе развития этиолированные ткани верхушек корневищ содержали наименьшее количество Н2О2, ТБК-РП и характеризовались относительно низкой активностью антиоксидантных ферментов (табл. 2 ). В ходе морфогенетических преобразований в конусе нарастания корневища, при переходе от фотофобного к фотофильному этапу развития, отмечено усиление процессов перекисного окисления липидов и накопления пероксида водорода (табл. 2 ). Концентрация ТБК-РП и Н2О2 возрастала в 1.3 и 2.5 раза соответственно. Повышению содержания прооксидантов в верхушках зеленеющих сарментов соответствовало усиление активности антиоксидантных ферментов. Уровень активности SOD, CAT и GPX увеличивался в среднем на 38, 87 и 24% соответственно. В процессе формирования молодых листьев сарментов содержание прооксидантов и активность SOD и GPX снижались до значений, отмеченных для этиолированных верхушек корневищ, а активность САТ продолжала повышаться.
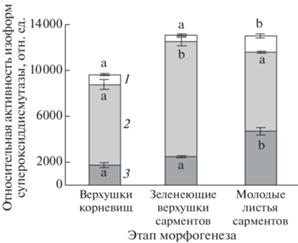
На основе изоферментного анализа антиоксидантных ферментов нами идентифицированы три изоформы SOD, одна изоформа GPX и одна изоформа САТ в этиолированных верхушках корневищ и в процессе их перехода на фотофильный этап развития (рис. 3). Ингибиторный анализ изоформ SOD выявил наличие одной Mn-SOD и двух Cu/Zn-SOD (рис. 3а). Следует отметить, что наиболее активной изоформой SOD в верхушках подземных побегов была цитозольная Cu/Zn-SOD-1 (рис. 4). Активность Cu/Zn-SOD-2 была наибольшей в молодых листьях сарментов. В целом, изменение относительной активности разных изоформ антиоксидантных ферментов на разных этапах развития корневищ соответствовало их общей активности.
Рис. 3.
Электрофореграммы изоформ супероксиддисмутазы (а), гваяколпероксидазы (б) и каталазы (в) в верхушках подземных побегов Achillea millefolium на разных этапах морфогенеза: 1 – верхушки корневищ, 2 – верхушки зеленеющих сарментов, 3 – молодые листья сарментов.

Рис. 4.
Относительная активность разных изоформ супероксиддисмутазы (SOD) в подземных побегах Achillea millefolium в процессе фотоморфогенеза (1 – Mn-SOD, 2 – Cu/Zn-SOD-1, 3 – Cu/Zn-SOD-2). Разные буквенные символы на столбцах обозначают статистическую значимость различий между показателями на разных стадиях развития верхушек корневищ (ANOVA, критерий Дункана, n = 4, P ≤ 0.05).
ОБСУЖДЕНИЕ
Рост и ветвление корневищ, формирование новых меристематических зон происходит во второй половине вегетации после прекращения роста надземных побегов. Корневища Achillea millefolium на этой стадии развития характеризовались сравнительно высокой интенсивностью дыхания, значительным содержанием неструктурных углеводов и повышенной активностью фитогормонов ИУК, цитокининов и АБК [8]. В этот период 25% корневищ осуществляют переход от фотофобного к фотофильному этапу развития верхушечной почки, формируя надземные ассимилирующие побеги.
Выделение тепла клетками является интегральным показателем активности метаболизма. Калориметрические определения показали, что теплопродукция этиолированных верхушек корневищ A. millefolium была сравнительно высокой и составляла около 25 мкВт/мг сухой массы (рис. 1). Сведения о теплопродукции почек корневищ в литературе единичны. Ранее нами было показано, что теплопродукция верхушек корневищ A. millefolium возрастала с 5 до 25 мкВт/мг сухой массы с увеличением температуры от 5 до 25°С [8]. Величина этого показателя для верхушек корневищ Mentha arvensis и Pyrola rotundifolia при 20°С составляла 13 и 2.5 мкВт/мг сухой массы, соответственно [23].
В процессе зеленения верхушки подземного побега отмечали тенденцию к снижению скорости тепловыделения и выделения CO2, измеренного калориметрически (рис. 1). Расчеты показали, что скорость роста, отражающая количество запасенной энергии в биомассе, была максимальной в этиолированных верхушках корневища, значительно снижалась при фотоморфогенетическом переходе и была низкой в молодых листьях сарментов.
Сведений об интенсивности дыхания и соотношении дыхательных путей в почках корневищ многолетних трав мы не обнаружили. Нами показано, что на фотофобном этапе развития этиолированные верхушки корневищ A. millefolium характеризовались сравнительно высокой скоростью поглощения О2 (табл. 1). Дыхательная активность этиолированных верхушек подземных корневищ была в 1.5–2 раза выше по сравнению с проростками пшеницы [10] или почками черники при выходе из состояния покоя [24]. Высокая скорость поглощения О2 и трехкратное превышение способности Vcyt, сопряженного с образованием энергии, над способностью энергетически малоэффективного Valt указывают на запрос энергии для роста, деления и дифференциации клеток и тканей в верхушечных меристемах этиолированных корневищ в этот период развития. Показано, что рост корневищ осуществлялся за счет увеличения числа и длины метамеров, что обеспечивается значительной активностью гормонов роста в тканях верхушечных и латеральных меристем в это время [8].
В процессе фотоморфогенеза апикальной почки подземного побега A. millefolium, при переходе от фотофобного к фотофильному этапу развития, выявлено снижение метаболической активности тканей. Верхушки сарментов на фотофильном этапе характеризовались снижением скорости дыхания и запасали в три раза меньше энергии по сравнению с этилированными верхушками корневищ (рис. 1). В верхушках зеленеющих сарментов усиливалось вовлечение АП, доля которого в общем дыхании составляла 50% (рис. 2). В этот период в конусе нарастания формируется фотофильный гистологический комплекс – листовые примордии, и осуществляется подготовка к переходу от гетеротрофного к автотрофному способу питания. В тканях зеленеющей верхушки сарментов формируются хлоропласты с развитой гранальной системой, происходит накопление фотосинтетических пигментов [3], что говорит об активном формировании компонентов фотосинтетического аппарата при фотоморфогенетическом переходе.
Активация АП в зеленеющих верхушках сарментов может свидетельствовать об участии альтернативной оксидазы (AOX) в защите фотосинтетического аппарата (ФСА), когда собственные защитные системы хлоропласта находятся в стадии формирования. Известно, что при переходе растений от роста в темноте к росту на свету в хлоропластах образуется избыток восстановительных эквивалентов, который может транспортироваться и окисляться в ЭТЦ митохондрий [11, 25, 26]. Усиление интенсивности дыхания по АП отмечали при переходе от роста в темноте к формированию на свету у семядольных листьев сои [27] и первого листа пшеницы [10]. В первые часы деэтиоляции проростков риса и пшеницы показано усиление экспрессии генов, кодирующих белок AOX [28, 29]. Активация дыхания по АП у зеленеющих верхушек сарментов свидетельствует в пользу современной гипотезы о прямой светозависимой регуляции компонентов митохондриальной дыхательной сети растений через систему фоторецепторов [11, 30, 31].
В ходе фотоморфогенетических преобразований в конусе нарастания корневища A. millefolium выявлено усиление процессов перекисного окисления липидов, увеличение содержания Н2О2 и повышение активности антиоксидантных ферментов (табл. 2). На этапе зеленения верхушки подземного побега – сармента – формируется фотосинтетический аппарат и устанавливается новый уровень про-/антиоксидантного баланса. При этом активация антиоксидантной системы препятствует развитию окислительного стресса при фотоморфогенетическом переходе, что способствует поддержанию гомеостаза. Н2О2 считают сигнальной молекулой, которая участвует в адаптации роста растений на свету [32] и играет важную роль в запуске экспрессии генов антиоксидантных ферментов для фотозищиты [33].
Таблица 2.
Активность антиоксидантных ферментов, содержание ТБК-РП и пероксида водорода в верхушках подземных побегов Achillea millefolium на разных этапах морфогенеза
| Этап морфогенеза | ТБК-РП, нмоль/г сухой массы | Н2О2, мкМ/г сухой массы | SOD Ед/мг белка | GPX, мкМ гваякола/мг белка мин | CAT, мкМ Н2О2/мг белка мин |
|---|---|---|---|---|---|
| Верхушки корневищ | 205.2 ± 8.5a | 34.3 ± 3.8a | 26.6 ± 1.3a | 160.0 ± 1.5a | 5.3 ± 0.1a |
| Верхушки зеленеющих сарментов | 268.9 ± 18.8b | 84.0 ± 2.6c | 36.1 ± 0.3b | 299.4 ± 6.2b | 6.6 ± 0.2b |
| Молодые листья сарментов | 217.8 ± 8.1a | 54.2 ± 4.8b | 28.3 ± 0.2a | 207.1 ± 32.9a | 8.4 ± 0.1c |
Примечание. Активность супероксиддисмутазы (SOD), гваяколпероксидазы (GPX), каталазы (CAT), содержание МДА (ТБК-РП) и H2O2 представлены как средние значения ± стандартная ошибка. Разные буквенные символы обозначают статистическую значимость различий изменения показателей в зависимости от этапа развития верхушек подземных побегов (ANOVA, критерий Дункана, Р ≤ 0.05).
Следует отметить, что совместное усиление активности антиоксидантных ферментов и способности АП в зеленеющих верхушках сарментов свидетельствует в пользу полифункциональности АОХ в растительной клетке и позволяет рассматривать АП в качестве компонента антиоксидантной системы растений [34]. Однонаправленный характер экспрессии генов, кодирующих ферменты антиоксидантной системы и белок AOX, ранее был выявлен в эксперименте с деэтиоляцией проростков пшеницы [7]. Полученные нами результаты указывают на универсальность некоторых физиологических механизмов адаптации растений в период перехода от гетеротрофного к фотоавтотрофному типу питания как в условиях эксперимента, так и в природе.
В молодых листьях сарментов отмечали снижение содержания ТБК-РП и Н2О2 (табл. 2), что может быть обусловлено активацией антиоксидантных ферментов и собственных систем защиты сформировавшегося ФСА. Усиление на этом фоне способности ЦП и снижение АП отражает успешную адаптацию верхушки подземных побегов A. millefolium к росту на свету (табл. 1, рис. 2).
Переход от фотофобного этапа развития к фотофильному не приводил к появлению новых изоформ антиоксидантных ферментов. По-видимому, основные ферменты антиоксидантной системы защиты присутствовали и участвовали в регуляции содержания АФК уже на гетеротрофном этапе развития верхушек корневищ. Мы не обнаружили Fe-SOD в зеленеющих верхушках и молодых листьях сарментов, хотя известно, что данная изоформа локализована в хлоропластах растительных клеток [35]. Наиболее активной изоформой SOD в верхушках подземных побегов на разных этапах развития была Cu/Zn-SOD-1 (рис. 3). В молодых листьях сарментов отмечено повышение активности Cu/Zn-SOD-2. Это согласуется с представлениями о локализации данных изоферментов в цитозоле и хлоропластах растительной клетки [35]. Активность митохондриальной изоформы Mn-SOD не изменялась в ходе зеленения на фоне увеличения содержания АФК. Вероятно, активации АП дыхания в процессе фотоморфогенеза верхушки корневища было достаточно для контроля уровня образования АФК в митохондриях. При изоферментном анализе GPX и САТ идентифицировали по одной изоформе исследуемых ферментов. В целом, общая активность антиоксидантных ферментов совпадала с активностью их изоформ.
Выявлено, что этиолированные верхушки корневищ A. millefolium накапливали значительное количество Н2О2 и характеризовались относительно высокой активностью GPX и SOD (табл. 2). Например, в этиолированных проростках пшеницы исследуемые показатели были существенно ниже [7]. Это может быть связано с высокой функциональной активностью верхушек корневищ на фотофобном этапе развития и вовлечением компонентов про-/антиоксидантного метаболизма в регуляцию процессов роста и дифференцировки клеток и тканей в конусе нарастания во время подземного роста и формирования вегетативных меристем. Компоненты про-/антиоксидантного метаболизма могут служить сигнальными молекулами, модулируя процессы роста и развития растений [36–39], и участвовать в регуляции органогенеза, поддерживая баланс между клеточной пролиферацией и дифференцировкой в апикальных меристемах [40].
Итак, нами получены оригинальные данные о дыхании, запасании энергии и компонентах про-/ антиоксидантного метаболизма в верхушках корневищ A. millefolium при фотоморфогенетическом переходе. Выявлена высокая скорость запасания энергии и поглощения О2, трехкратное превышение способности ЦП, сопряженного с образованием энергии, над способностью энергетически малоэффективного АП в тканях этиолированных верхушек корневищ. Это обусловлено запросом энергии для роста, деления и дифференциации клеток и тканей в верхушечных меристемах этиолированных корневищ в этот период развития. Обнаружены значительные количества прооксидантов и сравнительно высокая активность гваяколпероксидазы и супероксиддисмутазы, что может быть связано с вовлечением компонентов про-/антиоксидантного метаболизма в регуляцию процессов роста и дифференцировки клеток и тканей в конусе нарастания во время фотофобного развития. При зеленении верхушки подземного побега, когда собственные защитные системы фотосинтетического аппарата находятся в стадии формирования, обнаружена активация энергетически малоэффективного АП: его доля составляла 50% общей дыхательной активности. На этапе зеленения происходит значительное снижение скорости запасания энергии, устанавливается новый уровень про-/антиоксидантного баланса. Показано усиление процессов ПОЛ, увеличение содержания Н2О2 и повышение активности антиоксидантных ферментов. В листьях сарментов отмечали снижение содержания прооксидантов и усиление активности энергетически эффективного цитохромного пути дыхания, что отражает успешную адаптацию подземных побегов A. millefolium к росту на свету.
Работа выполнена в рамках темы госбюджетных НИОКТР “Фотосинтез, дыхание и биоэнергетика растений и фототрофных организмов (физиолого-биохимические, молекулярно-генетические и экологические аспекты)” (регистрационный номер 122040600021-4).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Markarov A.M., Golovko T.K. Growth orientation of underground shoots in perennial herbaceous plants. 3. Morphophysiology of underground shoots and sarment development // Russ. J. Plant Physiol. 1995. V. 2. P. 630.
Maslova S.P., Golovko T.K. Tropisms in underground shoots — stolons and rhizomes // Biol. Bull. Rev. 2018. V. 78. P. 47. https://doi.org/10.1134/S207908641803009X
Маслова С.П., Дымова О.В., Плюснина С.Н. Изменение ультраструктуры пластид и пигментного комплекса в процессе морфогенеза подземных побегов Achillea millefolium (Asteraceae) // Ботан. журнал. 2019. Т.104. С.1727.
Reinbothe C., Bakkouri M.E., Buhr F., Muraki N., Nomata J., Kurisu G., Fujita Y., Reinbothe S. Chlorophyll biosynthesis: spotlight on protochlorophyllide reduction // Trends Plant Sci. 2010. V. 15. P. 614. https://doi.org/10.1016/j.tplants.2010.07.002
Solymosi K., Schoefs B. Etioplast and etio-chloroplast formation under natural conditions: the dark side of chlorophyll biosynthesis in angiosperms // Photosynth Res. 2010. V. 105. P. 143. https://doi.org/10.1007/s11120-010-9568-2
Garmash E.V., Dymova O.V., Malyshev R.V., Plyusnina S.N., Golovko T.K. Developmental changes in energy dissipation in etiolated wheat seedlings during the greening process // Photosynthetica. 2013. V 51. P. 497.
Garmash E.V., Velegzhaninov I.O., Grabelnykh O.I., Borovik O.A., Silina E.V., Voinikov V.K., Golovko T.K. Expression profiles of genes for mitochondrial respiratory energy-dissipating systems and antioxidant enzymes in wheat leaves during de-etiolation // J. Plant Physiol. 2017. V. 215. P. 110. https://doi.org/10.1016/j.jplph.2017.05.023
Maslova S.P., Tabalenkova G.N., Malyshev R.V., Golovko T.K. Seasonal changes in growth and metabolic activity of underground shoots of yarrow // Russ. J. Plant Physiol. 2013. V. 60. P. 821. https://doi.org/10.1134/S1021443713060071
Семихатова О.А., Юдина О.С. 60 лет изучения темнового дыхания растений разных биомов в Лаборатории экологической физиологии Ботанического института им. В. Л. Комарова РАН // Бот. журн. 2012. Т. 97. С. 538.
Garmash E.V., Malyshev R.V., Shelyakin M.A., Golovko T.K. Activities of respiratory pathways and the pool of nonstructural carbohydrates in greening leaves of spring wheat seedlings // Russ. J. Plant Physiol. 2014. V. 61. P. 160. https://doi.org/10.1134/S1021443714020046
Garmash E.V. Role of mitochondrial alternative oxidase in the regulation of cellular homeostasis during development of photosynthetic function in greening leaves // Plant Biol. 2021. V. 23. P. 221. https://doi.org/10.1111/plb.13217
Безделев А.Б., Безделева Т.А. Жизненные формы семенных растений российского Дальнего Востока. Владивосток: Дальнаука, 2006. 296 с.
Hansen L.D., Hopkin M.S., Rank D.R., Anekonda T.S., Breidenbach R.W., Criddle R.S. The relation between plant growth and respiration: A thermodynamic model // Planta. 1994. V. 194. P. 77. https://doi.org/10.1007/BF00201037
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts: I. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125. P. 189. https://doi.org/10.1016/0003-9861(68)90654-1
Bellincampi D., Dipierro N., Salvi G., Cervone F., Lorenzo G.D. Extracellular H2O2 induced by oligogalacturonides is not involved in the inhibition of the auxin-regulated rolB gene expression in tobacco leaf explants // Plant Physiol. 2000. V. 122. P. 1379. https://doi.org/10.1104/pp.122.4.1379
Beauchamp C., Fridovich I. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels // Anal. Biochem. 1971. V. 44. P. 276. https://doi.org/10.1016/0003-2697(71)90370-8
Maehly A.C., Chance B. The assay of catalases and peroxidases // Meth. Biochem. Anal. 1954. V. 1. P. 357. https://doi.org/10.1002/9780470110171.ch14
Aebi H. Catalase in vitro // Meth. Enzymol. 1984. V. 105. P. 121. https://doi.org/10.1002/9780470110171.ch14
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248. https://doi.org/10.1016/0003-2697(76)90527-3
Miszalski Z., Slesak I., Niewiadomska E., Baczek-kwinta R., Lüttge U., Ratajczak R. Subcellular localization and stress responses of superoxide dismutase isoforms from leaves in the C3-CAM intermediate halophyte Mesembryanthemum crystallinum L. // Plant Cell Environ. 1998. V. 21. P. 169. https://doi.org/10.1046/j.1365-3040.1998.00266.x
Radotić K., Dučić T., Mutavdžić D. Changes in peroxidase activity and isoenzymes in spruce needles after exposure to different concentrations of cadmium // Environ. Exp. Bot. 2000. V. 44. P. 105. https://doi.org/10.1016/S0098-8472(00)00059-9
Pezzoni M., Pizarro R.A., Costa C.S. Detection of catalase activity by polyacrylamide gel electrophoresis (PAGE) in cell extracts from Pseudomonas aeruginosa // Bio Protoc. 2018. V. 8. P. 2869. https://dx.doi.org/10.21769%2FBioProtoc.2869
Маслова С.П., Табаленкова Г.Н. Гормональный статус подземных побегов и распределение ассимилятов у длиннокорневищных видов // Вестник Нижегородского университета им. Н.И. Лобачевского. 2010. № 5(1). P. 119.
Malyshev R.V., Shelyakin M.A., Golovko T.K. Bud dormancy breaking affects respiration and energy balance of bilberry shoots in the initial stage of growth // Russ. J. Plant Physiol. 2016. V. 63. P. 409. https://doi.org/10.1134/S1021443716030092
Noguchi K., Yoshida K. Interaction between photosynthesis and respiration in illuminated leaves // Mitochondrion. 2008. V. 8. P. 87. https://doi.org/10.1016/j.mito.2007.09.003
Garmash E.V. Mitochondrial respiration of the photosynthesizing cell // Russ. J. Plant Physiol. 2016. V. 63. P. 13. https://doi.org/10.1134/S1021443715060072
Ribas-Carbo M., Robinson S.A., Gonzàlez-Meler M.A., Lennon A.M., Giles L., Siedow J.N., Berry J.A. Effects of light on respiration and oxygen isotope fractionation in soybean cotyledons // Plant Cell Environ. 2000. V. 23. P. 983. https://doi.org/10.1046/j.1365-3040.2000.00607.x
Feng H.Q., Li H.Y., Zhou G.M., Liang H.G., Duan J.G., Zhi D.J., Li X., Ma J. Influence of irradiation on cyanide-resistant respiration and AOX1 multi-gene family expression during greening of etiolated rice seedlings // Photosynthetica. 2007. V. 45. P. 2720.
Garmash E.V. Grabelnych O.I., Velegzhaninov I.O., Borovik O.A., Dalke I.V., Voinikov V.K., Golovko T.K. Light regulation of mitochondrial alternative oxidase pathway during greening of etiolated wheat seedlings // J. Plant Physiol. 2015. V. 174. P. 75. https://doi.org/10.1016/j.jplph.2014.09.016
Ribas-Carbo M., Giles L., Flexas J., Briggs W., Berry J.A. Phytochrome-driven changes in respiratory electron transport partitioning in soybean (Glycine max. L.) cotyledons // Plant Biol. 2008. V. 10. P. 281. https://doi.org/10.1111/j.1438-8677.2008.00046.x
Igamberdiev A.U., Eprintsev A.T., Fedorin D.N., Popov V.N. Phytochrome-mediated regulation of plant respiration and photorespiration: Phytochrome regulation of plant respiration // Plant Cell Environ. 2014. V. 37. P. 290. https://doi.org/10.1111/pce.12155
Mullineaux P., Karpinski S. Signal transduction in response to excess light: getting out of the chloroplast // Curr. Opin. Plant Biol. 2002. V. 5. P. 43. https://doi.org/10.1016/S1369-5266(01)00226-6
Neill S., Desikan R., Hancock J. Hydrogen peroxide signalling // Curr. Opin. Plant Biol. 2002. V. 5. P. 388. https://doi.org/10.1016/S1369-5266(02)00282-0
Maxwell D.P., Wang Y., McIntosh L. The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells // Proc. Natl. Acad. Sci. U.S.A. 1999. V. 96. P. 8271. https://doi.org/10.1073/pnas.96.14.8271
Kliebenstein D.J., Monde R.-A., Last R.L. Superoxide dismutase in Arabidopsis: an eclectic enzyme family with disparate regulation and protein localization // Plant Physiol. 1998. V. 118. P. 637. https://doi.org/10.1104/pp.118.2.637
Пескин А.В. О регуляторной роли активных форм кислорода // Биохимия. 1998. Т. 63. P. 1305.
Sauer H., Wartenberg M., Hescheler J. Reactive oxygen species as intracellular messengers during cell growth and differentiation // Cell Physiol. Biochem. 2001. V. 11. P. 173. https://doi.org/10.1159/000047804
Miller G., Shulaev V., Mittler R. Reactive oxygen signaling and abiotic stress // Physiol. Plant. 2008. V. 133. P. 481. https://doi.org/10.1111/j.1399-3054.2008.01090.x
Tripathy B.C., Oelmüller R. Reactive oxygen species generation and signaling in plants // Plant Signal. Behav. 2012. V. 7. P. 1621. https://doi.org/10.4161/psb.22455
Tsukagoshi H., Busch W., Benfey P.N. Transcriptional regulation of ROS controls transition from proliferation to differentiation in the root // Cell. 2010. V. 143. P. 606. https://doi.org/10.1016/j.cell.2010.10.020
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


