Физиология растений, 2023, T. 70, № 1, стр. 3-13
Физиологическое значение рН-зависимого структурного перехода в кислород-выделяющем комплексе ФС II
Б. К. Сёмин a, *, Л. Н. Давлетшина a, А. В. Локтюшкин a, Е. Р. Ловягина a
a Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
* E-mail: semin@biophys.msu.ru
Поступила в редакцию 24.03.2022
После доработки 22.04.2022
Принята к публикации 27.04.2022
- EDN: ALDDHF
- DOI: 10.31857/S0015330322100268
Аннотация
Фотосистема II (ФС II) фотосинтетического аппарата оксигенных организмов содержит каталитический центр, осуществляющий одну из важнейших биоэнергетических реакций – светозависимое окисление воды до молекулярного кислорода. Каталитический центр представляет собой кластер Mn4CaO5, состоящий из 4 катионов марганца и 1 катиона кальция, соединенных кислородными мостиками. Ранее нами было установлено, что в области рН 5.7 в кластере имеет место структурный переход, сопровождающийся изменением редокс-потенциала катиона(ов) марганца и повышением устойчивости Mn-кластера к действию восстановителей. Обнаруженный эффект был изучен нами в ряде исследований, обзор которых представлен в данной работе. Установлено, что при рН 5.7 катионы Fe(II) замещают не два катиона марганца как при рН 6.5, а только один катион, формируя химерный кластер Mn3Fe1. Мембранные препараты ФС II с таким химерным кластером способны в присутствии экзогенных ионов кальция выделять кислород при освещении (около 25% скорости в нативной ФС II). Обнаружено, что фотоингибирование, в котором значительную роль играют процессы окисления/восстановления, при рН 5.7 замедляется по сравнению с рН 6.5. Препараты ФС II также были более устойчивы к термоинактивации при рН 5.7, чем при рН 6.5. Однако в препаратах ФС II без катионов марганца в кислород-выделяющем комплексе разницы в скоростях фотоингибирования при рН 6.5 и 5.7 не наблюдалось. В тилакоидных мембранах протонофоры, сбрасывающие протонный градиент и увеличивающие рН люмена, где локализован марганцевый кластер, c 5.7 до 7.0, значительно увеличивали скорость фотоингибирования ФС II. Предполагается, что структурный переход в Mn-кластере в области рН 5.7 вовлечен в механизм защиты ФС II от фотоингибирования.
ВВЕДЕНИЕ
Фундаментальный и важнейший биологический процесс, называемый фотосинтезом, осуществляется оксигенными организмами (высшие растения, водоросли, цианобактерии) в фотосинтетическом аппарате, главными компонентами которого являются фотосистема II (ФС II) и фотосистема I. ФС II содержит уникальный каталитический центр, осуществляющий светозависимую реакцию окисления двух молекул воды и образования между двумя оставшимися атомами кислорода химической связи. При этом высвобождаются необходимые для фотосинтеза электроны и протоны. Образующийся молекулярный кислород выбрасывается в атмосферу как побочный продукт. Данная реакция является практически единственным источником кислорода на нашей планете.
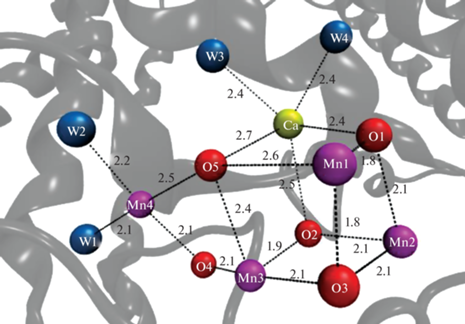
Каталитический центр, окисляющий воду, состоит из 4 катионов марганца и 1 катиона кальция, соединенных кислородными мостиками (Mn4CaO5). В 2011 году Umena с коллегами с помощью рентгеноструктурного анализа определили структуру каталитического центра с разрешением 1.9 Å [1]. Эта структура представлена на рис. 1. Она представляет собой неправильный куб, образованный катионом кальция, тремя катионами марганца и четырьмя кислородными атомами. Четвертый катион марганца расположен на некотором расстоянии от куба, но соединен с ним. Отдельно расположенный катион марганца и катион кальция имеют по две молекулы воды в качестве лигандов. Являются ли эти молекулы воды субстратной водой, пока неясно. Относительным недостатком данной работы была возможность восстановления рентгеновскими лучами катионов марганца в процессе эксперимента, что могло повлиять на точность определения расстояний между элементами кластера. Эта проблема была решена позже с применением лазера, генерирующего фемтосекундные импульсы рентгеновских лучей [2]. Однако, несмотря на то, что структура каталитического центра в настоящее время известна, механизм синтеза молекулярного кислорода этим центром все еще остается непонятным.
Рис. 1.
Атомная структура кислород-выделяющего комплекса ФС II: Ca, Mn(1-4) и О(1-5) − ионы кальция, марганца и атомы кислорода; W(1-4) − атомы кислорода молекул воды, являющихся лигандами марганца и кальция. Структура получена в работе [1]. Код PDB: 3WU2.
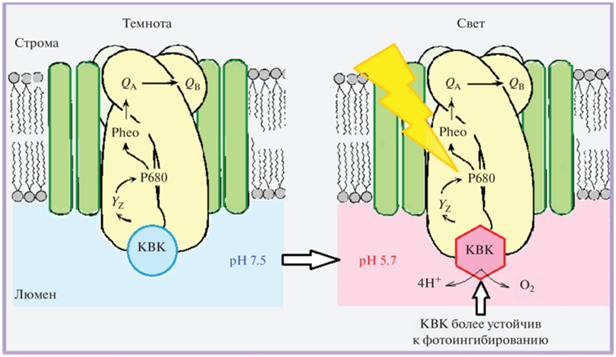
Функциональная активность и характеристики марганец-кальциевого каталитичеcкого центра существенно зависят от рН окружающей среды, что может быть связано с процессом протонирования/депротонирования не только аминокислотных остатков, но и кислородных мостиков, некоторые из которых (например, мостик О5) могут участвовать непосредственно в образовании молекулярного кислорода [3]. В предлагаемой работе мы представляем наши результаты исследований влияния процесса протонирования/депротонирования на свойства каталитического центра окисления воды в ФС II. Мы показали, что в области рН 5.7 имеет место существенное уменьшение редокс-потенциала одного из катионов марганца, входящего в состав кислород-выделяющего комплекса (КВК) ФС II. Данный процесс приводит к повышению устойчивости этого катиона марганца к действию эндогенных и экзогенных восстановителей. Используя обнаруженный эффект, мы разработали метод получения мембранных препаратов ФС II с химерным каталитическим центром в КВК, состоящим из 3 катионов марганца и 1 катиона железа и способным выделять молекулярный кислород, окисляя воду с активностью около 25% от нативного препарата ФС II [4]. Полученные результаты могут представлять интерес для разработки искусственных систем фотолиза воды как генераторов молекулярного кислорода и водорода. В процессе исследования механизма фотоингибирования была обнаружена взаимосвязь между рН-зависимым структурным переходом в КВК в области рН 5.7 и устойчивостью к фотоингибированию. Данная взаимосвязь представляет собой новый, ранее неизвестный, механизм самозащиты фотосинтетического аппарата в оксигенных организмах от фотоингибирования. Учитывая важность процесса фотоингибирования в определении выхода валового продукта фотосинтеза, мы предполагаем высокую практическую и теоретическую значимость дальнейших исследований данного эффекта как в фундаментальном, так и в практическом направлении.
рН-ЗАВИСИМОСТЬ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ФС II
Скорость генерации молекулярного кислорода КВК ФС II в оксигенных фотосинтезирующих организмах значительно зависит от рН окружающей среды. Зависимость кислород-выделяющей активности мембранных препаратов ФС II имеет колоколообразную форму с максимумом в области рН 6.2–6.8 и ниспадающими участками с 50% ингибированием в области рН 4.8−5.7 и рН 7.3−7.5 [5–11]. Механизм рН-зависимой инактивации ФС II до сих пор недостаточно выяснен. Ингибирование КВК в щелочной области, по крайней мере частично, определяется экстракцией из него аниона Сl– [8]. В области кислых рН инактивация КВК в значительной степени определяется диссоциацией периферических белков. PsbP, PsbQ и PsbO периферические белки имеют соответствующие рК (50% диссоциация) – 5.0, 4.1 и 3.6 [12]. рН-зависимая экстракция PsbP и PsbQ белков сопровождается экстракцией Са2+ из КВК, что приводит к ингибированию реакции окисления воды [13]. Увеличение концентрации протонов в среде оказывает влияние и на марганцевый кластер КВК, в том числе и на S-переходы каталитического цикла. В работах Bernát с соавт. и Suzuki с соавт. практически идентичные результаты были получены на препаратах ФС II, выделенных из шпината [14] и термофильных цианобактерий Thermosynechoccocus elongatus [15]. В проведенных экспериментах было установлено, что в КВК шпината S1 → S2 переход не зависит от рН в области 4.1−8.4, тогда как S2 → S3, S3 → [S4] → S0 и S0 → S1 переходы имеют pK, соответственно, 4.0, 4.5 и 4.7 [14].
рН-ЗАВИСИМОСТЬ УСТОЙЧИВОСТИ КАТИОНОВ МАРГАНЦА В КВК К ДЕЙСТВИЮ ЭКЗОГЕННЫХ ВОССТАНОВИТЕЛЕЙ
Известно, что экзогенные восстановители с небольшим размером молекулы, такие как гидроксиламин (NH2OH), гидразин (NH2NH2), перекись водорода (Н2О2) могут восстанавливать катионы марганца в КВК интактной ФС II [16]. Восстановители большего размера, такие как гидрохинон и бензидин, также могут восстанавливать катионы марганца, но в препаратах ФС II, в которых Mn4CaO5 кластер не защищен периферическими белками PsbP и PsbQ [16]. Последний тип препарата ФС II (ФС II(-Са)) получают обработкой ФС II раствором с высокой концентрацией NaCl (2 М), в результате чего ФС II теряет не только два периферических белка PsbP и PsbQ, но и катион кальция из КВК [17]. Восстановленные экзогенными восстановителями катионы марганца (Mn(II)) покидают участки связывания. Данная реакция часто используется как метод экстракции катионов марганца из КВК ФС II (например, экстракция марганца гидроксиламином или Трис при щелочных рН). Следует отметить, что обработка гидроксиламином не удаляет из ФС II периферический марганец-стабилизирующий белок PsbO, тогда как экстракция марганца обработкой Трис удаляет все 3 периферических белка [18–21].
Особенности восстановления катионов марганца экзогенными восстановителями
Действие восстановителей на катионы марганца в КВК имеет свои особенности. Эффективность восстановления катионов марганца зависит от природы восстановителя. Например, при рН 6.5 (оптимум рН для реакции выделения кислорода [11]) гидроксиламин экстрагирует все 4 катиона, тогда как гидрохинон экстрагирует только 3 катиона марганца из 4 [11], а катионы железа экстрагируют 2 катиона марганца [22]. Нами также была исследована эффективность экстракции катионов марганца из КВК при другом рН, величина которого соответствует величине рК (≈5.7) ниспадающей ветви зависимости выделения кислорода в кислой области рН [11]. Эти эксперименты показали, что эффективность экстракции зависит от рН. Например, катионы Fe(II) экстрагируют 2 Mn(II) при рН 6.5 и только один катион марганца при рН 5.7. Соответственно, гидрохинон и Н2О2 экстрагирует 3 и 2 катиона при тех же рН (табл. 1).
Таблица 1.
Эффективность экстракции катионов марганца из кислород-выделяющего комплекса различными восстановителями
| Восстановитель | Количество катионов Mn на реакционный центр после обработки восстановителем | |
|---|---|---|
| рН 5.7 | рН 6.5 | |
| Без обработкиа | 4.0 ± 0.2 | 4.0 ± 0.2 |
| Гидроксиламинб | 0.4 ± 0.1 | 0.4 ± 0.1 |
| Гидрохинона | 2.0 ± 0.2 | 1.0 ± 0.1 |
| Н2О2а | 2.0 ± 0.1 | 1.0 ± 0.2 |
| Fe(II)в | 2.9 ± 0.2 | 2.0 ± 0.1 |
Таким образом, рН-зависимая устойчивость к действию экзогенных восстановителей имеется, предположительно, только у одного катиона марганца, входящего в состав марганцевого кластера КВК. При исследовании процесса экстракции катионов марганца из КВК частиц ФС II без кальция катионами Fe(II) было показано, что один из экстрагируемых катионов марганца связан с высокоаффинным Mn-связывающим участком [22] и его устойчивость к действию восстановителя регулируется катионом кальция [23]. Высокоаффинный Mn-связывающий участок является уникальным участком, поскольку в частицах ФС II после экстракции Mn/Ca кластера он является единственным Mn-связывающим участком, с которым связывается катион Mn(II), окисляемый затем вторичным донором YZ [24]. Очень интересно с точки зрения темы нашего обзора то, что константа диссоциации для катиона марганца, связанного с этим сайтом, сильно зависит от рН в области 5.0–7.0 [24], уменьшаясь с увеличением рН, т.е. прочность связывания катиона Mn(II) с высокоаффинным участком уменьшается с уменьшением рН. Это дает возможность предполагать, что лабильный катион марганца (катион, замещаемый катионом железа при рН 5.7 и регулируемый катионом кальция), связан с высокоаффинным Mn-связывающим участком. Однако рН может влиять и на аффинность связывания не только катиона Mn(II), но и катиона марганца с повышенной валентностью, что может изменить другой параметр – окислительно-восстановительный потенциал связанных катионов марганца. Поскольку экстракция катионов марганца происходит в результате их восстановления, это может свидетельствовать о важной роли соотношения окислительно-восстановительных потенциалов восстановителя и катионов марганца в этом процессе [25]. В этой связи можно предположить, что повышение устойчивости к действию восстановителей одного из катионов марганца в кластере связано с уменьшением его редокс-потенциала при понижении рН. C другой стороны, и при рН 6.5 кластер Mn4CaO5 содержит катион марганца, очень устойчивый к действию восстановителей, который не экстрагируется ни гидрохиноном, ни Н2О2 (табл. 1), и этот катион не связан с высокоаффинным участком [22]. Недавно Zabret с соавт. [26] обнаружили в кристаллографической структуре, собирающейся ФС II еще без Mn-кластера и белков КВК, один положительно заряженный ион (не идентифицированный, возможно катион марганца) в позиции высокоаффинного участка нативной ФС II. Учитывая этот факт и возможность экстракции катиона марганца из высокоаффинного участка восстановителями, мы может предполагать, что этот катион не является катионом марганца, устойчивым к действию восстановителей.
Влияние Са2+ на восстановление катионов марганца гидрохиноном и катионами железа
Окисление двух молекул воды, сопряженное с образованием молекулярного кислорода, осуществляется каталитическим центром, в состав которого входит помимо 4 катионов марганца также 1 катион кальция. Катион кальция соединен с катионами Mn1, 2, 3 и 4 кислородными мостиками О1, О2 и О5 (рис. 1). Механизм участия Са2+ в реакции фотолиза воды пока не известен в деталях. Согласно одной из гипотез, катион кальция связывает молекулу субстратной воды. Действительно, рентгеноструктурный анализ показал, что Са2+ связывает две молекулы воды (W3 и W4). Имеются экспериментальные данные, что кислород одной из них (W3) возможно принимает участие в образовании молекулярного кислорода [27]. В последнее время появилась новая гипотеза, основанная на модельных экспериментах. Tsui и Agapie [28] обнаружили линейную зависимость между окислительно-восстановительным потенциалом гетерометаллического металл-оксидного кластера и кислотностью Льюиса редокс-неактивного катиона металла. Авторы предположили, что эта корреляция является свидетельством участия катиона кальция в модулировании редокс-потенциала марганцевого кластера. Таким образом, катион кальция в КВК может влиять на редокc-потенциал одного или нескольких катионов марганца и, таким образом, регулировать эффективность восстановления катионов марганца экзогенными редокс-агентами. В этой связи мы исследовали влияние Са2+ на эффективность экстракции катионов марганца гидрохиноном и катионами Fe(II). Полученные результаты представлены в табл. 2 и свидетельствуют о влиянии Са2+ на восстановление катионов марганца в КВК. Инкубация препарата ФС II(-Са) в присутствии Са2+ с гидрохиноном предотвращает экстракцию катиона марганца при рН 6.5, но не влияет на процесс экстракции при рН 5.7 (табл. 2). В случае другого восстановителя, а именно катиона Fe(II), Cа2+ ингибирует экстракцию дополнительного катиона Mn как при рН 5.7, так и при рН 6.5 (табл. 2). Ингибирующее действие Са2+ на экстракцию катионов марганца из КВК гидрохиноном и катионами железа подтверждает возможность влияния Са2+ в КВК на редокс-потенциал одного или нескольких катионов марганца. Помимо Са2+ нами было также исследовано влияние и других катионов металлов на экстракцию катионов марганца из КВК ионами Fe(II) и гидрохиноном. Из всех исследованных катионов (La3+, Cd2+, Ni2+, Mg2+, Sr2+ [23] и Co2+, Cd2+ Mg2+, Sr2+ [11]) только катионы Sr2+ влияли на экстракцию, и это влияние было аналогично влиянию катионов кальция. Необходимо отметить, что из всех исследованных в литературе катионов металлов только катионы стронция могут замещать катионы Са2+ в КВК in vivo биосинтетическим методом [29–31] и восстанавливать кислород-выделяющую активность (до 40–50%) в препаратах ФС II без Са2+ в КВК [32, 33]. Совокупность этих результатов позволяет предполагать, что механизм влияния кальция на редокс-свойства катиона/катионов марганца в КВК связан с механизмом участия кальция в фотолизе воды. Факт влияния катиона кальция на количество экстрагируемых катионов марганца свидетельствует о том, что модификация препарата изменяет его свойства, что должно учитываться при планировании экспериментов и интерпретации экспериментальных данных.
Таблица 2.
Влияние катионов Ca2+ на экстракцию катионов марганца из кислород-выделяющего комплекса гидрохиноном и ионами Fe(II) при различных рН
| Препарат | Количество катионов Mn на реакционный центр после обработки восстановителем | |
|---|---|---|
| рН 5.7 | рН 6.5 | |
| ФС II(-Са)a, б | 4.0 ± 0.2 | 4.0 ± 0.2 |
| ФС II(-Са) + Н2Qа | 2.0 ± 0.2 | 1.0 ± 0.1 |
| ФС II(-Са) + Н2Q + Ca2+ а | 2.1 ± 0.1 | 1.8 ± 0.1 |
| ФС II(-Са) + Fe(II)б | 2.9 ± 0.2 | 2.0 ± 0.1 |
| ФС II(-Са) + Fe(II) + Ca2+ б | 3.9 ± 0.2 | 3.1 ± 0.2 |
Структурный переход в марганцевом кластере КВК в области рН 5.7
Представленные выше результаты позволяют предположить, что в области рН 5.7 происходит протонирование (при понижении рН) либо кислородного мостика/мостиков, либо одной или нескольких аминокислотных групп, входящих в состав марганцевого кластера или его ближайшего окружения. Этот процесс, по-видимому, уменьшает редокс-потенциал одного из катионов марганца, что делает его недоступным для восстановителя [11]. Возможно, в рН-зависимость действия восстановителя вносит свой вклад и процесс протонирования/депротонирования самого восстановителя, как, например, в случае гидрохинона, однако влияние катионов железа свидетельствует, что рН зависимость определяется главным образом процессом протонирования/депротонирования КВК. Следует отметить, что рН-зависимость кислород-выделяющей активности мембранных препаратов как шпината, так и цианобактерий, измеренная достаточно детально (с шагом рН 0.1), имеет небольшое плечо в области рН 5.7 [8]. В работе Терентьева с соавт. [9] также было отмечено небольшое плечо в рН-зависимости скорости выделения кислорода. Более заметное плечо в рН-зависимости функциональной активности ФС II в области рН 5.3 появляется в мутантах Synechocystis sp. PCC 6803 D1-S169A и D2-K317A, у которых заменены аминокислоты, по-видимому, участвующие в работе протонных каналов и взаимодействующие через водородные связи с марганцевым кластером [34]. Работа этих каналов, отводящих протоны от КВК, может быть очень важной в механизме окисления воды, так как позволяет поддерживать в КВК баланс зарядов, необходимый для эффективного синтеза молекулярного кислорода. Иными словами, скорость синтеза кислорода может лимитироваться скоростью высвобождения протонов. В пользу этого свидетельствуют, например, следующие факты: 1) в мутанте Chlamydomonas без карбоангидразы, ассоциированной с донорной стороной ФС II, выделение кислорода подавляется в отсутствие ${\text{HCO}}_{3}^{ - }$ [35]; 2) активность карбоангидразы может поддерживать фотосинтетическую активность ФС II при определенных условиях [9].
рН-зависимый структурный переход может быть связан и с влиянием на белковый компонент ФС II. Известно, что периферические белки ФС II отсоединяются от ядра ФС II при подкислении среды [12]. Первым покидает участок связывания белок PsbP, 50%-ая диссоциация которого наблюдается при рН 5.0 [12]. Для частиц ФС II без Са2+ данный факт не имеет значения, поскольку эти препараты уже не имеют этого белка. Но в случае нативных препаратов такой эффект необходимо иметь в виду, например, при использовании тилакоидных мембран (см. далее). В случае глубокой деструкции КВК могут проявляться конформационные эффекты, связанные с белком СР43 [36], но они имеют место при разрушении марганцевого кластера.
ПОЛУЧЕНИЕ ХИМЕРНОГО КЛАСТЕРА Mn3Fe1 В КВК ФС II ПРИ рН 5.7
Взаимодействие катионов железа как восстановителей с катионами марганца в КВК имеет некоторые особенности. Во-первых, взаимодействие возможно только в препаратах ФС II без периферических белков PsbQ и PsbP, закрывающих марганцевый кластер в КВК и делающих его недоступным для катионов Fe(II). Во-вторых, катионы Fe(III) c высокой специфичностью и эффективностью связываются с Мn-связывающими участками КВК, в том числе и с высокоаффинным Мn-связывающим участком [37–39]. Эта особенность окисленных катионов железа приводит к тому, что при восстановлении катиона марганца катионом Fe(II) катионы Mn(II) высвобождаются из участка связывания, и освобожденный Мn-связывающий участок c высокой эффективностью связывает катион Fe(III). Данный процесс был исследован в случае взаимодействия катионов Fe(II) с марганцевым кластером КВК при рН 6.5 [22], при этом было установлено, что катионы железа замещают два катиона марганца, один из которых связан с высокоаффинным Мn-связывающим участком. Химерный кластер окисляет на свету молекулы воды с меньшей эффективностью, чем нативные препараты ФС II, но не до молекулярного кислорода, а до Н2О2. Как отмечалось выше (табл. 2), при рН 5.7 катионы железа экстрагируют из КВК не 2 катиона марганца, а один. Экстракция, по-видимому, также сопровождается замещением катиона марганца на катион железа, т.е. в КВК образуется кластер Mn3Fe1. В пользу этой гипотезы свидетельствует тот факт, что гидрохинон не экстрагирует катионы марганца из химерного кластера Mn3Fe1, но экстрагирует 3 катиона марганца из нативного кластера Mn4 без катионов железа [4], т.е. в химерном кластере катионы марганца более устойчивы к действию восстановителя. Это косвенно свидетельствует о том, что кластер содержит катион железа, повышающий устойчивость катионов марганца. Данный вывод подтверждается тем, что в случае химерного кластера Mn2Fe2 при сравнении с кластером Mn2 наблюдается такой же эффект [4]. При исследовании функциональных свойств ФС II с химерным кластером Mn3Fe1 был обнаружен интересный факт. В отличие от ФС II с химерным кластером Mn2Fe2 ФС II с кластером Mn3Fe1 выделяет на свету в присутствии экзогенного кальция кислород. Эффективность кислород-выделяющей реакции составляет 27% от аналогичной скорости в нативной ФС II. Возможность окисления воды химерным кластером с выделением кислорода представляет интерес для исследования механизма фотосинтетического окисления воды (идентификация катионов марганца, играющих генеральную роль в фотолизе воды и т. д.), а также для разработки искусственных систем фотолиза воды как генераторов молекулярного кислорода и водорода.
рН-ЗАВИСИМОСТЬ ФОТОИНГИБИРОВАНИЯ И ТЕРМОИНАКТИВАЦИИ
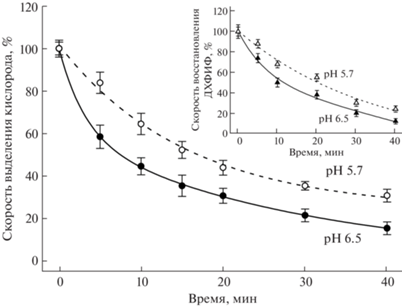
Известно, что ФС II разрушается под действием света и скорость этого процесса увеличивается при повышении его интенсивности. Данный эффект называется фотоингибированием, и имеется достаточно много данных, указывающих на то, что первой стадией этого процесса является деструкция марганцевого кластера Mn4CaO5 в КВК [40–42]. Марганцевый кластер может быть разрушен восстановителями, например, некоторыми активными формами кислорода (${\text{O}}_{2}^{{\centerdot - }}$, Н2О2), генерируемыми на донорной и акцепторной стороне ФС II [43]. Таким образом, повышенная устойчивость марганцевого кластера к действию восстановителей (гидрохинон, Н2О2, катионы Fe(II)) при рН 5.7, обнаруженная нами [4, 11], может обеспечить и повышенную устойчивость ФС II к фотоингибированию при этих рН. Мы провели сравнительное исследование кинетик фотоингибирования мембранных препаратов ФС II из шпината при рН 5.7 и 6.5 [44]. Эффективность фотоингибирования определяли, измеряя скорости выделения кислорода и восстановления 2,6-дихлорфенолиндофенола (ДХФИФ) после освещения в течение определенного времени (рис. 2). Было обнаружено, что эффективность фотоингибирования электронного транспорта в ФС II выше при рН 6.5, чем при рН 5.7. Время 50% ингибирования составляет 7.8 ± 0.4 и 18.0 ± 0.6 мин при рН 6.5 и 5.7 соответственно. Таким образом, при рН 5.7 наблюдается эффект повышенной защиты от фотоингибирования, и этот эффект является максимальным по величине именно при этом рН, судя по его рН-зависимости.
Рис. 2.
Влияние рН на фотоинактивацию реакции выделения кислорода нативными мембранными препаратами ФС II [44]. Мембранные препараты ФС II (15 мкг Хл/мл) суспендировали в буфере А, pH 6.5 (сплошная линия) или pH 5.7 (пунктирная линия) и освещали при 25°C белым светом (1300 мкЭ/(м2 с) при постоянном перемешивании в отсутствие искусственного акцептора. После освещения в течение определенного времени измеряли скорость выделения O2 при 25°C в присутствии акцептора 2,6-дихлоро-п-бензохинона (0.2 мМ). Кривые на вставке демонстрируют фотоинактивацию реакции восстановления ДХФИФ (начальная концентрация 40 мкМ). Непрерывная линия представляет фотоинактивацию в буфере A, pH 6.5, пунктирная линия – pH 5.7. Контрольные скорости выделения O2 при pH 6.5 и 5.7 составляли 450 ± 16 и 330 ± 15 мкмоль O2/(мг Хл ч), соответственно. Контрольные скорости восстановления ДХФИФ при pH 6.5 и 5.7 составляли 130 ± 9 и 97 ± 5 мкмоль ДХФИФ/(мг Хл ч), соответственно. Состав буфера А: сахароза 0.4 М, MES 50 мМ, NaCl 15 мМ. Каждая точка представляет среднее значение и стандартное отклонение трех экспериментов.
Экстракция катиона кальция из КВК не оказывает влияния на рН эффект и на скорость фотоингибирования. Однако препараты ФС II, из которых был экстрагирован Mn4CaO5 кластер вместе с периферическими белками (ФС II(-Mn)), показали совсем другую кинетику фотоингибирования (рис. 3).
Рис. 3.
Влияние рН на фотоинактивацию транспорта электрона в мембранных препаратах ФС II(-Mn) [44]. Мембранные препараты ФС II(-Mn) (15 мкг Хл/мл) были суспендированы в буфере А, рН 6.5 (сплошная линия) или рН 5.7 (пунктирная линия) и освещены при 25°С белым светом (1300 мкЭ/(м2 с)) при постоянном перемешивании в отсутствие искусственных акцептора и донора. После освещения в течение определенного времени измеряли скорость восстановления ДХФИФ при 25°С в присутствии донорной системы [3 мM H2O2 + 2 мкM MnCl2]. Контрольные значения скорости восстановления ДХФИФ составляли 149 ± 10 и 71 ± 8 мкмоль ДХФИФ/(мг Хл ч) при рН 6.5 и 5.7, соответственно. Каждая точка представляет среднее значение и стандартное отклонение трех экспериментов.
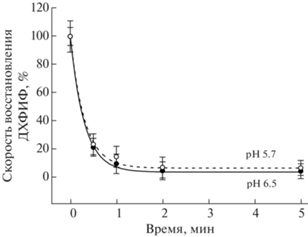
Полученные результаты демонстрируют, что скорость фотоингибирования в препаратах ФС II(-Mn) значительно выше, чем в нативных препаратах ФС II (t1/2 = 0.18 ± 0.01 мин при рН 6.5, тогда как в нативных препаратах t1/2 = 7.8 ± ± 0.4 мин). Увеличение скорости фотоингибирования ФС II, не содержащей марганец, известно [45]. Повышенная чувствительность к свету объясняется окислительным повреждением реакционного центра, так как время жизни первичных окисленных доноров Р680+ и ${\text{Y}}_{{\text{Z}}}^{ + }$ значительно увеличивается в отсутствие притока электронов от марганцевого кластера/воды. Но здесь важно отметить другой факт − рН не влияет на скорость фотоинактивации ФС II без марганца в области структурного перехода в КВК (рН 5.7) – кинетики фотоинактивации при рН 5.7 и 6.5 совпадают (рис. 3), в отличие от кинетик фотоинактивации нативных препаратов ФС II или препаратов ФС II без кальция, но имеющих марганцевый кластер. Этот результат ясно демонстрирует, что рН-зависимость фотоинактивации определяется рН-зависимым процессом в КВК ФС II (нет КВК – нет рН зависимости фотоингибирования, а именно повышения резистентности к действию света в области рН 5.7).
рН-зависимость фотоингибирования ФС II в тилакоидных мембранах. Структурный переход в КВК в области рН 5.7 как механизм защиты от фотоингибирования
Наш анализ рН-зависимости фотоинактивации ФС II показал, что наибольшая резистентность к этому процессу наблюдается в области рН 5.7. Эта величина рН представляет существенный интерес, поскольку рН 5.7 – это область рН внутритилакоидной среды (люмена) при освещении [46–48]. Известно, что генерируемый светом электронный транспорт в ФС II обеспечивает появление трансмембранного протонного градиента (ΔрН), используемого АТФ-синтазой для продукции АТФ. Появление ΔрН сопровождается уменьшением рН среды в люмене от 7.0 (в темноте) до pH ≈5.7–5.8 [49, 50]. При рН в люмене >7.0 наблюдается необратимое ингибирование КВК в части ФС II препаратов [9]. Следует отметить, что протонный градиент на тилакоидных мембранах может варьировать в зависимости от интенсивности света, активности АТФ-синтазы и др. Кроме того, может иметь место большая латеральная гетерогенность в значении рН между гранальными и стромальными областями тилакоидов [51, 52]. Принимая во внимание эти результаты, мы исследовали фотоингибирование ФС II и действие разобщителей NH4Cl и нигерицина на этот процесс. Фотоинактивация отслеживалась посредством измерения скорости выделения кислорода с использованием акцептора электронов 2,6-дихлоро-п-бензохинона (0.2 мМ). Тилакоидные мембраны суспендировали в трициновом буфере с рН 7.6 (20 мкг Хл/мл), освещали (1300 мкЭ/(м2 с)) при 25°С и измеряли скорость выделения кислорода. Результаты приведены в табл. 3. Согласно полученным данным, скорость фотоинактивации тилакоидных мембран была несколько меньше скорости фотоинактивации препаратов ФС II (рис. 2 и табл. 3). Однако разобщители значительно ускоряли этот процесс (табл. 3). Так как разобщители устраняют протонный градиент [53], увеличивая величину рН в люмене (место локализации КВК), этот результат может рассматриваться как дополнительное свидетельство того, что рН 5.7 обеспечивает максимальную защиту ФС II от фотоингибирования.
Таблица 3.
Влияние разобщителей на фотоинактивацию выделения О2 в тилакоидных мембранах
| Образец | Скорость выделения О2, мкмоль O2/(мг Хл ч) (%) | |
|---|---|---|
| Без освещения (инкубация в темноте) |
Через 40 мин освещения | |
| Тилакоидные мембраны | 184 ± 5 (100% ± 2.7%) | 114 ± 9 (62.0% ± 4.9%) |
| + 2 мМ NH4Cl | 270 ± 15 (100% ± 5.6%) | 67 ± 5 (24.8% ± 1.9%) |
| + 6 мкM нигерицина | 261 ± 14 (100% ± 5.4%) | 55 ± 5 (21.1% ± 2.3%) |
Примечание. По данным [44].
Повышение термостабильности ФС II при рН 5.7
Увеличение устойчивости катионов марганца в КВК к действию экзогенных восстановителей с максимумом при рН 5.7 также может играть заметную роль и в системе защиты растений от теплового повреждения, так как в термоинактивации участвуют, по-видимому, и активные формы кислорода [54], некоторые из которых являются эффективными восстановителями [43]. Мы обнаружили, что мембранные препараты ФС II, суспендированные в буфере с рН 5.7, менее чувствительны к тепловому стрессу (50°C), чем аналогичные образцы при pH 6.5. После термической обработки остаточная скорость транспорта электронов к искусственному акцептору ДХФИФ при рН 6.5 была близка к нулю, в то время как при рН 5.7 составляла 20–25% от исходной [55]. Мы предполагаем, что повышение устойчивости КВК к тепловому стрессу при рН 5.7 определяется рН-зависимым изменением окислительно-восстановительного потенциала Em одного или нескольких катионов марганца в КВК [11]. Изменение Em в свою очередь увеличивает устойчивость катионов марганца к восстановителям, например, активным формам кислорода. С учетом аналогичного эффекта рН при фотоингибировании [44] мы допускаем, что структурный переход в марганцевом кластере в области рН 5.7 может играть важную роль в защитном ответе ФС II на разрушительное воздействие окружающей среды в целом.
ЗАКЛЮЧЕНИЕ
Совпадение величины рН 5.7, при которой увеличивается защищенность ФС II от фотоингибирования, с величиной рН люмена при условиях генерации трансмембранного рН градиента означает, что рН-зависимый структурный переход в области рН 5.7 может играть роль нового (неизвестного ранее) рН-зависимого механизма самозащиты фотосинтетического аппарата от фотоинактивации. Схема подобного механизма представлена на рис. 4 и заключается в следующем: в тилакоидных мембранах освещение ФС II сопровождается генерацией ΔpH на тилакоидной мембране и уменьшением рН в люмене до величины ≈5.7 [49, 50], т.е. до рН максимальной защиты от фотоингибирования. Таким образом, обнаруженный нами эффект обеспечивает дополнительный механизм защиты ФС II от фотоингибирования в условиях освещения.
Исследование выполнено в рамках научного проекта государственного задания Федерального государственного бюджетного образовательного учреждения высшего образования “Московский государственный университет имени М.В. Ломоносова”, № 121032500058-7.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Umena Y., Kawakami K., Shen J.-R., Kamiya N. Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å // Nature. 2011. V. 473. P. 55. https://doi.org/10.1038/nature09913
Suga M., Akita F., Hirata K., Ueno G., Murakami H., Nakajima Y., Shimizu T., Yamashita K., Yamamoto M., Ago H., Shen J.-R. Native structure of photosystem II at 1.95 Å resolution viewed by femtosecond X-ray pulses // Nature. 2015. V. 517. P. 99. https://doi.org/10.1038/nature13991
Shen J.-R. The structure of photosystem II and the mechanism of water oxidation in photosynthesis // Annu. Rev. Plant Biol. 2015. V. 66. P. 23. https://doi.org/10.1146/annurev-arplant-050312-120129
Semin B.K., Davletshina L.N., Seibert M., Rubin A.B. Creation of a 3Mn/1Fe cluster in the oxygen-evolving complex of photosystem II and investigation of its functional activity // J. Photochem. Photobiol. B. 2018. V. 178. P. 192. https://doi.org/10.1016/j.jphotobiol.2017.11.016
Damoder R., Dismukes G.C. pH dependence of the multiline, manganese EPR signal for the 'S2' state in PS II particles. Absence of proton release during the S1 → S2 electron transfer step of the oxygen evolving system // FEBS Lett. 1984. V. 174. P. 157. https://doi.org/10.1016/0014-5793(84)81096-0
Vass I., Styring S. pH-dependent charge equilibria between tyrosine-D and the S states in photosystem II. Estimation of relative midpoint redox potentials // Biochemistry. 1991. V. 30. P. 830. https://doi.org/10.1021/bi00217a037
Haddy A., Hatchell J.A., Kimel R.A., Thomas R. Azide as a competitor of chloride in oxygen evolution by photosystem II // Biochemistry. 1999. V. 38. P. 6104. https://doi.org/10.1021/bi983075c
Schiller H., Dau H. Preparation protocols for high-activity photosystem II membrane particles of green algae and higher plants, pH dependence of oxygen evolution and comparison of the S2-state multiline signal by X-band EPR spectroscopy // J. Photochem. Photobiol. B. 2000. V. 55. P. 138. https://doi.org/10.1016/S1011-1344(00)00036-1
Terentyev V.V., Shukshina A.K., Shitov A.V. Carbonic anhydrase CAH3 supports the activity of photosystem II under increased pH // Biochim. Biophys. Acta Bioenerg. 2019. V. 1860. № 7. P. 582. https://doi.org/10.1016/j.bbabio.2019.06.003
Semin B.K., Davletschina L.N., Aleksandrov A.Yu., Lanchinskaya V.Yu., Novakova A.A., Ivanov I.I. pH dependence of iron binding to the donor side of photosystem II // Biochemistry (Mosc.). 2004. V. 69. P. 410. https://doi.org/10.1023/B:BIRY.0000022066.38297.8a
Semin B.K., Davletshina L.N., Rubin A.B. Correlation between pH dependence of O2 evolution and sensitivity of Mn cations in the oxygen-evolving complex to exogenous reductants // Photosynth. Res. 2015. V. 125. P. 95. https://doi.org/10.1007/s11120-015-0155-4
Shen J.-R., Inoue Y. Low pH-induced dissociation of three extrinsic proteins from O2-evolving photosystem II // Plant Cell Physiol. 1991. V. 32(3). P. 453. https://doi.org/10.1093/oxfordjournals.pcp.a078101
Ono T., Inoue Y. Discrete extraction of the Ca atom functional for O2 evolution in higher plant photosystem II by a simple low pH treatment // FEBS Lett. 1988. V. 227. P. 147. https://doi.org/10.1016/0014-5793(88)80886-X
Bernát G., Morvaridi F., Feyziyev Y., Styring S. pH dependence of the four individual transitions in the catalytic S-cycle during photosynthetic oxygen evolution // Biochemistry. 2002. V. 41. P. 5830. https://doi.org/10.1021/bi011691u
Suzuki H., Sugiura M., Noguchi T. pH dependence of the flash-Induced S-state transitions in the oxygen-evolving center of photosystem II from Thermosynechoccocus elongatus as revealed by Fourier transform infrared spectroscopy // Biochemistry. 2005. V. 44. P. 1708. https://doi.org/10.1021/bi0483312
Ghanotakis D.F., Topper J.N., Yocum C.F. Exogenous reductants reduce and destroy the Mn-complex in photosystem II membranes depleted of the 17 and 23 kDa polypeptides // Biochim. Biophys. Acta. 1984. V. 767. P. 524. https://doi.org/10.1016/0005-2728(84)90051-3
Ono T., Inoue Y. Abnormal redox reactions in photosynthetic O2-evolving centers in NaCl/EDTA-washed PS II. A dark-stable EPR multiline signal and an unknown positive charge accumulator // Biochim. Biophys. Acta. 1990. V. 1020. P. 269. https://doi.org/10.1016/0005-2728(90)90157-Y
Klimov V.V., Allakhverdiev S.I., Shuvalov V.A., Krasnovsky A.A. Effect of extraction and re-addition of manganese on light reactions of photosystem-II preparations // FEBS Lett. 1982. V. 148. P. 307. https://doi.org/10.1016/0014-5793(82)80830-2
Ghirardi M.L., Lutton T.W., Seibert M. Interactions between diphenylcarbazide, zinc, cobalt, and manganese on the oxidizing side of photosystem II // Biochemistry. 1996. V. 35. P. 1820. https://doi.org/10.1021/bi951657d
Allakhverdiev S.I., Yruela I., Picorel R., Klimov V.V. Bicarbonate is an essential constituent of the water-oxidizing complex of photosystem II // Proc. Natl. Acad. Sci. U. S. A. 1997. V. 94. P. 5050. https://doi.org/10.1073/pnas.94.10.5050
Nagata T., Zharmukhamedov S.K., Khorobrykh A.A., Klimov V.V., Allakhverdiev S.I. Reconstitution of the water-oxidizing complex in manganese-depleted photosystem II preparations using synthetic Mn-complexes: a fluorine-19 NMR study of the reconstitution process // Photosynth. Res. 2008. V. 98. P. 277. https://doi.org/10.1007/s11120-008-9319-9
Semin B.K., Seibert M. Substituting Fe for two of the four Mn ions in photosystem II – effects on water-oxidation // J. Bioenerg. Biomembr. 2016. V. 48. P. 227. https://doi.org/10.1007/s10863-016-9651-2
Semin B.K., Davletshina L.N., Goryachev S.N., Seibert M. Ca2+ effects on Fe(II) interactions with Mn-binding sites in Mn-depleted oxygen-evolving complexes of photosystem II and on Fe replacement of Mn in Mn-containing, Ca-depleted complexes // Photosynth. Res. 2021. V. 147(2). P. 229. https://doi.org/10.1007/s11120-020-00813-z
Ono T., Mino H. Unique binding site for Mn2+ ion responsible for reducing an oxidized YZ tyrosine in manganese-depleted photosystem II membranes // Biochemistry. 1999. V. 38. P. 8778. https://doi.org/10.1021/bi982949s
Kuntzleman T., McCarrick R., Penner-Hahn J., Yocum C. Probing reactive sites within the photosystem II manganese cluster: evidence for separate populations of manganese that differ in redox potential // Phys. Chem. Chem. Phys. 2004. V. 6. P. 4897. https://doi.org/10.1039/B406601D
Zabret J., Bohn S., Schuller S.K., Arnolds O., Möller M., Meier-Credo J., Liauw P., Chan A., Tajkhorshid E., Langer J.D., Stoll R., Krieger-Liszkay A., Engel B.D., Rudack T., Schuller J.M., Nowaczyk M.M. Structural insights into photosystem II assembly // Nat. Plants. 2021. V. 7. P. 524. https://doi.org/10.1038/s41477-021-00895-0
Kim C.J., Debus R.J. Evidence from FTIR difference spectroscopy that a substrate H2O molecule for O2 formation in photosystem II is provided by the Ca ion of the catalytic Mn4CaO5 cluster // Biochemistry. 2017. V. 56. P. 2558. https://doi.org/10.1021/acs.biochem.6b01278
Tsui E.Y., Agapie T. Reduction potentials of heterometallic manganese-oxido cubane complexes modulated by redox-inactive metals // Proc. Natl. Acad. Sci. U. S. A. 2013. V. 110. P. 10084. https://doi.org/10.1073/pnas.1302677110
Boussac A., Rappaport F., Carrier P., Verbavatz J.M., Gobin R., Kirilovsky D., Rutherford A., Sugiura M. Biosynthetic Ca2+/Sr2+ exchange in the photosystem II oxygen-evolving enzyme of Thermosynechococcus elongatus // J. Biol. Chem. 2004. V. 279. P. 22809. https://doi.org/10.1074/jbc.M401677200
Kargul J., Maghlaoui K., Murray J.W., Deak Z., Boussac A., Rutherford A.W., Vass I., Barber J. Purification, crystallization and X-ray diffraction analyses of the T. elongatus PSII core dimer with strontium replacing calcium in the oxygen-evolving complex // Biochim. Biophys. Acta Bioenerg. 2007. V. 1767. P. 404. https://doi.org/10.1016/j.bbabio.2007.01.007
Koua F.H.M. Structural changes in the acceptor site of photosystem II upon Ca2+/Sr2+ exchange in the Mn4CaO5 cluster site and the possible long-range interactions // Biomolecules. 2019. V. 9. P. 371. https://doi.org/10.3390/biom9080371
Ghanotakis D.F., Babcock G.T., Yocum C.F. Calcium reconstitutes high rates of oxygen evolution in polypeptide depleted photosystem II preparations // FEBS Lett. 1984. V. 167. P. 127. https://doi.org/10.1016/0014-5793(84)80846-7
Vrettos J.S., Limburg J., Brudvig G.W. Mechanism of photosynthetic water oxidation: combining biophysical studies of photosystem II with inorganic model chemistry // Biochim. Biophys. Acta. 2001. V. 1503. P. 229. https://doi.org/10.1016/S0005-2728(00)00214-0
Ghosh I., Khan S., Banerjee G., Dziarski A., David J. Vinyard D.J., Debus R.J., Brudvig G.W. Insights into proton-transfer pathways during water oxidation in photosystem II // J. Phys. Chem. B. 2019. V. 123. P. 8195. https://doi.org/10.1021/acs.jpcb.9b06244
Shutova T., Kenneweg H., Buchta J., Nikitina J., Terentyev V., Chernyshov S., Andersson B., Allakhverdiev S., Klimov V., Dau H., Junge W., Samuelsson G. The photosystem II-associated Cah3 in Chlamydomonas enhances the O2 evolution rate by proton removal // EMBO J. 2008. V. 27. P. 782. https://doi.org/10.1038/emboj.2008.12
Tokano T., Kato Y., Sugiyama S., Uchihashi T., Noguchi T. Structural dynamics of a protein domain relevant to the water-oxidizing complex in photosystem II as visualized by high-speed atomic force microscopy // J. Phys. Chem. B. 2020. V. 124. P. 5847. https://doi.org/10.1021/acs.jpcb.0c03892
Semin B.K., Ivanov I.I., Rubin A.B., Parak F. High-specific binding of Fe(II) at the Mn-binding site in Mn-depleted PSII membranes from spinach // FEBS Lett. 1995. V. 375. P. 223. https://doi.org/10.1016/0014-5793(95)01215-Z
Semin B.K., Ghirardi M.L., Seibert M. Blocking of electron donation by Mn(II) to YZ· following incubation of Mn-depleted photosystem II membranes with Fe(II) in the light // Biochemistry. 2002. V. 41. P. 5854. https://doi.org/10.1021/bi0200054
Semin B.K., Seibert M. A carboxylic residue at the high-affinity, Mn-binding site participates in the binding of iron cations that block the site // Biochim. Biophys. Acta. 2006. V. 1757(3). P. 189. https://doi.org/10.1016/j.bbabio.2006.02.001
Virgin I., Styring S., Andersson B. Photosystem II disorganization and manganese release after photoinhibition of isolated spinach thylakoid membranes // FEBS Lett. 1998. V. 233. P. 408. https://doi.org/10.1016/0014-5793(88)80472-1
Hakala M., Tuominen I., Keränen M., Tyystjärvi T., Tyystjärvi E. Evidence for the role of the oxygen-evolving manganese complex in photoinhibition of photosystem II // Biochim. Biophys. Acta. 2005. V. 1706. P. 68. https://doi.org/ o.2004.09.001https://doi.org/10.1016/j.bbabi
Tyystjärvi E. Photoinhibition of photosystem II and photodamage of the oxygen evolving manganese cluster // Coord. Chem. Rev. 2008. V. 252. P. 361. https://doi.org/10.1016/j.ccr.2007.08.021
Pospišil P. Molecular mechanisms of production and scavenging of reactive oxygen species by photosystem II // Biochim. Biophys. Acta. 2012. V. 1817. P. 218. https://doi.org/10.1016/j.bbabio.2011.05.017
Davletshina L.N., Semin B.K. pH dependence of photosystem II photoinhibition: relationship with structural transition of oxygen-evolving complex at the pH of thylakoid lumen // Photosynth. Res. 2020. V. 145. P. 135. https://doi.org/10.1007/s11120-020-00769-0
Klimov V.V., Shafiev M.A., Allakhverdiev S.I. Photoinactivation of the reactivatipon capacity of photosystem II in pea subchloroplast particles after a complete removal of manganese // Photosynth. Res. 1990. V. 23. P. 59. https://doi.org/10.1007/BF00030063
Kramer D.M., Sacksteder C.A., Cruz J.A. How acidic is the lumen? // Photosynth. Res. 1999. V. 60. P. 151. https://doi.org/10.1023/A:1006212014
Cruz J.A., Sacksteder C.A., Kanazawa A., Kramer D.M. Contribution of electric field (Δψ) to steady-state transthylakoid proton motive force (pmf) in vitro and in vivo. Control of PMF parsing into Δψ and ΔpH by ionic strength // Biochemistry. 2001. V. 40. P. 1226. https://doi.org/10.1021/bi0018741
Takizawa K., Cruz J.A., Kanazawa A., Kramer D.M. The thylakoid proton motive force in vivo. Quantitative, non-invasive probes, energetics, and regulatory consequences of light-induced PMF // Biochim. Biophys. Acta. 2007. V. 1767. P. 1233. https://doi.org/ o.2007.07.006https://doi.org/10.1016/j.bbabi
Cruz J.A., Kanazawa A., Treff N., Kramer D.M. Storage of light-driven transthylakoid proton motive force as an electric field (Δψ) under steady-state conditions in intact cells of Chlamydomonas reinhardtii // Photosynth. Res. 2005. V. 85. P. 221. https://doi.org/10.1007/s11120-005-4731-x
Kramer D.M., Cruz J.A., Kanazawa A. Balancing the central roles of the thylakoid proton gradient // Trends Plant Sci. 2003. V. 8. P. 27. https://doi.org/10.1016/S1360-1385(02)00010-9
Vershubskii A.V., Trubitsin B.V., Priklonskii V.I., Tikhonov A.N. Lateral heterogeneity of the proton potential along the thylakoid membranes of chloroplasts // Biochim. Biophys. Acta Biomembr. 2017. V. 1859. P. 388. https://doi.org/10.1016/j.bbamem.2016.11.016
Tikhonov A.N. Photosynthetic electron and proton transport in chloroplasts: EPR Study of ΔpH generation, an overview // Cell Biochem. Biophys. 2017. V. 75. P. 421. https://doi.org/10.1007/s12013-017-0797-2
Sen K., Ghosh A., Chakraborty M., Maity S., Ghosh S., DasGupta M. Trans-thylakoid ΔpH dependent oscillation of FPSI/FPSII under continuous irradiance in isolated thylakoids // J. Bioenerg. Biomembr. 2014. V. 46. P. 71. https://doi.org/ 3-013-9533-9https://doi.org/10.1007/s1086
Yamashita A., Nijo M., Pospišil P., Morita N., Takenaka D., Aminaka R., Yamamoto Yo., Yamamoto Ya. Quality control of photosystem II. Reactive oxygen species are responsible for the damage to photosystem II under moderate heat stress // J. Biol. Chem. 2008. V. 283. P. 28380. https://doi.org/10.1074/jbc.M710465200
Lovyagina E., Semin B. Elevation of photosystem II thermal stability at pH 5.7 due to the structural transition in the oxygen-evolving complex // J. Plant Biochem. Biotechnol. 2021. https://doi.org/10.1007/s13562-021-00693-x
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений