Физиология растений, 2023, T. 70, № 2, стр. 214-224
Биохимический состав клеток Euglena gracilis при миксотрофном росте в присутствии различных органических субстратов
Е. И. Гулк a, Е. Б. Замяткина a, К. Биркемайер b, Е. Р. Тараховская a, c, *
a Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
b Университет Лейпцига
Лейпциг, Германия
c Санкт-Петербургский филиал Института общей генетики им. Н.И. Вавилова
Российской академии наук
Санкт-Петербург, Россия
* E-mail: elena.tarakhovskaya@gmail.com
Поступила в редакцию 22.07.2022
После доработки 27.09.2022
Принята к публикации 28.09.2022
- EDN: GKPQWG
- DOI: 10.31857/S0015330322600462
Аннотация
Проведено исследование общего биохимического состава и профиля низкомолекулярных метаболитов клеток эвглены (Euglena gracilis Klebs.), растущих в миксотрофной культуре с добавлением 0.5% этанола, глюкозы, бутанола, глицина или глицерина. Этанол и глюкоза существенно стимулировали рост культуры эвглены и накопление в клетках запасных соединений (парамилона и восковых эфиров). Бутанол также способствовал делению клеток эвглены и усилению биосинтеза белка, моно- и дисахаридов, каротиноидов и токоферолов. Глицин и глицерин усваивались медленнее, чем другие субстраты, и накапливались в клетках E. gracilis вместе со своими непосредственными производными. Глицин не стимулировал рост культуры, но вызывал накопление в клетках парамилона, органических кислот цикла Кребса и азотсодержащих метаболитов (хлорофилла, свободных аминокислот и азотистых оснований). По-видимому, в условиях миксотрофии глицин одинаково эффективно используется эвгленой как дополнительный источник и углерода, и азота. Усвоение глицерина сопровождалось накоплением в клетках эвглены восковых эфиров, а также аминокислот пролина и орнитина. В целом, полученные результаты демонстрируют способность эвглены существенно перестраивать свой метаболизм при усвоении органических субстратов различной химической природы. Данные могут быть использованы в контексте прикладного применения E. gracilis.
ВВЕДЕНИЕ
Euglena gracilis Klebs. – пресноводная одноклеточная водоросль, которая легко культивируется в лабораторных условиях и используется как модельный объект для цитологических, биохимических и экологических исследований [1]. Для эвглены характерен миксотрофный тип питания: в дополнение к фотосинтетической ассимиляции углерода, она способна эффективно усваивать экзогенные органические субстраты различной химической природы – спирты, сахара, аминокислоты, жирные кислоты и др. [2, 3]. Спектр метаболизируемых эвгленой органических соединений чрезвычайно широк, что свидетельствует о высокой метаболической пластичности данного организма. Наличие в окружающей среде доступных источников органического углерода вызывает существенные изменения в клетках эвглены, затрагивающие такие параметры, как форма и размер клеток, частота делений (и соответственно, скорость роста культуры), интенсивность фотосинтеза и дыхания, а также химический состав клеток [3–5].
Клетки автотрофной культуры E. gracilis имеют веретенообразную форму (~50 мкм в длину и 10 мкм в ширину), однако они способны изменять ее в широком диапазоне, вплоть до шарообразной, что используется эвгленами при так называемом метаболирующем движении. Возможность такого типа движения обеспечивается отсутствием клеточной стенки и поверхностным аппаратом в виде белковой пелликулы эвгленоидного типа. Основным локомоторным органоидом эвглены является длинный передний жгутик. Клетка E. gracilis, как правило, содержит одну крупную митохондрию, образующую обширную разветвленную сеть (митохондриальный ретикулум) [6]. Такая структура обеспечивает эффективное клеточное дыхание, в том числе при усвоении экзогенных органических субстратов. На свету в клетках формируется 10–12 относительно крупных дисковидных хлоропластов, содержащих пиреноиды [7]. Основными фотосинтетическими пигментами E. gracilis являются хлорофиллы a и b, β-каротин, диадиноксантин и неоксантин [8]. В качестве запасных соединений в клетках могут накапливаться парамилон (β-D-(1→3)-глюкан) и восковые эфиры [9, 10]. Характерными особенностями метаболизма эвглены является зависимость от витаминов B1 и B12, а также неспособность усваивать азот в форме нитрата и мочевины [11, 12].
В последние годы наблюдается повышение интереса к изучению метаболизма и биохимического состава E. gracilis. При этом подавляющее большинство работ имеет прикладной характер и очень узкую направленность. В центре внимания находятся два компонента клеток E. gracilis: парамилон и восковые эфиры. Эти соединения при определенных условиях накапливаются в клетках эвглены в значительных количествах (до 70–80% сухой массы) и имеют практическую ценность. Парамилон в настоящее время используется как биологически активная добавка к пище в Японии и США, а восковые эфиры рассматриваются как перспективное сырье для производства биодизельного топлива [9, 10]. В то время как накопление этих соединений клетками эвглены в условиях миксотрофии и гетеротрофии к настоящему моменту изучено достаточно подробно [13, 14], детальные исследования изменений общего биохимического состава E. gracilis при смене источников питания все еще очень немногочисленны. Наиболее хорошо изучено влияние на эвглену экзогенных этанола и глюкозы: эти субстраты стимулируют деление клеток, сопровождающееся накоплением запасных углеводов и снижением содержания фотосинтетических пигментов [4, 9, 15]. Однако процессы усвоения эвгленой субстратов, не вызывающих резкого ускорения роста культуры, исследованы значительно хуже. К таким соединениям относятся бутанол, глицерин, глицин, глутаминовая кислота и другие. Подобные субстраты упоминаются, в основном, лишь в качестве дополнительных компонентов питательных сред в сравнительных исследованиях роста культур эвглены при различных условиях [2, 3, 16]. Между тем, переход к миксотрофному питанию сопряжен не только с изменением скорости роста культуры микроводоросли, но, в первую очередь, с изменением биохимического состава клеток, их метаболома и протеома. В настоящее время метаболомные исследования, как правило, проводятся методом газовой хроматографии – масс-спектрометрии (ГХ-МС), поскольку этот подход позволяет одновременно анализировать сотни соединений, задействованных в первичном и вторичном метаболизме клеток. За последние 20 лет этот метод хорошо зарекомендовал себя в исследованиях метаболитных профилей различных макро- и микроводорослей, как живущих в естественных условиях, так и культивируемых [17, 18]. Нам удалось найти лишь несколько работ по метаболомике эвглены, и все они ориентированы на поиск оптимальных условий культивирования клеток для интенсификации накопления жирных кислот и восковых эфиров [19–21]. Прикладных работ более широкого профиля или фундаментальных исследований, которые бы анализировали особенности метаболома клеток E. gracilis, выращенных на разных органических субстратах в миксотрофных условиях, нами найдено не было.
Целью нашей работы является сравнение биохимического состава (в том числе метаболитного профиля) клеток E. gracilis, растущих миксотрофно в присутствии органических субстратов разной химической природы. Мы полагаем, что детальное изучение биохимических адаптаций эвглены к условиям углеродного питания позволит лучше понять механизмы метаболической пластичности этого организма и существенно дополнит фундаментальную научную базу, необходимую для эффективного прикладного использования микроводорослей.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом данного исследования является микроводоросль Euglena gracilis Klebs. штамм Z. Культура E. gracilis была получена из коллекции Ресурсного центра СПбГУ “Культивирование микроорганизмов” (клон CALU 520).
Водоросли выращивали на среде Cramer-Myers [22] при температуре 25°С, постоянном освещении (50 мкмоль фотонов/ (м2 с)) и перемешивании. Культуры эвглены росли в условиях автотрофии (минеральная среда) и миксотрофии (среда с добавлением органических субстратов, 0.5%, w/v). В качестве субстратов использовали этанол, бутанол, глюкозу, глицин и глицерин.
Постановку экспериментов проводили следующим образом. Автотрофную культуру, находящуюся в фазе экспоненциального роста, разводили минеральной средой до концентрации примерно 100 тыс. клеток на мл. Аликвоты суспензии (25 мл) помещали в конические колбы объемом 100 мл, после чего вносили соответствующие органические субстраты. Для изучения динамики роста культур ежедневно в течение 14 дней осуществляли подсчет клеток в суспензиях с помощью камеры Горяева (клетки предварительно фиксировали раствором Люголя). У культур, находящихся в начале фазы экспоненциального роста, оценивали следующие параметры: общее содержание углеводов, общее содержание белка, содержание хлорофиллов a и b, общее содержание каротиноидов, а также профиль низкомолекулярных метаболитов.
Общее содержание углеводов в клетках E. gracilis определяли спектрофотометрически с помощью антронового метода [23]. Предварительно клетки отмывали от культуральной жидкости, четыре раза промывая их минеральной средой. К 0.3 мл суспензии клеток приливали 3 мл антронового реактива, полученную смесь 7 мин кипятили на водяной бане, после чего остужали на льду. Измерение оптической плотности растворов проводили на длине волны 620 нм с помощью спектрофотометра СФ-46 (ЛОМО, Россия). Общее содержание углеводов рассчитывали на основе калибровочного графика с глюкозой в качестве стандарта.
Общее содержание белка определяли по методу Лоури. Для полной экстракции белка, клетки (предварительно отмытые от культуральной жидкости) осаждали центрифугированием (5000 g, 5 мин), заливали осадок 3 мл смеси додецилсульфата натрия (0.5%) и NaOH (0.5 М) и кипятили на водяной бане в течение 20 мин. Далее содержание белка в экстрактах определяли спектрофотометрически (СФ-46, λ = 750 нм) по стандартному протоколу с реактивом Фолина-Чокальтеу. В качестве белкового стандарта использовали бычий сывороточный альбумин (Sigma-Aldrich, США) (калибровочные растворы были приготовлены на смеси додецилсульфата натрия и NaOH).
Для экстракции пигментов клетки E. gracilis (500–800 тыс. клеток) осаждали центрифугированием (5000 g, 5 мин) и добавляли к осадку 3 мл ацетона с небольшим количеством MgCO3. Пробы выдерживали в темноте при комнатной температуре в течение 1 ч, после чего экстракты центрифугировали (5000 g, 10 мин). Содержание хлорофиллов a и b и общее содержание каротиноидов определяли спектрофотометрически (СФ-46), производя расчеты по опубликованным формулам [24, 25].
При проведении метаболомного анализа пробы по 4 млн. клеток E. gracilis фиксировали, смешивая с охлажденным (−25°C) 32.5% метанолом (Sigma-Aldrich, США) в соотношении 1 : 4 [26], осаждали центрифугированием (5000 g, 3 мин), отмывали от культуральной жидкости и заливали 1 мл 100% метанола для экстракции низкомолекулярных метаболитов. Далее метанольные экстракты переносили в полипропиленовые пробирки объемом 1.5 мл (VWR, Германия), высушивали при помощи вакуум-концентратора (CentriVap, Labconco, США) и хранили затем при −80°C для последующего анализа. Метаболомный анализ проводили методом газовой хроматографии – масс-спектрометрии (ГХ-МС) по протоколу Hutschenreuther с соавт. [27]. Высушенные экстракты подвергались двухэтапной дериватизации: в пиридиновом растворе метоксиамин-гидрохлорида (Sigma-Aldrich, США) и N, O-бис(триметилсилил)-трифторацетамиде (Macherey-Nagel, Германия). После дериватизации пробы анализировали с помощью газового хроматографа Agilent 6890 (хроматографическая колонка DB-5 MS, газ-носитель – гелий, скорость протока – 0.9 мл/мин, режим без деления потока, температура инжектора 250°С, температурный режим – начальная температура 40°C удерживалась 1 мин, затем повышение со скоростью 15°C/мин до 70°C, одна минута при 70°C, далее повышение со скоростью 6°C/мин до 350°C), соединенного с квадрупольным масс-спектрометром Agilent 5971N (Agilent Technologies, Германия) со стандартной электронной ионизацией 70 эВ.
Для расчета индексов удерживания Ковача (RI) к каждой анализируемой последовательности проб добавляли пробу, содержащую смесь алканов (C10–C32) в гексане [28]. Для идентификации ожидаемых соединений использовали смесь стандартов, содержащую 21 аминокислоту, 20 сахаров и сахароспиртов и 19 органических кислот. Деконволюцию хроматографических пиков проводили с использованием программы AMDIS 2.65. Индексы удерживания рассчитывались автоматически с помощью файла калибровки AMDIS, содержащего время удерживания каждого алкана. Для идентификации метаболитов, помимо стандартов, использовали библиотеки масс-спектров Golm metabolome database [29] и NIST (США). Интегрирование пиков экстрагированных ионов (m/z ± 0.5) при определенных временах удерживания проводили с помощью программы Xcalibur 3.0.
Количество биологических повторностей при проведении экспериментов составило 3–4 для метаболомных исследований и 8–12 для остальных анализов. Для статистической обработки и нормализации данных, а также для создания рисунков использовали программное обеспечение Excel 2016 и MetaboAnalyst 5.0 (http://www.metaboanalyst.ca). На рисунках представлены средние арифметические значения величин и стандартные отклонения. Достоверность различий определяли с помощью t-критерия Стьюдента при P < 0.05. На рисунках значения, между которыми наблюдались достоверные различия, отмечены разными буквами.
РЕЗУЛЬТАТЫ
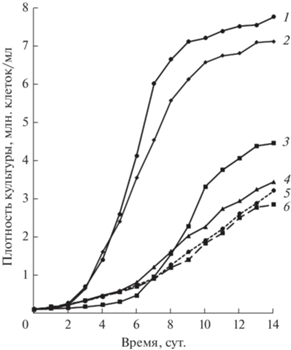
Динамика роста культур E. gracilis. Все использованные в данной работе органические субстраты, за исключением глицина, стимулировали рост культуры E. gracilis. Типичные ростовые кривые культур эвглены, полученные в автотрофных и миксотрофных условиях представлены на рис. 1. Наиболее интенсивный рост наблюдался в средах с добавлением этанола и глюкозы (рис. 1, кривые 1–2) – в таких условиях плотность культур через 14 сут после начала эксперимента в 2.5–3 раза превышала контроль (рис. 1, кривая 6). Бутанол также существенно стимулировал деления клеток E. gracilis: после 14 сут роста в присутствии этого субстрата плотность культуры была примерно в полтора раза выше, чем в контроле (рис. 1, кривые 3 и 6). Плотность культуры, растущей на среде с добавлением глицерина, начиная с 7-х сут эксперимента, также достоверно (P < 0.05) превышала плотность автотрофной культуры (в среднем, на 30%) (рис. 1, кривые 4 и 6). По сравнению с культурами, растущими в средах с добавлением этанола и глюкозы, культуры, растущие на бутаноле и глицерине, характеризовались увеличенной продолжительностью лаг-фазы и переходили к интенсивному росту лишь через 6–7 сут после начала эксперимента. Глицин в нашем исследовании не оказал влияния на скорость роста культуры эвглены (рис. 1, кривая 5).
Рис. 1.
Типичные ростовые кривые культур Euglena gracilis, выращенных миксотрофно в присутствии 0.5% этанола (1), глюкозы (2), бутанола (3), глицерина (4), глицина (5) или автотрофно (6).
Общий биохимический состав клеток E. gracilis. Данные по содержанию углеводов, белка и пигментов в клетках эвглены представлены на рис. 2–5. В присутствии всех исследованных субстратов клетки эвглены в начале фазы интенсивного роста культуры содержали значительно больше углеводов, чем в контроле (рис. 2). В присутствии бутанола, глицина и, в меньшей степени, этанола также наблюдалось увеличение общего содержания белка в клетках (рис. 3). Наибольшее содержание углеводов (705 пг на клетку) при миксотрофном росте достигалось в присутствии этанола, наименьшее (149 пг на клетку) – в присутствии глицерина (рис. 2). Наиболее значительное накопление белка (на 73% выше, чем в контроле) было отмечено в клетках, метаболизирующих бутанол. Содержание фотосинтетических пигментов в клетках эвглены (рис. 4), в целом, обратно пропорционально скорости роста культуры и накоплению углеводов. В присутствии наиболее эффективно усваиваемых субстратов (этанол, глюкоза, бутанол) содержание хлорофилла а составило, соответственно, от 21 до 76% от автотрофного контроля. Наиболее значимым исключением в данном случае является глицин – усвоение этого субстрата сопровождалось увеличением содержания фотосинтетических пигментов в клетках (рис. 4). В присутствии бутанола наблюдалось снижение количества хлорофилла в клетках, но рост общего количества каротиноидов. Содержание хлорофилла b в клетках эвглены составило примерно от 4 до 7% от суммы хлорофиллов (рис. 5). Максимальные значения этого параметра были получены для культур, растущих в средах с добавлением этанола, глюкозы и бутанола.
Рис. 2.
Общее содержание углеводов в клетках Euglena gracilis в начале экспоненциальной фазы роста при выращивании в автотрофных (контроль) и миксотрофных условиях. Значения, отмеченные разными буквами, различаются достоверно (t-тест, P < 0.05).
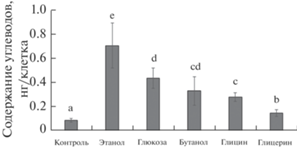
Рис. 3.
Общее содержание белка в клетках Euglena gracilis в начале экспоненциальной фазы роста при выращивании в автотрофных (контроль) и миксотрофных условиях. Значения, отмеченные разными буквами, различаются достоверно (t-тест, P < 0.05).

Рис. 4.
Содержание хлорофилла а (1) и каротиноидов (2) в клетках Euglena gracilis в начале экспоненциальной фазы роста при выращивании в автотрофных (контроль) и миксотрофных условиях. В каждом ряду значения, отмеченные разными буквами, различаются достоверно (t-тест, P < 0.05).
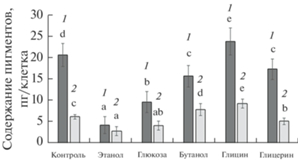
Рис. 5.
Доля хлорофилла b в сумме хлорофиллов клеток Euglena gracilis в начале экспоненциальной фазы роста при выращивании в автотрофных (контроль) и миксотрофных условиях. Значения, отмеченные разными буквами, различаются достоверно (t-тест, P < 0.05).

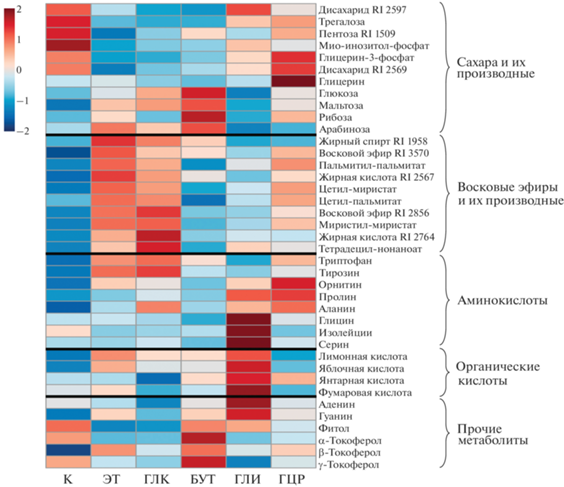
Данные метаболитного профайлинга. ГХ-МС-анализ позволил выявить в клетках E. gracilis 324 метаболита. Из них более половины было идентифицировано на основании показателей RI и сходства спектров, а также с использованием стандартов. В пробах обнаружено 40 различных углеводов, 28 метаболитов липидного обмена (жирные кислоты, жирные спирты и их эфиры) и 19 аминокислот, в том числе 3 непротеиногенные аминокислоты (β‑аланин, гомосерин и орнитин). Кроме того, были найдены азотистые основания (аденин, гуанин и урацил), витамины (биотин, никотинамид, α-, β- и γ-токоферолы), мочевина, АМФ, терпеноды (фитол, сквален) и другие соединения. Доминирующими соединениями являются маннит, трегалоза, производные глюкозы, яблочная кислота, аланин, глутаминовая кислота, а также восковые эфиры – специфические метаболиты E. gracilis.
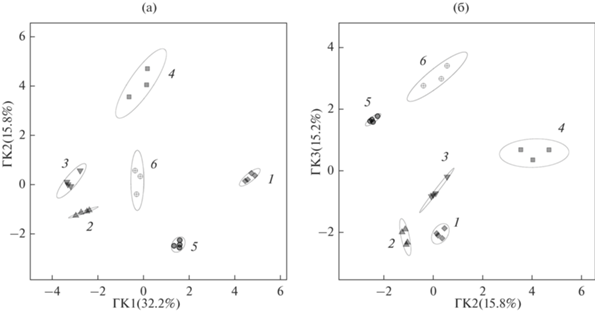
Анализ полученных данных методом главных компонент (МГК) позволил выявить основные тенденции изменения метаболитного профиля клеток эвглены при разных вариантах миксотрофии (рис. 6). Относительное содержание идентифицированных метаболитов, имеющих максимальные по модулю значения нагрузок в МГК-анализе, представлено в виде теплокарты на рис. 7. Первые три главные компоненты (ГК) объясняют 63% дисперсии. По ГК 1 все образцы разделяются на 3 кластера: первый кластер включает пробы автотрофных культур, во второй попадают культуры, растущие на трудноусваиваемых субстратах (бутанол, глицерин, глицин), и наконец, третий кластер объединяет культуры, усваивающие этанол и глюкозу и характеризующиеся наиболее интенсивным ростом (рис. 6). Наибольший вклад в эту компоненту вносят сахара и их производные, метаболиты липидного обмена (жирные кислоты, восковые эфиры), фитол и некоторые аминокислоты. Для клеток автотрофных культур характерно относительно высокое содержание мио-инозитол-фосфата, трегалозы, а также ряда других дисахаридов и их производных. Усвоение этанола и глюкозы приводит к накоплению в клетках эвглены большого количества разнообразных восковых эфиров (пальмитил-пальмитат, цетил-миристат и др.) (рис. 7). ГК 2 выделяет в отдельные кластеры метаболомы клеток E. gracilis, выращенных в присутствии бутанола и глицина. Анализ нагрузок этой компоненты показывает, что для клеток, метаболизирующих бутанол, характерно накопление ряда моно- и дисахаридов (глюкоза, мальтоза, рибоза), а также токоферолов. Усвоение глицина сопровождается повышением содержания в клетках эвглены ряда аминокислот (глицин, изолейцин, серин), органических кислот цикла Кребса (лимонная, яблочная и др.) и азотистых оснований (аденин, гуанин) (рис. 7). Анализ нагрузок ГК 3 позволяет выявить особенности метаболитного профиля клеток E. gracilis, выращенных в присутствии глицерина. Усвоение этого субстрата сопровождается накоплением ряда сахаров, аминокислот (включая непротеиногенную аминокислоту орнитин) и восковых эфиров (цетил-миристат, цетил-пальмитат и др.).
ОБСУЖДЕНИЕ
При переходе от фотоавтотрофии к миксотрофному питанию клетки E. gracilis получают дополнительный органический материал и энергию, включая в метаболизм экзогенные субстраты. Анализ полученных нами данных показывает, что эвглена реализует принципиально разные пути использования этого дополнительного ресурса в зависимости от химической структуры метаболизируемого соединения.
Известно, что растущие культуры микроорганизмов проходят несколько стадий, характеризующихся разной частотой деления клеток. На протяжении первой стадии (лаг-фазы) рост культуры замедлен – в этот период клетки адаптируются к изменению условий среды и накапливают ресурсы для последующей интенсификации делений [30]. Естественно, продолжительность лаг-фазы при переходе культуры к миксотрофному питанию напрямую зависит от того, насколько обширные и сложные метаболические перестройки требуются клеткам для усвоения конкретного органического субстрата. Относительно малая продолжительность (2 сут) лаг-фазы у культур E. gracilis, растущих в среде с добавлением этанола и глюкозы (рис. 1, кривые 1–2), свидетельствует о том, что эти субстраты легко метаболизируются данным организмом, что соответствует литературным данным [4, 9, 15]. В присутствии других органических соединений продолжительность лаг-фазы была существенно увеличена (до 5–6 сут) (рис. 1, кривые 3–5), что характеризует эти субстраты как относительно трудноусваиваемые.
Следующей стадией развития культуры является фаза экспоненциального роста, во время которой происходит быстрое увеличение биомассы микроорганизмов за счет активации клеточных делений. В этот период в клетках активно идут биосинтетические процессы, повышается интенсивность энергетического обмена и усвоения минеральных соединений [31]. Очевидно, именно на этой стадии в миксотрофных культурах устанавливается баланс между потреблением неорганического и органического углерода, и биохимический состав клеток в наибольшей степени адаптирован к текущим условиям питания. По этой причине все биохимические характеристики E. gracilis, исследованные в данной работе, были проанализированы в клетках культур, находящихся в начале фазы экспоненциального роста. Наиболее интенсивный рост культуры эвглены на этой стадии наблюдался в присутствии этанола и глюкозы (рис. 1, кривые 1–2). Относительно невысокая скорость роста культуры в присутствии бутанола и глицерина, по-видимому, связана с более низкой эффективностью усвоения данных субстратов. Увеличенная продолжительность лаг-фазы и менее интенсивный рост культур эвглены на бутаноле, по сравнению с этанолом, были показаны ранее [3].
Помимо ускорения роста культуры, органические субстраты также используются эвгленой и для стимулирования роста индивидуальных клеток: биосинтеза структурных компонентов и запасных соединений. Результаты определения общего содержания углеводов, по-видимому, главным образом характеризуют количество парамилона в клетках, поскольку этот запасной полисахарид является доминирующим углеводным метаболитом E. gracilis [14]. Основным низкомолекулярным углеводом, который мог бы вносить вклад в реакцию с антроном, является трегалоза, однако по нашим данным изменение ее содержания в клетках не коррелирует с изменением общего содержания углеводов (рис. 2, 7). Таким образом, мы интерпретируем увеличение содержания углеводов, наблюдаемое в миксотрофных условиях, как накопление парамилона в клетках эвглены. Увеличение количества запасного полисахарида, по сравнению с автотрофным контролем, подтверждает способность E. gracilis к усвоению всех рассмотренных субстратов, в том числе глицина, не стимулирующего рост культуры (рис. 1). Это подтверждается и данными МГК-анализа метаболитных профилей клеток эвглены: ГК 1, объясняющая наибольшую долю общей дисперсии, четко отделяет пробы контроля от всех проб миксотрофных культур (рис. 6). Такая кластеризация проб указывает на то, что наиболее значимым фактором, повлиявшим на биохимический состав эвглены, является сам переход к миксотрофии, который был обеспечен всеми использованными субстратами. Согласно литературным данным, накопление парамилона (рис. 2) и восковых эфиров (рис. 7), сопровождающееся снижением содержания хлорофилла (рис. 4), типично для клеток E. gracilis, растущих на средах с этанолом и глюкозой [4, 9]. Однако, данные по влиянию этих субстратов на содержание белка в клетках микроводорослей не столь однозначны. Так, в работе Garlaschi с соавт. [4] было показано, что при выращивании культур эвглены в присутствии этанола содержание белка в клетках снижалось, что не подтверждается нашими результатами (рис. 3). Относительно низкое содержание хлорофилла b в клетках эвглены по сравнению с зелеными микроводорослями (рис. 5) соответствует литературным данным [8]. Увеличение содержания дополнительного хлорофилла в клетках наиболее интенсивно растущих культур может быть связано со снижением общего уровня освещенности клеток в более плотных суспензиях.
Поскольку результаты, полученные с использованием глюкозы и этанола, во многом совпадают с литературными данными, дополняя их в части влияния этих субстратов на содержание в клетках E. gracilis белка и ряда низкомолекулярных метаболитов, мы в данной работе сосредоточимся на обсуждении усвоения эвгленой других, значительно менее исследованных, экзогенных источников органического углерода.
Биохимические процессы, происходящие в клетках E. gracilis при усвоении бутанола, глицина и глицерина детально исследуются впервые. Интересно, что изменения метаболизма эвглены при росте на этих относительно трудноусваиваемых субстратах, наряду со специфическими особенностями, имеют и ряд общих черт. На это указывают результаты МГК-анализа метаболомных данных: пробы культур, выращенных на этих трех субстратах, фактически формируют один крупный кластер на уровне ГК 1, отделяясь и от проб контроля, и от проб культур, выращенных на легкоусваиваемых этаноле и глюкозе (рис. 6). Общими характеристиками клеток, метаболизирующих бутанол, глицерин и глицин являются умеренное содержание парамилона и восковых эфиров, а также большее разнообразие накапливающихся сахаров и аминокислот, по сравнению как с автотрофным контролем, так и с культурами, интенсивно растущими на этаноле и глюкозе (рис. 7). Очевидно, что из этих трех субстратов, бутанол усваивается данным штаммом эвглены наиболее эффективно. При этом возникающий в клетках избыток органического вещества инвестируется как в рост культуры (рис. 1), так и в разнообразные биосинтетические процессы, о чем свидетельствует увеличение содержания парамилона, ряда низкомолекулярных углеводов, белка и каротиноидов (рис. 2–4, 7). Снижение содержания хлорофилла a в клетках эвглены, хоть и не столь значительное, как на этанол-содержащей среде (рис. 4), позволяет предположить, что усвоение бутанола сопровождается снижением интенсивности фотосинтетических процессов. Метаболические пути усвоения бутанола в клетках E. gracilis не исследованы, однако было показано, что этот спирт может окисляться митохондриальной алкогольдегидрогеназой наряду с этанолом [32]. У бактерий, способных к метаболизации бутанола (например, Pseudomonas putida), он окисляется алкоголь- и альдегид-дегидрогеназами до бутирата, который затем подвергается β-окислению и включается в глиоксилатный цикл [33]. Можно предположить, что включение бутанола в метаболизм E. gracilis происходит по сходной схеме. Метаболомные данные показывают повышение содержания ряда метаболитов цикла Кребса и глиоксилатного цикла (лимонная, яблочная, и янтарная кислоты) в клетках, растущих в присутствии бутанола, по сравнению с контролем (рис. 7). Накопление в этих клетках сахаров (глюкоза, мальтоза) может свидетельствовать об активном сопряжении глиоксилатного цикла с процессом глюконеогенеза. Интересная особенность метаболитного профиля эвглены, ассимилирующей бутанол, – это повышенное содержание токоферолов (рис. 7). Этот результат может иметь практическую ценность, поскольку эвглена известна как хороший продуцент альфа- и гамма-токоферолов [14]. Исходя из полученных нами данных, имеет смысл рассмотреть бутанол в качестве субстрата при культивировании E. gracilis для промышленного получения витамина Е.
Общей чертой культур эвглены, выращенных на средах с глицерином и глицином, является повышенное содержание в клетках самих этих соединений и их непосредственных производных (например, глицерин и глицерин-3-фосфат) (рис. 7). Это свидетельствует об относительно низкой скорости метаболизации данных субстратов по сравнению, например, с глюкозой, которая даже в клетках, имеющих экзогенный источник этого соединения, не является преобладающим метаболитом (рис. 7). Несмотря на то, что эти субстраты не относятся к одному классу химических соединений, данные МГК-анализа показывают, что их усвоение приводит к сходным биохимическим перестройкам. Так же, как и для пары этанол-глюкоза, на уровне первых трех ГК пробы культур, выращенных на глицерине и глицине располагаются относительно близко друг к другу (рис. 6). Анализ нагрузок ГК показывает, что все эти пробы характеризуются относительно высоким содержанием трегалозы, по сравнению с пробами других миксотрофных культур, накоплением некоторых аминокислот и ряда неидентифицированных метаболитов, которые еще предстоит исследовать (рис. 7). Из всех использованных в данной работе органических субстратов E. gracilis наименее эффективно усваивала глицерин. В присутствии этого субстрата клетки эвглены содержали наименьшее (хотя и вдвое превышающее контроль) количество парамилона и не накапливали белок (рис. 2–3). Относительно большая продолжительность лаг-фазы при росте культуры указывает на значительные перестройки метаболизма клеток эвглены, что подтверждается детальным анализом профиля низкомолекулярных метаболитов (рис. 6–7). Известно, что глицерин способен проникать в клетки микроорганизмов путем простой диффузии [34]. Особенности метаболизации глицерина у эвглены в настоящее время не изучены, однако у других микроводорослей этот процесс включает в себя образование глицерин-3-фосфата и его последующее окисление до глицеральдегид-3-фосфата – соединения, которое стоит на пересечении ключевых метаболических путей [35, 36]. Дальнейшая ассимиляция, по-видимому, осуществляется через реакции цикла Кребса. Полученные нами результаты, в целом, не противоречат этой схеме, поскольку одновременно с накоплением глицерина в клетках отмечается и накопление глицерин-3-фосфата. Можно предположить, что часть глицерин-3-фосфата расходуется на синтез липидов, поскольку мы видим увеличение относительного содержания метаболитов липидного обмена в присутствии глицерина (рис. 7). Стимулирование биосинтеза липидов при усвоении глицерина клетками E. gracilis было показано в недавних исследованиях возможного биотехнологического применения эвглены [36]. Относительно высокое содержание ряда моно- и дисахаридов указывает также на возможную активацию процессов глюконеогенеза (рис. 7). Еще одна характерная черта метаболитного профиля эвглены, растущей в присутствии глицерина, это накопление ряда свободных аминокислот, особенно пролина и орнитина (рис. 7). Эти две аминокислоты метаболически связаны: орнитин является одним из предшественников в биосинтезе пролина [37]. Таким образом, можно интерпретировать эти данные как усиление биосинтеза пролина в клетках E. gracilis. Поскольку пролин является одним из низкомолекулярных осмолитов, накапливающихся в клетках растений при гипертоническом стрессе, повышение его содержания может быть связано со снижением водного потенциала среды в присутствии глицерина в связи с относительно низкой скоростью поглощения и усвоения этого субстрата.
Хотя аминокислоты часто включаются в питательные среды на основе глюкозы как дополнительные азотсодержащие компоненты [16, 38, 39], использование микроводорослями этих субстратов в качестве единственных источников органического углерода очень мало исследовано. Единичные работы, в которых рассматривалось усвоение эвгленой нескольких аминокислот [2, 40] свидетельствуют о том, что они используются в метаболизме этой водоросли не только как дополнительный источник азота. Эксперименты с применением 14С-метки показали, что около 50% проникших в клетки глутамата, глицина, аспартата и фенилаланина включается в состав органических соединений. При ассимиляции глицина было показано включение радиоактивной метки в свободные аминокислоты (серин, цистеин), пуриновые азотистые основания и белок [40]. Это полностью согласуется с нашими данными о биохимическом составе клеток E. gracilis, выращенных на среде с добавлением глицина. Поскольку глицин является одновременно источником и углерода, и азота, этот ресурс инвестируется, в первую очередь, в биосинтез азотсодержащих молекул: в клетках эвглены возросло содержание белка, хлорофилла a, свободных аминокислот, аденина и гуанина (рис. 3, 4, 7). Глицин может включаться в метаболизм через митохондриальные реакции фотодыхания, что приводит к быстрому синтезу и накоплению серина (рис. 7). Формирующийся в дальнейшем пируват может поступать либо в цикл Кребса, стимулируя синтез органических кислот (рис. 7), либо в глюконеогенез, вызывая накопление углеводов (рис. 2). Избыток азота выделяется в среду в виде аммиака [2]. Интересно, что, хотя усвоение глицина, очевидно, происходит достаточно эффективно и сопровождается биосинтезом белка и нуклеиновых кислот, этот субстрат в использованной нами концентрации не стимулировал деления клеток в культуре E. gracilis (рис. 1). Этот результат подтверждает данные Murray с соавт. [2], которые показали, что при усвоении глицина, как единственного источника углерода, культура эвглены растет со скоростью, типичной для фотоавтотрофного роста.
В целом, полученные результаты демонстрируют способность эвглены существенно перестраивать свой метаболизм при усвоении органических субстратов различной химической природы в режиме миксотрофии. По-видимому, в присутствии наиболее эффективно усваиваемых субстратов, этанола и глюкозы, дополнительные биохимические ресурсы затрачиваются, преимущественно, на усиление роста культуры, а также на синтез и накопление запасных соединений. При этом в клетках эвглены одновременно стимулируется образование как парамилона, так и восковых эфиров. Умеренное накопление восковых эфиров происходит также в присутствии глицерина. Усвоение бутанола сопровождается усилением разнообразных биосинтетических процессов, затрагивающих как первичный, так и вторичный метаболизм, о чем свидетельствует накопление токоферолов в клетках эвглены. Относительно медленно усваивающийся глицин, в первую очередь, стимулирует биосинтез азотсодержащих метаболитов. Выявленные в ходе данного исследования особенности метаболизма E. gracilis при миксотрофном росте на трудноусваиваемых субстратах требуют дальнейшего, более детального изучения.
Данное исследование было выполнено при поддержке Российского фонда фундаментальных исследований (грант № 20-04-00944).
Авторы выражают благодарность Наталье Вашуриной, Сюзан Биллиг и Валерии Лемешевой за техническую помощь при осуществлении этой работы.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Buetow D.E. Euglena // Encyclopedia of life sciences (ELS). Chichester: John Wiley and Sons, Ltd, 2011. P. 1. https://doi.org/10.1002/9780470015902.a0001964.pub3
Murray D.R., Giovanelli J., Smillie R.M. Photoassimilation of glycolate, glycine and serine by Euglena gracilis // J. Protozool. 1970. V. 17. P. 99. https://doi.org/10.1111/j.1550-7408.1970.tb05165.x
Hosotani K., Ohkochi T., Inui H., Yokota A., Nakano Y., Kitaoka S. Photoassimilation of fatty acids, fatty alcohols and sugars by Euglena gracilis Z // Microbiology. 1988. V. 134. P. 61. https://doi.org/10.1099/00221287-134-1-61
Garlaschi F.M., Garlaschi A.M., Lombardi A., Forti G. Effect of ethanol on the metabolism of Euglena gracilis // Plant Sci. Lett. 1974. V. 2. P. 29. https://doi.org/10.1016/0304-4211(74)90035-2
Ogbonna J.C., Ichige E., Tanaka H. Interactions between photoautotrophic and heterotrophic metabolism in photoheterotrophic cultures of Euglena gracilis // Appl. Microbiol. Biotechnol. 2002. V. 58. P. 532. https://doi.org/10.1007/s00253-001-0901-8
Barsanti L., Gualtieri P. Anatomy of Euglena gracilis // Handbook of algal science, technology and medicine / Ed. O. Konur. NY: Academic Press, 2020. P. 61. https://doi.org/10.1016/B978-0-12-818305-2.00004-8
Klein S., Schiff J.A., Holowinsky A.W. Events surrounding the early development of Euglena chloroplasts: II. Normal development of fine structure and the consequences of preillumination // Developmental Biology. 1972. V. 28. P. 253. https://doi.org/10.1016/0012-1606(72)90142-X
Cunningham Jr.F.X., Schiff J.A. Chlorophyll-protein complexes from Euglena gracilis and mutants deficient in chlorophyll b: I. Pigment composition // Plant Physiol. 1986. V. 80. P. 223. https://doi.org/10.1104/pp.80.1.223
Barsanti L., Vismara R., Passarelli V. Paramylon (β-1,3-glucan) content in wild type and WZSL mutant of Euglena gracilis. Effects of growth conditions // J. Appl. Phycol. 2001. V. 13. P. 59. https://doi.org/10.1023/A:1008105416065
Inui H., Ishikawa T., Tamoi M. Wax ester fermentation and its application for biofuel production // Euglena: biochemistry, cell and molecular biology / Eds. S. Schwartzbach, S. Shigeoka. Springer International Publishing AG, 2017. P. 269
Oda Y., Miyatake K., Kitaoka S. Inability of Euglena gracilis Z to utilize nitrate, nitrite and urea as the nitrogen sources // Bulletin of the University of Osaka Prefecture. Ser. B, Agriculture and biology. 1979. V. 31. P. 43. https://doi.org/10.24729/00009403
Watanabe F., Yoshimura K., Shigeoka S. Biochemistry and physiology of vitamins in Euglena // Euglena: biochemistry, cell and molecular biology / Eds. S. Schwartzbach, S. Shigeoka. Springer International Publishing AG, 2017. P. 65. https://doi.org/10.1007/978-3-319-54910-1_5
Furuhashi T., Ogawa T., Nakai R., Nakazawa M., Okazawa A., Padermschoke A., Nishio K., Hirai M.Y., Arita M., Ohta D. Wax ester and lipophilic compound profiling of Euglena gracilis by gas chromatography-mass spectrometry: toward understanding of wax ester fermentation under hypoxia // Metabolomics. 2015. V. 11. P. 175. https://doi.org/10.1007/s11306-014-0687-1
Gissibl A., Sun A., Care A., Nevalaine H., Sunna A. Bioproducts from Euglena gracilis: synthesis and applications // Frontiers in Bioengineering and Biotechnology. 2019. V. 7. P. 108. https://doi.org/10.3389/fbioe.2019.00108
Mokrosnop V.M. Dynamics of chlorophyll and paramylon accumulation in Euglena gracilis cells at mixotrophic cultivation // Studia Biologica. 2016. V. 10. P. 141. https://doi.org/10.30970/sbi.1002.483
Oda Y., Nakano Y., Kitaoka S. Utilization and toxicity of exogenous amino acids in Euglena gracilis // Microbiology. 1982. V. 128. P. 853. https://doi.org/10.1099/00221287-128-4-853
Puzanskiy R.K., Shavarda A.L., Tarakhovskaya E.R., Shishova M.F. Analysis of metabolic profile of Chlamydomonas reinhardtii cultivated under autotrophic conditions // Appl. Biochem. Microbiol. 2015. V. 51. P. 83. https://doi.org/10.1134/S0003683815010135
Birkemeyer C., Osmolovskaya N., Kuchaeva L., Tarakhovskaya E. Distribution of natural ingredients suggests a complex network of metabolic transport between source and sink tissues in the brown alga Fucus vesiculosus // Planta. 2019. V. 249. P. 377. https://doi.org/10.1007/s00425-018-3009-4
Matsuda F., Hayashi M., Kondo A. Comparative profiling analysis of central metabolites in Euglena gracilis under various cultivation conditions // Biosci. Biotechnol. Biochem. 2011. V. 75. P. 2253. https://doi.org/10.1271/bbb.110482
Zeng M., Hao W., Zou Y., Shi M., Jiang Y., Xiao P., Lei A., Hu Z., Zhang W., Zhao L., Wang J. Fatty acid and metabolomic profiling approaches differentiate heterotrophic and mixotrophic culture conditions in a microalgal food supplement “Euglena” // BMC Biotechnol. 2016. V. 16. P. 1. https://doi.org/10.1186/s12896-016-0279-4
Shao Q., Hu L., Qin H., Liu Y., Tang X. Metabolomic response of Euglena gracilis and its bleached mutant strain to light // PLoS One. 2019. V. 14: e0224926. https://doi.org/10.1371/journal.pone.0224926
Cramer M., Myers J. Growth and photosynthetic characteristics of Euglena gracilis // Archiv. Mikrobiol. 1952. V. 17. P. 384. https://doi.org/10.1007/BF00410835
Hewitt B.R. Spectrophotometric determination of total carbohydrate // Nature. 1958. V. 182. P. 246. https://doi.org/10.1038/182246b0
Jeffrey S.W., Humphrey G.F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton // Biochem. Physiol. Pflanz. 1975. V. 167. P. 191. https://doi.org/10.1016/S0015-3796(17)30778-3
Lichtenthaler H.K., Wellburn A.R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents // Biochem. Soc. Trans. 1983. V. 11. P. 591. https://doi.org/10.1042/bst0110591
Bolling C., Fiehn O. Metabolite profiling of Chlamydomonas reinhardtii under nutrient deprivation // Plant Physiol. 2005. V. 139. P. 1995. https://doi.org/10.1104/pp.105.071589
Hutschenreuther A., Kiontke A., Birkenmeier G., Birkemeyer C. Comparison of extraction conditions and normalization approaches for cellular metabolomics of adherent growing cells with GC-MS // Anal. Methods. 2012. V. 4. P. 1953. https://doi.org/10.1039/c2ay25046b
Kovats E. Gas-chromatographische charakterisierung organischer verbindungen. Teil 1: retentionsindices aliphatischer halogenide, alkohole, aldehyde und ketone // Helv. Chim. Acta. 1958. V. 41. P. 1915. https://doi.org/10.1002/hlca.19580410703
Kopka J., Schauer N., Krueger S., Birkemeyer C., Usadel B., Bergmüller E., Dörmann P., Weckwerth W., Gibon Y., Stitt M., Willmitzer L., Fernie A.R., Steinhauser D. GMD@CSB.DB: the Golm Metabolome Database // Bioinformatics. 2005. V. 21. P. 1635. https://doi.org/10.1093/bioinformatics/bti236
Rolfe M.D., Rice C.J., Lucchini S., Pin C., Thompson A., Cameron A.D., Alston M., Stringer M.F., Betts R.P., Baranyi J., Peck M.W., Hinton J.C. Lag phase is a distinct growth phase that prepares bacteria for exponential growth and involves transient metal accumulation // J. Bacteriol. 2012. V. 194. P. 686. https://doi.org/10.1128/JB.06112-11
Puzanskiy R., Tarakhovskaya E., Shavarda A., Shishova M. Metabolomic and physiological changes of Chlamydomonas reinhardtii (Chlorophyceae, Chlorophyta) during batch culture development // J. Appl. Phycol. 2018. V. 30. P. 803. https://doi.org/10.1007/s10811-017-1326-9
Ono K., Kawanaka Y., Izumi Y., Inui H., Miyatak K., Kitao S., Nakano Y. Mitochondrial alcohol dehydrogenase from ethanol-grown Euglena gracilis // J. Biochem. 1995. V. 117. P. 1178. https://doi.org/10.1093/oxfordjournals.jbchem.a124841
Cuenca M.D.S., Roca A., Molina-Santiago C., Duque E., Armengaud J., Gómez-Garcia M.R., Ramos J.L. Understanding butanol tolerance and assimilation in Pseudomonas putida BIRD-1: an integrated omics approach // Microb. Biotechnol. 2016. V. 9. P. 100. https://doi.org/10.1111/1751-7915.12328
Neilson A.H., Lewin R.A. The uptake and utilization of organic carbon by algae: an essay in comparative biochemistry // Phycologia. 1974. V. 13. P. 227. https://doi.org/10.2216/i0031-8884-13-3-227.1
Perez-Garcia O., Escalante F.M.E., de-Bashan L.E., Bashan Y. Heterotrophic cultures of microalgae: Metabolism and potential products // Water research. 2011. V. 45. P. 11. https://doi.org/10.1016/J.WATRES.2010.08.037
Khanra A., Rai M.P. Evaluation of mixotrophic cultivation of Euglena gracilis for lipid synthesis and FAME characterization towards biodiesel application // J. Sci. Ind. Res. 2018. V. 77. P. 359.
Aral B., Kamoun P. The proline biosynthesis in living organisms // Amino Acids. 1997. V. 13. P. 189. https://doi.org/10.1007/BF01372588
Hurlbert R.E., Rittenberg S.C. Glucose metabolism of Euglena gracilis var. bacillaris; growth and enzymatic studies // J. Protozool. 1962. V. 9. P. 170. https://doi.org/10.1111/j.1550-7408.1962.tb02602.x
Buetow D.E. Amino acids as nitrogen sources for the growth of Euglena gracilis and Astasia longa // J. Protozool. 1966. V. 13. P. 585. https://doi.org/10.1111/j.1550-7408.1966.tb01967.x
Kempner E.S., Miller J.H. The molecular biology of Euglena gracilis. III. General carbon metabolism // Biochemistry. 1965. V. 4. P. 2735. https://doi.org/10.1021/bi00888a025
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений