Физиология растений, 2023, T. 70, № 2, стр. 202-213
Лабораторная система для интенсивного культивирования микроводорослей и цианобактерий
Д. А. Габриелян a, М. А. Синетова a, *, А. К. Габриелян a, Л. А. Бобровникова a, В. С. Бедбенов a, А. Ю. Стариков a, А. А. Зорина a, Б. В. Габель a, Д. А. Лось a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
имени К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: maria.sinetova@mail.ru
Поступила в редакцию 25.08.2022
После доработки 07.09.2022
Принята к публикации 07.09.2022
- EDN: GKCNLD
- DOI: 10.31857/S0015330322600486
Аннотация
В настоящее время микроводоросли и цианобактерии привлекают к себе внимание исследователей как потенциальные продуценты различных ценных веществ. Для увеличения рентабельности биотехнологических процессов с использованием этих организмов необходим отбор высокоэффективных штаммов и выбор оптимальных условий для их роста и максимальной продуктивности. Оптимизация роста должна производиться, с одной стороны, в интенсивных условиях, максимально близких к масштабному культивированию, а с другой стороны – в небольших объемах, чтобы иметь возможность параллельно проверять множество разных параметров с минимальными затратами. В данной работе мы представляем описание и характеристики сконструированной нами лабораторной системы для интенсивного культивирования (LSIC – Laboratory System for Intensive Cultivation) с термо-, свето- и газорегулированием и возможностью культивирования в 4 повторностях в 8 разных условиях, отличающихся по свету, температуре и концентрации CO2. Также в качестве примера представлены результаты ряда экспериментов с использованием установки.
ВВЕДЕНИЕ
Микроводоросли и цианобактерии – это простейшие фотосинтезирующие организмы, которые вносят существенный вклад в глобальное поглощение углекислоты и синтез органического вещества с выделением кислорода. В настоящее время эти организмы привлекают к себе внимание исследователей как потенциальные продуценты ценных соединений, таких как полисахариды, липиды с разнообразным составом жирных кислот (ЖК), пигменты, витамины, стерины, антибиотики и токсины [1]. Основным преимуществом микроводорослей и цианобактерий является возможность их выращивания без использования плодородных земель и запасов пресной воды, высокая эффективность фотосинтеза и скорость роста. Однако до сих пор коммерческое получение биомассы и большинства ценных продуктов остается нерентабельным в промышленных масштабах [2, 3]. Для увеличения рентабельности необходим подбор высокоэффективных штаммов и оптимальных условий для их роста и максимальной продуктивности, включающих такие параметры как температура, освещенность, содержание СО2 в газовой смеси, состав среды. Оптимизация роста должна производиться, с одной стороны, в интенсивных условиях, максимально близких к масштабному культивированию, а с другой стороны – в небольших объемах, чтобы иметь возможность параллельно проверять множество разных условий с минимальными затратами. Кроме того, микроводоросли и цианобактерии являются модельными объектами для изучения стрессовых ответов фотоавтотрофных организмов на клеточном и молекулярном уровнях [4–6]. Для подбора биотехнологически перспективных штаммов, оптимизации их роста и продуктивности, моделирования промышленного культивирования, а также для изучения стрессовых ответов фототрофных организмов с использованием методов транскриптомики, протеомики и метаболомики необходимы лабораторные фотобиореакторы, позволяющие вести исследования множества образцов в воспроизводимых условиях с заданными параметрами [7, 8].
Основные требования к лабораторной системе интенсивного культивирования:
– перемешивание, обеспечивающее гомогенность культуры по отношению к освещенности и газообмену – необходимое условие для получения автотрофных культур с высокой плотностью;
– поддержание стерильности культуры во время длительных экспериментов;
– поддержание освещенности, температуры и подачи CO2 в заданном диапазоне, необходимое для интенсификации фотосинтеза, максимального накопления биомассы и обеспечения воспроизводимости экспериментальных условий;
– возможность проводить параллельные эксперименты с разными параметрами культивирования в минимальной повторности (3–4), необходимая для оптимизации условий роста и накопления целевых продуктов в клетках микроводорослей, для изучения стрессовых ответов;
– дешевизна и простота конструкции, что предполагает возможность изготовления из доступных материалов, легкость сборки;
– культивирование в объеме, достаточном для отбора проб на изучение биохимического состава клеток, исследований транскриптомики и протеомики (100–400 мл).
В данной работе мы представляем описание и характеристики сконструированной нами лабораторной системы для интенсивного культивирования (LSIC – Laboratory System for Intensive Cultivation) с термо-, свето- и газорегулированием, возможностью культивирования в 4 повторностях в 8 разных условиях, отличающихся по свету, температуре и концентрации CO2. Эта система является обновленной версией установок, разработанных в ИФР РАН в 1960–70-х гг. [9, 10]. Производство подобной установки и ее модификация под собственные нужды возможны в любых лабораторных условиях из доступных материалов. В качестве примера мы приводим результаты ряда экспериментов, проведенных с использованием установки: 1) скрининг штаммов, пригодных к массовому культивированию; 2) оптимизация ростовых условий; 3) исследование биохимического состава клеток микроводорослей на разных стадиях роста и выбор наиболее продуктивных штаммов.
МАТЕРИАЛЫ И МЕТОДЫ
Лабораторная установка для интенсивного культивирования
Фотографии, схема и основные характеристики культивационной установки LSIC представлены на рис. 1(а–г) и в табл. 1. Резервуар культивационной установки представляет собой герметичную емкость, объем которой ограничен двумя полыми коаксиальными цилиндрами, расположенными на массивной цилиндрической платформе. Вся конструкция выполнена из монолитного прозрачного поликарбоната. Рабочий объем резервуара разделен на восемь секторов двуслойными стенками с воздушным зазором для обеспечения термоизоляции секторов между собой.
Рис. 1.
Фотографии и схема культивационной установки: а – общий вид установки без сосудов; б – резервуар с сосудами; в – схема рабочей емкости культивационной установки; г – детальная схема сосуда для интенсивного культивирования микроводорослей и цианобактерий. 1 – секция культиватора; 2 – платформа; 3 – сосуд; 4 – теплоноситель (вода); 5 – культура микроводорослей или цианобактерий; 6 – барботер; 7 – трубка подачи воздуха; 8 – ватно-марлевая пробка; 9 – элемент Пельтье; 10 – радиатор №1; 11 – радиатор №2; 12 – вентилятор; 13 – переключатель; 14 – терморегулятор; 15 – датчик температуры; 16 – светодиоды (СД); 17 – выключатели СД; 18 – светодиодный модуль (СДМ); 19 – блок питания СДМ.
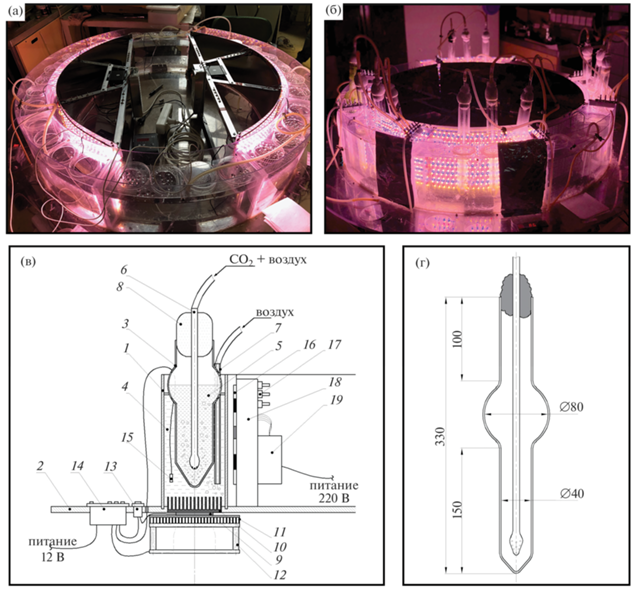
Таблица 1.
Характеристики лабораторной установки для интенсивного культивирования
| Характеристика | Описание |
|---|---|
| Параллелизация | 8 условий, различных по температуре, освещению, СО2, по 4 повторности в каждом варианте |
| Рабочий объем одного сосуда | 100–250 мл |
| Температура | 22–41°С ± 1°С |
| Освещение | 30–500 мкмоль/(м2·с), теплый белый, красный и голубой свет, возможны другие комбинации по спектру и дополнительное освещение с внешней стороны, контроль с помощью люминометра |
| Оптический путь | 4 см в цилиндрической части, 8 см в расширении |
| СО2 | 0.04–100%, контроль с помощью газоанализатора |
| Тип перемешивания | Барботаж газовоздушной смесью |
Система терморегулирования состоит из восьми термостатирующих модулей, расположенных в середине каждой секции культиватора, и системы подачи воздуха для равномерного перемешивания теплоносителя (воды) в секции культиватора (рис. 1в). Термостатирующий модуль представляет собой систему, состоящую из модуля Пельтье (9), подключенного к измерителю-контроллеру (терморегулятору, 14) через переключатель (13), осевого вентилятора (12) и двух радиаторов (10, 11) (рис. 1в).
Радиаторы служат для интенсификации теплообмена между источником и приемником тепловой энергии. На культивационной установке применяются радиаторы двух типов: профиль 100 × 90 × × 26 мм (10) и профиль 150 × 170 × 20 мм (11), которые необходимы для передачи тепла от нагревателя (9) к теплоносителю в секции культиватора (4) и для отвода тепла от нагревателя (9) к поверхности радиатора, омываемой воздухом за счет работы осевого вентилятора (12), соответственно. Термостатирующий модуль позволяет задавать температуру теплоносителя в рабочей емкости с точностью в пределах двух градусов по Фаренгейту: границы температур устанавливаются исходя из отклонения от рабочей температуры на один градус по Фаренгейту. Терморегулятор (14) управляет переключением режимов нагрев–охлаждение при температурах в емкости ниже или, соответственно, выше 1°F от рабочей и отключением питания элемента Пельтье (9) при рабочих значениях температуры. Предусмотрено ручное переключение режимов и отключение работы элемента Пельтье с помощью трехпозиционного переключателя (13). В каждом термостатирующем модуле установлено по одному элементу Пельтье марки ТЕС1-12712 размерами 62 × 62 × 4 мм и мощностью 120 Вт с рабочим напряжением 12 В.
Система освещения позволяет проводить исследования по влиянию условий культивирования в большем диапазоне значений по интенсивности (от 30 до 500 мкмоль/м2 · c) в разных по спектральному составу вариантах освещенности (белые светодиоды дополнены синими и красными). Предусмотрена возможность установки дополнительного внешнего освещения, к примеру, для определения пороговых значений интенсивности света исследуемой культуры.
Восьми секторам резервуара культивационной установки соответствуют свои секции системы освещения. Секции сгруппированы в модули следующим образом: два модуля по три секции и два односекционных модуля. Модули питаются отдельно друг от друга. Такое разбиение позволяет проводить обслуживание и смену модулей освещения, не нарушая работы всего реактора.
Каждая секция модуля представляет собой спаянные в определенной последовательности светодиодные ленты различного свечения (белые 2400К марки SDM 2835, красные с 620–630 нм и синие 465–475 нм, марки SDM 3528 от компании “Arlight”, Беларусь), размещенные на дуговых конструкциях из листового алюминия радиусом меньшим, чем внутренний радиус стенки биореактора. Таким образом, светогенерирующая поверхность модулей расположена в непосредственной близости к светопринимающей поверхности реактора, на расстоянии не более 3 см, что позволяет сократить потери энергии света и равномерно распределить освещение по емкостям реактора.
На секцию приходится 13 светодиодных лент белого теплого света и по 6 лент красного и синего. Для двух емкостей дополнительно собраны односекционные модули только из лент красного и синего света для исследования влияния на рост света с длинами волн 620–630 нм и 465–475 нм и их различных комбинаций.
Подача и регулирование газо-воздушной смеси. Чистый диоксид углерода из баллона подается через ротаметр в смесительную емкость, где смешивается с воздухом, нагнетаемым компрессором, далее смесь через ротаметры подачи и измерения концентрации СО2 поступают через фильтр и стеклянный барботер в сосуд с суспензией микроводорослей или цианобактерий. Расход смеси регулируется краниками и зажимами на подводящих силиконовых трубках.
Сосуд для интенсивного культивирования. Форма сосуда была разработана еще для первых вариантов установки [9] и позже модифицирована (рис. 1г). Сосуд представляет собой по сути модифицированную барботажную колонну (bubble column) и позволяет производить выращивание культуры в диапазоне объемов 100–250 мл. Важной особенностью сосуда является отсутствие углов, положение барботера и форма дна, что позволяет обеспечить равномерное перемешивание и оптимизировать газообмен. Нижняя часть сосуда имеет оптический путь 4 см, позволяющий обеспечить оптимальную освещенность культуры. Расширенная часть сосуда выполняет функции пеноотбойника, обеспечивает оседание пены, так же как и верхняя вытянутая часть, и создает дополнительный объем. Сосуд, закрытый ватно-марлевой пробкой, можно стерилизовать при температуре 150°С и поддерживать в нем стерильные условия при культивировании, пропуская воздушную смесь для барботажа через ватный или целлюлозный фильтр (Millex-GS, 0.22 µm, “Merck Millipore”, США).
Измерение облученности
Все измерения уровня облученности в рабочем объеме фотобиореакторов и на поверхности светодиодных модулей снимались прибором LI-COR (Model LI-189 с LI-190SA “Quantum Sensor”, США) в мкмоль/(м2 · с).
Оценка скорости перемешивания
Для оценки скорости и полноты перемешивания измеряли время, за которое 1 мл 0.1% водного раствора красителя Ponceau полностью растворится в 250 мл воды при обычно используемой интенсивности барботажа [11]. Измерения повторяли 5 раз.
Оценка температурного контроля, теплопереноса
Оценивали, за какое время после изменения температурного режима изменится температура в трех сосудах с 150 мл воды или культуры микроводорослей (при таком объеме заполненная часть сосуда полностью погружена в теплоноситель), оценивали соответствие температуры в сосуде и в водяной бане и точность поддержания температуры на протяжении суток.
Тест на стерильность
Для тестирования возможности поддержания асептических условий культивирования в сосуд в стерильных условиях добавляли среду LB с 2% глюкозы и помещали его в условия интенсивного культивирования при температуре 32°C на 7 дней. Затем пробу отбирали и высеивали на агаризованную среду LB с глюкозой. После инкубации в течение 14 дней при 30°С тестовые чашки были проверены на наличие колоний.
Аксеничность культуры C. sorokiniana IPPAS C-1, выращиваемой на культивационной установке в течение трех суток, проверяли микроскопированием (микроскоп Axio Imager D1; “Carl Zeiss”, Германия) и посадкой на чашку Петри с тестовой средой (ВВМ-3N с добавлением 0.2% глюкозы и 0.02% казеинового гидролизата). Тестовую чашку инкубировали в темноте при комнатной температуре в течение 7 дней, затем проверяли на присутствие посторонних колоний.
Штаммы цианобактерий и микроводорослей
В работе были использованы 13 штаммов цианобактерий и микроводорослей из коллекции IPPAS ИФР РАН (табл. 2).
Таблица 2.
Штаммы и условия культивирования
| Штамм | Среда для культивирования* | Температура культивирования |
|---|---|---|
| Limnospira sp. IPPAS B-256 | Заррука | 32°С |
| Limnospira sp. IPPAS B-287 | Заррука | 32°С |
| Limnospira sp. IPPAS B-1526 | Заррука | 32°С |
| Cyanobacterium sp. IPPAS B-1528 | Заррука | 32°С |
| Geminocystis sp. IPPAS B-1530 | Заррука | 27°С |
| Microcystis aeruginosa IPPAS B-1527 | Microcystis | 27°С |
| Nodularia spumigena IPPAS B-1529 | Заррука-N | 32°С |
| Chromochloris zofingiensis IPPAS C-30 | 5A+2B | 27°С |
| Chromochloris zofingiensis IPPAS C-108 | 5A+2B | 27°С |
| Chlorella sp. IPPAS C-1210 | BBM-3N | 30°С |
| Chlorella sorokiniana IPPAS C-1 | 1/2 Тамия модифицированная | 32°С |
| Lobosphaeropsis lobophora IPPAS C-102 | BBM-3N | 27°С |
| Chlamydopodium sp. IPPAS C-1503 | BBM-3N | 27°С |
Примечание: * Состав сред указан в http://cellreg.org/Catalog_2020/media_list.html
Условия интенсивного культивирования
Исходные культуры штаммов микроводорослей и цианобактерий поддерживали на соответствующих агаризованных средах в пробирках или чашках Петри. Перед экспериментом штаммы пересаживали в 100–150 мл жидкой среды в колбу Эрленмейера и подращивали на качалке при освещении 50 мкмоль /м2 · сек в течение 7–14 дней. Интенсивное культивирование производили в вышеописанной культивационной установке, в сосудах с 150–250 мл соответствующей среды при освещении 500 мкмоль /м2 · сек и оптимальной температуре роста, если не указано иное. Перемешивание и аэрация культуры осуществлялись за счет барботирования стерильной газовоздушной смесью. Объемный расход подаваемой смеси составлял около 0.25 л/мин, концентрация СО2 поддерживалась в диапазоне 1.2–1.8% (v/v). Для адаптации к условиям интенсивного культивирования каждую культуру предварительно выращивали до экспоненциальной фазы в указанных условиях, затем разбавляли свежей средой до оптической плотности, измеренной при 750 нм (ОП750) 0.1–0.3 и проводили эксперименты в трех повторностях. Среды культивирования и оптимальные температуры роста указаны в таблице 2.
Ростовые характеристики
Скорость роста оценивалась по изменению ОП750 суспензии и по сухой массе. ОП750 измеряли на спектрофотометре Genesys 10S UV-Vis (“Thermo Scientific”, США).
Для измерения сухой массы 1–10 мл культуры осаждали центрифугированием, промывали дистиллированной водой и высушивали в сушильном шкафу 24 ч при 80°C в предварительно взвешенных микропробирках.
Для оценки скорости роста использовали следующие параметры.
Удельная скорость роста, μ, оценивалась по изменению оптической плотности культуры или по сухой массе (/сут.):
где N1 и N2 – ОП750, измеренная во время 1 (t1) и время 2 (t2) соответственно.
Средняя скорость накопления биомассы, vср, оценивалась по сухой массе (г/(л · сут.)):
где m1 и m2 – сухая масса 1 мл культуры, измеренная во время 1 (t1) и время 2 (t2).
По удельной скорости также рассчитывалось время удвоения биомассы Тудв:
Конечную продуктивность Пк штаммов определяли по концентрации биомассы в конце культивирования.
Эксперименты по оценке скорости роста проводили в трех повторностях.
Биохимический анализ
Методы биохимического анализа клеток микроводорослей и цианобактерий подробно описаны в [12]. Концентрации хлорофиллов и каротиноидов определяли спектрофотометрически в метанольных экстрактах. Содержание белка в клетках определяли с бицинхониновым реагентом (BCA1, “Sigma-Aldrich”, США), согласно инструкции производителя. Содержание запасных углеводов определяли фенол-сернокислым методом. Содержание суммарных липидов оценивали газохроматографически в пересчете на количество этерифицированных ЖК на грамм сухой массы клеток.
РЕЗУЛЬТАТЫ
Оценка скорости перемешивания
При стандартной интенсивности барботажа 1 мл 0.1% водного раствора Ponceau растворялся в сосуде с 250 мл воды за 4–5 с. По распределению красителя было видно, что зоны без перемешивания в сосуде отсутствуют. В отсутствие барботажа краситель полностью растворялся за 45 с.
Температурный тест
Во всех экспериментах при переносе сосудов с 150 мл воды или с 150 мл плотной суспензии клеток в секцию с температурой, отличающейся на 10°C (были установлены значения температуры 22, 32 и 42°С), температура в сосудах достигала заданных значений за 12 мин, при этом уже за 6–8 мин температура достигала значений, отличных от заданного на 1°С (рис. 2).
Рис. 2.
Динамика изменения температуры в сосудах при перемещении из секции с установленной температурой 32°С в секцию с температурой 22°С и обратно (а); в секцию с температурой 42°С и обратно (б). 1, 2 – сосуды с водой; 3, 4 – сосуды с плотной суспензией микроводорослей. 1, 3 – охлаждение; 2, 4 – нагрев. Показаны средние значения и стандартные отклонения по трем повторностям.
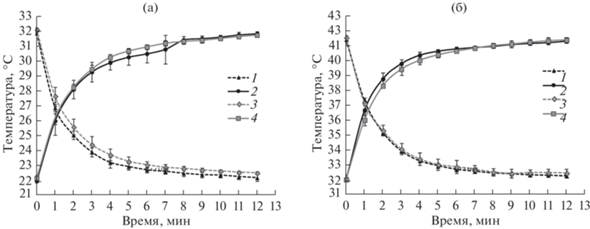
При температуре окружающей среды 23°C и максимальном освещении заданные в секциях установки значения температуры 22, 32 и 44°C поддерживались в течение суток в пределах 22–23°C, 31–33°C, 41–41.5°C соответственно.
Тест на стерильность
Возможность сохранять культуры аксеничными при длительном культивировании в установке проверяли двумя способами. В первом варианте в установке инкубировали сосуды с органической средой LB с добавлением глюкозы при 32°C и стандартных условиях барботажа в течение 7 дней. Отсутствие роста микроорганизмов было подтверждено отсутствием изменения оптической плотности, измеренной при 595 нм, и отсутствием колоний после посева среды из сосудов на агаризованную среду LB c глюкозой после 35 дней инкубации (Дополнительные материалы, рис. 1а). Во втором варианте на установке выращивали аксеничную культуру C. sorokininana IPPAS C-1 в течение 3 суток. Аксеничность культуры C. sorokininana IPPAS C-1 после культивирования подтверждали микроскопированием и инкубацией в темноте на тестовой среде. Микроскопирование показало отсутствие посторонних организмов. Проверка культуры на тестовой среде (Дополнительные материалы, рис. 1б) также подтвердила отсутствие в культуре посторонних организмов – после инкубации в темноте на чашках был заметен только зеленый газон C. sorokininana IPPAS C-1, способной к гетеротрофному росту, а колонии бактерий или грибов отсутствовали.
Скрининг штаммов, пригодных к массовому культивированию
Для данного этапа были отобраны 6 штаммов цианобактерий и зеленых микроводорослей коллекции IPPAS, ранее не культивировавшиеся в интенсивных условиях: Cyanobacterium sp. IPPAS B-1528, Geminocystis sp. IPPAS B-1530, Microcystis aeruginosa IPPAS B-1527, Nodularia spumigena IPPAS B-1529, Lobosphaeropsis lobophora IPPAS C-102, Chlamydopodium sp. IPPAS C-1503. Для всех штаммов с использованием культивационной установки были получены интенсивные культуры и данные по конечной продуктивности после 7 суток культивирования (табл. 3).
Таблица 3.
Конечная продуктивность штаммов
| Штамм | Пк, г/л |
|---|---|
| Microcystis aeruginosa IPPAS B-1527 | 1.5 ± 0.2 |
| Cyanobacterium sp. IPPAS B-1528 |
4.7 ± 0.2 |
| Geminocystis sp. IPPAS B-1530 |
1.0 ± 0.0 |
| Nodularia spumigena IPPAS B-1529 |
4.3 ± 0.4 |
| Lobosphaeropsis lobophora IPPAS C-102 | 3.8 ± 0.1 |
| Chlamydopodium sp. IPPAS C-1503 |
1.9 ± 0.1 |
Определение температурного оптимума штамма C. sorokiniana IPPAS C-1
Для выявления температурных зависимостей роста C. sorokiniana IPPAS C-1 рабочие температуры в четырех емкостях культивационной установки были выставлены на 26, 31, 36 и 41°С.
Результаты проведенных исследований (рис. 3) показывают, что в первые сутки самые высокие значения максимальной удельной скорости µmax были у вариантов, выращиваемых при 31 и 36°С (минимальное время удвоения составляло 5.3 ч и 4.6 ч, соответственно). Показатель µmax характеризует максимально возможную скорость роста штамма в экспоненциальной фазе роста, когда отсутствует лимитирование роста освещенностью и компонентами среды.
Рис. 3.
Зависимость роста C. sorokiniana IPPAS C-1 от температуры при подаче ГВС с концентрацией СО2 1.5–1.8% и постоянном освещении 500 мкмоль/(м2 · с). Ростовые кривые – (а); удельная скорость роста – (б) 1 – 26°С; 2 – 31 °С; 3 – 36°С; 4 – 41°С. Показаны средние значения и стандартные отклонения по трем повторностям.
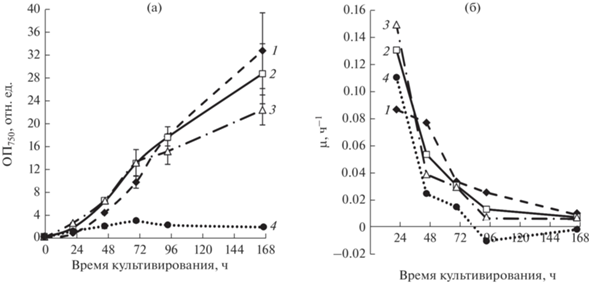
Однако, по окончанию всего периода культивирования (на седьмые сутки) больше биомассы накопили варианты, выращиваемые при 26 и 31ºС. Рост вариантов, выращиваемых при 41°С, был полностью ингибирован уже после 72 ч, но гибели культуры не произошло даже после 7 сут., так как последующее снижение температуры до 31°С привело к возобновлению роста культуры.
Влияние условий низкой и высокой освещенности на накопление биомассы у штамма Chlorella sp. IPPAS C-1210
Сравнивали рост культуры Chlorella sp. IPPAS C-1210 при интенсивностях освещения 100 и 500 мкмоль/(м2 · с) (рис. 4). Варианты существенно отличались по µmax, которая была в 2 раза выше в варианте с большей освещенностью (минимальное время удвоения составило 12.1 ч и 5.5 ч, соответственно). За счет этого различия в варианте с большей освещенностью была достигнута также значительно более высокая конечная оптическая плотность культуры.
Рис. 4.
Зависимость роста Chlorella sp. IPPAS C-1210 от интенсивности освещения при температуре 30°С и подаче ГВС с концентрацией СО2 1.5–1.8%. Ростовые кривые – (а); удельная скорость роста – (б). 1 – 100 мкмоль/(м2 · с); 2 – 500 мкмоль/(м2 · с). Показаны средние значения и стандартные отклонения по трем повторностям.
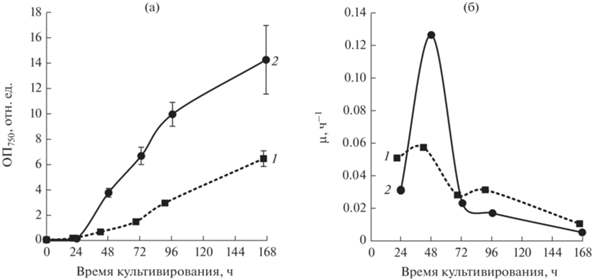
Исследования биохимического состава штаммов микроводорослей и цианобактерий на разных стадиях роста и выбора наиболее продуктивных штаммов
Сравнение штаммов рода Limnospira
Сравнивали ростовые характеристики и биохимический состав трех штаммов нитчатых цианобактерий IPPAS B-256, IPPAS B-287, и IPPAS B-1526, принадлежащих к роду Limnospira sp. (ранее относимых к роду Arthrospira [13]).
Штаммы, относящиеся к этому роду, являются источником макро- и микроэлементов, витаминов, пигментов, белков, полисахаридов, γ-линоленовой кислоты (ГЛК) и других биоактивных соединений [14]. Поэтому особое внимание при сравнении штаммов уделяли скорости накопления биомассы, содержанию белков, гликогена и ГЛК.
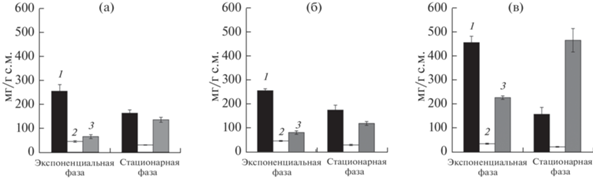
Все исследуемые штаммы отличались высокими скоростями роста (минимальные времена удвоения 8–14 ч, средняя скорость накопления биомассы 0.91–1.24 г/(л · сут.). Штамм IPPAS B-256 отличался высоким значением vср и самой высокой конечной продуктивностью после 10 дней культивирования (табл. 4). Штамм IPPAS B-287 характеризовался высоким значением μmax, высоким содержанием ГЛК в общих ЖК (18%) и в культуре (табл. 4). Штамм IPPAS B-1526 имел высокие значения μmax, vср, конечной продуктивности и содержания ГЛК в общих ЖК (20%) и в культуре (табл. 4). Кроме того, этот штамм имел самое высокое содержание белка в экспоненциальной фазе и самое высокое содержание гликогена в стационарной фазе (рис. 5), однако он более всех исследованных штаммов был склонен образовывать крупные плотные конгломераты, не поддававшиеся гомогенизации.
Сравнение штаммов Chromochloris zofingiensis
Сравнивали ростовые характеристики и биохимический состав двух штаммов C. zofingiensis IPPAS C-30 и IPPAS C-108, которые являются сестринскими штаммами для типового штамма данного вида SAG 211-14 [15]. Штаммы C. zofingiensis представляют интерес для биотехнологии, так как способны к вторичному каротиногенезу и могут синтезировать астаксантин, а также накапливают значительное количество липидов [16]. Изучаемые штаммы поступили в коллекцию IPPAS из коллекции Прата в 1964 г. и из коллекции LABIK лаборатории альгологии Ботанического института имени В. Л. Комарова в 1989 г., соответственно. До 2020 г. штаммы поддерживались на разных средах: IPPAS C-30 на среде Тамия, IPPAS C-108 – на среде BBM-3N. Целью данного эксперимента было проверить, насколько сохранилось сходство между этими сестринскими штаммами по ростовым характеристикам и по биохимическому составу.
При выращивании в одинаковых интенсивных условиях штаммы показали сходные ростовые характеристик (рис. 6а, б). Оба штамма характеризовались наличием лагфазы длиной около суток, минимальное время удвоения составляло 12.3 ч и 13.4 ч, конечная продуктивность составила 2.85 ± ± 0.09 г/л и 2.58 ± 0.08 г/л у IPPAS C-30 и IPPAS C-108, соответственно.
Рис. 6.
Ростовые характеристики и биохимический состав клеток штаммов C. zofingiensis IPPAS C-30 (а, в, д) и IPPAS C-108 (б, г, е). Кривые роста (1) и удельные скорости роста (2) – а, б; содержание хлорофиллов а (1), b (2) и каротиноидов (3) на разных стадиях роста – в, г; содержание белков (1), липидов (2), запасных углеводов (3) на разных стадиях роста – д, е. Показаны средние значения и стандартные отклонения по трем повторностям.

В обоих исследуемых штаммах при переходе к стационарной фазе содержание хлорофилла падало, тогда как содержание каротиноидов возрастало (рис. 6в, г), что свидетельствует о вторичном каротиногенезе в клетках исследуемых штаммов.
Динамика содержания общего белка, запасных углеводов и суммарных липидов в клетках исследуемых штаммов также была сходна: при переходе из экспоненциальной в стационарную фазу в клетках обоих штаммов снижалось содержание белка и возрастало содержание липидов и крахмала (рис. 6д, е).
ОБСУЖДЕНИЕ
Тестирование разработанной нами лабораторной системы интенсивного культивирования показало, что осуществляющиеся в ней перемешивание с помощью барботирования газовоздушной смеси в сосудах особой формы обеспечивает гомогенность культуры. Система терморегуляции позволяет поддерживать температуру в диапазоне 22–42°С с точностью до 1°С. При этом содержимое сосуда достигает установленной в культивационной секции температуры в течение максимум 12 мин при условии, что изначальная разница в температуре между жидкостью в сосуде и теплоносителем составляет 10°С. Вместе с тем, температура, отличная от установленной на 1°С, была достигнута уже в течение 6–8 мин. Таким образом, данная установка позволит проводить эксперименты по исследованию механизмов регуляции экспрессии генов при воздействии холодового или теплового стрессов и брать первые пробы уже через 15 мин. Тест на поддержание стерильности показал, что в установке возможно длительное культивирование (в течение 3–7 суток) в асептических условиях.
С использованием данной установки нами была проверена возможность интенсивного культивирования ряда штаммов, недавно изолированных из природных местообитаний. Среди исследуемых штаммов были цианобактерии и зеленые микроводоросли, нитчатые, колониальные и одноклеточные организмы. Всех их оказалось возможным выращивать в представленной системе культивирования. По конечной продуктивности для дальнейших исследований были отобраны штаммы с наиболее высокими показателями: Cyanobacterium sp. IPPAS B-1528 и Nodularia spumigena IPPAS B-1529, изолированные из содовых озер.
Результаты экспериментов с поиском оптимальной температуры роста для штамма C. sorokiniana IPPAS C-1 показали, что штамм способен накапливать биомассу с высокой скоростью в широком диапазоне температур 26–36°С при аэрировании ГВС с 1.5–1.8% СО2 и при постоянном освещении с интенсивностью 500 мкмоль/(м2 · с). Следует отметить, что первые трое суток культивирования набор биомассы шел интенсивней при 31 и 36°С, чем при 26°С, однако, по окончанию всего периода культивирования (на седьмой день) накапливали больше биомассы варианты, выращенные при 26°С. Культура, выращиваемая в течение 7 сут. при температуре 41°С, находилась в неблагоприятных для роста условиях, однако не потеряла жизнеспособность.
Сравнение накопления биомассы штаммом Chlorella sp. IPPAS C-1210 в условиях высокой и низкой освещенности показало, что высокая освещенность (500 мкмоль/(м2 · с)) позволяет увеличить скорость роста и концентрацию биомассы более чем в 2 раза.
Выращивание трех штаммов Limnospira на представленной установке позволило получить культуры с высокой продуктивностью по биомассе и провести сравнение биохимического состава исследуемых штаммов на разных стадиях роста. Высокое содержание белка, близкое к среднему у этого рода, имел только штамм IPPAS B-1526: 45.9 ± ± 2.7% по сравнению с 45% в среднем [14]. Остальные два штамма значительно отставали по этому параметру. По содержанию липидов все штаммы были в пределах известных средних значений 1.5–12% [14]. По содержанию гликогена штаммы IPPAS B-256 и IPPAS B-287 находились в пределах известных средних значений 10–15% для общего содержания углеводов [14]. Содержание гликогена в клетках IPPAS B-1526 было значительно выше и достигало 46.9 ± 4.9% в стационарной фазе. Все исследуемые штаммы имели более низкую долю ГЛК по сравнению со средними известными значениями 40% [14], однако за счет высокой продуктивности по биомассе содержание ГЛК в культуре штаммов IPPAS B-1526 и IPPAS B-287 достигало значений, превышающих полученные в других экспериментах [17, 18].
Так как на разработанной нами установке возможно полное воспроизведение заданных условий по свету, температуре и обеспеченностью углекислотой в разных секциях, то было возможно провести сравнение в минимально необходимых трех повторностях двух сестринских штаммов C. zofingiensis, полученных в коллекции IPPAS из разных мест в разное время и поддерживаемых на протяжении десятилетий на разных средах. Сравнение ростовых кривых и биохимического состава показало отсутствие значительных различий между штаммами. Оба штамма оказались способными к вторичному каротиногенезу и накоплению липидов, т.е. две основные биотехнологичеки ценные характеристики C. zofingiensis [16] были сохранены в обоих штаммах.
Таким образом, представленная нами лабораторная система имеет простое исполнение и собрана из доступных материалов (см. раздел 2.1), поэтому воспроизведение ее аналогов возможно практически в любой лаборатории. Лабораторная установка имеет широкий спектр применения, примеры которого приведены в данной работе.
Работа выполнена на базе “Научно-производственного биотехнологического комплекса для проведения работ по изучению, сохранению и практическому применению культивируемых клеток и органов высших растений и микроводорослей” при финансовой поддержке Мегагранта Правительства Российской Федерации, Соглашение № 075-15-2019-1882 (эксперименты с микроводорослями и цианобактериями), а также в рамках выполнения темы № 122042600086-7 государственного задания Министерства науки и высшего образования России (температурные тесты, тесты на стерильность и перемешивание).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Spolaore P., Joannis-Cassan C., Duran E., Isambert A. Commercial applications of microalgae // J. Biosci. Bioeng. 2006. V. 101. P. 87. https://doi.org/10.1263/jbb.101.87
Chisti Y. Raceways-based production of algal crude oil // Green. 2013. V. 3. P. 195. https://doi.org/10.1515/green-2013-0018
Hoang A.T., Sirohi R., Pandey A., Nižetić S., Lam S.S., Chen W.-H., Luque R., Thomas S., Arıcı M., Pham V.V. Biofuel production from microalgae: challenges and chances // Phytochem. Rev. 2022. https://doi.org/10.1007/s11101-022-09819-y
Zorina A.A., Bedbenov V.S., Novikova G.V., Panichkin V.B., Los D.A. Involvement of serine/threonine protein kinases in the cold stress response in the cyanobacterium Synechocystis sp. PCC 6803: Functional characterization of SpkE protein kinase // Mol. Biol. 2014. V. 48(3). P. 390. https://doi.org/10.1134/S0026893314030212
Sinetova M.A., Los D.A. Systemic analysis of stress transcriptomics of Synechocystis reveals common stress genes and their universal triggers // Mol. BioSyst. 2016. V. 12. P. 3254. https://doi.org/10.1039/C6MB00551A
Mironov K.S., Sinetova M.A., Shumskaya M., Los D.A. Universal molecular triggers of stress responses in cyanobacterium Synechocystis // Life. 2019. V. 9. P. 67. https://doi.org/10.3390/life9030067
Tsygankov A.A. Laboratory scale photobioreactors. // Appl. Biochem. Microbiol. 2001. V. 37(4). P. 333. https://doi.org/10.1023/A:1010266116747
Benner P., Meier L., Pfeffer A., Kruger K., Oropeza Vargas J.E., Weuster-Botz D. Lab-scale photobioreactor systems: principles, applications, and scalability // Bioprocess Biosyst. Eng. 2022. V. 45. P. 791. https://doi.org/10.1007/s00449-022-02711-1
Владимирова М.Г., Семененко В.Е. Интенсивная культура одноклеточных водорослей. М.: Академия наук СССР, 1962. 58 с.
Абдуллаев А.А., Семененко В.Е. Интенсивная культура Dunaliella salina Teod. и некоторые ее физиологические характеристики // Физиология растений. 1974. Т. 21. P. 1145.
Fuchs T., Arnold N.D., Garbe D., Deimel S., Lorenzen J., Masri M., Mehlmer N., Weuster-Botz D., Bruck T.B. A newly designed automatically controlled, sterilizable flat panel photobioreactor for axenic algae culture // Front. Bioeng. Biotechnol. 2021. V. 9. P. 697354. https://doi.org/10.3389/fbioe.2021.697354
Sinetova M.A., Sidorov R.A., Starikov A.Y., Voronkov A.S., Medvedeva A.S., Krivova Z.V., Pakholkova M.S., Bachin D.V., Bedbenov V.S., Gabrielyan D.A., Zayadan B.K., Bolatkhan K., Los D.A. Assessment of biotechnological potential of cyanobacteria and microalgae strains from the IPPAS culture collection // Appl. Biochem. Microbiol. 2020. V. 56. P. 36. https://doi.org/10.1134/S0003683820070030
Nowicka-Krawczyk P., Mühlsteinová R., Hauer T. Detailed characterization of the Arthrospira type species separating commercially grown taxa into the new genus Limnospira (Cyanobacteria) // Sci. Rep. 2019. V. 9. P. 694. https://doi.org/10.1038/s41598-018-36831-0
Furmaniak M.A., Misztak A.E., Franczuk M.D., Wilmotte A., Waleron M., Waleron K.F. Edible cyanobacterial genus Arthrospira: Actual state of the art in cultivation methods, genetics, and application in medicine // Front. Microbiol. 2017. V. 8. P. 2541. https://doi.org/10.3389/fmicb.2017.02541
Fučíková K., Lewis L. Intersection of Chlorella, Muriella and Bracteacoccus: Resurrecting the genus Chromochloris Kol et Chodat (Chlorophyceae, Chlorophyta) // Fottea. 2012. V. 12. P. 83. https://doi.org/10.5507/fot.2012.007
Liu J., Sun Z., Gerken H., Liu Z., Jiang Y., Chen F. Chlorella zofingiensis as an alternative microalgal producer of astaxanthin: biology and industrial potential // Mar. Drugs. 2014. V. 12. P. 3487. https://doi.org/10.3390/md12063487
Mahajan G., Kamat M. γ-Linolenic acid production from Spirulina platensis // Appl. Microbiol. Biotechnol. 1995. V. 43. P. 466. https://doi.org/10.1007/bf00218450
Golmakani M.T., Rezaei K., Mazidi S., Razavi S.H. γ-Linolenic acid production by Arthrospira platensis using different carbon sources // Eur. J. Lipid Sci. Technol. 2012. V. 114. P. 306. https://doi.org/10.1002/ejlt.201100264
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Рис. 1. Тест стерильности
Инструменты
Физиология растений