Физиология растений, 2023, T. 70, № 2, стр. 148-159
Возможные физиологические механизмы фотоповреждения листьев растений в условиях круглосуточного освещения
Т. Г. Шибаева a, *, А. В. Мамаев a, А. Ф. Титов a
a Федеральное государственное бюджетное учреждение науки Институт биологии
Карельского научного центра Российской академии наук, Федеральный исследовательский центр
“Карельский научный центр РАН”
Петрозаводск, Россия
* E-mail: shibaeva@krc.karelia.ru
Поступила в редакцию 15.10.2022
После доработки 19.10.2022
Принята к публикации 20.10.2022
- EDN: GKXQOW
- DOI: 10.31857/S0015330322600541
Аннотация
В противоположность естественному фотопериоду, включающему чередование дня и ночи в суточном цикле, круглосуточное освещение обеспечивает непрерывное поступление световой энергии, необходимой для фотосинтеза, вызывает постоянное фотоокислительное воздействие, сигнальное воздействие на фоторецепторы и приводит к рассогласованию внутренних (циркадных) биоритмов с внешним циклом свет/темнота (циркадная асинхрония). У многих видов растений в условиях круглосуточного освещения развивается характерный и потенциально летальный межжилковый хлороз и некроз. Данный феномен (фотоповреждение листьев растений в условиях длинных фотопериодов, включая круглосуточное освещение) был описан более 90 лет назад, однако причины этого до сих пор не вполне ясны. Хотя понимание его биологической природы важно не только в теоретическом плане, но и с практической точки зрения, поскольку выращивание растений в условиях круглосуточного освещения при относительно невысокой плотности потока фотонов считается потенциально одним из наиболее эффективных способов экономии ресурсов и повышения продуктивности растений в теплицах и на фабриках растений с искусственным освещением. В обзоре обобщены и проанализированы имеющиеся на сегодняшний день литературные и собственные данные в поддержку или опровержение гипотезы о накоплении углеводов и, в частности, гипераккумуляции крахмала, в листьях как основной причине появления фотоповреждений у растений, находящихся в условиях круглосуточного освещения или длинных фотопериодов. Проведенный анализ большого числа работ свидетельствует о том, что накопление углеводов не является главной и тем более единственной причиной повреждения листьев растений при круглосуточном освещении, хотя и исключить роль этого фактора в развитии фотоповреждений тоже нельзя. По мнению авторов, в процессе появления и развития фотоповреждений, вызванных круглосуточным освещением, участвует не один, а несколько факторов одновременно (фотоокисление, стресс-индуцированное старение, циркадная асинхрония и др.). При этом удельный вклад каждого из них может существенно варьировать в зависимости от биологических особенностей объекта (видовая и сортовая принадлежность, возраст и фаза развития) и условий внешней среды.
ВВЕДЕНИЕ
Свет необходим фотосинтезирующим организмам для нормальной жизнедеятельности как источник энергии, обеспечивающей многие их функции и потребности. Вместе с тем, избыток света может быть опасен и вреден для них. Хорошо известно, что повышение фотосинтетической активности растений с увеличением освещенности достигает в определенный момент предела (светового насыщения), после чего избыток света выступает как агрессивный фактор, вызывая фотоингибирование, фотодинамическое разрушение фотосинтетического аппарата и даже гибель клеток [1, 2]. Помимо высокой освещенности, избыток света может возникать в условиях длинных фотопериодов. Многочисленные данные свидетельствуют о негативном влиянии длинных фотопериодов (>17–20 ч), и прежде всего 24-часового, на рост и продуктивность растений [3–5]. У многих видов растений в условиях круглосуточного освещения (СL, от англ. Continuous Lighting) развивается характерный и потенциально летальный межжилковый хлороз и некроз (рис. 1). Симптомы светового повреждения листьев при CL отмечены у таких культур как томат [3, 5–31 ], баклажан [28, 32–34], сладкий перец [14, 15, 28, 35–37], огурец [31, 38, 39], картофель [40–44] и некоторых других. В качестве возможных причин светового повреждения называют фотоокисление, индукцию процесса старения, циркадную асинхронию и др. [5, 20, 24]. Но в большинстве работ [3, 6, 11–13, 15, 16, 18, 32, 45, 46] авторы называют (или предполагают) главным фактором, вызывающим появление и развитие повреждений растений под влиянием CL, накопление в листьях большого количества крахмала и растворимых сахаров. В то же время имеется достаточно большое число работ [6, 20, 24, 25, 38], в которых связь между развитием хлороза и накоплением крахмала в условиях длинных фотопериодов не только не подтверждается, но даже опровергается.
Рис. 1.
Симптомы светового повреждения листьев растений томата (хлороз) (а), огурца (хлороз) (б) и баклажана (хлороз, некроз) (в), выращенных в условиях 24-часового фотопериода и постоянной температуры 23°С.

Таким образом, несмотря на то, что феномен светового повреждения листьев у растений, находящихся в условиях CL был описан более 90 лет назад, причины этого до сих пор не вполне ясны. Хотя понимание биологической природы данного феномена важно не только в теоретическом плане, но и с практической точки зрения, поскольку выращивание растений в условиях CL при относительно невысокой плотности потока фотонов считается потенциально одним из наиболее эффективных способов экономии ресурсов и повышения продуктивности растений.
Данная работа посвящена обзору имеющихся на сегодняшний день литературных и собственных данных, поддерживающих или, наоборот, не поддерживающих гипотезу о накоплении углеводов и, в частности, гипераккумуляции крахмала, в листьях как основной причине появления фотоповреждений у растений, находящихся в условиях CL или длинных фотопериодов.
ДАННЫЕ В ПОДДЕРЖКУ ГИПОТЕЗЫ О ГИПЕРАККУМУЛЯЦИИ КРАХМАЛА КАК ОСНОВНОЙ ПРИЧИНЕ ФОТОПОВРЕЖДЕНИЯ ЛИСТЬЕВ
В целом ряде работ, выполненных на томатах в условиях длинных фотопериодов, отмечалось высокое содержание крахмала и растворимых сахаров в листьях растений [10–12, 18, 47, 48] и было высказано предположение, что развитие световых повреждений, таких как хлороз и некроз листьев, связано с накоплением именно этих соединений. Было, в частности, установлено, что в молодых листьях томата в условиях CL ассимиляция СО2 и содержание крахмала увеличиваются в течение первых 6 сут., а затем, с появлением повреждений, поглощение СО2 постепенно снижается, тогда как содержание крахмала продолжает увеличиваться, хотя и с меньшей скоростью [11]. Исследования на других видах растений подтвердили гипотезу о существовании определенной связи между развитием хлороза в условиях CL и накоплением крахмала и сахаров. Так, CL вызывало на 4-5 сут. развитие хлороза листьев у баклажана, что совпадало с пиком накопления крахмала, глюкозы и фруктозы, указывая, что после того как растения достигают максимума в содержании крахмала, у них начинает развиваться хлороз [32]. Что касается сахарозы, то данные относительно ее содержания более противоречивы. В одних работах наблюдалось увеличение содержания сахарозы наряду с крахмалом [12, 49], тогда как другие авторы [11, 32, 50, 51] отмечали более низкое содержание сахарозы в листьях при CL. В ряде исследований было показано, что у растений томата [11, 12, 52] и баклажана [32] в условиях CL, а также у огурца при низкотемпературном стрессе [53] избыточное накопление крахмала в листьях может нарушать структуру и функциональную активность хлоропластов, приводя к развитию хлороза. Увеличение содержания крахмала при длинных фотопериодах происходит, вероятно, в результате его постепенного ежедневного накопления, пока потребности акцепторов удовлетворяются за счет пулов гексоз и сахарозы [12, 32, 54, 55].
Как известно, органы, производящие и потребляющие ассимиляты, образуют в растении единую, хорошо сбалансированную донорно-акцепторную систему [56, 57]. Первичными донорами являются фотосинтезирующие взрослые зеленые листья, снабжающие ассимилятами все другие органы и ткани, а гетеротрофные части растения, как правило, выступают в роли акцепторов. Интенсивность, направленность транспорта ассимилятов и их распределение между органами и тканями контролируются функциональной активностью как донорных, так и акцепторных органов, причем наиболее эффективно − при одновременном участии этих двух элементов донорно-акцепторной системы [58]. В условиях CL доноры обеспечивают непрерывное поступление сахаров. Очевидно, что при этом не происходит пропорционального увеличения запроса со стороны акцепторов [59] и/или способности экспортировать сахарозу [3, 45], поэтому возникающий избыток сахаров не может быть экспортирован и остается в листьях. Так, снижение запроса со стороны акцептора вследствие уменьшения плодонагрузки у растений томата и перца (только один плод в кисти) не сказывалось на накоплении крахмала и сахаров при 14- и 24-часовом фотопериодах и не увеличило степень повреждения, вызванного СL [18, 36]. Следовательно, лимитирующим фактором может выступать неспособность листа экспортировать фотоассимиляты. Имеются также данные, что неспособность экспортировать продукты распада крахмала может вызывать хлороз и деградацию хлоропластов у арабидопсиса [60]. Сходным образом мутанты tie-dyed1 кукурузы, которые неспособны экспортировать углеводы наравне с немутантными растениями, демонстрировали сильный светозависимый хлороз, предположительно связанный с накоплением углеводов [61–63]. Было также показано, что высокий запрос со стороны акцептора может, наоборот, снижать повреждение. При выращивании в условиях CL двух видов лука, у вида Allium cepa L., который формировал луковицу, не наблюдалось ингибирование фотосинтеза, в то время как у неформирующего луковицу A. fistulosum L. отмечено снижение скорости фотосинтеза [59]. Сходные результаты были получены на картофеле [64]. В обоих случаях хороший рост в условиях СL был связан с высоким запросом акцептора, т.е. у луковиц и клубней. Таким образом, имеются данные, свидетельствующие о том, что повреждения, вызванные СL, положительно коррелируют с гипераккумуляцией углеводов и отрицательно с аттрагирующей активностью акцептора.
У томата помимо повышения содержания крахмала и растворимых сахаров и развития хлороза СL вызывало снижение скорости фотосинтеза и активности фермента сахарозофосфатсинтазы [65]. Этот фермент является ключевым в синтезе сахарозы (главного экспортируемого сахара) и может влиять на распределение углеводов. Например, показано, что у трансгенных растений томата со сверхэкспрессией сахарозофосфатсинтазы, было снижено содержание крахмала, увеличено содержание сахарозы и скорости фотосинтеза по сравнению с обычными растениями [66–68]. На основании этого высказано предположение, что накопление крахмала и сахаров в условиях СL может быть вызвано ограниченным синтезом сахарозы вследствие снижения активности данного фермента. Однако изменение его активности происходило на 6-8 нед. воздействия СL на растения, то есть примерно тогда, когда развивался хлороз листьев, а содержание крахмала и гексоз в листьях увеличилось значительно раньше (в первые 4 нед. эксперимента). Очевидно, что снижение активности фермента произошло после увеличения содержания крахмала и гексоз, поэтому трудно предполагать, что именно он ответственен за их накопление. Тем не менее, возможно, что активность сахарозофосфатсинтазы in vivo лимитирована, что может объяснить накопление гексоз. Это предполагает, что лимитирующим этапом экспорта фотоассимилятов у томата является синтез сахарозы и это объясняет отсутствие роста и увеличения продуктивности в условиях СL. Кроме того, повышенный уровень гексоз в цитоплазме по принципу обратной связи ограничивает экспорт триозофосфатов (промежуточных продуктов фотосинтеза) из хлоропластов, которые затем перенаправляются на синтез крахмала, обеспечивая увеличение его содержания в пластидах [3]. Более того, накопление крахмала “перегружает” цикл Кальвина, вызывая постепенное снижение ассимиляции СО2. Возможно, что подобная “перегрузка” цикла Кальвина может уменьшать использование АТФ и НАДФН, образованных в световой фазе фотосинтеза, вызывая тем самым “перегрузку” ЭТЦ хлоропластов, фотоокисление хлорофилла и снижение его содержания, объясняя таким образом наблюдаемый хлороз листьев [3]. На основании этих исследований был сделан вывод, что в негативных эффектах длинных фотопериодов на растения томата определенную роль может играть углеводный обмен. У растений перца в тех же условиях влияние фотопериода на углеводный обмен не наблюдалось и это может объяснять их бóльшую, чем томатов, устойчивость к СL [48].
В одной из недавних работ показана возможность выращивания растений огурца (сорт Bonwell RZ F1 mini) в течение всего продукционного цикла с использованием дополнительного освещения светодиодными лампами, обеспечивающего 24-часовой фотопериод [69]. В отсутствие хлороза урожай растений, выращенных в условиях СL, был сходен с контролем, но экономически такой режим был более выгодным, т.к. позволил сократить не только начальные затраты на осветительные приборы, но и операционные затраты за счет перераспределения освещения на ночное время, когда стоимость электроэнергии ниже благодаря ночным тарифам. В отличие от огурца, в таких же условиях у растений томата развивался хлороз листьев. Авторы подчеркивают, что эти две важные тепличные культуры (томат и огурец) по-разному реагируют на схожие световые условия, что возможно связано с различиями в их углеводном обмене, а именно в процессе экспорта углерода. У томата основным транспортным углеводом является сахароза, а у огурца − раффиноза и стахиоза [70, 71]. Кроме того, у томатов работает механизм апопластной загрузки флоэмы, в то время как у огурца происходит симпластная загрузка. Эти два механизма существенно отличаются, причем апопластная загрузка флоэмы представляет собой более сложный путь с участием ферментов и транспортеров, являющихся потенциальными пунктами регуляции [70, 72], а симпластная загрузка флоэмы более “рудиментарна” с минимальным уровнем регуляции [71]. Благодаря разнице в способе загрузки флоэмы и образованию раффинозы и стахиозы огурец отличается быстрым экспортом недавно связанного углерода, сводя тем самым к минимуму накопление углеводов (крахмала) в листьях [73]. Следовательно, при обсуждении избыточного накопления углеводов в листьях в условиях СL и его потенциальных последствий нельзя упускать из виду скорость оттока сахаров из листьев. Предполагается, что у огурца избыточное накопление сахаров проявляется в меньшей степени, чем у томата, именно благодаря высокой скорости экспорта, что делает огурец более устойчивым к СL [69].
Интересная серия опытов для проверки обсуждаемой гипотезы была проведена на растениях баклажана, которые выращивали при СL, но лишая их СО2 в атмосфере на 6 или 12 ч ежесуточно [32]. В отсутствие СО2 в атмосфере в течение 12 ч, крахмала и гексоз накапливалось меньше, чем при постоянном присутствии СО2 и хлороз листьев не развивался. Содержание крахмала и сахарозы в варианте с 6-часовым отсутствием СО2 было промежуточным и хлороз развивался на 4 дня позже, чем у растений, не испытывавших дефицита СО2. Уменьшение времени снабжения СО2 привело с снижению фотосинтетической активности листьев, несмотря на то что уровень освещенности был постоянным. В этой ситуации накопление крахмала в хлоропластах до критического уровня заняло больше времени. В результате опытов был сделан вывод, что дестабилизация углеводного обмена и последующее накопление фотоассимилятов в листьях, в частности крахмала, может играть основную роль в развитии хлороза при длинных фотопериодах [32].
Помимо прочего, накопление углеводов в условиях СL может вызывать нарушения и повреждения в растениях вследствие усиления генерации АФК [5]. В разных условиях накопление углеводов ассоциируется с подавлением фотосинтеза, в том числе при длительной экспозиции при высокой концентрации СО2 [74], дефиците магния [75], сахарной подкормке [76] и мутациях, влияющих на обмен углеводов [62, 63]. Фотосинтетическая регуляция, включающая подавление фотосинтеза и ретроградный сигнальный путь − это ряд краткосрочных и долгосрочных адаптационных изменений, которые оказывают на фотосинтез регулирующее воздействие таким образом, что образование АТФ и НАДФН в световых реакциях сбалансировано со скоростью их утилизации, предотвращая сверхвосстановление компонентов хлоропластной ЭТЦ [77]. Накопление углеводов, вызванное CL, ведет к чрезмерному восстановлению акцепторов электронов, в результате чего фотосинтетическая ЭТЦ передает электроны на молекулярный кислород, генерируя АФК, вызывающие окислительное повреждение [5, 75]. С другой стороны, растворимые сахара, такие как сахароза, глюкоза и фруктоза, когда они присутствуют в более высокой концентрации, могут нейтрализовать АФК и предотвращать фотоповреждения за счет снижения окислительного пентозофосфатного пути и усиления биосинтеза аскорбиновой кислоты и каротиноидов [78].
Ретроградные сигналы (от пластид к ядру) оказывают регулирующее воздействие на экспрессию генов PhANGs (photosynthesis-associated nuclear genes), направленное на согласование потребностей и состояния хлоропластов [79, 80]. Недавние исследования показывают, что ретроградный сигнальный путь пересекается с сетью светового сигналинга [81–83]. Например, на дисфункциональных хлоропластах показано, что пластидный сигнал может перенаправить световой сигнал так, что вместо индукции экспрессии происходит репрессия некоторых генов, ассоциированных с фотосинтезом. Отчасти это может объяснять влияние спектрального состава света [3, 7, 16, 33, 84, 85] на степень повреждений, вызванных СL.
Таким образом, логично предположить, что СL изменяет редокс-состояние компонентов ЭТЦ хлоропластов, как следствие накопления углеводов и сверхвосстановления акцепторов электронов, приводя к подавлению фотосинтеза и развитию фотоповреждений листьев [20]. В подтверждение развития окислительного стресса у растений в условиях СL в ряде работ был показан более высокий уровень активности антиоксидантных ферментов при выращивании растений в условиях 24-часового фотопериода по сравнению с обычными фотопериодами [24, 34, 86].
Еще один возможный путь влияния избытка крахмала на фотоповреждения растений связан с тем, что на углеводный обмен оказывает влияние циркадная ритмика [87–89]. Высказано предположение, что у растений, выращиваемых в условиях СL, непрерывное поступление сахарозы может нарушать синхронизацию циркадных ритмов побегов и корней [90].
ДАННЫЕ, НЕ ПОДДЕРЖИВАЮЩИЕ ГИПОТЕЗУ О ГИПЕРАККУМУЛЯЦИИ КРАХМАЛА КАК ОСНОВНОЙ ПРИЧИНЕ ФОТОПОВРЕЖДЕНИЯ ЛИСТЬЕВ
В предыдущем разделе приведены примеры работ, в которых появление хлороза, по мнению авторов, прямо или косвенно было обусловлено избыточным накоплением крахмала и/или других углеводов. Однако, анализ литературы показывает, что точно также имеется значительное количество работ, результаты которых позволяют высказывать гипотезы, отводящие накоплению углеводов второстепенную роль в развитии хлороза в условиях длинных фотопериодов или даже вообще отрицающие их участие. Так, например, у растений огурца в условиях СL признаки хлороза отмечались через 4 нед., а через 5 нед. наблюдался сильный хлороз и некроз листьев [38]. Однако содержание крахмала в пробах, взятых через 4 и 5 нед. СL было даже ниже, чем в листьях растений, выращиваемых при 18-часовом фотопериоде. Эти данные не поддерживают гипотезу о гипераккумуляции углеводов как причине развития хлороза, но сами авторы не исключают, что это может быть связано с тем, что пробы были взяты на довольно поздних стадиях развития повреждений, а содержание углеводов до появления хлороза не анализировалось.
В листьях картофеля ассимиляция СО2 и содержание крахмала сильно снижались после появления повреждений, вызванных СL [42]. Отмечено, что в первые 5 сут в условиях СL при постоянной температуре сохранялась нормальная структура хлоропластов, способность к фотосинтезу и синтезу крахмала, но затем большие участки листьев резко теряли способность к ассимиляции СО2, поддержанию резервов крахмала и сохранению целостности мембран хлоропластов [43]. При этом структура хлоропластов в отдельных участках листа заметно деградировала до появления видимых признаков повреждения. Кроме того, было показано [42, 43], что снижение ассимиляции СО2 листьями картофеля не было связано с ограничениями со стороны устьиц. Следовательно, ассимиляция СО2 могла снижаться вследствие того, что большие участки листьев утрачивали способность к фотосинтезу, а не из-за ограниченного газообмена. Уменьшение ассимиляции СО2, содержания крахмала и нарушение целостности мембран хлоропластов, проявившиеся на 6 или 7 сут, были самыми ранними событиями, четко ассоциированными с появлением повреждений. Интересно, что полная потеря функций хлоропластов на большой площади листа картофеля никак не отразилась на процессе роста листа. В условиях СL у поврежденных листьев увеличение площади происходило с такой же скоростью и до такого же размера, как у неповрежденных листьев [42].
Изучение чувствительных и устойчивых к СL сортов картофеля показало, что у чувствительных сортов скорость фотосинтеза и биомасса растений в условиях СL были значительно ниже, чем у устойчивых сортов, но при этом концентрация крахмала у них была в 10 раз меньше [42]. Однако, по концентрации растворимых сахаров две группы сортов не различались. Эти результаты показывают, что более низкая скорость ассимиляции СО2 и торможение роста у чувствительных сортов не связаны с избыточным накоплением углеводов в листьях.
В серии работ на томате авторы [24, 25] наблюдали нарушение суточной динамики содержания углеводов в условиях CL. При 24-часовом фотопериоде уровень содержания сахаров практически не менялся в суточном цикле из-за непрерывного поступления фотоассимилятов, что может быть связано с ингибированием под влиянием света активности ферментов, расщепляющих углеводы [91]. Однако гипераккумуляции углеводов при этом не происходило, что позволило предположить, что снижение скорости фотосинтеза и повреждение листьев при СL не были связаны с накоплением углеводов. Снижение скорости фотосинтеза у растений томата в условиях СL при постоянной температуре было вызвано не закрытием устьиц и накоплением углеводов, а уменьшением карбоксилирования и регенерации РБФК/О [25]. Выращивание томата в условиях СL с применением переменных температур дня и ночи (термопериода) с градиентом 10°С значительно снижало степень повреждения листьев, однако содержание углеводов в них было сопоставимо или даже выше, чем у растений, выращенных при постоянной температуре, у которых развивался сильный хлороз [25].
В работах с использованием монохроматического света было показано, что СL синим светом приводило к развитию сильного хлороза листьев томата [92]. При этом содержание крахмала и растворимых сахаров в листьях этих растений было ниже, чем у растений с более слабой степенью хлороза (при облучении монохроматическим красным светом или красно-синими светодиодными лампами). В серии опытов с использованием монохроматического света разных спектров и разных соотношений (1 : 1, 1 : 3) красного и синего спектров линейный регрессионный анализ между такими показателями как доля площади хлоротичных участков листьев и содержанием крахмала и растворимых сахаров через 14 дней действия СL показал отсутствие корреляции, указывая на то, что разная степень хлороза не объясняется различиями в содержании углеводов. При этом была выявлена высокая корреляция (коэффициенты детерминации 0.88−0.95) между содержанием глюкозы и фруктозы и степенью эпинастии листьев. На основании полученных данных, авторы [92] пришли к заключению, что хлороз листьев и эпинастии, возникающие в условиях СL являются двумя типами ответных реакций растений, не связанными друг с другом и управляемыми разными механизмами. Кроме того, в этих работах [25, 92] было показано, что степень хлороза листьев не коррелирует с содержанием H2O2 и скоростью генерации ${\text{O}}_{2}^{{ - \,\centerdot }}$, что в противоположность ранее высказанным предположениям исключает их непосредственное участие в развитии фотоповреждений листьев.
Надо отметить, что в работах, подтверждающих гипотезу о гипераккумуляции крахмала как причине фотоповреждений листьев у чувствительных видов [11, 15, 18, 32], поддержание одинакового уровня освещенности в вариантах опытов с разной продолжительностью фотопериода привело к различиям в интеграле дневного освещения (ИДО) (ИДО = фотопериод ‧ ФАР). Растения, выращенные в условиях СL, суммарно получали больше света в день, что могло увеличить скорость фотосинтеза и привести к большему накоплению углеводов в листьях по сравнению с растениями, получающими меньший ИДО. В работах на томате [24, 46], огурце [38] и картофеле [42], где ключевая роль углеводов в развитии фотоповреждений поставлена под вопрос, сохранялся один и тот же ИДО за счет использования разных уровней освещенности в вариантах опыта с разными фотопериодами. Возможно, различия в постановке экспериментов могут частично объяснить несовпадение результатов и выводов. В наших экспериментах было показано [31], что при разном ИДО растения томата и огурца в условиях 24-часового фотопериода имели значения сухой массы листа на единицу площади (LMA, от англ. Leaf Mass per Area) на 31 и 14% выше, чем при 14-часовом фотопериоде, соответственно. При этом содержание хлорофилла снижалось на 38 и 24% и наблюдался хлороз листьев. В опытах, когда ИДО был одинаковым, у томата значения LMA в условиях СL были ниже на 25% по сравнению с 14 ч фотопериодом, а у огурца не изменялись. При этом также наблюдался хлороз и содержание хлорофилла при СL было ниже на 27% у обоих видов. Следовательно, деградация хлорофилла и развитие хлороза листьев происходили независимо от накопления углеводов в листьях, о чем можно косвенно судить по значениям LMA. В серии экспериментов со взрослыми растениями томата и баклажана мы имели возможность измерить LMA у хлоротичных и зеленых (без признаков хлороза) листьев, находящихся в условиях СL [30]. Наличие зеленых листьев связано с существованием возрастной изменчивости в чувствительности растений к СL. Взрослые растения становятся менее чувствительными и хлороз листьев не развивается (рис. 2). Значения LMA у хлоротичных листьев были на 45 и 12% выше у томата и баклажана по сравнению с 16-часовым фотопериодом (при разном ИДО). Содержание хлорофилла при этом было на 30 и 23% ниже, соответственно. В этих же условиях у зеленых листьев томата и баклажана значения LMА были в 2 и 1.5 раза, соответственно, выше таковых при 16-часовом фотопериоде. Содержание хлорофилла было ниже на 19 и 15% у томата и баклажана, но признаков хлороза и некроза не наблюдалось. Таким образом, и в этих опытах не наблюдалось связи между накоплением углеводов в листьях и развитием фотоповреждений.
Рис. 2.
Растение баклажана, выращенное в течение 3 недель при 16-часовом фотопериоде и затем в течение 4 недель в условиях 24-часового фотопериода и постоянной температуры 23°С.

Исследования с использованием молекулярно-биологических методов показали, что устойчивость к СL у дикого томата обусловлена геном LHCB type III CAB-13, связь которого с углеводным обменом не установлена [19]. Этот ген кодирует белок светособирающего комплекса ФС I.
Вместо подавления процесса фотосинтеза по принципу обратной связи у растений, выращиваемых в условиях СL, высокая концентрация сахаров может быть триггером старения [5]. Было высказано предположение, что повреждения, вызванные СL, имеют признаки ускоренного старения [17, 43]. СL вызывает повышение концентрации сахаров и этилена – потенциальных триггеров старения листьев [93, 94]. Однако заметим, что гипотеза, предполагающая, что высокие концентрации сахаров запускают старение листьев, противоречива. В обзоре [95] рассмотрены две гипотезы: первая о том, что программируемая клеточная гибель может быть вызвана углеводным голоданием листьев и, вторая – накоплением углеводов в клетках листьев. Но ни одна из них не нашла достаточного экспериментального подтверждения [5].
Развитие симптомов повреждений при СL в листьях чувствительных сортов картофеля действительно напоминает процесс старения, когда основные белковые и углеводные компоненты листа деградируют и продукты их распада перемещаются в другие части растения [96]. Возможно, что симптомы повреждений, вызванных СL, сходны с другими похожими на старение событиями, особенно теми, которые индуцированы разными видами стресса, поскольку хорошо известно, что стресс может привести к быстрой утрате фотосинтетической способности, потере содержания крахмала, появлению некроза и старению тканей листа. Нельзя также исключить, что все симптомы повреждений, описываемые при действии на растения СL на самом деле носят вторичный характер и обусловлены каким-то пока не установленным первичным событием.
ЗАКЛЮЧЕНИЕ
В условиях CL растения попадают в ситуацию, с которой они не встречаются в природных условиях. В противоположность естественному фотопериоду, включающему чередование дня и ночи в суточном цикле, CL обеспечивает непрерывное поступление световой энергии, необходимой для фотосинтеза, вызывает постоянное фотоокислительное воздействие и постоянное сигнальное воздействие на фоторецепторы (если в какой-то момент не произойдет их десенситизация), а также может приводить к рассогласованию внутренних (циркадных) биоритмов с внешним циклом свет/темнота (циркадная асинхрония) (рис. 3). Поскольку влияние энергетического и сигнального компонентов CL на растения происходит одновременно, то однозначно определить какой из них является первопричиной повреждения листьев, затруднительно. Энергетический компонент может вызывать повреждения, приводя к углеродному дисбалансу и в результате фотоокислению. Сигнальный компонент также может играть важную роль в развитии повреждений, на что указывает тот факт, что при выращивании растений в условиях термопериода (переменных суточных температур) у чувствительных растений степень хлороза намного ниже или он не развивается вообще [3, 4, 25, 26, 33, 43, 97–99]. Участие циркадной асинхронии в развитии фотоповреждений листьев под влиянием CL также находит в последние годы все новые подтверждения [5, 20]. Наконец, не исключено, что хлороз, наблюдаемый в условиях CL у некоторых чувствительных к избыточному свету видов растений, может быть проявлением супрессированной светозависимой хлорофиллдефектности [28].
Рис. 3.
Предполагаемые механизмы, обуславливающие подавление фотосинтеза и повреждение листьев растений в условиях круглосуточного освещения (по Velez-Ramirez et al., 2011, с модификациями).
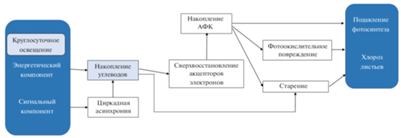
В целом, анализ имеющихся литературных и собственных данных приводит нас к выводу, что поскольку влияние разных компонентов (составляющих) CL на растения происходит одновременно, то наиболее вероятно, что все они участвуют в той или иной степени в фотоповреждении листьев. Хотя в каждой конкретной ситуации удельный вклад любого из них может существенно варьировать, в зависимости от биологических особенностей объекта (вида, сорта, генотипа) и/или от условий внешней среды. Поэтому накопление углеводов не может, на наш взгляд, рассматриваться в качестве главной и тем более единственной причины повреждения листьев растений в условиях CL и длинных фотопериодов. Но и исключать роль этого фактора в появлении и развитии фотоповреждений листьев тоже нельзя.
Следовательно, установление причин, определяющих появление и развитие повреждений листьев у растений в условиях CL является сложной и многоплановой задачей, требующей продолжения исследований. Очевидно, что ее решение будет иметь не только важное фундаментальное, но и прикладное значение, т.к. понимание биологической природы данного феномена получит свое отражение в сельскохозяйственной и растениеводческой практике, в частности, при выращивании в условиях контролируемой внешней среды овощных, цветочных и декоративных растений, масштабы производства которых во всем мире постоянно растут.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 20-016-00033а. Работа выполнена с использованием научного оборудования Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук” в рамках государственного задания КарНЦ РАН (FMEN-2022-004).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов.
Список литературы
Demmig-Adams B., Adams W.W. Photoprotection and other responses of plants to high light stress // Ann. Rev. Plant Physiol. Plant Mol. Biol. 1992. V. 43. P. 599. https://doi.org/10.1146/annurev.pp.43.060192.003123
Li Z., Wakao S., Fischer B.B., Niyogi K.K. Sensing and responding to excess light // Ann. Rev. Plant Biol. 2009. V. 60. P. 239. https://doi.org/10.1146/ annurev.arplant.58.032806.103844
Demers D.A., Gosselin A. Growing greenhouse tomato and sweet pepper under supplemental lighting: optimal photoperiod, negative effects of long photoperiod and their causes // Acta Hort. 2002. V. 580. P. 83. https://doi.org/10.17660/ActaHortic.2002.580.9
Sysoeva M.I., Markovskaya E.F., Shibaeva T.G. Plant under continuous light: a review // Plant Stress. 2010. V. 4. P. 5.
Velez-Ramirez A.I., van Ieperen W., Vreugdenhil D., Millenaar F.F. Plants under continuous light // Trends Plant Sci. 2011. V. 16. P. 310. https://doi.org/10.1016/j.tplants.2011.02.003
Arthur J.M. Plant growth in continuous illumination // Biological effects of radiation. V. 2 / Ed. B.M. Duggar. New York: McGraw-Hill Book Company. 1936. P. 715.
Arthur J.W., Guthrie J.D., Newell J.M. Some effects of artificial climates on the growth and chemical composition of plants // Amer. J. Bot. 1930. V. 17. P. 416. https://doi.org/10.2307/2435930
Withrow A.P., Withrow R.B. Photoperiodic chlorosis in tomato // Plant Physiol. 1949. V. 24. P. 657. https://doi.org/10.1104/pp.24.4.657
Hillman W.S. Injury of tomato plants by continuous light and unfavorable photoperiodic cycles // Amer. J. Bot. 1956. V. 43. P. 89. https://doi.org/10.2307/2438816
Ho L.C. The relationship between rates of carbon transport and of photosynthesis in tomato leaves // J. Exp. Bot. 1976. V. 27. P. 87. https://doi.org/10.1093/jxb/27.1.87
Bradley F.M., Janes H.W. Carbon partitioning in tomato leaves exposed to continuous light // Acta Hortic. 1985. V. 174. P. 293. https://doi.org/10.17660/ActaHortic.1985.174.37
Logendra S., Putman J.D., Janes H.W. The influence of light period on carbon partitioning, translocation and growth in tomato // Sci. Hort. 1990. V. 42. P. 75. https://doi.org/10.1016/0304-4238(90)90149-9
Vézina F., Trudel M.J., Gosselin A. Influence du mode d’utilisation de l’éclairage d’appoint sur la productivité et la physiologie de la tomate se serre // Can. J. Plant Sci. 1991. V. 71. P. 923.
Dorais M., Carpentier R., Yelle S., Gosselin A. Adaptability of tomato and pepper leaves to changes in photoperiod: effects on the composition and function of the thylakoid membrane // Physiol. Plant. 1995. V. 94. P. 692. https://doi.org/10.1111/j.1399-3054.1995.tb00986.x
Dorais M., Yelle S., Gosselin A. Influence of extended photoperiod on photosynthate particioning and export in tomato and pepper plants // N. Z. J. Crop Hortic. Sci. 1996. V. 24. P. 29. https://doi.org/10.1080/01140671.1996.9513932
Globig S., Rosen I., Janes H.W. Continuous light effects on photosynthesis and carbon metabolism in tomato // Acta Hort. 1997. V. 418. P. 141. https://doi.org/10.17660/ActaHortic.1997.418.19
Cushman K.E., Tibbitts T.W. The role of ethylene in the development of constant-light injury of potato and tomato // J. Am. Soc. Hort. Sci. 1998. V. 123. P. 239.
Demers D.A., Dorais M, Wien H.C., Gosselin A. Effects of supplemental light duration on greenhouse tomato (Lycopersicon exculentum Mill.) plants and fruit yields // Sci. Hort. 1998. V. 74. P. 295. https://doi.org/10.1016/S0304-4238(98)00097-1
Velez-Ramirez A.I., van Ieperen W., Vreugdenhil D., van Poppel P.M.J.A., Heuvelink E., Millenaar F.F. A single locus confers tolerance to continuous light and allows substantial yield increase in tomato // Nat. Commun. 2014. V. 5. P. 4549. https://doi.org/10.1038/ncomms5549
Velez-Ramirez A.I., Dünner-Planella G., Vreugdenhil D., Millenaar F.F., van Ieperen W. On the induction of injury in tomato under continuous light: circadian asynchrony as the main triggering factor // Funct. Plant Biol. 2017. V. 6. P. 597. https://doi.org/10.1071/FP16285
Velez-Ramirez A., Carreno-Quintero N., Vreugdenhil D., Millenaar F.F., van Ieperen W. Sucrose and starch content negatively correlates with PSII maximum quantum efficiency in tomato (Solanum lycopercicum) exposed to abnormal light/dark cycles and continuous light // Plant Cell Physiol. 2017. V. 58. P. 1339. https://doi.org/10.1093/pcp/pcx068
Matsuda R., Ozawa N., Fujiwara K. Effects of continuous lighting with or without a diurnal temperature difference on photosynthetic characteristics of tomato leaves // Acta Hort. 2012. V. 956. P. 165. https://doi.org/10.17660/ActaHortic.2012.956.16
Matsuda R., Yamano T., Murakami K., Fujiwara K. Effects of spectral distribution and photosynthetic photon flux density for overnight LED light irradiation on tomato seedling growth and leaf injury // Sci. Hort. 2016. V. 198. P. 363. https://doi.org/10.1016/j.scienta.2015.11.045
Hague M.S., Kjaer K.H., Rosenqvist E., Ottosen C.O. Continuous light increases growth, daily carbon gain, antioxidants, and alters carbohydrate metabolism in a cultivated and a wild tomato species // Front. Plant Sci. 2015. V. 6. P. 522. https://doi.org/10.3389/fpls.2015.00522
Hague M., de Sousa A., Soares C., Kjaer K.H., Fidalgo F., Rosenqvist E., Ottosen C.-O. Temperature variation under continuous light restores tomato leaf photosynthesis and maintains the diurnal pattern in stomatal conductance // Front. Plant Sci. 2017. V. 8. P. 1602. https://doi.org/10.3389/fpls.2017.01602
Ikkonen E.N., Shibaeva T.G., Rosenqvist E., Ottosen C.O. Daily temperature drop prevents inhibition of photosynthesis in tomato plants under continuous light // Photosynthetica. 2015. V. 53. P. 114. https://doi.org/10.1007/s11099-015- 0115-4
Shibaeva T.G., Sherudilo E.G. Immediate and delayed effects of diurnal temperature drops on growth and reproductive development of tomato plants grown under continuous lighting // Russ. J. Plant Physiol. 2015. V. 62. P. 328. https://doi.org/10.1134/S1021443715030176
Шибаева Т.Г., Титов А.Ф. Влияние круглосуточного освещения на пигментный комплекс растений сем. Solanaceae // Труды Карельского научного центра РАН. Серия Экспериментальная биология. 2017. № 5. С. 111. https://doi.org/10.17076/eb498
Shibaeva T.G., Mamaev A.V., Sherudilo E.G. Evaluation of a SPAD-502 plus chlorophyll meter to estimate chlorophyll content in leaves with interveinal chlorosis // Russ. J. Plant Physiol. 2020. V. 67. P. 690. https://doi.org/10.1134/S1021443720040160
Shibaeva T.G., Mamaev A.V., Sherudilo E.G. Ikkonen E.N., Titov A.F. Age-related changes in sensitivity of tomato (Solanum lycopersicum L.) leaves to continuous light // Russ. J. Plant Physiol. 2021. V. 68. P. 948. https://doi.org/10.1134/S1021443721040154
Shibaeva T.G., Mamaev A.V., Sherudilo E.G., Titov A.F. The role of photosynthetic daily light integral in plant response to extended photoperiods // Russ. J. Plant Physiol. 2022. V. 69. P. 7. https://doi.org/10.1134/S1021443722010216
Murage E., Watashiro N., Masuda M. Leaf chlorosis and carbon metabolism of eggplant in response to continuous light and carbon dioxide // Sci. Hort. 1996. V. 67. P. 27. https://doi.org/10.1016/S0304-4238(96)00930-2
Murage E.N., Sato Y., Masuda M. Influence of light quality, PPFD and temperature on leaf chlorosis of eggplants grown under continuous illumination // Sci. Hort. 1997. V. 68. P. 73. https://doi.org/ (96)00953-3https://doi.org/10.1016/S0304-4238
Murage E.N., Masuda M. Response of pepper and eggplant to continuous light in relation to leaf chlorosis and activities of antioxidative enzymes // Sci. Hort. 1997. V. 70. P. 269. https://doi.org/10.1016/S0304-4238(97)00078-2
Nilwik H.J.M. Growth analysis of sweet pepper (Capsicum annuum L.). Interacting effects of irradiance, temperature and plant age in controlled conditions // Ann. Bot. V. 48. P. 137. https://doi.org/10.1093/oxfordjournals.aob.a086107
Demers D.A., Gosselin A., Wien H.C. Effects of supplemental light duration on greenhouse sweet pepper plants and fruit yields // J. Amer. Soc Hort. Sci. 1998. V. 123. P. 202. https://doi.org/10.21273/JASHS.123.2.202
Lanoue J., Little C., Hao X. The power of far-red light at night: photomorphogenic, physiological, and yield response in pepper during dynamic 24 hour lighting // Front. Plant Sci. 2022. V. 13. P. 857616. https://doi.org/10.3389/fpls.2022.857616
Wolff S.A., Langerud A. Fruit yield, starch content and leaf chlorosis in cucumber exposed to continuous lighting // Eur. J. Hortic. Sci. 2006. V. 71. P. 259.
Shibaeva T.G., Markovskaya E.F. Growth and development of cucumber Cucumis sativus L. in the prereproductive period under long photoperiods // Russ. J. Dev. Biol. 2013. V. 44. P. 78. https://doi.org/10.1134/S1062360413020082
Wheeler R.M., Tibbitts T.W. Utilization of potatoes for life support systems in space. I. Cultivar-photoperiod interaction // Am. Potato J. 1986. V. 63. P. 315. https://doi.org/10.1007/BF02854441
Wheeler R.M., Tibbitts T.W. Growth and tuberization of potato (Solanum tuberosum L.) under continuous light // Plant Physiol. 1986. V. 80. P. 801. https://doi.org/10.1104/pp.80.3.801
Cao W., Tibbitts T.W. Physiological responses in potato plants under continuous irradiation // J. Am. Soc. Hort. Sci. 1991. V. 116. P. 525. https://doi.org/10.21273/JASHS.116.3.525
Cushman K.E., Tibbitts T.W., Sharkey T.D., Wise R.R. Constant-light injury of potato: temporal and spatial patterns of carbon dioxide assimilation, starch content, chloroplast Integrity, and necrotic lesions // J. Amer. Soc. Hort. Sci. 1995. V. 120. P. 1032. https://doi.org/10.21273/JASHS.120.6.1032
Wheeler R.M. Potato and human exploration of space: some observations from NASA-sponsored controlled environment studies // Potato Res. 2006. V. 49. P. 67. https://doi.org/10.1007/s11540-006-9003-4
Dorais M., Gosselin A. Physiological response of greenhouse vegetable crops to supplemental lighting // Acta Hort. 2002. V. 580. P. 59. https://doi.org/10.17660/ActaHortic.2002.580.6
Matsuda R., Ozawa N., Fujiwara K. Leaf photosynthesis, plant growth, and carbohydrate accumulation of tomato under different photoperiods and diurnal temperature differences // Sci. Hort. 2014. V. 170. P. 150. https://doi.org/10.1016/j.scienta.2014.03.014
Dorais M. Aspects culturaux et physiologiques de la tomate et du poivron de serre soumis à un éclairage d’appoint. Thèse de doctorat faculté des études supérieures. Université Laval, Québec, Canada. 1992.
Demers D.A., Yelle S., Gosselin A. Effects of continuous lighting on enzyme activities of leaf carbon metabolism of tomato and pepper plants // Hort. Sci. 1994. V. 29. P. 250. https://doi.org/10.21273/HORTSCI.29.4.250a
Sawada S., Hayakawa T., Fukushi K., Kasai M. Influence of carbohydrates on photosynthesis in single rooted soybean leaves used as a source-sink model // Plant Cell Physiol. 1986. V. 27. P. 591. https://doi.org/10.1093/oxfordjournals.pcp.a077138
Kerr P.S., Rufty T.W., Huber S.C. Endogenous rhythms in photosynthesis, sucrose phosphate synthase activity, and stomata resistance in leaves of soybeans (Glycine max L. Merr.) // Plant Physiol. 1985. V. 77. P. 275. https://doi.org/10.1104/pp.77.2.275
Layne D.R., Flore J.A. Physiological responses of Prunus cerasus to whole-plant source manipulation. Leaf gas exchange, chlorophyll fluorescence, water relations and carbohydrate concentrations // Physiol. Plant. 1993. V. 88. P. 44. https://doi.org/10.1111/j.1399-3054.1993.tb01758.x
Kalucheva I., Vinarova K. Deformation of chloroplasts upon illumination and darkening of tomato leaves // C. R. Acad. Bulg. Sci. 1969. V. 22. P. 93.
Schaffer A.A., Nerson H., Zamski E. Premature leaf chlorosis in cucumber associated with high starch accumulation // J. Plant Physiol. 1991. V. 138. P. 186. https://doi.org/10.1016/S0176-1617(11)80268-3
Chatterton N.J., Silvius J.E. Photosynthate partitioning into starch in soybean leaves. 1. Effects of photoperiod versus photosynthetic period duration // Plant Physiol. 1979. V. 64. P. 749.
Chatterton N.J., Silvius J.E. Photosynthate partitioning into leaf starch as affected by the daily photosynthetic period duration in six species // Physiol. Plant. 1980. V. 49. P. 141.
Курсанов A.Л. Эндогенная регуляция транспорта ассимилятов и донорно-акцепторные отношения у растений // Физиология растений. 1984. Т. 31. С. 579.
Курсанов А.Л. Эндогенная регуляция транспорта ассимилятов и донор-акцепторные отношения у растений // Передвижение ассимилятов в растениях и проблема сахаронакопления / Под ред. В.А. Печенова. Фрунзе: Илим, 1986. С. 110.
Мокроносов А.Т. Фотосинтетическая функция и целостность растительного организма. М.: Наука, 1983. 64 с.
Van Gestel N.C., Nesbit A.D., Gordon E.P., Green C., Pare P.W., Thompson L., Peffley E.B., Tissue D.T. Continuous light may induce photosynthetic downregulation in onion – consequences for growth and biomass partitioning // Physiol. Plant. 2005. V. 125. P. 235. https://doi.org/10.1111/j.1399-3054.2005.00560.x
Stettler M., Eicke S., Mettler T., Messerli G., Hörtensteiner S., Zeeman S.C. Blocking the metabolism of starch breakdown products in Arabidopsis leaves triggers chloroplast degradation // Mol. Plant. 2009. V. 2. P. 1233. https://doi.org/10.1093/mp/ssp093
Braun D.M., Ma Y., Inada N., Muszynski M.G., Baker R.F. Tie-dyed1 regulates carbohydrate accumulation in maize leaves // Plant Physiol. 2006. V. 142. P. 1511. https://doi.org/10.1104/pp.106.090381
Baker R.F., Braun D.M. Tie-dyed1 functions non-cell autonomously to control carbohydrate accumulation in maize leaves // Plant Physiol. 2007. V. 144. P. 867. https://doi.org/10.1104/pp.107.098814
Baker R.F., Braun D.M. Tie-dyed2 functions with Tie-dyed1 to promote carbohydrate export from maize leaves // Plant Physiol. 2008. V. 146. P. 1085. https://doi.org/10.1104/pp.107.111476
Cushman K.E., Tibbitts T.W. Size of tuber propagule influences injury of “Kennebec” potato plants by constant light // Hort. Sci. 1996. V. 31. P. 1164. https://doi.org/10.21273/HORTSCI.31.7.1164
Demers D.A. Physiologie, photosynthèse et métabolisme carboné de plants de tomate (Lycopersicon esculentum Mill.) et de poivron (Capsicum annuum L.) cultivés sous de longues photoperiods. Thèse de Doctorat, Faculté des Études Supérieures, Université Laval, Ste-Foy, Québec, Canada. 1998.
Galtier N., Foyer C.H., Huber J., Voelker T.A., Huber S.C. Effects of elevated sucrose-phosphate synthase activity on photosynthesis and assimilate partitioning and growth in tomato (Lycopersicon esculentum var UC82B) // Plant Physiol. 1993. V. 101. P. 535. https://doi.org/10.1104/pp.101.2.535
Galtier N., Foyer C.N., Murchie E., Alred R., Quick P., Voelker T.A., Thépenier C., Lascève G., Betsche T. Effects of light and atmospheric carbon dioxide enrichment on photosynthesis and carbon partitioning in the leaves of tomato (Lycopersicon esculentum L.) plants over-expressing sucrose phosphate synthase // J. Exp. Bot. 1995. V. 46. P. 1335. https://doi.org/10.1093/jxb/46.special_issue.1335
Micallef B.J., Haskins K.A., Vanderveer P.J., Roh K.S., Shewmaker C.K., Sharkey T.D. Altered photosynthesis, flowering, and fruiting in transgenic tomato plants that have increased capacity for sucrose synthesis // Planta. 1995. V. 196. P. 327. https://doi.org/10.1007/BF00201392
Lanoue J., Zheng J., Little C., Grodzinski B., Hao X. Continuous light does not compromise growth and yield in mini-cucumber greenhouse production with supplemental led light // Plants. 2021. V. 10. P. 378. https://doi.org/10.3390/plants10020378
Lanoue J., Leonardos E.D., Grodzinski B. Effects of light quality and intensity on diurnal patterns and rates of photo-assimilate translocation and transpiration in tomato leaves // Front. Plant Sci. 2018. V. 9. P. 756. https://doi.org/10.3389/fpls.2018.00756
Ma S., Sun L., Sui X., Li Y., Chang Y., Fan J., Zhang Z. Phloem loading in cucumber: combined symplastic and apoplastic strategies // Plant J. 2019. V. 98. P. 391. https://doi.org/10.1111/tpj.14224
Lemoine R., La Camera S., Atanassova R., Dédaldéchamp F., Allario T., Pourtau N., Bonnemain J.-L., Laloi M., Coutos-Thévenot P., Maurousset L., Faucher M., Girousse Ch., Lemonnier P., Parrilla J., Durand M. Source-to-sink transport of sugar and regulation by environmental factors // Front. Plant Sci. 2013 V. 4. P. 272. https://doi.org/10.3389/fpls.2013.00272
Grodzinski B., Jiao J., Leonardos E.D. Estimating photosynthesis and concurrent export rates in C3 and C4 species at ambient and elevated CO2 // Plant Physiol. 1998. V. 117. P. 207. https://doi.org/10.1104/pp.117.1.207
Stitt M. Rising CO2 levels and their potential significance for carbon flow in photosynthetic cells // Plant Cell Environ. 1991. V. 14. P. 741. https://doi.org/10.1111/j.1365-3040.1991.tb01440.x
Cakmak I., Kirkby E.A. Role of magnesium in carbon partitioning and alleviating photooxidative damage // Physiol. Plant. 2008. V. 133. P. 692. https://doi.org/10.1111/j.1399-3054.2007.01042.x
Krapp A., Quick W.P., Stitt M. Ribulose-1,5-biphosphate carboxylase-oxygenase, other Calvin-cycle enzymes, and chlorophyll decrease when glucose is supplied to mature spinach leaves via the transpiration stream // Planta. 1991. V. 186. P. 58. https://doi.org/10.1007/BF00201498
Foyer C.H., Neukermans J., Queval G., Noctor G., Harbinson J. Photosynthetic control of electron transport and the regulation of gene expression // J. Exp. Bot. 2012. V. 63. P. 1637. https://doi.org/10.1093/jxb/ers013
Van den Ende W., Valluru R. Sucrose, sucrosyl oligosaccharides, and oxidative stress: scavenging and salvaging? // J. Exp. Bot. 2009. V. 60. P. 9. https://doi.org/10.1093/jxb/ern297
Nott A., Jung H.-S., Koussevitzky S., Chory J. Plastid-to-nucleus retrograde signaling // Annu. Rev. Plant Biol. 2006. V. 57. P. 739. https://doi.org/10.1146/annurev.arplant.57.032905.105310
Inaba T. Bilateral communication between plastid and the nucleus: plastid protein import and plastid-to-nucleus retrograde signaling // Biosci. Biotechnol. Biochem. 2010. V. 74. P. 471. https://doi.org/10.1271/bbb.90842
Ruckle M.E., DeMarco S.M., Larkin R.M. Plastid signals remodel light signaling networks and are essential for efficient chloroplast biogenesis in Arabidopsis // Plant Cell. 2007. V. 19. P. 3944. https://doi.org/10.1105/tpc.107.054312
Ruckle M.E., Burgoon L.D., Lawrence L.A., Sinkler C.A., Larkin R.M. Plastids are major regulators of light signaling in Arabidopsis // Plant Physiol. 2012. V. 159. P. 366. https://doi.org/10.1104/pp.112.193599
Lepistö A., Rintamäki E. Coordination of plastid and light signaling 609 pathways upon development of arabidopsis leaves under various photoperiods // Mol. Plant. 2012. V. 5. P. 799. https://doi.org/10.1093/mp/ssr106
Lanoue J., Zheng J., Little C., Thibodeau A., Grodzinski B., Hao X. Alternating red and blue light-emitting diodes allows for injury-free tomato production with continuous lighting // Front. Plant Sci. 2019. V. 10. P. 1114. https://doi.org/10.3389/fpls.2019.01114
Lanoue J., Thibodeau A., Little C., Zheng J., Grodzinski B., Hao X. Light spectra and root stocks affect response of greenhouse tomatoes to long photoperiod of supplemental lighting // Plants. 2021. V. 10. P. 1674. https://doi.org/10.3390/ plants10081674
Peter E., Rothbart M., Oelze M.-L., Shalygo N., Dietz K.-J., Grimm B. Mg protoporphyrin monomethylester cyclase deficiency and effects on tetrapyrrole metabolism in different light conditions // Plant Cell Physiol. 2010. V. 51. P. 1229. https://doi.org/10.1093/pcp/pcq071
Graf A., Schlereth A., Stitt M., Smith A.M. Circadian control of carbohydrate availability for growth in Arabidopsis plants at night // Proc. Natl. Acad. Sci. USA 2010. V. 107. P. 9458. https://doi.org/10.1073/pnas.0914299107
Weise S.E., Schrader S.M., Kleinbeck K.R., Sharkey T.D. Carbon balance and circadian regulation of hydrolytic and phosphorolytic breakdown of transitory starch // Plant Physiol. 2006. V. 141. P. 879. https://doi.org/10.1104/pp.106.081174
Lu Y., Gehan J.P., Sharkey T.D. Daylength and circadian effects on starch degradation and maltose metabolism // Plant Physiol. 2005. V. 138. P. 2280. https://doi.org/10.1104/pp.105.061903
James A.B., Monreal J.A., Nimmo G.A., Kelly C.L., Herzyk P., Jenkins G.I., Nimmo H.G. The circadian clock in Arabidopsis roots is a simplified slave version of the clock in shoots // Science. 2008. V. 322. P. 1832. https://doi.org/10.1126/science.11614
Zeeman S.C., Delatte T., Messerli G., Umhang M., Stettler M., Mettler T., Streb S., Reinhold H., Kotting O. Starch breakdown: recent discoveries suggest distinct pathways and novel mechanisms // Func. Plant Biol. 2007. V. 34. P. 465. https://doi.org/10.1071/FP06313
Pham D.M., Chun C. Growth and leaf injury in tomato plants under continuous light at different settings of constant and diurnally varied photosynthetic photon flux densities // Sci. Hort. 2020. V. 269. P. 109347. https://doi.org/10.1016/j.scienta.2020.109347
Wingler A., Masclaux-Daubresse C., Fischer A.M. Sugars, senescence, and ageing in plants and heterotrophic organisms // J. Exp. Bot. 2009. V. 60. P. 1063. https://doi.org/10.1093/jxb/erp067
Lim P.O., Kim H.J., Gil Nam H. Leaf senescence // Annu. Rev. Plant Biol. 2007. V. 58. P. 115. https://doi.org/10.1146/annurev.arplant.57.032905.105316
Van Doorn W.G. Is the onset of senescence in leaf cells of intact plants due to low or high sugar levels? // J. Exp. Bot. 2008. V. 59. P. 1963. https://doi.org/10.1093/jxb/ern076
Noodén L.D. The phenomena of senescence and aging // Senescence and aging in plants / Eds. L.D. Noodén, A.C. Leopold. San Diego, CA: Academic Press. 1988. 50 p.
Cushman K.E., Tibbitts T.W. Root-zone temperature effects on continuous irradiation injury on potato // Hort. Sci. 1991. V. 26. P. 745.
Tibbitts T.W., Bennett S.M., Cao W. Control of continuous irradiation injury on potato with daily temperature cycling // Plant Physiol. 1990. V. 93. P. 409. https://doi.org/10.1104/pp.93.2.409
Cao W., Tibbitts T.W. Temperature cycling periods affect growth and tuberization in potatoes under continuous light // Hort. Sci. 1992. V. 27. P. 344. https://doi.org/10.21273/HORTSCI.27.4.344
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


