Физиология растений, 2023, T. 70, № 4, стр. 382-391
Белок мембранных нанодоменов Flot1 участвует в образовании ранних эндосом в клетках корней A. thaliana
Л. А. Халилова a, *, А. С. Воронков a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: lhalilova@mail.ru
Поступила в редакцию 30.01.2023
После доработки 06.02.2023
Принята к публикации 06.02.2023
- EDN: QAHCTE
- DOI: 10.31857/S0015330323600067
Аннотация
Растения в ходе всей своей жизни подвергаются различным стрессовым воздействиям. Плазматическая мембрана – основной компартмент клетки, отвечающий за адаптацию растений к стрессу и способный ремоделировать состав входящих в нее белков посредством эндоцитоза. Основным путем эндоцитоза у растений служит клатрин-зависимый эндоцитоз, но кроме него также известны несколько альтернативных, клатрин-независимых путей эндоцитоза. Одним из белков, участвующих в таком эндоцитозе, является Flot1. В данном исследовании на модельной системе корней проростков A. thaliana дикого типа и нокаут-мутанта (Atflot1ko) методами световой микроскопии с флуоресцентным липофильным зондом FM4-64 и электронной микроскопии была исследована роль Flot1 в процессе эндоцитоза. Одновременная обработка корней проростков ингибитором клатринового эндоцитоза (1-нафталинуксусной кислотой) и агентом, обедняющим плазмалемму по стеринам (метил-β-циклодекстрином), блокировала эндоцитоз в клетках корней дикого типа. Вследствие этого, наблюдалось снижение везикуляции цитоплазмы (ранних эндосом, мелких везикул, образованных агранулярным эндоплазматическим ретикулумом, и микровакуолей из его фрагментов, а также клатриновых везикул) как в контрольном варианте, так и в условиях стресса – при внесении в среду 100 мМ NaCl. При этом у мутанта Atflot1ko происходило замыкание цистерн комплекса Гольджи в кольцо с полным блокированием процесса формирования ранних эндосом. Таким образом, полученные результаты наводят на мысль, что при действии ингибиторов на клетки корней A. thaliana присутствующий в микродоменах плазматической мембраны белок Flot1 сохраняет структуру комплекса Гольджи и его способность к формированию на транс-стороне ранних эндосом, а также принимает участие в образовании ранних эндосом из транс-Гольджи сети.
ВВЕДЕНИЕ
В течение всей своей жизни клетки постоянно сталкиваются со случайными и сложными изменениями в окружающей среде. Ярким примером такого действия является солевой стресс. Отклонения от гомеостатических условий часто неблагоприятны для клеточной жизни и вызывают различные стрессовые реакции, что обеспечивает адаптацию и выживание клеток в неблагоприятных условиях [1]. Плазматическая мембрана (ПМ) считается центральным компартментом в клеточной адаптации к разным стрессовым условиям, поскольку она является барьером между внутренней и внешней средой клеток [2]. Динамическое ремоделирование ПМ является важнейшим процессом клеточной адаптации к различным стрессовым условиям. Регулируемый обмен молекулами и сигналами через ПМ достигается с помощью трансмембранных белков – таких как каналы, транспортеры и рецепторы [3]. Белки удаляются из ПМ путем интернализации мембранных участков в везикулы при эндоцитозе [4]. Внутри эндосом этот материал затем сортируется для деградации или рециркулируется обратно на поверхность клетки. Переработанные белки вместе с вновь синтезированными секретируются в виде транспортных пузырьков для пополнения функциональной популяции белков плазматической мембраны [5]. У растений описано несколько вариантов эндоцитоза, обусловленных специфическим набором белков в различных местах вдоль эндоцитарного пути [4]. Наиболее заметным из них считают клатрин-зависимый эндоцитоз (КЗЭ), при котором на ПМ образуются впячивания с высокой концентрацией белков, подлежащих транспортировке [6]. Результатом инвагинации мембраны является образование пузырьков, покрытых клатрином, которые затем нацеливаются на перенос груза (карго) в эндосомальные компартменты [7]. Значительная часть зарождающихся пузырьков может не созреть, тем самым блокируя процесс поглощения и переноса груза. КЗЭ – строго регулируемый процесс, ориентированный только на перенос груза.
На сегодняшний день наиболее широко используемый метод визуализации и количественной оценки скорости эндоцитоза – использование липофильного красителя FM4-64, который флуоресцирует только при связывании с мембранами и легко проникает в клетки корней посредством эндоцитоза, что позволяет оценить потоки мембранного транспорта [8–10]. Эксперименты по отслеживанию эндоцитоза FM4-64 показывают, что нарушение КЗЭ с использованием доминантно-негативной формы клатрина резко снижает общую интернализацию материала ПМ, поэтому данный путь может быть преобладающим в клетках растений. Было обнаружено, что КЗЭ функционирует во всех клетках корня A. thaliana, что указывает на его глобальное значение в физиологии растений [11, 12].
Ингибиторы КЗЭ дрожжей и животных также являются мощными ингибиторами эндоцитоза растений [11, 13]. Они препятствуют взаимодействию между белками-грузами и клатрин-рекрутинговыми адаптерными белковыми комплексами в растениях, тем самым блокируя процесс КЗЭ [14]. Неспецифически воздействуя на КЗЭ, ауксины могут увеличивать свой собственный отток, стабилизируя мембранные белки (например, PIN) и, следовательно, организуя свой полярный транспорт в тканях [15, 16]. Различные эффекты ауксинов на транспорт PIN в клетке были получены при использовании его изоформ, преимущественно 1‑нафталинуксусной кислоты (НУК) [15–17].
Большинство изученных до сих пор трансмембранных белков следуют по клатрин-зависимому пути поглощения, который действует во всех клеточных слоях корня A. thaliana [12, 16, 18]. Однако в растениях существуют альтернативы КЗЭ. Независимый от клатрина путь, нацеленный на закрепленные на мембране, но не трансмембранные белки, был описан в клетках эпидермиса корней A. thaliana при стандартных условиях роста [12]. В то же время обнаружено, что солевой стресс индуцирует другой независимый от клатрина путь для трансмембранных и мембраносвязанных (заякоренных GPI) белков, на который влияет сортировка вакуолярных белков фактора АДФ-рибозилирования, т.е фактора обмена гуанидина (ARF-GEF) 6. Данный факт согласуется с тем, что независимый от клатрина эндоцитоз белка плазмалеммы – трансмембранного аквапорина 2;1 (PIP2;1) – усиливался при солевом стрессе [12, 19]. Таким образом, тип эндоцитоза, которому будет подвергаться растительный белок, не является фиксированным и может зависеть от множества факторов, таких как положение клетки, состояние ее развития и сигналы/стимулы, факторы окружающей среды. Одним из клатрин-независимых путей эндоцитоза (КНЗЭ) является флотиллин-опосредованный эндоцитоз. Мембранные рафты ПМ, богатые сфинголипидами и холестерином, представляют собой упорядоченные микродомены с уникальным белком флотиллином (Flot1). Нокдаун флотилина-1 ингибирует поглощение GPI-связанных белков [20]. Мембранный микродомен-ассоциированный эндоцитоз с помощью Flot1, обнаруженный у A. thaliana, участвует в регуляции передачи сигнала посредством эндоцитоза [19, 21–23]. Ранее нами было показано, что у мутанта со сверхэкспрессией гена flot1 наблюдалось снижение числа диктиосом в комплексах Гольджи (КГ) и их деформация с образованием кольцеобразных структур на транс-стороне КГ, что было особенно заметно в условиях засоления. Такие изменения КГ также могут отражать активирование везикулярного транспорта и ускоренное расходование материала транс-стороны КГ на образование эндосом [24]. Хотя функции флотиллинов у растений исследованы в значительно меньшей степени, чем у представителей других царств, их участие в ряде процессов тоже было показано. Однако есть данные об очень низкой частоте образования инвагинаций, связанных с Flot1, что согласуется с отсутствием действия истощения флотилина на скорость эндоцитоза холерного токсина [25].
КНЗЭ заякоренных GPI-белков в клетках животных критически зависит от содержания стеринов в мембране [26]. Предварительная обработка корней проростков метил-β-циклодекстрином (MβЦД) – соединением, обедняющим ПМ растений по стеринам [19, 27], снижает поглощение FM4-64 в эпидермальных клетках корня A. thaliana [12]. MβЦД может выводить стерины из ПМ, тем самым способствуя MβЦД-индуцированному истощению мембраны, что, в свою очередь, приводит к ослаблению динамики фосфорилирования, димеризации и интернализации растительных белков [28].
Целью данной работы было показать участие белка Flot1 в образовании ранних эндосом (РЭ) на транс-стороне комплекса Гольджи. Для достижения данной цели были проведены исследования с ингибиторами эндоцитоза на клетках корней проростков A. thaliana дикого типа (ДТ) и его нокаут-мутанта по гену flot1, а также изучена ультраструктура клеток корней этих растений при действии на них данных ингибиторов.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Работу выполняли на растениях Arabidopsis thaliana (L.) Heynh. (экотип Col-0) ДТ и его нокаут-мутанте Atflot1ko (SALK_205125C). Данные о вставке и характеристика мутанта были показаны нами ранее [29]. 5-дневные проростки A. thaliana ДТ и нокаут-мутанта Atflot1ko как для FM-окрашивания, так и для трансмиссионной электронной микроскопии (ТЭМ) были выращены на агаризованной ½ МС-среде с 0.5% сахарозой при температуре 23 ± 2°С, относительной влажности воздуха 70 ± 5%, фотопериоде 16 ч/сут и интенсивности света 80 мкмоль квантов/м2 с, полученного от люминесцентных ламп ЛБ-80 (“Philips”, Польша).
FM4-64 окрашивание. В ходе эксперимента 5‑дневные проростки инкубировали в 1 мл жидкой ½ MС-среде (без 0.5% сахарозы, рН 5.8). В контрольном варианте опыта проростки инкубировали с эндоцитозным красителем FM4-64 (2 мкМ) при комнатной температуре в течение 30 мин. В опытном варианте в среду инкубации одновременно с красителем вносили 100 мМ NaCl. Далее проростки переносили на предметное стекло и визуализировали с помощью микроскопа AxioImager Z2 (“Carl Zeiss”, Германия). Изображения получали с помощью монохромной высокочувствительной камеры AxioCamMRm (“Carl Zeiss”, Германия) в программе AxioVision 4.8. Флуоресценцию FM4-64 (красный псевдоцвет) детектировали, используя наборы фильтров №14 (λex 510–560 нм, λem > 590 нм; “Carl Zeiss”, Германия). Средняя интенсивность пикселей цитозольной стороны клеток, исключая плазматическую мембрану, были измерены с помощью программы ZEN Blue (“Carl Zeiss”, Германия). Для анализа использовали не менее 50 снимков в каждой точке.
Обработка корней НУК и MßЦД. 5-дневные проростки инкубировали в 1 мл жидкой ½ MС-среде (без 0.5% сахарозы, рН 5.8) с добавлением 100 мкМ НУК (“Sigma”, #N1641, Великобритания) и прединкубировали в течение 30 мин. Далее в инкубирующий раствор добавляли 2 мкМ FM4-64 при комнатной температуре и продолжали инкубацию еще 30 мин. В опытном варианте в среду инкубации вместе с FM4-64 добавляли 100 мМ NaCl. При одновременной обработке проростков НУК и MßЦД в раствор ½ MС-среды добавляли 100 мкм НУК и 10 мМ MßЦД (“Sigma”, #128446-36-6, Китай) и прединкубировали при комнатной температуре в течение 30 мин. Далее все так же, как при обработке НУК. Обработка изображений была такая же, как при окрашивании FM4-64.
Трансмиссионная электронная микроскопия. Изучение ультраструктуры клеток корней проростков A. thaliana ДТ и нокаут-мутанта Atflot1ko проводили с помощью трансмиссионной электронной микроскопии. Образцы подготавливали в соответствии со стандартной методикой [24]. Кусочки корней (2–3 мм) для ТЭМ были вырезаны на расстоянии 1‒2 мм от кончика корня. Образцы фиксировали в 2.5% растворе глутарового альдегида в течение 3 ч и далее постфиксировали в 1% OsO4 при 4°С в течение одних суток. Фиксирующие растворы готовили на основе 0.05 М какодилатного буфера, рН 7.2. После фиксации образцы обезвоживали в спиртах (30 и 40% ‒ 2 раза по 15 мин; 50 и 60% ‒ 2 раза по 30 мин; 70% ‒ на ночь при 4°С). На следующий день образцы переносили в 96% этанол ‒ 1 ч; 100% этанол : 100% ацетон – 1 : 1 (об/об) – 1 ч; 100% ацетон – 1 ч и далее в смесь эпоксидной смолы (“Fluka”, cat. № 2920114, Германия) и ацетона в соотношении 1 : 8, 1 : 4, 1 : 1 (об/об). После полимеризации образцов с помощью ультрамикротома Om U3 (“Reihert”, Австрия) были получены ультратонкие срезы. Для просмотра в ТЭМ LIBRA 120 (“Carl Zeiss”, Германия) срезы помещали на сетки и контрастировали 1% уранилацетатом.
Статистический анализ. Для статистического анализа использовали факторный дисперсионный анализ с апостериорным критерием HSD для неравных выборок в программе STATISTICA10 (StatSoft). На графиках представлены средние значения и их стандартные отклонения, разными буквами указаны достоверно отличающиеся величины при P < 0.05.
РЕЗУЛЬТАТЫ
Для мониторинга общего эндоцитоза, протекающего в клетках корней 5-дневных проростков растений A. thaliana ДТ и его нокаут-мутанта (Atflot1ko), мы проанализировали внутриклеточное накопление эндоцитарного индикатора FM4-64, гидрофобные молекулы которого поглощаются клетками корня путем связывания с липидами ПМ. Поглощенный краситель интернализуется с помощью эндоцитозных пузырьков [30].
Интенсивность флуоресценции FM4-64 в клетках корня у Atflot1ko в зоне растяжения была в 2 раза больше, чем у ДТ, как в отсутствие соли, так и при внесении 100 мМ NaCl в среду (рис. 1; Дополнительные материалы, рис. 1). Внесение NaCl в среду инкубирования не оказало влияния на скорость интернализации красителя у ДТ и у Atflot1ko, что согласуется с данными, полученными нами ранее [28]. Инкубация проростков в растворе, содержащем 2 мкМ FM4-64, привела к заметному эндоцитозу красителя клетками корня Atflot-1ko в исследуемой зоне.
Рис. 1.
Интенсивность флуоресценции FM4-64 в клетках корней 5-дневных проростков растений A. thaliana: 1 – дикий тип, 0 мМ NaCl; 2 – дикий тип, 100 мМ NaCl; 3 – Atflot1ko, 0 мМ NaCl; 4 – Atflot1ko, 100 мМ NaCl. Контроль – FM4-64, 2 мкМ; НУК – 100 мкМ; МßЦД – 10 мМ.
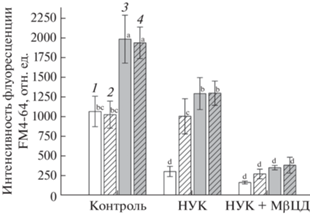
Анализ влияния НУК на эндоцитоз в клетках корней проростков исследуемых нами линий A. thaliana показал, что в корнях ДТ, предобработанных раствором 100 мкМ НУК, и в отсутствие соли в среде ингибирование эндоцитоза составило 70%. Внесение в среду инкубации 100 мМ NaCl возвращало значения интенсивности флуоресценции FM4-64 у растений ДТ до контрольных значений (рис. 1). Следует отметить, что клеточные мембраны оставались очерченными FM4-64, поэтому доступ красителя ко всем клеткам корня не нарушался обработкой корней НУК (Дополнительные материалы, рис. 1).
Обработка корней проростков Atflot1ko 100 мкМ НУК ингибировала эндоцитоз FM4-64 в клетках на 35% в условиях отсутствия соли в среде. Внесение NaCl в среду инкубации не оказало действия на интернализацию красителя клетками корней проростков и оставалось на том же уровне, что и в контроле (рис. 1).
Одновременная обработка корней проростков растений A. thaliana ДТ и нокаут-мутанта НУК и MßЦД (агентом, вымывающим стерины из ПМ), способствовала сильному снижению сигнала флуоресценции маркера FM4-64. Совместное действие этих двух агентов на клетки корня проростков ДТ в контрольных условиях привело к снижению сигнала FM4-64 на 84% от контрольных значений, а у нокаут-мутанта – на 82% в аналогичных условиях. Внесение в среду 100 мМ NaCl также приводило к ингибированию сигнала флуоресценции на 76% у ДТ и на 75% у нокаут-мутанта по сравнению с контролем (рис. 1; Дополнительные материалы, рис. 1). Общий эффект ингибирования сохранялся у обеих линий. Кроме того, поглощение FM4-64, которое было невосприимчивым к обработке НУК в клетках корней ДТ в условиях засоления, было значительно снижено в ответ на одновременное действие двух агентов (рис. 1; Дополнительные материалы, рис. 1). Одновременная обработка корней НУК и MßЦД блокировала все вызванные солью увеличения поглощения FM4-64 у ДТ.
Трансмиссионная электронная микроскопия. Изучение ультраструктуры клеток корней 5-дневных проростков растений A. thaliana ДТ и его нокаут-мутанта по гену flot1 (Atflot1ko) в исследуемой нами зоне растяжения как в контрольных условиях, так и в условиях стресса (100 мМ NaCl) (рис. 2а–в) показало отсутствие различий с морфологией структур клеток зоны поглощения, которая была описана нами ранее [29]. Обработка ауксином корней проростков ДТ в контрольных условиях привела к выраженному уменьшению кривизны ПМ (рис. 2ж–и) и ее плотному прилеганию к клеточной стенке, за исключением редких участков скопления экзосом (Экз) между ПМ и периплазмаческим пространством (ПП) (рис. 2з). ТГС активно формировала РЭ на транс-стороне (рис. 2з). Действие НУК сказалось и на структуре хорошо развитого эндоплазматического ретикулума (ЭР), имеющего в контроле форму разветвленных трубочек (рис. 2а–е), которое привело к расширению просветов и переходу из трубчатой формы в форму цистерн, а затем и к его фрагментированию. Мелкие фрагменты ЭР образовывали множество микровакуолей (МВ) угловатой формы (рис. 2и). Наблюдалась повышенная извилистость тонопласта (рис. 2ж–и), что, по-видимому, связано с усилением потока транспорта везикул в сторону вакуоли и увеличением общей площади мембраны. Активное состояние ТГС в условиях контроля демонстрировало усиление везикуляции цитоплазмы в целом (рис. 2з, и) и активацию процесса экзоцитоза в клетках корней проростков при ингибировании КЗЭ. В корнях растений ДТ, не обработанных ауксином, в условиях отсутствия соли в среде такой сильной везикуляции не наблюдалось (рис. 2а–в).
Рис. 2.
Ультраструктура клеток корней 5-дневных проростков дикого типа растений A. thaliana: а–в – 0 мМ NaCl; г–е – 100 мМ NaCl; ж–и – 0 мМ NaCl + 100 мкМ НУК; к–м – 100 мМ NaCl + 100 мкМ НУК; н–п – 0 мМ NaCl + + 100 мкМ НУК + 10 мМ MßЦД; р–т – ДТ 100 мМ NaCl + 100 мкМ НУК + 10 мМ MßЦД. ЭР – эндоплазматический ретикулум, В – вакуоль, белая звездочка – транс-Гольджи сеть/ранние эндосомы, черная стрелка – плазматическая мембрана, белая стрелка – экзосомы. Масштаб – 0.5 мкм.
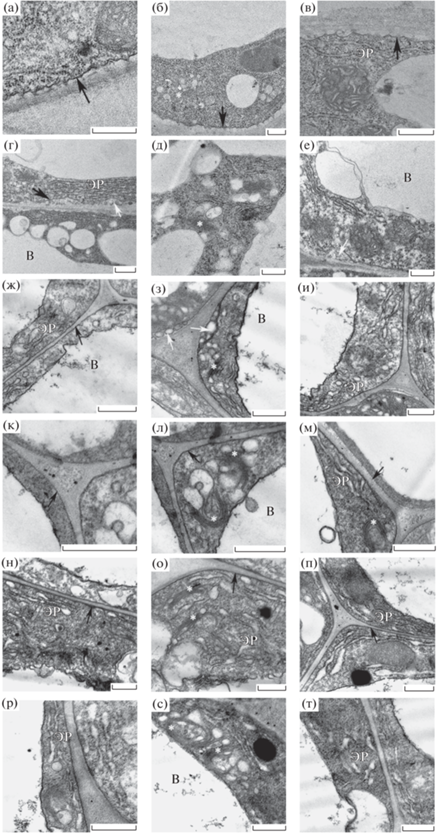
При внесении в среду инкубации 100 мМ NaCl наблюдались некоторые изменения ультраструктуры клеток. Обработка ауксином в этих условиях деформировала ТГС с образованием полукольцеобразных структур (рис. 2л, м), однако на транс-стороне КГ автивно формировались РЭ крупных размеров (рис. 2л), по сравнению с контролем. Просветы ЭР были также расширены, фрагментированных участков ЭР в цитоплазме не наблюдалось (рис. 2м). Уменьшение общей везикуляции и вакуолизации цитоплазмы при обработке корней ДТ 100 мМ NaCl является результатом снижения интенсивного образования везикул и активирования экзоцитоза в сторону вакуоли (рис. 2к–м). При этом в условиях засоления и отсутствия ауксина в среде инкубирования в клетках корней проростков ДТ наблюдалась повышенная вакуолизация цитоплазмы (рис. 2г–е).
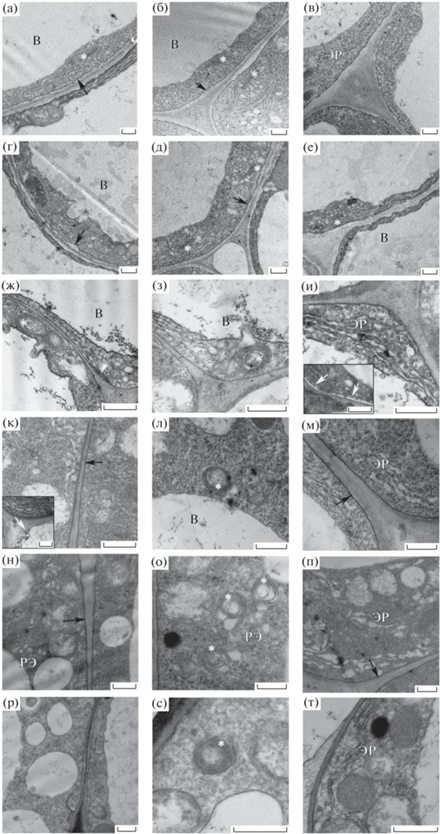
Изучение ультраструктуры клеток нокаут-мутанта, обработанных НУК, показало, что мутация Atflot1 не выявила особых различий между контрольными и опытными вариантами растений. Тем не менее, в условиях отсутствия соли в среде в клетках корня нокаут-мутанта наблюдалось отсутствие извилистости ПМ и ее плотное прилегание к клеточной стенке, кроме редких участков скопления Экз в ПП (рис. 3ж–и, и-(вставка)). ТГС дефомировались с образованием кольцеобразных структур (рис. 3ж, з) по сравнению с аналогичными условиями инкубации корней проростков ДТ (рис. 2ж–и). На транс-стороне КГ формировались единичные эндосомы. Просветы ЭР были расширены, при этом сам ЭР не был фрагментирован (рис. 3з, и). Цитоплазма клеток не была вакуолизирована. Внесение NaCl в среду инкубирования и обработка проростков нокаут-мутанта НУК не привело к заметным ультраструктурным изменениям (рис. 3к–м) по сравнению с контрольными условиями (рис. 3ж–и). Однако, следует отметить, что в условиях засоления ТГС полностью замыкалась в кольцо, тем самым блокируя образование РЭ на транс-стороне. В аналогичных условиях, но без обработки НУК, КГ сохраняли структуру и процесс образования РЭ на транс-стороне был ярко выражен (рис. 3г–е).
Рис. 3.
Ультраструктура клеток корней 5-дневных проростков нокаут-мутанта A. thaliana: а–в – 0 мМ NaCl; г–е – 100 мМ NaCl; ж–и – 0 мМ NaCl + 100 мкМ НУК; к–м – 100 мМ NaCl + 100 мкМ НУК; н–п – 0 мМ NaCl + 100 мкМ НУК + + 10 мМ MßЦД; р–т – ДТ 100 мМ NaCl + 100 мкМ НУК + 10 мМ MßЦД. ЭР – эндоплазматический ретикулум, В – вакуоль, белая звездочка – транс-Гольджи сеть/ранние эндосомы, черная стрелка – плазматическая мембрана, белая стрелка – экзосомы. Масштаб – 0.5 мкм.
Обработка корней проростков ДТ одновременно НУК и MßЦД не привела к заметным изменениям в ультраструктуре клеток – они были аналогичны действию ауксина на корни. В условиях отсутствия соли в среде КГ активно отшнуровывал от транс-стороны РЭ (рис. 2н–п). Расширение ЭР, его фрагментация и образование мелких МВ неправильной формы вызвало усиление везикуляции и вакуолизации цитоплазмы (рис. 2н–п). Внесение в среду 100 мМ NaCl имело аналогичное действие на структуру клеток корня ДТ, как и при действии только НУК в условиях засоления (рис. 2р–т). Следует отметить, что у растений ДТ изменение ультраструктуры КГ наблюдалось только в условиях засоления как при обработке НУК, так и при одновременной обработке НУК и MßЦД.
Совместная обработка корней нокаут-мутанта НУК и MßЦД в контрольных условиях приводила в целом к увеличению везикуляции и вакуолизации цитоплазмы за счет образования более крупных РЭ на транс-стороне КГ и увеличению просветов ЭР с образованием МВ неправильной формы (рис. 3н–п). В условиях засоления выраженная везикуляция цитоплазмы снижалась, ТГС замыкались в кольцо, активности на их транс-стороне не происходило (рис. 3с). Фрагментации и расширения просветов ЭР не наблюдалось (рис. 3т), в отличие от варианта, когда корни были обработаны только НУК (рис. 3м).
Таким образом, все описанные изменения ультраструктуры клеток корней были вызванны скорее действием НУК, чем двойным действием агентов. Добавление в среду инкубации NaCl приводило к уменьшению вакуолизации цитоплазмы клеток корня как у ДТ, так и у нокаут-мутанта.
ОБСУЖДЕНИЕ
Мембранный транспорт у эукариот включает сложную сеть транспортных систем везикул, идущих во многих направлениях и соединяющих практически каждый внутриклеточный компартмент. По большей части, внутренний транспорт опосредован клатрином, тогда как транспортные везикулы, происходящие из ПМ, могут иметь различное происхождение. Эти эндоцитарные пузырьки, как правило, имеют разные размеры (60–200 нм) [30, 31]. После формирования везикулы сливаются и обмениваются грузом в пре-вакуолярном компартменте, в том числе и в ТГС/РЭ [32, 33].
Ранее нами было показано, что в зоне поглощения в клетках корня ДТ и нокаут-мутанта не было выявлено различий в скорости поглощения зонда FM4-64 как в контрольном варианте, так и в присутствии NaCl в среде [29]. Исследования показали, что в разных зонах корня, а также в различных слоях клеток корня протекают разные процессы эндоцитоза (клатрин-зависимые и клатрин-независимые) [12]. В данной работе исследования были проведены в зоне растяжения корня. Известно, что в зоне роста (растяжения) клетки сильно удлиняются путем растяжения. Интенсивность данного процесса во всей зоне роста не одинаковая и своего максимума достигает в центральной части. Для этих процессов необходим постоянный активный транспорт веществ и мембранного материала, который доставляется в результате везикулярного транспорта (эндо- и экзоцитоза), идущего в обоих направлениях в клетке.
Единственным хорошо охарактеризованным эндоцитарным путем в растениях является клатрин-зависимый путь, в основном из-за доступности специфических химических ингибиторов – НУК, Tyr-A23, HUB1 [11, 18]. Каждый из этих агентов эффективно блокирует поглощение большинства трансмембранных белков (PIN2, LTI6b, PIN1), подтверждая, что эти белки поглощаются исключительно клатрин-зависимым путем. Было показано, что этот путь действует конститутивно во всех слоях корня [12].
Для выявления эффектов ауксина на транспорт везикул предпочтительно используется синтетическая форма НУК из-за ее более высокой стабильности по сравнению с природным ауксином, индол-3-уксусной кислотой (ИУК) [15, 16]. Ауксины влияют на эндоцитоз, а точнее на клатрин-зависимый эндоцитоз, что подтверждено ауксин-опосредованным ингибированием интернализации эндоцитарного индикатора FM4-64 [8] и снижением его сигнала в клетках [15, 16]. Показано, что при добавлении 100 мкМ НУК в среду инкубации практически отсутствует внутриклеточный сигнал FM4-64 [34]. В нашей работе такая концентрация НУК вызвала максимальный эффект ингибирования КЗЭ в клетках обоих исследуемых линий растений (рис. 1; Дополнительные материалы, рис. 1). Обработка проростков ДТ ауксином привела к сильному ингибированию КЗЭ (на ≈70%), тогда как эффект ингибирования этого процесса у нокаут-мутанта составил ≈15% (рис. 1). Вероятно, КЗЭ в клетках корней нокаут-мутантов является доминирующим, и полное ингибирование данного процесса в клетках корней мутантных растений могло бы привести к нарушению транспортных функций клетки в целом. При этом не исключено, что у данных растений существуют альтернативные пути КНЗЭ, в котором не участвует Flot1 (например, рецептор-опосредованный эндоцитоз). Отсутствие усиления сигнала в ответ на внесение в среду ингибирования 100 мМ NaCl в клетках корней нокаут-мутанта подтверждает данные об усилении КНЗЭ в условиях засоления с участием белка Flot1 [19, 21].
Использование ТЭМ показало, что обработка проростков НУК привела к изменению ультраструктуры клеток как у ДТ, так и у нокаут-мутанта (рис. 2ж–м, 3ж–м). По-видимому, НУК в высокой концентрации (100 мкМ) эффективно ингибирует КЗЭ и оказывает сильное влияние на эндомембранную систему, в том числе и на ее морфологию (деформация ТГС, фрагментация ЭР). Действие ауксина в контрольных условиях привело к скоплению Экз в ПП (рис. 3з), что, в свою очередь, указывает на активный процесс экзоцитоза, протекающий в клетках корней ДТ. Усиление сигнала FM4-64 в клетках корней ДТ в условиях засоления, по-видимому, происходит за счет перераспределения потоков везикулярного транспорта (активации КНЗЭ и направления экзоцитоза в сторону вакуоли).
В клетках корней растений A. thaliana клатрин-зависимый и клатрин-независимый пути эндоцитоза действуют повсеместно [12]. Показано, что обработка кончиков корней растений A. thaliana ауксинами снижала скорость КЗЭ и ингибировала поглощение мембранного белка PIP2;1 [19, 21, 35]. Однако следует отметить, что эндоцитоз PIP2;1 также происходит независимо от клатрина через нанодомен-опосредованный путь. Действительно, при солевом стрессе (100 мМ NaCl) совместная локализация между PIP2;1 с нанодоменным постоянным белком Flot1 увеличивалась [19]. Это согласуется с нашими данными по ингибиторному анализу эндоцитоза с НУК у ДТ и усиления сигнала FM4-64 при добавлении NaCl в среду (рис. 1).
Одновременное внесение НУК и MβЦД в среду инкубирования проростков ДТ блокировало все индуцированные солью увеличения поглощения FM4-64. Внесение NaCl в среду не приводило к увеличению внутриклеточного сигнала маркера. Это наблюдение указывает на то, что все дополнительные и индуцированные различными факторами пути эндоцитоза чувствительны к тому или иному из этих реагентов.
Микродомены мембран, обогащенные стеринами и сфинголипидами, могут модулировать локализацию и активность определенных мембранных белков [36]. Флотиллины были обнаружены в мембранных рафтах ПМ у A. thaliana, что указывает на его потенциальную связь с доменами, богатыми стеринами [21]. Известно, что флотиллины в составе рафтов входят в состав детергент-устойчивых мембран (ДУМ). Показано, что обработка фракции ДУМ MßЦД, выделенной в градиенте сахарозы [37], приводит к истощению фитостеринов и удалению плавающей фракции ДУМ из градиента плотности сахарозы, что, скорее всего, связано с нарушением свойств ДУМ [38], при этом глобальный белковый состав ПМ после обработки MßЦД сохранялся [27]. По-видимому, истощение свободного фитостерина из ПM клеток после обработки корней MßЦД приводит к полному удалению фракции ДУМ и, в некоторой степени, к нарушению гетерогенности мембраны, в частности богатых стерином доменов. Таким образом, фитостерины в ПМ клеток, возможно, являются ключевыми соединениями для структурирования липидных рафтов путем упорядочивания ацильной цепи липидов и продвижения их в качестве платформ рекрутирования мембранных белков, в состав которых входит и Flot1. Таким образом, наблюдаемые нами изменения в ультраструктуре клеток исследуемых линий растений A. thaliana (деформация ТГС, фрагментация ЭР), обработанных отдельно ауксином и одновременно НУК с MßЦД, могут быть объяснены изменениями в уровнях и/или составе свободных стеринов в мембранах в целом.
Одновременная обработка корней нокаут-мутантов ауксином и MßЦД оказала сильное ингибирующее действие на КЗЭ. Изучение ультраструктуры клеток растений Atflot1ko, обработанных одновременно двумя агентами, показало, что небольшое количество РЭ и МВ в цитоплазме клеток, наблюдаемых в условиях отсутствия соли в среде, полностью исчезло при внесении в среду 100 мМ NaCl. Вероятно, засоление среды приводит к быстрому слиянию образовавшихся в цитоплазме клеток РЭ между собой и/или с вакуолью, а также к полному замыканию цистерн КГ в кольцо, что, в свою очередь, блокирует процесс образования РЭ на транс-стороне.
Нами показано, что наличие в микродоменах ПМ клеток корней белка Flot1 сохраняет структуру КГ и его способность к формированию на транс-стороне РЭ при ингибировании КЗЭ и обработке корней MßЦД как в контрольных условиях, так и при засолении. При этом аналогичное действие ауксина и MßЦД на клетки корней нокаут-мутанта сильно деформировало структуру ТГС. Внесение в среду NaCl приводило к полному блокированию способности ТГС формировать везикулы на транс-стороне. Таким образом, мы можем утверждать, что функционирование микродоменного белка ПМ Flot1 сохраняет структуру КГ в клетках корней A. thaliana и принимает участие в образовании РЭ из ТГС.
Работа выполнена в рамках государственного задания Министерства образования и науки Российской Федерации (№ темы 122042700044-6).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Rodas-Junco B.A., Racagni-Di-Palma G.E., Canul-Chan M., Usorach J., Hernández-Sotomayor S.M.T. Link between lipid second messengers and osmotic stress in plants // IJMS. 2021. V. 22. P. 2658. https://doi.org/10.3390/ijms22052658
López-Hernández T., Haucke V., Maritzen T. Endocytosis in the adaptation to cellular stress // Cell Stress. 2020. V. 4. P. 230. https://doi.org/10.15698/cst2020.10.232
Ivanov R., Vert G. Endocytosis in plants: Peculiarities and roles in the regulated trafficking of plant metal transporters // Biol. Cell. 2021. V. 113. P. 1. https://doi.org/10.1111/boc.202000118
Paez Valencia J., Goodman K., Otegui M.S. Endocytosis and Endosomal Trafficking in Plants. Ann. Rev. Plant Biol. 2016. V. 67. P. 309. https://doi.org/10.1146/annurev-arplant-043015-112242
Fan L., Li R., Pan J., Ding Z., Lin J. Endocytosis and its regulation in plants // Trends Plant Sci. 2015. V. 20. P. 388. https://doi.org/10.1016/j.tplants.2015.03.014
Kaksonen M., Roux A. Mechanisms of clathrin-mediated endocytosis // Nat. Rev. Mol. Cell Biol. 2018. V. 19. P. 313. https://doi.org/10.1038/nrm.2017.132
Reynolds G.D., Wang C., Pan J., Bednarek S.Y. Inroads into Internalization: five years of endocytic exploration // Plant Physiol. 2018. V. 176. P. 208. https://doi.org/10.1104/pp.17.01117
Jelínková A., Malínská K., Simon S., Kleine-Vehn J., Pařezová M., Pejchar P., Kubeš M., Martinec J., Friml J., Zažímalová E., Petrášek J. Probing plant membranes with FM dyes: tracking, dragging or blocking? // Plant J. 2010. V. 61. P. 883. https://doi.org/10.1111/j.1365-313X.2009.04102.x
Gadeyne A., Sánchez-Rodríguez C., Vanneste S., Di Rubbo S., Zauber H., Vanneste K., Van Leene J., De Winne N., Eeckhout D., Persiau G., Van De Slijke E., Cannoot B., Vercruysse L., Mayers J.R., Adamowski M., et al. The TPLATE adaptor complex drives clathrin-mediated endocytosis in plants // Cell. 2014. V. 156. P. 691. https://doi.org/10.1016/j.cell.2014.01.039
Estevez J.M. Plant cell expansion. Methods and protocols // MIMB. 2015. V. 1242. P. 59. https://doi.org/10.1007/978-1-4939-1902-4
Dhonukshe P., Aniento F., Hwang I., Robinson D.G., Mravec J., Stierhof Y.-D., Friml J. Clathrin-mediated constitutive endocytosis of PIN auxin efflux carriers in Arabidopsis // Curr. Biol. 2007. V. 17. P. 520. https://doi.org/10.1016/j.cub.2007.01.052
Baral A., Irani N.G., Fujimoto M., Nakano A., Mayor S., Mathew M.K. Salt-induced remodeling of spatially restricted clathrin-independent endocytic pathways in Arabidopsis root // Plant Cell. 2015. V. 27. P. 1297. https://doi.org/10.1105/tpc.15.00154
Boutte Y., Jonsson K., McFarlane H.E., Johnson E., Gendre D., Swarup R., Friml J., Samuels L., Robert S., Bhalerao R.P. ECHIDNA-mediated post-Golgi trafficking of auxin carriers for differential cell elongation // Proc. Nat. Acad. Sci. 2013. V. 110. P. 16259.
Ortiz-Zapater E., Soriano-Ortega E., Marcote M.J., Ortiz-Masiá D., Aniento F. Trafficking of the human transferrin receptor in plant cells: effects of tyrphostin A23 and brefeldin A // Plant J. 2006. V. 48. P. 757. https://doi.org/10.1111/j.1365-313X.2006.02909.x
Paciorek T., Zažímalová E., Ruthardt N., Petrášek J., Stierhof Y.D., Kleine-Vehn J., Morris D.A., Emans N., Jürgens G., Geldner N., Friml J. Auxin inhibits endocytosis and promotes its own efflux from cells // Nature. 2005. V. 435. P. 1251. https://doi.org/10.1038/nature03633
Robert S., Kleine-Vehn J., Barbez E., Sauer M., Paciorek T., Baster P., Vanneste S., Zhang J., Simon S., Čovanová M., Hayashi K., Dhonukshe P., Yang Z., Bednarek S.Y., Jones A.M., et al. ABP1 mediates auxin inhibition of clathrin-dependent endocytosis in Arabidopsis // Cell. 2010. V. 143. P. 111. https://doi.org/10.1016/j.cell.2010.09.027
Abas L., Benjamins R., Malenica N., Paciorek T., Wisniewska J., Moulinier-Anzola J.C., Sieberer T., Friml J., Luschnig C. Intracellular trafficking and proteolysis of the Arabidopsis auxin-efflux facilitator PIN2 are involved in root gravitropism // Nat. Cell Biol. 2006. V. 8. P. 249.
Kitakura S., Vanneste S., Robert S., Löfke C., Teichmann T., Tanaka H., Friml J. Clathrin mediates endocytosis and polar distribution of PIN auxin transporters in Arabidopsis // Plant Cell. 2011. V. 23. P. 1920.
Li X., Wang X., Yang Y., Li R., He Q., Fang X., Luu D.T., Maurel C., Lin J. Single-molecule analysis of PIP2;1 dynamics and partitioning reveals multiple modes of Arabidopsis plasma membrane aquaporin regulation // Plant Cell. 2011. V. 23. P. 3780. https://doi.org/10.1105/tpc.111.091454
Glebov O.O., Bright N.A., Nichols B.J. Flotillin-1 defines a clathrin-independent endocytic pathway in mammalian cells // Nat. Cell. Biol. 2006. V. 8. P. 46.
Li R., Liu P., Wan Y., Chen T., Wang Q., Mettbach U., Baluška F., Šamaj J., Fang X., Lucas W.J., Lin J. A membrane microdomain-associated protein, Arabidopsis Flot1, is involved in a clathrin-independent endocytic pathway and is required for seedling development // Plant Cell. 2012. V. 24. P. 2105. https://doi.org/10.1105/tpc.112.095695
Zhang L., Xing J., Lin J. At the intersection of exocytosis and endocytosis in plants // New Phytol. 2019. V. 224. P. 1479. https://doi.org/10.1111/nph.16018
Cao Y., He Q., Qi Z., Zhang Y., Lu L., Xue J., Li J., Li R. Dynamics and endocytosis of Flot1 in Arabidopsis require CPI1 function // IJMS. 2020. V. 21. P. 1552. https://doi.org/10.3390/ijms21051552
Khalilova L.A., Sergienko O.V., Orlova Y.V., Myasoedov N.A., Karpichev I.V., Balnokin Y.V. Arabidopsis thaliana mutant with t-DNA insertion in the Flot1 (At5g25250) gene promotor possesses increased resistance to NaCl // Russ. J. Plant Physiol. 2020. V. 67. P. 275. https://doi.org/10.1134/S1021443720020077
Saslowsky D.E., Cho J.A., Chinnapen H., Massol R.H., Chinnapen D.J., Wagner J.S., De Luca H.E., Kam W., Paw B.H., Lencer W.I. Intoxication of zebra fish and mammalian cells by cholera toxin depends on the flotillin/reggie proteins but not Derlin-1 or -2 // J. Clin. Invest. 2010. V. 120. P. 4399.
Chadda R., Howes M.T., Plowman S.J., Hancock J.F., Parton R.G., Mayor S. Cholesterol-sensitive cdc42 activation regulates actin polymerization for endocytosis via the GEEC pathway // Traffic. 2007. V. 8. P. 702. https://doi.org/10.1111/j.1600-0854.2007.00565.x
Roche Y., Gerbeau-Pissot P., Buhot B., Thomas D., Bonneau L., Gresti J., Mongrand S., Perrier-Cornet J., Simon-Plas F. Depletion of phytosterols from the plant plasma membrane provides evidence for disruption of lipid rafts // FASEB J. 2008. V. 22. P. 3980. https://doi.org/10.1096/fj.08-111070
Xue Y., Xing J., Wan Y., Lv X., Fan L., Zhang Y., Song K., Wang L., Wang X., Deng X., Baluška F., Christie J.M., Lin J. Arabidopsis blue light receptor phototropin 1 undergoes blue light-induced activation in membrane microdomains // Mol. Plant. 2018. V. 11. P. 846. https://doi.org/10.1016/j.molp.2018.04.003
Khalilova L.A., Lobreva O.V., Nedelyaeva O.I., Karpichev I.V., Balnokin Y.V. Involvement of the membrane nanodomain protein, AtFlot1, in vesicular transport of plasma membrane H+-ATPase in Arabidopsis thaliana under salt stress // IJMS. 2023. V. 24. P. 1251. https://doi.org/10.3390/ijms24021251
Bolte S., Talbot C., Boutte Y., Catrice O., Read N.D., Satiat-Jeunemaitre B. FM-dyes as experimental probes for dissecting vesicle trafficking in living plant cells // J. Microsc. 2004. V. 214. P. 159.
Mayor S., Parton R.G., Donaldson J.G. Clathrin-independent pathways of endocytosis // Cold Spring Harb. Perspect. Biol. 2014. V. 6. a016758. https://doi.org/10.1101/cshperspect.a016758
Šamaj J., Read N.D., Volkmann D., Menzel D., Baluška F. The endocytic network in plants // Trends Cell Biol. 2005. V. 15. P. 425. https://doi.org/10.1016/j.tcb.2005.06.006
Lam S.K., Tse Y.C., Jiang L., Oliviusson P., Heinzerling O., Robinson D.G. Plant prevacuolar compartments and endocytosis // Plant Cell Monographs. 2005. P. 37. https://doi.org/10.1007/7089_004
Narasimhan M., Gallei M., Tan S., Johnson A., Verstraeten I., Li L., Rodriguez L., Han H., Himschoot E., Wang R., Vanneste S., Sánchez-Simarro J., Aniento F., Adamowski M., Friml J. Systematic analysis of specific and nonspecific auxin effects on endocytosis and trafficking // Plant Physiol. 2021. V. 186. P. 1122. https://doi.org/10.1093/plphys/kiab134.
Martinière A., Fiche J.B., Smokvarska M., Mari S., Alcon C., Dumont X., Hematy K., Jaillais Y., Nollmann M., Maurel C. Osmotic stress activates two reactive oxygen species pathways with distinct effects on protein nanodomains and diffusion // Plant Physiol. 2019. V. 179. P. 1581. https://doi.org/10.1104/pp.18.01065
Feraru E., Friml J. PIN polar targeting // Plant Physiol. 2008. V. 147. P. 1553.
Danielsen E.M., Hansen G.H. Lipid rafts in epithelial brush borders: atypical membrane microdomains with specialized functions // Biochim. Biophys. Acta Biomembr. 2003. V. 1617. P. 1.
dos Santos S.M., Weber C.C., Franke C., Muller W.E., Eckert G.P. Cholesterol: coupling between membrane microenvironment and ABC transporter activity // Biochem. BioPhys. Res. Commun. 2007. V. 354. P. 216.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Рис. 1. Интенсивность флуоресценции FM4-64 в клетках корней 5-дневных проростков растений A. thaliana дикого типа и нокаут-мутанта в отсутствие соли в среде и при солевом стрессе.
Инструменты
Физиология растений


