Физиология растений, 2023, T. 70, № 5, стр. 484-493
Кратковременная предобработка мелатонином повышает устойчивость растений ячменя к последующему действию кадмия
Е. Д. Данилова a, *, И. Е. Злобин a, b, М. В. Ефимова a
a Федеральное государственное автономное образовательное учреждение высшего образования
“Национальный исследовательский Томский государственный университет”
Томск, Россия
b Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: nusy.l.d@gmail.com
Поступила в редакцию 04.03.23
После доработки 04.03.2023
Принята к публикации 04.03.2023
- EDN: WWXHRG
- DOI: 10.31857/S0015330323600225
Аннотация
Исследовано влияние кратковременной и длительной прикорневой обработки мелатонином на ростовые параметры, фотохимическую активность ФС II, содержание основных фотосинтетических пигментов, перекисное окисление липидов и накопление неорганических ионов в растениях ячменя на фоне действия хлорида кадмия. Впервые показано, что защитное действие фитомелатонина при кратковременной обработке проявляется в снижении токсического действия кадмия на содержание фотосинтетических пигментов и накопление ионов кадмия в побегах и корнях растений ячменя. В основе протекторного действия мелатонина лежит его способность снижать интенсивность окислительного стресса за счет поддержания уровня каротиноидов и повышения активности антиоксидантных ферментов. Эффективность кратковременного применения мелатонина по ряду показателей превосходит его защитный эффект от длительного воздействия. Полученные данные свидетельствуют о возможности применения мелатонина в качестве вещества, индуцирующего состояние прайминга растений при последующем действии кадмия.
ВВЕДЕНИЕ
Загрязнение почв ионами тяжелых металлов (ТМ) обусловлено использованием фосфатных удобрений, добычей полезных ископаемых, сжиганием топлива и металлургическими промышленными процессами [1, 2]. Избыточные концентрации ТМ в среде вызывают снижение продуктивности растений и создают риски для животных и человека из-за загрязнения продуктов питания и кормов токсичными элементами. Повышенное содержание подвижных форм ТМ присуще кислым почвам, на которые приходится более трети всех пахотных угодий [2, 3]. Одним из наиболее токсичных металлов является кадмий, избыточная концентрация которого лимитирует рост и развитие растений [4, 5]. Наиболее интенсивные источники загрязнения окружающей среды кадмием – металлургия и гальванотехника, а также сжигание твердого и жидкого топлива. Кадмий токсичен даже в низких концентрациях [6]. Он негативно влияет на растения на морфологическом, физиологическом, биохимическом и молекулярном уровнях [7]. Многочисленные исследования показали, что кадмий ингибирует прорастание семян, уменьшает длину и массу корней, снижает число листьев растений [8]. Наравне со свинцом и медью, кадмий является одним из наиболее токсичных металлов, попадающих в пищевые цепи и способных вызывать у человека канцерогенные и хронические заболевания. Кислотность почв повышает доступность ионов ТМ, в том числе и кадмия для растений. Однако, принятые в настоящее время технологии снижения кислотности почв могут оказывать негативное влияние на окружающую среду [9]. Применение соединений гормональной природы для повышения продуктивности растений в условиях техногенного стресса является эффективной и безопасной технологией [3]. В этом свете особый интерес представляет фитомелатонин – плейотропная молекула индольной природы, которую ряд исследователей относят к фитогормонам [10]. Показано, что экзогенный мелатонин снижает токсическое действие меди, кадмия, алюминия и никеля за счет усиления роста корней, повышения антиоксидантной активности, увеличения интенсивности фотосинтеза и снижения накопления ионов металлов в разных частях растений [11–13]. Однако, в большинстве работ, посвященных влиянию мелатонина на устойчивость растений в условиях избытка ТМ, используют высокие концентрации как самого мелатонина, так и изучаемых металлов. Первое является экономически не выгодным, второе не соответствует реальным характеристикам загрязненных почв. Кроме того, в научной литературе практически не обсуждается способность мелатонина вызывать у растений состояние прайминга – процесса приобретения организмом способности повышать стресс-толерантность в ответ на действие того или иного повреждающего фактора в будущем [14]. Мелатонин может служить индуктором прайминга, приводя к значительному повышению устойчивости растений к самым разным абиотическим и биотическим повреждающим воздействиям. Целесообразным представляется изучение краткосрочного, по сравнению длительным, воздействия мелатонина на устойчивость злаковых растений к действию тяжелых металлов в условиях прикорневой обработки. Данные о механизмах защиты растений мелатонином в ответ на действие ионов кадмия, а также оптимизация технологии обработки растений с целью получения максимального защитного эффекта имеют существенное значение как для получения новых фундаментальных знаний, так и для создания научной основы разработки инновационных сельскохозяйственных технологий повышения продуктивности растений.
Цель работы – выяснение физиологических механизмов прайминга мелатонином растений ячменя на фоне отсроченного действия избыточного содержания кадмия в среде по сравнению с длительным действием мелатонина во время “кадмиевого стресса”.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования были проведены на растениях ячменя Hordeum vulgare L. сорта Биом. Растения выращивали в грунте с добавлением перлита в течение пяти суток при температуре 19 ± 2°С в фитотроне с 16-часовым фотопериодом. Далее, в течение семи суток, растения адаптировали к условиям жидкой питательной среды по Blamey (pH 4.5) [15] с низким содержанием фосфора. Данная питательная среда наиболее соответствует реальному составу почвенного раствора на кислых почвах по сравнению с традиционно используемыми питательными средами, где из-за высоких значений рН раствора и высоких концентраций фосфат-ионов доступность ионов металлов для растений и, следовательно, их токсический эффект значительно снижены [3, 16].
После адаптации часть растений подвергали суточной прикорневой обработке мелатонином в концентрации 10 мкМ. Для остальных растений меняли питательную среду на сутки. Затем все растения разделяли на шесть вариантов (табл. 1).
Таблица 1.
Схема эксперимента
| № | Варианты | 1–5 сут (5 сут) |
5–12 сут (7 сут) |
12–13 сут (1 сут) |
13–19 сут (6 сут) |
|---|---|---|---|---|---|
| 1 | Контроль | Проращивание семян в перлите | Адаптация
к условиям
жидкой
питательной среды по Blamey (ПС, pH 4.5) |
ПС | ПС |
| 2 | Кратковременное воздействие мелатонином | ПС + 10 мкМ Мел | ПС | ||
| 3 | Длительное воздействие мелатонином | ПС | ПС + 10 мкМ Мел | ||
| 4 | Кадмий | ПС | ПС + 2 мкМ CdCl2 | ||
| 5 | Прайминг мелатонином + кадмий | ПС + 10 мкМ Мел | ПС + 2 мкМ CdCl2 | ||
| 6 | Длительное воздействие мелатонина и кадмия | ПС | ПС + 10 мкМ Мел + 2 мкМ CdCl2 |
Концентрацию хлорида кадмия (CdCl2) подбирали на основании типичных значений в почвенном растворе промышленно загрязненных кислых почв [16–18]. Через шесть суток оценивали ростовые показатели (длину осевых орагнов, суммарную площадь листовой поверхности), содержание фотосинтетических пигментов и параметры фотохимической активности ФС II. Растительный материал для проведения биохимических методов анализа фиксировали жидким азотом и хранили при –70°С.
Сырую и сухую биомассы растительного материала оценивали гравиметрическим методом с помощью аналитических весов “Sartorius CP 622” (Германия). Сухую массу определяли после фиксации материала и его высушивания до постоянного веса. Содержание воды (% от сырой массы) рассчитывали, исходя из отношения разности сырой и сухой биомасс, отнесенной к сырой массе. Расчет площади листьев осуществляли по формуле Аникеева и Кутузова [19].
Параметры фотохимической активности ФС II измеряли с помощью РАМ-флуориметра (MINI-PAM-II, “Heinz-Walz”, Германия). Параметры коэффициентов флуоресценции и относительной скорости транспорта электронов рассчитывали с использованием программного обеспечения MINI-PAM-II.
Анализ содержания металлов в корневой системе и надземной части растений производили методом масс-спектрометрии с индуктивно-связанной плазмой (ICP-MS) (масс-спектрометр “Agilent 7900”, США). С целью десорбции ионов металлов из апопластного пространства использовали отмывку растворами хлорида кальция.
Величину ПОЛ измеряли спектрофотометрическим методом по концентрации соединений, активных в реакции с тиобарбитуровой кислотой при нагревании (ТБК-АП) по Buege и Aust [20].
Концентрацию фотосинтетических пигментов в растворе определяли согласно Lichtenthaler [21]. Навеску листьев (70 мг) вносили в пробирку с 96% этанолом (1.5 мл) и карбонатом кальция, вортексировали, центрифугировали 10 мин (10 000 g), надосадочную жидкость аккуратно переносили в пробирки. Данную экстракцию производили трижды, пробирки держали в темноте. Доводили количество спирта во всех пробирках до одинакового объема (до 5 мл), перемешивали и измеряли оптическую плотность.
Содержание эндогенного пролина определяли согласно Bates с соавт. [22].
Для оценки активности супероксиддисмутазы (СОД) и пероксидазы (ПО) образцы растений растирали в жидком азоте с нерастворимым поливинилпирролидоном, экстрагировали калийфосфатным буфером (рН 7.4), затем центрифугировали 20 мин (8000 g, t = 4°С (“Eppendorf 5430R”, Германия). Из полученного супернатанта отбирали аликвоты для определения активности СОД и ПО. Общую активность СОД определяли по методу, описанному Beauchamp и Fridovich [23]. Активность ПО определяли согласно Шевяковой с соавт. [24]. Содержание белка в препаратах измеряли по методу Esen [25].
Полученные результаты представлены в таблицах и на рисунках в виде средней арифметической со стандартной ошибкой. Для сравнения независимых выборок, подчиняющихся закону нормального распределения, использовали параметрический критерий Стьюдента. Значения t-критерия находили для 95% уровня значимости (Р ≤ 0.05).
РЕЗУЛЬТАТЫ
Влияние хлорида кадмия и мелатонина на морфометрические параметры растений ячменя
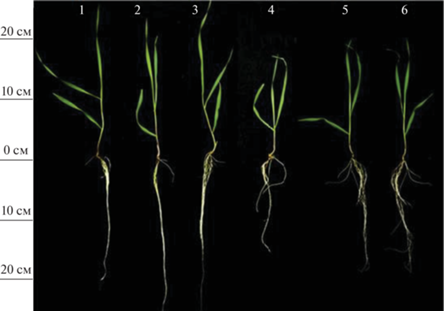
В оптимальных условиях выращивания мелатонин не оказывал достоверного влияния на рост ячменя. Добавление в раствор 2 мкМ кадмия вызывало подавление роста стебля и корня на 11 и 24%, соответственно (рис. 1а, 2). Мелатонин, вне зависимости от длительности воздействия, частично снижал негативное действие “кадмиевого стресса” на рост стебля и корня.
Рис. 1.
Влияние хлорида кадмия и мелатонина на рост растений ячменя: а – длина стебля и корня; б – суммарная площадь листовой поверхности. *P ≤ 0.05 при сравнении с контрольным значением; #P ≤ 0,05 при сравнении с CdCl2. 1 – контроль; 2 – мелатонин (1 сут); 3 – мелатонин (6 сут); 4 – CdCl2 (6 сут); 5 – мелатонин (1 сут) + CdCl2 (6 сут); 6 – мелатонин (6 сут) + CdCl2 (6 сут).
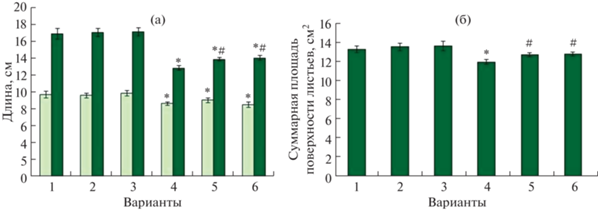
Негативное воздействие “кадмиевого стресса” отразилось не только на размерах осевых органов, но и на площади листовой поверхности, которая сокращалась на 12% (рис. 1б, 2). Прайминг мелатонином с последующим “кадмиевым стрессом”, как и длительное воздействие мелатонина, частично поддерживали площадь ассимилирующей поверхности по сравнению с действием кадмия в отсутствие мелатонина.
Влияние хлорида кадмия и мелатонина на фотосинтетические параметры растений ячменя
Анализ флуоресценции хлорофилла – широко распространённый метод для обнаружения изменений в условиях стресса не только ФС II, но и фотосинтетического аппарата в целом. Одним из основных критериев эффективности протекания фотохимических процессов в ФС II является максимальная квантовая эффективность (Fv/Fm). Полученные данные свидетельствуют о том, что Fv/Fm листьев растений снижалась на 6% при действии ионов кадмия относительно контрольного варианта (табл. 2).
Таблица 2.
Влияние хлорида кадмия и мелатонина на параметры фотохимической активности ФС II листьев ячменя
| № | Варианты | Y (II) | ETR | Y(NO) | Y(NPQ) | Fv/Fm |
|---|---|---|---|---|---|---|
| 1 | Контроль (ПС 7 сут) | 0.65 ± 0.01 | 24.70 ± 1.18 | 0.22 ± 0.01 | 0.13 ± 0.001 | 0.84 ± 0.01 |
| 2 | 1 сут 10 мкМ мел + 6 сут ПС | 0.65 ± 0.02 | 23.39 ± 0.85 | 0.22 ± 0.01 | 0.13 ± 0.01 | 0.83 ± 0.001 |
| % от контрольного значения | 99 | 95 | 100 | 102 | 98 | |
| 3 | 1 сут ПС + 6 сут 10 мкМ мел | 0.64 ± 0.01 | 22.36 ± 0.34 | 0.22 ± 0.01 | 0.12 ± 0.001 | 0.83 ± 0.001 |
| % от контрольного значения | 97 | 91 | 100 | 89 | 99 | |
| 4 | 1 сут ПС + 6 сут 2 мкМ CdCl2 | 0.62 ± 0.01 | 23.03 ± 0.03 | 0.24 ± 0.01 | 0.14 ± 0.01 | 0.79 ± 0.01* |
| % от контрольного значения | 94 | 93 | 112 | 110 | 94 | |
| 5 | 1 сут 10 мкМ мел + 6 сут 2 мкМ CdCl2 | 0.65 ± 0.01 | 23.72 ± 0.33 | 0.23 ± 0.001 | 0.11 ± 0.01 | 0.81 ± 0.02 |
| % от контрольного значения | 100 | 96 | 106 | 87 | 96 | |
| 6 | 1 сут ПС + 6 сут (10 мкМ мел и 2 мкМ CdCl2) | 0.67 ± 0.03 | 24.05 ± 1.00 | 0.21 ± 0.02 | 0.12 ± 0.01 | 0.80 ± 0.02 |
| % от контрольного значения | 102 | 97 | 98 | 91 | 96 |
Под действием 2 мкМ CdCl2 фотохимическая эффективность ФС II несколько снижалась, о чем можно судить по тенденции к уменьшению параметра эффективного квантового выхода ФС II (Y (II)) и увеличению нерегулируемой диссипации энергии в ФС II (Y(NO)). Фотоповреждение ФС II является результатом превышения поглощения световой энергии фотосистемой над способностью использования энергии при фотосинтезе [26].
ФС II у предварительно обработанных мелатонином растений сохраняла более высокую фотохимическую активность в условиях загрязнения хлоридом кадмия. Так, значение параметра эффективного квантового выхода ФС II (Y (II)) в варианте с праймингом было практически равно контрольному (табл. 2), как и при длительном воздействии мелатонином. Кроме того, длительная обработка мелатонином на фоне действия ионов кадмия снижала регулируемое тепловое рассеяние энергии возбуждения (Y (NPQ)) на 19%, а кратковременная – на 23% по сравнению со стрессовым вариантом.
Другим негативным эффектом ТМ является снижение уровня фотосинтетических пигментов, в том числе из-за подавления их биосинтеза [27]. В контрольных условиях листья растений ячменя содержали, в среднем, 0.77 мг/г хлорофилла а, 0.22 мг/г хлорофилла b и 0.19 мг/г каротиноидов. В ответ на действие мелатонина возрастало содержание хлорофиллов (a, b) и каротиноидов, причем степень увеличения определялась продолжительностью воздействия. Так, при кратковременной обработке мелатонином содержание пигментов увеличивалось на 14–26%, тогда как при длительной – лишь на 4–7% (рис. 3). Воздействие хлорида кадмия оказывало значительное влияние на содержание в листьях фотосинтетических пигментов. Так, добавление 2 мкМ СdCl2 в среду снижало количество хлорофилла а, хлорофилла b и каротиноидов на 31, 18 и 24% соответственно (рис. 3).
Рис. 3.
Влияние хлорида кадмия и мелатонина на содержание пигментов в листьях ячменя. * P ≤ 0.05 при сравнении с контрольным значением; # P ≤ 0.05 при сравнении с CdCl2. 1 – контроль; 2 – мелатонин (1 сут); 3 – мелатонин (6 сут); 4 – CdCl2 (6 сут); 5 – мелатонин (1 сут) + CdCl2 (6 сут); 6 – мелатонин (6 сут) + + CdCl2 (6 сут).
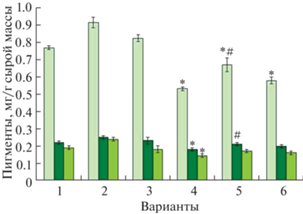
В присутствии мелатонина в среде, содержавшей хлорид кадмия, количество хлорофиллов (а, b) и каротиноидов на 9–14 и 11% соответственно, превышало содержание этих пигментов в листьях растений, находившихся в аналогичных условиях, но в отсутствие мелатонина. Однако прайминг мелатонином был более эффективным для снижения токсического действия кадмия на содержание хлорофиллов: количество хлорофилла a возрастало на 18% (0.67 мг/г) относительно варианта с хлоридом кадмия (0.53 мг/г), а количество хлорофилла b (0.21 мг/г) было практически равно контрольному значению.
Влияние хлорида кадмия и мелатонина на перекисное окисление липидов и антиоксидантный статус растений ячменя
Величину ПОЛ в растениях ячменя оценивали по содержанию продуктов, активных в реакции с тиобарбитуровой кислотой (ТБК-АП) при нагревании. В контрольных условиях листья растений ячменя содержали в среднем 39 нМ/г, стебли – 97 нМ/г, корни – 69 нМ/г сырой массы ТБК-АП (рис. 4). В ответ на действие мелатонина достоверного роста или снижения уровня ТБК-АП не отмечено ни для кратковременной обработки, ни для длительной. Как видно из данных, представленных на рисунке 4, добавление 2 мкМ CdCl2 в питательный раствор повышало содержание ТБК-АП на 49% в листьях и на 32% в стеблях и корнях, что свидетельствует о развитии в растениях ячменя окислительного стресса.
Рис. 4.
Влияние хлорида кадмия и мелатонина на величину перекисного окисления липидов в разных частях растений ячменя. * P ≤ 0.05 при сравнении с контрольным значением; # P ≤ 0.05 при сравнении с CdCl2. 1 – контроль; 2 – мелатонин (1 сут); 3 – мелатонин (6 сут); 4 – CdCl2 (6 сут); 5 – мелатонин (1 сут) + CdCl2 (6 сут); 6 – мелатонин (6 сут) + CdCl2 (6 сут).
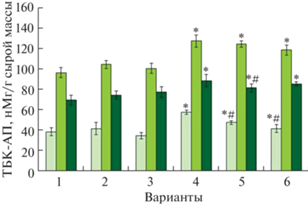
Прайминг мелатонином с последующим действием кадмия частично снижал ПОЛ, причем для листьев растений кратковременная предобработка была несколько эффективнее добавления мелатонина в питательный раствор на фоне стрессора. Для снижения негативного влияния окислительного стресса в растениях активируются антиоксидантные защитные системы, действие которых направлено на гашение активных форм кислорода. Важными ферментами антиоксидантной системы являются СОД и ПО. Кратковременное и длительное воздействие мелатонина повышало активность СОД на 30 и 44% соответственно, в сравнении с контрольным вариантом. В ответ на действие хлорида кадмия в растениях ячменя увеличивалась активность СОД на 62% относительно контрольных значений (рис. 5а).
Рис. 5.
Влияние хлорида кадмия и мелатонина на активность антиоксидантных ферментов в растениях ячменя. а – активность СОД, условных единиц/мг белка в минуту; б – активность ПО, условных единиц/мг белка в минуту; *P ≤ 0.05 при сравнении с контрольным значением; # P ≤ 0.05 при сравнении с CdCl2. 1 – контроль; 2 – мелатонин (1 сут); 3 – мелатонин (6 сут); 4 – CdCl2 (6 сут); 5 – мелатонин (1 сут) + CdCl2 (6 сут); 6 – мелатонин (6 сут) + CdCl2 (6 сут).
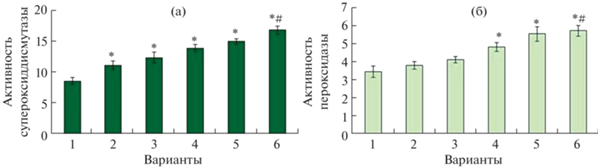
Прайминг растений мелатонином с последующим действием хлорида кадмия не вызывал достоверного увеличения активности СОД относительно действия только стрессора. Однако длительное воздействие мелатонина приводило к росту активности СОД на 96% относительно контрольных значений и на 34% относительно варианта с кадмием (рис.5а). Использование мелатонина в оптимальных условиях выращивания ячменя не приводило к достоверному изменению активности ПО, тогда как хлорид кадмия повышал активность ПО на 39% (рис. 5б). Прайминг мелатонином с последующим действием стрессора увеличивал изучаемый показатель на 60%. Длительное воздействие мелатонина достоверно увеличивало активность ПО не только относительно контроля, но и в сравнении с действием CdCl2. Таким образом, длительное применение мелатонина было эффективнее прайминга для увеличения активности антиоксидантных ферментов (СОД и ПО) растений ячменя, подвергнутых воздействию кадмия.
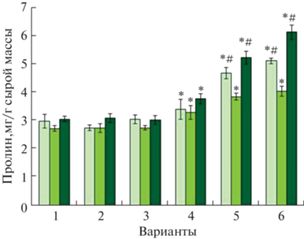
Типичным ответом растений на стрессовые условия является накопление пролина [12] – аминокислоты, которая выполняет различные функции, в том числе осмопротектора, стабилизатора белка, хелатора металлов и антиоксиданта [28]. В оптимальных условиях выращивания мелатонин, вне зависимости от части растения и длительности обработки, достоверно не изменял содержание пролина в ячмене. Хлорид кадмия увеличивал накопление пролина в стеблях и корнях растений ячменя на 21 и 24% соответственно (рис. 6б, в). Прайминг мелатонином с последующим загрязнением среды способствовал увеличению содержания пролина в листьях и корнях ячменя не только относительно контрольных значений, но и по сравнению с действием стрессового фактора. Длительное воздействие мелатонина также усиливало накопление пролина в органах растений ячменя на фоне хлорида кадмия и продемонстрировало большую эффективность по сравнению с праймингом (рис. 6).
Рис. 6.
Влияние хлорида кадмия и мелатонина на накопление пролина в разных частях растений ячменя. * P ≤ 0.05 при сравнении с контрольным значением; # P ≤ 0.05 при сравнении с CdCl2. 1 – контроль; 2 – мелатонин (1 сут); 3 – мелатонин (6 сут); 4 – CdCl2 (6 сут); 5 – мелатонин (1 сут) + CdCl2 (6 сут); 6 – мелатонин (6 сут) + CdCl2 (6 сут).
Влияние хлорида кадмия и мелатонина на накопление неорганических ионов в растениях ячменя
Было проанализировано содержание натрия, магния, калия, кальция, фосфора и кадмия в побегах и корнях растений ячменя в норме и в условиях “кадмиевого стресса”. Хлорид кадмия снижал количество ионов натрия на 52 и 13%, магния – на 15 и 19%, фосфора – на 19 и 25% для надземной (табл. 3) и подземной (табл. 4) частей растений, соответственно. Ожидаемо, что накопление ионов кадмия многократно возрастало как в корне, так и побеге ячменя – в среднем в 72 раза относительно контрольных значений (табл. 3, 4). Мелатонин вне зависимости от длительности применения на фоне действия 2 мкМ CdCl2 восстанавливал содержание кальция в побегах растений ячменя. Кроме того, прайминг мелатонином с последующим “кадмиевым стрессом” приводил к снижению количества ионов кадмия в надземной части растений относительно действия кадмия в отсутствие мелатонина (табл. 3).
Таблица 3.
Влияние хлорида кадмия и мелатонина на содержание неорганических ионов в побегах растений ячменя
| № | Варианты | Содержание элементов, мкг/г | |||||
|---|---|---|---|---|---|---|---|
| Na | Mg | K | Ca | P | Cd | ||
| 1 | Контроль (ПС 7 сут) | 724 ± 4 | 2380 ± 115 | 60717 ± 1976 | 9196 ± 432 | 5302 ± 241 | 1.1 ± 0.05 |
| 2 | 1 сут 10 мкМ мел + 6 сут ПС | 674 ± 35* | 2493 ± 110 | 58900 ± 2623 | 9411 ± 421 | 5173 ± 194 | 1.2 ± 0.06 |
| % от контрольного значения | 93 | 105 | 97 | 102 | 98 | 110 | |
| 3 | 1 сут ПС + 6 сут 10 мкМ мел | 703 ± 29 | 2271 ± 123 | 59314 ± 2849 | 9518 ± 470 | 5417 ± 263 | 0.9 ± 0.05* |
| % от контрольного значения | 97 | 95 | 98 | 104 | 102 | 82 | |
| 4 | 1 сут ПС + 6 сут 2 мкМ CdCl2 | 346 ± 18* | 2014 ± 89* | 49383 ± 2513* | 7691 ± 375* | 4279 ± 216* | 80 ± 5* |
| % от контрольного значения | 48 | 85 | 81 | 84 | 81 | 7273 | |
| 5 | 1 сут 10 мкМ мел + 6 сут 2 мкМ CdCl2 | 305 ± 17* | 2146 ± 109 | 53396 ± 2692* | 9589 ± 502# | 4234 ± 215* | 50 ± 4*, # |
| % от контрольного значения | 42 | 89 | 88 | 104 | 80 | 4545 | |
| 6 | 1 сут. ПС + 6 сут (10 мкМ мел и 2 мкМ CdCl2) | 285 ± 16*,# | 1863 ± 97* | 43059 ± 2217* | 9797 ± 493# | 4104 ± 209* | 81 ± 5* |
| % от контрольного значения | 39 | 78 | 71 | 107 | 77 | 7364 | |
Таблица 4.
Влияние хлорида кадмия и мелатонина на содержание неорганических ионов в корнях растений ячменя
| № | Варианты | Содержание элементов, мкг/г | |||||
|---|---|---|---|---|---|---|---|
| Na | Mg | K | Ca | P | Cd | ||
| 1 | Контроль (ПС 7 сут) | 6708 ± 349 | 3656 ± 190 | 18820 ± 1157 | 2931 ± 180 | 4663 ± 246 | 10 ± 0,8 |
| 2 | 1 сут 10 мкМ мел + 6 сут ПС | 6512 ± 369 | 3794 ± 212 | 19386 ± 1094 | 2878 ± 158 | 4321 ± 249 | 8 ± 0.6 |
| % от контрольного значения | 97 | 104 | 103 | 98 | 93 | 80 | |
| 3 | 1 сут ПС + 6 сут 10 мкМ мел | 6674 ± 349 | 3872 ± 231 | 17899 ± 904 | 3061 ± 162 | 4567 ± 238 | 11 ± 0.7 |
| % от контрольного значения | 99 | 106 | 95 | 104 | 98 | 110 | |
| 4 | 1 сут ПС + 6 сут 2 мкМ CdCl2 | 5856 ± 314* | 2964 ± 157* | 18614 ± 970 | 3222 ± 174 | 3495 ± 184* | 737 ± 41* |
| % от контрольного значения | 87 | 81 | 99 | 110 | 75 | 7370 | |
| 5 | 1 сут 10 мкМ мел + 6 сут 2 мкМ CdCl2 | 6103 ± 311 | 3504 ± 184 | 19658 ± 1037 | 3040 ± 167 | 3234 ± 169* | 632 ± 37* |
| % от контрольного значения | 91 | 96 | 104 | 104 | 69 | 6320 | |
| 6 | 1 сут ПС + 6 сут (10 мкМ мел и 2 мкМ CdCl2) |
6224 ± 327 | 3913 ± 213# | 18004 ± 934 | 3304 ± 181 | 3302 ± 173* | 682 ± 38* |
| % от контрольного значения | 93 | 107 | 96 | 113 | 71 | 6820 | |
ОБСУЖДЕНИЕ
Изучение ответных реакций ячменя на действие хлорида кадмия позволяет оценить прямые токсические эффекты избыточных концентраций тяжелых металлов для злаковых культур. Действие хлорида кадмия приводило к значительному снижению содержания фотосинтетических пигментов. Одна из основных причин этого – подавление биосинтеза хлорофиллов a, b [27], происходящего, в основном, из-за ингибирования протохлорофиллид-редуктазы, которая является ключевым ферментом данного процесса [29].
Падение уровня пигментов в совокупности с уменьшением площади ассимилирующей поверхности и снижением активности фотосинтетических реакций ФС II свидетельствует об ингибировании процессов фотосинтеза. В связи с этим, способность мелатонина препятствовать деградации хлорофиллов a, b и поддерживать фотохимическую активность ФС II, тем самым задерживая старение листьев растений ячменя, как было показано нами ранее [30], является одним из защитных механизмов в условиях действия тяжелых металлов.
О стрессе, вызванном действием ионов кадмия, свидетельствует увеличение степени ПОЛ в органах растений ячменя. Антиоксидантные свойства мелатонина проявлялись в повышении активности антиоксидантных ферментов, а именно супероксиддисмутазы и гваякол-зависимой пероксидазы, а также в поддержании уровня каротиноидов, являющихся неферментативными антиоксидантами. Положительное влияние мелатонина на фотосинтетические пигменты возможно за счет повышения активности антиоксидантных ферментов, удаляющих активные формы кислорода. Многочисленные исследования демонстрируют, что мелатонин усиливает активность различных антиоксидантных ферментов и в ответ на другие стрессовые факторы. Так, экзогенный мелатонин повышал активность и концентрацию антиоксидантных ферментов, усиливая толерантность растений огурца к засолению (в концентрации 50–150 мкМ) [31], дыни – к низким температурам (в концентрации 50–400 мкМ) [32], арбуза – к загрязнению ванадием (в концентрации 0.1 мкМ) [13], гикори – к засухе (в концентрации 25–200 мкМ) [33].
Свидетельством снижения окислительного стресса экзогенным мелатонином является уменьшение степени ПОЛ в листьях растений ячменя на фоне действия стрессового фактора. Кроме того, для надземных органов кратковременная предобработка была эффективнее длительного воздействия мелатонина для снижения уровня ПОЛ.
В проведенном исследовании избыток кадмия в среде приводил к его многократному росту в корнях и побегах. Согласно полученным результатам, мелатонин не оказывал существенного влияния на накопление ионов кадмия в растениях ячменя, за исключением снижения накопления кадмия в побегах растений для варианта с предобработкой мелатонином и последующим “кадмиевым стрессом”. Экзогенное применение мелатонина ингибировало накопление Cd как в корнях, так и в листьях редьки [35], риса [36], сафлоры [37] и томатов [38]. Возможно, положительный эффект мелатонина для растений ячменя реализовывался не через влияние на накопление металла.
Нами показано, что в отношении некоторых защитных механизмов, например, поддержании уровня фотосинтетических пигментов и снижении перекисного окисления липидов на фоне действия хлорида кадмия, кратковременная прикорневая предобработка мелатонином была эффективнее его длительного воздействия. Данные о механизмах защиты растений мелатонином в ответ на действие ионов кадмия, а также оптимизация обработки растений с целью получения максимального защитного эффекта имеют значение не только для получения новых фундаментальных знаний, но и могут стать основой для разработки инновационных сельскохозяйственных технологий повышения продуктивности растений.
Постановка опыта была поддержана государственным заданием Министерства науки и высшего образования Российской Федерации (проект № 122042700044-6). Оценка физиологических показателей была поддержана Российским научным фондом (РНФ, проект № 23-44-10019). Анализ накопления неорганических ионов в растениях ячменя выполнен при поддержке программы развития Томского государственного университета (Приоритет-2030, проект № 2.1.2.22).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Clemens S., Ma J.F. Toxic heavy metal and metalloid accumulation in crop plants and foods // Annu. Rev. Plant Biol. 2016. V. 67. P. 489. https://doi.org/10.1146/annurev-arplant-043015-112301
Srivastava V., Sarkar A., Singh S., Singh P., de Araujo A.S.F., Singh R. Agroecological responses of heavy metal pollution with special emphasis on soil health and plant performances // Front. Environ. Sci. 2017. V. 5. P. 1. https://doi.org/10.3389/fenvs.2017.00064
Danilova E.D., Zlobin I.E., Kuznetsov V.V., Efimova M.V. Exogenic melatonin reduces the toxic effect of polymetallic stress on barley plants // Dokl. Biochem. Biophys. 2021. V. 499. P. 228. https://doi.org/10.1134/S1607672921040049
Asgher M., Khan M.I.R., Anjum N.A., Khan N.A. Minimising toxicity of cadmium in plants – role of plant growth regulators // Protoplasma. 2015. V. 252. P. 399. https://doi.org/10.1007/s00709-014-0710-4
Muradoglu F., Gundogdu M., Ercisli S., Encu T., Balta F., Jaafar H., Zia-Ul-Haq M. Cadmium toxicity affects chlorophyll a and b content, antioxidant enzyme activities and mineral nutrient accumulation in strawberry // Biological Res. 2015. V. 48. P. 1. https://doi.org/10.1186/s40659-015-0001-3
Cho U.H., Seo N.H. Oxidative stress in Arabidopsis thaliana exposed to cadmium is due to hydrogen peroxide accumulation // Plant Sci. 2005. V. 168. P. 113. https://doi.org/10.1016/j.plantsci.2004.07.021
Hussain I., Iqbal M., Qurat-Ul-Ain S., Rasheed R., Mahmood S., Perveen F., Wahid A. Cadmium dose and exposure-time dependent alterations in growth and physiology of maize (Zea mays) // Int. J. Agric. Biol. 2012. V. 14. P. 959.
El Rasafi T., Oukarroum A., Haddioui A., Song H., Kwon E.E., Bolan N., Tack F.M.G., Sebastian A., Prasad M.N.V., Rinklebe J. Cadmium stress in plants: a critical review of the effects, mechanisms, and tolerance strategies // Crit. Rev. Environ. Sci. Technol. 2020. P. 1. https://doi.org/10.1080/10643389.2020.183543
Bian M., Zhou M., Sun D., Li C. Molecular approaches unravel the mechanism of acid soil tolerance in plants // Crop J. 2013. V. 1. P. 91. https://doi.org/10.1016/j.cj.2013.08.002
Arnao M.B., Hernandez-Ruiz J. Functions of melatonin in plants: a review // J. Pineal Res. 2015. V. 59. P. 133. https://doi.org/10.1111/jpi.12253
Zhang Y.P., Yang S.J., Chen Y.Y. Effects of melatonin on photosynthetic performance and antioxidants in melon during cold and recovery // Biol. Plant. 2017. V. 61. P. 571. https://doi.org/10.1007/s10535-017-0717-8
Kholodova V.P., Vasil’ev S.V., Efimova M.V., Voronin P.Yu., Rakhmankulova Z.F., Danilova E.Yu., Kuznetsov Vl.V. Exogenous melatonin protects canola plants from toxicity of excessive copper // Russ. J. Plant Physiol. 2018. T. 65. P. 882. https://doi.org/10.1134/S1021443718060080
Nawaz M.A., Jiao Y., Chen C., Shireen F., Zheng Z., Imtiaz M., Bie Z., Huang Y. Melatonin pretreatment improves vanadium stress tolerance of watermelon seedlings by reducing vanadium concentration in the leaves and regulating melatonin biosynthesis and antioxidant-related gene expression // J. Plant Physiol. 2018. V. 220. P. 115. https://doi.org/10.1016/j.jplph.2017.11.003
Savvides A., Ali S., Tester M., Fotopoulos V. Chemical priming of plants against multiple abiotic stresses: mission possible? // Trends Plant Sci. 2016. V. 21. P. 329. https://doi.org/10.1016/j.tplants.2015.11.003
Blamey F.P.C., Hernandez-Soriano M.C., Cheng M., Cheng M., Tang C., Paterson D.J., Lombi E., Wang W.H., Scheckel K.G., Kopittke P.M. Synchrotron-based techniques shed light on mechanisms of plant sensitivity and tolerance to high manganese in the root environment // Plant Physiol. 2015. V. 169. P. 2006. https://doi.org/10.1104/pp.15.00726
Danilova E.D., Litvinovskaya R.P., Zlobin I.E., Kolomeichuk L.V., Murgan O.K., Sauchuk A.L., Khripach V.A., Kuznetsov V.V., Efimova M.V. Polymetallic stress changes the endogenous status of brassinosteroids and reduces the effectiveness of photochemical reactions photosystem II in barley plants // Dokl. Biochem. Biophys. 2022. V. 504. P. 123. https://doi.org/10.1134/S1607672922030024
Kopittke P.M., Blamey F.P.C., Asher C.J., Menzies N.W. Trace metal phytotoxicity in solution culture: a review // J. Exp. Bot. 2010. V. 61. P. 945. https://doi.org/10.1093/jxb/erp385
Li Z., Wang P., Menzies N.W., Kopittke P.M. Defining appropriate methods for studying toxicities of trace metals in nutrient solutions // Ecotoxicol. Environ. Saf. 2018. V.147. P. 872. https://doi.org/10.1016/j.ecoenv.2017.09.044
Аникеев В.В., Кутузов Ф.Ф. Новый способ определения листовой поверхности у злаков // Физиология растений. 1961. Т. 8. С. 375.
Buege J.A., Aust S.D. Microsomal lipid peroxidation // Biomembrans. 1978. V. 52. P. 302. https://doi.org/10.1016/s0076-6879(78)52032-6
Lichtenthaler H.K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes // Plant Cell. 1987. P. 350. https://doi.org/10.1016/0076-6879(87)48036-1
Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water-stress studies // Plant Soil. 1973. V. 39. P. 205. https://doi.org/10.1007/BF00018060
Beauchamp C., Fridovich I. Superoxide dismutase improved assays and an assay applicable to acrylamide gels // Anal. Biochem. 1971. V. 44. P. 276. https://doi.org/10.1016/0003-2697(71)90370-8
Shevyakova N.I., Stetsenko L.A., Meshcheryakov A.B., Kuznetsov Vl.V. The activity of the peroxidase system in the course of stress-induced CAM development // Russ. J. Plant Physiol. 2002. V. 49. P. 598. https://doi.org/10.1023/A:1020224531599
Esen A.A. Simple method for quantitative, semiquantitative, and qualitative assay of protein // Anal. Biochem. 1978. V. 89. P. 264. https://doi.org/10.1016/0003-2697(78)90749-2
Ruban A.V. Nonphotochemical chlorophyll fluorescence quenching: mechanism and effectiveness in protecting plants from photodamage // Plant Physiol. 2016. V. 170. P. 1903. https://doi.org/10.1104/pp.15.01935
Yan H., Jia S., Mao P. Melatonin priming alleviates aging-induced germination inhibition by regulating β-oxidation, protein translation, and antioxidant metabolism in oat (Avena sativa L.) seeds // Int. J. Mol. Sci. 2020. V. 21. P. 1. https://doi.org/10.3390/ijms21051898
Mehta V., Kansara R., Srivashtav V., Savaliya P. A novel insight into phytoremediation of heavy metals through genetic engineering and phytohormones // J. Nanosci. Nanomed. Nanobio. 2021. V. 4. P. 1.
Sadak M.S., Abdalla A.M., Abd Elhamid E.M., Ezzo M.I. Role of melatonin in improving growth, yield quantity and quality of Moringa oleifera L. plant under drought stress // Bull. Natl. Res. Cent. 2020. V. 44. P. 1.
Danilova E.D., Efimova M.V., Kolomeichuk L.V., Kuznetsov V.V. Melatonin supports photochemical activity of assimilation apparatus and delays senescence of leaves of monocotyledonous plants // Dokl. Biochem. Biophys. 2020. V. 495. P. 271. https://doi.org/10.1134/S1607672920050051
Wang L.Y., Liu J.L., Wang W.X., Sun Y. Exogenous melatonin improves growth and photosynthetic capacity of cucumber under salinity-induced stress // Photosynthetica. 2016. V. 54. P. 19. https://doi.org/10.1007/s11099-015-0140-3
Zhang Y.P., Yang S.J., Chen Y.Y. Effects of melatonin on photosynthetic performance and antioxidants in melon during cold and recovery // Biol. Plant. 2017. V. 61. P. 571. https://doi.org/10.1007/s10535-017-0717-8
Sharma A., Zheng B. Melatonin mediated regulation of drought stress: physiological and molecular aspects // Plants. 2019. V. 8. P. 1. https://doi.org/10.3390/plants8070190
Hoqu M., Tahjib-Ul-Arif M., Hannan A., Sultana N., Akhter S., Hasanuzzaman M., Akter F., Hossain M.S., Sayed M.A., Hasan M.T., Skalicky M., Li X., Brestic M. Melatonin modulates plant tolerance to heavy metal stress: Morphological responses to molecular mechanisms // Int. J. Mol. Sci. 2021. V. 22. № 21. P. 1. https://doi.org/10.3390/ijms222111445
Xu L., Zhang F., Tang M., Wang Y., Dong J., Ying J., Chen Y., Hu B., Li C., Liu L. Melatonin confers cadmium tolerance by modulating critical heavy metal chelators and transporters in radish plants // J. Pin. Res. 2020. V. 69. P. 1. https://doi.org/10.1111/jpi.12659
Jiang M., Dai S., Wang B., Xie Z., Li J., Wang L., Li S., Tana Y., Tian B., Shu Q., Huang J. Gold nanoparticles synthesized using melatonin suppress cadmium uptake and alleviate its toxicity in rice // Enviro. Sci. Nano. 2021. V. 8. P. 1042.
Amjadi Z., Namdjoyan S., Soorki A.A. Exogenous melatonin and salicylic acid alleviates cadmium toxicity in safflower (Carthamus tinctorius L.) seedlings // Ecotoxicol. 2021. V. 30. P. 387. https://doi.org/10.1007/s10646-021-02364-y
Hasan M.K., Ahammed G.J., Sun S., Li M., Yin H., Zhou J. Melaton ininhibits cadmium translocation and enhances plant tolerance by regulating sulfur uptake and assimilation in Solanum lycopersicum L. // J. Agric. Food Chem. 2019. V. 67. P. 10563. https://doi.org/10.1021/acs.jafc.9b0240
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений