Физиология растений, 2023, T. 70, № 6, стр. 623-634
Круглосуточное освещение повышает урожайность и пищевую ценность, и снижает содержание нитратов в микрозелени семейства Brassicaceae
Т. Г. Шибаева a, *, А. А. Рубаева a, Е. Г. Шерудило a, А. Ф. Титов a
a Институт биологии Карельского научного центра Российской академии наук,
Федеральный исследовательский центр “Карельский научный центр РАН”
Петрозаводск, Россия
* E-mail: shibaeva@krc.karelia.ru
Поступила в редакцию 13.03.2023
После доработки 10.04.2023
Принята к публикации 12.04.2023
- EDN: QYVARR
- DOI: 10.31857/S0015330323600262
Аннотация
Микрозелень четырех видов семейства Brassicaceae (брокколи, мизуна, редис и рукола) выращивали в условиях 16- и/или 24-часового фотопериода. В первой серии опытов интеграл дневного освещения был разным (15.6 и 23.3 моль/(м2 сут) при ФАР 270 мкмоль/(м2 с)), во второй – одинаковым (15.6 моль/(м2 сут) при ФАР 270 мкмоль/(м2 с) и 180 мкмоль/(м2 с)). В третьей серии опытов круглосуточное освещение применяли только в последние трое суток перед сбором урожая. Полученные результаты показали, что растения брокколи, мизуны, редиса и руколы на ранних фазах роста устойчивы к действию круглосуточного освещения и не проявляют типичных признаков фотоповреждения листьев. Микрозелень всех четырех видов, выращенная в условиях круглосуточного освещения, во всех трех сериях опытов имела более высокую урожайность и пищевую ценность (более высокое содержание веществ с антиоксидантными свойствами − антоцианов, флавоноидов, каротиноидов, пролина, а также повышенную активность ферментов антиоксидантной системы), и более низкое содержание нитратов по сравнению с растениями, выращенными при 16-часовом фотопериоде. Сделан вывод, что за счет использования круглосуточного освещения без увеличения энергетических затрат (при сохранении ИДО) возможно увеличение урожайности и пищевой ценности изученных видов микрозелени и снижение в ней содержания нитратов по сравнению со стандартным 16-часовым фотопериодом. Кроме того, повышение пищевой ценности и снижение содержания нитратов также возможно и при применении круглосуточного освещения (как агротехнического приема) в течение нескольких дней непосредственно перед сбором урожая.
ВВЕДЕНИЕ
Микрозелень – особая культура, представляющая новейший тренд мирового растениеводства. Ее производство стало привлекательным направлением бизнеса вследствие неуклонно растущего потребительского спроса и в силу ее высокой рыночной стоимости [1]. К тому же многие виды микрозелени оказывают благоприятное воздействие на здоровье человека, поскольку содержат высокую концентрацию полезных питательных веществ [2]. Эти молодые растения имеют более высокое содержание антиоксидантных соединений (полифенолов, каротиноидов, аскорбиновой кислоты) по сравнению со взрослыми растениями, поэтому микрозелень относят к группе “функциональных продуктов” питания [1, 2]. Помимо высокой пищевой ценности, одним из главных критериев “функционального продукта” является его биологическая безопасность, а избыточное минеральное питание или слабая освещенность (или иные причины) могут приводить к повышению содержания в растениях нитрат-ионов (${\text{NO}}_{3}^{ - }$). Нитраты, будучи необходимыми компонентами для жизнедеятельности растений, в организме человека, восстанавливаясь до нитритов, вызывают различные нарушения в обмене веществ и даже патологические процессы [3]. Результаты единичных исследований влияния круглосуточного освещения (CL, от Continuous Lighting) на содержание нитратов в растениях довольно противоречивы. Есть данные о том, что содержание нитратов в листьях руколы значительно снижалось в условиях CL, причем независимо от спектрального состава света [4]. В то же время более высокая интенсивность света оказывала слабое влияние на содержание нитратов в микрозелени рапса, капусты, руколы, горчицы [5] и мизуны [6]. Следовательно, необходимы дополнительные исследования для изучения влияния условий освещения на содержание нитратов у разных видов, чтобы выращивать микрозелень с их содержанием в безопасных для человека количествах.
В настоящее время микрозелень выращивают в теплицах и на фабриках растений с использованием искусственного освещения (PFAL − plant factories with artificial lighting). Такие фабрики растений представляют собой закрытые производственные системы, в которых интегрированы современные промышленные технологии для круглогодичного производства продукции различных сельскохозяйственных культур. Стоимость полученной в этом случае продукции прежде всего определяется затратами на электроэнергию, а поскольку цены на энергоносители во всем мире неуклонно растут, то необходим поиск надежных решений, позволяющих снижать потребление энергии при производстве тех или иных свежих продуктов, и повышающих эффективность конвертирования электроэнергии в урожай и его качество. В настоящее время большинство проводимых работ по изучению влияния световых условий на продуктивность и эффективность производства нацелены на подбор оптимального спектрального состава света [7] и интенсивности фотосинтетически активной радиации (ФАР) [8, 9], а влиянию фотопериода при светодиодном освещении уделяется недостаточно внимания, хотя несомненно он играет важную роль в регулировании процессов роста и развития растений. В частности, продолжительность фотопериода оказывает влияние на некоторые молекулярные механизмы, связанные с восприятием и передачей светового сигнала листьями, циркадной ритмикой, которые регулируют рост, время цветения, реакцию на абиотические и биотические стрессы и в целом метаболизм растений.
Одним из возможных способов повышения эффективности производства продукции на фабриках растений является перераспределение интеграла дневного освещения (ИДО = освещенность × фотопериод) во времени. Использование длинных фотопериодов, включая CL, c более низкой интенсивностью освещения позволяет сократить начальные затраты на осветительные приборы и операционные затраты на освещение благодаря использованию более низких ночных тарифов на электроэнергию. Кроме того, применение CL открывает значительные дополнительные возможности для повышения урожайности и качества урожая без увеличения энергетических затрат [4, 10, 11]. В целом CL обеспечивает постоянное поступление энергии для ассимиляции углерода, что теоретически предполагает большее накопление биомассы и более высокий урожай. Но положительный экономический эффект от использования CL может быть достигнут только при условии, что такой световой режим не приводит к фотоповреждению листьев, поскольку известно, что продолжительные световые периоды вызывают фотоповреждение растений (хлороз и/или некроз) листьев и снижение урожайности таких овощных культур как томаты, баклажаны, огурцы и перцы, что ограничивает применение этого экономически выгодного режима освещения при выращивании в теплицах определенных видов овощей [11, 12]. В наших предыдущих исследованиях было показано, что СL повышает урожайность и пищевую ценность микрозелени четырех видов семейства Brassicaceae [13]. Однако, эти результаты были получены в условиях, когда растения выращивали при фотопериодах 16 и 24 ч с одинаковой интенсивностью освещения, что приводило к более высокому ИДО в вариантах с CL, а повышение урожайности за счет увеличения ИДО является энергетически затратным, т.е. неэффективным.
Учитывая вышеизложенное, цель данного исследования заключалась в изучении физиологических механизмов реакции растений на CL у четырех видов микрозелени семейства Brassicaceae (брокколи, мизуна, редис и рукола) и проверке возможности увеличения урожайности и пищевой ценности микрозелени, и снижения содержания в ней нитратов по сравнению со стандартным 16-часовым фотопериодом за счет: а) использования CL без увеличения энергетических затрат (при сохранении ИДО) и б) применения CL в конце продукционного периода (перед сбором урожая).
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования служили 4 вида растений семейства Brassicaceae − брокколи (Brassica oleracea var. italica Plenck), мизуна (Brassica rapa ssp nipposinica (L.H. Bailey) Hanelt), редис (Raphanus sativus var. radicula Pers.) и рукола (Eruca vesicaria sp. sativa Mill.). Растения выращивали в контролируемых условиях среды. Средняя температура воздуха и относительная влажность воздуха составляли 22 ± 1°С и 60 ± 5%, соответственно.
Микрозелень выращивали в пластиковых контейнерах на ковриках из кокосового субстрата площадью 10 см2. В первые 3 дня после посева контейнеры с микрозеленью помещали для проращивания в темноту и поливали водой. Растения в возрасте 4 дней от посева (фаза полностью раскрытых семядолей) подвергали воздействию разных световых режимов, увлажняя субстрат половинным питательным раствором Хогланда-Арнона (рН 6.2–6.4).
Освещение растений обеспечивали светодиодными лампами (LED GL V300, Китай), соотношение (%) светодиодов красного : зеленого : синего света составляло 50.3 : 21.1 : 17.6. В первой серии опытов с разным интегралом дневного освещения (ИДО) растения выращивали при фотопериодах 16 или 24 ч и ФАР 270 мкмоль/(м2 с), ИДО составлял 15.6 и 23.3 моль/(м2 сут) соответственно. Во второй серии опытов с одинаковым ИДО растения выращивали при фотопериодах 16 или 24 ч при ФАР 270 мкмоль/(м2 с) и 180 мкмоль/(м2 с), соответственно. ИДО в обоих вариантах составлял 15.6 моль/(м2 сут). В третьей серии опытов растения выращивали при фотопериоде 16 ч, а начиная с 9 сут (последние 3 сут опыта) часть растений подвергали воздействию 24 ч фотопериода при ФАР 270 мкмоль/(м2 с) (табл. 1). ФАР измеряли с помощью измерителя освещенности LI-250A (“Li-COR Biosciences”, Lincoln, NE, USA). В каждом опыте за контроль приняты растения, выращенные при фотопериоде 16 ч.
Таблица 1.
Условия освещения в опытах с разным и одинаковым интегралом дневного освещения (ИДО), а также при воздействии круглосуточного освещения (CL) в конце продукционного периода
| Серии опытов | Фотопериод, ч | ФАР, мкмоль/(м2 с) | ИДО, моль/(м2 сут) |
|---|---|---|---|
| 1. С разным ИДО | 16 | 270 | 15.6 |
| 24 | 270 | 23.3 | |
| 2. С одинаковым ИДО | 16 | 270 | 15.6 |
| 24 | 180 | 15.6 | |
| 3. CL в конце продукционного периода | 16 | 270 | 15.6 |
| 16 (8 сут) + 24 (3 сут) | 270 | 18.2 |
Анализ растений проводили на 12 сут после посева, в фазе появления первого настоящего листа. У десяти проростков каждого вида всех вариантов были измерены длина гипокотиля, длина первого настоящего листа, сырой и сухой вес побегов. Длину гипокотиля измеряли от основания гипокотиля до апикальной меристемы побега. Для определения сырого веса растения взвешивали, а затем образцы высушивали в сушильном шкафу при температуре 105°C до постоянного веса.
Рассчитывали массу листа на единицу площади (LMA, от англ. leaf mass per area) как отношение сухой массы четырех высечек семядольных листьев диаметром 4 мм к их площади. Сухую массу высечек определяли после их высушивания при 105°С.
Индекс робастности (от англ. robust – крепкий) определяли, как отношение произведения сухой массы побега и диаметра гипокотиля к длине гипокотиля.
Содержание фотосинтетических пигментов (хлорофилла (Хл) a и b, каротиноидов (Кар)) определяли с помощью спектрофотометра СФ-2000 (“Спектр”, Россия) в экстракте 96% этилового спирта и рассчитывали по известным формулам [14].
Содержание малонового диальдегила (МДА), конечного продукта перекисного окисления липидов, определяли методом, основанным на реакции образования триметинового комплекса с максимумом поглощения 532 нм при взаимодействии данных веществ с тиобарбитуровой кислотой [13].
Для анализа активности антиоксидантных ферментов супероксиддисмутазы (СОД, КФ 1.1.5.1.1), каталазы (КАТ, КФ 1.11.1.6), аскорбатпероксидазы (АПО, КФ 1.м 11.1.11) и гваякол-пероксидазы (ГвПО, КФ 1.11.1.7) листья растений гомогенизировали в 50 мМ фосфатном буфере (рН 7.8), гомогенат центрифугировали при 15 000 g в течение 10 мин при 4°С и в супернатанте определяли активность ферментов с использованием спектрофотометра СФ-2000 (“Спектр”, Россия). Активность АПО определяли в присутствии 0.5 мМ аскорбиновой кислоты и 0.25 мМ Н2О2 по снижению оптической плотности при 290 нм [13]. Активность КАТ определяли по ферментативному разложению H2O2 при 240 нм; активность СОД − по способности ингибировать фотохимическую реакцию тетразолия нитросинего [13]. Анализ ГвПО основывался на окислении гваякола в присутствии H2O2 [13]. Измеряли оптическую плотность при 470 нм. Активность ферментов рассчитывали на 1 г сухой массы листьев, а удельную активность – на 1 мг белка. Общее содержание белка определяли по методу Бредфорд, используя в качестве стандарта бычий сывороточный альбумин [13].
Для определения содержания перекиси водорода навеску растительной ткани гомогенизировали на льду в 0.1% трихлоруксусной кислоте, центрифугировали 15 мин при 12 000 g и температуре 4°С. К 0.5 мл супернатанта добавляли по 0.5 мл 10 мМ К-фосфатного буфера (рН 7.0) и 1 мл 1 М KI. После 1 ч выдерживания смеси в холодильнике в темноте определяли оптическую плотность при 390 нм на спектрофотометре СФ 2000 (“Спектр”, Россия) [13]. Содержание перекиси водорода рассчитывали по стандартной концентрационной кривой и выражали в мкмоль/г сырого веса.
Содержание свободного пролина в тканях листа оценивали по нингидриновому методу [13].
Для определения содержания антоцианов и флавоноидов навеску растительного материала гомогенизировали в 4 мл холодной смеси этанола и 1.5 N соляной кислоты (85 : 15, об/об) с последующей экстракцией в течение 14 ч в холодильнике в темноте. После 5 мин центрифугирования экстракта при 10 000 g и температуре +4°С для антоцианов определяли оптическую плотность супернатанта при 530 и 657 нм на спектрофотометре СФ 2000. При расчете содержания антоцианов учитывали величину поглощения Хл и продуктов его распада при 657 нм. Содержание флавоноидов определяли спектрофотометрически при 300 и 350 нм в супернатанте для антоцианов, предварительно разбавив его в 10 раз. Содержание флавоноидов рассчитывали, как отношение оптической плотности к сырой массе:
Содержание нитратного азота определяли потенциометрическим методом с помощью pH-метра Анион-4100 (“Анион”, Россия). Навеску сухого вещества помещали в 1% раствор алюмокалиевых квасцов (“Вектон”, Россия) и перемешивали на шейкере ПЭ-6500 (“Экросхим”, Россия) в течение 5 мин. Затем снимали показания электродвижущей силы (ЭДС) с помощью потенциометра [16]. Содержание нитратов выражали как мг/кг сырого веса растительного материала.
В работе представлены средние значения по двум-трем независимым опытам (4–6 и более биологических повторностей в каждом варианте отдельного опыта) и их стандартные ошибки. Достоверность различий между средними значениями определяли на основе дисперсионного анализа (LSD тест) при Р < 0.05 с использованием программного обеспечения MS Excel.
РЕЗУЛЬТАТЫ
Опыт 1. Растения всех четырех видов при выращивании в условиях фотопериодов 16 и 24 ч с одинаковой освещенностью (разным ИДО, опыт 1) имели меньшую длину гипокотиля, бóльшую сырую и сухую биомассу побегов, более высокие значения LMA и индекса робастности (табл. 2, рис. 1а) при CL. У всех исследованных видов в условиях CL отмечено ускорение развития, о котором судили по более раннему появлению первого настоящего листа (табл. 2), что предполагает более ранние сроки сбора урожая. Ни у одной из культур не наблюдалось признаков фотоповреждения листьев. Содержание Хл в условиях CL было несколько ниже, чем при фотопериоде 16 ч, однако визуально эти изменения не были заметны и листья имели нормальную зеленую окраску. Содержание Кар под влиянием CL достоверно увеличивалось в листьях редиса и руколы, но значительно снижалось в листьях мизуны (табл. 3). В условиях CL у всех видов растений, кроме редиса, зафиксировано более высокое содержание перекиси водорода и МДА (табл. 3). При этом отмечено, что такие растения накапливали больше антоцианов, флавоноидов, пролина (табл. 3) и имели более высокую активность антиоксидантых ферментов – КАТ, СОД, АПО, ГвПО (табл. 4). У растений всех четырех видов в условиях CL содержание нитратов было ниже, чем у растений, выращенных в условиях 16-часового фотопериода (рис. 1б).
Таблица 2.
Биометрические показатели растений (% к контролю)
| Серия опытов | Длина гипокотиля | Длина первого настоящего листа | Сырая масса побега | Сухая масса побега | LMA |
|---|---|---|---|---|---|
| Брокколи | |||||
| 1 | 87* | 228* | 129* | 130* | 128* |
| 2 | 97 | 160* | 110 | 124* | 114 |
| 3 | 93 | 111 | 120* | 110 | 153* |
| Мизуна | |||||
| 1 | 81* | 128* | 116* | 128* | 136* |
| 2 | 87* | 109 | 109 | 130* | 118* |
| 3 | 92 | 132* | 127* | 124* | 119* |
| Редис | |||||
| 1 | 80* | 227* | 130* | 181* | 169* |
| 2 | 93 | 158* | 122* | 151* | 135* |
| 3 | 82* | 145* | 111* | 150* | 128* |
| Рукола | |||||
| 1 | 96 | 311* | 115* | 154* | 228* |
| 2 | 99 | 100 | 109 | 114 | 130* |
| 3 | 99 | 124* | 110 | 135* | 134* |
Примечание: за контроль приняты растения, выращенные в условиях 16 ч фотопериода с освещенностью 270 мкмоль/(м2 с) ФАР. * – статистически значимые различия с контролем. Абсолютные значения контрольных образцов: длина гипокотиля (мм) – 51.2 ± 2.2 (брокколи), 47.3 ± 1.7 (мизуна), 52.3 ± 2.4 (редис), 36.8 ± 1.2 (рукола), длина первого листа (мм) – 2.5 ± 0.7 (брокколи), 5.4 ± 0.5 (мизуна), 5.5 ± 0.7 (редис), 16.5 ± 0.8 (рукола); сырая масса побега (г) – 0.07 ± 0.01 (брокколи), 0.076 ± ± 0.003 (мизуна), 0.23 ± 0.02 (редис), 0.052 ± 0.003 (рукола); сухая масса побега (мг) – 10.0 ± 1.0 (брокколи), 7.7 ± 0.5 (мизуна), 21.0 ± 2.6 (редис), 2.9 ± 0.3 (рукола); LMA (мг/см2) – 5.2 ± 0.4 (брокколи), 3.3 ± 0.2 (мизуна), 2.9 ± 0.3 (редис), 2.5 ± 0.4 (рукола).
Рис. 1.
Индекс робастности (а) и содержание нитратов (б) у растений, выращенных при фотопериодах 16 ч (контроль) (1) и 24 ч с разным (серия опытов 1) (2) и одинаковым (серия опытов 2) (3) ИДО и при воздействии CL в конце продукционного периода (серия опытов 3) (4). Различными латинскими буквами для каждого вида указаны достоверные различия средних значений при P < 0.05.
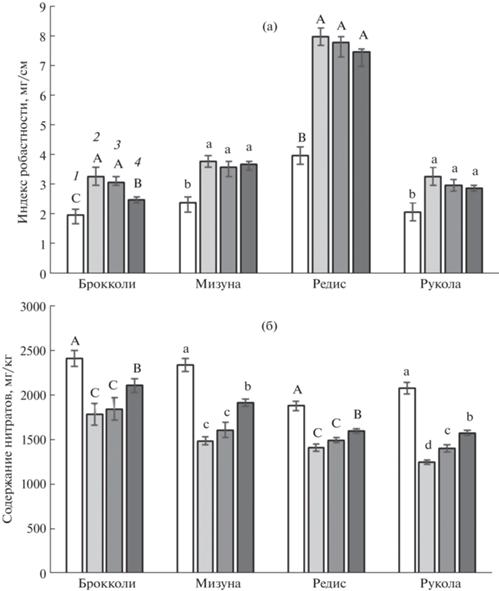
Таблица 3.
Физиолого-биохимические показатели листьев растений (% к контролю)
| Серия опытов | Хл (a + b) | Каротиноиды | Антоцианы | Флавоноиды | Пролин | Н2О2 | МДА |
|---|---|---|---|---|---|---|---|
| Брокколи | |||||||
| 1 | 90 | 108 | 199* | 136* | 132* | 131* | 329* |
| 2 | 117* | 95 | 135* | 109 | 108* | 100 | 110 |
| 3 | 81* | 67* | 110 | 155* | 155* | 126* | 188* |
| Мизуна | |||||||
| 1 | 81* | 50* | 152* | 125* | 112 | 125* | 130* |
| 2 | 116* | 114* | 97 | 116* | 134* | 137* | 109 |
| 3 | 92 | 81* | 100 | 120* | 123* | 100 | 111 |
| Редис | |||||||
| 1 | 85* | 125* | 159* | 136* | 171* | 117 | 98 |
| 2 | 80* | 92 | 170* | 119* | 125* | 89 | 101 |
| 3 | 76* | 97 | 124* | 125* | 113 | 91 | 107 |
| Рукола | |||||||
| 1 | 78* | 129* | 348* | 136* | 561* | 154* | 276* |
| 2 | 79* | 94 | 166* | 103 | 152* | 100 | 117* |
| 3 | 90 | 100 | 137* | 155* | 141* | 106 | 107 |
Примечание: за контроль приняты растения, выращенные в условиях 16 ч фотопериода с освещенностью 270 мкмоль/(м2 с) ФАР. * – статистически значимые различия с контролем. Абсолютные значения контрольных образцов: Хл (a + b) (мг/г сух веса) – 9.0 ± 0.3 мм (брокколи), 5.4 ± 0.3 (мизуна), 6.5 ± 0.2 (редис), 12.3 ± 0.7 (рукола), каротиноиды (мг/г сух веса) – 1.2 ± 0.1 (брокколи), 0.4 ± 0.1 (мизуна), 0.8 ± 0.1 (редис), 0.7 ± 0.1 (рукола); антоцианы (у.е.) – 1.3 ± 0.5 (брокколи), 0.30 ± 0.04 (мизуна), 0.40 ± 0.04 (редис), 1.7 ± 0.2 (рукола); флавоноиды (у.е.) – 23.0 ± 1.2 (брокколи), 18.9 ± 1.4 (мизуна), 23.9 ± 2.2 (редис), 30.7 ± 2.1 (рукола); пролин (мкмоль/г сыр. Веса) – 26.5 ± 2.8 (брокколи), 11.5 ± 0.3 (мизуна), 7.6 ± 1.3 (редис), 27.4 ± 2.5 (рукола); Н2О2 (мкмоль/г сыр. Веса) – 0.71 ± 0.05 (брокколи), 0.63 ± 0.04 (мизуна), 0.40 ± 0.05 (редис), 0.54 ± 0.04 (рукола); МДА (мкмоль/г сыр. Веса) – 18.4 ± 1.3 (брокколи), 11.9 ± 0.5 (мизуна), 18.3 ± 1.2 (редис), 20.1 ± 0.7 (рукола).
Таблица 4.
Активность антиоксидантных ферментов в листьях растений (% к контролю)
| Серия опытов | Активность антиоксидантных ферментов | |||
|---|---|---|---|---|
| КАТ | СОД | АПО | ГвПО | |
| Брокколи | ||||
| 1 | 113 | 164* | 165* | 117* |
| 2 | 86 | 136* | 167* | 112 |
| 3 | 164* | 147* | 118 | 100 |
| Мизуна | ||||
| 1 | 128* | 131* | 118* | 131* |
| 2 | 88 | 120* | 90 | 89 |
| 3 | 123* | 261* | 130* | 122* |
| Редис | ||||
| 1 | 289* | 122* | 132* | 123* |
| 2 | 141* | 114 | 114 | 113* |
| 3 | 148* | 112 | 125* | 117* |
| Рукола | ||||
| 1 | 118* | 180* | 132* | 136* |
| 2 | 103 | 115 | 117 | 108 |
| 3 | 120* | 135* | 125* | 178* |
Примечание: за контроль приняты растения, выращенные в условиях 16 ч фотопериода с освещенностью 270 мкмоль/(м2 с) ФАР. * – статистически значимые различия с контролем. Абсолютные значения контрольных образцов: Кат (мкмоль Н2О2/(мг белка · мин)) – 32.3 ± 2.6 (брокколи), 38.3 ± 5.5 (мизуна), 10.4 ± 2.8 (редис), 39.9 ± 3.2 (рукола), СОД (ед. акт./мг белка) – 6.6 ± 1.2 (брокколи), 13.0 ± 1.0 (мизуна), 15.3 ± 1.4 (редис), 5.0 ± 1.0 (рукола); АПО (мкмоль/(мг белка·мин)) – 79.4 ± 13.3 (брокколи), 96.4 ± 9.7 (мизуна), 143.70 ± 2.9 (редис), 113.1 ± 6.2 (рукола); ГвПО (мкмоль/(мг белка · мин)) – 193.3 ± 31.4 (брокколи), 180.4 ± 20.3 (мизуна), 141.4 ± 14.8 (редис), 19.1 ± 2.7 (рукола).
Опыт 2. В опытах с одинаковым ИДО, т.е. когда интенсивность освещения при 24-часовом фотопериоде была ниже, чем при 16-часовом, вышеперечисленные различия между растениями, выращенными при разных фотопериодах, сохранялись, хотя в некоторых случаях они были менее выраженными. Так, по высоте растения, выращенные при разных фотопериодах, практически не отличались (табл. 2, рис. 2), что свидетельствует о том, что на этот показатель бóльшее влияние оказывает ИДО. В то же время значения LMA и сухой массы побегов в целом были выше у растений, выращенных в условиях CL (табл. 2), что выразилось в более высоком индексе робастности у всех четырех видов (рис. 1а). Содержание Хл было несколько выше в условиях CL у брокколи и мизуны, но ниже у редиса и руколы (табл. 3). Содержание Кар в условиях CL было выше только у мизуны, у остальных видов – не отличалось достоверно от растений, выращенных при 16-часовом фотопериоде. В отличие от первой серии опытов, у растений в условиях СL при более низкой освещенности не наблюдалось значительного увеличения содержания перекиси водорода и МДА. Лишь у мизуны зафиксировано увеличение содержания перекиси водорода на 37%, а у руколы содержание МДА было выше на 17%. При этом отмечено увеличение содержания антоцианов у всех видов, кроме мизуны, флавоноидов у мизуны и редиса, и пролина у всех четырех видов растений (табл. 3). Зафиксировано также повышение активности антиоксидантных ферментов в условиях CL, хотя оно было менее выраженным, чем в первой серии опытов с разным ИДО (табл. 4). Снижение содержания нитратов в условиях CL было сопоставимым с таковым в первом опыте, лишь несколько менее выраженным у руколы (рис. 1б).
Рис. 2.
Внешний вид растений брокколи (Brassica oleracea var. italica) (а), мизуны (Brassica rapa ssp nipposinica) (б), руколы (Eruca sativa) (в) и редиса (Raphanus sativus ssp radicula) (г), выращенных при фотопериодах 16 и 24 ч с одинаковым ИДО (серия опытов 2).

Опыт 3. Когда растения подвергались действию CL только в течение последних 3 сут. опыта, достоверное уменьшение длины гипокотиля происходило только у редиса (табл. 2), однако растения всех четырех видов имели бóльшую биомассу побегов, более высокие значения LMA и длины первого настоящего листа. В результате индекс робастности у всех видов был выше, чем при выращивании растений при 16-часовом фотопериоде. Только у брокколи индекс робастности был ниже, чем в опыте 1 и 2, у остальных растений он был сопоставим с предыдущими вариантами применения 24-часового фотопериода (рис. 1а). Снижение содержания Хл под влиянием CL было аналогичным опыту 1 (табл. 3). Содержание Кар было ниже у брокколи и мизуны по сравнению с растениями в условиях 16-часового фотопериода. Достоверное увеличение содержания перекиси водорода и МДА отмечено только у брокколи, у остальных видов можно отметить лишь тенденцию повышения (табл. 3). При этом содержание антоцианов, флавоноидов и пролина и активность антиоксидантных ферментов были в большинстве случаев выше у растений, подвергавшихся CL в конце продукционного периода (табл. 3, 4). Под действием CL в течение 3 сут. содержание нитратов снижалось в меньшей степени, чем в опытах 1 и 2, но тем не менее оно составило от 13 до 24% для разных видов растений (рис. 1б).
ОБСУЖДЕНИЕ
Рост и продуктивность. Во всех трех сериях опытов у всех изученных видов сырая и сухая биомасса растений и значения LMA были выше в условиях CL по сравнению с растениями, выращенными при 16-часовом фотопериоде. В первом опыте (с разным ИДО) такая реакция растений была ожидаемой, поскольку CL обеспечивало более высокий ИДО, т.е. дополнительный свет для фотосинтеза и, следовательно, для накопления биомассы. Известно, что сухая биомасса растений увеличивается с увеличением ИДО до точки светового насыщения [17]. Более высокая продуктивность растений, выращенных в условиях CL, служит в поддержку гипотезы [11], что СL может вести к увеличению продуктивности растений, если при этом не происходит фотоповреждения листьев. В нашем исследовании все четыре вида растений не проявляли симптомов фотоповреждения листьев. Относительно чувствительности изучаемых видов к CL в литературе есть лишь сведения, что рукола, выращиваемая в условиях CL в течение 30 дней, не имела никаких повреждений [4]. Индекс робастности служит интегральным морфофизиологическим показателем, объединяющим объем гипокотиля (длину и диаметр) с сухой биомассой побега, который используется как показатель качества микрозелени [1]. CL увеличивало индекс робастности у всех четырех видов микрозелени, главным образом, за счет увеличения биомассы. Кроме того, CL значительно ускоряло формирование первого настоящего листа. Поскольку микрозелень обычно выращивают до стадии первого настоящего листа, то использование CL может служить способом сокращения времени сбора урожая, т.е. продукционного периода. Таким образом, в первом опыте CL, обеспечивая более высокий ИДО, повысило урожайность и ускорило развитие всех четырех видов микрозелени.
Во второй серии опытов (с одинаковым ИДО) интенсивность освещения в варианте с CL была ниже, однако индекс робастности растений не отличался от такового у растений в первой серии опытов с более высоким ИДО при CL. Этот результат хорошо корреспондируется с известными данными о том, что при одинаковом ИДО растения накапливают большую биомассу при более длинных фотопериодах [18–23]. Эффективность использования световой энергии в процессе фотосинтеза неизменно снижается с повышением интенсивности освещения и, следовательно, выход продуктов фотосинтеза на единицу ФАР всегда будет больше при более низкой освещенности [19, 21]. Снижение эффективности использования световой энергии при высокой интенсивности освещения происходит частично вследствие активизации фотозащитных процессов, которые превращают часть поглощенной энергии света в тепло, не позволяя ей быть использованной в световых реакциях фотосинтеза. Это предотвращает появление индуцированных светом повреждений фотосинтетического аппарата благодаря инициированию взаимодополняющих фотозащитных процессов, включающих ксантофилловый цикл и молекулярную реорганизацию антенных комплексов и реакционных центров. Наблюдаемое увеличение биомассы в ответ на более длительный фотопериод при одинаковом ИДО, вероятно, происходит в результате морфологических изменений и физиологических реакций растений. “Растягивание” ИДО во времени с использованием более низкой интенсивности ФАР имеет преимущества для производителей, так как позволяет, во-первых, снизить первоначальные капитальные затраты благодаря уменьшению количества источников света (ламп) для обеспечения необходимого ИДО. Во-вторых, за счет увеличения эффективности использования световой энергии повышается выход продукции на единицу затраченных средств. В-третьих, использование более низкой интенсивности освещения в течение длительного времени уменьшает количество выделяемого источниками освещения тепла, снижая затраты на кондиционирование (охлаждение, отвод влаги) помещения [22]. Наконец, использование длинных фотопериодов позволяет использовать преимущества более низких ночных тарифов на электроэнергию.
В третьей серии опытов при использовании CL в последние 3 дня перед сбором урожая индекс робастности был несколько ниже, чем в первых двух сериях опытов, что объяснимо, но он тем не менее заметно превосходил таковой у растений, выращенных при 16-часовом фотопериоде.
В принципе повышение продуктивности растений на основе увеличения ИДО возможно или за счет повышения интенсивности освещения, или удлинения фотопериода. В данной работе повышение продуктивности наблюдалось и в первой серии опытов при увеличении ИДО, и во второй, когда ИДО был одинаковым, что значительно повышает эффективность использования ресурсов, в данном случае электроэнергии. Отметим, что при выращивании микрозелени амаранта, зеленого и фиолетового базилика в условиях CL эффективность использования электроэнергии на освещение была на 10–42% выше, чем при 16-часовом фотопериоде с одинаковым ИДО, а затраты на электроэнергию для производства единицы продукции, наоборот, снижалась на 8–38% [10].
Фотосинтетические пигменты. Известно, что влияние света на содержание фотосинтетических пигментов варьирует в значительной степени, демонстрируя положительный или отрицательный отклик, в зависимости от фотопериода [4, 12]. В нашей работе содержание Хл у некоторых видов в ответ на действие CL снижалось, но не более, чем на 20% и визуально не было заметно. Это важно, так как содержание Хл тесно связано с восприятием человеком (как потенциальным потребителем) зеленой пигментации листьев, что является одним из критериев качества микрозелени [1]. У взрослых растений руколы также было отмечено снижение содержания Хл в условиях CL [4]. В то же время другие авторы отмечали в условиях CL увеличение содержания хлорофилла у базилика Ocimum basilicum, руколы, цикория Cichorium endivia [24], а также микрозелени амаранта Amaranthus tricolor, зеленого и фиолетового базилика по сравнению с 16-часовым фотопериодом [10]. У микрозелени листовой капусты Brassica oleracea var. viridis содержание хлорофилла в условиях CL увеличивалось при ИДО равном 14 моль/(м2 сут), но уменьшалось при ИДО 21 моль/(м2 сут). Уменьшение общего содержания Хл в листьях приводит к снижению поглощения света на единицу площади листа и служит одним из механизмов защиты от избыточного освещения. Поэтому во второй серии опытов, где “избыточность” света создавалась только длительностью фотопериода, но не количеством полученных растениями фотонов света, реакция брокколи и мизуны была иная и количество хлорофилла даже несколько увеличивалось. Ранее [13] мы отмечали у микрозелени изучаемых культур в условиях CL увеличение соотношения Хл a и b (что предполагает образование ССК в ФС II меньшего размера), а также соотношения Кар и Хл, свидетельствующее об относительно более высокой концентрации Кар в пуле фотосинтетических пигментов, что связано с их защитной функцией по отношению к избыточному освещению, поскольку они являются эффективными физическими и химическими тушителями синглетного кислорода и других свободных радикалов [25]. Таким образом, у растений, выращенных с использованием CL, содержание Хл было либо сопоставимо или немного выше, чем у растений, выращенных при 16-часовом фотопериоде, либо снижение было не столь значимым, чтобы повлиять на визуальную оценку качества микрозелени. Нужно отметить, что причиной небольшого снижения содержания фотосинтетических пигментов может быть и так называемый эффект “разбавления”, так как их содержание оценивали в побегах, а в условиях CL повышается доля биомассы стеблей, в которых содержание этих пигментов невелико. В то же время повышенное содержание Кар в руколе и редисе повышает пищевую ценность микрозелени, поскольку Кар обладают антиоксидантными свойствами, полезными для здоровья человека.
Окислительный стресс и антиоксиданты. Повышенное содержание МДА и перекиси водорода в растениях, выращенных в условиях CL, свидетельствует том, что растения испытывали легкий окислительный стресс. В ответ на стресс в растениях, как правило, усиливается образование антиоксидантных биоактивных веществ. Антиоксиданты в продуктах питания являются важными соединениями для здоровья человека, т.к. выполняют важную роль в нейтрализации свободных радикалов в организме. Поэтому увеличение содержания веществ, обладающих антиоксидантной активностью, в микрозелени повышает ее пищевую ценность и делает продукт более конкурентоспособным благодаря высокому качеству. В данной работе во всех трех сериях опытов у всех видов микрозелени за некоторыми исключениями по отдельным показателям было зафиксировано увеличение содержания пролина, антоцианов и флавоноидов, а также усиление активности ферментов антиоксидантной системы (КАТ, СОД, АПО и ГвПО). То, что более высокий ИДО может повышать не только урожайность листовых овощей, но и содержание в них веществ, обладающих антиоксидантной активностью, было также показано в ряде работ, в том числе с использованием CL [9, 13, 17, 26, 27]. Однако не было очевидно, будет ли это наблюдаться в случае, если CL не будет обеспечивать растения дополнительной световой энергией, т.е. при использовании одинакового ИДО. Кроме того, пока не решен вопрос является ли фотоокислительный стресс, вызванный СL, непосредственно результатом непрерывного поступления света или он вызван избыточностью света, возникающей вследствие более высокого ИДО. Заметим, что имеются данные, из которых следует, что при CL непрерывность поступления светового сигнала, протекания фотосинтеза и фотоокислительных процессов могут вызывать окислительный стресс у растений, даже если значения ИДО не выше, чем обычно требуется растениям при более коротких фотопериодах [23]. В нашем исследовании несмотря на то, что во второй серии опытов c одинаковым ИДО окислительный стресс в большинстве случаев не наблюдался (судя по отсутствию повышения содержания МДА или перекиси водорода), тем не менее, содержание низкомолекулярных антиоксидантов и активность антиоксидантных ферментов увеличивались. Ранее аналогичные данные о более высокой активности КАТ, СОД и АПО в условиях CL по сравнению с 16-часовым фотопериодом при одинаковом ИДО были получены на растениях томата [28].
Что касается третьей серии опытов, то полученные результаты вызывают особый интерес. По содержанию антиоксидантов или по активности антиоксидантных ферментов данные первой и третьей серий опыта в некоторых случаях сопоставимы или эффекты в третьей серии несколько слабее, хотя в первой серии опытов длительность действия CL на растения составляла 9 сут., а в третьей − только 3 сут. В своей работе мы не изучали динамику содержания антоцианов, флавоноидов и пролина в условиях CL, но имеются работы, показывающие, что в начальный период действия CL растения испытывают стресс, в ответ на который синтезируются различные защитные вещества и активизируется работа антиоксидантных ферментов, а впоследствии может происходить адаптация к CL и, соответственно, изменяться состав веществ в растении. Так, показано, что у растений маша Vigna radiata L. такая адаптация происходила через 6 сут. действия CL, когда наблюдалось снижение активности КАТ, СОД, ГвПО и содержания пролина на фоне уменьшения концентрации МДА [29]. Максимальное снижение содержания нитратов в листьях пак-чой Brassica campestris L. при CL происходило уже через 24 ч, а затем наблюдалось некоторое их увеличение [30]. Эти результаты свидетельствуют о том, что непродолжительное применение CL непосредственно перед сбором урожая для повышения пищевой ценности и биологической безопасности растений может быть даже эффективнее, чем применение CL в течение всего периода выращивания. К тому же более короткие сроки применения CL снижают энергозатраты и повышают эффективность производства микрозелени.
В целом наши данные и анализ литературы [10, 31] показывают, что чувствительность растений к тем или иным световым воздействиям достаточно видоспецифична. Особенно это проявляется в ответных реакциях, когда на то или иное воздействие растения реагируют активным образованием защитных метаболитов. Так, например, при изучении влияния различных комбинаций оранжевого, красного и синего света на 8 видов, подвидов и сортов микрозелени рода Brassica (2 сорта мизуны Brassica rapa nipposinica, пак-чой Brassica rapa chinensis, 2 сорта редиса Raphanus sativus и 3 сорта горчицы Brassica juncea) авторы выявили три разных типа ответной реакции растений, оцениваемой по синтезу фенольных веществ и изменению антиоксидантной активности [32]. При действии CL на микрозелень амаранта и листовой капусты содержание в них фенольных соединений и антоцианов, а также антиоксидантная активность увеличивались, но эти же условия не оказывали значительного влияния на биохимический состав зеленого и фиолетового базилика [10].
Содержание нитратов. Контроль за содержанием нитратов в микрозелени является важным компонентом получения качественной безопасной продукции. Наши результаты показывают, что содержание нитратов значительно снижалось при выращивании растений в условиях СL (серии опытов 1 и 2), а также при использовании CL в конце продукционного периода (серия опытов 3). Это согласуется с данными о снижении содержания нитратов на 17% у растений руколы при выращивании в условиях CL по сравнению с 12-часовым фотопериодом [4]. Также было отмечено значительное (до 56%) снижение содержания нитратов в растениях салата, которые перед сбором урожая подвергали воздействию CL в течение 2−3 сут [3, 27]. В целом известно, что световые условия, а именно интенсивность освещения, спектральный состав света и фотопериод являются важными факторами, влияющими на содержание нитратов в растениях [4, 33, 34]. Также отмечена довольно выраженная видоспецифичность в реакциях растений на свет по содержанию нитратов в растениях [8, 34].
Известно, что содержание нитратов в растениях отрицательно коррелирует с концентрацией растворимых, неструктурных форм углерода, таких как сахара и органические кислоты [35], потому что они играют комплементарные роли в поддержании тургора клеток [36]. Поэтому значительное снижение содержания нитратов в условиях CL может быть связано с усилением синтеза углеводов и увеличением содержания ферредоксина и НАДФН, которые используются при редукции нитратов в листьях [11, 37]. Однако, с увеличением продолжительности CL синтез фермента нитратредуктазы (НР) и НАДФН de novo может снижаться [38]. Снижение содержания нитратов в условиях CL также может быть вызвано более высокой активностью НР в результате увеличения уровня экспрессии генов НР [4, 39]. Нитратредуктаза является ключевым ферментом, лимитирующим скорость восстановления нитрат-иона до нитрит-иона. Свет влияет на активность НР в растениях, регулируя процессы транскрипции генов НР, трансляцию и посттрансляционную активность [40]. Предполагается, что свет может регулировать активность НР двумя способами, а именно регулируя экспрессию генов НР продуктами фотосинтеза и регулируя состояние НР через НАДФH [34].
В целом, результаты наших исследований показывают, что растения брокколи, мизуны, редиса и руколы на ранних фазах роста устойчивы к действию CL и не проявляют типичных признаков фотоповреждения листьев. Более того, за счет использования CL без увеличения энергетических затрат (при сохранении ИДО) возможно увеличение урожайности и пищевой ценности микрозелени брокколи, мизуны, редиса и руколы и снижения содержания в ней нитратов по сравнению со стандартным 16-часовым фотопериодом. Очевидно, испытывая под действием CL умеренный окислительный стресс, растения накапливают больше низкомолекулярных антиоксидантов (антоцианы, флавоноиды, каротиноиды, пролин) и отличаются повышенной активностью антиоксидантных ферментов. Это увеличивает пищевую ценность микрозелени, которая рекомендуется в качестве функционального продукта (“functional food”) для здорового питания. Повышение пищевой ценности и снижение содержания нитратов также возможно при применении CL (в качестве агротехнического приема) в течение нескольких дней в конце продукционного периода (непосредственно перед сбором урожая), получая при этом экономию электроэнергии, затраченной на выращивание микрозелени.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-016-00033а. Работа выполнена с использованием научного оборудования Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук” в рамках государственного задания КарНЦ РАН (FMEN-2022-0004).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Treadwell D.D., Hochmuth R., Landrum L., Laughlin W. Microgreens: A new specialty crop // Univ. Florida IFAS Ext. Bul. 2020. HS1164 https://doi.org/journals.flvc.org/edis/article/view/118552
Xiao Z., Codling E.E., Luo Y., Nou X., Lester G.E., Wang Q. Microgreens of Brassicaceae: Mineral composition and content of 30 varieties // J. Food Compos. Anal. 2016. V. 49. P. 87. https://doi.org/10.1016/j.jfca.2016.04.006
Zhou W., Wenke L., Qichang Y. Reducing nitrate content in lettuce by pre-harvest continuous light delivered by red and blue light-emitting diodes // J. Plant Nutr. 2013. V. 36. P. 481. https://doi.org/10.1080/01904167.2012.748069
Proietti S., Moscatello S., Riccio F., Downey P., Battistelli A. Continuous lighting promotes plant growth, light conversion efficiency, and nutritional quality of Eruca vesicaria (L.) Cav. in controlled environment with minor effects due to light quality // Front. Plant Sci. 2021. V. 12. 730119. https://doi.org/10.3389/fpls.2021.730119
Jones-Baumgardt C., Llewellyn D., Ying Q., Zheng Y. Intensity of sole-source light-emitting diodes affects growth, yield, and quality of Brassicaceae microgreens // HortSci. 2019. V. 54. P. 1168. https://doi.org/10.21273/HORTSCI13788-18
Trejo-Tellez L.I., Estrada-Ortiz E., Gomez-Merino F.C., Becker C., Krumbein A., Schwarz D. Flavonoid, nitrate and glucosinolate concentrations in Brassica species are differentially affected by photosynthetically active radiation, phosphate and phosphate // Front Plant Sci. 2019. V. 10. P. 371. https://doi.org/10.3389/fpls.2019.00371
Artés-Hernández F., Castillejo N., Martínez-Zamora L. UV and visible spectrum LED lighting as abiotic elicitors of bioactive compounds in sprouts, microgreens, and baby leaves. A comprehensive review including their mode of action // Foods. 2022. V. 11. P. 265. https://doi.org/10.3390/ foods11030265
Viršilë A., Brazaitytë A., Vaštakaitë-Kairienë V., Miliauskienë J., Jankauskienë J., Novièkovas A., Laužikė K., Samuolienė G. The distinct impact of multi-color LED light on nitrate, amino acid, soluble sugar and organic acid contents in red and green leaf lettuce cultivated in controlled environment // Food Chem. 2020. V. 310. 125799. https://doi.org/10.1016/j.foodchem.2019.125799
Yan Z., He D., Niu G., Zhou Q., Qu Y. Growth, nutritional quality, and energy use efficiency of hydroponic lettuce as influenced by daily light integrals exposed to white versus white plus red light-emitting diodes // HortSci. 2019. V. 54. P. 1737. https://doi.org/10.21273/HORTSCI14236-19
Lanoue J., St Louis S., Little C., Hao X. Continuous lighting can improve yield and reduce energy costs while increasing or maintaining nutritional contents of microgreens // Front. Plant Sci. 2022. V. 13. 983222. https://doi.org/10.3389/fpls.2022.983222
Velez-Ramirez A.I., Van Ieperen W., Vreugdenhil D., Millenaar F.F. Plants under continuous light // Trends Plant Sci. 2011. V. 16. P. 310. https://doi.org/10.1016/ j.tplants.2011.02.003
Sysoeva M.I., Markovskaya E.F., Shibaeva T.G. Plants under continuous light: a review // Plant Stress. 2010. V. 4. P. 5.
Shibaeva T.G., Sherudilo E.G., Rubaeva A.A., Titov A.F. Continuous LED lighting enhances yield and nutritional value of four genotypes of Brassicaceae microgreens // Plants. 2022. V. 11. P. 1. https://doi.org/10.3390/plants11020176
Lichtenthaler H.K., Wellburn A.R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents // Biochem. Soc. Trans. 1983. V. 603. P. 591.
Kolupaev Y.E., Fisova E.N., Yastreb T.O., Ryabchun N.I., Kirichenko V.V. Effect of hydrogen sulfide donor on antioxidant state of wheat plants and their resistance to soil drought // Russ. J. Plant Physiol. 2019. V. 66. P. 59. https://doi.org/10.1134/S1021443719010084
Методические указания по определению нитратов и нитритов в продукции растениеводства 5048-89. М., 1989.
Poorter H., Niinemets U., Ntagkas N., Siebenk A., Maenpaa M., Matsubara S., Pons T.L. A meta-analysis of plant responses to light intensity for 70 traits ranging from molecules to whole plant performance // New Phytol. 2019. V. 223. P. 1073. https://doi.org/10.1111/nph.15754
Koontz H.V., Prince R.P. Effect of 16 and 24 hours daily radiation (light) on lettuce growth // HortSci. 1986. V. 21. P. 123. https://doi.org/10.21273/HORTSCI.21.1.123
Weaver G., van Iersel M.W. Photochemical characterization of greenhouse-grown lettuce (Lactuca sativa L. ‘Green Towers’) with applications for supplemental lighting control // HortSci. 2019. V. 54. P. 317. https://doi.org/10.21273/HORTSCI13553-18
Weaver G., van Iersel M.W. Longer photoperiods with adaptive lighting control can improve growth of greenhouse-grown ‘Little gem’ lettuce (Lactuca sativa) // HortSci. 2020. V. 55. P. 573. https://doi.org/10.21273/HORTSCI14721-19
Aikman D.P. Potential increase in photosynthetic efficiency from the redistribution of solar radiation in a crop // J. Exp. Bot. 1989. V. 40. P. 855. https://doi.org/10.1093/jxb/40.8.855
Palmer S., van Iersel M.W. Increasing growth of lettuce and mizuna under sole-source LED lighting using longer photoperiods with the same daily light integral // Agronomy. 2020. V. 10. P. 1. https://doi.org/10.3390/agronomy10111659
Shibaeva T.G., Mamaev A.V., Sherudilo E.G., Titov A.F. The role of photosynthetic daily light integral in plant response to extended photoperiods // Russ. J. Plant Physiol. 2022. V. 69, 7. https://doi.org/10.1134/s1021443722010216
Pennisi G., Orsini F., Landolfo M., Pistillo A., Crepaldi A., Nicola S., Fernández J.A., Marcelis L.F.M., Gianquinto G. Optimal photoperiod for indoor cultivation of leafy vegetables and herbs // Eut. J. Hortic. Sci. 2020. V. 85. P. 329. https://doi.org/10.17660/eJHS.2020/85.5.4
Llorente B., Martínez-García J., Stange C., Rodríguez-Concepción M. Illuminating colors: regulation of carotenoid biosynthesis and accumulation by light // Curr. Opin. Plant Biol. 2017. V. 37. P. 49. https://doi.org/10.1016/j.pbi.2017.03.011
Proietti S., Moscatello S., Leccese A., Colla G., Battistelli A. The effect of growing spinach (Spinacia oleracea L.) at low light intensities on the amounts of oxalate, ascorbate and nitrate in their leaves // J. Hort. Sci. Biotechnol. 2004. V. 79. P. 606. https://doi.org/10.1080/14620316.2004.11511814
Bian Z.-H., Cheng R.-F., Yang Q.-C., Wang J., Lu C. Continuous light from red, blue, and green light-emitting diodes reduces nitrate content and enhances phytochemical concentrations and antioxidant capacity in lettuce // J. Amer. Soc. Hort. Sci. 2016. V. 141. P. 186. https://doi.org/10.21273/JASHS.141.2.186
Haque M.S., de Sousa A., Soares C., Kjaer K.H., Fidalgo F., Rosenqvist E., Ottosen C.-O. Temperature variation under continuous light restores tomato leaf photosynthesis and maintains the diurnal pattern in stomatal conductance // Front. Plant Sci. 2017. V. 8. P. 1602. https://doi.org/10.3389/fpls.2017.01602
Kumar D., Singh H., Bhatt U., Soni V. Effect of continuous light on antioxidant activity, lipid peroxidation, proline and chlorophyll content in Vigna radiata l // Funct. Plant Biol. 2022. V. 49. P. 145. https://doi.org/10.1071/FP21226
Fan X.-X., XueF., Song B., Chen L.-Z., Xu G., Xu H. Effects of blue and red light on growth and metabolism in pakchoi // Open Chem. 2019. V. 17. P. 456. https://doi.org/10.1515/chem-2019-0038
Paradiso R., Proietti S. Light-quality manipulation to control plant growth and photomorphogenesis in greenhouse horticulture: the state of the art and the opportunities of modern led systems // J. Plant Growth Regul. 2021. V. 21. P. 1. https://doi.org/10.1007/s00344-021-10337-y
Alrifai O., Hao X., Liu R., Lu Z., Marcone M.F., Tsao R. Amber, red and blue LEDs modulate phenolic contents and antioxidant activities in eight cruciferous microgreens // J. Food Bioact. 2020. V. 11. P. 95. https://doi.org/10.31665/ jfb.2020.11241
Bian Z.H., Yang Q.C., Liu W.K. Effects of light quality on the accumulation of phytochemicals in vegetables produced in controlled environments: a review // J. Sci. Food Agric. 2015. V. 95. P. 869. https://doi.org/10.1002/jsfa.6789
Signore A., Bell L., Santamaria P., Wagstaff C., Van Labeke M.-C. Red light is effective in reducing nitrate concentration in rocket by increasing nitrate reductase activity, and contributes to increased total glucosinolates content // Front. Plant Sci. 2020. V. 11. P. 604. https://doi.org/10.3389/fpls.2020.00604
Champigny M.L. Integration of photosynthetic carbon and nitrogen metabolism in higher plants // Photosynth. Res. 1995. V. 46. P. 117. https://doi.org/10.1007/BF00020422
Veen B.W., Kleinendorst A. Nitrate accumulation and osmotic regulation in Italian ryegrass (Lolium multiflorum Lam.) // J. Expt. Bot. 1985. V. 36. P. 211.
Huner N.P.A., Öquist G., Sarhan F. Energy balance and acclimation to light and cold // Trends Plant Sci. 1998. V. 3. P. 224. https://doi.org/10.1016/S1360-1385(98)01248-5
Lillo C. Light regulation of nitrate uptake, assimilation and metabolism // Nitrogen Acquisition and Assimilation in Higher Plants. Plant Ecophysiology. V. 3. / Eds Amâncio S., Stulen I. Dordrecht: Springer. 2004. P. 149. https://doi.org/10.1007/978-1-4020-2728-4_6
Nawaz M.Q. Effect of different sowing methods and nitrogen levels on fodder yield of oat in salt affected soil // Pakistan J. Agricul. Research. 2017. V. 30. P. 323. https://doi.org/10.17582/journal.pjar/2017/30.4.323.328
Liandong Q., Shiqi L., Li X., Wenyan Y., Qingling L., Shuqin H. Effects of light qualities on accumulation of oxalate, tannin and nitrate in spinach // Transactions of the CSAE. 2007. V. 23. P. 201. https://doi.org/10.3969/J.ISSN.1002-6819.2007.4.040
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


