Физиология растений, 2023, T. 70, № 6, стр. 588-600
Влияние повышенной концентрации СО2 и температуры на растения с разным типом фотосинтеза: киноа (С3) и амарант (С4)
З. Ф. Рахманкулова a, *, Е. В. Шуйская a, М. Ю. Прокофьева a, Л. Т. Саидова a, П. Ю. Воронин a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: zulfirar@mail.ru
Поступила в редакцию 02.05.2023
После доработки 10.05.2023
Принята к публикации 11.05.2023
- EDN: ICAOVY
- DOI: 10.31857/S0015330323600353
Аннотация
Исследовали термоустойчивость растений с разным типом фотосинтеза Chenopodium quinoa Willd. (С3) и Amaranthus retroflexus L. (С4-НАД) к кратковременной повышенной температуре (35°С, eT) при естественной (400 ppm, aCO2) и повышенной (800 ppm, eCO2) концентрации СО2. Анализировали ростовые параметры, содержание воды, пролина, МДА, параметры СО2/Н2О газообмена, функционирование ФС I и ФС II, содержание ключевых фотосинтетических (РБФК/О, ФЕПк) и фотодыхательных (ГДК) ферментов. В контрольных условиях у растений С4-вида, по сравнению с С3-видом, показаны более высокие значения прироста сухой биомассы, интенсивности видимого фотосинтеза, транспирации, активности ФС I и более низкое содержание пролина. Фотосинтетический и устьичный аппарат обоих видов был чувствителен к eT, что проявлялось в снижении интенсивности видимого фотосинтеза и транспирации. Кроме того, у С3-вида наблюдалось подавление световых реакций (ФС II) и интенсивности фотодыхания (по ГДК), а у С4-вида – увеличение содержания пролина. В условиях eCO2 у С3-вида наблюдалось снижение интенсивности фотодыхания, а у С4-вида окислительный стресс (2-кратное увеличение содержания МДА) сопровождался снижением интенсивности видимого фотосинтеза, транспирации и возрастанием интенсивности темнового митохондриального дыхания. Смягчающий эффект eCO2 на термоустойчивость данных С3- и С4-растений не установлен. При совместном действии eCO2 и eT у обоих видов имели место окислительный стресс, снижение эффективности ФС II и видимого фотосинтеза, а также активация темнового дыхания. Однако наблюдались и отличия: у С3-вида окислительный стресс сопровождался снижением прироста сухой биомассы и содержания воды в тканях, а также подавлением фотодыхания, а у С4-вида – снижением интенсивности транспирации и возрастанием содержания ФЕПк. Снижение WUE при совместном действии eCO2 и eT у растений С4-вида было менее значительным, чем у С3-вида. Обсуждается разная реакция растений киноа (С3) и амаранта (С4) на совместное действие климатических факторов: повышенной температуры и концентрации СО2.
ВВЕДЕНИЕ
В ближайшие годы прогнозируется возрастание частоты экстремальных явлений и климатических колебаний, что окажет серьезное влияние на стабильность и безопасность производства продуктов питания [1]. Увеличение атмосферной концентрации CO2 (eCO2, elevated CО2) и потепление (eT, elevated temperature) являются значимыми проявлениями изменения климата и факторами, определяющими продуктивность ценных пищевых и кормовых культур [2, 3].
Наблюдаемый стремительный рост атмосферной концентрации СО2 по-разному влияет на интенсивность фотосинтеза, биопродуктивность и устойчивость С3- и С4-растений [4, 5]. Долгое время считалось, что C3-фотосинтез более чувствителен к изменениям концентрации СО2 в атмосфере и что ее увеличение оказывает положительное влияние на интенсивность фотосинтеза и продуктивность С3-видов посредством активации карбоксилирования в цикле Кальвина и повышения эффективности использования воды благодаря снижению устьичной проводимости в растениях [6]. Однако позже было показано, что увеличение биомассы С3-растений может быть лишь кратковременным эффектом, который теряется в течение более длительного периода времени [4, 7] и может сопровождаться снижением пищевой ценности кормовых культур из-за подавления фотодыхания высоким уровнем CO2 за счет снижения оксигеназной функции рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы (РБФК/О), что может отрицательно сказываться на азотном обмене растений [8, 9]. C4-растения, благодаря наличию углерод-концентрирующего механизма (УКМ), ранее рассматривались как менее зависимые от концентрации CO2 в окружающей среде, чем C3-виды, и предполагалось, что они будут меньше реагировать на еCO2 [6, 7]. Эта концепция глубоко укоренилась в климатических и экологических моделях воздействия меняющегося климата на растения [7]. Однако за последние годы появилось много противоречивой информации по этому вопросу [2, 3]. Было показано, что у С4-видов еСО2 более эффективно стимулирует фотосинтетический метаболизм [10] и накопление биомассы, связанное с повышением эффективности использования воды (WUE) [11]. В то же время есть информация, что высокие и сверхвысокие концентрации СО2 приводят к снижению интенсивности фотосинтеза как у С3-, так и у С4-видов [9, 12]. Таким образом, вопрос о влиянии еСО2 на растения с разным типом фотосинтеза в настоящее время остается открытым.
Известно, что условия, которые сопровождают повышение концентрации СО2 в атмосфере, в частности повышенные температуры, могут стать лимитирующими факторами для роста растений [13]. Исследования совместного комплексного воздействия нескольких климатических факторов представляют особый интерес, поскольку они вызывают более сложные ответные реакции растений, по сравнению с действием одиночных стрессов [14]. Было установлено, что способность к температурной акклимации фотосинтеза у C3- и C4-видов различается [15]. На С3-виде киноа показано, что реакция растений на высокие температуры разнообразна и зависит от генотипа и фенологической стадии [16]. На С3-видах, пшенице и рисе, высокие температуры снижали урожай зерна, причем еCO2 не компенсировал это негативное воздействие, что в результате приводило к снижению урожая до 35% [17]. У С3-видов основными причинами снижения фотосинтеза при совместном действии еСО2 и еТ являются тепловая лабильность РБФК/О-активазы и снижение фотосинтетического электронного транспорта [18]. В то же время установлено, что еСО2 может положительно влиять на термоустойчивость некоторых С3-видов, и у них наблюдается активация чувствительных к повышенной температуре фотосинтетических параметров (видимый фотосинтез, устьичная проводимость и эффективность ФС II) [19]. Предполагается, что смягчающий эффект eCO2 при комплексном воздействии климатических факторов у С3-растений связан с активацией антиоксидантной защитной системы, снижением фотодыхания [20], уменьшением отрицательного влияния стрессовых факторов на метаболизм сахаров и аминокислот [21], а также с положительным влиянием еСО2 на интенсивность карбоксилирования и водный баланс растений [2, 22]. Таким образом, в настоящее время однозначно сказать о влиянии eCO2 на термоустойчивость ростовых и фотосинтетических параметров С3-растений нельзя [22].
C4-растения демонстрируют другую, по сравнению с С3-видами, и достаточно противоречивую картину биохимических ограничений при действии повышенных температур. Это объясняется сложностью биохимической модели C4-фотосинтеза. Можно сказать, что фотосинтетический С4-УКМ, является адаптацией С3-пути к низкой концентрации СО2, которая за счет снижения оксигеназной функции РБФК/О ограничивает фотодыхание, способствуя повышению эффективности фотосинтеза и минимизируя потери воды в жарких и засушливых условиях [23]. На примере C4-трав установлено, что активация биосинтеза белков и метаболитов в результате усиления метаболических процессов при еCO2 может способствовать улучшению термостойкости растений, связанной с усилением дыхательных метаболических путей в условиях теплового стресса [24]. Действие еСО2 на С4-НАД-растения способствует повышению клеточной устойчивости к тепловому шоку, стимулирует рост растений [25]. С другой стороны, показано, что при еСО2 у С4-растений наблюдается снижение чувствительных к повышенной температуре фотосинтетических параметров (видимый фотосинтез, устьичная проводимость и эффективность ФС II) [19]. Предполагается, что неоднозначность ответов на совместное действие еСО2 и еТ у С4-видов связана с видоспецифичностью [26] и с противоположным действием этих факторов на транспирацию [27]. Итак, на сегодняшний день данные о влиянии еСО2 на механизмы термоустойчивости растений с разным типом фотосинтетического метаболизма противоречивы и фрагментарны [3, 10, 11, 22]. В то же время исследования комбинированного действия еСО2 и еТ на отдельные этапы С3- и С4-фотосинтеза важны для создания реалистичной картины влияния изменяющегося климата на растения, необходимой для прогнозирования продуктивности растений [4, 10, 11, 22].
В данной работе исследовали однолетние окультуренные растения одного семейства Амарантовые с разным типом фотосинтеза – киноа (С3, подсем. Chenopodiaceae) и амарант (С4, Amaranthaceae). Они относятся к группе культур, известных как псевдозерновые. Киноа (Chenopodium quinoa Willd.) – cтрессоустойчивое растение, из-за высокой питательной ценности и адаптируемости было предложено в качестве культуры, используемой для повышения продовольственной безопасности в условиях климатических изменений [1, 16]. Амарант запрокинутый (Amaranthus retroflexus L.) – теплолюбивый, устойчивый к засухе вид, произрастающий почти во всех районах России. В настоящее время амарант используется повсеместно: выведены кормовые, декоративные и овощные сорта растения [28, 29].
Целью данной работы являлось исследование влияния повышенной концентрации СО2 (800 ppm) на термоустойчивость растений с разным типом фотосинтеза: Chenopodium quinoa (С3) и Amaranthus retroflexus (С4-НАД) к кратковременной повышенной температуре (35°С).
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования и условия выращивания. Семена Chenopodium quinoa Willd., сорт “Vakhdat”, и Amaranthus retroflexus L. (интродуцированный вид) получены из Центра генетических ресурсов Таджикской академии сельскохозяйственных наук (CGR TAAS).
Семена киноа проращивали в дистиллированной воде и 3–4-дневные проростки высаживали на перлит, пропитанный 50% раствором Хогланда. Семена Amaranthus retroflexus проращивали в перлите без предварительного замачивания. Растения выращивали в течение 30 дней под люминесцентными лампами (плотность потоков квантов ФАР 200 мкмоль/(м2 с)), при 16-часовом фотопериоде, в двух раздельных камерах при естественной (400 ppm, аСО2) и повышенной (800 ppm, еСО2) концентрации СО2 при температуре 25°С. Затем растения в обеих камерах подвергали 4-дневному воздействию повышенной температуры (35°С, еТ).
Определение сухой биомассы, содержания воды, пролина и МДА. Для определения сухой биомассы листья высушивали при 80°С до постоянной массы. Содержание воды (W) рассчитывали по формуле и выражали в г Н2О/г сухой массы:
(1)
${\text{W}} = {{({\text{FW}} - {\text{DW}})} \mathord{\left/ {\vphantom {{({\text{FW}} - {\text{DW}})} {{\text{DW}}}}} \right. \kern-0em} {{\text{DW}}}},$где FW – сырая биомасса, DW – сухая биомасса.
Содержание свободного пролина определяли с помощью кислого нингидринового реактива по методу Bates [30] с модификациями. В качестве анализируемых экстрактов использовали водные вытяжки высушенных и растертых листьев. Результаты рассчитывали на 1 г сухой массы.
Скорость перекисного окисления липидов оценивали спектрофотометрически по реакции с тиобарбитуровой кислотой (ТБК), основанной на взаимодействии ТБК с малоновым диальдегидом (МДА). Содержание МДА определяли по Heath и Packer [31]. Навеску листьев (0.5 г) растирали в ступке с 2 мл 0.5% трихлоруксусной кислоты (ТХУ). Гомогенат центрифугировали при 10 000 g в течение 10 мин и к 0.3 мл супернатанта добавляли 1.2 мл 0.5% ТБК в 20% ТХУ. Смесь нагревали на кипящей водяной бане в течение 30 мин, затем быстро охлаждали во льду и центрифугировали при 10 000 g в течение 10 мин. После этого измеряли оптическую плотность проб при 532 и 600 нм (Multiskan Sky Spectrophotometer, “Thermo Scientific”, США). Концентрацию МДА рассчитывали после вычитания неспецифического поглощения при 600 нм (ε = 1.56 × 105 М–1 см–1) и выражали в нмоль/г сырой массы.
Измерение СО2/Н2О газообмена. Для определения интенсивности видимого фотосинтеза (А) и транспирации (Е) лист помещали в термостатируемую при комнатной температуре листовую камеру и освещали оптоволоконным световодом от осветителя (KL 1500 LCD, “Shott”, Германия) с галогеновой лампой (150 Вт, “Philips”, Нидерланды) с интенсивностью ФАР в поле объекта 2000 мкмоль/(м2 с). Стационарный СО2/Н2О газообмен листа измеряли с помощью одноканального ИК-газоанализатора (LI-820, “LICOR”, США) в открытой схеме. Транспирацию листа рассчитывали на основании разности влажности газа на входе и выходе из листовой камеры. В данной установке в опорном газовом потоке на входе в листовую камеру поддерживали известную постоянную влажность с помощью увлажнителя LI-610 (“LICOR”, США). Для определения влажности на выходе из листовой камеры использовали психрометрический датчик HMP50 (“Vaisala INTERCAP”, Финляндия). Эффективность использования воды (WUE) рассчитывали, как отношение скорости видимого фотосинтеза к транспирации (А/Е). Интенсивность темнового дыхания (Rd) оценивали через 20 мин после выключения света.
Измерение функционирования фотосистем I и II. Изменение окислительно-восстановительного потенциала Р700 измеряли путем мониторинга оптической плотности листьев при 820 нм с использованием двухволновой системы импульсной модуляции ED-P700DW (“Heinz-Walz, Effeltrich”, Германия) в сочетании с PAM-101 (“Heinz-Walz”, Германия). Кинетика окисления P700 измерялась при освещении дальним красным светом (720 нм, 17.2 Вт/м2). Максимальное окисление P700 определяли с использованием ксеноновой газоразрядной лампы (50 мс, 1500 Вт/м2, “Heinz-Walz”, Германия) в присутствии дальнего красного света.
Определение квантового выхода флуоресценции ФС II адаптированного к темноте (20 мин) фрагмента листа осуществляли с помощью РАМ-флуориметра (PAM-101, “Heinz-Walz”, Германия). Измеряли темновой максимальный квантовый выход флуоресценции ФС II (Fv/Fm). Измерение проводили с досветкой образца слабым модулированным потоком красного света, которое осуществлялось АЦП (PDA-100, “Walz”, Германия), преобразующим первичный сигнал от PAM-101 на компьютер со стандартным программным интерфейсом. Расчет показателей проводили на основании текущих значений минимальной (F0) и максимальной (Fm) флуоресценции адаптированного к темноте листа по формуле:
(2)
${{{{F}_{{\text{v}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{v}}}}} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}} = {{\left( {{{F}_{{\text{m}}}} - {{F}_{0}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{F}_{{\text{m}}}} - {{F}_{0}}} \right)} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}}.$Максимальную квантовую эффективность (${{F_{{\text{v}}}^{'}} \mathord{\left/ {\vphantom {{F_{{\text{v}}}^{'}} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}$) и эффективный квантовый выход (ФФСII) фотохимии ФС II при заданной интенсивности света рассчитывали по формулам:
(3)
${{F_{{\text{v}}}^{'}} \mathord{\left/ {\vphantom {{F_{{\text{v}}}^{'}} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}} = {{(F_{{\text{m}}}^{'} - F_{{\text{0}}}^{'})} \mathord{\left/ {\vphantom {{(F_{{\text{m}}}^{'} - F_{{\text{0}}}^{'})} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}},$(4)
${{\Phi }_{{\Phi {\text{CII}}}}} = {{F_{{\text{q}}}^{'}} \mathord{\left/ {\vphantom {{F_{{\text{q}}}^{'}} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}},$где $F_{{\text{q}}}^{'}$ – фотохимическое тушение флуоресценции открытым реакционным центром ФС II, а $F_{{\text{0}}}^{'}$ и $F_{{\text{m}}}^{'}$ – минимальная и максимальная флуоресценция хлорофилла после световой адаптации.
Нефотохимическое тушение флуоресценции хлорофилла (NPQ) рассчитывали по формуле:
(5)
${\text{NPQ}} = {{({{F}_{{\text{m}}}} - F_{{\text{m}}}^{'})} \mathord{\left/ {\vphantom {{({{F}_{{\text{m}}}} - F_{{\text{m}}}^{'})} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}.$Определение содержания белков рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы (РБФК/О), фосфоенолпируваткарбоксилазы (ФЕПк) и глициндекарбоксилазы (ГДК) проводили с помощью вестерн-блоттинга. Тотальный белок выделяли из листьев (0.5 г) экстракционным буфером (50 мМ Tрис-HCl (pH 8.0), 10 мМ MgCl2, 0.3 мМ ЭДТА, 2% поливинилпирролидон и 5 мМ дитиотреитол). Содержание белка определяли по методу Бредфорд, используя бычий сывороточный альбумин (“Sigma-Aldrich”, США) в качестве стандарта.
Вестерн блоттинг. Анализ содержания белков РБФК/О, ФЕПк и ГДК проводили с помощью иммуноферментного анализа, как было описано ранее [32] с использованием коммерческих поликлональных антител против белков большой субъединицы (L) (БС) РБФК/О (RbcL, AS03037, “Agrisera”, Швеция), ФЕПк (PEPC, AS09458, “Agrisera”, Швеция) и ГДК (GLDP, AS204370, “Agrisera”, Швеция). Разделение суммарных белков (5–15 мкг тотального белка в слоте) проводили с помощью 10% денатурирующего гель-электрофореза (SDS-PAGE). После проведения электрофореза белки переносили на нитроцеллюлозную мембрану (“Amersham, GE Healthcare”, Великобритания), используя прибор для мокрого блоттинга (“BioRad”, США) согласно стандартному протоколу. Анализ взаимодействия антител с антигеном проводили обработкой вторичными антителами (anti-rabbit IgG horse radish antibodies (Agrisera, AS09 602)) с помощью смеси люминола и кумаровой кислоты в присутствии перекиси водорода. Хемилюминесцентный сигнал на мембранах регистрировали с помощью пленки Retina XBE (Германия). Интенсивность полос в вестерн-блоттинге оценивали с помощью программы ImageJ 1.37v (США) и выражали относительно среднего уровня (n = 3) для контрольных растений, который был взят за 100%. Анализ проводили не менее 3 раз.
Статистический анализ. Во всех экспериментах было пять биологических повторностей. Для корреляционного и факторного (ANOVA) анализа использовали программу SigmaPlot 12.0. На графиках приведены средние арифметические значения полученных величин и их стандартные ошибки. Различия считались достоверными при Р < 0.05 (тест Тьюки). Для многофакторного анализа методом главных компонент (РСА) было использовано программное обеспечение R (версия 3.6.1).
РЕЗУЛЬТАТЫ
Ростовые параметры, содержание воды, пролина и малонового диальдегида
34-дневные растения C. quinoa (С3) и A. retroflexus (С4-НАД) отличались по продуктивности и устойчивости. Сухая биомасса растений A. retroflexus, выращенных в контрольном варианте, была в 1.5 раза больше контрольных растений C. quinoa. Отдельное воздействие еТ и еСО2 не вызывало изменений в росте растений обоих видов, а совместное действие еСО2 и еТ снижало биомассу только у C. quinoa на 28% (рис. 1а).
Рис. 1.
Накопление сухой биомассы (а), содержание воды (б), пролина (в) и МДА (г) у растений Chenopodium quinoa и Amaranthus retroflexus, выращенных при разных концентрациях СО2 и кратковременном действии повышенной температуры (35°С, еТ). (1) Контрольные растения, выращенные при естественной (400 ppm) концентрации СО2 (аСО2); (2) растения, выращенные при аСО2 и 4-дневном воздействии еТ; (3) растения, выращенные при повышенной (800 ppm) концентрации СО2 (еСО2); (4) растения, выращенные при еСО2 и 4-дневном воздействии еТ (еСО2 и еТ). Разными латинскими буквами отмечены достоверные различия на уровне P < 0.05.
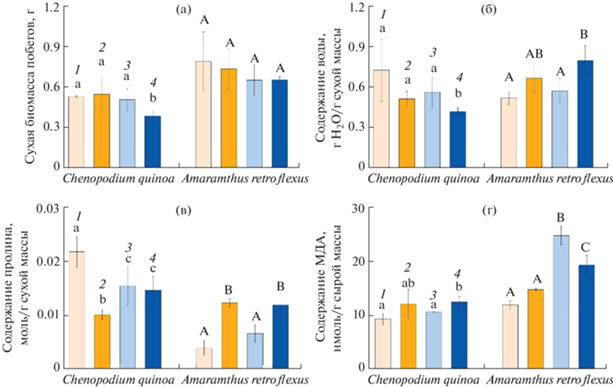
При совместном действии факторов (еСО2 и еТ) исследуемые растения отличались также по содержанию воды: у C. quinoa наблюдалось его снижение на 42%, а у A. retroflexus возрастание на 52%, по сравнению с контролем (рис. 1б).
Содержание пролина при всех видах воздействия у C. quinoa снижалось на 30–50%, а у A. retroflexus повышалось при температурном воздействии и совместном действии факторов (еСО2 и еТ) в 3 раза, по сравнению с контролем (рис. 1в).
Содержание МДА, которое является показателем окислительного стресса, у C. quinoa возрастало при совместном действии еСО2 и еТ на 34%, а у A. retroflexus – в 2 раза при действии еСО2 и на 61% при совместном действии факторов (еСО2 и еТ) (рис. 1г).
Интенсивность параметров СО2/Н2О газообмена
Интенсивность видимого фотосинтеза (А) в контроле была более значительной у растений A. retroflexus (на 28%) по сравнению с растениями C. quinoa. Интенсивность видимого фотосинтеза C. quinoa снижалась при действии повышенной температуры как при обычном, так и при повышенном уровне СО2 на 28 и 18%, соответственно, а у A. retroflexus при всех видах воздействий в среднем на 33% по сравнению с контролем (рис. 2а).
Рис. 2.
Интенсивность видимого фотосинтеза (а), транспирации (б), темнового дыхания (в) и эффективность использования воды (г) у растений Chenopodium quinoa и Amaranthus retroflexus, выращенных при разных концентрациях СО2 и кратковременном действии повышенной температуры (35°С, еТ). (1) Контрольные растения, выращенные при естественной (400 ppm) концентрации СО2 (аСО2); (2) растения, выращенные при аСО2 и 4-дневном воздействии еТ; (3) растения, выращенные при повышенной (800 ppm) концентрации СО2 (еСО2); (4) растения, выращенные при еСО2 и 4-дневном воздействии еТ (еСО2 и еТ). Разными латинскими буквами отмечены достоверные различия на уровне P < 0.05.
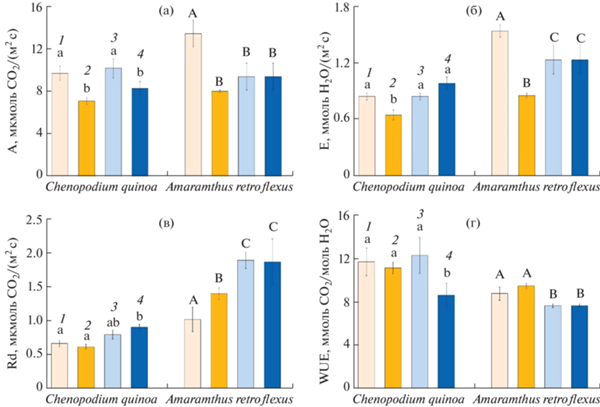
У обоих видов C. quinoa и A. retroflexus значения интенсивности транспирации (Е) при повышении температуры снижались на 23 и 45% соответственно. Кроме того, снижение Е на 20%, по сравнению с контролем, происходило у растений A. retroflexus при действии еСО2 и совместном действии факторов (еСО2 и еТ) (рис. 2б).
Интенсивность темнового митохондриального дыхания (Rd) у обоих видов возрастала при действии повышенной температуры и повышенной концентрации СО2: на 36% у C. quinoa и на 83% у A. retroflexus. У A. retroflexus Rd также увеличивалась на 39% при действии повышенной температуры и на 86% в условиях повышенной концентрации СО2 по сравнению с контролем (рис. 2в).
Эффективность использования воды (WUE) у обоих видов снижалась при совместном действии факторов (еСО2 и еТ): на 26% у C. quinoa и на 13% у A. retroflexus по сравнению с контролем. У A. retroflexus происходило снижение WUE и при действии повышенного уровня СО2 при обычной температуре на 13% по сравнению с контролем (рис. 2г).
Активность ФС I и эффективность функционирования ФС II
Эффективность функционирования ФС I и циклического транспорта электронов была более значительной у растений A. retroflexus. При всех вариантах воздействий данный параметр достоверно не изменялся у обоих видов (рис. 3а).
Рис. 3.
Фотосинтетические параметры у растений Chenopodium quinoa и Amaranthus retroflexus, выращенных при разных концентрациях СО2 и кратковременном действии повышенной температуры (35°С, еТ). (а) Активность циклического транспорта электронов ФС I; (б) максимальный квантовый выход флуоресценции ФС II (Fv/Fm); (в) максимальная квантовая эффективность фотохимии ФС II при заданной интенсивности света (${{F_{{\text{v}}}^{'}} \mathord{\left/ {\vphantom {{F_{{\text{v}}}^{'}} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}$); (г) эффективный квантовый выход фотохимии ФС II при заданной интенсивности света (ФФСII); (д) нефотохимическое тушение флуоресценции ФС II (NPQ). (1) Контрольные растения, выращенные при естественной (400 ppm) концентрации СО2 (аСО2); (2) растения, выращенные при аСО2 и 4-дневном воздействии еТ; (3) растения, выращенные при повышенной (800 ppm) концентрации СО2 (еСО2); (4) растения, выращенные при еСО2 и 4-дневном воздействии еТ (еСО2 и еТ). Разными латинскими буквами отмечены достоверные различия на уровне P < 0.05.
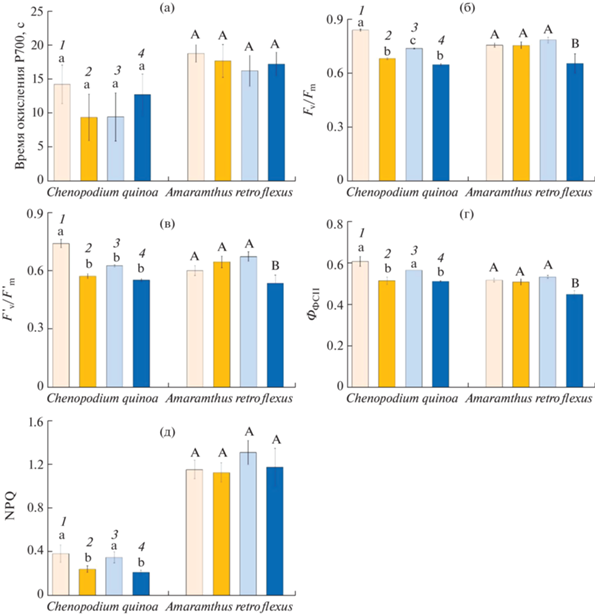
Эффективность максимального квантового выхода фотосинтеза ФС II (Fv/Fm) у растений обоих видов снижалась при совместном действии еСО2 и еТ в среднем на 20%. У C. quinoa она также снижалась на 20% при действии только eT (рис. 3б). Снижение Fv/Fm у обоих видов при совместном действии еСО2 и еТ и у C. quinoa при еТ сопровождалось аналогичным снижением на ~20% максимальной квантовой эффективности фотохимии ФС II при заданной интенсивности света (Y ' = ${{F_{{\text{v}}}^{'}} \mathord{\left/ {\vphantom {{F_{{\text{v}}}^{'}} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}$) и на ~14% эффективного квантового выхода фотохимии ФС II при заданной интенсивности света (ФФСII (${{F_{{\text{q}}}^{'}} \mathord{\left/ {\vphantom {{F_{{\text{q}}}^{'}} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}$)) (рис. 3в, г). В контрольных условиях нефотохимическое тушение (NPQ) было более значительным (почти в 3 раза) у растений A. retroflexus по сравнению с растениями C. quinoa, у которых при действии еТ и при совместном действии еСО2 и еТ NPQ снижалось на 38% (рис. 3д).
Содержание фотосинтетических ферментов
Содержание фермента РБФК/О достоверно не изменялось в результате воздействия всех вариантов факторов ни у растений C. quinoa, ни у A. retroflexus (рис. 4а).
Рис. 4.
Результаты вестерн-блоттинга белков БС РБФК/О (большая субъединица) (а, б), ФЕПк (а, в) и ГДК (а, г) в листьях растений Chenopodium quinoa и Amaranthus retroflexus, выращенных при разных концентрациях СО2 и кратковременном действии повышенной температуры (35°С, еТ). (1) Контрольные растения, выращенные при естественной (400 ppm) концентрации СО2 (аСО2); (2) растения, выращенные при аСО2 и 4-дневном воздействии еТ; (3) растения, выращенные при повышенной (800 ppm) концентрации СО2 (еСО2); (4) растения, выращенные при еСО2 и 4-дневном воздействии еТ (еСО2 и еТ). Разными латинскими буквами отмечены достоверные различия на уровне P < 0.05.
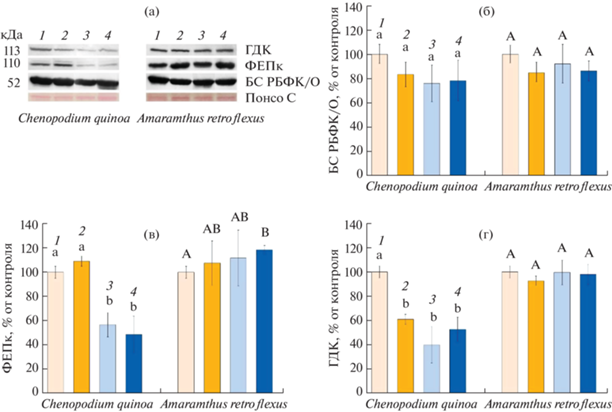
Содержание фермента ФЕПк было снижено только у растений C. quinoa, выращенных при действии еСО2 и при совместном действии еСО2 и еТ на 44 и 51% по сравнению с контролем соответственно. У растений A. retroflexus, выращенных при совместном действии еСО2 и еТ, наблюдалось возрастание содержания ФЕПк на 20% (рис. 4в).
Содержание ГДК снижалось в среднем в 2 раза только у растений C. quinoa при всех исследованных вариантах воздействия (рис. 4г).
Многофакторный анализ физиологических и биохимических параметров
Для оценки степени изменений характеристик фотосинтетического аппарата и механизмов устойчивости в условиях повышенной температуры и концентрации СО2 был проведен многофакторный анализ методом главных компонент (РСА) биохимических и физиологических параметров C. quinoa (С3) и A. retroflexus (С4). На рис. 5а видно, что у растений C. quinoa первой основной компонентой (PC1) четко отделяются от контроля два варианта с повышенной температурой: еТ и совместным действием еСО2 и еТ. Разделение составляет 41.15% от общей вариации. Основными элементами PC1 были характеристики функционирования ФС II (табл. 1). Полученные результаты свидетельствуют о значительном воздействии повышенной температуры на данный С3-вид. Вторая главная компонента (PC2) разделила контроль и вариант еСО2 (рис. 5а). Разделение составило 18.63% от общей вариации. В данном случае основными значимыми параметрами явились содержание ферментов ГДК и ФЕПк (ключевых ферментов фотодыхательного гликолатного цикла и УМК), а также интенсивность транспирации (табл. 1). Первых двух PC компонент достаточно для объяснения 59.78% изменений от общей вариации. На рисунке 5б приведены результаты РСА-анализа данных С4-вида A. retroflexus. У данного вида первой основной компонентой (PC1) разделяются только варианты контроль и совместное действие факторов (еСО2 и еТ). Разделение составляет 30.02% от общей вариации. Основными элементами PC1 были характеристики функционирования ФС II и содержание ФЕПк (табл. 1).
Рис. 5.
Многофакторный анализ методом главных компонент (PCA) биохимических и физиологических параметров, участвующих в процессе адаптации растений Chenopodium quinoa и Amaranthus retroflexus, выращенных при разных концентрациях СО2 и кратковременном действии повышенной температуры (35°С, еТ). (1) Контрольные растения, выращенные при естественной (400 ppm) концентрации СО2 (аСО2); (2) растения, выращенные при аСО2 и 4-дневном воздействии еТ; (3) растения, выращенные при повышенной (800 ppm) концентрации СО2 (еСО2); (4) растения, выращенные при еСО2 и 4-дневном воздействии еТ (еСО2 и еТ).
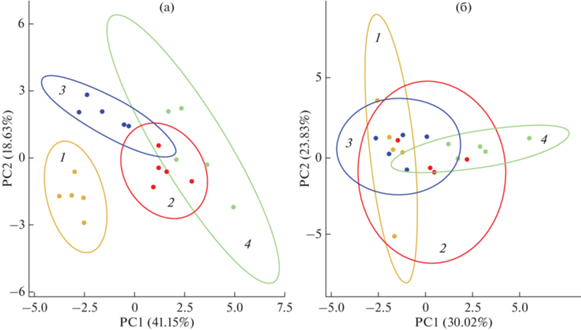
Таблица 1.
Факторные нагрузки биохимических и физиологических параметров на главные компоненты (PC1 и PC2) многофакторного анализа (PCA) растений Chenopodium quinoa и Amaranthus retroflexus, выращенных при естественной (400 ppm) и повышенной (800 ppm) концентрациях СО2 и кратковременном действии повышенной температуры (35°С)
| Параметры | C. quinoa | A. retroflexus | ||
|---|---|---|---|---|
| PC1 | PC2 | PC1 | PC2 | |
| Сухая биомасса | −0.198 | 0.052 | −0.143 | 0.274 |
| Содержание воды | 0.255 | −0.270 | 0.314 | −0.085 |
| Содержание пролина | −0.213 | −0.143 | 0.308 | −0.171 |
| Содержание МДА | 0.245 | 0.139 | 0.069 | 0.152 |
| А | −0.265 | 0.325 | 0.049 | 0.496 |
| Rd | −0.133 | 0.364 | 0.251 | 0.040 |
| E | −0.223 | 0.375 | 0.029 | 0.467 |
| WUE | −0.233 | 0.204 | 0.066 | 0.459 |
| ФС I | −0.178 | 0.116 | 0.071 | −0.147 |
| Fv/Fm | −0.349 | −0.203 | −0.400 | −0.118 |
| ${{F_{{\text{v}}}^{'}} \mathord{\left/ {\vphantom {{F_{{\text{v}}}^{'}} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}$ | −0.335 | −0.236 | −0.325 | −0.187 |
| ФФСII | −0.325 | −0.122 | −0.391 | 0.047 |
| NPQ | −0.296 | −0.054 | −0.219 | 0.108 |
| Содержание РБФК/О | −0.295 | 0.026 | −0.324 | −0.142 |
| Содержание ФЕПк | −0.108 | −0.374 | 0.330 | −0.271 |
| Содержание ГДК | −0.143 | −0.442 | −0.160 | −0.108 |
Примечание. Полужирным шрифтом показаны наиболее значимые параметры. А – интенсивность видимого фотосинтеза; Rd – интенсивность темнового дыхания; Е – интенсивность транспирации; WUE – эффективность использования воды; Fv/Fm – максимальный квантовый выход флуоресценции ФС II; ${{F_{{\text{v}}}^{'}} \mathord{\left/ {\vphantom {{F_{{\text{v}}}^{'}} {F_{{\text{m}}}^{'}}}} \right. \kern-0em} {F_{{\text{m}}}^{'}}}$ – максимальная квантовая эффективность фотохимии ФС II при заданной интенсивности света; ФФСII –эффективный квантовый выход фотохимии ФС II при заданной интенсивности света; NPQ – нефотохимическое тушение.
ОБСУЖДЕНИЕ
В контрольных условиях исследуемые растения C. quinoa (С3) и A. retroflexus (С4) отличались по ряду биохимических и физиологических параметров: у С4-вида, по сравнению с С3-видом, были более высокие значения прироста сухой биомассы, интенсивности видимого фотосинтеза (А) и транспирации (Е), активности ФС I и содержания пролина (рис. 1–3). Эти данные свидетельствуют о более эффективном функционировании фотосинтетического аппарата и УКМ у A. retroflexus, которые обеспечили более значительный прирост биомассы, по сравнению с С3-видом. Низкие значения WUE в контрольных условиях у A. retroflexus можно объяснить видоспецифичностью данного параметра [3]. Более высокие значения активности ФС I у С4-вида свидетельствуют о более интенсивном циклическом транспорте электронов ФС I. Как известно, две дополнительные молекулы АТФ требуются для каждой молекулы CO2, фиксированной в результате действия C4-цикла [33, 34]. Полученные нами данные согласуются с результатами других авторов [3].
Увеличение температуры влияет почти на все биологические процессы в растении, включая морфогенез, текучесть мембранных липидов и их состав, камбиальную активность [4]. Одним из наиболее термочувствительных процессов растений считается фотосинтез. На С3-видах показано, что термолабильными лимитирующими этапами фотосинтеза являются световые реакции (компоненты ФС II) и темновые реакции (на уровне РБФК/О-активазы) [35, 36]. При высокой температуре РБФК/О-активаза может образовывать неактивные агрегаты, что приводит к замедлению активности карбоксилазной функции РБФК/О [8, 18]. Проведенный нами РСА-анализ морфофизиологических и биохимических параметров C. quinoa подтвердил, что для данного С3-вида значимыми параметрами в условиях повышенной температуры были показатели эффективности функционирования ФС II (рис. 5а; табл. 1). РСА-анализ С4-вида A. retroflexus не выявил значимой реакции на температурное воздействие. Однако некоторые параметры при действии еТ достоверно изменялись. Наблюдалось значительное снижение интенсивностей А и Е, которые сопровождались признаками осмотического стресса, о чем свидетельствует значительное увеличение содержания пролина (рис. 1, 2).
Неоднозначность реакции С3-растений на высокий уровень CO2 может быть связана со сложным и комплексным характером воздействия еСО2 на углеводный обмен растений. Так, еCO2, снижая устьичную проводимость, влияет на динамику как углеродного, так и водного обмена растений. С одной стороны, низкие значения устьичной проводимости отрицательно действуют на интенсивность поступления CO2 в растения, что частично компенсируется стимуляцией скорости карбоксилирования РБФК/О высоким содержанием CO2 [9, 37]. С другой стороны, они могут привести к значительной экономии воды в растениях, снижая уровень транспирации, что приводит к увеличению эффективности использования воды [6, 9]. В наших экспериментах у растений C. quinoa не наблюдалось возрастания WUE, вследствие снижения Е при действии еСО2 (рис. 2). Для С3-видов характерно подавление интенсивности фотодыхания высоким уровнем CO2 за счет снижения оксигеназной функции РБФК/О [9]. При удвоении уровня CO2 снижение фотодыхания может составить более ∼50% [6]. В проведенных нами экспериментах снижение содержания ключевого фермента гликолатного фотодыхательного цикла ГДК у растений C. quinoa при действии еСО2 составило 60% (рис. 4г). Проведенный нами РСА-анализ действия еСО2 на параметры C. quinoa подтвердил, что для данного С3-вида значимыми параметрами были содержание фермента ГДК и интенсивность транспирации (рис. 5а, табл. 1). Хотя РСА-анализ С4-вида A. retroflexus не выявил значимой реакции на воздействие еСО2, однако некоторые параметры у этого вида при еСО2 достоверно изменялись. В частности, наблюдалось снижение интенсивностей А и Е, что сопровождалось окислительным стрессом, наличие которого подтверждает 2-кратное увеличение содержания МДА и значительное увеличение диссипационных дыхательных затрат в темновом митохондриальном дыхании (рис. 1г, 2в). Снижение Е у С4-растений при действии еСО2 показано и другими авторами [11, 38]. О влиянии еСО2 на активность, содержание и экспрессию генов РБФК/О у С4-растений информация противоречивая: экспрессия может как снижаться [39], так и увеличиваться [38]. Это объясняется тем, что гены, кодирующие важные фотосинтетические ферменты, необходимые для эффективного функционирования С4-фотосинтеза, роста биомассы и накопления сахарозы, по-разному регулируются в условиях еСО2 и связано это с видоспецифичностью или с разновидностью C4-пути и/или комбинированным воздействием высоких экологических нагрузок, сопровождающих еСО2.
РСА-анализ морфофизиологических и биохимических параметров при совместном действии еСО2 и еТ продемонстрировал их значительные отличия по первой компоненте (РС1) от контрольного варианта у обоих видов (рис. 5). Как у С3-, так и у С4-вида значимыми параметрами были показатели эффективности функционирования ФС II, а у A. retroflexus еще и содержание ФЕПк (рис. 5а, б; табл. 1). При этом у С3-вида решающим фактором была еТ, поскольку подобным образом растения реагировали на данный фактор в отдельности. Воздействие еСО2 и совместное действие еСО2 и еТ одинаково негативно влияли на содержание у C. quinoa фотодыхательного фермента ГДК. Это согласуется с данными других авторов, показавших снижение фотодыхания в результате подавления еСО2 функции оксигенации РБФК/О [6, 9]. Характерной особенностью совместного действия еСО2 и еТ на С3-вид C. quinoa было снижение сухой биомассы, содержания воды в тканях и WUE (рис. 1, 2). Из работ других авторов следует, что C. quinoa проявляет очень разнообразную реакцию по перечисленным параметрам в зависимости от генотипа и фенологической стадии [16]. О наличии окислительного стресса свидетельствует увеличение содержания МДА, а усиление темнового дыхания, вероятно, связано с его диссипационной и защитной функцией от окислительного стресса (рис. 1, 2). У С4-вида при совместном действии еСО2 и еТ возрастание содержания ФЕПк свидетельствует об усилении роли УКМ и, возможно, о рассогласовании функционирования цикла Кальвина и УКМ (рис. 4). Данные изменения фотосинтетических параметров сопровождались значительным возрастанием содержания пролина, связанным в основном с температурным фактором (рис. 1), и возрастанием содержания МДА, свидетельствующим об окислительном стрессе, связанным у данного С4-вида с еСО2 (рис. 1). При совместном действии еСО2 и еТ у обоих видов наблюдалось снижение WUE, и в большей степени у С3-вида.
Итак, С4-вид A. retroflexus, по сравнению с С3-видом C. quinoa, продемонстрировал в контрольных условиях более высокие значения интенсивности фотосинтеза и транспирации, активности ФС I, а также низкое содержание пролина. На действие еТ более сильно реагировал С3-вид, наблюдалось подавление световых реакций (ФС II), цикла Кальвина и фотодыхания. У С4-вида подавлялись интенсивность фотосинтеза и транспирации. Сильное возрастание пролина у A. retroflexus свидетельствует о тепловом стрессе. На действие еСО2 С3-вид реагировал значительным снижением фотодыхания, а у С4-вида признаки окислительного стресса сопровождались подавлением интенсивности фотосинтеза, транспирации и возрастанием темнового дыхания, вероятно, связанного с диссипационной и защитной функцией. Смягчающий эффект еСО2 на термоустойчивость С3- и С4-растений, показанный в ряде работ [2, 20–22], в наших экспериментах у растений C. quinoa и A. retroflexus не был установлен. Действие еТ на С3-вид было главным повреждающим фактором, который при действии еСО2 приводил еще к снижению роста и окислительному стрессу. У С4-вида A. retroflexus совместное действие еСО2 и еТ вызывало дополнительно возрастание содержания ключевого фермента УКМ – ФЕПк. А сочетание температурного стресса, вызванного еТ, и окислительного стресса, вызванного еСО2, приводило к нарушению эффективности ФС II. Таким образом, С3‑растения C. quinoa в стрессовых условиях проявили большую вариабельность фотосинтетического и устьичного аппарата, а также способность к акклимации фотосинтеза к повышенной температуре на уровне световых и темновых реакций, но слабую устойчивость к совместному действию еСО2 и еТ, тогда как C4-растения A. retroflexus продемонстрировали изначально большую адаптированность к теплой среде, за счет наличия узкоспециального УКМ, а также стабильность ростовых параметров, однако у данного вида при совместном действии еСО2 и еТ помимо окислительного стресса наблюдались признаки теплового стресса. Тем не менее, на основании анализа первичной продуктивности изученных растений, можно предположить, что в условиях совместного действия еСО2 и еТ преимущество будут иметь С4-виды.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 23-24-00551).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Ain Q.T., Siddique K., Bawazeer S., Ali I., Mazhar M., Rasool R., Mubeen B., Ullah F., Unar A., Jafar T.H. Adaptive mechanisms in quinoa for coping in stressful environments: an update // PeerJ. 2023. V. 11: e14832. https://doi.org/10.7717/peerj.14832
Shanker A.K., Gunnapaneni D., Bhanu D., Vanaja M., Lakshmi N.J., Yadav S.K., Prabhakar M., Singh V.K. E-levated CO2 and water stress in combination in plants: Brothers in arms or partners in crime? // Biology. 2022. V. 11. P. 1330. https://doi.org/10.3390/biology11091330
Cao Q., Li G., Liu F. Elevated CO2 enhanced water use efficiency of wheat to progressive drought stress but not on maize // Front. Plant Sci. 2022. V. 13. P. 953712. https://doi.org/10.3389/fpls.2022.953712
Dusenge M.E., Duarte A.G., Way D.A. Plant carbon metabolism and climate change: elevated CO2 and temperature impacts on photosynthesis, photorespiration and respiration // New Phytol. 2019. V. 221. P. 32. https://doi.org/10.1111/nph.15283
Yadav S., Elansary H.O., Mattar M.A., Elhindi M.K., Alotaibi A.M., Mishra A. Differential accumulation of metabolites in Suaeda species provides new insights into abiotic stress tolerance in C4-halophytic species in elevated CO2 conditions // Agronomy. 2021. V. 11. P. 131. https://doi.org/10.3390/agronomy11010131
Xu Z., Jiang Y., Zhou G. Response and adaptation of photosynthesis, respiration, and antioxidant systems to elevated CO2 with environmental stress in plants // Front. Plant Sci. 2015. V. 6. P. 701. https://doi.org/10.3389/fpls.2015.00701
Reich P.B., Hobbie S.E., Lee T.D., Pastore M.A. Unexpected reversal of C3 versus C4 grass response to elevated CO2 during a 20-year field experiment // Science. 2018. V. 360. P. 317. https://doi.org/10.1126/science.aas9313
Lara M.V., Andreo C.S. C4 plants adaptation to high levels of CO2 and to drought environments // Abiotic Stress in Plants-Mechanisms and Adaptations. Shanker, A., (Ed.). InTech: Hampshire, UK, 2011. P. 415. https://doi.org/10.5772/24936
Zheng Y., Li F., Hao L., Yu J., Guo L., Zhou H., Ma C., Zhang X., Xu M. Elevated CO2 concentration induces photosynthetic down-regulation with changes in leaf structure, non-structural carbohydrates and nitrogen content of soybean // BMC Plant Biol. 2019. V. 19. P. 255. https://doi.org/10.1186/s12870-019-1788-9
Jothiramshekar S., Benjamin J.J., Krishnasamy R., Pal A., George S., Swaminathan R., Parida A. Responses of selected C3 and C4 halophytes to elevated CO2 concentration under salinity // Curr. Sci. 2018. V. 115. P. 129. https://doi.org/10.18520/cs/v115/i1/129-135
Faria A.P., Marabesi M.A., Gaspar M., França M.G. The increase of current atmospheric CO2 and temperature can benefit leaf gas exchanges, carbohydrate content and growth in C4 grass invaders of the Cerrado biome // Plant Physiol. Biochem. 2018. V. 127. P. 608. https://doi.org/10.1016/j.plaphy.2018.04.042
Wang M., Xie B., Fu Y., Dong C., Hui L., Guanghui L., Liu H. Effects of different elevated CO2 concentrations on chlorophyll contents, gas exchange, water use efficiency, and PSII activity on C3 and C4 cereal crops in a closed artificial ecosystem // Photosynth. Res. 2015. V. 126. P. 351. https://doi.org/10.1007/s11120-015-0134-9
Boretti A., Florentine S. Atmospheric CO2 concentration and other limiting factors in the growth of C3 and C4 plants // Plants. 2019. V. 8. P. 92. https://doi.org/10.3390/plants8040092
Prasch C.M., Sonnewald U. Simultaneous application of heat, drought, and virus to Arabidopsis plants reveals significant shifts in signaling networks // Plant Physiol. 2013. V. 162. P. 1849. https://doi.org/10.1104/pp.113.221044
Yamori W., Hikosaka K., Way D.A. Temperature response of photosynthesis in C3, C4, and CAM plants: temperature acclimation and temperature adaptation // Photosynth Res. 2014. V. 119. P. 101. https://doi.org/10.1007/s11120-013-9874-6
Hinojosa L., González J.A., Barrios-Masias F.H., Fuentes F., Murphy K.M. Quinoa abiotic stress responses: A review // Plants. 2018. V. 7. P. 106. https://doi.org/10.3390/plants7040106
Li G., Chen T., Feng B., Peng S., Tao L., Fu G. Respiration, rather than photosynthesis, determines rice yield loss under moderate high-temperature conditions // Front Plant Sci. 2021. V. 12. P. 678653. https://doi.org/10.3389/fpls.2021.678653
Sage R.F., Kubien D.K. The temperature response of C3 and C4 photosynthesis // Plant, Cell Environ. 2007. V. 30. P. 1086. https://doi.org/10.1111/j.1365-3040.2007.01682.x
Wang D., Heckathorn S.A., Barua D., Joshi P., Hamilton E.W., Lacroix J.J. Effects of elevated CO2 on the tolerance of photosynthesis to acute heat stress in C3, C4, and CAM species // Am. J. Bot. 2008. V. 95. P. 165. https://doi.org/10.3732/ajb.95.2.165
Zinta G., AbdElgawad H., Domagalska M.A., Vergauwen L., Knapen D., Nijs I. Physiological, biochemical, and genome-wide transcriptional analysis reveals that elevated CO2 mitigates the impact of combined heat wave and drought stress in Arabidopsis thaliana at multiple organizational levels // Glob. Chang. Biol. 2014. V. 20. P. 3670. https://doi.org/10.1111/gcb.12626
Zinta G., AbdElgawad H., Peshev D., Weedon J.T., Van den Ende W., Nijs I. Dynamics of metabolic responses to periods of combined heat and drought in Arabidopsis thaliana under ambient and elevated atmospheric CO2 // J. Exp. Bot. 2018. V. 69. P. 2159. https://doi.org/10.1093/jxb/ery055
Zhou R., Yu X., Wen J., Jensen N.B., Dos Santos T.M., Wu Z., Rosenqvist E., Ottosen C.O. Interactive effects of elevated CO2 concentration and combined heat and drought stress on tomato photosynthesis // BMC Plant Biol. 2020. V. 20. P. 260. https://doi.org/10.1186/s12870-020-02457-6
Arrivault S., Alexandre Moraes T., Obata T., Medeiros D.B., Fernie A.R., Boulouis A., Ludwig M., Lunn J.E., Borghi G.L., Schlereth A., Guenther M., Stitt M. Metabolite profiles reveal interspecific variation in operation of the Calvin-Benson cycle in both C4 and C3 plants // J. Exp. Bot. 2019. V. 70. P. 1843. https://doi.org/10.1093/jxb/erz051
Yu J., Li R., Fan N., Yang Z., Huang B. Metabolic pathways involved in carbon dioxide enhanced heat tolerance in bermudagrass // Front. Plant Sci. 2017. V. 8. P. 1506. https://doi.org/10.3389/fpls.2017.01506
Bordignon L., Faria A.P., França M.G.C., Fernandes G.W. Osmotic stress at membrane level and photosystem II activity in two C4 plants after growth in elevated CO2 and temperature // Ann. Appl. Biol. 2019. V. 174. P. 113. https://doi.org/10.1111/aab.12483
Jeong H.M., Kim H.R., Hong S., You Y.H. Effects of elevated CO2 concentration and increased temperature on leaf quality responses of rare and endangered plants // J. Ecol. Environ. 2018. V. 42. https://doi.org/10.1186/s41610-017-0061-0
Kirschbaum M.U.F., McMillan A.M.S. Warming and elevated CO2 have opposing influences on transpiration. Which is more important? // Curr. Forestry Rep. 2018. V. 4. P. 51. https://doi.org/10.1007/s40725-018-0073-8
Wei Z., Abdelhakim L., Fang L., Peng X., Liu J., Liu F. Elevated CO2 effect on the response of stomatal control and water use efficiency in amaranth and maize plants to progressive drought stress // Agric. Water Manage. 2022. V. 266. https://doi.org/10.1016/j.agwat.2022.107609
Schafleitner R., Lin Y.-P., Dinssa F., N’Danikou S., Finkers R., Minja R., Abukutsa-Onyango M., Nyonje W., Lin C.-Y., Wu T.-H., Sigalla J.P., van Zonneveld M., Hsiao Y.-Y., Kumar S., Wu W.-J., et al. The World Vegetable Center Amaranthus germplasm collection: Core collection development and evaluation of agronomic and nutritional traits // Crop Sci. 2022. V. 62. P. 1173. https://doi.org/10.1002/csc2.20715
Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water stress studies // Plant Soil. 1973. V. 39. P. 205. https://doi.org/10.1007/BF00018060
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts // Arch. Biochem. Biophys. 1968, V. 125. P. 180. https://doi.org/10.1016/0003-9861(68)90654-1
Shuyskaya E., Rakhmankulova Z., Prokofieva M., Saidova L., Toderich K., Voronin P. Intensity and duration of salinity required to form adaptive response in C4 halophyte Kochia prostrata (L.) Shrad. // Front. Plant Sci. 2022. V. 13. https://doi.org/10.3389/fpls.2022.955880
Nakamura N., Iwano M., Havaux M., Yokota A., Munekage Y.N. Promotion of cyclic electron transport around photosystem I during the evolution of NADP-malic enzyme-type C4 photosynthesis in the genus Flaveria // New Phytol. 2013. V. 199. P. 832. https://doi.org/10.1111/nph.12296
Yadav S., Mishra A. Ectopic expression of C4 photosynthetic pathway genes improves carbon assimilation and alleviate stress tolerance for future climate change // Physiol. Mol. Biol. Plants. 2020. V. 26. P. 195. https://doi.org/10.1007/s12298-019-00751-8
Crafts-Brandner S.J., Salvucci M.E. Sensitivity of photosynthesis in a C4 plant, maize, to heat stress // Plant Physiol. 2002. V. 129. P. 1773. https://doi.org/10.1104/pp.002170
Heckathorn S.A., Ryan S.L., Baylis J.A., Wang J.A., Hamilton E.W., Cundiff L. In vivo evidence from an Agrostis stolonifera selection genotype that chloroplast small heat-shock proteins can protect photosystem II during heat stress // Funct. Plant Biol. 2002. V. 29. P. 933. https://doi.org/10.1071/PP01191
Singh S.K., Reddy V.R. Methods of mesophyll conductance estimation: its impact on key biochemical parameters and photosynthetic limitations in phosphorus stressed soybean across CO2 // Physiol. Plant. 2016. V. 157. P. 234. https://doi.org/10.1111/ppl.12415
Souza A.P., Gaspar M., Silva E.A., Ulian E.C., Waclawovsky A.J., Nishiyama M.Y. Jr., Santos R.V. Teixeira M.M., Souza G.M., Buckeridge M.S. Elevated CO2 increases photosynthesis, biomass and productivity, and modifies gene expression in sugarcane // Plant Cell Environ. 2008. V. 31. P. 1116. https://doi.org/10.1111/j.1365-3040.2008.01822.x
Huang Y., Fang R., Li Y., Liu X., Wang G., Yin K., Jin J., Herbert S.J. Warming and elevated CO2 alter the transcriptomic response of maize (Zea mays L.) at the silking stage // Sci. Rep. 2019. V. 9. P. 17948. https://doi.org/10.1038/s41598-019-54325-5
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


