Генетика, 2019, T. 55, № 1, стр. 70-80
Анализ изменчивости микросателлитных локусов в популяциях азиатской зубастой корюшки Osmerus dentex Восточной и Западной Камчатки
А. В. Семенова 1, *, А. Н. Строганов 1, А. В. Бугаев 2, Г. А. Рубцова 3, А. М. Малютина 1
1 Московский государственный университет им. М.В. Ломоносова, кафедра ихтиологии
119234 Москва, Россия
2 Камчатский научно-исследовательский институт рыбного хозяйства и океанографии
683000 Петропавловск-Камчатский, Россия
3 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
* E-mail: anna.semenova@mail.bio.msu.ru
Поступила в редакцию 17.01.2018
После доработки 26.03.2018
Принята к публикации 14.03.2018
Аннотация
Исследовано генетическое разнообразие азиатской зубастой корюшки по 10 микросателлитным локусам. Средние оценки ожидаемой гетерозиготности по разным локусам варьировали от 12.6 до 85.3%, в среднем 55.3%. Степень генетической дифференциации корюшки достоверно значима, θ = 2.8%, 95% СI (1.4–4.9). Наибольшие различия показаны между выборками корюшки Восточной и Западной Камчатки, максимальные оценки дивергенции от остальных выборок как западного, так и восточного побережий демонстрируют выборки озера Нерпичье.
Азиатская зубастая корюшка Osmerus dentex [1, 2] является одним из наиболее массовых видов рыб семейства Osmeridae. Азиатская корюшка широко распространена в северо-западной части Тихого океана и арктических морях, большая часть ее промысловых запасов сосредоточена в водах Камчатского края. Osmerus dentex анадромный вид, нагуливается в морских прибрежных акваториях западного (Охотское море) и восточного (Берингово море) побережий Камчатки, а на нерест заходит в большинство рек полуострова [3, 4].
Многие отечественные исследователи корюшку азиатского и американского побережий Тихого океана рассматривают в качестве подвидов Osmerus mordax dentex Steindachner et Kner, 1870 и Osmerus mordax mordax Mitchill, 1814 [5, 6]. В предлагаемой работе на основании молекулярно-генетических данных и современного представления о таксономии рода Osmerus мы рассматриваем азиатскую корюшку в ранге самостоятельного вида Osmerus dentex [1, 2, 7].
Исследования популяционной структуры и биологии корюшек Камчатки немногочисленны и охватывают далеко не весь ареал [4, 8–11]. Однако полученная информация свидетельствует о пространственной и временной неоднородности популяционной структуры этого вида на Камчатке.
По данным промысловой статистики и некоторым биологическим показателям на западном побережье Камчатки выделяют две географически разобщенные популяционные группировки азиатской корюшки: “северную” – представители которой имеют главный центр воспроизводства в реках северо-запада Камчатки (Ковран, Хайрюзова, Белоголовая, Морошечная), и “южную” – основным центром воспроизводства этой группировки является р. Большая, большинство нерестилищ корюшки сосредоточены от приустьевого участка р. Коль до р. Голыгина в северо-западной части Камчатского полуострова [11]. Предполагают репродуктивную изоляцию и отсутствие миграционных потоков между ними. На северо-востоке Камчатки, в Карагинской промысловой подзоне, также возможно наличие “северной” и “южной” репродуктивно изолированных популяционных группировок. “Северная” воспроизводится в бассейне залива Корфа, “южная” в реках южной части Карагинского залива [11]. На основе анализа морфологических показателей исследователи выделяют группировки (субпопуляционный уровень дифференциации) камчатского восточного побережья из р. Камчатка, оз. Калыгирь и Авачинской губы [8].
Существует предположение, что в водоемах Камчатки корюшка образует две экологические группировки: представители первой, морской, проводят зиму на шельфе, в отдалении от берега; представители второй, лиманной или прибрежной, в зимнее время находятся в солоноватых озерах, лиманах, заливах в непосредственной близости от берега. Корюшки морской группировки наиболее многочисленны на западно-камчатском шельфе и в Карагинском заливе; рыбы прибрежной группировки – в крупных солоновато-водных озерах, лиманах больших рек и в глубоко вдающихся в берег закрытых бухтах и заливах (оз. Нерпичье, оз. Калыгирь, эстуарий р. Большая) [4, 8]. Однако такое разделение на экологические группировки весьма условно, поскольку распределение корюшки в шельфовой зоне в зимний период в значительной мере обусловлено локализацией кормовых ресурсов.
Исследований популяционно-генетической структуры и репродуктивных взаимоотношений между различными экологическими и географическими группировками корюшек Камчатки практически не проводилось. Имеется информация только об изменчивости митохондриальной ДНК у небольшого числа географически удаленных популяций, при этом выявлен очень низкий уровень внутривидовой структурированности [12, 13]. Маркеры мтДНК в связи с наследованием только по материнской линии и отсутствием рекомбинации прекрасно подходят для филогенетических реконструкций. Эти свойства, однако, приводят к тому, что весь митохондриальный геном действует как один локус, и делают маркеры мтДНК малоинформативными для исследований внутривидовой структурированности и потока генов между популяциями. Для получения корректных представлений о популяционно-генетической структуре видов традиционно используют аллозимы, маркеры ядерной ДНК, такие как микросателлиты, SNP [14].
Цель данной работы – исследование генетической изменчивости и дифференциации азиатской зубастой корюшки западного и восточного побережий Камчатки с использованием микросателлитных локусов ядерной ДНК. В задачи работы входило подбор локусов, оценка их разрешающей способности для популяционно-генетических исследований корюшки, сравнение оценки генетического разнообразия и дифференциации группировок корюшки в прибрежных водах Камчатки.
МАТЕРИАЛЫ И МЕТОДЫ
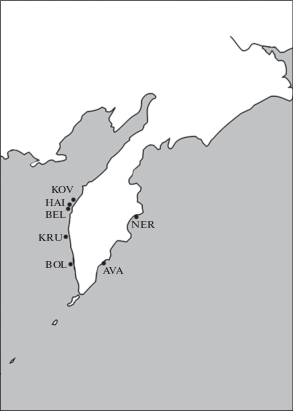
Исследованный материал. Материал для анализа генетической изменчивости (n = 377) был собран у берегов Западной и Восточной Камчатки в период 2011–2016 гг. Обозначения выборок и их географическая локализация представлены в табл. 1 и на рис. 1. В соответствии с дифференциацией на экологические формы, предложенной в работе П.М. Васильца [4], мы можем отнести наши выборки из оз. Нерпичье и р. Большой (собраны зимой в приустьевых зонах речных бассейнов) к прибрежной (лиманной) экологической группировке, остальные выборки условно принадлежат к морской экологической группировке.
Таблица 1.
Характеристика исследованного материала
| Локальность | Географическое положение | Дата сбора | Объем выборки, экз. | Обозначение выборки |
|---|---|---|---|---|
| р. Ковран | Северо-западное побережье Камчатки, Охотское море | 06.2014 | 50 | KOV |
| р. Хайрюзова | То же | 05.2014 | 50 | HAI |
| р. Белоголовая | » | 07.2014 | 50 | BEL |
| р. Крутогорова | Западное побережье Камчатки, Охотское море | 03.2011 | 40 | KRU |
| р. Большая | Юго-западное побережье Камчатки, Охотское море | 01.2014 | 50 | BOL |
| р. Авача | Юго-восточное побережье Камчатки, Тихий океан | 01.2014 | 32 | AVA |
| оз. Нерпичье | Восточное побережье Камчатки, Берингово море | 02.2014 | 50 | NER14 |
| 12.2016 | 55 | NER16 |
Рис. 1.
Карта мест сбора выборок азиатской зубастой корюшки. Обозначение выборок соответствует таковому в табл. 1.
Методика микросателлитного анализа. Для исследований использовали 10 микросателлитных локусов, разработанных для анализа тихоокеанской корюшки или родственных видов [15–17]. Характеристики локусов приведены в табл. 2.
Таблица 2.
Характеристика исследованных микросателлитных локусов
| Локус | Повторяющаяся последовательность | Температура отжига, °С | Интервал размеров фрагментов, пн | Источник информации о последовательности праймеров |
|---|---|---|---|---|
| MGPL-Omo1 | (GACA)n | 54 | 106–150 | [15] |
| MGPL-Omo2 | (GTCT)n | 54 | 139–175 | [15] |
| MGPL-Omo3* | (CTGC)nCTGTTT(GTCT)n | 53 | 150–166 | [15] |
| MGPL-Omo4* | (CAGA)n | 53 | 85–109 | [15] |
| MGPL-Omo5* | (CTGT)nCCGT(CTGT)n | 52 | 118–166 | [15] |
| MGPL-Omo9* | (GACA)nCAGACA(GGCA)n | 55 | 108–144 | [15] |
| MGPL-Omo15* | (GTCT)n(GT)nCT(GT)n | 54 | 117–125 | [15] |
| MGPL-Omo16* | (CCTG)nNn(TCTG)n | 54 | 124–140 | [15] |
| HtrG107 | (CAGA)n | 54 | 94–110 | [16] |
| Tpa119 | (GACA)n | 54 | 136–140 | [17] |
Используемая нами методика генотипирования микросателлитных локусов требует небольших размеров амплифицируемых фрагментов ДНК (не превышающих 250 пн), поэтому для шести локусов с большими размерами аллелей были сконструированы новые праймеры, позволившие уменьшить размеры ПЦР-продукта (в табл. 2 эти локусы помечены звездочками):
| MGPL-Omo3 | F: CTGTTACTGGATTTGCCATGTT |
| R: CCTAAACTTCTATGCTGTCCCT; | |
| MGPL-Omo4 | F: GGGCATTAATAGACAGTCAGAG |
| R: TAACTGCCTGTCTCCCTTAC; | |
| MGPL-Omo5 | F: GAGATTCATTATGATAGAGGCCTAACT |
| R: CTGCCGACTTGCAACTTTATTC; | |
| MGPL-Omo9 | F: CGAGGCAAGCAGTGTGA |
| R: GCCTGTCTCTCTTTCTGTATGT; | |
| MGPL-Omo15 | F: CACGTCTGTCTGTCTGTCTTTC |
| R: AGCTGGGTATACAGAGGAAGAA; | |
| MGPL-Omo16 | F: GCTACAATCGGTCCATCTG |
| R: CCTAAGCTTCTATGCTGTCTC. |
Последовательности новых праймеров были получены с использованием онлайн-ресурса Primer-BLAST [18].
Полимеразную цепную реакцию (ПЦР) проводили в амплификаторе MJ Research PTC 100 с использованием 10 мкл готовых лиофилизированных смесей для ПЦР GenePak PCR Core фирмы “ИзоГен” (Россия), с добавлением 5 мкл смеси праймеров (конечная концентрация 0.5 мкМ) и 5 мкл геномной ДНК (100 нг). Амплификацию проводили при следующем режиме: денатурация в течение 2 мин при 94°С, затем восемь циклов, включающих 1 мин денатурации ДНК-матрицы при температуре 94°С, 30 с отжига праймеров при X°С (табл. 2) и синтез новых цепей в течение 30 с при 72°С; затем следовал 21 цикл, включающий 30 с при 94°С, 30 с при Х°С и 15 с при 72°С; элонгация 3 мин при 72°С. Продукты амплификации фракционировали с помощью электрофореза в 6%-ном неденатурирующем полиакриламидном геле в 0.5× TBE буфере при напряжении 300 В в течение 2–5 ч. Полученные электрофореграммы окрашивали бромистым этидием и фотографировали в ультрафиолетовом свете. В качестве маркеров длин фрагментов использовали ДНК плазмиды pBR322, обработанные рестриктазой HpaII. Размеры аллелей по каждому локусу определяли с использованием программы 1D Image Analysis Software Version 3.5 фирмы “Кодак”.
Статистический анализ. С помощью программы Micro-Checker 2.2.3 данные по всем локусам были исследованы на возможные ошибки генотипирования, а также присутствие нуль-аллелей [19]. В случае обнаружения нуль-аллелей мы использовали программу FreENA [20] для оценки частот возможных нуль-аллелей и вычисления значений FST с поправкой на их присутствие.
Статистическая сила микросателлитных локусов для выявления различных уровней дивергенции (FST = 0.001, 0.0025, 0.005, 0.01 и 0.05) была исследована с использованием симуляционного метода Римана и Пальма в программе POWSIM 4.1 [21, 22]. Этот анализ позволяет оценить эффективность используемой панели локусов для оценки дифференциации группировок при том объеме выборок, которые имеются у исследователей. Подробно особенности и параметры применения данного метода описаны в [23].
Программа GDA [24] была использована для оценки частот аллелей, аллельного разнообразия (А), ожидаемой и наблюдаемой гетерозиготности (HE, HO), cтепени дифференциации популяций θ. Отклонения от равновесия Харди–Вайнберга были тестированы с использованием коэффициента инбридинга FIS в программе GENEPOP 4.2 [25], достоверность была оценена с использованием точных тестов Фишера. Оценки аллельного разнообразия (AR), скорректированные по минимальному размеру выборки, были получены в программе FSTAT 2.9.3 [26]. Программа GENEPOP была использована для оценки попарной дифференциации популяций на основании коэффициентов FST. Значимость корреляции генетических FST/(1–FST) и географических (по кратчайшему водному пути, км) дистанций между группировками проверяли с помощью Мантель-теста [27] в программе GENEPOP с использованием 1000 пермутаций.
Построение UPGMA дендрограмм на основании генетических дистанций Нея проводили в программе GDA.
Для определения возможного прохождения популяций корюшки через “горлышко бутылки”, т.е. сильного снижения эффективной численности в относительно недавнем прошлом, использовалась программа BOTTLENECK 1.2.02 [28]. Была тестирована гипотеза об избытке гетерозигот, поскольку в процессе уменьшения размера популяции потеря числа аллелей происходит быстрее, чем уменьшение гетерозиготности. Согласно количеству используемых локусов и рекомендациям авторов программы для проверки статистической значимости гипотезы был выбран тест Уилкоксона [28, 29]. Для каждой выборки использовали только локусы в равновесии Харди–Вайнберга.
РЕЗУЛЬТАТЫ
Проверка качества данных, равновесие Харди–Вайнберга
Программа Micro-Checker не обнаружила возможных ошибок генотипирования ни в одном из изученных локусов. В четырех выборках показана возможность присутствия нуль-аллелей в локусе MGPL-Omo9 (BEL, KRU, BOL, NER14), в трех в локусе Tpa119 (KRU, NER14, NER16). После проверки влияния возможных нуль-аллелей на оценки генетической дифференциации оказалось, что с их учетом показатели FST изменяются не более чем на 1%. Тем не менее оценки дифференциации FST были скорректированы.
Анализ статистической силы в программе POWSIM показал высокую разрешающую способность исследованных локусов. Так, при используемых в исследовании объемах выборок и панели локусов дивергенция FST = 0.0025 будет выявлена более чем в 85% случаев (85.8% для точного теста Фишера и 89.8% для χ2-теста). Дивергенция FST = 0.005 и более будет выявлена в 100% случаев (табл. 3).
Таблица 3.
Результаты симуляции в программе POWSIM для различных значений ожидаемой FST
| FST | χ2-тест | Тест Фишера | NE | Число поколений (t) | Число итераций |
|---|---|---|---|---|---|
| 0.001 | 0.354 | 0.329 | 2000 | 4 | 1000 |
| 0.0025 | 0.898 | 0.858 | 2000 | 10 | 1000 |
| 0.005 | 1.000 | 1.000 | 2000 | 20 | 1000 |
| 0.01 | 1.000 | 1.000 | 2000 | 40 | 1000 |
| 0.05 | 1.000 | 1.000 | 2000 | 200 | 1000 |
Из 80 локус-специфических тестов на соответствие наблюдаемых генотипических распределений теоретическому распределению Харди–Вайнберга в семи показан достоверный дефицит гетерозигот после применения коррекции уровня значимости Бонферрони (табл. 4). Четыре из них по локусам MGPL-Omo9 и Tpa119 можно объяснить присутствием нуль-аллелей. Помимо этого, в выборке из р. Белоголовой (BEL) показаны отклонения по локусам MGPL-Omo4, MGPL-Omo5 и MGPL-Omo16. Если не проводить коррекцию уровня значимости для множественных тестов, то недостаток гетерозигот в этой выборке выявляется еще по двум локусам: MGPL-Omo3 и MGPL-Omo9. Можно предполагать, что это проявление эффекта Валунда и, возможно, смешение в данной выборке рыб, по меньшей мере, из двух отдельных нерестовых популяций.
Таблица 4.
Генетическая изменчивость азиатской корюшки по микросателлитным локусам
| Локус | Пока-затели | Выборки | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| KOV | HAI | BEL | KRU | BOL | AVA | NER14 | NER16 | Среднее | ||
| MGPL-Omo1 | n | 46 | 47 | 47 | 40 | 50 | 16 | 50 | 54 | 43.7 |
| A/Ar | 11/7.9 | 11/7.7 | 9/7.9 | 10/8.4 | 11/7.5 | 6/5.5 | 10/6.7 | 10/6.2 | 9.62/7.6 | |
| HE | 0.869 | 0.847 | 0.865 | 0.889 | 0.858 | 0.780 | 0.814 | 0.787 | 0.839 | |
| HO | 0.804 | 0.936 | 0.893 | 0.875 | 0.820 | 0.812 | 0.940 | 0.814 | 0.862 | |
| MGPL-Omo2 | n | 49 | 48 | 49 | 39 | 50 | 12 | 50 | 51 | 43.5 |
| A/Ar | 8/3.8 | 7/4.1 | 6/3.9 | 8/4.9 | 7/3.8 | 2/1.8 | 6/3.7 | 7/3.7 | 6.37/3.9 | |
| HE | 0.425 | 0.476 | 0.498 | 0.603 | 0.381 | 0.083 | 0.543 | 0.426 | 0.429 | |
| HO | 0.387 | 0.541 | 0.530 | 0.564 | 0.400 | 0.083 | 0.460 | 0.412 | 0.422 | |
| MGPL-Omo3 | n | 49 | 47 | 49 | 40 | 50 | 10 | 50 | 55 | 43.7 |
| A/Ar | 5/3.8 | 6/4.1 | 5/3.7 | 6/4.0 | 6/4.4 | 4/4.0 | 6/4.3 | 6/4.3 | 5.5/4.4 | |
| HE | 0.590 | 0.598 | 0.522 | 0.621 | 0.560 | 0.700 | 0.535 | 0.521 | 0.581 | |
| HO | 0.612 | 0.595 | 0.408 | 0.575 | 0.560 | 0.700 | 0.560 | 0.581 | 0.574 | |
| MGPL-Omo4 | n | 49 | 47 | 47 | 40 | 50 | 18 | 50 | 55 | 4.5 |
| A/Ar | 7/4.6 | 6/4.8 | 6/4.4 | 5/4.0 | 8/5.0 | 6/5.8 | 7/4.9 | 6/4.2 | 6.37/4.9 | |
| HE | 0.683 | 0.704 | 0.649 | 0.633 | 0.685 | 0.796 | 0.614 | 0.444 | 0.651 | |
| HO | 0.714 | 0.723 | 0.638 | 0.575 | 0.680 | 0.722 | 0.600 | 0.436 | 0.636 | |
| MGPL-Omo5 | n | 48 | 47 | 47 | 38 | 50 | 13 | 50 | 55 | 43.5 |
| A/Ar | 13/8.1 | 14/9.2 | 14/9.1 | 12/8.9 | 12/8.8 | 7/6.2 | 11/7.4 | 10/7.5 | 11.6/8.6 | |
| HE | 0.854 | 0.880 | 0.890 | 0.891 | 0.865 | 0.753 | 0.838 | 0.851 | 0.853 | |
| HO | 0.833 | 0.893 | 0.872 | 0.947 | 0.900 | 0.923 | 0.840 | 0.890 | 0.887 | |
| MGPL-Omo9 | n | 48 | 48 | 47 | 40 | 50 | 14 | 50 | 55 | 44.0 |
| A/Ar | 7/4.6 | 5/3.9 | 6/4.4 | 6/5.2 | 6/3.8 | 5/4.6 | 8/5.3 | 6/4.3 | 6.12/4.7 | |
| HE | 0.564 | 0.545 | 0.606 | 0.678 | 0.525 | 0.568 | 0.747 | 0.601 | 0.604 | |
| HO | 0.500 | 0.500 | 0.446 | 0.475 | 0.280 | 0.571 | 0.440 | 0.527 | 0.467 | |
| MGPL-Omo15 | n | 49 | 48 | 49 | 40 | 50 | 17 | 50 | 55 | 44.7 |
| A/Ar | 4/2.9 | 4/2.7 | 4/3.4 | 4/2.5 | 4/3.0 | 4/3.5 | 4/3.3 | 4/3.2 | 4/3.1 | |
| HE | 0.555 | 0.523 | 0.564 | 0.447 | 0.555 | 0.506 | 0.389 | 0.452 | 0.503 | |
| HO | 0.551 | 0.645 | 0.591 | 0.500 | 0.600 | 0.470 | 0.420 | 0.381 | 0.520 | |
| MGPL-Omo16 | n | 49 | 48 | 49 | 40 | 50 | 18 | 50 | 55 | 44.9 |
| A/Ar | 5/3.9 | 6/4.2 | 5/3.7 | 6/4.0 | 6/4.3 | 5/3.9 | 6/4.3 | 6/4.2 | 5.62/4.4 | |
| HE | 0.604 | 0.593 | 0.519 | 0.633 | 0.565 | 0.560 | 0.535 | 0.509 | 0.565 | |
| HO | 0.591 | 0.583 | 0.387 | 0.600 | 0.560 | 0.444 | 0.560 | 0.563 | 0.536 | |
| Tpa119 | n | 49 | 48 | 49 | 39 | 50 | 32 | 48 | 55 | 46.2 |
| A/Ar | 3/2.5 | 3/2.4 | 3/2.8 | 3/2.8 | 3/2.3 | 2/2.0 | 4/2.4 | 3/2.6 | 3.0/2.6 | |
| HE | 0.284 | 0.328 | 0.421 | 0.368 | 0.248 | 0.436 | 0.419 | 0.506 | 0.376 | |
| HO | 0.285 | 0.312 | 0.367 | 0.230 | 0.200 | 0.312 | 0.250 | 0.345 | 0.288 | |
| HtrG107 | n | 49 | 48 | 49. | 40 | 50 | 32 | 50 | 55 | 46.6 |
| A/Ar | 2/1.8 | 3/2.1 | 2/1.9 | 3/2.1 | 2/1.9 | 1/1.0 | 1/1.0 | 4/1.5 | 2.25/1.8 | |
| HE | 0.151 | 0.207 | 0.201 | 0.184 | 0.213 | 0.000 | 0.000 | 0.054 | 0.126 | |
| HO | 0.163 | 0.229 | 0.224 | 0.200 | 0.240 | 0.000 | 0.000 | 0.054 | 0.138 | |
| Среднее | n | 48.5 | 47.6 | 48.2 | 39.6 | 50 | 18.2 | 49.8 | 54.5 | 44.5 |
| A/Ar | 6.5/4.4 | 6.5/4.5 | 6.0/4.5 | 6.3/4.7 | 6.5/4..5 | 4.1/3.8 | 6.3/4.3 | 6.2/4.2 | 6.05/4.6 | |
| HE | 0.558 | 0.570 | 0.573 | 0.598 | 0.546 | 0.518 | 0.544 | 0.515 | 0.553 | |
| Ho | 0.544 | 0.596 | 0.536 | 0.554 | 0.524 | 0.504 | 0.507 | 0.500 | 0.533 | |
Генетическое разнообразие азиатской корюшки по микросателлитным локусам
Все локусы были полиморфны в исследованных выборках (за исключением локуса HtrG107, мономорфного в выборках AVA и NER16). Число аллелей в каждом локусе варьировало от 1 (HtrG107) до 14 (MGPL-Omo5) (табл. 4), оценки ожидаемой гетерозиготности (HE) изменялись в выборках от 0.054 до 0.891. Максимальные значения HE, как и наибольшее число аллелей показаны в локусе MGPL-Omo5. Средние оценки гетерозиготности и аллельного разнообразия (HE и AR) во всех изученных выборках варьировали от 0.515 до 0.598, и от 3.8 до 4.7 соответственно. Оценки средней HE у корюшки восточного побережья несколько меньше, чем западного: HE = 0.515–0.544 и HE = 0.546–0.598 соответственно. То же можно сказать про оценки аллельного разнообразия: AR = 3.8–4.3 у корюшки Восточной Камчатки и AR = 4.4–4.7 у Западной. Однако разница в аллельном разнообразии, возможно, связана с небольшим объемом выборки из р. Авача, на который были скорректированы показатели AR. При сравнении остальных выборок примерно одинакового объема (50 экз.) среднее число аллелей (А) изменяется в пределах 6.0–6.5 у корюшек западного побережья и 6.2–6.3 в выборках восточного побережья. Основные показатели генетической изменчивости азиатской корюшки приведены в табл. 4.
Тестирование в программе BOTTLENECK не выявило прохождения корюшками этапа “горлышка бутылки” в недавнем прошлом (0.921 < P < 1.000).
Генетическая дифференциация корюшки исследуемого ареала
Оценка генетической дифференциации всей совокупности выборок по 10 локусам была достоверна θ = 0.028 с 95%-ным бутстреп-интервалом (от 0.014 до 0.049). Наибольшие оценки дифференциации получены по локусам Tpa119 (θ = 0.036) и MGPL-Omo15 (θ = 0.033), наименьшие – по локусам MGPL-Omo1 (θ = 0.007) и MGPL-Omo2, MGPL-Omo5, MGPL-Omo9 (θ = 0.013). Оценки дифференциации достоверны по каждому из локусов (Р < 0.001), кроме MGPL-Omo2 (Р = 0.16).
Достоверная дифференциация между выборками была обнаружена и при попарном сравнении (табл. 5). Наибольшие различия показаны между выборками Восточной и Западной Камчатки (FST = 0.021–0.070), максимальные оценки дивергенции от остальных выборок как западного, так и восточного побережий демонстрируют выборки оз. Нерпичье. В пределах восточного побережья выборка р. Авача с высокой степенью достоверности отличается от выборок оз. Нерпичье (FST = 0.029–0.041). Среди корюшек западного побережья значения попарных FST варьируют от 0.00 до 0.0139. Достоверные различия показаны между выборкой из р. Белоголовой и выборками рек Крутогорова, Большая и Хайрюзова, а также между р. Крутогорова и р. Хайрюзова.
Таблица 5.
Оценки попарной генетической дифференциации FST азиатской корюшки Западной и Восточной Камчатки
| KOV | HAI | BEL | KRU | BOL | AVA | NER14 | |
|---|---|---|---|---|---|---|---|
| KOV | – | ||||||
| HAI | 0.0001 | – | |||||
| BEL | 0.0069 | 0.0087 | – | ||||
| KRU | 0.0033 | 0.0054 | 0.0118 | – | |||
| BOL | 0.0000 | 0.0000 | 0.0139 | 0.0093 | – | ||
| AVA | 0.0218 | 0.0243 | 0.0239 | 0.0318 | 0.0262 | – | |
| NER14 | 0.0474 | 0.0450 | 0.0259 | 0.0427 | 0.0548 | 0.0293 | – |
| NER16 | 0.0564 | 0.0529 | 0.0276 | 0.0620 | 0.0701 | 0.0411 | 0.0077 |
Общая генетическая дифференциация выборок корюшки Восточной Камчатки более чем в 2 раза выше, чем Западной: θ = 0.019 (от 0.007 до 0.034) и θ = 0.0058 (от 0.001 до 0.011) соответственно. При исключении из анализа выборки р. Белоголовой, больше всего отличающейся от других выборок западного побережья и, возможно, представленной несколькими популяциями, оценка дифференциации остальных выборок корюшек Западной Камчатки оказывается недостоверной: θ = 0.0023 (от –0.0004 до 0.0049).
Анализ на наличие изоляции расстоянием показал, что корреляция между географическими расстояниями и генетической дифференциацией корюшек достоверна для всей совокупности выборок (Мантель-тест, Р = 0.008). При этом изоляция расстоянием не выявляется при отдельном анализе выборок из водоемов Западной Камчатки (Р = 0.84). Возможно, последнее связано с тем, что “западная” группа включает генетически довольно обособленную от всех выборку смешанного происхождения из р. Белоголовой. Однако при исключении выборки р. Белоголовой тест Мантеля для выборок Западной Камчатки также был недостоверным. Для выборок восточного побережья такой анализ не проводился в связи с недостаточностью материала.
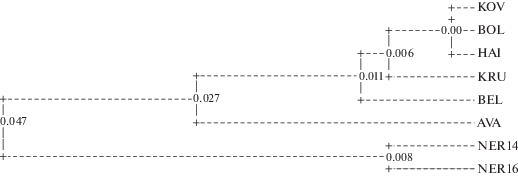
UPGMA-дендрограмма, построенная на основании генетических дистанций Нея, прежде всего отражает региональные генетические различия между корюшкой западного и восточного побережий Камчатки (рис. 2). Кластеризация выборок западного побережья не соответствует их географической локализации. Так, в один кластер вместе с выборками из рек Ковран и Хайрюзова северо-западной части Камчатского побережья Охотского моря попала выборка из р. Большой (юго-западная его часть). Очевидно, что иные факторы, кроме географической изоляции, способствуют формированию наблюдаемой генетической дифференциации корюшки на западном побережье Камчатки.
ОБСУЖДЕНИЕ
Генетическое разнообразие азиатской корюшки из водоемов Камчатки (средние оценки гетерозиготности в выборках: HE = 0.515–0.598, среднее число аллелей: А = 6.0–6.5) оказалось несколько меньше, чем у родственного вида Osmerus mordax из водоемов Канады и США: HE = 0.58–0.87, A = 6.29–11.3 [30–32]. Меньшие оценки генетического разнообразия корюшки Камчатки нельзя объяснить историческими процессами редукции численности популяций, поскольку анализ в программе BOTTLENECK не подтвердил вероятность этих событий. Вероятнее всего, различия оценок генетического разнообразия связаны с неодинаковым набором микросателлитных локусов, используемых нами и исследователями Osmerus mordax. Если сравнивать только совпадающие локусы, то средние оценки генетического разнообразия корюшек Камчатки составляют HE = 0.651 и A = 7.2 и находятся в пределах изменчивости генетического разнообразия корюшек Северной Америки.
В водах Камчатки корюшка восточного побережья (AVA, NER14, NER16) характеризуется меньшими показателями генетической изменчивости, чем корюшка Западной Камчатки. В случае выборки р. Авача (AVA) это может быть связано с небольшим количеством экземпляров, для которых удалось получить информацию о полиморфизме микросателлитных локусов. Что касается корюшки из оз. Нерпичье, то в выборках как 2014 г., так и 2016 г. выявлены меньшие показатели гетерозиготности по сравнению с корюшкой Западной Камчатки. Меньшее генетическое разнообразие в выборках корюшки из оз. Нерпичье, вероятнее всего, можно связать с меньшей численностью популяции в этом озере по сравнению с численностью популяции Западной Камчатки [4, 11].
Общие оценки генетической дифференциации корюшки в акваториях Камчатки составили θ = 0.028. Эти оценки превышают географическую дифференциацию анадромной формы Osmerus mordax прибрежных вод Северной Америки и Канады: θ = 0.017 [33, 34]. В то же время у корюшки Osmerus mordax на отдельных участках ареала (о-в Ньюфаунленд, п-ов Лабрадор) известны группировки со значительно меньшим генным обменом FST = 0.047–0.11 [33, 35, 36]. Известно, что при формировании и поддержании генетической дивергенции популяций структурные и функциональные особенности местообитания могут играть значительную роль [37].
Полученные результаты свидетельствуют о выраженной генетической дивергенции корюшки Восточной Камчатки из оз. Нерпичье и р. Авача от остальных выборок Западной Камчатки (FST = = 0.0218–0.071). Причиной этого, вероятно, являются ограничения миграционных генных потоков между корюшками разных побережий, связанные со значительными географическими расстояниями между ними. Выборка из р. Авача занимает равноудаленное географическое положение между Западной Камчаткой и оз. Нерпичье, при этом отличается от выборок Западной Камчатки и от выборок оз. Нерпичье примерно одинаково: FST = = 0.0218–0.0318 и FST = 0.0293, 0.0411 соответственно.
Формированию подразделенной генетической структуры среди корюшек Восточной Камчатки, очевидно, способствуют особенности образа жизни этих рыб в данном районе, и в частности, в оз. Нерпичье. По данным исследователей, не все особи из популяции корюшек покидают для нагула водоем, при этом нагульные стада рассредоточиваются в прибрежной зоне без значительного удаления от мест воспроизводства [4].
Среди группировок Западной Камчатки генетическая дифференциация гораздо ниже, чем на восточном побережье, что свидетельствует о значительном уровне потока генов между популяциями корюшки Западной Камчатки. Предположение о самостоятельности группировок корюшки на севере и на юге Западной Камчатки, основанное на различиях некоторых морфометрических признаков, а также на свойстве данного вида не совершать продолжительных морских миграций [4], не подтверждается нашими данными. Напротив, оценки дифференциации выборки из р. Большой, находящейся на юго-западе Камчатки, и выборок из северной части западного побережья (реки Ковран, Хайрюзова, Белоголовая) оказываются в ряде случаев меньше, чем дифференциация среди выборок северо-западного побережья.
Не показано генетических различий между выборками корюшки, принадлежащими предположительно к разным экологическим группировкам – морским и лиманным. Так, корюшка р. Большой, которую по предложенной классификации можно отнести к лиманной экологической форме, не отличается ни от одной выборки морских корюшек западного побережья, кроме выборки р. Белоголовой.
Следует отметить, что результаты, представленные в этой работе, являются предварительными. Вопрос популяционной организации данного вида очень сложен. Для определения пространственных и темпоральных аспектов популяционно-генетической структурированности корюшки необходим анализ более обширного геногеографического материала.
Таким образом, показана генетическая гетерогенность корюшки Западной и Восточной Камчатки по микросателлитным локусам. Среди корюшки восточного побережья из р. Авача и оз. Нерпичье генетическая дифференциация выше, чем между группировками корюшки Западной Камчатки из рек Ковран, Хайрюзова, Белоголовая, Крутогорова и Большая.
Авторы благодарят сотрудников лаборатории пресноводных биоресурсов и аквакультуры ФГБНУ “КамчатНИРО” Ю.Н. Амельченко, С.В. Липнягова, С.В.Коптева, О.В. Фролова, принявших участие в сборе материала.
Закупка реактивов для проведения исследований осуществлялась при поддержке Российского научного фонда (грант “Научные основы создания национального банка-депозитария живых систем” № 14-50-00029). Лабораторный анализ образцов выполнен при частичной финансовой поддержке гранта РФФИ № 18-016-00033. и Гос. задания AAAA-A18-118012490139-7 (Программа Президиума РАН № 41 “Биоразнообразие природных систем и биологические ресурсы России”).
Список литературы
Nellbring S. The ecology of smelts (genus Osmerus): a literature review // Nordic J. Freshwater Res. 1989. V. 65. P. 116–145.
Taylor E.B., Dodson J.J. A molecular analysis of relationships and biogeography within a species complex of Holarctic fish (genus Osmerus) // Mol. Ecol. 1994. V. 3. № 3. P. 235–248.
Андрияшев А.П., Чернова Н.В. Аннотированный список рыбообразных и рыб морей Арктики и сопредельных вод // Вопр. ихтиологии. 1994. Т. 34. № 4. С. 435–456.
Василец П.М. Корюшки прибрежных вод Камчатки: Дис. … канд. биол. наук. Владивосток: ИБМ ДВО РАН, 2000. 192 с.
Клюканов В.А. Морфологические основы систематики корюшек рода Osmerus (Osmeridae) // Зоол. журн. 1969. Т. 48. № 1. С. 99–109.
Черешнев И.А. Биологическое разнообразие пресноводной ихтиофауны Северо-Востока России. Владивосток: Дальнаука, 1996. 196 с.
Парин Н.В., Евсеенко С.А., Васильева Е.Д. Рыбы морей России: аннотированный каталог. Сб. тр. Зоол. музея МГУ. Т. 53. М.: Т-во научн. изд. КМК, 2014. 733 с.
Василец П.М., Трофимов И.К., Раевский Р.В. Морфологическая дифференциация тихоокеанской корюшки Osmerus mordax dentex в водах Камчатки // Исслед. вод. биол. ресурсов Камчатки и сев.-зап. части Тихого океана. 2000. Вып. 5. С. 101–105.
Черешнев И.А., Волобуев В.В., Шестаков А.В., Фролов С.В. Лососевидные рыбы Северо-Востока России. Владивосток: Дальнаука, 2002. 496 с.
Бугаев В.Ф. Рыбы бассейна реки Камчатки. Петропавловск-Камчатский: Камчатпресс, 2007. 192 с.
Бугаев А.В., Амельченко Ю.Н., Липнягов С.В. Азиатская зубастая корюшка Osmerus mordax dentex в шельфовой зоне и внутренних водоемах Камчатки: состояние запасов, промысел и биологическая структура // Изв. ТИНРО. 2014. Т. 178. С. 3–24.
Ковпак Н.Е., Скурихина Л.А., Кухлевский А.Д. и др. Генетическое разнообразие и родственные взаимоотношения корюшек рода Osmerus российских вод // Генетика. 2011. Т. 47. № 8. С. 1081–1096.
Скурихина Л.А., Олейник. А.Г., Кухлевский А.Д. и др. Генетическая дифференциация тихоокеанской корюшки Osmerus mordax dentex по данным анализа митохондриальной ДНК // Генетика. 2015. Т. 51. № 12. С. 1410–1422.
Allendorf F.W. Genetics and the conservation of natural populations: allozymes to genomes // Mol. Ecol. 2017. V. 26. № 2. P. 420–430. doi 10.1111/mec.13948
Coulson M.W., Paterson I.G., Green A. et al. Characterization of di- and tetranucleotide microsatellite markers in rainbow smelt (Osmerus mordax) // Mol. Ecol. Res. 2006. V. 6. № 3. P. 942–944. doi 10.1111/j.1471-8286.2006.01409.x
Fisch K.M., Petersen J.L., Baerwald M.R. et al. Characterization of 24 microsatellite loci in delta smelt, Hypomesus transpacificus, and their cross-species amplification in two other smelt species of the Osmeridae family // Mol. Ecol. Res. 2009. V. 9. № 1. P. 405–408. doi 10.1111/ j.1755-0998.2008.02254.x
Kaukinen K.H., Supernault K.J., Miller K.M. Development of microsatellite loci in eulachon (Thaleichthys pacificus) // Mol. Ecol. Res. 2004. V. 4. № 4. P. 632–634. doi 10.1111/j.1471-8286.2004.00742.x
Ye J., Coulouris G., Zaretskaya I. et al. Primer-BLAST: a tool to design target-specific primers for polymerase chain reaction // BMC Bioinformatics. 2012. V. 13. № 1. P. 134.
Van Oosterhout C., Hutchinson W.F., Wills D.P.M., Shipley P. MICRO-CHECKER: software for identifying and correcting genotyping errors in microsatellite data // Mol. Ecol. Notes. 2004. V. 4. P. 535–538. doi 10.1111/ j.1471-8286.2004.00684.x
Chapuis M.P., Estoup A. Microsatellite null alleles and estimation of population differentiation // Mol. Biol. Evol. 2007. V. 24. P. 621–631. doi 10.1093/molbev/ msl191
Ryman N., Palm S. POWSIM: a computer program for assessing statistical power when testing for genetic differentiation // Mol. Ecol. Notes. 2006. V. 6. № 3. P. 600–602. doi 10.1111/j.1471-8286.2006.01378.x
Ryman N., Palm S., André C. et al. Power for detecting genetic divergence: differences between statistical methods and marker loci // Mol. Ecol. 2006. V. 15. № 8. P. 2031–2045. doi 10.1111/j.1365-294X.2006.02839.x
Семенова А.В., Карпов А.К., Андреева А.П. и др. Темпоральная стабильность популяционно-генетической структуры беломорской сельди Clupea pallasii marisalbi // Генетика. 2016. Т. 52. № 12. С. 1428–1436.
Lewis P.O., Zaykin D. Genetic Data Analysis: Computer program for the analysis of allelic data. Version 1.0 (d 16c). 2001. Free program distributed by the authors over the internet from http://lewis.eeb.unconn.edu/ lewishome/software.html.
Rousset F. Genepop'007: a complete reimplementation of the Genepop software for Windows and Linux // Mol. Ecol. Res. 2008. V. 8. P. 103–106.
Goudet J. FSTAT, a program to estimate and test gene diversities and fixation indices (version 2.9.3). 2001. Available from http://www2.unil.ch/popgen/softwares/ fstat.htm.
Mantel N. The detection of disease clustering and a generalized regression approach // Cancer Res. 1967. V. 27. P. 209–220.
Piry S., Luikart G., Cornuet J.M. Computer note. BOTTLENECK: a computer program for detecting recent reductions in the effective size using allele frequency data // J. Heredity. 1999. V. 90. № 4. P. 502–503.
Cornuet J.M., Luikart G. Description and power analysis of two tests for detecting recent population bottlenecks from allele frequency data // Genetics. 1996. V. 144. № 4. P. 2001–2014.
Bradbury I.R., Coulson M.W., Campana S.E. et al. Contemporary nuclear and mitochondrial genetic clines in a north temperate estuarine fish reflect Pleistocene vicariance // Mar. Ecol. Prog. Ser. 2011. V. 438. P. 207–218. doi 10.3354/meps09286
Coulson M.W., Bradbury I.R., Bentzen P. Temporal genetic differentiation: continuous v. discontinuous spawning runs in anadromous rainbow smelt Osmerus mordax (Mitchill) // J. Fish Biol. 2006. V. 69 (sc). P. 209–216. doi 10.1111/j.1095-8649.2006.01270.x
Curry R.A., Currie S.L., Bernatchez L., Saint-Laurent R. The rainbow smelt, Osmerus mordax, complex of Lake Utopia: threatened or misunderstood? // Environ. Biol. Fish. 2004. V. 69. P. 153–166.
Bradbury I.R., Coulson M.W., Campana S.E., Bentzen P. Morphological and genetic differentiation in anadromous smelt Osmerus mordax (Mitchill): disentangling the effects of geography and morphology on gene flow // J. Fish Biol. 2006. V. 69 (sc). P. 95–114. doi 10.1111/ j.1095-8649.2006.01263.x
Kovach A.I., Breton T.S., Enterline C., Berlinsky D.L. Identifying the spatial scale of population structure in anadromous rainbow smelt (Osmerus mordax) // Fish. Res. 2013. V. 141 P. 95–106. doi 10.1016/j.fishres.2012.07.008
Bradbury I.R., Campana S.E., Bentzen P. Estimating contemporary early life-history dispersal in an estuarine fish: Integrating molecular and otolith elemental approaches // Mol. Ecol. 2008. V. 17. № 6. P. 1438–1450. doi 10.1111/j.1365-294X.2008.03694.x
Bradbury I.R., Snelgrove P.V.R., Bentzen P. et al. Structural and functional connectivity of marine fishes within a semi-enclosed Newfoundland fjord // J. Fish Biol. 2009. V. 75. № 6. P. 1393–1409. doi 10.1111/j.1095-8649.2009.02391.x
Hedrick P.W. Genetic polymorphism in heterogeneous environments: a decade later // Annu. Rev. Ecol. Syst. 1986. V. 17. P. 535–566.
Дополнительные материалы отсутствуют.