Генетика, 2019, T. 55, № 10, стр. 1172-1179
Интерпретация результатов метода FISH при неравномерном внутреннем облучении тела человека с использованием модельного подхода
Е. И. Толстых 1, *, М. О. Дегтева 1, А. В. Возилова 1, А. В. Аклеев 1
1 Уральский научно-практический центр радиационной медицины
454076 Челябинск, Россия
* E-mail: evgenia@urcrm.ru
Поступила в редакцию 24.04.2019
После доработки 20.05.2019
Принята к публикации 22.05.2019
Аннотация
Метод флуоресцентной in situ гибридизации (FISH) позволяет оценивать число стабильных хромосомных аберраций (транслокаций) в Т-лимфоцитах крови человека через десятилетия после радиационного воздействия, поэтому он используется для ретроспективной оценки доз облучения красного костного мозга (ККМ). Анализ результатов цитогенетических исследований у лиц, облучившихся в 1950-е годы 89, 90Sr, который локально облучает ККМ, показал, что оценка доз на основе данных FISH приводит к занижению реальной дозы, оцененной на основе измерений содержания 90Sr в организме. Была оценена зависимость доза–эффект и определена частота транслокаций на 1 Гр дозы облучения ККМ и Т-лимфоцитов у доноров, проживавших в прибрежных селах р. Теча (n = 178; число транслокаций = 2389; число геном-эквивалентов GE = 96 446). Для оценки доз были использованы последняя версия дозиметрической системы р. Теча и модель облучения Т-лимфоцитов. Статистический анализ показал, что частота транслокаций на 1000 GE на 1 Гр дозы на ККМ составила 8.0 ± 0.7; это статистически значимо ниже, чем аналогичная величина, оцененная для работников Селлафилда при внешнем облучении (11.6 ± 1.6). В то же время использование дозы на Т-лимфоциты и их предшественники привело к переоценке (повышению) угла наклона дозовой кривой до 11.8 ± 1.6 на 1 Гр на 1000 GE, что хорошо согласуется с опубликованными данными. Полученные оценки фоновых частот транслокаций также оказались близкими к опубликованным значениям для необлученных доноров. Это свидетельствует о правомерности использования модельного подхода к оценкам доз на Т-лимфоциты и их предшественники и о необходимости учета сложной динамики Т-клеток при интерпретации цитогенетических данных в целях биодозиметрии.
Анализ хромосомных аберраций в Т-лимфоцитах периферической крови признан в качестве одного из важных методов биодозиметрии [1–4]. Метод флуоресцентной in situ гибридизации (FISH) позволяет оценивать число стабильных хромосомных аберраций (транслокаций), индуцированных облучением, в лимфоцитах крови человека. Общепринятая точка зрения указывает [1], что “при ретроспективной биологической дозиметрии, спустя десятилетие или более после воздействия, когда транслокации измеряются методом FISH, дозовая оценка представляет собой среднюю дозу на активный костный мозг. Связано это с тем, что первоначально облучению подверглись стволовые клетки – предшественники лимфоцитов, которые собственно и исследуются”. Существуют калибровочные кривые, связывающие число транслокаций с известной дозой облучения, рекомендованные для оценки дозы на красный костный мозг (ККМ) [3].
Однако анализ данных FISH у лиц, облучившихся 89, 90Sr в 1950-е гг. в прибрежных населенных пунктах р. Теча, показал, что оценка доз с использованием данных по частоте транслокаций приводит к занижению реальной дозы на ККМ, оцененной на основе измерений содержания 90Sr в организме [5, 6]. Поскольку 90Sr является метаболическим аналогом кальция, он встраивается в кристаллы гидроксиапатита костной ткани и надолго задерживается в организме. Средняя длина пробега электрона спектра 90Sr и дочернего 90Y составляет в кости около 3 мм, что приводит к хроническому локальному облучению ККМ, расположенного в костных полостях. Жители прибрежных сел р. Теча получили значительные количества 90Sr (в среднем около трех млн Бк), поступившего в организм с загрязненной речной водой и продуктами питания местного производства [7], при этом максимум поступления пришелся на 1950–1953 гг. В этой связи нельзя отбросить предположение, что при локальном облучении ККМ часть Т-клеток, сформированных до начала облучения, могла получить значительно более низкие дозы, поскольку эти клетки (и их предшественники) не находились в костном мозге.
Изучение динамики Т-клеток привело к созданию модели облучения Т-лимфоцитов с учетом части Т-клеточных предшественников в костном мозге, облучения Т-лимфоцитов в экстра-скелетных лимфоидных тканях (ЭЛТ) и с учетом рециркуляции лимфоцитов в красном костном мозге [8]. Модель основана на концепции Т-клеточного рода (T-Genus), объединяющего всех потомков T‑прогенитора с наследуемыми специфическими аберрациями, которые могли образоваться в ККМ. Модель, в частности, использует результаты математического моделирования гомеостаза T-лимфоцитов [9, 10].
Задачи настоящей работы: обобщить экспериментальные данные по цитогенетическим исследованиям стабильных хромосомных аберраций у жителей прибрежных сел р. Теча за период 1994–2012 гг.; рассчитать для каждого донора дозу на Т‑лимфоциты на основе разработанного модельного подхода; оценить зависимость доза–эффект и определить частоту транслокаций на 1 Гр дозы и фоновую частоту транслокаций; сопоставить полученные значения с аналогичными показателями, полученными в обобщающих международных исследованиях [11, 12], т.е. провести верификацию модели.
МАТЕРИАЛЫ И МЕТОДЫ
Цитогенетические исследования
Цитогенетические исследования стабильных хромосомных аберраций были выполнены для 178 доноров, проживавших в прибрежных пунктах р. Теча в период сбросов радиоактивных отходов. Эта группа была подробно описана ранее [8], количество проведенных анализов FISH составило 193, исследования выполнялись в период 1994–2012 гг. Возраст доноров на момент отбора образцов крови варьировал от 47 до 78 лет, число мужчин – 61. Подсчет аберраций был выполнен в цитогенетических лабораториях нескольких научных центров: в УНПЦ РМ (Россия), Институте радиобиологии им. Гельмгольца (Германия), лаборатории Public Health England (Великобритания), а также в Лейденском университетском медицинском центре (Нидерланды). Протоколы FISH и подробные описания подсчета хромосомных аберраций были даны в предыдущих работах [5, 6, 13]. Во всех случаях использовали цельнохромосомные зонды для окрашивания трех пар хромосом, которые покрывали около 23% генома. Всего было просчитано 96 446 GE (геном-эквивалентов) и обнаружено 2389 транслокаций.
Оценка доз облучения красного костного мозга и экстра-скелетных лимфоидных тканей доноров
Все доноры подвергались внешнему γ- и внутреннему γ-, β-облучению, в основном 89, 90Sr и 137Cs [14]. Расчет доз для всех доноров был проведен с использованием последней версии дозиметрической системы р. Теча (TRDS-2016) [15], подходы к индивидуализации доз облучения были подробно описаны ранее [16]. Для оценок доз от 89, 90Sr в TRDS используются биокинетическая половозрастная модель для стронция [17], а также результаты прижизненных измерений содержания радионуклидов в организме, если таковые имелись для конкретного индивида. Следует отметить, что среди доноров, участвовавших в настоящем исследовании, 90% лиц прижизненно измерялись на спектрометре излучений человека для определения содержания 90Sr в организме.
Вклад изотопов стронция в суммарную дозу на ККМ в разных дозовых группах варьировал от 52 до 85%, этот показатель свидетельствует о значительном вкладе локального облучения ККМ в суммарную дозу. Дозы рассчитывали с момента начала облучения до даты отбора проб крови.
Экстра-скелетные лимфоидные ткани, включающие тимус и другие лимфоидные органы, не могут быть значимо облучены при поступлении с рационом 89,90Sr. Доза их облучения обусловлена равномерно распределенным в теле 137Cs и внешним γ-излучением от загрязненной почвы пойменных земель. Доза на ЭЛТ, где в основном расположены лимфоциты, считалась равной поглощенной дозе в мышцах и рассчитывалась так же с использованием TRDS-2016.
Оценка доз облучения Т-лимфоцитов и их предшественников (модельный подход)
Модель облучения Т-лимфоцитов подробно была описана ранее [8]. При разработке модели принимались во внимание следующие особенности формирования пула Т-лимфоцитов периферической крови:
1. Все Т-лимфоциты происходят от Т-клеточных предшественников, которые формируются в костном мозге.
2. Т-предшественники через кровеносное русло мигрируют в тимус, где происходит формирование Т-лимфоцитов с уникальными Т-клеточными рецепторами.
3. Т-лимфоциты в периферических лимфоидных тканях образуют многоклеточные и часто долгоживущие клоны клеток с одинаковыми Т‑клеточными рецепторами; репертуар Т-клонов формируется в детстве и остается довольно стабильным в течение жизни (до 70 лет) [18–23].
4. При облучении Т-предшественника (прогенитора) в костном мозге потенциальный груз хромосомных аберраций несут все его потомки, т.е. целый набор Т-клонов с уникальными Т-клеточными рецепторами.
5. Все потомки одного прогенитора и сам прогенитор объединяются в Т-клеточный род, или Genus (ТG), который является объектом моделирования [8].
Принималось, что продукция TG прямо пропорциональна продукции тимусом Т-лимфоцитов, и потеря TG в течение жизни не оказывает существенного влияния на возрастное соотношение представителей различных TG в периферической крови. В свою очередь, для оценки зависящей от возраста продукции тимусом Т-лимфоцитов использовали результаты модельных оценок Bains I [9, 10], которые базировались на экспериментальных данных по скорости пролиферации различных фракций Т-лимфоцитов, их общего количества в периферической крови.
Полная средневзвешенная лимфоцитарная доза DL рассчитывается как сумма двух доз: 1) средневзвешенная доза облучения Т-лимфоцитов, накопленная в период пребывания предшественников Т-клеток в ККМ (DLP); 2) средневзвешенная доза на циркулирующие лимфоциты DLC, которая представляет собой дозу, накопленную лимфоцитами в период их циркуляции в организме человека. Таким образом, здесь и далее “доза на Т-лимфоциты” подразумевает средневзвешенную лимфоцитарную дозу, включающую дозу на Т-предшественники. Ниже приводится алгоритм расчетов доз облучения.
Средневзвешенная доза облучения Т-лимфоцитов, накопленная в период пребывания предшественников в ККМ (DLP), представляет собой дозу, накопленную прежде чем предшественники покинули ККМ и начали генерировать клонотипы Т-лимфоцитов в тимусе. Она рассчитывается как среднее значение, взвешенное в соответствии с долей потомков каждого предшественника в периферической крови на момент забора крови:
(1)
${{D}_{{{\text{LP}}}}} = \frac{1}{{{{P}_{{{\text{TG}}}}}(ag{{e}_{{\text{s}}}})}}\int\limits_{{{t}_{1}}}^{{{t}_{{\text{s}}}}} {{{p}_{{{\text{TG}}}}}\left( {age} \right){{D}_{{{\text{ККМ}}}}}(t,age)} dt,$(2)
${{P}_{{{\text{TG}}}}}\left( {age} \right) = \int\limits_0^{age} {{{f}_{{{\text{TG}}}}}\left( t \right)dt} ;$(3)
$\begin{gathered} {{f}_{{{\text{TG}}}}}\left( {age} \right) = \\ = \left\{ {\begin{array}{*{20}{l}} {0.5 + 0.5age,}&{0 \leqslant age \leqslant 1;} \\ {\exp \left( { - 0.12\left( {age - 1} \right)} \right),}&{1 \leqslant age < 8;} \\ {0.4582 + \exp \left( { - 0.04\left( {age - 8} \right)} \right),}&{8 \leqslant age < 20;} \\ {0.2893 + \exp \left( { - 0.08\left( {age - 20} \right)} \right),}&{age > 20;} \end{array}} \right. \\ \end{gathered} $pTG(age) – число Т-клеточных родов (TG), произведенных за один год (в отн. ед.), которое рассчитывается интегрированием функции (3) для заданного возраста age
(4)
${{p}_{{{\text{TG}}}}}\left( {age} \right) = \int\limits_{age}^{age + 1} {{{f}_{{{\text{TG}}}}}\left( t \right)dt} .$DККМ(t, age) – поглощенная доза на ККМ, накопленная к возрасту age с момента начала облучения, которая представляет собой функцию календарного времени, возраста и времени проживания донора на загрязненных территориях.
Средневзвешенная доза на циркулирующие лимфоциты (DLC) представляет собой дозу, накопленную лимфоцитами в период их циркуляции в организме человека при радиационном облучении; во время циркуляции лимфоциты проводят 88% времени в экстра-скелетных лимфоидных тканях, а остальные 12% – в красном костном мозге [24]. DLC рассчитывается как среднее значение, взвешенное в соответствии с долей лимфоцитов, которые включены в режим циркуляции в каждом возрасте; а также с долей времени, проводимого циркулирующими лимфоцитами в ЭЛТ и ККМ:
(5)
$\begin{gathered} {{D}_{{{\text{LC}}}}} = \frac{1}{{{{P}_{{{\text{TG}}}}}(ag{{e}_{{\text{s}}}})}}\int\limits_{{{t}_{1}}}^{{{t}_{{\text{s}}}}} {{{P}_{{{\text{TG}}}}}\left( {age} \right)} \times \\ \times \,\,\left[ {0.88{{{\dot {D}}}_{{{\text{ЭЛТ}}}}}\left( {t,age} \right) + 0.12{{{\dot {D}}}_{{{\text{ККМ}}}}}\left( {t,age} \right)} \right]dt, \\ \end{gathered} $где PTG(age) – число Т-клеточных родов, произведенных в течение периода от рождения до age и переключившихся в режим циркуляции (рассчитывается согласно (2) в отн. ед.);
${{\dot {D}}_{{{\text{ККМ}}}}}\left( {t,age} \right)$ – годовая мощность поглощенной дозы в ККМ, которая является функцией календарного времени, возраста и истории облучения конкретного индивида;
${{\dot {D}}_{{{\text{ЭЛТ}}}}}\left( {t,age} \right)$ – годовая мощность поглощенной дозы в ЭЛТ, которая зависит от календарного времени, возраста, истории проживания конкретного донора на загрязненной территории.
Полная средневзвешенная лимфоцитарная доза DL рассчитывается как сумма (1) и (5):
Статистический анализ
Для оценки связи между суммарной дозой облучения (доза на ККМ или полная средневзвешенная лимфоцитарная доза) и частотой транслокации был использован модуль AMFIT программного пакета EPICURE [25], позволяющий построить линейную модель регрессии Пуассона. Модель имеет общий вид:
(7)
$Y\left( {age,sex,dose} \right) = {\text{ }}{{Y}_{0}}\left( {age,sex} \right) + \beta {\text{ }} \times dose,$Переменные были распределены по следующим категориям: возраст (годы) – четыре категории (<50, 50–60, 60–70, >70); доза на ККМ (Гр) – шесть категорий (0–0.5, 0.5–1, 1–1.5, 1.5–2, 2–2.5, >2.5); доза на Т-лимфоциты (Гр) – шесть категорий (0–0.25, 0.25–0.5, 0.5–0.75, 0.75–1; 1–1.3, >1.3); пол – две категории.
Для выбранной группы доноров были выполнены два варианта расчетов дозовой зависимости частоты транслокаций с использованием программы EPICURE: 1) частота транслокаций на 1 Гр дозы на ККМ; 2) частота транслокаций на 1 Гр дозы на Т-лимфоциты. В обоих случаях значения параметров вычисляли с помощью метода максимального правдоподобия, а значения P оценивали на основании двусторонних тестов.
Так как в группе доноров не было лиц с нулевыми дозами облучения, значения фоновой частоты транслокаций (параметр Y0) получали методом экстраполяции линейной регрессии к нулевой дозе.
Вычисления стандартных параметров и построение рисунков проводили с помощью лицензионных программ Microsoft Excel и Sigma Plot на персональном компьютере.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ доз облучения доноров
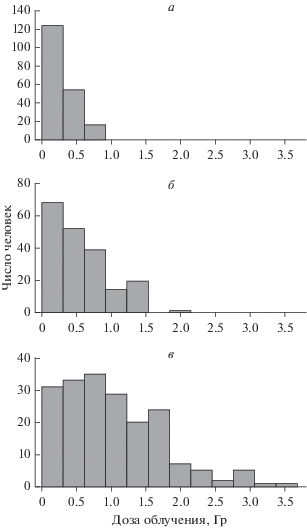
Рис. 1 представляет статистические распределения доз на ККМ, ЭЛТ и Т-лимфоциты в изучаемой выборке доноров. Как видно, дозы на лимфоциты занимают промежуточное положение между дозами на ККМ и ЭЛТ. Максимальное значение дозы на ККМ составило 3.6 Гр, на Т‑лимфоциты – 2.3 Гр, на ЭЛТ – 0.9 Гр. Рис. 1 иллюстрирует неравномерность облучения при накоплении в организме 89, 90Sr. Следует отметить, что максимальные мощности дозы наблюдались в течение короткого промежутка времени, совпадающего с периодом сбросов радиоактивных отходов в р. Теча.
Анализ дозовых зависимостей частоты транслокаций
При всех вариантах расчетов не было выявлено влияния пола на частоту транслокаций, поэтому далее приведены результаты для объединенной по полу группы доноров.
Табл. 1 представляет частоту транслокаций в расчете на 1 Гр дозы облучения, т.е. угол наклона кривой доза–эффект. Значения угла наклона (угловые коэффициенты) используются при переходе от числа транслокаций к дозе облучения человека после проведения цитогенетических исследований в целях биодозиметрии. Для сравнения в табл. 1 приведены результаты исследования [11], выполненного на основе FISH, где для построения линейной регрессии Пуассона также был использован модуль AMFIT программного пакета EPICURE. В этой обобщающей работе оценивали частоту транслокаций у работников ядерного предприятия в Селлафилде (Sellafield nuclear facility, Cumbria, UK; n = 459), подвергавшихся в основном внешнему облучению. Это означает, что для них дозы на ККМ и Т-лимфоциты практически совпадают, и нет необходимости учитывать облучение Т-клеток в различных отделах тела. Кроме того, работники, как и в случае с донорами из когорты р. Теча, подвергались пролонгированному облучению с небольшой мощностью дозы. Таким образом, результаты этого исследования могут служить своеобразным “золотым стандартом” для оценок связи между дозой на Т-лимфоциты и частотой хромосомных аберраций. Также для сравнения приведены данные по небольшой группе доноров (n = 26) из прибрежных сел р. Теча, для которых неравномерность облучения выражена максимально, и вклад облучения в дозу на ККМ достигает 95–99%, т.е. имело место локальное облучение ККМ [6].
Таблица 1.
Частота транслокаций на 1 Гр дозы облучения на 1000 GE
| № | Источник данных |
Орган-мишень для оценки доз | Характер облучения | Частота транслокаций, среднее ± SE |
|---|---|---|---|---|
| 1 | [11] | ККМ | Внешнее всего тела, доза на ККМ совпадает с дозой на лимфоциты | 11.6 ± 1.6 |
| 2 | [6] | ККМ | Внутреннее, локальное облучение ККМ, вклад в дозу 89,90Sr – 96%а | 7.0 ± 0.2б |
| 3 | Настоящее исследование | ККМ | Внутреннее и внешнее, вклад в дозу на ККМ 89,90Sr – 54–85%в |
8.0 ± 0.7б |
| 4 | Настоящее исследование | Т-лимфоциты | То же | 11.8 ± 1.2 |
а Оставшиеся 4% дозы на ККМ обусловлены незначительным внешним облучением и внутренним облучением за счет 137Cs. б Статистически значимые различия со значением № 1 [11]. в Средний вклад в дозовых группах.
Как следует из табл. 1, выделяются две пары близких значений частоты транслокаций на 1 Гр. В первом случае это оценки № 1 и 4, которые базируются на дозах на ККМ, совпадающих с дозами на лимфоциты, и непосредственно на лимфоцитарных дозах. Во втором случае это оценки № 2 и 3, полученные для доноров с преимущественным локальным облучением ККМ. Во втором случае частота транслокаций на 1 Гр существенно ниже.
Статистический анализ показал, что частота транслокаций на 1000 GE на 1 Гр дозы на ККМ составила 8.0 ± 0.7; статистически это значимо ниже, чем аналогичная величина, оцененная для работников Селлафилда при внешнем облучении (11.6 ± 1.6). В то же время использование для оценок доза–эффект дозы на Т-лимфоциты и их предшественники привело к переоценке (повышению) угла наклона дозовой кривой, который составил 11.8 ± 1.6 на 1 Гр на 1000 GE, что хорошо согласуется с данными по внешнему облучению.
Как уже говорилось, в нашем исследовании дозы на Т-лимфоциты и их предшественники были впервые рассчитаны с использованием модели, учитывающей облучение Т-клеток как в костном мозге, так и во внескелетных тканях. Сопоставление наших оценок и опубликованных данных – это по сути один из способов верификации модели, а хорошая сходимость результатов по частоте транслокаций свидетельствует о правомерности использования нашего модельного подхода.
Анализ возрастной зависимости частоты транслокаций у необлученных доноров
В табл. 2 представлены оценки фоновых значений частоты транслокаций в зависимости от возраста, полученные при построении регрессии с дозами на Т-лимфоциты и их предшественники. Для сравнения приведены значения, полученные в рамках международного исследования влияния различных нерадиационных факторов на частоту транслокаций [12], количество доноров интересующего возрастного диапазона n = 817. Как видно, во всех случаях наблюдается увеличение фоновой частоты с увеличением возраста. Найденные нами оценки близки к фоновым значениям для необлученных доноров [12], что может рассматриваться как еще один элемент верификации модели облучения Т-лимфоцитов.
Таблица 2.
Фоновая, зависящая от возраста, частота транслокаций на 1000 GE в сопоставлении с опубликованными данными
| Возраст, лет | Настоящее исследование, среднее (границы SE) | Данные международного исследования [12], оба пола, среднее (95% CI) |
|---|---|---|
| <50 | 7.2 (5.3–9.8) |
7.90 (7.00–10.4) |
| 50–60 | 10.2 (8.5–12.2) |
8.85 (8.00–13.5) |
| 60–70 | 17.1 (16.0–18.4) |
12.1 (10.5–13.8) |
| >70 | 17.5 (16.5–18.6) |
16.1 (13.6–21.4) |
В заключение следует отметить, что верификация модельных оценок доз на Т-лимфоциты является сложной задачей, которая не имеет прямого решения, так как геном Т-лимфоцитов сам выступает в качестве биодозиметра, “хранящего” индуцированные транслокации. Однако полученная регрессионная зависимость доза–эффект (зависимость частоты транслокаций от лимфоцитарной дозы) позволила провести сопоставление с опубликованными данными по двум параметрам: по угловому коэффициенту линии регрессии и по фоновым частотам транслокаций, число которых увеличивается с возрастом. Во всех случаях наблюдается хорошая сходимость результатов. Необходимость учета неравномерности облучения и использования доз на Т-лимфоциты можно проиллюстрировать следующим примером: предположим, что у человека с неизвестной дозой облучения определили частоту транслокаций; известно, что его облучение обусловлено 90Sr. Чтобы перейти к дозе на ККМ, использовали коэффициент, полученный для условий внешнего равномерного облучения (11.6 на 1 Гр на 1000 GE [11]) или полученный при облучении лимфоцитов in vitro (15 на 1 Гр на 1000 GE [3]). В результате реальная доза на ККМ может быть занижена в 1.5–2 раза. Таким образом, без учета неравномерности облучения и сложной динамики Т-клеток доза облучения ККМ при использовании цитогенетических методов может быть существенно недооценена.
Авторы выражают благодарность С.Б. Епифановой за помощь в работе с программой EPICURE и В.А. Кривощапову за разработку программы для расчетов доз на Т-лимфоциты и их предшественники.
Работа была поддержана Федеральным медико-биологическим агентством России и Департаментом энергетики США в рамках Российско-Американского проекта 1.1.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
IAEA Cytogenetic Analysis for Radiation Dose Assessment. A Manual Technical Reports. Series 405. 2001. http://www-pub.iaea.org/books/IAEABooks/6303/Cytogenetic-Analysis-for-Radiation-Dose-Assessment-A-Manual.
Hande M.P., Azizova T.V., Burak L.E. et al. Complex chromosome aberrations persist in individuals many years after occupational exposure to densely ionizing radiation: an mFISH study // Genes Chromosomes Cancer. 2005. V. 44. № 1. P. 1–9.
Edwards A.A., Lindholm C., Darroudi F. et al. Review of translocations detected by FISH for retrospective biological dosimetry applications // Radiat. Prot. Dosimetry. 2005. V. 113. № 4. P. 396–402. https://doi.org/10.1093/rpd/nch452
Пилинская М.А., Дыбский С.С., Скалецкий Ю.Н. Опыт использования метода FISH для реконструкции индивидуальных доз облучения у ликвидаторов Чернобыльской аварии в рамках Украинско-Американского проекта “Лейкемия” // Цитология и генетика. 2006. Т. 40. № 3. С. 34–39.
Vozilova A.V., Shagina N.B., Degteva M.O. et al. Preliminary FISH-based assessment of external dose for residents exposed on the Techa River // Radiat. Res. 2012. V. 177. № 1. P. 84–91.
Vozilova A.V., Shagina N.B., Degteva M.O. et al. FISH analysis of translocations induced by chronic exposure to Sr radioisotopes: second set of analysis of the Techa River Cohort // Radiat. Prot. Dosimetry. 2014. V. 159. № 1–4. P. 34–37. https://doi.org/10.1093/rpd/ncu131
Tolstykh E.I., Degteva M.O., Peremyslova L.M. et al. Reconstruction of long-lived radionuclide intakes for Techa Riverside residents: Strontium-90 // Health Phys. 2011. V. 101. P. 28–47. https://doi.org/10.1097/HP.0b013e318206d0ff
Tolstykh E.I., Degteva M.O., Vozilova A.V., Anspaugh L.R. Local bone-marrow exposure: how to interpret the data on stable chromosome aberrations in circulating lymphocytes? (some comments on the use of FISH method for dose reconstruction for Techa Riverside residents) // Radiat. Environ. Biophys. 2017. V. 56. № 4. P. 389–403. https://doi.org/10.1007/s00411-017-0712-7
Bains I. Mathematical Modelling of T Cell Homeostasis. A thesis submitted for the degree of Doctor of Philosophy of the University College London, 2010. http://discovery.ucl.ac.uk/20159/1/20159.pdf
Bains I., Yates A.J., Callard R.E. Heterogeneity in thymic emigrants: implications for thymectomy and immunosenescence // PLoS One. 2013. V. 8(2): e49554. https://doi.org/10.1371/journal.pone.0049554
Tawn E.J., Curwen G.B., Jonas P. et al. Chromosome aberrations determined by FISH in radiation workers from the sellafield nuclear facility // Radiat. Res. 2015. V. 184. № 3. P. 296–303. https://doi.org/10.1667/RR14125.1
Sigurdson A.J., Ha M., Hauptmann M. et al. International study of factors affecting human chromosome translocations // Mutat. Res. 2008. V. 652. № 2. P. 112–121. https://doi.org/10.1016/j.mrgentox.2008.01.005
Bauchinger M., Salassidis K., Brasellmann H. et al. FISH-based analysis of stable translocations in a Techa River population // Int. J. Radiat. Biol. 1998. V. 7. P. 605–612.
Дёгтева М.О., Шагина Н.Б., Воробьева М.И. и др. Радиационная биология. Современное представление о радиоактивном загрязнении реки Теча в 1949–1956 гг. // Радиац. биология. Радиоэкология. 2016. Т. 56. № 5. С. 523–534.
Degteva M.O., Napier B.A., Tolstykh E.I. et al. Enhancements in the Techa River dosimetry system: TRDS-2016D Code for reconstruction of deterministic estimates of dose from environmental exposures // Health Phys. 2019. Apr 5. https://doi.org/10.1097/HP.0000000000001067
Шагина Н.Б., Дегтева М.О., Толстых Е.И. и др. Снижение неопределенностей доз внутреннего облучения от 90Sr для расширенной когорты реки Теча // Вопр. радиац. безопасности. 2006. Спец. вып. № 1. С. 5−25.
Shagina N.B., Tolstykh E.I., Degteva M.O. et al. Age and gender specific biokinetic model for strontium in humans // J. Radiol. Prot. 2015. V. 35. № 1. P. 87–127. https://doi.org/10.1088/0952-4746/35/1/87
Britanova O.V., Shugay M., Merzlyak E.M. et al. Dynamics of individual T cell repertoires: From cord blood to centenarians // J. Immunol. 2016. V. 196. № 12. P. 5005–5013. https://doi.org/10.4049/jimmunol.1600005
Naumova E.N., Gorski J., Naumov Y.N. Simulation studies for a multistage dynamic process of immune memory response to influenza: experiment in silico // Ann. Zool. Fenn. 2008. V. 45. P. 369–384.
Yoshida K., Cologne J.B., Cordova K. et al. Aging-related changes in human T-cell repertoire over 20 years delineated by deep sequencing of peripheral T-cell receptors // Exp. Gerontol. 2017. V. 1. № 96. P. 29–37. https://doi.org/10.1016/j.exger.2017.05.015
Britanova O.V., Putintseva E.V., Shugay M. et al. Age-related decrease in TCR repertoire diversity measured with deep and normalized sequence profiling // J. Immunol. 2014. V. 192. № 6. P. 2689–2698. https://doi.org/10.4049/jimmunol.1302064
Attaf M., Huseby E., Sewell A.K. αβ T cell receptors as predictors of health and disease // Cell Mol. Immunol. 2015. V. 12. № 4. P. 391–399.https://doi.org/10.1038/cmi.2014.134
Израельсон М., Касацкая С., Погорелый М. и др. Анализ индивидуальных репертуаров Т-клеточных рецепторов // Иммунология. 2016. Т. 37. № 6. С. 347– 352.
Di Rosa F., Pabst R. The bone marrow: a nest for migratory memory T cells // Trends Immunol. 2005. V. 26. № 7. P. 360–366.
Hirosoft. Epicure: Fast, interactive software for the analysis of medical, public health, epidemiologic, econometric, and reliability data Seattle, WA: Hirosoft Intern. Corporation. 1998. V. 2 (10).
Дополнительные материалы отсутствуют.