Генетика, 2019, T. 55, № 3, стр. 273-279
Взаимосвязь EAST-зависимой и Su(Hw)-зависимой репрессии в трансгенных линиях Drosophila melanogaster
А. К. Головнин 1, М. В. Костюченко 1, П. Г. Георгиев 1, Л. С. Мельникова 1, *
1 Институт биологии гена Российской академии наук
119334 Москва, Россия
* E-mail: lsm73@mail.ru
Поступила в редакцию 09.04.2018
После доработки 13.07.2018
Принята к публикации 19.06.2018
Аннотация
У D. melanogaster белок ядерного матрикса EAST функционально взаимодействует с Su(Hw)-зависимым инсуляторным комплексом. Ранее был описан аллель y2, в котором ретротранспозон МДГ4 встроен между энхансерами и промотором гена. В регуляторной области МДГ4 присутствует последовательность инсулятора Su(Hw). Увеличение концентрации белка EAST или инактивация белка Mod(mdg4)-67.2, входящего в Su(Hw)-зависимый комплекс, приводят к тканеспецифичной репрессии гена yellow в аллеле y2. В представленной работе с помощью транспозиции трансгенов, содержащих последовательности длинного концевого повтора (ДКП) ретротранспозона МДГ4 и инсулятора Su(Hw), была проанализирована степень EAST-зависимой и Su(Hw)-зависимой репрессии в различных участках генома. В результате генетических экспериментов впервые показано, что EAST-зависимая репрессия гена yellow наблюдается в тех же трансгенных линиях D. melanogaster, что и Su(Hw)-зависимая репрессия. Полученные данные подтверждают высказанное нами ранее предположение, что регуляторный комплекс, формирующийся на последовательности ДКП и функционально взаимодействующий с белком EAST, перемещает трансген в области ядра с высокой концентрацией факторов, репрессирующих транскрипцию.
В настоящее время EAST является одним из немногих охарактеризованных белков ядерного матрикса дрозофилы [1–3]. При физиологических условиях в интерфазных клетках EAST локализуется в межхромосомном пространстве ядер [1]. Увеличение концентрации EAST приводит к увеличению межхромосомного пространства и сокращению объема, занимаемого хромосомами. В структуре EAST предсказаны семь последовательностей сигналов ядерной локализации (NLS) и 12 сайтов протеолитических сигналов (PEST), что свидетельствует о разнообразных вариантах посттрансляционной модификации белка [1]. Ранее мы показали, что белок EAST функционально взаимодействует с инсулятором Su(Hw) [2, 3]. Инсулятор Su(Hw) был впервые обнаружен в 5'-нетранслируемой области (5'UTR) ретротранспозона МДГ4 (gypsy). Он состоит из 12 сайтов связывания белка Su(Hw) [4], который рекрутирует в состав комплекса белки Mod(mdg4)-67.2 и CP190 [5, 6]. Белок EAST напрямую взаимодействует с белками Mod(mdg4)-67.2 и CP190 [2]. Влияние EAST на инсуляторную и репрессионную активность Su(Hw)-зависимого комплекса было продемонстрировано на примере гена yellow [3].
Ген yellow отвечает за пигментацию кутикулярных структур дрозофилы [7]. В диком типе тело, крылья и щетинки мух окрашены в темный цвет. В аллеле y2 ретротранспозон МДГ4 встроился между энхансерами тела и крыльев и промотором гена yellow. В этом случае инсулятор Su(Hw) полностью блокирует активацию экспрессии yellow в теле и крыльях, в результате чего они приобретают желтую окраску. Однако щетинки мух остаются пигментированными, так как энхансер щетинок расположен в интроне гена [8].
Инактивация белка Mod(mdg4)-67.2 вследствие делеции 145 ак С-концевого домена (мутация mod(mdg4)u1) влияет на активность Su(Hw)-инсулятора и, с одной стороны, частично восстанавливает энхансер-промоторное взаимодействие, а с другой – превращает инсулятор в сайленсер. В линии y2;mod(mdg4)u1/mod(mdg4)u1 Su(Hw)-зависимая репрессия выражается в депигментации щетинок – они становятся желтыми [5, 9]. Интересно, что такую же тканеспецифичную репрессию транскрипции гена yellow в щетинках вызывает и суперэкспрессия белка EAST. В линии y2;P{w+; east+}/CyO;P{w+; east+}/TM6,Tb введение двух копий конструкции P{w+ east+}, экспрессирующей белок EAST, в аллель y2 не влияет на окраску тела и крыльев, но приводит к полной депигментации щетинок [10]. Ранее мы показали, что при локализации трансгена в различных участках генома репрессия, обусловленная белком EAST, часто зависит от присутствия в составе трансгена последовательности длинного концевого повтора (ДКП) ретротранспозона МДГ4 [11]. В последовательности ДКП ретротранспозона МДГ4 был локализован инвертированный повтор, включающий сайт связывания белка Mad, ключевого компонента сигнального каскада TGF-β/BMP [12]. Результаты предыдущих работ [11, 12] позволяют предположить, что белок Mad рекрутирует на хроматин регуляторный комплекс, который не только функционально взаимодействует с белком EAST и усиливает EAST-зависимую репрессию, но и обусловливает локализацию трансгенов в репрессионных компартментах ядра.
Цель представленной работы состояла в изучении влияния геномной локализации трансгенов, содержащих Su(Hw)-инсулятор и последовательность ДКП из МДГ4, на репрессию, обусловленную Su(Hw)-зависимым комплексом, и EAST-зависимую репрессию. Для этого мы использовали созданные нами ранее [11] трансгенные линии дрозофил E(Su)(L301dir)YW, E(Su)(L301rev)YW, E(Su)(L92)YW, E(Su)(L5 × 92)YW и E(Su)YW (рис. 1), в которых соответствующий трансген был встроен в хромосому Х. Для получения коллекции линий, в которых перечисленные трансгены встроены в различные места генома, мы индуцировали транспозиции конструкций с хромосомы Х на аутосомы на фоне мутации mod(mdg4)u1. В качестве источника Р-транспозазы [13] использовалась линия y2w1118;P[ry+Δ2-3](99B),mod(mdg4)u1/TM6,Tb. Самцы этой линии индивидуально скрещивались с пятью-шестью самками из трансгенных линий y2w1118,P{y+w+};mod(mdg4)u1/TM6,Tb, где P{y+w+} обозначает каждый из перечисленных трансгенов. Из потомков F1 этого скрещивания отбирались самцы y2w1118,P{y+w+};mod(mdg4)u1/P[ry+Δ2-3](99B),mod(mdg4)u1, которые в свою очередь скрещивались с самками y2w1118, mod(mdg4)u1/ mod(mdg4)u1. Мухи гомо- и гемизиготные по мутации w1118 имеют белые глаза. Самцы y2w1118;mod(mdg4)u1/ mod(mdg4)u1 с транспозициями трансгена, маркированного геном miniwhite, на аутосому выявлялись в потомстве F2 по изменению цвета глаз. Отбирались только самцы с окрашенными глазами. В результате мы получили коллекцию трансгенных линий с гомозиготной мутацией mod(mdg4)u1 и проанализировали частоту проявления Su(Hw)-зависимой репрессии (рис. 1).
Рис. 1.
Проявление репрессии, опосредованной Su(Hw)-зависимым инсуляторным комплексом, в полученных в результате транспозиций трансгенных линиях. а – схематичное изображение последовательности ретротранспозона МДГ4 и последовательностей, использованных в конструкциях, изображенных ниже. Цифрами обозначены размеры ретротранспозона МДГ4 (gypsy) и его фрагментов в составе конструкций; пн – пары нуклеотидов; направление транскрипции МДГ4 показано стрелками; б – приведены схематичные изображения конструкций, на которых энхансер крыльев обозначен как W, энхансер тела – В, энхансер щетинок – Br, инсулятор Su(Hw) – Su. Направление транскрипции указано горизонтальными стрелками. Темно-серые вертикальные стрелки обозначают сайты связывания Cre-рекомбиназы loxР, белые вертикальные стрелки – сайты связывания FRT, узнаваемые рекомбиназой Flp. Буква E в названиях конструкций обозначает энхансеры тела и крыльев гена yellow. Под схемами конструкций представлены результаты фенотипического анализа мух в трансгенных линиях. “+” – линии, в которых на фоне мутации mod(mdg4)u1 наблюдалась Su(Hw)-зависимая репрессия, “–” – линии, в которых такая репрессия не наблюдалась. Пигментация тела и крыльев у самцов обозначена цифрами от 5 – темная окраска, как в диком типе, до 2 – желтая окраска, соответствующая фенотипу аллеля у2. Число трансгенных линий каждого фенотипа обозначено цифрами.
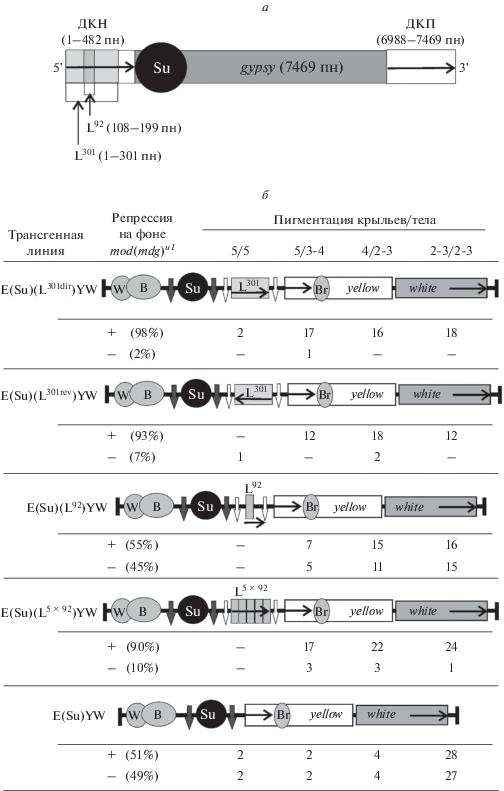
В подавляющем большинстве линий (от 90 до 98%) E(Su)(L301dir)YW, E(Su)(L301rev)YW и E(Su)(L5 × 92)YW от 60 до 100% щетинок у мух имели желтую окраску, т.е. наблюдалась Su(Hw)-зависимая репрессия. В линиях E(Su)(L92)YW и E(Su)YW Su(Hw)-зависимая репрессия наблюдалась лишь в половине случаев (55–51%). Интересно, что Su(Hw)-зависимая репрессия не была тесно связана с инсуляцией. Для каждой конструкции были получены линии с желтой окраской тела и крыльев, т.е. с эффективной инсуляцией, и линии с промежуточной или даже очень слабой инсуляцией, в которых тело и крылья мух имели темную окраску. При этом депигментация щетинок на фоне мутации mod(mdg4)u1 наблюдалась в обоих случаях.
Затем мы протестировали частоту проявления EAST-зависимой репрессии в полученных линиях (табл. 1). Для каждой из тестируемых конструкций мы отобрали самцов из линий с разной степенью Su(Hw)-зависимой репрессии и скрестили их с самками линии y2w1118;P{w+east+}/CyO; P{w+east+}/TM6,Tb, где P{w+east+} обозначает конструкцию, оверэкспрессирующую белок EAST. В F1 потомстве этого скрещивания мы получили мух y2w1118;P{w+east+}/+;P{w+east+}/P{y+w+},mod(mdg4)u1 либо y2w1118;P{w+east+}/P{y+w+}; P{w+east+}/ mod(mdg4)u1. Мутация mod(mdg4)u1 является рецессивной, поэтому в гетерозиготных по ней линиях Su(Hw)-зависимая репрессия не проявляется. Таким образом, депигментация щетинок в линиях, где суперэкспрессировался белок EAST, была связана только с EAST-зависимой репрессией. В результате EAST-зависимая репрессия возникала почти во всех линиях E(Su)(L301dir)YW, E(Su)(L301rev)YW и E(Su)(L5 × 92)YW, где наблюдалась Su(Hw)-зависимая репрессия, и не проявлялась ни в одной линии, где на фоне мутации mod(mdg4)u1 щетинки оставались черными (табл. 1). Среди линий E(Su)(L92)YW и E(Su)YW обнаружились отдельные линии, в которых не проявлялась Su(Hw)-зависимая репрессия, но наблюдалась слабая EAST-зависимая репрессия, т.е. на фоне суперэкспрессии белка EAST около 30–40% щетинок у мухи становились непигментированными. При этом EAST-зависимая репрессия возникала только в половине mod(mdg4)u1-чувствительных линий E(Su)YW.
Таблица 1.
Su(Hw)-зависимая и EAST-зависимая репрессия в трансгенных линиях
| Трансгенная линия | mod(mdg4)u1 | Число линий | EAST+ | EAST– |
|---|---|---|---|---|
| E(Su)(L301dir)YW | + | 32 | 29 | 3 |
| – | 1 | 0 | 1 | |
| E(Su)(L301rev)YW | + | 30 | 26 | 4 |
| – | 3 | 0 | 3 | |
| E(Su)(L92)YW | + | 20 | 18 | 2 |
| – | 20 | 3 | 17 | |
| E(Su)(L5 × 92)YW | + | 23 | 21 | 2 |
| – | 7 | 0 | 7 | |
| E(Su)YW | + | 28 | 13 | 15 |
| – | 26 | 2 | 24 |
Примечание. В первой колонке указано название трансгенов; во второй колонке знаком “+” обозначены линии, в которых на фоне мутации mod(mdg4)u1 наблюдалась репрессия, обусловленная инсулятором Su(Hw), а знаком “–” – линии, в которых такая репрессия отсутствовала; в третьей колонке указано число проанализированных линий каждого из двух фенотипов; в четвертой колонке указано число линий, в которых на фоне суперэкспрессии белка EAST возникала EAST-зависимая репрессия, а в пятой колонке – число линий, где такая репрессия не проявлялась.
Чтобы выяснить, не связана ли наблюдаемая репрессия с транспозициями конструкций в области репрессионного хроматина, мы выбрали линии с различной степенью Su(Hw)-зависимой и EAST-зависимой репрессии и картировали в них места встраивания соответствующих трансгенов (табл. 2). Для этого использовалась обратная ПЦР с последующим секвенированием амплифицированных последовательностей ДНК (стандартный протокол из Berkeley Drosophila Genome Project http://www.fruitfly.org/about/methods/inverse.pcr.html). Проанализировав полученные данные, мы не обнаружили какой-либо закономерности в геномном распределении линий с различной степенью репрессии. Также не наблюдалось зависимости между местом инсерции трансгена и силой инсуляции. Однако даже в линиях с ярко выраженной репрессией не наблюдалась специфическая репрессия маркирующего конструкции гена miniwhite. Следовательно, трансгены не были интегрированы в геномные районы, способные вызывать репрессию транскрипции, например в теломерные повторы, HP1-обогащенные эухроматиновые районы, области мобильных элементов или PREs (Polycomb Response Elements) [14–18].
Таблица 2.
Результаты картирования сайтов интеграции трансгенов в геном
| Локализация трансгена |
Пигментация крыльев/тела |
mod(mdg4)u1 | EAST | Место инсерции |
|---|---|---|---|---|
| E(Su)(L301dir)YW | ||||
| 3L:14724091 70F1 |
2/2 | + | + | Промотор гена ome |
| 3L:24301156 – |
5/5 | + | + | Между генами Snap25 и nvd |
| 3R:29933264 99C7 |
5/3 | + | + | Промотор гена CG42557 |
| 2R:12880267 49D7 |
3/2 | – | – | Промотор гена Nmda1 |
| E(Su)(L301rev)YW | ||||
| 3L:5745556 64E5 |
5/4 | + | – | Интрон гена Usp47 |
| 3L:7643395 66A8 |
5/3 | + | + | Между генами CG7506 и CG32373 |
| 3L:16799603 73С4 |
2/2 | + | + | Интрон гена CG9674 |
| 3R:11963458 87A3 |
4/3 | – | – | Интрон гена aurA |
| 2R:17600788 54С12 |
3/2 | – | – | Экзон гена Smurf |
| E(Su)(L92)YW | ||||
| 2R:14390912 51A1 |
4/2 | + | + | Экзон гена CG10104 |
| 2R:170094305 53F7 |
3/3 | – | – | Интрон гена GstS1 |
| E(Su)(L5 × 92)YW | ||||
| 3R:11568231 86Е10-86E11 |
4/3 | + | + | Между генами sea и Mrp4 |
| 2L:4822056 25A7 |
5/4 | + | + | 5'UTR гена CG15628 |
| 2R:19502394 56D14 |
4/2 | – | – | Между генами CG16926 и CG11007 |
| 2L:21221379 39B3 |
5/3 | – | – | 5'UTR гена CG8677 |
| E(Su)YW | ||||
| 3R:29157638 98F13 |
2/2 | + | + | Между генами Rpn2 и CG11897 |
| 3R:16195331 89B12-89B7 |
3/2 | + | + | Интрон гена sra |
| 2R:6501998 42B1-42B2 |
4/3 | + | + | Промотор гена jing |
| 3R:25065834 96B19 |
2/2 | – | – | 5'UTR гена PQBP1 |
| 3R:12369293 87B8 |
3/2 | – | – | Промотор гена GstD1 |
| 3R:19190344 91F11 |
4/3 | – | – | Интрон гена CG31475 |
Примечание. Пигментация крыльев и тела обозначена как на рис. 1. Знаками “+” и “–” обозначено проявление репрессии на фоне мутации mod(mdg4)u1 или на фоне суперэкспрессии белка EAST. Места встраивания конструкций определяли с помощью базы данных Flybase R5.13 (www.flybase.org).
Известно, что в интерфазе хромосомы занимают в пространстве ядра определенные локации – хромосомные территории. Расположение участков хромосом влияет на возможность протекания trans-взаимодействий и определяет активный или репрессированный статус геномного локуса [19, 20]. Перемещение участков хромосом между хромосомными территориями приводит к изменению активности генов [21, 22]. Например, активно транскрибирующийся на данной стадии развития ген может перемещаться во внутриядерные скопления транскрипционных комплексов, так называемые транскрипционные фабрики [23]. В свою очередь, инактивация транскрипции достигается привлечением локуса в репрессионные ядерные структуры.
Полученные результаты показывают, что в случае присутствия в составе конструкций E(Su)(L301dir)YW, E(Su)(L301rev)YW и E(Su)(L5 × 92)YW фрагментов ДКП EAST-зависимая репрессия и Su(Hw)-зависимая репрессия возникают почти во всех трансгенных линиях. Следовательно, можно предположить, что обусловливающие, как было показано ранее, EAST-зависимую репрессию последовательности ДНК [11] способствуют встраиванию трансгена в локусы, находящиеся в наиболее доступной для репрессионных факторов области ядра, где возможны сборка и функционирование любых репрессионных комплексов.
При транспозиции конструкции E(Su)(L92)YW, содержащей маленький фрагмент ДКП, недостаточный для обеспечения стабильной EAST-зависимой репрессии, и конструкции E(Su)YW, включающей только последовательность Su(Hw)-инсулятора, Su(Hw)-зависимая репрессия наблюдается лишь в половине линий. При этом в линиях E(Su)YW нет взаимосвязи между EAST-зависимой и Su(Hw)-зависимой репрессиями. Это свидетельствует о случайном характере транспозиций.
В сумме результаты работы доказывают, что на последовательность ДКП МГД4 рекрутируется белковый комплекс, который не только функционально взаимодействует с белком EAST, но и обусловливает локализацию трансгенов в репрессионных компартментах ядра. Такой комплекс может связываться с хроматином через белок Mad, сайт связывания которого в составе ДКП ретротранспозона МДГ4 был локализован нами ранее [12].
Исследование выполнено за счет гранта Российского научного фонда (проект № 18-14-00295).
Список литературы
Wasser M., Chia W. The EAST protein of drosophila controls an expandable nuclear endoskeleton // Nat. Cell Biol. 2000. V. 2. P. 268–275. doi 10.1038/ 35010535
Golovnin A., Melnikova L., Shapovalov I. et al. EAST organizes drosophila insulator proteins in the interchromosomal nuclear compartment and modulates CP190 binding to chromatin // PLoS One. 2015. V. 10. e0140991. doi 10.1371/journal.pone.0140991
Melnikova L., Shapovalov I., Kostyuchenko M. et al. EAST affects the activity of Su(Hw) insulators by two different mechanisms in Drosophila melanogaster // Chromosoma. 2017. V. 126. P. 299–311. doi 10.1007/ s00412-016-0596-3
Spana C., Corces V.G. DNA bending is a determinant of binding specificity for a Drosophila zinc finger protein // Genes Dev. 1990. V. 4. P. 1505–1515.
Gause M., Morcillo P., Dorsett D. Insulation of enhancer-promoter communication by a gypsy transposon insert in the Drosophila cut gene: cooperation between suppressor of hairy-wing and modifier of mdg4 proteins // Mol. Cell Biol. 2001. V. 21. P. 4807–4817. doi 10.1128/MCB.21.14.4807-4817.2001
Pai C.Y., Lei E.P., Ghosh D., Corces V.G. The centrosomal protein CP190 is a component of the gypsy chromatin insulator // Mol. Cell. 2004. V. 16. P. 737–748. doi 10.1016/j.molcel.2004.11.004
Geyer P.K., Corces V.G. Separate regulatory elements are responsible for the complex pattern of tissue-specific and developmental transcription of the yellow locus in Drosophila melanogaster // Genes Dev. 1987. V. 1. P. 996–1004.
Geyer P.K., Spana C., Corces V.G. On the molecular mechanism of gypsy-induced mutations at the yellow locus of Drosophila melanogaster // EMBO J. 1986. V. 5. P. 2657–2662.
Georgiev P., Kozycina M. Interaction between mutations in the suppressor of Hairy wing and modifier of mdg4 genes of Drosophila melanogaster affecting the phenotype of gypsy-induced mutations // Genetics. 1996. V. 142. P. 425–436.
Мельникова Л.С., Кривега И.В., Георгиев П.Г., Головнин А.К. Белок ядерного матрикса EAST участвует в регуляции транскрипции гена yellow у Drosophila melanogaster // ДАН. 2007. Т. 415. № 5. С. 1–4.
Мельникова Л.С., Костюченко М.В., Кривега И.В. и др. Картирование последовательности в ретротранспозоне МДГ4, отвечающей за EAST-зависимую репрессию в модельной системе гена yellow у Drosophila melanogaster // Генетика. 2017. Т. 53. № 9. С. 1042–1052.
Головнин А.К., Молодина В.В., Шаповалов И.С. и др. Последовательность ДКП ретротранспозона МДГ4 содержит сайт связывания белка MAD, усиливающий EAST-зависимую репрессию // ДАН. 2017. Т. 473. № 3. С. 365–369.
Robertson H.M., Preston C.R., Phillips R.M. et al. A stable genomic source of P element transposase in Drosophila melanogaster // Genetics. 1988. V. 118. P. 461–470.
Cryderman D.E., Morris E.J., Biessmann H. et al. Silencing at Drosophila telomeres: nuclear organization and chromatin structure play critical roles // EMBO J. 1999. V. 18. P. 3724–3735.
Fanti L., Berloco M., Piacentini L., Pimpinelli S. Chromosomal distribution of Heterochromatin Protein 1 (HP1) in Drosophila: a cytological map of euchromatic HP1 binding sites // Genetica. 2003. V. 117. P. 135–147.
Carmena M., González C. Transposable elements map in a conserved pattern of distribution extending from beta-heterochromatin to centromeres in Drosophila melanogaster // Chromosoma. 1995. V. 103. P. 676–684.
Четверина Д.А., Елизарьев П.В., Ломаев Д.В. и др. Контроль активности генов белками групп Polycomb и Trithorax у Drosophila // Генетика. 2017. Т. 53. № 2. С. 133–154.
Erokhin M., Georgiev P., Chetverina D. Drosophila DNA-binding proteins in polycomb repression // Epigenomes. 2018. V. 2. № 1. doi 10.3390/epigenomes2010001
Cremer T., Kupper K., Dietzel S., Fakan S. Higher order chromatin architecture in the cell nucleus: on the way from structure to function // Biol. Cell. 2004. V. 96. P. 555–567. doi 10.1016/j.biolcel.2004.07.002
Fraser P., Bickmore W. Nuclear organization of the genome and the potential for gene regulation // Nature. 2007. V. 447. P. 413–417. doi 10.1038/nature05916
Branco M.R., Pombo A. Intermingling of chromosome territories in interphase suggests role in translocations and transcription-dependent associations // PLoS Biol. 2006. V. 4. e138. doi 10.1371/journal.pbio.0040138
Chambeyron S., Bickmore W.A. Does looping and clustering in the nucleus regulate gene expression? // Curr. Opin. Cell Biol. 2004. V. 16. P. 256–262. doi 10.1016/ j.ceb.2004.03.004
Chakalova L., Fraser P. Organization of transcription // Cold Spring Harb. Perspect. Biol. 2010. V. 2. a000729. doi 10.1101/cshperspect.a000729
Дополнительные материалы отсутствуют.


