Генетика, 2019, T. 55, № 6, стр. 714-719
Генетическая дифференциация рододендрона золотистого (Rhododendron aureum Georgi) по ядерным микросателлитным локусам
М. А. Полежаева 1, 2, *, Н. А. Тихонова 3, М. В. Модоров 1, М. Н. Ранюк 1, О. С. Корчагина 1
1 Институт экологии растений и животных Уральского отделения
Российской академии наук
620144 Екатеринбург, Россия
2 Институт биологических проблем Севера Дальневосточного отделения
Российской академии наук
685000 Магадан, Россия
3 Институт леса им. В.Н. Сукачева Сибирского отделения
Российской академии наук
660036 Красноярск, Россия
* E-mail: polezhaevam@mail.ru
Поступила в редакцию 06.07.2018
После доработки 26.09.2018
Принята к публикации 09.10.2018
Аннотация
Проведен анализ генетической изменчивости восьми выборок (63 особей) широкоареального вида Rhododendron aureum – одного из ведущих компонентов горных экосистем Сибири и Дальнего Востока. По данным полиморфизма пяти локусов ядерных микросателлитов выявлен высокий уровень генетического разнообразия в популяциях из Сибири (Западный и Восточный Саяны) и Камчатки (средние значения Но = 0.667, Не = 0.638). AMOVA показал, что около 16% генетического разнообразия приходится на межпопуляционные различия (Fst = 0.161, p = 0.001). Установлено, что вид имеет неоднородную генетическую структуру – образцы с Камчатки образуют отдельный кластер и демонстрируют высокую гомогенность, а образцы из Западной и Восточной Сибири имеют смешанное происхождение. Полученные результаты указывают на перспективность использования данного типа маркеров для широкомасштабных исследований R. аureum с целью реконструкции истории расселения вида.
Рододендрон золотистый (Rhododendron aureum Georgi, сем. Ericaceae) – вечнозеленый кустарник, обычно распространенный в высокогорном альпийском и субальпийском поясах до 2700 м над уровнем моря в зарослях кедрового стланика. Часто спускается в верхние части лесного пояса, произрастает на болотах, в кустарничковых тундрах. Обладая пластичной жизненной формой, в зависимости от местообитания представлен различными экобиоморфами – от небольшого кустарничка до 30 см до почти 2-метрового кустарника [1].
Вид имеет широкий ареал: Западная Сибирь (Алтай), Восточная Сибирь (Саяны, Прибайкалье, Забайкалье, Восток Якутии), Дальний Восток, включая Чукотку, Камчатку, Сахалин, Курильские и Командорские о-ва. Известно изолированное местонахождение в горах Путорана. За пределами России произрастает в Монголии, Корее, Китае, Японии.
Рододендрон золотистый – ведущий компонент высокогорных экосистем. Обладает ландшафтнообразующей функцией в условиях сурового климата: поддерживает экологический баланс, формирует специфический почвенный микробиом, предотвращает эрозию почв [2]. Наряду со многими альпийскими видами, рододендрон золотистый имеет значение в качестве модельного объекта-индикатора климатических колебаний, происходивших как в прошлом, так и в настоящее время [3, 4]. Кроме того, растительное сырье данного вида содержит ряд биохимических веществ, обладающих фармакологическими свойствами [5], что вместе с высокой декоративностью обуславливает антропогенную нагрузку на некоторые его популяции. Вид включен в красные книги ряда субъектов РФ (Кемеровской, Читинской областей, Забайкальского края, Агинского Бурятского АО).
Популяционно-генетические исследования R. aureum необходимы для оценки адаптивного потенциала вида в условиях изменения окружающей среды и определения статуса популяций для разработки форм охраны их ресурсов. Фундаментальный интерес исследования связан с пополнением перечня модельных объектов широкоареальных растений, генетическая структура которых отражает процессы изменения климата в истории и, таким образом, удобных для реконструкции динамики растительности Северной Евразии в плейстоцене–голоцене [6, 7].
Исследования генетического и популяционного разнообразия различных представителей рода Rhododendron многочисленны [8–12 и др.], однако для R. aureum они практически отсутствуют [13–17]. В данном исследовании было решено использовать мультилокусный анализ микросателлитов ядерной ДНК. Генетическое разнообразие R. aureum по данному типу маркеров изучено лишь в единичных популяциях из Японии, Китая и о. Сахалин [15–17]. Знания о генетической изменчивости и популяционной структуре R. aureum на всем ареале позволит реконструировать историю расселения вида.
Цель данной работы – оценка параметров генетической изменчивости и степени популяционной дифференциации рододендрона золотистого в Сибири и на Камчатке с использованием локусов ядерных микросателлитов.
В анализ были включены данные по 63 растениям рододендрона золотистого: четыре выборки (32 растения) из Западного Саяна, две выборки (15 растений) из Восточного Саяна, две выборки (16 растений) с п-ва Камчатка. Местоположение и географические координаты указаны в табл. 1. Для анализа ДНК использовали высушенные в силикагеле листья. ДНК выделяли по стандартному протоколу для растительных тканей (СТАВ-метод) [18]. Исследованы локусы, разработанные для R. aureum и R. brachycarpum: RD4, RD8, RDE12 [16] и RA20, RA31 [17]. Условия ПЦР описаны в [16, 17]. Длины амплифицированных фрагментов определяли на Genetic Analyzer 3130 (Applied Biosystems, США) в присутствии маркера молекулярной массы S-450 (Гордиз, Россия). Хроматограммы расшифровывали в программе GeneMapper v. 4.0.
Таблица 1.
Параметры генетического разнообразия микросателлитных локусов в выборках Rhododendron aureum
| № п.п. | Популяция | Координаты, с.ш./в.д. | N | Na | Ne | Но | Не | F ± SE |
|---|---|---|---|---|---|---|---|---|
| 1 | Красноярский край, Западный Саян, Ергаки, Тармазаковский мост | 52°85′/92°41′ | 8 | 4.20 | 2.68 | 0.650 | 0.616 | –0.059 ± 0.086 |
| 2 | Красноярский край, Западный Саян, Каменный городок | 52°53′/92°54′ | 10 | 3.40 | 2.35 | 0.540 | 0.565 | 0.030 ± 0.144 |
| 3 | Западный Саян I | 52°81′/93°12′ | 10 | 4.00 | 2.70 | 0.620 | 0.607 | –0.020 ± 0.067 |
| 4 | Западный Саян II | 51°59′/93°07′ | 4 | 3.60 | 2.89 | 0.750 | 0.644 | –0.178 ± 0.064 |
| 5 | Республика Бурятия, Восточный Саян, граница с Республикой Тува | 52°30′/98°78′ | 4 | 3.60 | 2.81 | 0.750 | 0.613 | –0.115 ± 0.282 |
| 6 | Республика Тува, Восточный Саян, хр. Обручева | 52°03′/94°07′ | 11 | 4.40 | 2.71 | 0.655 | 0.618 | –0.077 ± 0.133 |
| 7 | Камчатский кр., вулк. Авачинский | 53°21′/158°75′ | 10 | 5.20 | 3.79 | 0.780 | 0.710 | –0.116 ± 0.118 |
| 8 | Камчатский кр., гора Вокчажец | 53°07′/157°93′ | 6 | 4.60 | 3.91 | 0.667 | 0.733 | 0.093 ± 0.088 |
| В среднем | 4.13 (0.180) | 2.98 (0.142) | 0.667 (0.031) | 0.638 (0.015) | –0.055 ± 0.047 |
Для расчета параметров генетического разнообразия, индекса фиксации Райта, дифференциации популяций, анализа иерархической структуры изменчивости (AMOVA), PCA-анализа матрицы генетических расстояний, сравнения генетических и географических расстояний с помощью теста Мантела была использована программа GenAlEx 6.5 [19]. Анализ генетической структуры всей исследуемой выборки без учета их популяционной принадлежности проводили в программе STRUCTURE 2.2 с использованием байесовского алгоритма кластеризации, применяющего марковские цепи [20]. На основании данных о генотипах метод разделяет выборку на заданное число кластеров (K), определяя для каждой особи вероятность отнесения к тому или иному кластеру. Алгоритм был повторен 5 раз для значений К от 2 до 5 при использовании модели “admixture” (учитывает вероятное смешанное происхождение образцов при условии независимости частот аллелей между кластерами) с количеством итераций 100 000, первые 10 000 итераций отбрасывали. Выбор оптимального числа групп осуществляли в программе Structure harvest [21], реализующей метод, предложенный Эвано с соавт. [22].
Все отобранные микросателлитные локусы обнаружили изменчивость в исследуемых образцах. Количество выявленных аллелей в локусах по всем выборкам варьирует от 6 до 13: локус RD4 – выявлено 6 аллелей, RD8 – 13 аллелей, RDE12 – 9 аллелей, RA20 – 10 аллелей, RA31 – 11 аллелей. Всего при анализе пяти микросателлитных локусов идентифицировано 49 аллельных вариантов, из них девять встречаются во всех выборках. Среднее число аллелей на локус варьирует в выборках от 3.40 до 5.20, эффективное число аллелей – от 2.35 до 3.91. Максимальные значения этих параметров выявлены в выборках с Камчатки. Значения наблюдаемой и ожидаемой гетерозиготности высоки и варьируют соответственно от 0.540 до 0.780 и от 0.565 до 0.733. Средние значения этих показателей составляют: Na = 4.13, Ne = 2.98, Ho = 0.667, He = 0.638.
Среднее значение индекса фиксации F равно –0.055, что указывает на небольшой переизбыток гетерозиготных генотипов. Средние значения Fis и Fit, отражающие соответственно инбридинг особи относительно популяции и инбридинг особи относительно вида в целом, равны –0.059 (SE = 0.052) и 0.144 (SE = 0.053). Генетическая дифференциация между всеми анализируемыми выборками составила 16% (Fst = 0.161, p = 0.001) с учетом камчатских популяций и 7% (Fst = 0.071, p = 0.001) при их исключении. Иерархический анализ AMOVA показал, что на долю изменчивости между тремя географическими регионами (Западный Саян, Восточный Саян, Камчатка) приходится 17% от выявленной изменчивости. Остальная изменчивость (83%) сосредоточена внутри популяций. Наибольший вклад в межпопуляционную дифференциацию вносят локусы RDE12 и RA20 (25.0 и 23.6% соответственно).
Генетические дистанции D Нея [23] между популяциями варьируют от 0.054 до 2.349. Согласно тесту Мантела [24], генетическое расстояние между популяциями обнаруживает статистически значимую связь с географическим расстоянием между ними: r = 0.959, p = 0.013 с учетом камчатских популяций, r = 0.684, p = 0.045 – при их исключении. Наибольшие дистанции характерны для выборки с Камчатки со всеми остальными выборками (D варьирует от 1.246 до 2.349). Низкий уровень различий выявлен между выборками в пределах Западного Саяна (D варьирует от 0.054 до 0.269). Чуть выше он между двумя выборками Восточного Саяна (D = 0.577). В целом между выборками Западного и Восточного Саяна D варьирует от 0.201 до 0.534.
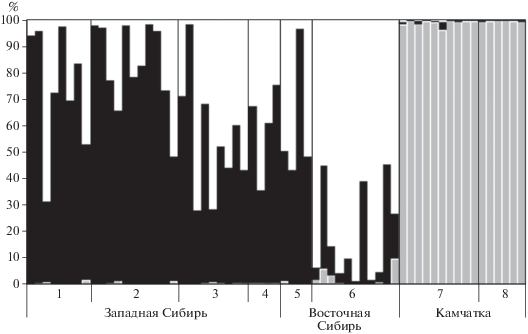
На основании генетических расстояний проведен анализ популяционной структуры вида методом главных координат. На ординации большая часть проанализированных выборок формирует слабодифференцированную группу, выборки с Камчатки значительно удалены. Большая часть изменчивости – 73.59% приходится на первую ось, на вторую – 10.87% (рисунок не приводится). Аналогичные результаты получены с использованием алгоритма Байеса. Максимальное значение логарифма апостериорной вероятности было получено для трех групп (K = 3). Это означает, что с максимальной вероятностью выборка может быть разделена на три генетических кластера (рис. 1). Все образцы с Камчатки с высокой вероятностью отнесены к единому кластеру (рис. 1). Образцы из Западной и Восточной Сибири имеют смешанную генетическую природу. Наблюдается тенденция к дифференциации выборки из Восточного Саяна (хр. Обручева), однако в силу малочисленности особей ее невозможно интерпретировать однозначно.
Рис. 1.
Вероятность отнесения 63 образцов Rhododendron aureum к одному из трех кластеров при “admixture” анализе в программе STRUCTURE по данным анализа пяти микросателлитных локусов. Каждый вертикальный столбец соответствует одному образцу, а относительная доля разных цветовых сегментов в нем обозначает вероятность принадлежности данного образца к соответствующему кластеру. 1–8 – номер популяции см. табл. 1.
Уровни изменчивости и подразделенности популяций рододендрона золотистого в Сибири и на Камчатке по маркерам ядерных микросателлитов близки к значениям, полученным ранее для других представителей рода. Так, для широкоареального европейского вида R. ferrugineum значения He составили 0.29–0.44 в Пиренеях, 0.37–0.68 в выборках из Альп и Апеннинского п-ва. Значение Fst между всеми выборками составило 0.095, доля изменчивости между региональными кластерами – 24% [11]. Схожий уровень гетерозиготности наблюдается также у ряда других видов рододендронов [8–10]. В нашем исследовании даже для малочисленных выборок рододендрона золотистого показан высокий уровень генетического разнообразия (табл. 1). Рядом авторов схожая картина наблюдалась для эндемичных или ограниченных по размеру популяций этого вида в Китае, Японии и на о-ве Сахалин [15–17].
Наблюдаемую дифференциацию между популяциями сибирского и дальневосточного регионов можно объяснить разделением общего ареала в истории крупными биогеографическими барьерами, таким как Верхоянский и Сихотэ-Алинский хребты. Многие исследования холодоустойчивых видов, бореального, альпийского и субальпийского поясов выявили их значительную генетическую подразделенность, связанную с историей последних оледенений [25–28].
В результате проведенного популяционно-генетического исследования рододендрона золотистого из сибирской и дальневосточной частей его ареала установлено, что микросателлитные локусы ядерной ДНК являются перспективными маркерами для широкомасштабных биогеографических исследований данного вида.
Работа (сбор образцов) выполнена в рамках государственного задания Института экологии растений и животных УрО РАН, проведение молекулярно-генетического анализа поддержано грантом РФФИ (№ 15-04-01640а).
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Александрова М.С. Рододендроны природной флоры СССР. М.: Наука, 1975. 112 с.
Wang X., Lin L., Zhao W. et al. Rhododendron aureum Georgi formed a special soil microbial community and competed with above-ground plants on the tundra of the Changbai Mountain, China // Ecol. Evol. 2017. V. 7. P. 7503–7514. https://doi.org/10.1002/ece3.3307
Sturm M., Racine C., Tape K. Climate change: Increasing shrub abundance in the Arctic // Nature. 2001. V. 411. P. 546–547. https://doi.org/10.1038/35079180
Tape K.D., Hallinger M., Welker J.M. et al. Landscape heterogeneity of shrub expansion in Arctic Alaska // Ecosystems. 2012. V. 15. P. 711–724. https://doi.org/10.1007/ s10021-012-9540-4
Olennikov D.N., Dudareva L.V., Osipenko S.V., Penzina T.A. Chemical composition of Rhododendron aureum (gold rosebay) essential oil from Pribaikal’e (Russian Federation) // J. Serb. Chem. Soc. 2010. V. 75. P. 209–215.
Hewitt G. The genetic legacy of the Quaternary ice ages // Nature. 2000. V. 405. P. 907–913. https://doi.org/10.1038/35016000
Abbott R.J., Smith L.C., Milne R.I. et al. Molecular analysis of plant migration and refugia in the Arctic // Science. 2000. V. 289. P. 1343–1346. https://doi.org/10.1126/science.289.5483.1343
Naito K., Isagi Y., Kameyama Y., Nakagoshi N. Population structures in Rhododendron metternichii var. hondoense assessed with microsatellites and their implication for conservation // J. Plant Res. 1999. V. 112. P. 405–412. https://doi.org/10.1007/PL00013895
Tan X.X., Li Y., Ge X.J. Development and characterization of eight polymorphic microsatellites for Rhododendron simsii Planch (Ericaceae) // Conserv.Genet. 2009. V. 10. P. 1553–1555. doihttps://doi.org/ 10.1007/s10592-008-9791-y
Wang X.Q., Huang Y., Long C.L. Assessing the genetic consequences of flower-harvesting in Rhododendron decorum Franchet (Ericaceae) using microsatellite markers // Biochem. Syst. Ecol. 2013. V. 50. P. 296–303. https://doi.org/10.1016/j.bse.2013.04.009
Charrier O., Dupont P., Pornon A., Escaravage N. Microsatellite marker analysis reveals the complex phylogeographic history of Rhododendron ferrugineum (Ericaceae) in the Pyrenees // PLoS One. 2014. V. 9. e92976. https://doi.org/10.1371/journal.pone.0092976
Polezhaeva M.A., Pimenova E.A., Tikhonova N.A. et al. Plastid DNA diversity and genetic divergence within Rhododendron dauricum s.l. (R. dauricum s.s., R. ledebourii, R. sichotense and R. mucronulatum; Ericaceae) // Plant Syst. Evol. 2018. V. 304. P. 763–774. https://doi.org/10.1007/ s00606-018-1508-1
Hirao A.S., Kameyama Y., Ohara M. et al. Seasonal changes in pollinator activity influence pollen dispersal and seed production of the alpine shrub Rhododendron aureum (Ericaceae) // Mol. Ecol. 2006. V.15. P. 1165–1173. https://doi.org/10.1111/j.1365-294X.2006.02853.x
Wang X., Zhao W., Li L. et al. Clonal plasticity and diversity facilitates the adaptation of Rhododendron aureum Georgi to alpine environment // PLoS One. 2018. V. 13. e0197089. https://doi.org/10.1371/journal.pone.0197089
Liu Y.-F., Xing M., Zhao W. et al. Genetic diversity analysis of Rhododendron aureum Georgi (Ericaceae) located on Changbai Mountain using ISSR and RAPD markers // Plant. Syst. Evol. 2012. V. 298. P. 921–930. https://doi.org/10.1007/s00606-012-0601-0
Li L.-F., Song N., Tang E.H., Xiao H.X. Genomic and EST microsatellites for Rhododendron aureum (Ericaceae) and cross-amplification in other congeneric species // Amer. J. Bot. 2011. V. 98. P. 250–252. https://doi.org/10.3732/ajb.1100153
Kwak M., Won H., Hong J., Lee B.Y. Isolation and characterization of 19 novel microsatellite loci in Rhododendron aureum and Rhododendron brachycarpum (Ericaceae) // Biochem. Syst. and Ecol. 2015. V. 61. P. 520–523. https://doi.org/10.1016/j.bse.2015.07.011
Devey M.E., Bell J.C., Smith D.N. et al. A genetic linkage map for Pinus radiata based on RFLP, RAPD and microsatellite markers // Theor. Appl. Genet. 1996. V. 92. P. 673–679.
Peakall R., Smouse P.E. GenALex 6: Genetic analysis in Excel. Population genetic software for teaching and research // Mol. Ecol. Notes. 2006. V. 6. P. 288–295. https://doi.org/10.1111/j.1471-8286.2005.01155.x
Pritchard J.K., Stephens M., Donnelly P. Inference of population structure using multilocus genotype data // Genetics. 2000. V. 155. P. 945–959.
Earl D.A., von Holdt B.M. Structure harvester: a website and program for visualizing STRUCTURE output and implementing the Evanno method // Conserv. Genet. Res. 2012. V. 4. P. 359–361. https://doi.org/10.1007/s12686-011-9548-7
Evanno G., Regnaut S., Goudet J. Detecting the number of clusters of individuals using the software structure: a simulation study // Mol. Ecol. 2005. V. 14. P. 2611–2620. doi 10.1111/j.1365-294X.2005.02553.x
Nei M. Genetic distance between populations // Amer. Naturalist. 1972. V. 106. P. 283–292.
Mantel N. The detection of disease clustering and a generalized regression approach // Cancer Res. 1976. V. 27. P. 209–220.
Alsos I.G., Engelskjøn T., Gielly L. et al. Impact of ice ages on circumpolar molecular diversity: insights from an ecological key species // Mol. Ecol. 2005. V. 14. P. 2739–2753. https://doi.org/10.1111/j.1365-294X.2005.02621.x
Eidesen P.B., Alsos I.G., Popp M. et al. Nuclear vs plastid data: Complex Pleistocene history of a circumpolar key species // Mol. Ecol. 2007. V. 16. P. 3902–3925. https://doi.org/10.1111/j.1365-294X.2007.03425.x
Polezhaeva M.A., Lascoux M., Semerikov V.L. Cytoplasmic DNA variation and biogeography of Larix Mill. in Northeast Asia // Mol. Ecol. 2010. V. 19. P. 1239–1252. https://doi.org/10.1111/j.1365-294X.2010.04552.x
Hantemirova E.V., Heinze B., Knyazeva S.G. et al. A new Eurasian phylogeographical paradigm? Limited contribution of southern populations to the recolonization of high latitude populations in Juniperus communis L. (Cupressaceae) // J. Biogeogr. 2016. https://doi.org/10.1111/ jbi.12867
Дополнительные материалы отсутствуют.


