Генетика, 2019, T. 55, № 8, стр. 887-892
О возможности экспериментальной модификации импринтинга у апомиктичных растений
В. А. Соколов 1, 2, *, Э. А. Абдырахманова 1
1 Институт молекулярной и клеточной биологии Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
2 Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений
им. Н.И. Вавилова
190000 Санкт-Петербург, Россия
* E-mail: sokolov@mcb.nsc.ru
Поступила в редакцию 06.12.2018
После доработки 18.02.2019
Принята к публикации 19.03.2019
Аннотация
Показана возможность экспериментальной модификации экспрессии геномного импринтинга у апомиктичных гибридов кукурузы с гамаграссом посредством воздействия синтетическим нуклеозидом 5-азацитидином (AZ), ингибирующим метилирование ДНК. У покрытосеменных растений с двойным оплодотворением соотношение материнских и отцовских геномов в клетках эндосперма как правило 2F : 1M соответственно. При этом любые отклонения от него чаще всего приводят к абортивности семян. Апомиктичные псевдогамные растения, у которых для развития зерновок требуется оплодотворение эндосперма, выработали различные механизмы преодоления негативного эффекта импринтинга, связанного с отклонением в соотношении родительских геномов в эндосперме от 2 : 1. Тем не менее у такого апомикта как тетраплоидный гамаграсс (Tripsacum dactyloides) в силу значительного отклонения в соотношении геномов в эндосперме только около 25% зерновок оказываются жизнеспособными и дают проростки. Такая же картина характерна и для его апомиктичных гибридов с кукурузой. Была предпринята попытка с помощью 5-азацитидина модифицировать женское импринтирование и усилить экспрессию генов, доза которых недостаточна в силу несоответствия числа отцовских геномов требуемому соотношению. Полученные результаты позволяют говорить о возможности модификации экспрессии импринтинга. При этом эффект 5-азацитидина обнаруживается как в М1, так и в последующих трех поколениях. В М2 выделены семьи, в которых по сравнению с контролем достоверны не только разница средних, но и частотный характер опытных и контрольных распределений по признаку “масса зерновки”.
Одним из активно изучаемых проявлений эпигенетической регуляции является геномный импринтинг. По своей сути это феномен, определяющий неодинаковую экспрессию родительских генов у потомков [1–3]. Примечательно, что он эволюционно независимо возник у цветковых растений и плацентарных животных. Для обеих этих форм возможно одновременное развитие потомства от разных отцов. Поэтому одна из наиболее обоснованных гипотез возникновения геномного импринтинга связана с исключением конкуренции потомков за пластические вещества за счет полиморфизма получаемых отцовских генов, хотя при этом не исключается влияние взаимодействия материнского организма с потомством [4–6], но проблема до настоящего времени остается дискуссионной [7–9] и по всей видимости далека от решения [10]. Иногда эффекты, имеющие родительское происхождение при реципрокных скрещиваниях, могут давать различающиеся фенотипы; это свидетельствует о том, что геномный импринтинг не ограничивается в своем проявлении только стадией раннего развития эндосперма и зародыша [2].
Интерес к этому феномену у животных прежде всего связан с его определяющим значением в успехе транснуклеарных манипуляций и перспективами использования стволовых клеток. Практическое значение у растений определяется его воздействием на физические размеры эндосперма как запасающего органа и на качество его компонентов, особенно переваримость запасных белков [3]. Эффект импринтинга проявляется в избирательной и неодинаковой экспрессии материнских и отцовских аллелей генов у потомков [1, 2, 5]. В основном он реализуется путем метилирования цитозина в GC и GNC островках и гистона Н3, что приводит к полному или частичному блокированию транскрипции структурных генов [9, 11]. Необходимо подчеркнуть, что это единственная изученная модификация ДНК, не нарушающая кодирования и полимеразного копирования. Одним из проявлений импринтинга являются различия в метилировании ДНК материнских и отцовских генеративных клеток. В итоге это приводит к неравной экспрессии их геномов у гибридов и отличиям в фенотипическом выражении родительских признаков. В случае эндосперма картина импринтинга усложняется дозовыми взаимодействиями родительских геномов. Для нормального развития эндосперма их соотношение должно быть 2F : 1M, т.е. два материнских к одному отцовскому. Особенно жестко это правило выполняется у злаков, для которых по этой причине крайне сложно получать интерплоидные гибриды [3]. Поскольку у апомиктов компоненты зародышевого мешка образуются из нередуцированной клетки, а пыльца гаплоидна, необходимы какие-то механизмы, позволяющие обходить действие геномного импринтинга [3]. По всей видимости, в этой связи у них сформировались различные механизмы преодоления дозового эффекта – тетраспорический зародышевый мешок с образованием центральной клетки на основе одного ядра (Pennisetum squamulatum), оплодотворение только одного полярного ядра (Dichantium annulatum), оплодотворение двумя спермиями у лютиков. У гамаграсса (Tripsacum dactyloides L.) и многих других покрытосеменных растений тетраплоидная центральная клетка оплодотворяется редуцированным спермием, что дает соотношение геномов 4F : 1M. Несмотря на столь сильное уклонение от требуемого 2F : 1M, они формируют значительный процент жизнеспособных семян. Можно предположить, что у этих апомиктов сформировались какие-то механизмы, позволяющие преодолевать дозовый эффект. Более того, у полученных нами гибридов кукурузы с гамаграссом удается получить жизнеспособные семена от опыления 69-хромосомных растений (60Zm + 9Td) диплоидной кукурузой. В этом случае отношение материнских к отцовским геномам кукурузы у потомков будет 12F : 1M. Тем не менее дозовые эффекты у гибридов имеют место, и при опылении 39-хромосомных линий (плоидность центральной клетки у них – 2n = 60Zm + 18Td) диплоидной и тетраплоидной кукурузой (2n = 4x = 40) мы наблюдаем достоверные различия по массе семян (табл. 1). Здесь следует подчеркнуть, что согласно ранее полученным данным при опылении пыльцой гетерозисного гибрида (2n = 20) масса получаемых семян была почти равна таковой у семян, получаемых от опыления тетраплоидом [12].
Таблица 1.
Влияние плоидности опылителя на массу зерновок у апомиктичных кукурузно-трипсакумных гибридов
| Линия | Опылитель | Число зерен | Масса зерновки, г | Завязываемость, % | |
|---|---|---|---|---|---|
| х ± m | лимиты | ||||
| 4х-6 (30Zm + 9Td) | Тп (2n = 4х) | 651 | 0.086 ± 0.002 | 0.001–0.170 | 44.1 ± 3.6 |
| 4х-6 (30Zm + 9Td) | М (2n = 2х) | 697 | 0.021 ± 0.001 | 0.001–0.140 | 48.0 ± 4.2 |
| Тп (2n = 4х = 40) | Тп (2n = 4х) | 178 | 0.243 ± 0.005 | 0.045–0.380 | 72.0 ± 7.1 |
| М (2n = 2х = 20) | М (2n = 2х) | 122 | 0.186 ± 0.004 | 0.060–0.285 | 65.5 ± 6.1 |
Таким образом, можно заключить, что у апомиктичных гибридов кукурузы и гамаграсса в присутствии некоторых хромосом дикого родителя экспрессия импринтинга и его строгая дозовая зависимость отличаются от наблюдаемых у диплоидной кукурузы. Возможно, что присутствие хромосом гамаграсса каким-то образом влияет на установку импринтного сигнала или модифицирует экспрессию генов, которые он модулирует.
Известно, что метилирование ДНК играет особую роль в регуляции экспрессии генов, репликации генома и клеточной дифференцировке у растений и животных [8, 9]. Для экспрессии многих генов необходимо, чтобы они были неметилированы [11]. У высших растений ДНК сильно метилирована по остаткам цитозина и частично аденина. Особенно интенсивно метилированы прицентромерные районы и траспозоны. Синтетический нуклеозид 5-азацитидин при репликации может включаться в ДНК, замещая в ней цитозиновые остатки. В местах такой замены метилирование ДНК с образованием остатков 5-метилцитозина становится невозможным [13]. Таким образом, происходит стирание маркирующего сигнала и изменение экспрессии импринтинга. Эти события можно уловить в М1 и, возможно, в последующих поколениях путем сравнения средней массы зерновок в контрольном и опытном вариантах. В настоящем сообщении мы приводим результаты нашего исследования по использованию 5-азацитидина для модификации импринтинга у апомиктичных гибридов кукурузы с гамаграссом.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом служили 39-хромосомные (30Zm + + 9Td) апомиктичные гибриды кукурузы Zea mays L. с гамаграссом Tripsacum dactyloides L. (линия 4х-6). Сухие семена предварительно стерилизовали обработкой ТМТД, а далее замачивали при комнатной температуре в бюксах с раствором 5-азацитидина в двух различных концентрациях – опыт-1 (1 мкМ) и опыт-2 (0.33 мкМ) (табл. 2). Время экспозиции 2–4 дня до стадии прорастания с периодическим подливанием раствора до исходного объема. Проклюнувшиеся зерновки переносили в чашки Петри с фильтровальной бумагой, смоченной дистиллированной водой, и проращивали в термостате при температуре 27°С. Контрольные семена (необработанные) проращивали в чашках Петри, замачивая их в дистиллированной воде.
Таблица 2.
Влияние 5-азацитидина (AZ) на выживаемость гибридов кукурузы с гамаграссом
| Вариант опыта | Опыт-1 | Опыт-2 | ||
|---|---|---|---|---|
| контроль | AZ | контроль | AZ | |
| Заложено зерновок | 24 | 37 | 20 | 33 |
| Проклюнулось зерновок | 24 | 36 | 20 | 33 |
| Погибло в чашках Петри | 0 | 6 | 0 | 3 |
| Погибло после посадки | 0 | 6 | 1 | 7 |
| Погибло всего | 0 (0%) | 12 (33%) | 1 (5%) | 10 (30%) |
| Число взрослых растений | 24 | 24 | 19 | 23 |
Гибриды кукурузы с гамаграссом имеют вегетационный период более пяти месяцев, поэтому в условиях Новосибирской области проростки сначала сажали в горшочки с землей в теплице, а затем растения высаживали на парниках селекционно-генетического комплекса ИЦиГ СО РАН. С каждого растения М1 семена убирали отдельно. Семена поколения М2 высевали в полевых условиях по семьям (потомство каждого растения М1). Поколения М2–М4 выращивали на экспериментальных полях Кубанской опытной станции ВИР (2004–2006 гг.). Контролем служили растения, выросшие из необработанных семян.
Так как апомиктичные гибриды являются мужскостерильными, то для формирования эндосперма зерновок необходимо оплодотворение центральной клетки зародышевого мешка пыльцой кукурузы. В качестве опылителей использовали диплоидный тестер Мангельсдорфа (2n = 2х = 20) и тетраплоидные формы кукурузы – тестер пурпуровый (2n = 4х = 40) и С-435 (номер каталога ВИРа).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как видно из табл. 2, при обработке 5-азацитидином гибнет около 30% проростков. Отсюда можно заключить, что данный агент является достаточно сильным токсическим соединением. Для оценки воздействия 5-азацитидина на М1 и последующие поколения использовали семена только второго опыта. Результаты этих наблюдений приведены в табл. 3.
Таблица 3.
Средняя масса зерновки в поколениях М1–М4 растений апомиктичной линии 4х-6 (30Zm + 9Td), обработанных 5-азацитидином в концентрации 0.33 мкМ (AZ), при их опылении тетраплоидной формой кукурузы (2n = 4x = 40)
| Номер семьи | М1 (AZ) | М2 (AZ) | М3 (AZ) | М4 (AZ) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| масса зерновки, г | лимиты, мг |
число зерен | масса зерновки, г | лимиты, мг |
число зерен | масса зерновки, г | лимиты, мг |
число зерен | масса зерновки, г | лимиты, мг |
число зерен | |
| 87 | 0.094 ± 0.007 | 7–155 | 36 | – | – | – | – | – | – | – | – | – |
| 88 | 0.084 ± 0.006 | 3–140 | 37 | 0.092 ± 0.004*** | 4–170 | 167 | 0.067 ± 0.005 | 2–130 | 42 | 0.086 ± 0.005*** | 2–165 | 116 |
| 90 | 0.113 ± 0.006*** | 15–165 | 34 | 0.093 ± 0.003*** | 2–195 | 279 | 0.065 ± 0.003 | 5–115 | 92 | 0.069 ± 0.005 | 2–140 | 74 |
| 94 | 0.061 ± 0.006 | 4–115 | 26 | 0.069 ± 0.002 | 2–175 | 345 | 0.052 ± 0.003 | 2–110 | 109 | – | – | – |
| 95 | 0.091 ± 0.007 | 10–145 | 33 | 0.081 ± 0.002*** | 2–175 | 472 | 0.061 ± 0.013 | 10–100 | 47 | – | – | – |
| 97 | 0.097 ± 0.005 | 4–140 | 43 | 0.075 ± 0.004 | 3–175 | 119 | 0.063 ± 0.010 | 10–110 | 11 | – | – | – |
| 98 | 0.081 ± 0.005 | 3–130 | 59 | 0.032 ± 0.002*** | 1–125 | 199 | – | – | – | – | – | – |
| 99 | 0.084 ± 0.005 | 3–135 | 39 | – | – | – | – | – | – | – | – | – |
| 100 | 0.116 ± 0.005*** | 3–155 | 56 | 0.048 ± 0.005*** | 5–155 | 77 | – | – | – | – | – | – |
| 103 | 0.080 ± 0.006 | 7–140 | 60 | 0.048 ± 0.002*** | 2–185 | 448 | – | – | – | – | – | – |
| 106 | 0.088 ± 0.006 | 3–145 | 45 | 0.075 ± 0.002 | 2–175 | 403 | 0.057 ± 0.007 | 3–100 | 20 | – | – | – |
| 108 | 0.088 ± 0.005 | 6–125 | 61 | 0.058 ± 0.003** | 3–130 | 125 | – | – | – | – | – | – |
| 114 | 0.067 ± 0.006 | 3–125 | 45 | 0.061 ± 0.004** | 2–140 | 112 | – | – | – | – | – | – |
| 115 | 0.090 ± 0.004 | 3–145 | 73 | 0.091 ± 0.003*** | 4–165 | 164 | 0.070 ± 0.003 | 4–140 | 126 | 0.092 ± 0.004*** | 2–175 | 144 |
| 116 | 0.100 ± 0.006* | 3–150 | 58 | 0.088 ± 0.003*** | 2–170 | 204 | 0.040 ± 0.004*** | 10–85 | 22 | – | – | – |
| Среднее | 0.090 ± 0.002 | 3–165 | 705 | 0.071 ± 0.001 | 1–195 | 3114 | 0.062 ± 0.001 | 2–140 | 469 | 0.085 ± 0.003*** | 2–175 | 334 |
| Контроль | 0.088 ± 0.002 | 1–170 | 578 | 0.069 ± 0.002 | 2–170 | 414 | 0.060 ± 0.004 | 6–130 | 55 | 0.066 ± 0.003 | 2–135 | 167 |
В поколении М1 у двух семей (№ 90 и 116) из 15 средняя масса семян достоверно выше, чем в контроле (на 28.4 и 13.6% соответственно). При посеве поколения М2 в полевых условиях у этих семей она также достоверно выше (№ 90 – на 28.8%; № 116 – на 12.5%). Во втором поколении и в других семьях выявлялись достоверные отличия от контроля как в сторону увеличения массы зерновок (№ 88, 106), так и уменьшения (№ 114) относительно этих показателей в М1.
В третьем поколении были изучены восемь семей и только у одной (№ 116) наблюдаются значимые отличия от контроля, в то время как показатели у других семей лежат в пределах ошибки (табл. 3). В М4 изучены три семьи и две из них имели достоверно большую массу зерновок.
Полученные результаты позволяют говорить о возможности действия 5-азацитидина на модификацию метилирования и вероятную отмену импринтинга. При этом эффект обнаруживается как в М1, так и последующих поколениях. Однако, по всей видимости, в силу сложных взаимодействий его экспрессия нестабильна.
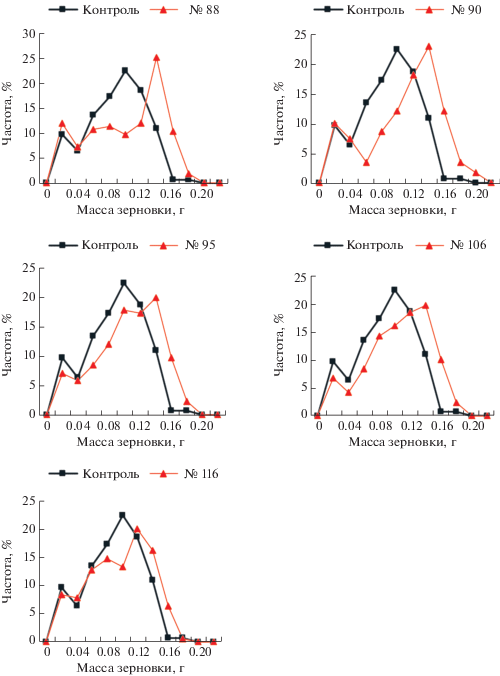
На рис. 1 представлены распределения по признаку “масса зерновки” в М2 лучших семей, обработанных 5-азацитидином, и в контроле. Из рисунка видно, что при обработке этим реагентом, по сравнению с контролем, достоверна не только разница средних, но и распределения частотного характера опытных семян по отношению к контрольным, что подтверждается сравнением по методу Колмогорова–Смирнова. При этом в семьях, обработанных 5-азацитидином, наблюдалось возрастание частот классов с максимальным значением признака “масса зерновки” (распределения сдвинуты вправо) относительно контроля. Наблюдаемый факт мы объясняем гипометилированием женского генома в результате действия 5-азацитидина. Аналогичный феномен показан в работе группы Фишера на арабидопсисе [11]. В заключение можно высказать предположение о том, что при более детальном изучении эффектов химических агентов, вызывающих наследуемые эпигенетические изменения, мы сможем начать их использование в практической селекции столь же эффективно, как в свое время были использованы классические химические мутагены.
Рис. 1.
Распределения по признаку “масса зерновки” в М2 лучших семей, обработанных 5-азацитидином, и в контроле.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Rodrigues J., Zilberman D. Evolution and function of genomic imprinting in plants // Genes & Dev. 2015. V. 29. P. 2517–2531. https://doi.org/10.1101/gad.269902.115
Alleman M., Doctor J. Genomic imprinting in plants: Observations and evolutionary implications // Plant Mol. Biol. 2000. V. 43. P. 147–161.
Соколов В.А. Импринтинг у растений // Генетика. 2006. Т. 42. № 9. С. 1250–1260.
Haig D. Coadaptation and conflict, misconception and muddle, in the evolution of genomic imprinting // Heredity. 2014. V. 113. P. 96–103.
Haig D. Kin conflict in seed development: an inter dependent but fractious collective // Annu. Rev. Cell. Dev. Biol. 2013. V.29. P.189–211.
Köhler C., Weinhofer-Molisch I. Mechanisms and evolution of genomic imprinting in plants // Heredity. 2010. V. 105. P. 57–63.
Bai F., Settles A.M. Imprinting in plants as a mechanism to generate seed phenotypic diversity // Front. Plant Sci. 2015. V. 5. P. 1–10. https://doi.org/10.3389/fpls.2014.00780
Ohnishi T., Sekine D., Kinoshita T. Genomic imprinting in plants: What makes the functions of paternal and maternal genes different in endosperm formation // Adv. Genet. 2014. V. 86. P. 1–25.
Zhang M., Xie S., Dong X., Zhao X. Genome-wide high resolution parental-specific DNA and histone methylation maps uncover patterns of imprinting regulation in maize // Genome Res. 2014. V. 24. P. 167–176. https://doi.org/10.1101/gr.155879.113
Patten M., Ross L., Curley J. et al. The evolution of genomic imprinting: theories, predictions and empirical tests // Heredity (Edinb.). 2014. V. 113. P. 119–128. https://doi.org/10.1038/hdy.2014.29
Xiao W., Brown R., Lemmon B. et al. Regulation of seed size by hypomethylation of maternal and paternal genomes // Plant Physiology. 2006. V. 142. P. 1160–1168.
Sokolov V., Khatypova I. The development of apomictic maize : update, problems and perspective // Acta Biol. Yugoslavica, Serial F. GENETIKA. 2000. V. 32. № 3. P. 331–353.
Jones P., Taylor S. Cellular differentiation, cytidine analogs and DNA methylation // Cell. 1980. V. 20. P. 85–93.
Дополнительные материалы отсутствуют.


