Генетика, 2020, T. 56, № 2, стр. 161-180
Мейотическая рекомбинация. Метаболические пути от двунитевых разрывов ДНК до кроссинговера и хиазм
Ю. Ф. Богданов 1, *, Т. М. Гришаева 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
* E-mail: yuri.bogdanov34@mail.ru
Поступила в редакцию 25.02.2019
После доработки 10.04.2019
Принята к публикации 30.05.2019
Аннотация
Сопряженные явления репарации и рекомбинации ДНК служат молекулярной основой, на которой в ходе эволюции полового процесса эукариот сформировался универсальный механизм мейоза. В обзоре описаны результаты исследований путей метаболизма хромосомной ДНК, ведущих от стартовых явлений на молекулярном уровне к кроссинговеру, а затем к хиазмам, которые необходимы для сегрегации гомологичных хромосом в ходе мейоза и превращения диплоидных клеток в гаплоидные гаметы или в споры. Излагается история создания теории гомологичной рекомбинации на основе репарации двунитевых разрывов ДНК и экспериментального открытия “стержневого” набора белков: SPO11, RAD51, ZMM-комплекса и других, ответственных за мейотическую рекомбинацию у большинства эукариот. Обращается внимание на известные исключения из этих закономерностей и возможные способы их объяснения. Излагается теория двух типов кроссинговера – зависимого и независимого от его интерференции. Описаны текущие результаты экспериментальных исследований роли мейоз-специфичных белков рекомбинации на всех этапах мейоза. Рассматриваются гипотезы гомеостаза кроссинговера и механизма его интерференции.
Способность молекул ДНК рекомбинировать in vivo унаследована эукариотами от прокариот и в ходе эволюции полового процесса стала основой для формирования мейоза, необходимого для перехода от диплоидной фазы жизненного цикла организмов к его гаплоидной фазе.
Молекулярная генетика и биохимия мейотической рекомбинации наиболее хорошо разработаны в результате исследований канонического мейоза у модельных организмов: почкующихся дрожжей Saccharomyces cerevisiae, нематоды Caenorhabditis elegans, растений Arabidopsis thaliana и Zea mays, мыши Mus musculus, а также мейоза у модельных объектов, у которых он несколько отличается от канонического, – делящихся дрожжей Schizosaccharomyces pombe и мухи Drosophila melanogaster. Обнаружен весьма высокий консерватизм ключевых генов и белков, ответственных за рекомбинацию хромосом в мейозе [1–3]. Биоинформатика позволяет распространять обнаруженные закономерности на другие организмы [4–6].
У всех эукариот существуют мейоз-специфичные гены и белки, в том числе специфические гены и белки мейотической рекомбинации [7–12]. Они супрессированы в вегетативных и соматических клетках, делящихся путем митоза, и активны во время мейоза. Переход диплоидных клеток от деления с помощью митоза к делению путем мейоза происходит в результате актов негативной регуляции: гены, инициирующие мейоз, выключают генетическую программу митоза, и тогда включается молчавшая ранее генетическая программа мейоза [1, 13–15]. Гены мейотической рекомбинации составляют количественно наибольшую часть мейоз-специфичных генов [8–12].
Мейотическая рекомбинация у всех изученных эукариот начинается с генетически запрограммированных многочисленных двунитевых разрывов ДНК специфичными для мейоза эндонкулеазами, которые кодируются мейоз-специфичными генами [1, 16, 17]. Большая часть двунитевых разрывов репарируется с сохранением исходной последовательности нуклеотидов, меньшая их часть превращается в обмены между сестринскими хроматидами или между несестринскими (гомологичными) хроматидами. Процесс обмена с несестринской хроматидой именуется кроссинговером, а возникшая “обменная” структура (результат кроссинговера) – кроссовером. Обмены между любыми хроматидами идут на основе гомологичной рекомбинации, при которой сестринская или несестринская молекула ДНК используется в качестве матрицы для ликвидации разрыва [7, 18].
Выбор между кроссоверным и некроссоверным вариантами репарации осуществляется сразу же в ходе ликвидации предварительно расширенного двунитевого разрыва [18, 19]. Это происходит с помощью миграции однонитевого конца разрезанной ДНК в гомологичную молекулу, денатурации двойной спирали в гомологичном сайте реципиентной молекулы ДНК и называется образованием смещающейся петли (D-петли, displacement loop).
В результате кроссинговера образуются обмены между несестринскими хроматидами – хиазмы, которые удерживают гомологичные хромосомы в виде бивалентов. Хиазмы сохраняются в метафазе I мейоза. Это позволяет бивалентам (а не индивидуальным хромосомам) выстроиться на экваторе веретена первого деления мейоза. Поэтому кроссинговер и хиазмы создают возможность для сегрегации гомологичных хромосом в первом делении мейоза и гаплоидизации клеток.
Белки, которые участвуют в мейотической репарации и рекомбинации ДНК, – это ферменты, медиаторы и адаптеры, работающие под контролем мейоз-специфичных генов [1, 2, 7, 9, 11, 12, 18, 20]. Данный обзор посвящен роли ключевых белков рекомбинации в этом процессе.
КРОССОВЕРНЫЙ И НЕКРОССОВЕРНЫЙ ПУТИ РЕКОМБИНАЦИИ В МЕЙОЗЕ. ИСТОРИЯ ИССЛЕДОВАНИЙ
В мейозе помимо мейотического пути рекомбинации сохраняется и тот, что был в соматических клетках, делящихся путем митоза. Митотический путь рекомбинации более древний и представляет собой “рекомбинационную” репарацию двунитевых разрывов ДНК. Кавычки введены потому, что при этом не возникает рекомбинации аллелей генов в данной хромосоме: обмен происходит между генетически идентичными сестринскими хроматидами. При таком обмене в митозе нет интерференции (подавления других обменов рядом с уже произошедшим), и сестринские хроматидные обмены (СХО) могут располагаться близко один от другого на хромосоме. В мейозе такие СХО тоже происходят и наблюдаются в первом делении мейоза (наряду с кроссоверами), если ввести меченый тимидин [21] или бромдезоксиуридин в ДНК в S-фазе митотического цикла перед последним премейотическим митозом [22]. Когда СХО были впервые обнаружены [21], применялась метка 3H-тимидина. В дальнейшем в качестве маркера новосинтезированной полинуклеотидной цепи ДНК стали применять бромдезоксиуридин, BrdU [23, 24].
Начиная с 80-х гг. ХХ в., обнаружены многочисленные белки, участвующие в мейотической рекомбинации у разных организмов. Одновременно эти исследования выявили общую схему (“сценарий”) мейотической рекомбинации у эукариот.
В 1964 г. Холлидей [25] предложил модель для объяснения того, как рекомбинация может приводить к кроссоверным и некроссоверным явлениям при репарации разрывов ДНК. Он предполагал, что накануне синапсиса гомологичных хромосом происходят разрывы одной из полинуклеотидных нитей ДНК (“ники”). Главным звеном в этой модели была промежуточная молекулярная структура, в которой однонитевые концы разрезанной ДНК проникают в двунитевую ДНК гомологичной хромосомы и образуется четырехнитевой промежуточный продукт. Теперь его называют структурой Холлидея или соединением Холлидея (Holliday junction, Hj).
Холлидей предполагал, что такие соединения расщепляются ферментами репарации ДНК – теперь их называют резолвазами, в результате чего 4-нитевая структура разделяется на две двунитевые в зависимости от того, на какой из нитей имел место разрыв. Этот процесс (называемый в англоязычной литературе словом “resolution”) приводит к кроссоверу (перекресту) или освобождению от связи без перекреста. Исследования на грибах показали, что кроссоверные и некроссоверные продукты рекомбинации (рекомбинационной репарации) появляются в равных количествах. Модель Холлидея соответствовала этим фактам.
Холлидей предполагал, что рекомбинация должна инициироваться симметричными разрывами (nicks) одной полинуклеотидной цепи на гомологичных хромосомах, но это не совпало с наблюдениями (обзор [26]). Для того, чтобы согласовать модель с экспериментальными данными, Шостак и его соавт. [27] предположили, что мейотическая рекомбинация начинается с двойных разрывов на одной хроматиде (молекуле ДНК). В новой модели рекомбинации на основе репарации двойных разрывов ДНК (DSBR-модель, Double-strand break repair model) они постулировали, что промежуточный продукт рекомбинации содержит два холлидеевских соединения. Это предположение основывалось на обнаружении репарации двойных разрывов ДНК в митотически делящихся клетках. Согласно модели Шостака и соавт., каждое из двух холлидеевских соединений в промежуточном продукте рекомбинации (предкроссоверном интермедиате) должно реализоваться независимо, но результат должен быть таким же, как в модели Холлидея: кроссоверные и некроссоверные продукты должны появляться в равных количествах. Эта модель получила сильную поддержку в результате физических опытов на промежуточных и окончательных продуктах мейотической рекомбинации у дрожжей S. cerevisiae. В этих исследованиях были обнаружены промежуточные продукты рекомбинации – соединенные молекулы (joint molecules) между гомологичными хромосомами [16]. Эти соединенные молекулы имели много признаков, предсказанных для двойных соединений Холлидея – ключевых промежуточных продуктов новой модели [17]. Результаты этих исследований получили широкое признание как доказательства существования двойных соединений Холлидея. Термин “соединенные молекулы” (joint molecules) используется для обозначения физических структур, обнаруженных в эксперименте, а “двойные соединения Холлидея” (double Holliday junctions, dHj) – для обозначения промежуточных продуктов, предсказанных моделью.
Дальнейшие исследования стали проверкой модели рекомбинации на основе репарации – DSBR-модели. Было обнаружено [19], что некроссоверы возникают одновременно с соединенными молекулами и раньше, чем появляются кроссоверы. Это было несовместимо с DSBR-моделью рекомбинации Шостака и соавт. [27]. Для того чтобы объяснить свою находку, Аллерс и Лихтен [19] предположили, что некроссоверы возникают не из двойных соединений Холлидея, а из ранних промежуточных продуктов, которые появляются на том же метаболическом пути, а именно при смещении растянутой D-петли. D‑петля появляется, когда однонитевой конец ДНК проникает в гомологичную двойную спираль, расплавляя ее (рис. 1). Это происходит потому, что белки RAD51 и DMC, покрывающие однонитевую ДНК, обладают свойствами денатурировать двуспиральную ДНК.
Рис. 1.
Гипотетическая схема путей мейотической репарации и рекомбинации молекул ДНК. Изображены две молекулы ДНК, принадлежащие несестринским хроматидам и участвующие в кроссинговере (по результатам исследования рекомбинации у почкующихся дрожжей S. cerevisiae) (по [7]).
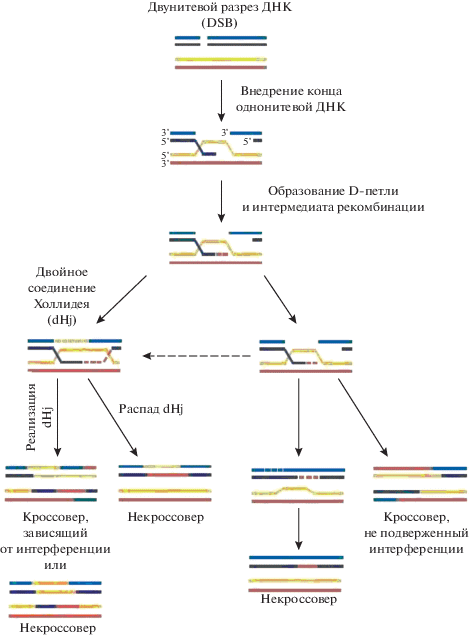
Аллерс и Лихтен предположили, что “некроссоверная резолваза” расширяет D-петлю и идет синтез ДНК на однонитевом 3'-конце “донорной” молекулы, внедренном в петлю. Затем одна из вновь синтезированных нитей D-петли захватывает надстроенный путем синтеза однонитевой конец двойного разрыва ДНК и образует с ним двуспиральную молекулу (отжиг ДНК). Главным путем образования кроссоверов, по Аллерсу и Лихтену, остается путь выхода из двойных соединений Холлидея с помощью “прокроссоверной” резолвазы, а некроссоверный путь – это путь, на котором антикроссоверная геликаза перехватывает процесс на более ранней стадии, после чего образуются некроссоверы [19, 28]. Более детально последовательность этих событий, показанных на рис. 1, описана в обзорах XXI в. [7, 18].
ДВА МЕТАБОЛИЧЕСКИХ ПУТИ КРОССИНГОВЕРА
Другой взгляд на проблему выбора между кроссинговером и бескроссоверной репарацией появился в результате изучения ZMM-комплекса белков у S. cerevisiae. Эти белки (Zip1–Zip4, Msh4–Msh5, Mer3) последовательно функционируют в местах будущих хиазм. Умеренно консервативные белки Msh4 и Msh5 образуют специфичный для мейоза рекомбинационный комплекс [29]. Потеря их у S. cerevisiae приводит к снижению частоты кроссинговера на 50–70% [30, 31]. Однако у нематоды C. elegans этот комплекс ответствен за 100% кроссинговеров [32, 33]. Для того чтобы объяснить это различие в регуляции рекомбинации у двух организмов, Залевский и соавт. [32, 34] предложили гипотезу о двух путях формирования мейотического кроссинговера (табл. 1).
Таблица 1.
Процент кроссинговера, приписываемый каждому из двух метаболических путей этого процесса, согласно ранней гипотезе (по [32])
| Класс | Тип кроссинговера | Определяющие белки |
Процент кроссинговера | ||||
|---|---|---|---|---|---|---|---|
| Sc | Sp | Ce | At | Dm | |||
| I | С интерференцией | Msh4–Msh5 | 50–70 | 0 | 100 | 75–85 | 0* |
| II | Без интерференции | Mus81–Mms4 | 20 | 100 | 0 | 9–12 | <10 |
Примечание. Sc – S. cerevisiae; Sp – S. pombe; Ce – C. elegans; At – A. thaliana; Dm – D. melanogaster. * Более поздние исследования показали, что 90% кроссинговера у D. melanogaster требуют функционирования комплекса белков mei–MCM, который, судя по всему, выполняет функцию белков Msh4–Msh5 [34].
Гипотеза двух метаболических путей помогла объяснить несогласующиеся данные о кроссинговере у других организмов. У дрожжей S. pombe нет ортологов белков Msh4–Msh5 [35]. Вместо этого у них большая часть кроссоверов зависит от резолвазы Mus81–Mms4 (у S. pombe и многих других организмов ортолог Mms4 обозначается символом Eme1, однако для простоты мы используем обозначение, заимствованное из исследований на S. cerevisiae, т.е. Mms4). Такими упрощенными обозначениями пользуются разные авторы [36, 37]. У S. cerevisiae от Mms4 зависят 20% кроссоверов [38]. Из этих фактов следует, что метаболический путь, использующий комплекс Mus81–Mms4, является основным путем формирования кроссинговера у S. pombe и только малой части кроссоверов у S. cerevisiae. Возникает вопрос: эти два пути являются вариантами общего метаболического пути или совершенно разными путями? Известно, что двойные мутации по генам обоих белковых комплексов подавляют кроссинговер гораздо сильнее, чем каждая из мутаций в отдельности, и из этого был сделан вывод, что два пути являются действительно разными путями [39, 40]. Эти варианты обозначены в табл. 1 как классы I и II.
Эти факты, по мнению Кол и Секельского [28], доказывают, что кроссинговер у S. pombe, подробно изученный Мюнцем [41], не интерферирует потому, что он зависит от метаболического пути белков Mus81–Mms4, а у C. elegans подвержен сильной интерференции потому, что он использует метаболический путь белков MSH4–MSH5 (ZMM-комплекс)11.
Парадигма двух путей кроссинговера помогает объяснить причину явлений, указанных выше, но, казалось бы, не объясняет два других факта: 1) почему у мутантов S. cerevisiae, у которых потеряны оба класса белков – Mus81–Mms4 и Msh4–Msh5, все-таки сохраняется остаточный кроссинговер? 2) почему у D. melanogaster расчеты свидетельствуют о присутствии интерференции, хотя у этого организма нет белков MSH4–MSH5 [42]. Возникает вопрос: нет ли у дрозофилы третьего пути рекомбинации? Ответы на эти вопросы таковы [28]: 1) мутации (если они не делеции) могут не полностью инактивировать белки рекомбинации, и “утечка” не до конца инактивированных белков обеспечивает “следовую” рекомбинацию; 2) если, как упомянуто в примечании к табл. 1, комплекс белков mei–MCM у дрозофилы выполняет функцию белков MSH4–MSH5, то вопрос о том, почему у дрозофилы есть интерференция кроссинговера, отпадает, ибо интерференция обеспечивается комплексом белков mei–MCM.
Инициация рекомбинации
Инициирующим событием мейотической рекомбинации служит появление мейоз-специфичной двунитевой эндонуклеазы SPO11, ее посадка на ДНК и разрезание двойной спирали ДНК [43–45]. SPO11 – белковый димер, который разрезает молекулу ДНК как ножницы, но не точно по противолежащим позициям комплементарных нуклеотидов, а со сдвигом на два нуклеотида [43]. Нуклеаза SPO11 найдена у большого числа разных организмов и является универсальным инициатором кроссинговера, ибо мутанты, лишенные этого фермента, у нематод, мух, мышей и растений теряют способность к кроссинговеру.
По сообщениям исследователей из разных лабораторий, изучавших мейотическую рекомбинацию у различных организмов, количество DSBs зависит от разных факторов: от модификации гистонов, от факторов транскрипции и ремоделирования хроматина и других. У дрожжей S. cerevisiae, у которых вообще нет гетерохроматина, мейотические сайты DSBs обладают чувствительностью к микрококковой нуклеазе (MNase) и к ДНКазе I. Это свойство характерно для “открытого” хроматина, не защищенного дополнительными белками [46]. Двунитевые разрывы формируются в районах с низкой плотностью нуклеосом в трехмерном пространстве фибрилл хроматина, имеющих толщину 30 нм [47]. Установлено также, что посадка на ДНК когезина REC8 регулирует формирование DSBs у S. cerevisiae. Рядом с этим когезином образуется очень мало двунитевых разрывов. Влияют также Mer2 и факторы комплекса COMPASS [48]. У дрозофилы, у которой формирование синаптонемного комплекса является необходимым (но не единственным) условием образования двунитевых разрывов, отсутствие белков C(3)G и C(2)M значительно снижает количество DSBs [49]. У нематоды в прицентромерном гетерохроматине избыток REC-8 супрессирует мейотические DSBs (также у S. cerevisiae и S. pombe, не имеющих гетерохроматина), хотя эндонуклеаза SPO11-1 обнаруживается на хромосомах [50]. При этом нормальный уровень REC-8 играет ключевую роль в организации архитектуры мейотической хромосомы и в обеспечении правильного обмена между гомологами. Таким образом, из совокупности этих и других исследований невозможно выявить общую закономерность, общий или ключевой фактор локализации всех DSB.
Судьба двунитевых разрывов ДНК (будут ли они репарированы без последствий для генома или превратятся в сайты кроссинговера) решается вскоре после расширения бреши в области DSB в направлении от 3'-конца к 5'-концу одиночной нити ДНК [19, 51]. Эта новость XXI в. для тех, кто интересуется механизмами мейотической рекомбинации у эукариот, должна стать изменением в учебном материале по курсу генетики и цитогенетики. Во всех учебниках, выпущенных в ХХ в., написано, что ключевым событием, которое превращает соединение Холлидея в кроссоверный обмен или в некроссоверный вариант – репарацию или конверсию, является способ “разрезания” или конформационного “освобождения” (resolution) нитей ДНК от соединения Холлидея. Это происходит якобы в самом конце череды молекулярных процессов, приводящих к кроссинговеру. Однако результаты исследований, опубликованные в первые годы ХХI в., доказывают, что “выбор” в пользу кроссинговера или его отсутствия и репарации двунитевой бреши в ДНК совершается в ходе процессинга DSBs и до формирования двойных соединений Холлидея [19, 51, 52]. Молекулярный механизм, который делает этот выбор, продолжает обсуждаться на момент написания этой статьи, но факт раннего “выбора” считается установленным [7, 18, 53, 54].
Разрывы двойной спирали ДНК, вызванные эндонуклеазой Spo11, превращаются в бреши размером в сотни пар нуклеотидов. Эти бреши формируются у S. cerevisiae под действием зкзонуклеазы. Затем одноцепочечный 3'-конец бреши наращивается с помощью фермента RPA (replication protein A) и одевается чехлом из димеров RecA-подобных белков. У эукариот есть два типа RecA-подобных белков: соматический RAD51 и мейоз-специфичный DMC1. Установлено, что они формируют два типа гомодимеров. Согласно модели, предложенной в 2004 г., димеры RAD51–RAD51 и DMC1–DMC1 садятся на разные концы ДНК в районе бреши [55]. Промоторами взаимодействия RECA-подобных белков с ДНК служат белки, функционирующие в виде комплекса физически связанных между собою (с помощью гидрофобных взаимодействий) белковых молекул. Это комплекс белков RAD51–RAD55–RAD57 (эпистатическая группа RAD52).
Посадка димеров RAD51–RAD51 на одноцепочечный конец ДНК происходит кооперативно (много молекул сразу). Одноцепочечная нить ДНК покрывается сотнями димеров RAD51–RAD51 на расстоянии в несколько сотен нуклеотидов. Димеры DMC1–DMC1, по-видимому, садятся на противоположный конец бреши ДНК (рис. 2). Установлено, что комплекс молекул DMC1 – это октамер, который охватывает кольцом однонитевой конец ДНК [55].
Рис. 2.
Участие белков рекомбинации в двух вариантах инвазии одноцепочечного конца ДНК в гомологичную молекулу. Если инвазия происходит в сестринскую хроматиду, то это начало образования сестринского хроматидного обмена; если в несестринскую – начало рекомбинации. Указаны белки, участвующие в наращивании одноцепочечного конца ДНК (RPA) (Rad51, Dmc1 и другие) (из [55] с изменениями).
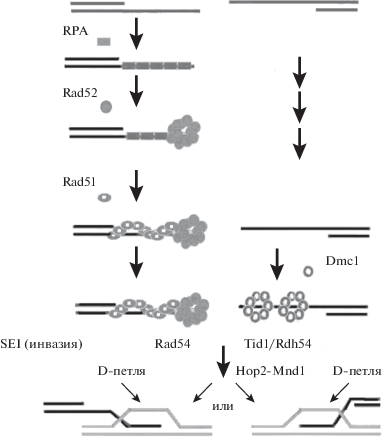
Инвазия однонитевой ДНК и D-петля
ДНК-белковая конструкция, состоящая из отрезанного нуклеазой SPO11 конца одноцепочечной молекулы ДНК и покрывающего ее полимера из молекул RAD51 или DMC1, внедряется в гомологичный сайт интактной молекулы ДНК другой хроматиды. Полимеризованные молекулы белка RAD51 как чехол одевают однонитевую ДНК. Такой нуклеопротеид был визуализирован с помощью электронной микроскопии [56].
Внедрение нуклеопротеидного филамента ДНК–RAD51 (или ДНК–DMC1) может происходить как в сестринскую хроматиду (в той же хромосоме), так и в несестринскую хроматиду (в гомологичную хромосому). При этом реципиентная молекула ДНК локально расплавляется (денатурирует). Это явление получило название инвазии (внедрения) конца одиночной нити (single end invasion, SEI).
В “реципиентной” хроматиде образуется D-петля (от английского displacement loop – петля смещения или смещающаяся петля) (рис. 2). Если инвазия происходит в сестринскую хроматиду, то это ведет к сестринскому хроматидному обмену; если в несестринскую, то это приводит к рекомбинации (кроссинговеру или конверсии) [52]. После инвазии одиночной нити на обоих концах бреши в молекуле ДНК локально возникают два гетеродуплекса ДНК – двойное соединение Холлидея (double Holliday junction, dHj) [17, 51]. Эти конфигурации показаны на рис. 1.
Структуры Холлидея
У дрожжей S. cerevisiae двунитевые разрывы возникают и существуют на стадии лептотены, до соединения осевых элементов хромосом и формирования из них синаптонемных комплексов (СК). Внедрившиеся одноцепочечные концы существуют во время стадии зиготены, и считается, что инициация формирования СК у этих дрожжей вызвана именно взаимным притяжением хроматид с помощью инвазии однонитевых концов ДНК в гомологичную хромосому. Двойные структуры Холлидея (интермедиаты рекомбинации) существуют значительное время: с поздней зиготены и до конца весьма продолжительной стадии пахитены.
Есть аргументы в пользу того, что превращение интермедиатов рекомбинации в кроссоверы происходит параллельно с изменениями, происходящими в латеральных элементах СК [20]. Не исключено, что возникновение двунитевых разрывов и их превращение во внедрившиеся концы (SEI) и в двойные структуры Холлидея (dHjs) сопровождаются взаимным захватом разорванных белковых осевых элементов хромосом и затем – соединением этих перекрестившихся концов и образованием перекрестов хромосомных осей [20, 54, 57]. По крайней мере на стадии лептотены под электронным микроскопом можно наблюдать разрывы осевых элементов хромосом [58]. Такие разрывы наблюдались многими, кто исследовал СК под электронным микроскопом, а хромосомные перестройки – транслокации и инверсии – всегда сопровождаются рекомбинацией латеральных элементов СК в точках разрыва и перестройки [59, 60].
В ходе профазы I мейоза у S. cerevisiae некроссоверные гетеродуплексы существуют одновременно с соединениями Холлидея (в которых кроссинговер должен происходить позже) [19]. Этот факт совпал с предположением исследователей о том, что кроссоверы и некроссоверы формируются на общем метаболическом пути. Анализ мутантов по генам комплекса ZMM привел к убеждению, что “решение” в пользу некроссоверного или кроссоверного развития событий происходит рано, а именно в то время, когда однонитевой конец ДНК внедряется в гомологичную молекулу ДНК и вызывает образование в ней D-петли [51, 61]. Эти представления иллюстрируются схемой на рис. 1. Именно это и послужило доказательством того, что “решение” в пользу некроссоверной или кроссоверной репарации мейоз-специфичных разрывов молекулы ДНК происходит на раннем этапе этой репарации (во время ранней пахитены), а не в конце ее (не в диплотене).
Комплекс белков ZMM и кроссинговер I типа
Итак, в первом десятилетии ХХI в. утвердилось мнение, что репарация двунитевых разрывов ДНК может идти сразу же и альтернативно как по пути кроссинговера, так и по пути их залечивания – по некроссоверному пути. Важный аргумент в пользу существования альтернативы состоит в том, что у эукариот есть гены, мутации которых нарушают процесс кроссинговера, но не затрагивают процесс некроссоверной репарации DSBs (обзоры [7, 62]). Эти гены известны давно, но в XXI в. именно этот комплекс получил название ZMM-комплекса у дрожжей. Ортологи этих белков есть у других модельных организмов, хотя иногда имеют другие обозначения. В состав ZMM-комплекса входят белок поперечных филаментов СК Zip1, белки Zip2, Zip3 и Zip4 из семейства лигаз SUMO или E3 [53, 63, 64], геликаза Mer3, расширяющая D-петлю [31], а также белки Msh4 и Msh5, стабилизирующие dHj [39].
У большинства изученных организмов в процесс формирования кроссоверов I типа последовательно вовлекаются белки, гомологичные белкам MutS и MutL бактерий. У эукариот белкам MutS гомологичны белки Msh4 и Msh5, которые функционируют в виде гетеродимеров Msh4–Msh5. Иногда такой гетеродимер обозначают как MutSγ [18]. В ядрах сперматоцитов мышей MutSγ связывается со 100–150 DSBs из примерно 250–300 DSBs, возникающих в ядре во время лептотены–зиготены. Важно, что при мутациях, инактивирующих один из белков гетеродимера Msh4–Msh5, мейоз у самцов мышей блокируется до начала стадии пахитены [18]. MutSγ, по-видимому, стабилизирует все двойные соединения Холлидея (dHj), а не только те, которые позднее приводят к кроссоверам I класса [18]. Обнаружено, что гетеродимер Msh4–Msh5 отнюдь не участвует в коррекции неправильно спаренных оснований ДНК, как это делают другие бактериальные белки группы MutS, а лишь стабилизирует dHjs, не давая им подвергнуться действию ферментов, разрушающих ДНК [31, 65–67]. Гетеродимер Msh4–Msh5, локализующийся на хромосомной оси во время зиготены, рекрутирует в хромосомы гетеродимеры Mlh1–Mlh3 (гомологи бактериальных белков семейства MutL).
Белки MLH1 консервативны в разной степени при сравнении растений, грибов и животных [68, 69]. Длина полипептидной цепи ортологов MLH1 у S. cerevisiae, A. thaliana, C. elegans, Danio rerio (рыба), мыши и человека составляет от 723 до 770 аминокислотных остатков (а. к.), у S. pombe и D. melanogaster – 664–684 а. к. Попарное сравнение взвешенных показателей сходства аминокислотных последовательностей этих белков разными методами (полных белковых молекул или их функциональных доменов), выраженное в % от сходства “сам с собой”, показало, что у рыбы, мыши и человека белок MLH1 сходен на 70–87%, а его функциональный домен MutL_Trans_MLH1 (от 113 до 128 а. к.) – даже на 85–97%. В то же время у D. melanogaster полный белок сходен с его ортологами из других организмов лишь на 30–49%, MLH1 C. elegans сходен с ортологами других организмов не более чем на 27%, а MLH1 дрожжей S. pombe и S. cerevisiae (относящихся к разным таксономичеким классам) сходны между собой лишь в пределах 20–23% [68, 69]. Таким образом, среди одноклеточных грибов и нематод – современных представителей древних филогенетических линий эукариот – наблюдается большая изменчивость белковой структуры важного фермента рекомбинации. У представителей филогенетической линии позвоночных сложилась более консервативная структура белка MLH1, что можно рассматривать как результат “движущего” отбора на молекулярном уровне.
РЕГУЛЯЦИЯ КРОССИНГОВЕРА
Согласно широко распространенному мнению [7, 12 и др.] существуют три уровня регуляции частоты и распределения кроссоверов: 1) страховка кроссинговера, 2) интерференция кроссинговера и 3) кроссоверный гомеостаз. Страховка кроссинговера обеспечивает каждую пару хромосом хотя бы одним кроссовером [22]. Интерференция обеспечивает неслучайное распределение кроссоверов вдоль хромосомы и их расположение на более далеком расстоянии один от другого, чем это ожидается при случайном распределении, если кроссоверов больше одного на пару гомологов [70]. Кроссоверный гомеостаз – это способность мейотических клеток сохранять присущий данному биологическому виду (и генетической линии или штамму организмов) уровень числа кроссоверов на хромосому, даже если число DSBs снижается на порядок величин. Пока не ясно, верно ли это правило для всех организмов (см. ниже).
Страховка кроссинговера обеспечивается существованием контрольного пункта (checkpoint), не дающего вступать в метафазу I клеткам, у которых был существенно не завершен синапсис хромосом. Такие клетки подвергаются “аресту” на стадии пахитены [60, 71]. Но если униваленты проходят в метафазу I и образуются анеуплоидные половые клетки, то они не дают потомства в результате отбора на стадии зиготы. Страховка кроссинговера особенно важна для микрохромосом, например, у птиц [72, 73], иначе эти хромосомы, несущие уникальные гены, могли бы иногда теряться.
Интерференция кроссинговера означает, что формирование кроссовера в одном локусе подавляет второй вблизи себя. Поскольку у C. elegans и D. melanogaster наблюдается всего по одному кроссоверу на хромосому (одна хиазма на пару гомологичных хромосом), то это является примером сильной интерференции. У других организмов обнаружено два типа кроссоверов (см. ниже). У S. cerevisiae кроссинговер подвержен интерференции, и он управляется белковым комплексом ZMM [53, 74].
Непрерывный СК вдоль хромосомы не является необходимым условием для интерференции кроссинговера у мышей и дрожжей [75, 76]. Однако интерференции кроссинговера нет ни у S. pombe, ни у A. nidulans. Интерференция кроссинговера (но не сам кроссинговер) исчезает у мутантов zip1 S. cerevisiae, у которых нарушено формирование СК [77]. Интерференция кроссинговера и хиазм у мыши и кукурузы снижается и даже превращается в “отрицательную интерференцию” (т.е. расстояние между соседними сайтами кроссинговера сокращается) в ограниченной области бивалента, вблизи точки разрыва одного из гомологов, претерпевшего инверсию или транслокацию. Это наблюдается именно там, где происходят вызванные перестройкой смена партнеров спаривания и смена латеральных элементов СК [78–80]. Возможно, влияние на интерференцию оказывает именно смена партнеров спаривания, вызванная транслокацией.
Гомеостаз кроссинговера поддерживает число кроссоверов на бивалент хромосом на уровне на два порядка величин ниже числа двойных разрывов ДНК. Особенно интересно и важно, что при снижении (по разным причинам) числа двойных разрывов ДНК число кроссоверов на бивалент сохраняется неизменным, очевидно, за счет уменьшения числа некроссоверов, т.е. репарированных двойных разрывов ДНК. Не исключено, что это не всеобщая закономерность, потому что она доказана пока только на почкующихся дрожжах. В этих экспериментах были использованы гипоморфные аллели эндонуклеазы Spo11, приводящие к разной степени снижения числа двойных разрывов ДНК на клетку. Число начальных событий кроссинговера у мутантов spo11 снижалось, но, несмотря на это, уровень числа кроссоверов оставался нормальным и неизменным [81].
Генный контроль сопряженных процессов рекомбинации и синапсиса (построения СК)
Многие гены, аннотированные как гены мейотической рекомбинации, оказывают значительное влияние на контакт гомологичных хромосом в мейозе, на формирование осевых элементов хромосом и синаптонемных комплексов. У Coprinus cinereus, как и у дрожжей S. cerevisiae, белок SPO11 катализирует двунитевые разрывы ДНК и инициирует процесс мейотической рекомбинации. У нуль-мутантов spo11 базидиомицета C. cinereus выявлены нарушения формирования осевых элементов хромосом и СК. Нормальные СК обнаружены только в 1% мейоцитов мутантов. Влияние этой мутации на формирование СК может быть обусловлено тем, что мейотические гены ZIP2 и ZIP3, контролирующие начало сборки центрального элемента СК из белка Zip1, являются SPO11-зависимыми генами [82–84].
Модель Бёрнера с соавт. [53], предложенная на основе выводов из экспериментов многих авторов, постулирует, что ZMM-комплекс способствует превращению DSB в кроссовер. Клетки дрожжей, дефицитные по одному из белков – Zip1, Zip2, Zip3 или Msh5, не способны к кроссинговеру в условиях повышенной температуры.
Совокупность событий, обычно ведущих к кроссинговеру, происходит на этапе инвазии одноцепочечной ДНК в несестринскую хроматиду. При этом мутации zip1, zip2, zip3 и msh5 не способны ингибировать превращение продуктов репарации DSBs в некроссоверные последовательности, и происходит конверсия гена [53]. Такая дифференциация может происходить во время возникновения программируемых DSBs, до начала формирования СК. Таким образом, сайты, в которых ZMM-комплекс связан с сайтами инициации синапсиса, могут маркировать те позиции на хромосоме, где DSBs “созревают” в кроссоверы.
Модель функционирования ZMM-комплекса [53] объясняет взаимоотношение между тремя явлениями: 1) превращение DSB в кроссовер, или конверсионное явление, 2) соединение еще не спаренных осевых элементов хромосом и 3) образование “фокусов”, в которых белковый комплекс ZMM ассоциирован с сайтами инициации синапсиса. Именно такая последовательность событий предшествует “созреванию” сайтов кроссинговера и инициации локального формирования СК у дрожжей S. cerevisiae. Далее мы попытаемся описать последовательность событий, которая частично доказана, а частично постулируется этой моделью.
Согласно модели ZMM-комплекса, во время ранней и средней лептотены происходит взаимодействие DSBs c сайтами узнавания (matching sequences) на гомологичных хромосомах, и это, возможно, приводит к образованию мостиков между осевыми элементами хромосом [85, 86]. Это, возможно, способствует инвазии конца одноцепочечной ДНК в гомологичную хромосому [87, 88]. Мостики, которые соединяют сблизившиеся оси хромосом, по-видимому, действительно несут на себе (или включают в себя) одноцепочечные концы ДНК, уже внедрившиеся в хроматиду гомологичной хромосомы [51]. Бёрнер с соавт. предположил, что неизвестный пока механизм вынуждает часть этих мостиков превращаться в истинные кроссоверы с такой частотой и распределением, какие подчиняются закону интерференции кроссинговера [53]. Эти уже предназначенные быть кроссоверными концы ДНК взаимодействуют с ZMM-комплексом, в состав которого входит Zip1 – белок поперечных филаментов СК. В результате всего этого происходит явление, которое называют нуклеацией СК: появление (в экспериментальных условиях) первых “фокусов” флуоресцирующих антител к белкам СК, т.е. зарождающихся фрагментов СК. Итак, нуклеация СК у S. cerevisiae, по-видимому, совпадает c инвазией нуклеопротеидных комплексов ДНК–Rad51 и ДНК–Dmc1 из одной хромосомы в другую, гомологичную. При этом исследователи обсуждают очень тонкие детали изменения хромосомных осей: их “пристегивание” в местах кроссоверных мостиков и отсутствие таких “застежек” там, где не будет кроссинговера, а произойдет некроссоверная рекомбинация – конверсия [54, 89].
Модель Бёрнера и соавт. весьма обоснована сочетанием фактов и перекрестными проверками на материале разных мутантов дрожжей, но она применима только к почкующимся дрожжам S. cerevisiae [53, 89]. Таково мнение исследователей, хорошо знающих детали формирования СК у других организмов. Она не применима к явлениям инициации формирования СК у самок Drosophila и у C. elegans, у которых для начала формирования СК не нужны DSBs (у этих организмов они появляются только после формирования СК). Модель функционирования ZMM-комплекса не применима и к мейозу у C. elegans.
Подробности “выбора” кроссоверного или некроссоверного пути мейотической рекомбинации
Как уже указывалось, достаточно одного кроссовера на бивалент для того, чтобы обеспечить в мейозе I правильную сегрегацию данной пары хромосом. Избыток кроссоверов (и хиазм) не может дать мейотической клетке преимущества в прохождении через контрольный пункт, пропускающий ее в метафазу I. Вероятно поэтому у большинства организмов наблюдается ограниченное число хиазм в биваленте. Механизм интерференции служит “поставщиком материала” для такого отбора. Это означает, что от 65 до 90% двунитевых разрывов ДНК репарируются без кроссинговера, используя в качестве матрицы гомологичную или сестринскую хроматиду [90]. Молекулярная модель рекомбинации, приводящей к бескроссоверной репарации [25], постулировала, что для расплетания молекулы ДНК необходима ферментативная активность геликазы. В клетках, делящихся путем митоза, было найдено несколько ДНК-геликаз. Однако долгое время оставалось неясным, какая из них направляет репарацию по некроссоверному пути во время мейоза. Исследования показывали, что эту функцию могут выполнять не все геликазы. Более того, выяснилось, что те геликазы, которые в ходе эволюции были избраны для некроссоверного завершения репарации, оказались разными у разных организмов. Относительно дрожжей S. cerevisiae долгое время считалось, что некроссоверную рекомбинацию обеспечивает ДНК-геликаза Sgs1, хотя доказательства были небесспорными. В конце концов было установлено, что эта геликаза не только обеспечивает некроссоверный путь репарации, но и является основным регулятором всей мейотической рекомбинации, необходимой для предотвращения множественной инвазии однонитевых концов ДНК в сайтах двунитевых разрывов ДНК [90]. Геликаза Sgs1 способствует формированию кроссоверов с помощью ZMM-комплекса ферментов [91, 92]. У C. elegans в регуляцию кроссоверного пути рекомбинации вовлечена геликаза RTEL-1. Но, по-видимому, она делает это путем предотвращения инвазии однонитевого конца ДНК в гомологичную хромосому, перенаправляя его в сестринскую хроматиду [93, 94]. Иначе говоря, дело не доходит до формирования некроссоверного продукта. Что касается выбора кроссоверного или некроссоверного пути в мейозе у S. pombe и A. thaliana, то у этих организмов были идентифицированы ортологи геликазы FANCM, которая сдерживает формирование кроссоверов.
A. thaliana относится к числу многих организмов, у которых есть два пути мейотической рекомбинации, приводящей к кроссинговеру: 1) путь кроссинговера, подвергающегося интерференции и зависящего от ZMM-комплекса ферментов, и 2) путь кроссинговера, не подверженного интерференции, который в основном зависит от ДНК-эндонуклеазы MUS81-EME1/MMS4. Если какие-либо факторы (например, мутации) повреждают или выводят из строя первый путь, то число кроссоверов снижается, но те, которые сохранились, оказываются распределенными случайно и не подверженными интерференции. Это приводит к тому, что некоторые пары гомологичных хромосом остаются без кроссоверных обменов и без хиазм. Мейоз в таких клетках приносит анеуплоидные микроспоры. Это указывает на то, что FANCM направляет те интермедиаты рекомбинации, которые потенциально могли стать кроссоверами, зависимыми от MUS81, на некроссоверный путь или на путь репарации с помощью сестринских хроматид.
Было неясным, какая из геликаз управляет образованием некроссоверов. Но появилась информация, что разные организмы используют для этой цели разные ферменты [90].
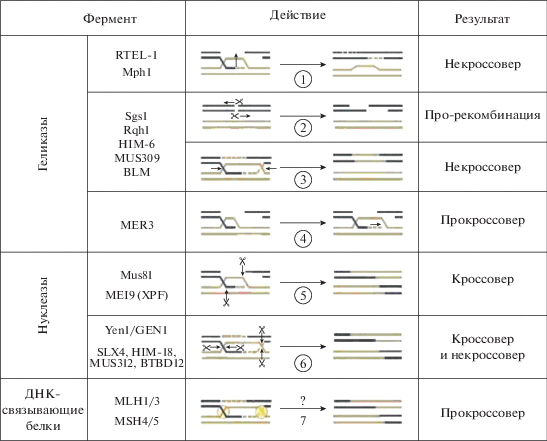
Представление о роли различных геликаз и нуклеаз, участвующих в процессе выбора между кроссоверным и бескроссоверным путями репарации, дает рис. 3. Но следует подчеркнуть, что конкретная роль этих белков остается наименее разработанной областью метаболизма ДНК, связанного с рекомбинацией у эукариот, и некоторые оценки носят предварительный характер.
Рис. 3.
Участие белков в выборе пути репарации ДНК между кроссинговером и отсутствием кроссинговера. 1 – инвазия нити и образование D-петли; 2 – расширение бреши; 3 – ликвидация D-петли; 4 – расширение гетеродуплекса; 5 – разрезание нитей; 6 – реализация кроссинговера; 7 – остается неясным. Надписи “про-рекомбинация” и “прокроссовер” означают, что действия ферментов способствуют (но не окончательно) репарации или кроссинговеру соответственно (по [7] с изменениями).
Горячие и холодные точки двунитевых разрывов ДНК
Число DSBs избыточно по сравнению с числом кроссоверов [94а]. Например, у человека примерно 150 DSBs реализуются в виде не более чем 50 кроссоверов на 23 пары хромосом (отношение ~4 : 1). У мыши это соотношение составляет примерно (200–300) : 25, т.е. ~10 : 1, но у арабидопсиса зарегистрировано примерно 230 DSBs на пять пар хромосом (и не более чем 10 кроссоверов), т.е. может быть от ~23 : 1 до 45 : 1 [94а]. Столь большие различия в пропорциях пока не имеют объяснения и означают неполноту изученности этого явления. Различия могут быть обусловлены как методическими причинами, так и существованием модификаторов процессов у разных организмов. Однако общая причина избыточности становится понятной после того, что мы узнали о существовании некроссоверного пути репарации DSBs.
Двунитевые разрывы ДНК распределены по хромосомам неравномерно. Существуют сайты, называемые горячими сайтами разрывов, где их частота повышена, и альтернативные им холодные сайты DSBs. Проблема факторов, детерминирующих расположение горячих и холодных сайтов (точек), исследуется в основном на таких модельных быстро размножающихся организмах как дрожжи и мыши. Однако универсального фактора не найдено. Для разных организмов описаны разные “мишени” преимущественного “попадания” нуклеазы SPO11.
Установлено, что существуют два пути возникновения горячих точек (ГТ) рекомбинации – зависимый от фактора PRDM9 и не зависимый. У многоклеточных организмов PRDM9 экспрессируется только в клетках зародышевого пути, а у дрожжей – в фазе “компетентности” для вступления в мейоз [95, 96]. Фермент PRDM9 обладает метилтрансферазной активностью. Кроме того, он имеет домен связывания с другими белками, а также многочисленные домены – “цинковые пальцы”, которые связываются с ДНК. PRDM9 садится на определенные последовательности ДНК (причем вследствие сильной изменчивости цинковых пальцев эти последовательности могут быть разными) и осуществляет триметилирование лизина в положениях 4 и 36 в гистоне Н3 (Н3К4 и Н3К36). Этот процесс происходит в нуклеосомах, тесно соседствующих с местом посадки PRDM9. Образуется горячая точка рекомбинации. Возможно, в центре ГТ хроматин лишается нуклеосом. Кроме того, для горячих точек рекомбинации характерно присутствие ацетилированного гистона Н3 (H3K9ac у дрожжей S. pombe и H3K5ac у нематоды C. elegans) [50], а также почти полное отсутствие двух модификаций гистона Н3 – H3K27me3 и H3K9me3. Наоборот, у S. cerevisiae необходимым компонентом хромосомных осей является Hop1, а у нематоды – конденсины [97]. Эти модификации хроматина или какие-то последующие сигналы могут привлекать эндонуклеазу. У человека и мыши PRDM9 контролирует образование большей части ГТ, но не всех. Активность PRDM9 обнаружена также у других млекопитающих и некоторых рыб и рептилий [95, 96]. Количество связанных с ДНК молекул PRDM9 может в несколько раз превышать количество образующихся DSBs. Большинство молекул PRDM9 локализуется в петлях хроматина, а основные компоненты комплекса ферментов, формирующего DSBs (MEI4, REC114 и IHO1), находятся на хромосомных осях. Предполагается, что фрагмент латеральной петли фибриллы хроматина с сайтом посадки PRDM9 сближается с осью хромосомы, после чего фермент PRDМ9 уходит и образуется DSB [95, 96].
У S. pombe двунитевые разрывы ДНК в горячих сайтах репарируются в результате взаимодействия преимущественно сестринских хроматид, в то время как в холодных областях такие разрывы репарируются в первую очередь или исключительно путем взаимодействия с гомологами [52, 98]. Это удалось установить потому, что в холодных сайтах примерно в 80% случаев репарационные события продуцируют кроссоверы (рис. 4).
Рис. 4.
Схематическое изображение различий частоты встречаемости двунитевых разрывов ДНК (DSBs) в горячих и холодных сайтах, экспериментально обнаруженных у дрожжей S. pombe, и постоянство частоты кроссинговера (гомеостаз кроссинговера). Указано присутствие белков линейных элементов хромосом Rec25, Rec27, Mug20 и Rec10 и участие сестринских и несестринских хроматид в процессе репарации/рекомбинации (адаптировано из [52]).
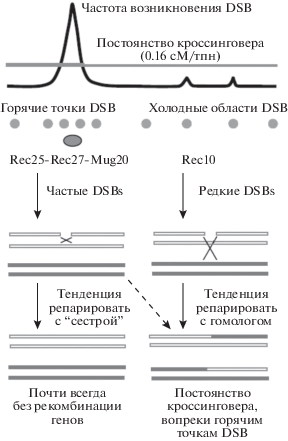
Авторы этих исследований считают, что выбор партнера для рекомбинации у S. pombe может быть следствием присутствия в линейных элементах хромосом у этого вида дрожжей белков Rec25, Rec27 и Mug20. Эти белки почти исключительно локализуются в местах двунитевых разрывов ДНК в горячих сайтах. Это определяет области дифференциальной репарации, потому что не найдено других связанных с хроматином белков, которые отличали бы большинство горячих сайтов от холодных сайтов (рис. 4). В пользу этой гипотезы есть результаты экспериментов с мутантами по генам Rec25, Rec27 и Mug20 [32] дрожжей S. pombe, но исследования продолжаются на других биологических объектах. Таким образом, складывается представление, что решающую роль в определении точки, где произойдет кроссинговер, играет не просто место посадки SPO11 на ДНК, а то, будет ли сайт посадки SPO11 взаимодействовать с белками, соединяющими сестринские хроматиды, т.е. с хромосомной осью. Эти представления совпадают с концепцией, объясняющей роль фактора PRDM9. Мы указывали выше на предположение, что фрагмент петли с сайтом посадки PRDM9 сближается с осью хромосомы, после чего этот фермент уходит и образуется DSB, но хромосомная ось сближает именно сестринские хроматиды, а сближение DSB с сестринской хроматидой ведет к сестринскому хроматидному обмену. Поэтому горячие точки DSBs не имеют преимущества стать горячими районами кроссинговера, и небольшое абсолютное число DSBs в их холодных областях парадоксальным образом может превращаться в относительно высокую частоту реализованного кроссинговера, как это показано на рис. 4.
В связи с этим для дальнейших исследований Дадашевым с соавт. [99] предложена модель участия повторов ДНК-нуклеотидов в топологической организации процесса рекомбинации. Эта модель построена на том, что в главном комплексе гистосовместимости человека обнаружена высокая множественная корреляция (с коэффициентом r = 0.92 при p < 0.001) между топологически связанными явлениями: расположением простых повторов типа (ГТ/ЦА)n близко от сайтов рекомбинации (и маркирующих эти сайты), локализацией таких повторов в латеральных петлях хроматина пахитенных хромосом, а повторов типа AluJb человека (и родственных им B1-повторов грызунов) в основании петель хроматина на латеральных элементах синаптонемных комплексов. Модель предполагает, что петли хроматина несестринских хроматид, несущие потенциальные сайты рекомбинации, инвагинируют в центральное пространство синаптонемных комплексов и соединяются с рекомбинационными узелками, несущими белки рекомбинации [99].
Хорошая таблица, содержащая перечень генов рекомбинации и их функций у модельных организмов – грибов, растений и беспозвоночных животных – в сравнении с гомологичными генами позвоночных животных, приведена в обзоре [7]. Она слишком велика для воспроизведения в нашем обзоре.
ИНТЕРФЕРЕНЦИЯ КРОССИНГОВЕРА
Явление интерференции кроссинговера относится к наиболее загадочным и трудным для изучения явлениям, наблюдаемым в мейозе. Существуют механистические гипотезы способа возникновения интерференции. “Гипотеза полимеризации” [100] постулирует, что первый кроссинговер, возникший в произвольном месте, индуцирует появление вещества, ингибирующего кроссинговер рядом с ним. Ингибитор распространяется вдоль хромосомы и полимеризуется. Распространение полимера на ближайшие сайты, в которых тоже произошли разрывы ДНК и которые являются потенциальными сайтами кроссинговера, блокирует кроссинговер в этих сайтах, и в них происходит некроссоверная репарация ДНК. Гипотеза осталась недоказанной, хотя результаты некоторых экспериментов и наблюдений можно трактовать в ее пользу.
Затем появилась гипотеза “напряжения” или “механического стресса”, препятствующего второму кроссинговеру вблизи сайта первого [53, 101]. При переходе от зиготены к пхитене происходит сокращение длины осевых элементов хромосом. Они превращаются в более плотные (чем осевой элемент) латеральные элементы СК. Иными словами, это продольное сжатие осей. Оно приводит к внутреннему напряжению в осях (по предположению авторов гипотезы), и оси “застегиваются” в области одного из потенциальных сайтов рекомбинации. Застегивание изменяет конфигурацию в интермедиате рекомбинации, и он превращается в кроссовер. Это приводит к снятию напряжения в осях и препятствует повторению ситуации в соседних областях хромосомы и к невозможности использовать внутреннее напряжение в осях в соседних областях, следовательно, к запрету второго кроссинговера в этих областях. Поэтому в соседних потенциальных сайтах рекомбинации интермедиаты ДНК репарируются без кроссинговера.
Была предложена и так называемая “счетная” модель интерференции [102], согласно которой соседние кроссоверные события разделены фиксированным количеством (m) некроссоверных событий. Число m различается у разных видов организмов и у разных полов одного вида и варьирует даже внутри одного организма (между хромосомами). Эта модель хорошо объясняла факты, полученные на дрозофиле и нейроспоре, но совершенно не согласовалась с данными по рекомбинации у дрожжей S. cerevisiae. Позже был введен еще один параметр, а именно – определенное количество не подверженных интерференции кроссоверных событий [102]. В таком модифицированном виде “счетная” модель подходила для объяснения интерференции у дрожжей, арабидопсиса и человека [102]. Недостатком ее является отсутствие как доказательств in vivo, так и внятного объяснения молекулярного механизма осуществления такой интерференции.
Существуют попытки доказать связь интерференции кроссинговера с морфогенезом хромосомных осей. У почкующихся дрожжей АТФазный контрольный пункт Pch2, действующий на стадии пахитены, проверяет уровень “загрузки” белка Hop1 в хромосомные оси (латеральные элементы СК), и это обеспечивает построение непрерывных осей из предшествующих им фрагментов. Благодаря этому образуется связь белка Hop1 с белком Zip3 в составе СК [103, 104]. Авторы публикаций этих фактов пытаются привязать их к “модели напряжения”. Они предлагают считать, что хромосомные оси несут на себе несколько “модулей” потенциального кроссинговера, и реализация кроссинговера в одном из модулей закрывает возможность реализации в других модулях, если модули физически и линейно связаны между собой непрерывной хромосомной осью. Это фактически пересказ “гипотезы напряжения” в других физических образах.
Установлено, что сайты локализации кроссоверной резолвазы MLH1 на пахитенных хромосомах совпадают с локусами хиазм у мыши, маркируют хиазмы и интерферируют так же, как кроссинговер [75]. На основе этой закономерности (подтвержденной в разных лабораториях) было установлено, что хромосомные перестройки, нарушающие исходную непрерывность хромосомных осей, приводят к тому, что, например, вместо одного кроссовера в каждой паре хромосом (в диком типе) после транслокации возникает второй кроссовер и соответственно дополнительный фокус флуоресцентных антител к белку MLH1. Из этого следует, что нарушение исходной целостности белковой оси мейотической хромосомы действительно приводит к потере интерференции. На качественном уровне это можно трактовать как в пользу теории полимеризации, так и в пользу теории напряжения. Ясно одно: интерференция кроссинговера обусловлена непрерывностью физической структуры хромосом, и, по-видимому, важно условие – нарушалась или нет непрерывность этой структуры [78–80, 105].
РЕКОМБИНАЦИОННЫЕ УЗЕЛКИ НА СК И ИХ РОЛЬ В КРОССИНГОВЕРЕ
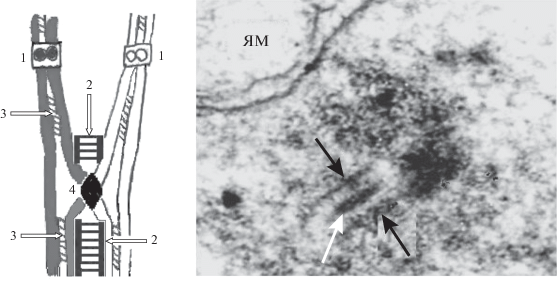
В 1970-е гг. при электронно-микроскопических исследованиях СК у разных объектов с помощью электронных микроскопов были обнаружены специфические плотные тельца субмикроскопических размеров (50–100 нм) на центральных элементах синаптонемных комплексов. Такие тельца были названы узелками (nodules) в отличие от узлов гетерохроматина (nodes или knobs) на пахитенных хромосомах, видимых даже под световым микроскопом и регистрируемых на цитологических картах хромосом у кукурузы и других растений. У кукурузы, томатов, дрозофилы и других объектов были найдены два типа субмикроскопических узелков: “ранние” – во время зиготены и “поздние” – в пахитене. Они различаются по форме и размеру, причем по-разному у разных организмов. Число ранних узелков на одно мейотическое ядро у всех организмов всегда превышает число поздних узелков. Тщательная исследовательница Карпентер первой обратила внимание [106] на то, что у D. melanogaster на каждом плече пахитенных бивалентов бывает по одному позднему узелку (1.1 узелок в среднем на большой выборке случаев), так же как только по одной хиазме и по одному кроссоверу. Карпентер высказала уверенное предположение, что поздние узелки – это скопление “поздних” ферментов рекомбинации, тех, что участвуют в реализации кроссинговера [106]. Статистически достоверное совпадение числа поздних узелков в пахитене и хиазм в диплотене было обнаружено в сперматоцитах человека [107] и аскариды (рис. 5), а затем и других объектов.
Рис. 5.
Схема структурной организации хиазмы (слева) и остаточный фрагмент синаптонемного комплекса (справа) с рекомбинационным узелком в диплотене у аскариды (ультратонкий срез, электронная микроскопия (по [114] с изменениями)). На схеме сестринские хроматиды (СХ) одной из двух гомологичных хромосом светлые, другой хромосомы – темные. Цифры 1 обозначают сестринские кинетохоры. Стрелками 2 указаны остаточные фрагменты синаптонемного комплекса (СК), сохраняющиеся во время диплотены и диакинеза и физически предохраняющие хиазму при маневрах хромосом во время подготовки к метафазе I. На схеме эти фрагменты СК искусственно раздвинуты, чтобы не маскировать изображение области обмена хроматид и рекомбинационный узелок. Стрелки 3 – когезины, скрепляющие СХ; 4 – поздний рекомбинационный узелок в сайте кроссинговера (оригинал). На фотографии белая стрелка – эллипсоидный рекомбинационный узелок, черные стрелки – латеральные элементы синаптонемного комплекса; ЯМ – двойная ядерная мембрана, сохраняющаяся во время диплотены.
Гипотеза о функции рекомбинационных узелков в центральном пространстве СК в качестве ядерного “компартмента” для молекулярных процессов рекомбинации была доказана, когда Бишоп [108] установил, что ранние мейотические узелки у S. cerevisiae содержат белки раннего этапа рекомбинации – Rad51 и Dmc1, а в поздних узелках был обнаружен фермент завершающего этапа кроссинговера – MLH1 [109, 110]. Это было сделано с помощью флуоресцирующих антител к данным белкам. Важно отметить, что белок MLH1 обнаруживается в рекомбинационных узелках, начиная со стадии пахитены. Кроме того, флуоресцирующие при иммунноокрашивании фокусы MLH1–MLH3 интерферируют так же, как кроссоверы и хиазмы [18, 109, 110]. Флуоресцентная окраска хромосом антителами к MLH1 широко используется в практике цитогенетики для маркирования сайтов кроссинговера на стадии пахитены и хиазм во время диплотены у растений, грибов и животных [111, 112].
За узелками, видимыми на СК во время зиготены и ранней пахитены, закрепились названия ранних мейотических или ранних рекомбинационных узелков (early nodules, EN), за поздними узелками (LN) – просто рекомбинационных узелков (recombination nodules, RN), а в русской аббревиатуре – РУ. Детали морфологии (ультраструктуры) всех типов РУ у разных организмов описаны в обзорах [20, 58, 89, 113]. Нам следует лишь упомянуть, что размеры этих узелков при сравнении разных организмов варьируют. Длина (если узелки эллипсоидные) может составлять от 50 до 200 нм, а поперечник (диаметр сферических узелков) – от 30 до 100 нм. Как правило, эти узелки вписываются в центральное пространство СК.
Хиазма, образованная двумя рекомбинировавшими молекулами ДНК, – не самая механически прочная конструкция. Однако во время стадий диплотены, диакинеза и метафазы I, на которых хиазма видна под микроскопом, она укреплена белками когезинами, связывающими пары сестринских хроматид по обе стороны от точки обмена, и другой белковой конструкцией – остаточным фрагментом синаптонемного комплекса [107, 109, 110, 114], скрепляющим сайт обмена как наложенная шина, которая фиксирует и защищает от движения область перелома кости руки или ноги у человека, как это показано на рис. 5. Остаточный СК, как правило (но не всегда), исчезает во время диакинеза и метафазы I, а соединение сестринских хроматид рядом с точкой обмена с помощью когезинов сохраняется до момента наступления анафазы I [115–117].
ЗАКЛЮЧЕНИЕ
Теоретической основой для исследования молекулярных механизмов рекомбинации и кроссинговера в конце ХХ в. и начале ХХI в. служила и служит модель рекомбинации на основе репарации двунитевых разрывов ДНК [27]. Она проверялась, уточнялась и в целом оправдалась. “Инструментами” для исследования молекулярных процессов, из которых складывается кроссинговер, служат, прежде всего, мутации специфических генов мейоза, найденные или индуцированные у модельных организмов. Наибольшее число мутаций, влияющих на рекомбинацию, обнаружено у одноклеточных почкующихся дрожжей S. cerevisiae и делящихся дрожжей S. pombe, но число обнаруженных мутаций гомологичных им генов у многоклеточных организмов постепенно приближается к этому уровню [9–12]. Чрезвычайно важными инструментами для исследования мейоза у мутантов и нормальных организмов стали методы иммуннофлуоресцентной цитохимии [109, 111, 112], которые позволяют локализовать в клеточных ядрах и хромосомах белки, участвующие в явлениях, происходящих на определенных стадиях мейоза.
Основные решенные вопросы. В общих чертах решена проблема “выбора” метаболического пути между кроссинговером и бескроссоверной репарацией двунитевых разрывов ДНК в мейозе и создана наглядная модель. Доказано, что “решение”, или “выбор”, между кроссинговером и репарацией без кроссинговера для каждого локуса (и расхождение этих путей) происходит не в поздней, а в ранней профазе I мейоза, во время инвазии конца однонитевой ДНК в гомологичную молекулу ДНК – в несестринскую или сестринскую хроматиду соответственно [10, 53].
Установлено существование эволюционно консервативного “стержневого” комплекса белков рекомбинации у большинства модельных организмов [3, 53]. Как ни странно, наименьшее число генов, входящих в этот комплекс, обнаружено у D. melanogaster. Но постепенно исследователи находят, что у дрозофилы функцию генов и белков “стержневого комплекса” выполняют другие функционально аналогичные гены и белки, не гомологичные таковым у других модельных организмов. Установлено, что синаптонемные комплексы служат ультраструктурными компартментами, в которых функционируют белки “стержневого комплекса” и другие белки рекомбинации [118].
Доказано одновременное существование кроссинговера двух типов – подверженного и не подверженного интерференции – и существование гомеостаза кроссинговера, который обеспечивает каждую пару гомологичных хромосом хотя бы одной хиазмой [18]. Доказана важная роль когезии сестринских хроматид в сайте хиазмы для сохранения хиазмы до начала анафазы I мейоза.
Число конкретных решенных вопросов велико, и их можно найти в цитируемых нами обзорных статьях других авторов.
Перспективы. Можно прогнозировать, что в ближайшие годы внимание исследователей будет сосредоточено на решении проблемы молекулярного, вероятно эпигенетического механизма интерференции кроссинговера. Есть гипотезы, но нет надежных доказательств природы и механизма этого очень существенного явления.
Мы не рассматривали важную проблему супрессии кроссинговера в гетерохроматических районах хромосом [46, 119, 120]. Не рассматривали факты неслучайного распределения хиазм на бивалентах [110]. Есть частные нерешенные вопросоы, например не установлена точная роль очень важного гетеродимера MSH4–MSH5 в формировании кроссоверов и хиазм.
Наконец, мы не касались важной проблемы конверсии, относящейся к общей проблеме мейотической рекомбинации. Она требует специального анализа и отдельного обзора.
Очевидно, что будут развиваться все более изощренные исследования ультраструктурной локализации (компартментализации) в клеточных ядрах и способов функционирования белков рекомбинации – ферментов, адаптеров и модуляторов этого явления.
Авторы благодарны П.М. Бородину, А.В. Родионову, А.А. Торгашевой за важные замечания и рекомендации.
Исследование выполнено при финансовой поддержке гранта РФФИ № 17-00-00430 (17-00-00429 КОМФИ) и государственного задания ФГБУ Института общей генетики им. Н.И. Вавилова РАН по теме № 0112-2019-0002.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Keeney S. Mechanism and control of meiotic recombination initiation // Curr. Top. Dev. Biol. 2001. V. 52. P. 1–53.
Marcon E., Moens H.B. The evolution of meiosis: recruitment and modification of somatic DNA-repair proteins // BioEssay. 2005. V. 27. P. 795–808. https://doi.org/10.1002/bies.20264
Loidl J. Conservation and variability of meiosis across the eukaryotes // Annu. Rev. Genet. 2016. V. 50. P. 293–316. https://doi.org/10.1146/annurev-genet-120215-035100
Богданов Ю.Ф., Дадашев С.Я., Гришаева Т.М. Сравнительная геномика и протеомика дрозофилы, нематоды Бреннера и арабидопсиса. Идентификация функционально сходных генов и белков синапсиса мейотических хромосом // Генетика. 2002. Т. 38. № 8. С. 1078–1089.
Bogdanov Yu.F., Dadashev S.Ya., Grishaeva T.M. In silico search for functionally similar proteins involved in meiosis and recombination in evolutionarily distant organisms // In Silico Biology. 2003. V. 3. № 1–2. P. 173–185.
Bogdanov Yu.F., Grishaeva T.M., Dadashev S.Ya. Similarity of the domain structure of proteins as a basis for the evolutionarily conservation of meiosis // Int. Rev. Cytol. 2007. V. 257. P. 83–142. https://doi.org/10.1016/S0074-7696(07)57003-8
Youds J.L., Boulton S.J. The choice in meiosis – defining the factors that influence crossover or non-crossover formation // J. Cell Sci. 2011. V. 124. P. 501–513. https://doi.org/10.1242/jcs.074427
Богданов Ю.Ф. Изменчивость и эволюция мейоза // Генетика. 2003. Т. 39. № 4. С. 453–473.
Богданов Ю.Ф. Неканонический мейоз у нематоды Caenorhabditis elegans как модель для изучения молекулярных основ синапсиса, кроссинговера и сегрегации гомологичных хромосом // Генетика. 2017. Т. 53. № 12. С. 1363–1379.
Гришаева Т.М., Богданов Ю.Ф. Генетический контроль мейоза у дрозофилы // Генетика. 2000. Т. 36. № 10. С. 1301–1321.
Гришаева Т.М., Богданов Ю.Ф. Особенности мейоза у дрозофилы: классический объект генетики имеет нестандартный мейоз // Успехи соврем. биологии. 2018. Т. 138. № 1. С. 68–82.
Симановский С.А., Богданов Ю.Ф. Генетический контроль мейоза у растений // Генетика. 2018. Т. 54. № 4. С. 397–411.
Turner J.M. Meiosis 2007 – where have we got to and where are we going? // Chromosome Res. 2007. V. 15. P. 517–521. https://doi.org/10.1007/s10577-007-1152-z
Harigaya Y., Yamamoto M. Molecular mechanisms underlying the mitosis-meiosis decision // Chromosome Res. 2007. V. 15. P. 523–537. https://doi.org/10.1007/s10577-007-1151-0
Matson C.K., Murphy M.W., Griswold M.D. et al. The mammalian doublesex homolog DMRT1 is a transcriptional gatekeeper that controls the mitosis versus meiosis decision in male germ cells // Dev. Cell. 2010. V. 19. P. 612–624. https://doi.org/10.1016/j.devcel.2010.09.010
Schwacha A., Kleckner N. Identification of joint molecules that form frequently between homologs but rarely between sister chromatids during yeast meiosis // Cell. 1994. V. 76. P. 51–63.
Schwacha A., Kleckner N. Identification of double Holliday junctions as intermediates in meiotic recombination // Cell. 1995. V. 83. P. 783–791.
Gray S., Cohen P.E. Control of meiotic crossovers: from double-strand break formation to designation // Annu. Rev. Genet. 2016. V. 50. P. 175–210. https://doi.org/10.1146/annurev-genet-120215-035111
Allers T., Lichten M. Differential timing and control of noncrossover and crossover recombination during meiosis // Cell. 2001. V. 106. P. 47–57. https://doi.org/10.1016/S0092-8674(01)00416-0
Zickler D., Kleckner N. Recombination, pairing, and synapsis of homologs during meiosis // Cold Spring Harb. Perspect. Biol. 2015. V. 7. pii: a016626. https://doi.org/10.1101/cshperspect.a016626
Taylor J.H., Woods P.S., Hughes W.I. The organization and duplication of chromosomes as revealed by autoradiographic studies using tritium-labeled thymidine // Proc. Natl Acad. Sci. USA. 1957. V. 43. P. 122–128.
Jones G.H. The control of chiasma distribution // Symp. Soc. Exp. Biol. 1984. V. 38. P. 293–320.
Zakharov A.F., Egolina N.A. Differential spiralization along mammalian chromosomes. I. BrdU-revealed differentiation in Chinese hamster chromosomes // Chromosoma (Berl.). 1972. V. 38. P. 341–365.
Perry P., Wolff S. New Giemsa method for the differential staining of sister chromatids // Nature. 1974. V. 251. P. 156–158.
Holliday R. A mechanism for gene conversion in fungi // Genet. Res. 1964. V. 78. P. 282–304.
Stahl F.W. The Holliday junction on its thirtieth anniversary // Genetics. 1994. V. 138. P. 241–246.
Szostak J.W., Orr-Weaver T.L., Rothstein R.J., Stahl F.W. Double-strand-break repair model for recombination // Cell. 1983. V. 33. P. 25–35.
Kohl K.P., Sekelsky J. Meiotic and mitotic recombination in meiosis // Genetics. 2013. V. 194. P. 327–334. https://doi.org/10.1534/genetics.113.150581
Pochart P., Woltering D., Hollingsworth N.M. Conserved properties between functionally distinct MutS homologs in yeast // J. Biol. Chem. 1997. V. 272. P. 30345–30349.
Ross-Macdonald P., Roeder G.S. Mutation of a meiosis-specific MutS homolog decreases crossing over but not mismatch correction // Cell. 1994. V. 79. P. 1069–1080.
Hollingsworth N.M., Ponte L., Halsey C. MSH5, a novel MutS homolog, facilitates meiotic reciprocal recombination between homologs in Saccharomyces cerevisiae but not mismatch repair // Genes Dev. 1995. V. 9. P. 1728–1739.
Zalevsky J., MacQueen A.J., Duffy J.B. et al. Crossing over during Caenorhabditis elegans meiosis requires a conserved MutS-based pathway that is partially dispensable in budding yeast // Genetics. 1999. V. 153. P. 1271–1283.
Kelly K.O., Dernburg A.F., Stanfield G.M., Villeneuve A.M. Caenorhabditis elegans msh-5 is required for both normal and radiation-induced meiotic crossing over but not for completion of meiosis // Genetics. 2000. V. 156. P. 617–630.
Kohl K.P., Jones C.D., Sekelsky J. Evolution of an MCM complex in flies that promotes meiotic crossovers by blocking BLM helicase // Science. 2012. V. 338. P. 1363–1365. https://doi.org/10.1126/science.1228190
Villeneuve A.M., Hillers K.J. Whence meiosis? // Cell. 2001. V. 106. P. 647–650.
Boddy M.N., Gaillard P.H., McDonald W.H. et al. Mus81-Eme1 are essential components of a Holliday junction resolvase // Cell. 2001. V.107. P. 537–548.
Smith G.R., Boddy M.N., Shanahan P., Russell P. Fission yeast Mus81-Emel Holliday junction resolvase is required for meiotic crossing over but not for gene conversion // Genetics. 2003. V. 165. P. 2289–2293.
Argueso J.L., Wanat J., Gemici Z., Alani E. Competing crossover pathways act during meiosis in Saccharomyces cerevisiae // Genetics. 2004. V. 168. P. 1805–1816. https://doi.org/10.1534/genetics.104.032912
de los Santos T., Hunter N., Lee C. et al. The Mus81/Mms4 endonuclease acts independently of double-Holliday junction resolution to promote a distinct subset of crossovers during meiosis in budding yeast // Genetics. 2003. V. 164. P. 81–94.
Berchowitz L.E., Francis K.E., Bey A.L., Copenhaver G.P. The role of AtMUS81 in interference-insensitive crossovers in A. thaliana // PLoS Genet. 2007. V. 3. e132. https://doi.org/10.1371/journal.pgen.0030132
Munz P. An analysis of interference in the fission yeast Schizosaccharomyces pombe // Genetics. 1994. V. 137. P. 701–707.
Sekelsky J., Brodsky M.H., Burtis K.C. DNA repair in Drosophila. Insights from the Drosophila genome sequence // J. Cell Biol. 2000. V. 150. P. F31–F36.
Keeney S., Giroux C.N., Kleckner N. Meiosis-specific DNA double-strand breaks are catalyzed by Spo11, a member of a widely conserved protein family // Cell. 1997. V. 88. P. 375–384.
Romanienko P.J., Camerini-Otero R.D. The mouse Spol1 gene is required for meiotic chromosome synapsis // Mol. Cell. 2000. V. 6. P. 975–987.
Grelon M., Vezon D., Gendrot G., Pelletier G. AtSPO11-1 is necessary for efficient meiotic recombination in plants // EMBO J. 2001. V. 20. P. 589–600. https://doi.org/10.1093/emboj/20.3.589
Phadnis N., Hyppa R.W., Smith G.R. New and old ways to control meiotic recombination // Trends in Genet. 2011. V. 27. P. 411–421. https://doi.org/10.1016/j.tig.2011.06.007
Mézard C., Jahns M.T., Grelon M. Where to cross? New insights into the location of meiotic crossovers // Trends in Genet. 2015. V. 31. P. 393–401. https://doi.org/10.1016/j.tig.2015.03.008
Székvőlgyi L., Ohta K., Nicokas A. Initiation of meiotic homologous recombination: flexibility, impact of histone modifications, and chromatin remodeling // Cold Spring Harb. Perspect. Biol. 2015. V. 7. a016527. https://doi.org/10.1101/cshperspect.a016527
Mehrotra S., McKim K.S. Temporal analysis of meiotic DNA double-strand break formation and repair in Drosophila females // PLoS Genet. 2006. V. 2. e200. https://doi.org/10.1371/journal.pgen.0020200
Lambing C., Tock A.J., Choi K. et al. REC8-cohesin, chromatin and transcription orchestrate meiotic recombination in the Arabidopsis genome // bioRxiv. 2019. (Preprint). https://doi.org/10.1101/512400
Hunter N., Kleckner N. The single-end invasion: an asymmetric intermediate at the double-strand break to double-holliday junction transition of meiotic recombination // Cell. 2001. V. 106. P. 59–70.
Fowler K.R., Gutierrez-Velasco S., Martın-Castellanos C., Smith G.R. Protein determinants of meiotic DNA break hot spots // Mol. Cell. 2013. V. 49. P. 983–996. https://doi.org/10.1016/j.molcel.2013.01.008
Börner G.V., Kleckner N., Hunter N. Crossover/noncrossover differentiation, synaptonemal complex formation, and regulatory surveillance at the leptotene/zygotene transition of meiosis // Cell. 2004. V. 117. P. 29–45.
Kleckner N. Chiasma formation: chromatin/axis interplay and the role(s) of the synaptonemal complex // Chromosoma. 2006. V. 115. P. 175–193. https://doi.org/10.1007/s00412-006-0055-7
Shinohara A., Shinohara M. Roles of RecA homologues Rad51 and Dmc1 during meiotic recombination // Cytogenet. Genome Res. 2004. V. 107. P. 201–207. https://doi.org/10.1159/000080598
West S.C. Molecular views of recombination proteins and their control // Nature Rev. 2003. V. 4. P. 435–445. https://doi.org/10.1038/nrm1127
Blat Y., Protacio R.U., Hunter N., Kleckner N. Physical and functional interactions among basic chromosome organizational features govern early steps of meiotic chiasma formation // Cell. 2002. V. 111. P. 791–802.
Zickler D., Kleckner N. The leptotene to zygotene transition of meiosis // Annu. Rev. Genet. 1998. V. 32. P. 619–697.
Moses M.J. Microspreading and synaptonemal complex in cytogenetic study // Chromosomes Today. 1977. V. 6. P. 71–82.
Богданов Ю.Ф., Коломиец О.Л. Синаптонемный комплекс – индикатор динамики мейоза и изменчивости хромосом. М.: Тов-во науч. изд. КМК, 2007. 358 с.
Bishop D.K., Zickler D. Early decision; meiotic cross-over interference prior to stable strand exchange and synapsis // Cell. 2004. V. 117. P. 9–15.
Lynn A., Soucek R., Börner G.V. ZMM proteins during meiosis: crossover artists at work // Chromosome Res. 2007. V. 15. P. 591–605. https://doi.org/10.1007/s10577-007-1150-1
Agarwal S., Roeder G.S. Zip3 provides a link between recombination enzymes and synaptonemal complex proteins // Cell. 2000. V. 102. P. 245–255.
Tsubouchi T., Zhao H., Roeder G.S. The meiosis-specific Zip4 protein regulates crossover distribution by promoting synaptonemal complex formation together with Zip2 // Dev. Cell. 2006. V. 10. P. 809–819. https://doi.org/10.1016/j.devcel.2006.04.003
Paquis-Flucklinger V., Santucci-Darmanin S., Paul R. et al. Cloning and expression analysis of a meiosis-specific MutS homolog: the human MSH4 gene // Genomics. 1997. V. 44. P. 188–194.
Bocker T., Barusevicius A., Snowden T. et al. Hmsh5: A human MutS homologue that forms a novel heterodimer with hMSH4 and is expressed during spermatogenesis // Cancer Res. 1999. V. 59. P. 816–822.
Santucci-Darmanin S., Walpita D., Lespinasse F. et al. MSH4 acts in conjunction with MLH1 during mammalian meiosis // FASEB J. 2000. V. 14. P. 1539–1547.
Гришаева Т.М., Богданов Ю.Ф. Эволюционный консерватизм белков рекомбинации и изменчивость мейоз-специфичных белков хромосом // Генетика. 2017. Т. 53. № 5. С. 541–550. https://doi.org/10.1134/S1022795417040081
Grishaeva T.M., Bogdanov Y.F. Conservation of meiosis-specific nuclear proteins in eukaryotes: a comparative approach // The Nucleus. 2018. V. 61. № 3. P. 175–182. https://doi.org/10.1007/s13237-018-0253-8
Muller H. The mechanism of crossing-over // Am. Nat. 1916. V. 50. P. 193–221.
Forejt J. X-inactivation and its role in mail sterility // Chromosomes Today. 1984. V. 8. P. 17–22.
Родионов А.В., Челышева Л.А., Соловей И.В. и др. Распределение хиазм по хромосомам-ламповым щеткам курицы Gallus gallus domesticus: горячие точки рекомбинации и их возможное значение для правильного расхождения гомологичных хромосом в первом мейотическом делении // Генетика. 1992. Т. 28. № 7. С. 151–160.
Родионов А.В. Micro vs. Macro: структурно-функциональная организация микро- и макрохромосом птиц // Генетика. 1996. Т. 32. № 5. С. 597–608.
Chen S.Y., Tsubouchi T., Rockmill B. et al. Global analysis of the meiotic crossover landscape // Dev. Cell. 2008. V. 15. P. 401–415. https://doi.org/10.1016/j.devcel.2008.07.006
de Boer E., Heyting C. The diverse roles of transverse filaments of synaptonemal complexes in meiosis // Chromosoma. 2006. V. 115. P. 220–234. https://doi.org/10.1007/s00412-006-0057-5
Shinohara M., Oh S.D., Hunter N., Shinohara A. Crossover assurance and crossover interference are distinctly regulated by the ZMM proteins during yeast meiosis // Nat. Genet. 2008. V. 40. P. 299–309. https://doi.org/10.1038/ng.83
Tung K.S., Roeder G.S. Meiotic chromosome morphology and behavior in zip1 mutants of Saccharomyces cerevisiae // Genetics. 1998. V. 149. P. 817–832.
Borodin P.M., Gorlov I.P., Agulnik A.I. et al. Chromosome pairing and recombination in mice heterozygous for different translocations in chromosomes 16 and 17 // Chromosoma. 1991. V. 101. P. 252–258.
Auger D.L., Sheridan W.F. Negative crossover interference in maize translocation heterozygotes // Genetics. 2001. V. 159. P. 1717–1726.
Torgasheva A.A., Rubtsov N.B., Borodin P.M. Recombination and synaptic adjustment in oocytes of mice heterozygous for a large paracentric inversion // Chromosome Res. 2013. V. 21. P. 37–48. https://doi.org/10.1007/s10577-012-9336-6
Martini E., Diaz R.L., Hunter N., Keeney S. Crossover homeostasis in yeast meiosis // Cell. 2006. V. 126. P. 285–295. https://doi.org/10.1016/j.cell.2006.05.044
Celerin M., Merino S.T., Stone J.E. et al. Multiple roles of Spo11 in meiotic chromosome behavior // EMBO J. 2000. V. 19. P. 2739–2750.
Henderson K.A., Keeney S. Tying synaptonemal complex initiation to the formation and programmed repair of DNA double strand breaks // Proc. Natl Acad. Sci. USA. 2004. V. 101. P. 4519–4524. https://doi.org/10.1073/pnas.0400843101
Bhuijan H., Schmekel K. Meiotic chromosome synapsis in yeast can occur without spo11-induced DNA double-strand breaks // Genetics. 2004. V. 168. P. 775–783. https://doi.org/10.1534/genetics.104.029660
Albini S.M., Jones G.H. Synaptonemal complex spreading in Allium cepa and A. fistulosum. I. The initiation and sequence of pairing // Chromosoma. 1987. V. 95. P. 324–338.
Tessé S., Storlazzi A., Kleckner N. et al. Localization and roles of SkiSp protein in Sordaria meiosis and delineation of three mechanistically distinct steps of meiotic homolog juxtaposition // Proc. Natl Acad. Sci. USA. 2003. V. 100. P. 12865–12870. https://doi.org/10.1073/pnas.2034282100
Franklin A.E., McElver J., Sunjevaric I. et al. Three-dimensional microscopy of the Rad51 recombination protein during meiotic prophase // Plant Cell. 1999. V. 11. P. 809–824.
Tarsounas M., Morita T., Pearlman R.E., Moens P.B. RAD51 and DMC1 form mixed complexes associated with mouse meiotic chromosome cores and synaptonemal complexes // J. Cell Biol. 1999. V. 147. P. 207–220.
Page S.L., Hawley R.S. The genetics and molecular biology of the synaptonemal complex // Annu. Rev. Cell. Dev. Biol. 2004. V. 20. P. 525–558. https://doi.org/10.1146/annurev.cellbio.19.111301.155141
Lorenz A., Whitby M.C. How not to get cross(ed): a novel role for FANCM orthologs in meiotic recombination // Cell Cycle. 2012. V. 11. P. 3347–3348. https://doi.org/10.4161/cc.21844
Zakharyevich K., Tang S., Ma Y., Hunter N. Delineation of joint molecule resolution pathways in meiosis identifies a cross-over-specific resolvase // Cell. 2012. V. 149. P. 334–347. https://doi.org/10.1016/j.cell.2012.03.023
De Muyt A., Jessop L., Kolar E. et al. BLM helicase ortholog Sgsl is a central regulator of meiotic recombination intermediate metabolism // Mol. Cell. 2012. V. 46. P. 43–53. https://doi.org/10.1016/j.molcel.2012.02.020
Youds J.L., Mets D.G., McIlwraith M.J. et al. RTEL-1 enforces meiotic crossover interference and homeostasis // Science. 2010. V. 327. P. 1254–1258. https://doi.org/10.1126/science.1183112
Rosu S., Libuda D.E., Villeneuve A.M. Robust crossover assurance and regulated interhomolog access maintain meiotic crossover number // Science. 2011. V. 334. P. 1286–1289. 10.1126/science.1212424 94a. Kauppi L., Jasin M., Keeney S. How much is enough? Control of DNA double-strand break numbers in mouse meiosis // Cell Cycle. 2013. V. 12. P. 2719–2720.
Baudat F., Buard J., Grey C. et al. PRDM9 is a major determinant of meiotic recombination hotspots in humans and mice // Science. 2010. V. 327. P. 836–840. https://doi.org/10.1126/science.1183439
Grey C., Baudat F., de Massy B. PRDM9, a driver of the genetic map // PLOS Genet. 2018. V. 14. e1007479. https://doi.org/10.1371/journal.pgen.1007479
Kumar R., de Massy B. Initiation of meiotic recombination in mammals // Genes. 2010. V. 1. P. 521–549. https://doi.org/10.3390/genes1030521
Cromie G.A., Hyppa R.W., Cam H.P. et al. A discrete class of intergenic DNA dictates meiotic DNA break hotspots in fission yeast // PLoS Genet. 2007. V. 3. e141. https://doi.org/10.1371/journal.pgen.0030141
Дадашев С.Я., Гришаева Т.М., Богданов Ю.Ф. Идентификация и характеристика in silico последовательностей мейотической ДНК. AluJb, возможно, участвуют в прикреплении петель хроматина к синаптонемному комплексу // Генетика. 2005. Т. 41. № 12. С. 1707–1713.
King J.S., Mortimer R.K. A polymerization model of chiasma interference and corresponding computer simulation // Genetics. 1990. V. 126. P. 1127–1138.
Kleckner N., Zickler D., Jones G.H. et al. A mechanical basis for chromosome function // Proc. Natl Acad. Sci. USA. 2004. V. 101. P. 12592–12597.
Berchowitz L.E., Copenhaver G.P. Genetic interference: don’t stand so close to me // Curr. Genomics. 2010. V. 11. P. 91–102. https://doi.org/10.2174/138920210790886835
Joshi N., Barot A., Jamison C., Börner G.V. Pch2 links chromosome axis remodeling at future crossover sites and crossover distribution during yeast meiosis // PLoS Genet. 2009. V. 5. P. e1000557. https://doi.org/10.1371/journal.pgen.1000557
Herruzo E., Ontoso D., Gonzalez-Arranz S. et al. The Pch2 AAA+ ATPase promotes phosphorylation of the Hop1 meiotic checkpoint adaptor in response to synaptonemal complex defects // Nucl. Acids Res. 2016. V. 44. P. 7722–7741. https://doi.org/10.1093/nar/gkw506
Goldman A.S.H., Hulten M.A. Meiotic analysis of a human male 46,XY,t (15;20)(q11.2;q.11.2) translocation heterozygote: quadrivalent configuration, orientation and fires meiotic segregation // Chromosoma. 1993. V. 102. P. 102–111.
Carpenter A.T.C. Electron microscopy of meiosis in Drosophila melanogaster females. II. The recombination nodule – a recombination-associated structure at pachytene? // Proc. Natl Acad. Sci. USA. 1975. V. 72. P. 3186–3189.
Holm P.B., Rasmussen S.W. Three-dimensional reconstruction of meiotic chromosomes in human spermatogenesis // Chromosomes Today. 1978. V. 6. P. 83–93.
Bishop D.K. RecA homologs Dmc1 and Rad51 interact to form multiple nuclear complexes prior to meiotic chromosome synapsis // Cell. 1994. V. 79. P. 1081–1092.
Anderson L.K., Reeves A., Web L.M., Ashley T. Distribution of crossing over on mouse synaptonemal complexes using immunofluorescent localization of MLH1 protein // Genetics. 1999. V. 151. P. 1569–1579.
Anderson L.K., Doyle G.G., Brigham B. et al. High-resolution crossover maps for each bivalents of Zea mays using recombination nodules // Genetics. 2003. V. 165. P. 849–865.
Lisachov A.P., Zadesenets K.S., Rubtsov N.B., Borodin P.M. Sex chromosome synapsis and recombination in male guppies // Zebrafish. 2015. V. 12. P. 174–180. https://doi.org/10.1089/zeb.2014.1000
Spangenberg V., Matveevsky S., Bogdanov Y. et al. Reticulate evolution of the rock lizards: meiotic chromosome dynamics and spermatogenesis in diploid and triploid males of the genus Darevskia // Genes. 2017. V. 8. P. 2–15. https://doi.org/10.3390/genes8060149
Zickler D., Kleckner N. Meiotic chromosomes: integrating structure and function // Annu. Rev. Genet. 1999. V. 33. P. 603–754.
Kundu S.C., Bogdanov Yu.F. Ultrastructural studies of late meiotic prophase nuclei of spermatocytes in Ascaris sum // Chromosoma. 1979. V. 70. № 3. P. 375–384.
Revenkova E., Jessberger R. Keeping sister chromatids together: cohesins in meiosis // Reproduction. 2005. V. 130. P. 783–790. https://doi.org/10.1530/rep.1.00864
Barbero J.L. Cohesins: chromatin architects in chromosome segregation, control of gene expression and much more // Cell. Mol. Life Sci. 2009. V. 66. P. 2025–2035. https://doi.org/10.1007/s00018-009-0004-8
Gutierrez-Caballero C., Cebollero L.R., Pendas A.M. Shugoshins: from protectors of cohesion to versatile adaptors at the centromere // Trends in Genetics. 2012. V. 28. P. 351–360. https://doi.org/10.106/j.tig.2012.03.003
West A.M.V., Rosenberg S.C., Ur S.N. et al. A conserved filamentous assembly underlies the structure of the meiotic chromosome axis // eLife. 2019. V. 8. e40372. https://doi.org/10.7554/eLife.40372
Прокофьева-Бельговская А.А. Гетерохроматические районы хромосом. М.: Наука, 1986. 432 с.
Elgin S.C., Grewal S.I. Heterochromatin: silence is golden // Current Biol. 2003. V. 13. R896.
Дополнительные материалы отсутствуют.


